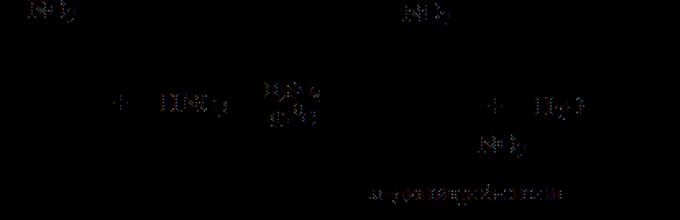Aromatik birləşmələrin nitrasiyası nitro birləşmələrinin alınmasının əsas üsuludur. Aromatik sıradakı elektrofil əvəzetmənin xüsusi halı kimi nitrasiya prosesi artıq əvvəllər nəzərdən keçirilmişdir. Ona görə də bu reaksiyanın sintetik potensialına diqqət yetirmək məqsədəuyğun görünür.
Benzolun özü olduqca asanlıqla və yaxşı nəticələrlə nitratlanır.
Daha ağır şəraitdə nitrobenzol da əmələ gəlmək üçün nitratlana bilər m-dinitrobenzol

İki nitro qrupunun deaktivləşdirici təsirinə görə üçüncü nitro qrupunu daxil edin m-dinitrobenzol yalnız böyük çətinliklə əldə edilə bilər. Nitrasiya nəticəsində 45% məhsuldarlıqla 1,3,5-Trinitrobenzol alınmışdır. m-dinitrobenzol 100-110 o C-də və reaksiya müddəti 5 gündür.
Benzolun birbaşa nitrasiyası ilə trinitrobenzolun alınmasında yaranan çətinliklər dolayı üsulların inkişafına səbəb oldu. Onlardan birinə görə, trinitrobenzoldan daha əlçatan olan trinitrotoluol 2,4,6-trinitrobenzoy turşusuna oksidləşir və suda qızdırıldıqda asanlıqla dekarboksilləşir.

Eyni şəkildə, 1,2-dinitrobenzol əldə etmək lazım olduqda dolayı üsullara müraciət etmək lazımdır. Bu vəziyyətdə, amin qrupunun bir nitro qrupuna oksidləşmə qabiliyyəti O-nitroanilin

Nitro birləşmələrinin nitrasiya yolu ilə hazırlanması heç bir xüsusi çətinliklə üzləşmədiyi hallarda belə, dolayı üsullara müraciət etmək lazımdır. Beləliklə, fenolun nitrasiyası ilə pikrin turşusu əldə etmək mümkün deyil, çünki Azot turşusu ilə fenol nitratlanmır, oksidləşir. Buna görə də adətən aşağıdakı sxem istifadə olunur

Bu sxemin incəlikləri ondan ibarətdir ki, halqanın xlor və artıq mövcud olan iki nitro qrupu tərəfindən deaktivasiyası səbəbindən ona üçüncü bir nitro qrupu daxil etmək mümkün deyil. Buna görə dinitroklorobenzoldakı xlor əvvəlcə nitro qruplarının kömək etdiyi hidroksillə əvəz olunur (bimolekulyar əvəz). Yaranan dinitrofenol nəzərəçarpacaq dərəcədə oksidləşmədən başqa bir nitro qrupunu asanlıqla qəbul edir. Mövcud nitro qrupları benzol halqasını oksidləşmədən qoruyur.
Pikrik turşusu əldə etməyin başqa bir qeyri-aşkar yolu fenolun 2,4-fenol disulfon turşusuna sulfonlaşdırılması, sonra isə yaranan birləşmənin nitrasiyasıdır. Bu zaman nitrasiya ilə eyni vaxtda sulfo qrupları nitro qrupları ilə əvəz olunur

Ən vacib aromatik nitro törəmələrindən biri olan trinitrotoluol texniki olaraq toluolun nitrasiyası ilə istehsal olunur və bu aşağıdakı sxemə uyğun aparılır.

Kimyəvi xassələri
Aromatik nitro birləşmələri həm benzol halqasının, həm də nitro qrupunun iştirakı ilə reaksiya verməyə qadirdir. Bu struktur elementlər bir-birinin reaktivliyinə təsir göstərir. Beləliklə, nitro qrupunun təsiri altında nitrobenzol istəksiz olaraq elektrofil əvəzetmə reaksiyasına daxil olur və yeni əvəzedici qəbul edir. m-vəzifə. Nitro qrupu təkcə benzol halqasının reaktivliyinə deyil, həm də kimyəvi reaksiyalarda qonşu funksional qrupların davranışına təsir göstərir.
Nitro qrupuna görə aromatik nitro birləşmələrinin reaksiyalarını nəzərdən keçirək.
16.2.1. Bərpa. Nitro birləşmələrinin ən mühüm reaksiyalarından biri onların aromatik aminlərə çevrilməsidir ki, bunlardan boyalar, dərmanlar və fotokimyəvi maddələr istehsalında geniş istifadə olunur.
Nitro birləşmələrinin azaldılması yolu ilə bir nitro qrupunun amin qrupuna çevrilməsinin mümkünlüyü ilk dəfə Zinin tərəfindən 1842-ci ildə nitrobenzolun ammonium sulfidlə reaksiyası nümunəsi ilə göstərilmişdir.

Daha sonra aromatik nitro birləşmələrinin azaldılması dərin tədqiqatın mövzusu oldu. Müəyyən edilmişdir ki, ümumi halda azalma mürəkkəbdir və aralıq məhsulların formalaşması ilə bir sıra mərhələlərdən keçir. Aminlər yalnız reaksiyanın son məhsuludur. Bərpanın nəticəsi azaldıcı maddənin gücü və pH mühiti ilə müəyyən edilir. Elektrokimyəvi reduksiya zamanı məhsulların tərkibi elektrodlardakı potensialdan asılıdır. Bu amilləri dəyişdirərək, bərpa prosesini ara mərhələlərdə gecikdirə bilərsiniz. Neytral və turşu mühitlərdə nitrobenzolun azaldılması ardıcıl olaraq nitrosobenzol və fenilhidroksilamin əmələ gəlməsi ilə baş verir.

Reduksiya qələvi mühitdə aparıldıqda, yaranan nitrosobenzol və fenilhidroksilamin bir-biri ilə kondensasiya olunaraq azoksibenzol əmələ gətirir, burada azot və oksigen atomları yarımqütblü bağla bir-birinə bağlanır.

Təklif olunan kondensasiya mexanizmi aldol kondensasiya mexanizmini xatırladır
Azo- və hidrazobenzollar vasitəsilə azoksibenzolun anilinə çevrilməsi baş verir.
Nitrobenzolun anilinə qədər azaldılması üçün yuxarıda qeyd olunan bütün ara məhsullar ya birbaşa nitrobenzoldan, ya da bir-birindən alına bilər. Burada bəzi nümunələr var


16.2.2. Nitro qrupunun digər funksional qrupların reaktivliyinə təsiri. Aromatik halogen törəmələri ilə bağlı tədqiqimiz zamanı biz artıq müvafiq şəkildə yerləşdirilmiş nitroqrup(lar)ın halogenin nukleofil əvəzlənməsinə (aromatik olaraq bağlanmış halogenin bimolekulyar əvəzlənməsi) əhəmiyyətli dərəcədə təsir etdiyi halla rastlaşmışıq. Nümunədən istifadə etməklə O- Və n-dinitrobenzollar, müəyyən edilmişdir ki, nitroqrup nəinki halogenin, hətta digər nitro qrupunun nukleofil əvəzlənməsini təşviq edə bilər.

Nitro qrupunun hidroksil qrupu ilə bimolekulyar əvəzlənməsi mexanizmi aşağıdakı iki mərhələli proses kimi təqdim edilə bilər.

Nəzərdən keçirilən reaksiyanın birinci mərhələsində əmələ gələn karbanion, nitro qrupunun elektronları daha çox olan benzol halqasının karbonundan tam olaraq çıxardığı məhdudlaşdırıcı struktur 1-in töhfəsinə görə rezonans sabitləşir.
Bir nitro qrupunun digər nitro qrupunun təsiri altında nukleofil əvəzlənməsinin bir xüsusiyyəti, reaksiyanın nitro qruplarının bir-birinə nisbətən yerləşməsinə çox həssas olmasıdır. Məlumdur ki m-dinitrobenzol 250 o C-də belə ammonyakın spirt məhlulu ilə reaksiya vermir.
Bu halda hidroksil əvəzlənməsini təşviq edən nitro qrupunun digər nümunələri pikrik turşusunun çevrilmələridir.

16.2.3. Aromatik karbohidrogenlərlə mürəkkəbləşmə. Aromatik nitro birləşmələrinin xarakterik xüsusiyyəti aromatik karbohidrogenlərlə komplekslər əmələ gətirmək meylidir. Belə komplekslərdəki bağlar elektrostatik xarakter daşıyır və elektron verən və elektron qəbul edən hissəciklər arasında yaranır. Baxılan komplekslər adlanır π -komplekslər və ya yük ötürmə kompleksləri.
π – Komplekslər əksər hallarda xarakterik ərimə nöqtələrinə malik kristal maddələrdir. Lazım gələrsə π -kompleks karbohidrogenlərin ayrılması ilə məhv edilə bilər. Bu xüsusiyyətlərin birləşməsi sayəsində π -komplekslər aromatik karbohidrogenlərin ayrılması, təmizlənməsi və identifikasiyası üçün istifadə olunur. Pikrik turşusu xüsusilə tez-tez kompleks formalaşması üçün istifadə olunur, kompleksləri səhv olaraq pikratlar adlanır.
Fəsil 17
Aminlər
Ammonyakdakı hidrogen atomlarının alkil və aril əvəzediciləri ilə əvəzlənmə dərəcəsinə əsasən birincili, ikincili və üçüncü dərəcəli aminlər fərqləndirilir. Əvəzedicilərin təbiətindən asılı olaraq aminlər yağlı aromatik və ya sırf aromatik ola bilər.
Aromatik aminlər azotla əlaqəli qrupların adına "amin" şəkilçisi əlavə edilərək adlandırılır. Mürəkkəb hallarda, daha kiçik əvəzedicisi olan bir amin qrupu daha mürəkkəb əvəzedicinin adına əlavə olunan "amino" (N-metilamino-, N, N-dimetilamino) prefiksi ilə təyin olunur. Aşağıda ən çox tapılan aminlər və onların adları verilmişdir.

Qəbul üsulları
Alifatik aminlərin öyrənilməsində aminlərin hazırlanması üsullarının bir çoxu ilə artıq qarşılaşmışıq. Bu üsulları aromatik aminlərin sintezinə tətbiq edərkən bəzi xüsusiyyətlər meydana çıxır, buna görə də təkrarlanma qorxusu olmadan onları nəzərdən keçirəcəyik.
17.1.1. Nitro birləşmələrinin azaldılması. Nitro birləşmələrinin azaldılması aminlərin həm laboratoriya, həm də sənaye istehsalı üçün əsas üsuldur və bir neçə yolla həyata keçirilə bilər. Bunlara katalitik hidrogenləşdirmə, atom hidrogenlə reduksiya və kimyəvi reduksiya daxildir.
Katalitik azalma, dayaqlarda incə üyüdülmüş nikel və ya platin, mis kompleks birləşmələrinin iştirakı ilə molekulyar hidrogenlə aparılır. Katalizator və reduksiya şərtlərini seçərkən, digər funksional qrupların da azaldıla biləcəyini nəzərə almaq lazımdır. Bundan əlavə, nitro birləşmələrinin katalitik reduksiyası reaksiyanın həddindən artıq ekzotermik təbiətinə görə bir qədər ehtiyatla aparılmalıdır.
Ammonium sulfid kimyəvi reduksiyaedici kimi istifadə edildikdə, bir neçə nitro qrupdan yalnız birini azaltmaq mümkün olur.

17.1.2. Halojen törəmələrinin aminasiyası.“Eliminasiya-əlavə” mexanizmindən istifadə edərək aromatik halogen törəmələrinin aminasiyası zamanı yaranan məlum çətinliklər var. Bununla belə, artıq bir neçə dəfə qeyd edildiyi kimi, düzgün yerləşdirilmiş benzol halqasında elektron çəkən əvəzedicilər, prosesi bimolekulyar mexanizm vasitəsilə idarə edərək, aril halogenidlərdə halogenin əvəzlənməsini əhəmiyyətli dərəcədə asanlaşdırır. Müqayisə üçün aşağıda xlorbenzol və dinitroxlorbenzolun aminləşdirilməsi şərtləri verilmişdir.

17.1.3. Hoffmann parçalanması. Turşu amidlərinin Hoffman parçalanması nəticəsində başlanğıc amidlərdən bir az karbon ehtiva edən ilkin aminlər əmələ gəlir.

Reaksiya aşağıdakı təklif olunan mexanizmə uyğun olaraq fenilin karbonil karbondan azot atomuna (1,2-fenil sürüşməsi) miqrasiyası ilə davam edir.

17.1.4. Aminlərin alkilasiyası və arilasiyası. Birincili və ikinci dərəcəli aromatik aminlərin haloalkillər və ya spirtlərlə alkilasiyası ikincili və üçüncü dərəcəli yağlı aromatik aminləri əmələ gətirir.

Təəssüf ki, ilkin aminlər reaksiyada iştirak etdikdə qarışıq alınır. Başlanğıc amin əvvəlcədən asilləşdirildikdə və sonra alkilləşdirildikdə bunun qarşısını almaq olar

Amin qrupunu qorumaq üçün bu üsul təmiz ikincili aromatik aminləri, həmçinin müxtəlif əvəzedici radikalları olan üçüncü dərəcəli aminləri əldə etməyə imkan verir.

Aminlərin arilasiyası təmiz ikincili və üçüncü dərəcəli aromatik aminləri əldə etməyə imkan verir
Kimyəvi xassələri
Aromatik aminlər həm amin qrupu, həm də benzol halqası ilə reaksiya verir. Üstəlik, hər bir funksional qrup başqa bir qrupdan təsirlənir.
Amin qrupuna reaksiyalar
Bir amin qrupunun olması səbəbindən aromatik aminlər çoxsaylı reaksiyalara məruz qalırlar. Onlardan bəziləri artıq müzakirə edilmişdir: alkilləşmə, asilləşmə, azometinlərin əmələ gəlməsi üçün aldehidlərlə reaksiya. Diqqət veriləcək digər reaksiyalar asanlıqla proqnozlaşdırıla bilər, lakin müəyyən xüsusiyyətlərə malikdir.
Əsaslıq
Azot atomunda bir protonla bir əlaqə yaratmaq üçün təqdim edilə bilən tək elektron cütünün olması əsas xüsusiyyətlərə malik aromatik aminləri təmin edir.

Alifatik və aromatik aminlərin əsaslığını müqayisə etmək maraqlıdır. Alifatik aminlərin tədqiqində artıq göstərildiyi kimi, aminlərin əsaslığını əsaslıq sabiti ilə mühakimə etmək rahatdır. K in

Anilin, metilamin və ammonyakın əsaslarını müqayisə edək
Ammonyak 1.7. 10 -5
Metilamin 4.4. 10 -4
Anilin 7.1. 10 -10
Bu məlumatlardan aydın olur ki, elektron verən metil qrupunun görünüşü azot atomunda elektron sıxlığını artırır və ammonyakla müqayisədə metilamin əsaslığının artmasına səbəb olur. Eyni zamanda, fenil qrupu ammiakla müqayisədə anilinin əsaslığını 10 5 dəfədən çox zəiflədir.
Alifatik aminlər və ammonyak ilə müqayisədə anilinin əsaslığının azalması, benzol halqasının elektronlarının seksteti ilə tək azot elektron cütünün konjuqasiyası ilə izah edilə bilər.

Bu, tək elektron cütünün protonu qəbul etmə qabiliyyətini azaldır. Bu tendensiya benzol halqasında elektron çəkən əvəzediciləri ehtiva edən aromatik aminlərdə daha qabarıq şəkildə özünü göstərir.

Belə ki, m-nitroanilin əsas kimi anilindən 90 dəfə zəifdir.
Gözlənildiyi kimi, benzol halqasında elektron verən əvəzedicilər aromatik aminlərin əsaslığını artırır.

Yağlı aromatik aminlər, alkil qrupunun təsiri altında, halqada elektron çəkən qrupları olan anilin və aminlərdən daha çox əsaslıq nümayiş etdirirlər.
 Nitro qrupunun elektron quruluşu yeddi qütblü (yarıqütblü) bağın olması ilə xarakterizə olunur:
Nitro qrupunun elektron quruluşu yeddi qütblü (yarıqütblü) bağın olması ilə xarakterizə olunur:
Yağlı nitro birləşmələri suda həll olunmayan, lakin spirt və efirdə çox həll olunan mayelərdir. Aromatik nitro birləşmələri müəyyən bir qoxu olan maye və ya bərk maddələrdir. Nitro birləşmələrinin çox vacib bir xüsusiyyəti, reduksiya edildikdən sonra ilkin aminlərə çevrilmələridir.
C 6 H 5 - NO 2 + 6 [H]  C 6 H 5 – NH 2 + 2 H 2 O
C 6 H 5 – NH 2 + 2 H 2 O
Bütün nitro birləşmələri zəhərlidir. Bir çox aromatik nitro birləşmələri partlayıcı xüsusiyyətlərə malikdir.
Kimyəvi xassələri. Nitro birləşmələrinin kimyəvi davranışı molekulda nitro qrupunun olması və onun xüsusiyyətləri, həmçinin karbohidrogen radikalının quruluşu və onların qarşılıqlı təsiri ilə müəyyən edilir.

1. Nitro birləşmələrinin azaldılması
.
Nitro birləşmələri azaldıqda ilkin aminlər əmələ gəlir. Aromatik nitro birləşmələrinin azaldılması xüsusilə böyük sənaye əhəmiyyətinə malikdir:
Reaksiya zamanı reduksiya şəraitindən (turşu, qələvi və ya neytral mühitlərdə) və reduksiyaedicinin təbiətindən asılı olaraq müxtəlif aralıq məhsullar əmələ gəlir ki, onların bir çoxu texnologiyada geniş istifadə olunur.
2. Qələvilərin nitro birləşmələrinə təsiri . Nitro qrupu karbohidrogen molekuluna daxil edildikdə, elektron çəkmə xüsusiyyətlərinə görə, α-mövqeyində hidrogen atomlarının hərəkətliliyini kəskin artırır. İlkin və ikincili nitro birləşmələri duzlar əmələ gətirmək üçün qələvilərdə həll olma qabiliyyəti əldə edirlər. Bir turşu duza təsir etdikdə, asinitro şəklində bir nitro birləşmə əmələ gəlir:

sonra nitro formasına keçir:
Nitro birləşmələrinin iki formasının qarşılıqlı çevrilməsi dinamik izomerizmin (tautomerizm) tipik nümunəsidir.
3. Aromatik nitro birləşmələrinin benzol halqasının reaksiyaları , Nitro qrupu elektrofilik əvəzetmə zamanı ikinci əvəzedicinin girişini l-mövqeyinə, nukleofil əvəzetmə zamanı isə o- və n-mövqelərinə istiqamətləndirir. Aromatik karbohidrogenlərin nitro birləşmələrinin törəmələrinə misal olaraq 2, 4, 6-trinitrofenol (pikrin turşusu) ola bilər:
Pikrik turşusu və onun duzları partlayıcı maddələr kimi və analitik kimyada istifadə olunur.

Ərizə. Nitropparafinlər sənayedə həlledicilər, dizel yanacağına onların alışma temperaturunu azaldan əlavələr kimi, partlayıcı maddələrin, plastiklərin istehsalında və reaktiv texnologiyada istifadə olunur; aminlərin, aldehidlərin və ketonların, yağ turşularının sintezində ara məhsullar kimi. Aromatik nitro birləşmələri boyalar, plastiklər, ətirlər və partlayıcı maddələr istehsal etmək üçün geniş istifadə olunur.
Fərdi nümayəndələr.
Nitrometan C H 3 -NO 2. Maye, qaynama temperaturu -101,2 °C. Raket yanacağı kimi həlledici kimi istifadə olunur. Nitrometanı xlorlayaraq trikloronitrometan (xloropikrin) CCl 3 NO 2 alınır ki, bu da çörək sexlərində və anbarlarda, həmçinin müxtəlif sintezlərdə gəmiricilərə qarşı mübarizə aparmaq üçün istifadə olunur.
Nitroetan CH 3 CH 2 -NO 2. Maye, t qaynama = 113 °C * Kip = PZ°C. Hidroksilamin istehsalında istifadə olunur:
Nitrosikloheksan C 6 CH 2 NO 2. Maye, qaynama temperaturu =205 °C. Sikloheksanın nitrasiyası ilə hazırlanır. Kaprolaktamın sintezində ara məhsul kimi istifadə olunur.
Nitrobenzol C 6 H 6 NO 2. Maye sarımtıl rəngdədir, acı badam qoxusu var, qaynama nöqtəsi = 211 °C. Suda az həll olunur və bir çox üzvi həlledicilərdə yüksək dərəcədə həll olunur. Anilin istehsalında başlanğıc məhsul anilin boyası, parfümeriya və əczaçılıq sənayesində geniş istifadə olunur.

trinitrotoluen (
tol, TNT)
Bərk maddə, t pl = 80°C. Partlayıcı kimi geniş istifadə olunur.
N- və O-nitro birləşmələri də məlumdur (bax və Üzvi Nitratlar).
Nitro qrupu iki məhdudlaşdırıcı rezonans strukturu arasında aralıq bir quruluşa malikdir:
BƏZİ ALİFATİK NİTRİKLƏRİN FİZİKİ XÜSUSİYYƏTLƏRİ

*25°C-də. **24°C-də. ***14°C-də.
Nitro birləşmələrinin İQ spektrləri iki xüsusiyyəti ehtiva edir. N-O bağının antisimmetrik və simmetrik uzanan vibrasiyalarına uyğun olan zolaqlar: müvafiq olaraq ilkin nitro birləşmələri üçün. 1560-1548 və 1388-1376 sm -1, ikinci dərəcəli 1553-1547 və 1364-1356 sm -1, üçüncü dərəcəli 1544-1534 və 1354-1344 sm -1; nitroolefinlər üçün RCH=CHNO 2 1529-1511 və 1351-1337 sm -1 ; dinitroalkanlar üçün RCH(NO 2) 2 1585-1575 və 1400-1300 sm -1 ; trinitroalkanlar üçün RC(NO 2) 3 1610-1590 və 1305-1295 sm -1 ; aromatik N. 1550-1520 və 1350-1330 sm -1 üçün (elektron çəkən əvəzedicilər yüksək tezlikli zolağı 1570-1540 bölgəyə, elektron verən əvəzedicilər isə 1510-1490 sm -1 bölgəyə keçir); N. 1610-1440 və 1285-1135 sm -1 üçün; nitron efirləri 1630-1570 sm, C-N bağı 1100-800 sm -1-də zəif zolaqlı olur.
Alifatik nitro birləşmələrinin UV spektrlərində l max 200-210 nm (intensiv zolaq) və 270-280 nm (zəif zolaq); müvafiq olaraq nitron turşularının üçün və efirləri. 220-230 və 310-320 nm; heme-dinitro tərkibli üçün 320-380 nm; aromatik N. üçün 250-300 nm (komplanarlıq pozulduqda zolağın intensivliyi kəskin şəkildə azalır).
Kimyanın PMR spektrində. a-H atomunun strukturundan asılı olaraq yerdəyişmələri 4-6 ppm. NMR spektrində 14 N və 15 N kimyəvi. 5-i - 50-dən + 20 ppm-ə dəyişdirin
Alifatik nitro birləşmələrinin kütlə spektrlərində (CH 3 NO 2 istisna olmaqla) pik mol. yoxdur və ya çox kiçik; əsas parçalanma prosesi - NO 2-nin və ya ikisinin aradan qaldırılması ilə bərabər fraqmentin əmələ gəlməsi. Aromatik nitro birləşmələri pik molun olması ilə xarakterizə olunur. ; əsas spektrdə pik NO 2-nin aradan qaldırılması zamanı əldə edilənə uyğundur.
Kimyəvi xassələri. Nitro qrupu ən çox olanlardan biridir güclü elektron çəkən qruplar və neqativi effektiv şəkildə delokalizasiya edə bilir. doldurmaq. Aromatik olaraq əlaqə. induksiya nəticəsində və xüsusilə paylanmasına təsir göstərir: nüvə qismən müsbət əldə edir. ilk növbədə orto və para mövqelərində lokallaşdırılmış yük; NO 2 qrupu üçün Hammet sabitləri s m 0,71, s n 0,778, s + n 0,740, s - n 1,25. Beləliklə, NO 2 qrupunun tətbiqi reaksiyanı kəskin şəkildə artırır. təşkil etmək bacarığı. əlaqə. nukleofa münasibətdə. reagentlər və elektrof ilə reaksiyaları çətinləşdirir. reagentlər. Bu, org-da nitro birləşmələrinin geniş istifadəsini müəyyən edir. sintez: NO 2 qrupu təşkilatın istənilən mövqeyinə daxil edilir. əlaqə, parçalanma həyata keçirmək. reaksiyalar, bir qayda olaraq, karbon skeletinin dəyişməsi ilə əlaqələndirilir və sonra başqa bir funksiyaya çevrilir və ya çıxarılır. Aromatik olaraq Bəzi hallarda tez-tez daha qısa bir sxem istifadə olunur: NO 2 qrupunun nitrasiya-transformasiyası.
Mn. alifatik nitro birləşmələrinin çevrilmələri ilkin müalicə ilə baş verir. nitron turşularına və ya uyğun əmələ gəlməsi . Məhlullarda tarazlıq adətən demək olar ki, tamamilə C formasına doğru sürüşür; 20 °C-də 1 üçün turşu formasının nisbəti 10-7, nitropropan 3 üçün. 10 -3. Sərbəst nitron turşuları. forma adətən qeyri-sabitdir; onlar N.-nin diqqətlə turşulaşdırılması ilə əldə edilir. N.-dən fərqli olaraq məhlullarda cərəyan keçirir və FeCl 3 ilə qırmızı rəng verir. Aci-N, müvafiq nitro birləşmələrindən (pK a ~ 8-10) daha güclü CH-turşularıdır (pK a ~ 3-5); NO 2 qrupuna a-mövqeyində elektron çəkən əvəzedicilərin daxil edilməsi ilə nitro birləşmələrinin turşuluğu artır.
Aromatik sıradakı nitron turşularının əmələ gəlməsi benzol halqasının quinoid formasına keçməsi ilə əlaqədardır; məsələn, conc ilə formalar. H 2 SO 4 rəngli duza bənzər I növ məhsul, o-nitrotoluol intramolla nəticələnir. parlaq mavi O törəməsi yaratmaq üçün transfer:

Əsaslar ilkin və ikincili azotla təsir etdikdə nitro birləşmələri əmələ gəlir; elektrofillərlə reaksiyalar zamanı həm O-, həm də C-törəmələri istehsal etməyə qadirdirlər. Beləliklə, H.-ni alkil halogenidlər, trialkilxlorosilanlar və ya R 3 O + BF - 4 ilə alkilləşdirdikdə O-alkilləşmə məhsulları əmələ gəlir. Ən son m.b. diazometan və ya N,O-bis-(trimetilsilil)asetamidin pK a ilə nitroalkanlara təsiri ilə də əldə edilir.

Asiklik nitron turşularının alkil efirləri termal cəhətdən qeyri-sabitdir və intramolu parçalayır. mexanizm:
r-tion əldə etmək üçün istifadə edilə bilər. Silil efirləri daha sabitdir. C-alkilasiya məhsullarının əmələ gəlməsi üçün aşağıya baxın.
Nitro birləşmələri N=O, O=N O, C=N -> O bağları boyunca C-N bağının parçalanması ilə reaksiyalar və NO 2 qrupunun qorunması ilə reaksiyalarla xarakterizə olunur.
R-ts və s r a r s təxminən m-də birləşmələr və S-N ilə. İlkin və ikinci dərəcəli N. qızdırma zamanı. mədənçi ilə. spirt və ya sulu məhlulun iştirakı ilə turşular karbonil birləşmələri əmələ gətirir. (Nave reaksiyasına baxın). R-tion boşluqlardan keçir. nitron turşularının əmələ gəlməsi:

İlkin əlaqə kimi. Silil nitron efirləri istifadə edilə bilər. Güclü turşuların alifatik nitro birləşmələrinə təsiri hidroksamik turşulara səbəb ola bilər, məsələn:

Metod sənayedə CH 3 COOH və nitroetanın sintezi üçün istifadə olunur. Aromatik nitro birləşmələri güclü turşuların təsirinə təsirsizdir.
NO 2 qrupuna b mövqeyində mobil H olan alifatik nitro birləşmələri əsasların təsiri altında onu HNO 2 şəklində əmələ gətirməklə asanlıqla aradan qaldırır. İstilik axını eyni şəkildə davam edir. 450°-dən yuxarı temperaturda nitroalkanların parçalanması. Vicinal dinitrosoidlər. Ca hexamstanolda emal edildikdə, NO 2 qrupları itirildikdə, doymamış nitro birləşmələrinin Ag duzları dimerləşə bilir;

Nukleof. NO 2 qrupunun əvəzlənməsi nitroalkanlar üçün xarakterik deyil, lakin aprotik həlledicilərdə tiolat ionları üçüncü dərəcəli nitroalkanlara təsir etdikdə, NO 2 qrupu ilə əvəz olunur. Reaksiya anion-radikal mexanizmlə gedir. Alifatik olaraq və heterosiklik. əlaqə. NO 2 qrupu nisbətən asanlıqla nükleofillə əvəz olunur, məsələn:

Aromatik olaraq əlaqə. nukleof. NO 2 qrupunun əvəzlənməsi onun digər əvəzedicilərə nisbətən mövqeyindən asılıdır: elektron çəkən əvəzedicilərə münasibətdə meta mövqedə və elektron donorlara nisbətən orto və para mövqelərində yerləşən NO 2 qrupu, aşağı reaktivliyə malikdir. bacarıq; reaksiya orto- və para-vəzifələrdə yerləşən NO 2 qrupunun elektron çəkən əvəzediciləri qəbul etmək qabiliyyəti nəzərəçarpacaq dərəcədə artır. Bəzi hallarda əvəzedici orto mövqeyə NO 2 ayrılan qrupuna daxil olur (məsələn, aromatik N. KCN-nin spirt məhlulu ilə qızdırıldığında, Rixter reaksiyası):

R-ts və əlaqə haqqında N = O. Ən vacib reaksiyalardan biri azalmadır, bu, ümumiyyətlə məhsullar dəstinə gətirib çıxarır:

Azoksi-(II), azo-(III) və hidrazo tərkibli. (IV) aralıq nitrozo birləşmələri nəticəsində qələvi mühitdə əmələ gəlir. s və . Prosesin turşu mühitdə aparılması bu maddələrin əmələ gəlməsini aradan qaldırır. Nitrozo tərkibli müvafiq nitro birləşmələrindən daha sürətli reduksiya olunur və onları reaksiyadan təcrid edin. qarışıq adətən uğursuz olur. Alifatik N. azoksi-və ya Na-nın təsiri altında azalır, aromatik - NaBH 4-ün təsiri altında, sonuncunun LiAlH 4 ilə müalicəsi buna səbəb olur. Elektrokimya. aromatik N., müəyyən şərtlərdə, təqdim olunan törəmələrdən hər hansı birini əldə etməyə imkan verir (nitrozo birləşmələri istisna olmaqla); Eyni üsuldan istifadə edərək mononitroalkanlardan və amidoksimləri heme-dinitroalkanlardan almaq rahatdır:
O = N O və C = N O bağları üçün nisbətlər. Nitro birləşmələri 1,3-dipolyar reaksiyalara girir, məsələn:

Naib. Bu reaksiya nitron esterləri və ya arasında asanlıqla baş verir. Nukleofillərin təsiri altında olan məhsullarda (mono- və bisiklik dialkoksiaminlər). və elektrof. N - O bağ reagentləri asanlıqla parçalanır, bu da parçalanmaya səbəb olur. alifatik və heterosiklik. əlaqə:

Hazırlayıcı məqsədlər üçün reaksiyada stabil silil nitron efirlərindən istifadə olunur.
R-ts və NO 2 qrupunun qorunması. Tərkibində a-H atomu olan alifatik N-lər asanlıqla alkilləşir və asilləşir, adətən O-törəmələri əmələ gətirir. Bununla belə, qarşılıqlı mod. dilitium əsas N. alkil halidləri, anhidridləri və ya karboksilik turşuların turşu halogenidləri ilə C-alkilləşmə və ya C-asilləşmə məhsullarına gətirib çıxarır, məsələn:
İntramolun məlum nümunələri var. C-alkilləşmə, məsələn:
İlkin və ikincili nitro birləşmələri alifatik birləşmələrlə reaksiya verir. və p-amino törəmələrinin əmələ gəlməsi ilə CH 2 O (Mannix məhlulu); reaksiyada nitro birləşmələrinin və ya amin birləşmələrinin əvvəllər hazırlanmış metilol törəmələrindən istifadə edə bilərsiniz:


Nitroolefinlər asanlıqla əlavə reaksiyalara girirlər: sonuncu ilə bir az turşu və ya bir qədər qələvi mühitdə. Henri retroreaksiya ilə onlar karbonil birləşmələri əmələ gətirirlər. və nitroalkanlar; a-H-atom, -poli-nitro birləşmələri olan nitro birləşmələri ilə; digər CH turşuları, məsələn, malon turşuları, Grignard reagentləri, həmçinin OR -, NR - 2 və s. kimi nukleofillər əlavə edin, məsələn:

Nitroolefinlər sikloyüklənmə reaksiyalarında dienofillər və ya dipolarofillər kimi, 1,4-dinitrodienlər isə dien komponentləri kimi çıxış edə bilər, məsələn:

Qəbz. Sənayedə aşağı nitroalkanlar maye fazalı (Konovalov üsulu) və ya buxar fazalı (Hess üsulu) qarışıqları ilə, və təbiidən təcrid olunmuş və ya emal yolu ilə əldə edilir (bax. Nitrasiya). Bu üsul daha yüksək nitratları, məsələn, kaprolaktam istehsalında ara məhsul olan nitrosikloheksan əldə etmək üçün də istifadə olunur.
Laboratoriyada nitroalkanları əldə etmək üçün azot turşusu istifadə olunur. aktivləşdirilməklə metilen qrupu; ilkin nitroalkanların sintezi üçün əlverişli üsul 1,3-indandionun sonuncu ilə nitrasiyasıdır. qələvi a-nitroketon:

Alifatik nitro birləşmələri də qarşılıqlı təsir alır. Alkil halidləri ilə AgNO 2 və ya a-halokarboksilik turşuların efirləri ilə NaNO 2 (bax Meyer reaksiyası). Alifatik N. zaman və zaman əmələ gəlir; -heme-di- və hem-trinitro birləşmələrinin alınması üsulu, məsələn:

Nitroalkanlar m.b. asil nitratları 200 °C-ə qədər qızdırmaqla əldə edilir.
Mn. nitro birləşmələrinin sintezi üsulları olefinlərə, HNO 3, nitronium, NO 2 Cl, org. nitratlar və s. Bir qayda olaraq, bu, vic-dinitro birləşmələri, nitronitratlar, nitronitritlər, doymamış nitro birləşmələri, həmçinin NO 2 qrupunun konjugat əlavəsi və həlledici və ya onların məhsullarının qarışığını istehsal edir, məsələn:
Nitro birləşmələri bir və ya bir neçə hidrogen atomunun nitro qrupu -NO 2 ilə əvəz olunduğu karbohidrogen törəmələridir. Nitro qrupunun bağlı olduğu karbohidrogen radikalından asılı olaraq nitro birləşmələri aromatik və alifatiklərə bölünür. Alifatik birləşmələr nitro qrupunun 1o, 2o və ya 3o karbon atomuna birləşməsindən asılı olaraq ilkin 1o, ikincili 2o və üçüncü dərəcəli 3o olaraq fərqləndirilir.
Nitro qrupu -NO2 nitrit qrupu -ONO ilə qarışdırılmamalıdır. Nitro qrupu aşağıdakı quruluşa malikdir:
Azot atomunda ümumi müsbət yükün olması onun güclü -I təsirinə səbəb olur. Güclü -I effekti ilə yanaşı, nitro qrupu güclü -M effektinə malikdir.
Məs. 1. Nitro qrupunun quruluşunu və aromatik halqada elektrofil əvəzetmə reaksiyasının istiqamətinə və sürətinə təsirini nəzərdən keçirin.
Nitro birləşmələrinin alınması üsulları
Nitro birləşmələrinin istehsalı üçün demək olar ki, bütün üsullar artıq əvvəlki fəsillərdə müzakirə edilmişdir. Aromatik nitro birləşmələri adətən arenlərin və aromatik heterosiklik birləşmələrin birbaşa nitrasiyası ilə alınır. Nitrosikloheksan sənayedə sikloheksanın nitrasiyası ilə istehsal olunur:

Nitrometan da eyni üsulla alınır, lakin laboratoriya şəraitində xlorosirkə turşusundan reaksiyalar nəticəsində alınır (2-5). Bunların əsas mərhələsi SN2 mexanizmi vasitəsilə baş verən reaksiyadır (3).
Xloroasetik turşu Natrium xloroasetat
Nitrosirkə turşusu
Nitrometan
Nitro birləşmələrinin reaksiyaları
Alifatik nitro birləşmələrinin tautomerizmi
Nitro qrupunun güclü elektron çəkmə xüsusiyyətlərinə görə -hidrogen atomlarının hərəkətliliyi artmışdır və buna görə də ilkin və ikincili nitro birləşmələri CH-turşularıdır. Beləliklə, nitrometan kifayət qədər güclü bir turşudur (pKa 10.2) və qələvi mühitdə asanlıqla rezonansla stabilləşdirilmiş aniona çevrilir:
Nitrometan pKa 10.2 Rezonans stabilləşdirilmiş anion
Məşq 2. (a) nitrometanın və (b) nitrosikloheksanın NaOH-un sulu məhlulu ilə reaksiyalarını yazın.
Alifatik nitro birləşmələrinin aldehidlər və ketonlarla kondensasiyası
Nitroqrup alifatik birləşmələrə nitroalkan anionu ilə aldehid və ya keton arasında aldol reaksiyası ilə daxil edilə bilər. Nitroalkanlarda -hidrogen atomları aldehidlərə və ketonlara nisbətən daha çox hərəkətlidir və buna görə də aldehidlər və ketonlarla birləşmə və kondensasiya reaksiyalarına girərək, onların -hidrogen atomlarını təmin edə bilirlər. Alifatik aldehidlərlə adətən əlavə reaksiyaları, aromatik aldehidlərlə isə yalnız kondensasiya reaksiyaları baş verir.
Beləliklə, nitrometan sikloheksanona əlavə olunur,

1-Nitrometilsikloheksanol
lakin benzaldehidlə kondensasiya olunur,
Formaldehidlə əlavə reaksiya 2-hidroksimetil-2-nitro-1,3-dinitropropan və ya trimetilolnitrometan yaratmaq üçün nitrometanın hər üç hidrogen atomunu əhatə edir.
Nitrometanın heksametilentetraminlə kondensasiyası ilə biz 7-nitro-1,3,5-triazaadamantan əldə etdik:

Məs. 3. Formaldehidin (a) nitrometan və (b) nitrosikloheksanla qələvi mühitdə reaksiyalarını yazın.
Nitro birləşmələrinin azaldılması
Nitro qrupu müxtəlif reduksiyaedici maddələrlə amin qrupuna çevrilir (11.3.3). Anilin sənaye şəraitində Raney nikelinin iştirakı ilə təzyiq altında nitrobenzolun hidrogenləşdirilməsi yolu ilə istehsal olunur.

Laboratoriya şəraitində, hidrogen əvəzinə, hidrogeni buraxmaq üçün Raney nikelinin iştirakı ilə parçalanan hidrazin istifadə edilə bilər.

7-nitro-1,3,5-triazaadamantan 7-amino-1,3,5-triazaadamantan
Nitro birləşmələri turşu mühitdə metallarla reduksiya edilir, sonra qələviləşmə baş verir

Mühitin pH-dan və istifadə olunan reduksiyadan asılı olaraq müxtəlif məhsullar əldə edilə bilər. Neytral və qələvi mühitdə adi reduksiyaedicilərin nitro birləşmələrə qarşı aktivliyi turşu mühitə nisbətən daha azdır. Tipik bir nümunə, nitrobenzolun sinklə azaldılmasıdır. Həddindən artıq xlorid turşusunda sink nitrobenzonu anilinə, ammonium xloridin bufer məhlulunda isə fenilhidroksilaminə qədər azaldır:

Turşu mühitdə arilhidroksilaminlər yenidən qurulur:

p-aminofenol fotoqrafiyada inkişaf etdirici kimi istifadə olunur. Fenilhidroksilamin daha sonra nitrosobenzenə oksidləşə bilər:

Nitrosobenzol
Nitrobenzolu qalay(II) xloridlə reduksiya etməklə azobenzol, qələvi mühitdə sinklə isə hidrazobenzol alınır.


Nitrobenzolun metanolda qələvi məhlulu ilə işlənməsi ilə azoksibenzol alınır, metanol isə qarışqa turşusuna oksidləşir.

Nitroalkanların natamam reduksiya üsulları məlumdur. Neylon istehsalının sənaye üsullarından biri də buna əsaslanır. Sikloheksanın nitrasiyası ilə nitrosikloheksan əldə edilir, o, reduksiya yolu ilə sikloheksanona çevrilir və sonra Beckmann yenidən təşkili ilə kaprolaktam və poliamidə - lif - neylonun hazırlanması üçün başlanğıc materiala çevrilir:

Aldol əlavə məhsullarının nitro qrupunun azaldılması (7) α-amino spirtlərinin hazırlanması üçün əlverişli üsuldur.

1-Nitrometilsikloheksanol 1-Aminometilsikloheksanol
Hidrogen sulfidin azaldıcı vasitə kimi istifadəsi dinitroarenlərdəki nitro qruplarından birini azaltmağa imkan verir:

m-Dinitrobenzol m-Nitroanilin

2,4-Dinitroanilin 4-Nitro-1,2-diaminobenzol
Məşq 4. (a) m-dinitrobenzolun xlorid turşusunda qalayla, (b) m-dinitrobenzolun hidrogen sulfidlə, (c) ammonium xloridin bufer məhlulunda sinklə p-nitrotoluolun reduksiya reaksiyalarını yazın.
Məşq 5. Reaksiyaları tamamlayın:


Nitro birləşmələrinin azaldılması . Bütün nitro birləşmələri ilkin aminlərə qədər azalır. Yaranan amin uçucudursa, onu göstərici kağızın rənginin dəyişməsi ilə aşkar etmək olar:
Azot turşusu ilə reaksiya. Birincili və ikincili nitro birləşmələrinə xarakterik keyfiyyət reaksiyası azot turşusu ilə reaksiyadır.
üçün üçüncü dərəcəli alifatik nitro birləşmələri Xüsusi aşkarlama reaksiyaları yoxdur.
Aromatik nitro birləşmələrinin aşkarlanması. Aromatik nitro birləşmələri adətən açıq sarı rəngdədir. Digər əvəzedicilərin iştirakı ilə rəngin intensivliyi və dərinliyi tez-tez artır. Aromatik nitro birləşmələrini aşkar etmək üçün onlar ilkin aminlərə qədər azaldılır, sonuncular diazotlaşdırılır və β-naftol ilə birləşdirilir:
| ArNO 2 → ArNH 2 → ArN 2 Cl → ArN=N |
| OH |
Lakin bu reaksiya spesifik deyil, çünki aminlər təkcə nitro birləşmələrin deyil, həm də nitrozo, azooksi və hidrazo birləşmələrinin reduksiyası zamanı əmələ gəlir. Bir birləşmədə nitro qrupunun olması barədə yekun nəticə çıxarmaq üçün kəmiyyət təyini aparmaq lazımdır.
N-nitrozo birləşmələrinin keyfiyyət reaksiyaları
HI ilə reaksiya. C-nitrozo birləşmələrini N-nitrozo birləşmələrindən kalium yodidin turşulaşdırılmış məhluluna münasibətinə görə ayırmaq olar: C-nitrozo birləşmələri hidroyod turşusunu oksidləşdirir, N-nitrozo birləşmələri hidroyod turşusu ilə reaksiyaya girmir.
İlkin aromatik aminlərlə reaksiya. C-Nitroso birləşmələri ilkin aromatik aminlərlə kondensasiya olunur və rəngli azo birləşmələri əmələ gətirir:
| ArN = O + H 2 N – Ar → Ar – N = N – Ar + H 2 O |
N-nitrozo birləşmələrinin hidrolizi. Saf aromatik və yağlı aromatik N-nitrozo birləşmələri (nitrozaminlər) HCl-nin spirt məhlulları ilə asanlıqla hidrolizə olunur, ikinci dərəcəli amin və azot turşusu əmələ gətirir. Hidroliz a-naftilaminin iştirakı ilə aparılırsa, onda sonuncu yaranan azot turşusu ilə diazotlaşdırılır və diazo birləşmə artıq a-naftilaminlə azo birləşmə reaksiyasına girir. Azo boya əmələ gəlir:
Reaksiya qarışığı çəhrayı olur; Tədricən rəng bənövşəyi olur.
Nitrillərin keyfiyyət reaksiyaları
RC≡N, ArC≡N nitrillərinin analizində onların hidroliz və reduksiya qabiliyyətindən istifadə edilir. C≡N qrupunu aşkar etmək üçün hidroliz aparılır:
| RC ≡ N + H 2 O → R – CONH 2 |
Nitrillər ən rahat şəkildə hidrolizləri ilə əldə edilən turşularla xarakterizə olunur. Turşu buxar distilləsi və ya ekstraksiya yolu ilə hidrolizatdan təcrid olunur və törəmələrdən birinə - efir və ya amidə çevrilir.
Tiolların keyfiyyət reaksiyaları (tio spirtləri, tioefirlər)
Təhlildə istifadə olunan tiolların ən mühüm xüsusiyyətləri -SH qrupunda bir hidrogen atomunu əvəz etmək qabiliyyəti və oksidləşmə qabiliyyətidir. Tərkibində -SH qrupu olan maddələr molekulda karbon atomlarının sayının artması ilə zəifləyən güclü xoşagəlməz qoxuya malikdir.
HNO 2 ilə reaksiya. Tərkibində SH qrupu olan maddələr azot turşusuna məruz qaldıqda rəng reaksiyası verir:
Bu reaksiyanı tiollardan başqa RCOSH tioturşuları da verir. R əsas və ya ikincil alkildirsə, qırmızı rəng görünür, əgər R üçüncü dərəcəli alkil və ya arildirsə, rəng əvvəlcə yaşıl, sonra qırmızıdır.
Merkaptid əmələ gəlməsi. Tiolların xarakterik keyfiyyət reaksiyası həm də ağır metal merkaptidlərinin (Pb, Cu, Hg) çöküntülərinin əmələ gəlməsidir. Məsələn,
| 2RSH + PbO → (RS)2Pb + H2O |
Qurğuşun və mis merkaptidləri rənglidir.