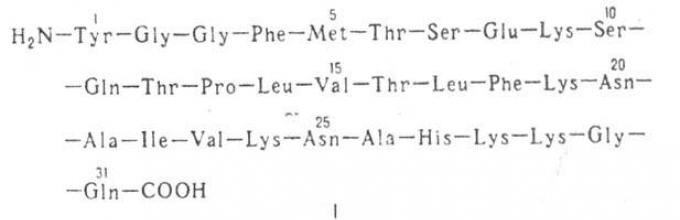OPIOIDNI PEPTIDI, grupa prirodnih i sintetičkih. peptidi slični opijatima (morfijum, kodein itd.) po svojoj sposobnosti da se vezuju za opijatske receptore organizma (strukture nervnog sistema, u odnosu na koje su opijati egzogeni ligandi). Prirodni OPIOIDNI PEPTIDI (endogeni ligandi opijatnih receptora) izolovani su prvi put 1975. godine iz mozga sisara. To su bili takozvani enkefalini - leucin-enkefalin H 2 N-Tyr-Gly-Gly- Phe-Leu-COOH (molekulska masa 556; vidi slovne oznake u članku Amino kiseline) i metionin-enkefalin H 2 N-Tur - Gly -Gly-Phe-Met-COOH (molekulska težina 574), koji su pentapentidi koji se razlikuju samo po C-terminalnom aminokiselinskom ostatku. Aminokiselinska sekvenca metionin-enkefalina je identična 61-65 fragmentu -lipotropina.
Iz ekstrakta tkiva hipofize i hipotalamusa sisara izolovani su i drugi OPIOIDNI PEPTIDI, koji su dobili naziv grupe endorfini. Svi oni obično sadrže enkefalinski ostatak u N-terminalnom području molekula. Postoje -endorfin (formula I), -endorfin (njegova molekula je identična fragmentu 1-16 (3-endorfin), -endorfin (sastoji se od ostatka -endorfina povezanog na C-terminusu sa ostatkom leucina) i -endorfina (-endorfin vezan na C-terminusu sa Phe-Lys) -neo-endorfin (razlikuje se od prethodnog po odsustvu ostatka lizina na C-kraju), dinorfin A (III), dinorfin B (IV) , dinorfin-32 (sastoji se od ostataka dinorfina A i dinorfina B povezanih sa Lys-Arg dipeptidom, redom na C- i N-kraju), dermorfina (V), kiotorfina (H 2 N-Tyr-Arg -COOH), kazomorfin-5 (H 2 N-Tyr -Pro-Phe-Pro -Gly-COOH), kazomorfin- 7 (razlikuje se od prethodnog po prisustvu na C-terminusu dodatnih dva aminokiselinska ostatka Pro-Ile i nekih drugi peptidi.

Svi endogeni OPIOIDNI PEPTIDI se sintetiziraju u tijelu u obliku velikih proteina prekursora iz kojih se oslobađaju kao rezultat proteolize. Poznata su tri različita proteina prekursora OPIOIDNIH PEPTIDA: proenkefalin, proopiomelanokortin i prodinorfin. Prostor struktura enkefalina i morfija je slična. Enkefalini i endorfini imaju analgetski učinak (kada se ubrizgavaju direktno u mozak) i smanjuju motoričku aktivnost. aktivnosti gastrointestinalnog trakta, utiču na emocionalno stanje. Efekat OPIOIDNIH PEPTIDA nestaje nekoliko sekundi nakon primene naloksona (VI), antagonista morfijuma.

Uporedo sa implementacijom kompletne hemijske sinteze prirodnih OPIOIDNIH PEPTIDA, intenzivno se proučavaju njihova različita sintetička jedinjenja. analozi. Posebna pažnja posvećena je sintezi analoga OPIOIDNIH PEPTIDA, koji su u porastu. otpornost na proteolitičko djelovanje. enzimi. Neki sintetički analozi OPIOIDNI PEPTIDI p. pokazuju aktivnost sličnu morfiju u perifer. administrirano.
Literatura: Endorfini, ur. E. Costa, M. Trabucchi, trans. sa engleskog, M., 1981; Jakubke H.-D., Eshkait X., Aminokiseline, peptidi, proteini, trans. sa njemačkog, M., 1985, str. 289-95. Yu. P. Shvachkin.
Hemijska enciklopedija. Sveska 3 >>
480 rub. | 150 UAH | $7,5 ", MOUSEOFF, FGCOLOR, "#FFFFCC",BGCOLOR, "#393939");" onMouseOut="return nd();"> Disertacija - 480 RUR, dostava 10 minuta, non-stop, sedam dana u nedelji i praznicima
240 rub. | 75 UAH | 3,75 dolara ", MOUSEOFF, FGCOLOR, "#FFFFCC",BGCOLOR, "#393939");" onMouseOut="return nd();"> Sažetak - 240 rubalja, dostava 1-3 sata, od 10-19 (moskovsko vrijeme), osim nedjelje
Damirov Aslan Hasan ogly. Teorijska konformaciona analiza leucin-enkefalina, N-terminalnog tridekapeptida dinorfina i njihovih analoga: IL RGB OD 61:85-1/1277
Uvod
POGLAVLJE I. Pregled literature 8
1.1. Eksperimentalne i teorijske metode za konformacionu analizu peptida. 9
1.3. Strukturna i funkcionalna organizacija peptida 29
1.4. Inverzni strukturni problem 39
1.5. Metoda teorijske konformacione analize" 50
1.6. Ciljevi istraživanja 56
POGLAVLJE II. Teorijska konformaciona analiza leucin-enkefalina 57
2.1. Biološke funkcije leucin-enkefalina 57
2.2. Konformacijske mogućnosti leucin-enkefalina 58
POGLAVLJE III. Teorijska analiza konfluencije analoga leucin-enkefalina 69
3.1. Analogni Tyr1- Gly2- Gly3- Phe4- Leu5- Arg6 70
3.2. Analogni Ty^-D-Ala2-Gly3~ Phe4-Leu5 » 72
3.3. Analogni Tyi^-D- Ala2- Gly3- Phe4- Leu5- - Arg6 79
3.4. Analogni Tyr*-D- Ala2- Gly3- Phe4- Ala5- - Arg6 84
3.5. Analogni TyrX-D~ Ala2- Gly3- Phe4- Gly5- - Arg6 88
3.6. Analogni Tyr1-])- Ala2- Gly3- Phe4- Ala5- - Lys6 91
3.7. Analog Tyr ^D- Ala2- Gly3- Phe4- Ala5- - Asn6 93
3.8* Analog Tyg ^D*- Ala2- Gly3- Phe4-Aln5~ - Gin6 99
3.9. Analogni Tyr -^- D- Ala2- Gly3- Phe4- Ala5- - His6 103
3.10* Analogni Tyr -^-D- Ala2- Glu3-N- MePhe4- - Leu5- Arg6 106
POGLAVLJE ÍU. Teorijska konformaciona analiza n-terminalnog dinorfin peptida i njegovih analoga
4.1 Funkcije dinorfina i šema za proračun njegove prostorne strukture IZ
4.2. Fragmenti Arg - Arg7, Arg - Arg9, Arg -
Bys11, bys11-Lys13 116
4.3. Fragmenti Phe 4-Arg7 i Arg 6-Arg9 121
4.4. Fragment Arg 9-Lys13 126
4.5. Fragment Tyr I*-Arg 9 129
4.6. Dynorphin N-terminalni tridekapeptidni molekul 132
4.7. -Analog dinorfina I - IZ 137
4.8. -Dinorfin analog I - IZ 137
Literatura 144
Uvod u rad
Opće karakteristike rada. Teza je posvećena proučavanju prostorne strukture leucin-enkefalina, N-terminalnog tridekapeptida dinorfina i niza njihovih analoga metodom teorijske konformacijske analize. Prilikom izračunavanja konformacije molekula, potencijalna energija se uzima kao zbir energija interakcija valentno nevezanih atoma, elektrostatičkih, toroidnih interakcija i vodikovih veza. Za traženje minimalne potencijalne energije korišćena je metoda konjugovanog gradijenta Rad razvijen u problemskoj laboratoriji "Molekularne biofizike" Univerziteta Azerbejdžan Državni univerzitet nazvan po S.M. Kirovu, univerzalni program napisan u algoritamskom jeziku "FORTRAN", Proračuni su vršeni na elektronskim računarima EC-I033, EC-I022 i BESM-6,
Relevantnost teme. Mnogi biološki procesi se odvijaju uz neizostavno učešće proteina i hormona. Znanje prostorna organizacija i dinamička konformaciona svojstva prirodnih oligopeptida neophodna je za proučavanje molekularnih mehanizama prepoznavanja, stimulacije, regulacije i koordinacije biološki procesi, fenomena strukturno-funkcionalnih odnosa i rješenja mnogih drugih pitanja od velikog naučnog i praktičnog značaja. Metoda rendgenske difrakcijske analize može odrediti samo statička stanja proteina i hormona. Teorijska konformaciona analiza daje ideju ne samo o prostornoj strukturi, već io njenom potencijalu za promjenu. Stoga rad u ovom smjeru može dovesti do vrijednih informacija o finim detaljima bioloških procesa na atomsko-molekularnom nivou.
Cilj rada. Disertacija je posvećena proučavanju prostorne strukture i dinamičkih konformacionih svojstava molekula endogenih peptidnih hormona leucin-enkefalina, dynorphy-yaa, kao i velikog broja njihovih analoga.
Ispitivanje teorijskog pristupa koji omogućava predviđanje strukture analoga koji imaju određene funkcije prirodnih hormona i prije sinteze i bioloških ispitivanja. Bilo je potrebno pronaći takve kemijske modifikacije hormona koje bi produžile njihovo djelovanje ili bi selektivno reproducirale jednu od ovih funkcija. To je zahtijevalo, prvo, razjasniti geometrijske i energetske karakteristike preferiranih konformacijskih stanja prirodnih hormona (direktan strukturni problem) i, drugo, namjerno modificirati kemijsku strukturu prirodnih hormona na takav način da njihova prostorna struktura dobro odgovara -definisane niskoenergetske konformacije prirodnog peptida (inverzni strukturni problem).
Naučna novina. Po prvi put su utvrđene prostorne strukture i konformacione mogućnosti leucin-enkefalina, n-terminalnog tridekapeptida dijaorfina i niza njihovih analoga. Utvrđeno je da leucin-enkefalin može imati samo nekoliko niskoenergetskih struktura različite vrste, čiji je broj za njegove analoge značajno smanjen.
Konformaciona stanja analoga leucin-enkefalina mogu se podijeliti u dvije grupe: analozi koji su podvrgnuti značajnim strukturnim promjenama zbog zamjene i analozi kod kojih zamjena aminokiselina dovodi do primjetnog pomaka u konformacionoj ravnoteži prema nekim oblicima prirodnog hormona. . Utvrđeno je da N-terminalni tridekapeptid dinorfina ima ograničen skup niskoenergetskih strukturnih tipova, čiji broj zavisi od
priroda okruženje. Pronađeni su analozi koji modeliraju određena funkcionalna svojstva leucin-enkefalina i dinorfina.
Praktična vrijednost. Na osnovu aminokiselinske sekvence leucin-enkefalina i dinorfina I-I3 određene su konformacijske sposobnosti i trodimenzionalne strukture molekula čije je poznavanje neophodno za proučavanje biološke aktivnosti i mehanizma funkcionisanja ovih molekula, kao i kao ciljano traženje analoga.
Testirano teorijski pristup i proučavana je prostorna struktura analoga. Istraživanje je korisno za ciljanu sintezu analoga ovih molekula sa specifičnim funkcijama. Proračuni su pokazali mogućnost predviđanja geometrije i konformacionih sposobnosti hormona i hemijske strukture njihovih analoga sa poznatim svojstvima metodom teorijske konformacione analize.
Glavne odredbe za odbranu: I. Rezultati proračuna prostorne strukture leucin-enkefalina H - Tyr 1 - Gly 2 - Gly 5 - Phe^~ Leu^-OH I sljedećih IGO analoga: H-Tyr 1 -Gly 2 -Gly 5 -Phe 4 -Leu 5 -Arg 6-OH,
H-Tyr 1 -D-Ala 2 -Gly 5 -Phe 4 -Leu 5 -OH,
H-Tyr 1 -D-Ala 2 -Gly 5 -Phe 4 -Leu 5 -Arg 6 -OH,
H-Tyr 1 -D-Al a 2 -Gly 3 -Phe 4 -Al a 5 -Arg 6 -OH,
H-Tyr 1 -D-Ala 2 -Gly 3 -Phe 4 -Ala 5 -Ly s 6 ~0H,
H-Tyr 1 -D-Ala 2 -Gly 5 -Phe 4 -Ala 5 -Asn 6 -OH,
H-Tyr 1 -D-Al a 2 -Gly 5 -Phe Z| "-Gly 5 -Arg 6 -OH,
H-Tyr 1 -D-Ala 2 -Gly 5 -Phe 4 -Ala 5 -Gln 6 -OH,
H-Tyr 1 -D-Ala 2 -Gly5-phe^-Ala5-His 6 -OH,
H-Tyr 1 -D-Ala 2 -Gly 5 -N-MePhe 4 -Leu 5 -Arg 6 -OH.
2. Rezultati proračuna prostorne strukture dinorfina
I-IZ N -Tyr 1 -Gly 2 -Gly 5 -Phe 4 -Leu 5 -Arg 6 -Arg 7 -lie 8 -Arg 9 -Pro 10 -Lys 11 -Leu 12 -Lys 15 -on i njegovi sljedeći analozi: [ʺ-
Ala 2 ] - i (b -Ala 12 ] -dinorfin.
Diskusija o odnosu između hemijske strukture i prostornog rasporeda razmatranih prirodnih i sintetičkih aminokiselinskih sekvenci,
Ciljana potraga za kemijskim modifikacijama molekula leucin-enkefalina i dinorfina, stabilnijima i reproducirajući biološke funkcije prirodnih peptida.
Apromacija rada. Rezultati rada predstavljeni su na 1. Svesaveznom simpozijumu o međumolekularnim interakcijama i konformacijama molekula (Viljnus, 1982), na 1. Svesaveznom biofizičkom kongresu (Moskva, 1982), na naučnoj konferenciji posvećenoj rezultatima istraživački rad za 1983. (Baku, 1984"), na Republičkoj konferenciji mladih naučnika za fizičku i hemijsku biologiju (Baku, 198I), kao i na seminarima Odeljenja za optiku i molekularna fizika i problemska laboratorija "Molekularna biofizika".
Publikacija. Osnovni sadržaj disertacije predstavljen je u sedam publikacija.
Struktura i obim disertacije. Disertacija je predstavljena na 159 stranica kucanog teksta, sastoji se od uvoda, četiri poglavlja i zaključaka, sadrži 10 slika, 35 tabela i spisak citirane literature, uključujući 135 naslova.
Direktni strukturalni problem
Pod direktnim strukturnim problemom podrazumijevamo uspostavljanje informacionih karakteristika molekula na osnovu njegovih hemijska struktura. Rješenje ovog problema za prirodne oligopeptide dato u tabeli. Izgrađen sam na osnovu sljedećih pretpostavki.
Aminokiselinska sekvenca u potpunosti određuje prostornu strukturu molekula oligopeptida. 2. Konformaciona stanja oligopeptida u fiziološkim uslovima su minimalna potencijalna energija. 3.Prostorna struktura prirodni oligopeptidi odgovaraju najstrožem pakovanju sekvence aminokiselina. 4. U kompaktnim strukturama oligopeptida postoji konzistentnost između svih kratkih, srednjih i dugotrajnih intramolekularnih interakcija.
Pod kratkoročnim podrazumevamo interakcije bočnog lanca datog ostatka sa dve susedne peptidne grupe; ispod prosjeka - interakcije ostatka sa četiri susjeda s obje strane u nizu; pod udaljenim - interakcije sa ostacima udaljenijim duž lanca (slika I). Interakcije kratkog dometa određuju konformacijske sposobnosti slobodnih monopeptida. Kvantitativna ideja o ovoj komponenti može se dobiti konformacijskom analizom odgovarajućih metilamida N-acetil-l-amino kiselina. Trenutno, za svih 20 standardnih α-amino kiselina, dobijeni su skupovi optimalnih konformacija koje su poželjne za interakcije kratkog dometa, pogodne za izračunavanje bilo koje sekvence aminokiselina. Slika 2a prikazuje potencijalnu površinu molekule N-acetil-l-alanin metilamida kao funkciju diedralnih uglova y i t/g. Površina ima četiri niskoenergetska područja B, H, b i P. Neformacijske mape tr-\jr y b od 20 standardnih aminokiselina, čiji bočni lanci ne sadrže granu na C atomu, vrlo su bliske. Potencijalne površine N-acetil-L-valina i b-izoleucin metilamida imaju iste, ali nešto suženije, niskoenergetske regije.-t mapa W-acetil-glicin metilamida je centrosimetrična i sadrži ekstenzivne i praktično izoenergetske regije R(b) i B (P), sl. 3. Potencijalna površina molekula N-acetil-b-prolin metilamida ima dva minimuma, koji odgovaraju vrijednostima ugla "r -60 (R.) i -140 (B), sl. 4.
Teorijska predviđanja u vezi sa informacionim mogućnostima i položajem konformacione ravnoteže metilamida N-acetil-os-amino kiselina u polarnim i nepolarnim medijima odgovaraju eksperimentalnim podacima dobijenim za niz ovih jedinjenja korišćenjem NMR, ODS, CD i IR spektroskopije metode, kao i dipolni momenti i plinsko-tečno osmometrija \p! 65]. Istovremeno, poređenje rezultata proračuna ovih molekula sa geometrijom aminokiselinskih ostataka u proteinima poznate trodimenzionalne strukture pokazalo je da su eksperimentalne vrijednosti uglova tp, J\T glavnog lanca svih ostataka nalaze se samo u niskoenergetskim regionima (0 - 4,0 kcad/mol) konformacionih mapa t / - t/g slobodnih monopeptida. Postoji i zadovoljavajuća korespondencija između poprečnih presjeka površine potencijala Y f , Y "I metilamida N-acetil-ot-amino kiselina i konformacijskih stanja bočnih lanaca u trodimenzionalnoj strukturi proteina [bb - 68]. Detekcija korelacije između geometrije svih aminokiselinskih ostataka u prirodnim sekvencama i niskoenergetskih stanja slobodnih monopeptida. Prisustvo korelacije je pokazalo da interakcije kratkog dometa određuju za sve standardne ostatke skupove dozvoljenih prostornih oblika. presavijanjem peptidnog lanca u nativnu strukturu, samo iz takvih skupova dolazi do izbora (prvo pod uticajem interakcija srednjeg dometa, a zatim i dugog dometa) konformacionih stanja svih ostataka. Ispadaju samo one konformacije ostataka poželjnije za interakcije kratkog dometa. da bude stvarna, čija kombinacija u datoj aminokiselinskoj sekvenci osigurava formiranje najpovoljnijih stabilizirajućih međurezidualnih kontakata, dakle sekvenca konformacionih stanja ostataka, a ne samih stanja. Ovdje je situacija u principu slična hemijskoj strukturi prirodnih peptida.
Zbog ogromnog broja početnih varijanti koje mogu biti sastavljene od niskoenergetskih konformacija ostataka, direktno rješenje direktnog strukturnog problema moguće je samo za kratke sekvence koje ne sadrže više od 4-5 jedinica. Za peptide veće molekularne težine, cilj se može postići samo podjelom cijelog problema na niz manje glomaznih zadataka i njihovim uzastopnim rješavanjem. Mogućnost korištenja korak-po-korak pristupa je zbog prisutnosti konzistentnosti između svih kratkih, srednjih i dugotrajnih interakcija. Na osnovu toga dobijena su rješenja velikog broja direktnih strukturnih problema za vrlo složene oligopeptide i proteine male molekularne težine.
Konformacijske mogućnosti leucin-enkefalina
Prilikom zamjene četvrtog ostatka peptida BPPk i N -MeAla 4 BPPc OOOTBeTCTBeHHO Ha D -Ala - I D -N CHieAIA - BPPg SVE CTpyK ture dozvoljene za molekule sa b-konfiguracijom bit će zabranjene za molekule različite konfiguracije. Stoga, sintetički analozi D - Ala4 - BPPg i D -N -MeAia 4 BPPg neće imati fiziološka svojstva prirodnog jedinjenja. Alternativno ograničenje na strukture se primjenjuje kada b-ostatak koji se zamjenjuje prethodi prolinu. Ali čak i ako ovo pravilo nije ispunjeno, uključivanje D-amino kiseline, posebno one supstituirane dušikom, u b-sekvenciju može biti najviše efikasan način rješavanje inverznog strukturnog problema. Ovo će zavisiti od specifičnog niza, konformacionih sposobnosti prirodnog peptida i svrhe studije. Dakle, zamjena b-ostatka koji se nalazi u stanju B u strukturi od interesa sa D-ostatkom uvijek će dovesti do njegove zabrane. Ako zamijenjeni ostatak ima L oblik glavnog lanca, tada se uključivanjem D-ostatka povećava vjerovatnoća realizacije odgovarajućeg konformacijskog stanja, jer se time smanjuje energija kratkog dometa interakcije ovog ostatka i proširuje raspon dozvoljenih vrednosti njegovih uglova Y, Tz (sl. 2), što može dovesti do uspostavljanja efikasnijih međurezidualnih kontakata. Velike mogućnosti za ciljano određivanje strukture jona otvaraju se kada se glicin zamijeni b- i D-alaninom. Tokom prve supstitucije, sve konformacije u kojima p, ar uglovi glicina padaju u P regionu biće zabranjene, a konformacije sa uglovima p, y glicina u b regionu će postati manje verovatne. Ako se Giy zamijeni D-Ala, konformacije s B oblikom glicina će biti nemoguće, a manje vjerovatne s B oblikom. Osim toga, uključivanje D-ostatka u lanac će uticati na odnos peptida sa peptidazama i dovesti do produženja njegovog djelovanja.
Rješenje inverznog strukturnog problema yaonapeptidnog hormona spavanja će se također zasnivati na poznatom skupu svih niskoenergetskih konformacija prirodnog molekula i najjednostavnijih i prirodnih kemijskih modifikacija aminokiselinskih sekvenci spomenutih gore.
Do sada su se pri rješavanju inverznog strukturnog problema koristile aminokiselinske supstitucije čiji se učinak na konformacijske sposobnosti molekula lako mogao procijeniti a priori, barem na nivou oblika i oblika glavnog lanca. Rigorozna kvantitativna analiza bila je potrebna samo da bi se odredio redoslijed rasporeda konformacijskih stanja prema energetskim vrijednostima u uskom rasponu odabranih opcija. Međutim, sve zamjene koje ne uključuju ostatke glicina i prolina ne dovode do a priori isključenja bilo kojeg oblika i oblika peptidnog okeleta. Utjecaj takvih supstitucija na konformacijske mogućnosti ne ovisi toliko o interakcijama kratkog dometa, koliko o interakcijama srednjeg i dugog dometa, tj. iz veoma složenog intramolekularnog kontaktnog sistema, određenog ne pojedinačnim ostacima, već čitavim nizom. Budući da je u svakom slučaju situacija jedinstvena, posljedice zamjene još uvijek je moguće identificirati samo proračunom čak iu odnosu na forme i oblike. Sljedeći predmet razmatranja je analog α-peptida u kojem su ostaci Ala 2 i Gly 8 zamijenjeni Vai 8. Moglo bi se očekivati da će uključivanje u sekvencu dva ostatka sa glomaznim i nefleksibilnim bočnim lancima značajno promijeniti raspodjela energije konformacije prirodnog nonapeptida. Međutim, prije proračuna to je bilo teško pretpostaviti globalna struktura Modifikovana sekvenca će biti HS konformacija, koja ima najveću energiju u seriji dodeljenoj za 8-peptid. Pokazalo se da se oba ostatka valina dobro uklapaju samo u strukturu SAD-a, bez promjene njene geometrije i bez uništavanja postojećeg sistema interakcija; Stabilnost ove strukture u Vai » analogu se povećava u poređenju sa 8 peptidom za 8,0 kcal/mol.
Sljedeća modifikacija &-peptidne sekvence - napomena od Asp do Asn, sterički je najbeznačajnija, ali elektronski veoma značajna. To čini strukture samo jednog tipa eefeefe stvarnim za Asn 5 -S-peptid, među kojima je dominantna Pa konformacija. Kako pokazuju proračuni, u ovom slučaju promjene se odnose samo na dvije međurezidualne interakcije sa YT, i to na kontakte Asn sa Gin i sa Trp. Odsustvo negativnog naboja na ostatku u petoj poziciji, koja je centralna u strukturi Pa, uklanja elektrostatičku repulziju između ostataka prvog para (oko +6,8 kcal/mol za prirodni -peptid do +0,2 za Asn-analog). Istovremeno, međutim, nestaje stabilizirajuća polarna interakcija između ostataka drugog para, koja je, međutim, u S-peptidu u PA konformaciji mnogo manje efikasna (-3,0 kcal/mol).
Analogni Tyi^-D- Ala2- Gly3- Phe4- Leu5- - Arg6
Niskoenergetske konformacije [p-Ala 2]-LEK koje smo dobili date su u tabeli. 9, energetske karakteristike najstabilnije konformacije svakog oblika glavnog lanca -LEK prikazane su u tabeli. 10. Rezultati proračuna su pokazali da u LEC sekvenci, zamjena Gly fc sa D-Alar dovodi do snažne energetske diferencijacije konformacije, oblika i oblika glavnog lanca. Od 16 mogućih tipova struktura, samo tri konformacije, odnosno ffff, fffe i efff, pokazale su se niskoenergetskim (tablica 9). Za razliku od LEC molekula, konformacije oblika effe za njegov analog su visokoenergetske. Njihova relativna energija porasla je u prosjeku za 3,0 kcal/mol u odnosu na konformacije istog oblika LEK molekula. Ovo je očigledno zbog činjenice da je u niskoenergetskim konformacijama oblika efff, drugi ostatak u obliku B okosnice, koji je manje povoljan za D-stereoizomer.
Globalna struktura LEC analoga je In LP % L32 ffff oblika u ovoj konformaciji, dipeptidne interakcije doprinose -9,2 kcal/mol, tripeptid -1,7 kcal/mol, tetrapeptid-nne -3,3 kcal/mol i pentapeptid -10,1 kcal/ mol. To je posljednja komponenta koja ovu konformaciju čini najpovoljnijom. Energija B2PHB2B32 konformacije fffe oblika je samo 0,1 kcal/mol veća od energije globalne konformacije. Ovdje je penta-peptidna interakcija između Tyr i Leu ostataka oslabljena, a tri- i tetrapeptidne interakcije su jače. Većina ogroman doprinos interakcije disperzije (-20,7 kcal/mol) doprinose stabilizaciji ove konformacije. čija je nominalna energija 3,0 kcal/mol. Na osnovu rezultata proračuna može se pretpostaviti da, u fiziološkim uslovima, D-Ala-LEK analog neće obavljati sve funkcije svojstvene prirodnom LEC molekulu. Funkcija molekula, za čiju implementaciju je potrebna LEC struktura tipa effe, postat će neostvariva. Dakle, rezultati konformacijske analize analoga Leutsch-enkefalina omogućavaju da se naprave sljedeće pretpostavke - prvo, ovaj analog neće moći obavljati sve funkcije LEC-a, već samo one u kojima bi njegova prostorna struktura trebala biti ffff , fffe i djelimično efff tipovi, I drugo, zbog zamjene? 2 aminokiselinskog ostatka Gly na D - Ala, analogna molekula postaje otpornija na djelovanje degradirajućih enzima, što usporava enzimsku hidrolizu ovog analoga u tijelu i samim tim produžava njegovo djelovanje." Analog Tyr I- D- Ala2- Gly3- Phe4- Leu5-Arg 6.
Prostorna struktura ovog analoga LEC molekula je proučavana na osnovu optimalnih konformacija njegova dva druga analoga - i -LEK-a, o kojima je gore diskutovano. Rezultirajuće niskoenergetske konformacije -LEK analoga prikazane su u tabeli. II, a energetske karakteristike najstabilnije konformacije svakog oblika glavnog lanca su u tabeli. 12.
Relativna energija 28 konformacija ovog analoga je ispod 5,0 kcal/mol. Svi oni pripadaju sedam različitih oblika glavnog lanca, pet oblika. Niskoenergetske varijante -LEK analoga uzete kao osnova za proračun pokazale su se obećavajućim i zadržane su za analog p-Ala2, Arg 6]. Niskoenergetski oblici glavnog lanca -LEK analoga, dobijeni kao rezultat njegove konformacione analize, prikazani su na slici 8.
Relativna energija konformacije B2PRR2B21B5522 ffffe oblika je 0,9 kcal/mol.U ovoj konformaciji doprinos interakcija di-tri-, tetra- i pentapeptida je -10,0, -3,9, -5,1 i -7,0 kcal / mol. Kao što se može vidjeti, prve dvije interakcije u ovoj konformaciji su slabije od one globalne, a interakcija heksa-peptida je vrlo mala,
U %REB3B32%22 konformaciji oblika fffee, relativna energija je 3,2 kcal/mol.U ovoj konformaciji imam stabilizirajući efekat! uglavnom interakcije di- i pentapeptida. One su jednake -8,4 i -9,3 kcal/mol, respektivno.Generalno, nevalentne interakcije imaju snažan stabilizirajući efekat, oko -29,0 kcal/mol,
Stoga se može pretpostaviti da molekula -LEK može zadržati samo neke od bioloških funkcija prirodnog hormona. Ali njegov efekat na organizam će verovatno biti produžen.Analog Tyr-a je D-Ala 2-Gly 3-Phe 4-A1a 5-Arg 6.
Budući da je prostorna struktura ovog analoga proučavana na osnovu rezultata proračuna [n-A1a 2t Arg 6]-LEK molekula o kojima je bilo riječi, za ovaj molekul su izračunate konformacije samo pet najboljih oblika peptidnog skeleta, tj. : ffffef, ffffe, effff, effe i fffee , Pronađene preferirane konformacije su prikazane u tabeli. 13, a energetske karakteristike najstabilnijih konformacija svakog razmatranog oblika glavnog lanca date su u tabeli. 14
Fragmenti Phe 4-Arg7 i Arg 6-Arg9
Prvi put identifikovali Goldstein et al. [Í27Í iz ekstrakta svinjske hipofize, N-terminalni tridekapeptid dinorfina ima biološku aktivnost cijelog peptida, sekvenca dinorfina (I-IZ) uključuje leucin-enkefalin. Aminokiselinska sekvenca dinorfina određena je kombinacijom automatske Edman metode i hidrolize sa karboksipeptidazama A i Y \l28j. Pretpostavlja se da je dinorfin prekursor dvaju peptida IA (N-terminalni 17-člani fragment) i IB (C-terminalni 13-člani fragment), nastalih kao rezultat enzimske hidrolize. peptidnu vezu Lyz - Arg 19.
Dinorfin se razlikuje od ostalih opijatnih peptida po tome što stupa u interakciju sa opijatnim receptorima u preparatu ileuma zamorca, 50 puta jači od p-endorfina, 200 puta jači od morfijuma i 700 puta jači od LEC-a. Dinorfin može igrati ulogu u regulaciji odgovora na promjene u metabolizmu vode i soli, kao i da učestvuje u procesima povezanim sa porođajem i hranjenjem.Biološka aktivnost dinorfina je bila otporna na destrukciju cijanogen bromidom.
Dinorfin ima jedinstven učinak na analgeziju koju kod miševa izazivaju opioidi kao što su morfin, β-endorfin (BER) i analozi leucin-ankefalina. Smanjuje analitički efekat morfijuma, pojačava analgetički efekat velikih doza BER, bez slabljenja dejstva malih doza BER, dinorfin (I - 13) ne izaziva analgeziju. Pretpostavlja se da dinorfin ima modulirajući efekat na analitičko dejstvo morfijuma, BER i nekih drugih endogenih opioida.
Dynorphin također utiče na ponašanje miševa, povećavajući osjećaj gladi kada se daje centralno u mozak, međutim, ovi efekti se ne eliminišu nalakoon # Djelovanje dynorphin (I-I3) je potpuno blokirano nalakoon-om, ali je potrebno 13 puta više za suzbijanje aktivnosti dinorfina (I-I3) njegove veće koncentracije nego za suzbijanje djelovanja LEC-a ili normorfina. Visoko pročišćene moždane membrane miša brzo razgrađuju dinorfin (I-I3), što ukazuje na prisustvo odgovarajuće proteaze u moždanim membranama.”
Kazarossian et al. dobijen je visoko osetljiv specifični kvantitativni antiserum (Ac) na konjugat biološki aktivnog fragmenta I-I3 dinorfina.” Lijek Ac ne reaguje sa LEC uključenim u strukturu dinorfina (I-I3). Studija unakrsne reakcije Ac sa skraćenim fragmentima dinorfina (I-I3) pokazala je da C-terminalni ostatak lizina-13 i slobodna amino grupa Tyr nisu bitni za imunoreaktivnost dinorfina (I-I3). Istovremeno, uzastopno skraćivanje dinorfina (I-I3) sa C-terminusa, počevši od 12. ostatka, dovodi do postepenog smanjenja imunoreaktivnosti, koja postaje izuzetno niska nakon uklanjanja 9. ostatka i praktički izostaje u dinorfin (1-5), one. leucin-enkefalin Isti rad je pokazao da zamjena Gly sa β-Ala2 u dinorfinu (I-I3) dovodi do smanjenja imunoreaktivnosti.
Chavkin i Goldstein [íZZ] proučavali su različite dijelove molekula dinorfina (I-ÍZ) u njegovoj interakciji sa receptorima nervnog pleksusa mišića svinje. Uklanjanje aminokiselina sa C-terminusa dinorfina (I-I3) pokazalo je da su lizin-13, lizin-H i arginin-7 očigledno potrebni za održavanje visokog nivoa interakcije peptida sa receptorima. Uklanjanje N-terminalnog tirozina dovelo je do gubitka biološke aktivnosti peptida." Autori \_133"\ sugeriraju da su TT 7 Lys i Arg očigledno potrebni za specifičnost interakcije sa dinorfinskim receptorima (I-I3), koji se razlikuju od mu receptora u istom tkivu Wüster i saradnici davali miševima istovremeno tokom 6 dana -LEK (I), kao agonist delta-opioidnih receptora (-0P), i sufentanil (P) kao jα-0P agonist Prilikom upoređivanja opioidnih aktivnosti dinorfina (I-I3), -LEK, LEC, sufentanila i dr. na lijek semenovod u koncentracijama 140 - 2500 puta većim za miševe tolerantne na I+P nego za kontrolne miševe, utvrđeno je da je aktivnost dinorfina (I-I3) neznatno smanjena. Na osnovu toga autori sugerišu da postoje opijatni receptori specifični za dinorfin (I-I3) koji funkcionišu nezavisno od f-- i o 0P. Dakle, dinorfin (I- I3) i LEC stupaju u interakciju s različitim populacijama opijatnih receptora.
Struktura dinorfina (I-13) u vodi i drugim supstancama proučavana je spektroskopskim metodama CD spektri vodeni rastvori dinorfin ukazuju na njegovu poremećenost i veoma labilnu strukturu.Uporedo sa polifunkcionalnošću, dinorfin (I-I3) ima visoku osetljivost i specifičnost svakog svog delovanja.A to je očigledno zbog činjenice da molekul dinorfina (I-I3) u fiziološkim uslovima nije statistički fluktuirajući kalem, ali ima vrlo specifičan skup izoenergetskih konformacija razne vrste Razmatrati veliki broj funkcije koje obavlja dynorphin, može se očekivati da je ovaj skup vrlo reprezentativan. Za proučavanje strukturne i funkcionalne organizacije oligopeptida na atomsko-molekularnom nivou, potrebno je poznavati kompletan skup niskoenergetskih i fiziološki „aktivnih“ konformacionih stanja molekula. Dobili smo rješenje ovog problema za N-terminalni tridekapeptid dinorfin i niz njegovih analoga korištenjem teorijske konformacijske analize u polarnim i nepolarnim sredinama.
Praktični rad na sekciji
„Reprodukcija genetske informacije»
To je poznato savremeni kurs opšta biologija za škole sadrži nedovoljno materijala za praktičnu nastavu. Osim toga, nedostatak ili nedostatak materijalnih sredstava, nedostatak opreme i potrošnog materijala u školskim hemijskim i biološkim laboratorijama dovode do teške situacije sa laboratorijskom i praktičnom nastavom u predmetu. opšta biologija. Međutim, dio predmeta kao što je „Reprodukcija genetskih informacija“ pruža dovoljno mogućnosti za praktičnu obuku kako bi se razvile vještine obrade i upravljanja genetskim informacijama.
Ovaj rad predstavlja razvoj praktične nastave koja se može koristiti za samostalnu i testovi na ovu temu koristeći materijale o ćelijskoj hemiji.
Prilikom izvođenja nastave mogu se postići sljedeći ciljevi.
1. Konsolidacija znanja o strukturi i svojstvima genetski kod.
2. Učvršćivanje znanja o procesu reduplikacije – šablonsko kopiranje DNK i princip komplementarnosti.
3. Učvršćivanje znanja o transkripciji i translaciji genetskih informacija – proces prenošenja.
4. Formulacija temeljnog principa biologije o prijenosu genetskih informacija u ćeliji:
DNK--->mRNA--->protein.
5. Objašnjenje mogućnosti prenošenja informacija RNA virusima prema šemi:
virusna RNK--->cDNK--->mRNA--->virusni protein.
7. Upoznavanje sa metodama savremene biotehnologije.
Naravno, ovo ni izdaleka ne iscrpljuje ciljeve predloženog zadatka, ali pokrivaju najvažnije dijelove teme „Reprodukcija genetskih informacija“.
Za izvođenje lekcije morate dobro poznavati gradivo o svojstvima i strukturi genetskog koda, procesima reprodukcije genetskih informacija (reduplikacija, transkripcija i translacija), principu komplementarnosti, Chargaffovom pravilu, koje treba ponoviti prije izvođenja radova.
Prijenos genetskih informacija uvijek se odvija na određeni način, što se odražava u takozvanoj „centralnoj dogmi biologije“, naime, samo u smjeru od DNK do mRNK i potom do proteina.
Prva faza reprodukcije genetske informacije, tzv transkripcija, nastaje uz pomoć RNA polimeraze, koja gradi komplementarnu kopiju gena u obliku mRNA.
U drugoj fazi, koja se zove emitovanje, informacije se prevode sa jezika nukleotida (RNA) na jezik aminokiselina (proteina). Tako se genetička informacija ostvaruje za izgradnju funkcionalnih jedinica – proteinskih molekula sa specifičnim funkcijama, koje su i genetski fiksirane.
Kada virusi koji sadrže RNK uđu u ćeliju, informacije se mogu prenijeti duž lanca: virusna RNK--->cDNA--->DNK--->mRNA--->virusni protein. Ovaj proces se implementira pomoću reverzna transkriptaza, koji u prvoj fazi reprodukcije genetske informacije virusa gradi kodirajuću DNK (cDNK) na osnovu virusne RNK šablone. Ova cDNK se zatim ubacuje u DNK ćelije domaćina. Međutim, to se događa samo kada se koriste resursi ćelije u koju je virus prodro.
Takva shema za prijenos genetskih informacija smatra se atavizmom. To je zbog činjenice da je RNK, očigledno, u toku kemijske evolucije počela igrati ulogu informacijske molekule ranije od DNK. Glavni argument u prilog ovoj tvrdnji je prisustvo enzimske aktivnosti u RNA molekule, koji je otkrio Thomas Cech, i sposobnost RNA molekula da se sami reproduciraju. Autor ovog otkrića dobio je Nobelovu nagradu.
Međutim, ribozimska aktivnost RNK je desetine hiljada puta manja od one RNA polimeraze, a imaju je samo kratki fragmenti RNK - oligonukleotidi dužine do 50-100 baza. S druge strane, postoji mišljenje da je aktivnost ribozima sekundarna i da nema veze sa hemijskom evolucijom.
Za snimanje genetskih informacija koristi se jedan genetski kod. Ako u jednom laboratoriju postane poznat aminokiselinski slijed proteina, onda u drugom laboratoriju mogu napisati odgovarajuće DNK (ili RNK) nukleotidne sekvence, i obrnuto.
Za aktivnosti u učionici možete ponuditi nekoliko oblika rada na osnovu popunjavanja nukleotidnih mapa i aminokiselinskih mapa odgovarajućih polipeptida (Prilozi 1–4). Ovo može biti individualni ili grupni rad. Rad u grupama može se smatrati radom zasebnih biotehnoloških laboratorija, čiji svaki član izvodi određenu operaciju. Pojedinačni učenici ili grupe razmjenjuju kartice, postepeno ih popunjavajući. Na kraju rada, grupa stručnjaka ili jedan stručnjak (ovo može biti nastavnik) provjerava kartice, identifikujući greške u mutaciji.
Složenost posla ovisit će o sposobnosti korištenja edukativni materijal: tabele genetskog koda, šeme reduplikacije, transkripcija i translacija, tabele komplementarnosti, svojstva genetskog koda itd. Času se može dati karakter laboratorijskog, praktičnog, samostalnog ili kontrolnog rada.
Za specificiranje zadataka, bolje je koristiti mape malih polipeptida, na primjer, nekih peptidnih hormona. U tu svrhu zgodno je koristiti oligopeptide hormona vazopresina i oksitocina, kao i metionin i leucin enkefaline - prirodne endorfine koji se proizvode u tijelu životinja i ljudi (Dodaci 1–4). Vasopresin i oksitocin imaju širok spektar djelovanja, a endogene tvari slične morfiju privukle su pažnju u vezi s problemom ovisnosti o drogama i objašnjenjem narkotičkog djelovanja.
Kartice mogu sadržavati materijal iz odjeljka “Ćelija hemija”, odnosno formule i svojstva aminokiselina. Oligopeptidi vazopresina i oksitocina sadrže aminokiseline koje sadrže SH (cistein), koje formiraju disulfidne mostove u sekundarna struktura peptida, što se može odraziti na stepen težine zadatka.
Kartice uključuju terminatorske kodone, koji moraju biti napisani u odgovarajućim tripletima u DNK ili RNK lancima. Uključen je i inicijatorski kodon za aminokiselinu metionin, koja se u ovom slučaju nalazi na početku lanca.
Nukleotidi vodeće sekvence nakon kodona inicijatora (i odgovarajuće aminokiseline) nisu uključeni u sadržaj mapa, jer nisu od fundamentalnog značaja za obradu genetskih informacija i uklanjaju se iz sekvence aminokiselina tokom obrade. (proteoliza).
Predloženi rad učenika sa karticama i popunjavanjem tabela za prevođenje genetskih informacija (reduplikacija, transkripcija, prevođenje), pisanje formula i simbola aminokiselina može se osmisliti za 1-2 lekcije, u zavisnosti od složenosti i prirode zadatka.
Na kraju časa učenici se ocjenjuju i formuliraju se sljedeći zaključci.
Genetske informacije su univerzalne. Životni oblici sa drugim genetskim kodovima nisu otkriveni, tj. Genetski kod je isti za sve organizme i ne postoji drugi genetski kod. Ovaj kod ima dovoljno mogućnosti da opiše čitav niz proteinskih molekula.
Mape koriste opšte prihvaćene skraćenice: mRNA – glasnička RNA; cDNA – DNK kodirajući lanac; comp. DNK je komplementarni lanac DNK. Kodon amino kiseline odabran je proizvoljno, kao jedan od mogućih, što je dozvoljeno u radu studenata.
Za izvođenje lekcije koriste se varijante kartica u kojima nedostaje bilo koja linija, tj. Postoji 5 varijanti svake kartice. Shodno tome, rad se može distribuirati određenom broju učenika i grupa. Možete ponuditi rad na drugim mapama za druge peptide, čiji je broj praktički neograničen.
Aneks 1
Metionin-enkefalin je hormon jezgra moždane kore, endogeni opioidni peptid, koji se sastoji od 5 aminokiselina
Amino kiseline Comp. DNK |
Dodatak 2
Leucin-enkefalin je hormon jezgra moždane kore, endogeni opioidni peptid, koji se sastoji od 5 aminokiselina
Hemijska formula radikal amino kiseline |
|||||||
Amino kiseline Comp. DNK |
Dodatak 3
Vasopresin - antidiuretski hormon - proizvodi hipofiza, izaziva kontrakciju glatkih mišića, smanjuje izlučivanje vode, sastoji se od 9 aminokiselina s jednom disulfidnom vezom
Hemijska formula radikala aminokiselina |
Endorfini(endogeni morfijumi (iz imena starogrčkog boga Morpheusa - "onaj koji oblikuje snove") - grupa polipeptidnih hemijskih jedinjenja sličnih po strukturi opijatima (morfijumu slična jedinjenja), koja se prirodno proizvode u neuronima mozga i imaju sposobnost da smanje bol sličan opijatima i utiču na emocionalno stanje.
Endorfini se formiraju iz lipotropina u moždanom tkivu i u srednjem režnju hipofize. Opšti tip Struktura ovih jedinjenja je tetrapeptidna sekvenca na N-kraju. Beta-endorfin nastaje iz beta-lipotropina proteolizom. Beta-lipotropin se formira od prekursora prohormona proopikortina (molekulska težina 29 kDa, 134 aminokiselinska ostatka).
U prednjem režnju hipofize, molekul prekursora se cijepa na ACTH i b-lipotropin, koji se izlučuju u plazmu. Mali dio (oko 15%) b-lipotropina se razgrađuje u b-endorfin. Biosintezu proopikortina u prednjoj hipofizi regulira kortikoliberin u hipotalamusu. Poznata su tri različita proteina prekursora opioidnih peptida: proenkefalin, proopiomelanokortin i prodinorfin.
Prirodni opioidni peptidi prvi put su izolovani 1976. godine iz mozga sisara. To su bili takozvani enkefalini - leucin-enkefalin i metionin-enkefalin, koji su se razlikovali samo u terminalnom C-ostatku.
Početkom 70-ih, razne laboratorije širom svijeta otkrile su da moždane stanice imaju receptore koji vežu morfij i samo u tom vezanom obliku on postaje aktivan. Nije bilo razloga za pretpostavku da je mozak posebno pripremio ovu vrstu receptora za tako rijedak sastojak kao što je morfij. Pojavila se sumnja da je funkcija ovih receptora da vežu ne morfijum, već neku njemu blisku supstancu, koju proizvodi samo tijelo. Godine 1976. dr. Hughes u Škotskoj je izvukao ovu misterioznu supstancu iz mozga zamorca, koji je odmah doživio nagli pad osjetljivosti na bol. Hjuz je supstancu nazvao enkefalin, što na grčkom znači "iz mozga". A profesor Cho Hao Lee u San Francisku izvukao je još jedan interni lijek iz kamilinog mozga, tačnije iz hipofize deve, za koji se pokazalo da je 50 puta jači od poznatog morfija. Cho ga je nazvao endorfinom - "unutrašnji morfijum". Iste 1976. godine iz krvi životinja su izolirana još dva interna lijeka, koji su po sastavu bili slični morfiju, ali, za razliku od biljnog, nisu deprimirali disanje i nisu doveli do ovisnosti o drogama. I konačno, dr. Pless u Švicarskoj je sintetizirao endorfin, odnosno proizveo ga je u laboratoriji, u epruveti, znajući tačno hemijski sastav i strukturu ove misteriozne supstance. Drugi opioidni peptidi, endorfini, takođe su izolovani iz ekstrakata tkiva hipofize i hipotalamusa sisara. Svi oni obično sadrže enkefalinski ostatak u N-terminalnom području. Svi endogeni opioidni peptidi se sintetiziraju u tijelu kao veliki prekursorski proteini proteolizom. Prostorna struktura enkefalina je slična morfiju. Enkefalini i endorfini imaju analgetski učinak, smanjuju motoričku aktivnost gastrointestinalnog trakta i utiču na emocionalno stanje.
· MSH - hormon koji stimuliše melanocite;
· LPG - lipotropni hormon;
· CPPP - intermedijarni peptid sličan kortikotropinu;
· ACTH je adrenokortikotropni hormon.
Regulacija sekrecije
Svi proizvodi razgradnje POMC proizvode se u ekvimolarnim količinama i izlučuju se u krv istovremeno. Dakle, nemoguće je povećati lučenje adrenokortikotropnog hormona bez istovremenog povećanja lučenja beta-lipotropnog hormona.Proizvodnju POMC regulišu faktori koji nastaju u hipotalamusu i paraventrikularnom jezgru mozga: kortikoliberin, arginin vazopresin - aktiviraju sintezu ACTH, kortizola - glavnog inhibitora sinteze kortikotropnog hormona i stvaranja POMC, stoga će kortikoliberin, arginin vazopresin i kortizol utjecati na sintezu i lučenje β-endorfina.
Sinteza β-endorfina se smanjuje kod endokrinih, infektivnih i virusnih bolesti, sindroma kroničnog umora; sinteza se može povećati fizičkom aktivnošću.
Transport i periferni metabolizam
Endorfini se sintetiziraju "za buduću upotrebu" i oslobađaju se u krv u određenim porcijama zbog pražnjenja sekretornih vezikula. Njihov nivo u krvi raste sa povećanjem učestalosti oslobađanja hormona iz ćelija žlezda. Ulazeći u krv, hormoni se vezuju za proteine plazme. Obično je samo 5-10% molekula hormona u slobodnom stanju u krvi i samo oni mogu stupiti u interakciju s receptorima.
Razgradnja peptidnih hormona često počinje u krvi ili na zidovima krvnih žila, a posebno je intenzivan u bubrezima. Protein-peptidne hormone hidroliziraju proteinaze, odnosno egzo- (na krajevima lanca) i endopeptidaze. Proteoliza rezultira stvaranjem mnogih fragmenata, od kojih neki mogu pokazati biološku aktivnost. Mnogi proteinsko-peptidni hormoni se uklanjaju iz cirkulacije vezivanjem za membranske receptore i naknadnom endocitozom kompleksa hormon-receptor. Do razgradnje takvih kompleksa dolazi u lizosomima, a konačni produkt razgradnje su aminokiseline, koje se opet koriste kao supstrati u anaboličkim i kataboličkim procesima.
Glavni cilj endorfina je tzv. opioidni sistem (njegova osnovna namjena je zaštita od oštećenja stresom, ublažavanje boli i koordinacija sistema organa i tkiva na nivou tijela u cjelini) tijela, a posebno opioidni receptori. . Endorfin je odgovoran za regulisanje aktivnosti svih unutrašnjih žlezda, za rad imunološki sistem, izvan nivoa pritiska, endorfin utiče i na nervni sistem. U mozgu su otkriveni specifični receptori za morfin. Ovi receptori se nalaze na sinaptičkim membranama. Njima je najbogatiji limbički sistem od kojeg zavisi emocionalni odgovor. Nakon toga, endogeni peptidi su izolovani iz moždanog tkiva koji oponašaju različite efekte morfijuma kada se ubrizgavaju. Ovi peptidi, koji imaju sposobnost specifičnog vezanja za opijatske receptore, nazivaju se endorfini i enkefalini.
Jer Receptori opijatnog hormona nalaze se na vanjskoj površini plazma membrane, hormon ne prodire u ćeliju. Hormoni (prvi prenosioci signala) prenose signal preko drugog glasnika, čiju ulogu imaju cAMP, cGMP, inozotol trifosfat i ioni Ca. Nakon što se hormon veže za receptor, slijedi lanac događaja koji mijenjaju metabolizam ćelije.
Fiziološki, endorfini i enkefalini imaju snažno analgetsko, anti-šok i antistresno djelovanje, smanjuju apetit i smanjuju osjetljivost pojedinih dijelova centralnog nervnog sistema. Endorfini normalizuju krvni pritisak, brzinu disanja, ubrzavaju zarastanje oštećenih tkiva i stvaranje kalusa kod preloma.
Endorfini se često javljaju zajedno s oslobađanjem adrenalina. Prilikom dugih treninga u tijelu se oslobađa adrenalin, pojačavaju se bolovi u mišićima i počinju se proizvoditi endorfini koji smanjuju bol i povećavaju reakciju tijela i brzinu prilagođavanja na stres.
Na šta utiče endorfinski sistem:
· - analgetski efekti
· -usporavanje disanja, otkucaja srca – antistresni efekti
· - jačanje imuniteta
· - regulacija bubrežnog krvotoka
· - regulacija crijevne aktivnosti
· - učešće u procesima ekscitacije i inhibicije u nervnom sistemu
· - učešće u procesima razvoja asocijativno-disocijativnih veza u nervnom sistemu - regulacija brzine metabolizma
· - osjećaj euforije
· - ubrzati zacjeljivanje oštećenih tkiva
· -formiranje kalusa tokom preloma
Osim toga, endorfini su povezani s termoregulacijom, pamćenjem, lipolizom, reprodukcijom, doživljajem zadovoljstva, uništavanjem tjelesne masti, antidiurezom, supresijom hiperventilacije kao odgovorom na povećanje ugljičnog dioksida i inhibicijom sinteze tirotropina i gonadotropina.
Patologija
Nedostatak endorfina uočava se u depresiji i u situacijama stalnog emocionalnog stresa, pogoršava kronične bolesti i može uzrokovati sindrom kroničnog umora. Otuda prateća depresija raspoloženja i povećana podložnost zaraznim bolestima.
Proizvodnja endorfina se smanjuje kod nekih patologija. Kao rezultat nedostatka endorfina u tijelu, povećava se rizik od kroničnih bolesti, takozvanih „bolesti stila života“, koje su u posljednje vrijeme postale glavni uzrok smrtnosti. Bolesti životnog stila uključuju dijabetes, kardiovaskularne bolesti, hronične respiratorne bolesti, rak i gojaznost.
Nedostatak endorfina se izražava u apatiji, veoma lošem raspoloženju i na kraju dovodi osobu u depresiju. Svaka osoba želi da zna kako da uživa u životu. Osećaj zadovoljstva kod osobe se javlja kada se poveća nivo endorfina koje proizvodi mozak i to hemijsko jedinjenje sličan leku morfijum. Stoga je endorfin dobio takvo ime - endogeni morfij, odnosno proizvodi ga samo tijelo.
Najteža manifestacija je anhedonija, bolest u kojoj osoba nije u stanju doživjeti zadovoljstvo.
Neurohormoni
Neurohormoni su supstance visoke fiziološke aktivnosti koje se proizvode u neurosekretornim ćelijama nervnog sistema (neuroni).
Po mehanizmu djelovanja imaju mnogo zajedničkog s neurotransmiterima, ali neurohormoni, za razliku od njih, ulaze u krv i druge biološke tekućine tijela (limfu, likvor i tkivnu tekućinu) i imaju dugotrajno, daljinsko regulacijsko djelovanje. .
By hemijska struktura neurohormoni su peptidi (sadrže aminokiseline) ili kateholamini (biogeni amini), njihov obavezni fragment je 3,4-dihidroksifenilalanin (katehol).
Neurohormoni održavaju homeostazu vode i soli, regulišu tonus glatkih mišića i metaboličke procese, a također učestvuju u regulaciji aktivnosti endokrinih žlijezda. Općenito, funkcija ovih tvari je održavanje zaštitnih i adaptivnih funkcija tijela.
Sinteza neurohormona se odvija u neurosekretornim ćelijama hipotalamusa (dopamin, vazopresin, oksitocin, norepinefrin, serotonin i oslobađajući faktori), kičmena moždina, epifiza, nadbubrežne žlezde (hromafinsko tkivo medule).Sintetišu se i u ganglijama, paraganglijima i nervnim stablima autonomnog nervnog sistema (sinteza adrenalina i norepinefrina).
Proces biosinteze peptidnih neurohormona odvija se u tijelu neurona, u strukturi koja se naziva endoplazmatski retikulum; zatim se u Golgijevom kompleksu pakuju u granule i odatle transportuju duž aksona do nervnih završetaka.
Neurofiziologija spavanja
Neurofiziološki mehanizmi spavanja i njegove starosne karakteristike
Spavanje je fiziološko stanje koje karakterizira gubitak aktivnih mentalnih veza subjekta sa svijetom oko njega. San je od vitalnog značaja za više životinje i ljude. Dugo se vjerovalo da je san odmor potreban za obnavljanje energije moždanih stanica nakon aktivnog budnog stanja. Međutim, pokazalo se da je moždana aktivnost tokom spavanja često veća nego tokom budnog stanja. Utvrđeno je da se aktivnost neurona u nizu moždanih struktura značajno povećava tokom spavanja, tj. spavanje je aktivan fiziološki proces.
Faze spavanja
Refleksne reakcije tokom spavanja su smanjene. Osoba koja spava ne reaguje na mnoge spoljašnje uticaje osim ako su preterano jaki.
Teorije spavanja:
Humoralna teorija, uzrokom sna smatra supstance koje se pojavljuju u krvi tokom dužeg budnog stanja. Dokaz ove teorije je eksperiment u kojem je budnom psu transfuzirana krv životinje koja je bila lišena sna 24 sata. Životinja primateljica je odmah zaspala. Ali humoralni faktori ne mogu se smatrati apsolutnim uzrokom sna. O tome svjedoče zapažanja ponašanja dva para nerazdvojenih blizanaca. Njihov nervni sistem je bio potpuno odvojen, a njihov cirkulatorni sistem je imao mnogo anastomoza. Ovi blizanci bi mogli da spavaju drugačije vrijeme: jedna djevojka je, na primjer, mogla spavati, dok je druga bila budna.
Subkortikalne i kortikalne teorije sna. Kod različitih tumorskih ili infektivnih lezija subkortikalnih, posebno moždanog debla, formacija, pacijenti doživljavaju različite poremećaje spavanja - od nesanice do dugotrajnog letargičnog sna, što ukazuje na prisutnost subkortikalnih centara za spavanje. Kada su stražnje strukture subtalamusa i hipotalamusa bile nadražene, životinje su zaspale, a nakon što je iritacija prestala, probudile su se, što ukazuje na prisustvo centara za spavanje u ovim strukturama.
Hemijska teorija. Prema ovoj teoriji, tokom budnosti se u ćelijama tela akumuliraju proizvodi koji se lako oksidiraju, što rezultira nedostatkom kiseonika i osoba zaspi. Zaspimo ne zato što smo otrovani ili umorni, već da ne bismo bili otrovani i umorni.
Funkcije spavanja
o pruža odmor tijelu.
o igra važnu ulogu u metaboličkim procesima. Tokom sporotalasnog sna oslobađa se hormon rasta. REM spavanje: vraćanje plastičnosti neurona i njihovo obogaćivanje kiseonikom; biosinteza proteina i RNA neurona.
o promoviše obradu i skladištenje informacija. Spavanje (posebno sporo spavanje) olakšava konsolidaciju proučavanog materijala, dok REM spavanje implementira podsvjesne modele očekivanih događaja. Ova potonja okolnost može poslužiti kao jedan od razloga za pojavu déjà vua.
o ovo je adaptacija tijela na promjene u osvjetljenju (dan-noć).
o obnavlja imunitet aktiviranjem T-limfocita koji se bore protiv prehlade i virusnih bolesti.
Vrste spavanja
Daljnjim detaljnijim proučavanjem pokazalo se da je san heterogen po svojim fiziološkim manifestacijama i da ima dvije varijante: spor (miran ili ortodoksan) i brz (aktivan ili paradoksan).
Kod sporotalasnog sna, disanje i otkucaji srca se smanjuju, mišići se opuštaju, a pokreti očiju usporavaju. Kako se sporotalasni san produbljuje, ukupan broj pokreta spavača postaje minimalan. U ovom trenutku ga je teško probuditi. NREM spavanje obično zauzima 75 - 80%.
Tokom REM spavanja, naprotiv, aktiviraju se fiziološke funkcije: ubrzava se disanje i broj otkucaja srca, fizička aktivnost Dok spavate, pokreti očnih jabučica postaju brzi (zbog čega se ova vrsta sna naziva „brzo“). Brzi pokreti očiju ukazuju na to da spavač u ovom trenutku sanja. A ako ga probudite 10-15 minuta nakon završetka brzih pokreta očiju, ispričat će vam šta je vidio u snu. Prilikom buđenja tokom sporotalasnog sna, osoba obično ne pamti snove. Uprkos relativno većoj aktivaciji fizioloških funkcija u REM snu, mišići tijela su u tom periodu opušteni, a spavača je mnogo teže probuditi. REM san je važan za funkcionisanje organizma. Ako je osoba umjetno lišena REM sna (budila se u periodima naglih pokreta očiju), tada će, uprkos sasvim dovoljnom ukupnom trajanju sna, nakon pet do sedam dana razviti mentalne poremećaje.
Naizmjenično brzo i sporo spavanje tipično je za zdrave ljude, a osoba se osjeća odmorno i budno.
Postoji još jedna klasifikacija faza spavanja:
1. Faza izjednačavanja: karakterizirana djelovanjem na jake i slabe stimuluse.
2. Paradoksalna faza: jaki podražaji izazivaju slabije odgovore od slabih stimulansa.
3. Ultradox faza: pozitivan stimulus inhibira, a negativan izaziva uslovni refleks.
4. Narkotična faza: opšte smanjenje aktivnosti uslovnih refleksa sa značajno jačim smanjenjem refleksa na slabe nadražaje nego na jake.
5. Faza inhibicije: potpuna inhibicija uslovnih refleksa
Dobne karakteristike:
Dječiji san je površan i osjetljiv. Spavaju nekoliko puta dnevno.
Kod novorođenčadi spavanje zauzima veći dio dana, a aktivirani san, ili san s trzajima (analogno paradoksalnom snu kod odraslih), čini većinu sna. U prvim mjesecima nakon rođenja, vrijeme budnosti se brzo povećava, udio paradoksalnog sna se smanjuje, a sporo spavanje se povećava.
Higijena spavanja:
Spavanje treba da ima dovoljno trajanja i dubine za uzrast. Deca lošeg zdravlja, ona koja se oporavljaju od akutnih zaraznih bolesti, povećane razdražljivosti nervnog sistema i deca koja se brzo umaraju treba da spavaju duže. Prije spavanja treba isključiti stimulativne igre i intenzivan mentalni rad. Večera treba da bude lagana, najkasnije 2-1,5 sata pre spavanja. Dobro za spavanje:
· svež, hladan vazduh u prostoriji (15-16)
· krevet ne smije biti ni mekan ni tvrd.
· čista, mekana posteljina bez bora i ožiljaka
· Bolje je ležati na desnom boku ili leđima, što osigurava slobodnije disanje i ne otežava rad srca.
Djecu treba naučiti da ustaju i idu na spavanje u isto vrijeme. Dijete se prilično lako razvija uslovljeni refleksi na okruženje spavanja. Uslovljeni stimulus u ovom slučaju je vrijeme odlaska u krevet.
Neurofiziologija ANS-a
Koncept autonomnog nervnog sistema prvi je uveo 1801. godine francuski lekar A. Besha. Ovaj dio centralnog nervnog sistema obezbjeđuje autonomne funkcije tijela i uključuje tri komponente:
1) simpatičan;
2) parasimpatikus;
3) metasimpatički.
Vegetativne funkcije uključuju one funkcije koje osiguravaju metabolizam u našem tijelu (probava, cirkulacija, disanje, izlučivanje itd.). To također uključuje osiguranje rasta i razvoja tijela, reprodukciju i pripremu tijela za štetne efekte. Autonomni sistem obezbeđuje regulaciju aktivnosti unutrašnjih organa, krvnih sudova, znojnih žlezda i drugih sličnih funkcija. Reguliše metabolizam, razdražljivost i autonomni rad unutrašnje organe, kao i fiziološko stanje tkiva i pojedinih organa (uključujući mozak i kičmenu moždinu), prilagođavajući njihovu aktivnost uvjetima okoline.
Simpatički odjel nervnog sistema obezbjeđuje mobilizaciju raspoloživih resursa organizma (energetskih i intelektualnih) za obavljanje hitnih poslova.Jasno je da to može dovesti do neravnoteže u tijelu.Vraćanje ravnoteže i postojanosti unutrašnje okruženje telo je zadatak parasimpatičkog nervnog sistema.Za to je potrebno kontinuirano korigovati pomake izazvane uticajima simpatikusa, obnavljati i održavati homeostazu.U tom smislu aktivnost ovih delova nervnog sistema autonomni sistem se u nizu reakcija manifestuje kao antagonistički.
U fiziologiji, subhomeostaza se shvata kao održavanje stalnih parametara unutrašnje sredine u telu. To uključuje održavanje konstantnog sastava krvi, tjelesne temperature itd.
Centri autonomnog nervnog sistema nalaze se u moždanom stablu i kičmenoj moždini. Centri parasimpatičkog nervnog sistema nalaze se u moždanom stablu i u sakralnom delu kičmene moždine.U srednjem mozgu nalaze se centri koji regulišu širenje zenica i akomodaciju oka. U produženoj moždini nalaze se centri nervnog parasimpatičkog sistema, iz kojih odlaze vlakna kao deo vagusnog, facijalnog i glosofaringealnog nerava. Ovi centri su uključeni u brojne funkcije, uključujući regulaciju aktivnosti brojnih unutrašnjih organa (srce, želudac, crijeva, jetra, itd.), te su „okidači“ za lučenje pljuvačke, suzne tekućine itd. ove funkcije se provode po principu refleksa (po vrsti odgovora na stimulus). Neki od ovih refleksa će biti opisani u nastavku.
Centri nervnog parasimpatičkog autonomnog sistema takođe se nalaze u sakralnim segmentima kičmene moždine. Vlakna iz njih idu kao dio karličnih nerava, koji inerviraju karlične organe (debelo crijevo, mjehur, genitalije itd.).
Centri simpatičkog nervnog sistema nalaze se u torakalnom i lumbalnom segmentu kičmene moždine. Autonomna vlakna iz ovih centara polaze kao dio prednjih korijena kičmene moždine zajedno s motoričkim nervima.
Svi navedeni centri simpatičkog i nervnog parasimpatičkog sistema su podređeni višem autonomnom centru - hipotalamusu. Hipotalamus je zauzvrat pod utjecajem niza drugih centara mozga. Svi ovi centri formiraju limbički sistem. Potpuni opis sistema biće dat u odgovarajućoj temi, a sada pogledajmo „rad“ perifernih delova nervnog autonomnog sistema.
Sa obe strane kičme na trbušnoj strani nalaze se dva stabla simpatičkog nervnog sistema. Nazivaju se i simpatički lanci. Lanac se sastoji od pojedinačnih ganglija povezanih međusobno i kičmene moždine brojnim nervnim vlaknima. Svako vlakno koje stiže u ganglij inervira do nekoliko desetina neurona u gangliju (divergencija). Zahvaljujući ovakvom rasporedu, simpatički uticaji obično imaju difuzan, generalizovan karakter. Zauzvrat, od ovih ganglija odlaze živci, koji idu do zidova krvnih žila, znojnih žlijezda i unutrašnjih organa. Pored ganglija graničnog trupa, na određenoj udaljenosti od njih nalaze se i takozvani prevertebralni gangliji.Najveći od njih su solarni pleksus i mezenterični čvorovi.
Nadbubrežne žlijezde igraju glavnu ulogu u aktivnosti simpatičkog nervnog sistema.Nastaju kod ljudi tokom prenatalnog perioda zbog migracije neuroblasta (još nediferenciranih neurona) iz neuralne cijevi u područje bubrega. Tamo te ćelije formiraju poseban organ na vrhovima oba bubrega - nadbubrežne žlijezde. Nadbubrežne žlijezde inerviraju simpatički živci. Osim toga, može ih aktivirati adrenokortikotropni hormon, koji se oslobađa kao odgovor na stres iz hipofize i dospijeva u nadbubrežne žlijezde zajedno s krvlju. Pod utjecajem ovog hormona iz nadbubrežnih žlijezda u krv se oslobađa mješavina adrenalina i repinefrina, koji se prenose krvotokom i izazivaju niz simpatičkih reakcija (povećan rad srca, znojenje, pojačan dotok krvi u mišiće, crvenilo kože i još mnogo toga).
Aksoni simpatičkih neurona u perifernim sinapsama oslobađaju medijator adrenalin.Molekuli adrenalina i norepinefrina stupaju u interakciju sa odgovarajućim receptorima. Postoje dvije vrste takvih receptora: alfa i beta adrenergički receptori. Neki unutrašnji organi imaju samo jedan od ovih receptora, drugi imaju oba. Dakle, u zidovima krvnih sudova postoje i alfa i beta adrenergički receptori. Veza simpatičkog transmitera sa alfa-adrenergičkim receptorom izaziva sužavanje arteriola, a veza sa beta-adrenergičkim receptorom dilataciju arteriola. U crijevima, gdje su prisutne oba tipa adrenergičkih receptora, medijator inhibira njegovu aktivnost. U srčanom mišiću i zidovima bronha postoje samo beta-adrenergički receptori - simpatički transmiter izaziva proširenje bronha i ubrzan rad srca.
Ganglije parasimpatičkog odjela nervnog autonomnog sistema, za razliku od simpatičkih, nalaze se u zidovima unutrašnjih organa ili blizu njih. Nervno vlakno (akson neurona) iz odgovarajućeg parasimpatičkog centra u moždanom deblu ili sakralnoj kičmenoj moždini stiže do inerviranog organa bez prekida i završava se na neuronima parasimpatičkog ganglija. Sljedeći parasimpatički neuron nalazi se ili unutar organa ili u njegovoj neposrednoj blizini. Intraorganska vlakna i ganglije formiraju pleksuse bogate neuronima u zidovima mnogih unutrašnjih organa srca, pluća, jednjaka, želuca itd., kao i u žlijezdama egzokrinog i unutrašnjeg sekreta. Anatomska struktura parasimpatičkog dela nervnog autonomnog sistema ukazuje da je njegov uticaj na organe lokalniji od simpatičkog nervnog sistema.
Posrednik u perifernim sinapsama parasimpatičkog nervnog sistema je acetilholin, za koji postoje dva tipa receptora: M- i N-holinergički receptori. Ova podjela se zasniva na činjenici da M-holinergički receptori gube osjetljivost na acetilholin pod utjecajem atropina (izolovanog iz gljive roda Muscaris), a H-holinergički receptori - pod utjecajem nikotina.
Utjecaj simpatičkog i parasimpatičkog autonomnog sistema na tjelesne funkcije. U većini organa, stimulacija simpatičkog i nervnog parasimpatičkog autonomnog sistema izaziva suprotne efekte. Međutim, treba imati na umu da ove interakcije nisu jednostavne. Na primjer, parasimpatički živci uzrokuju opuštanje sfinktera mjehura i istovremeno kontrakciju mišića mjehura. Simpatički živci stežu sfinkter i istovremeno opuštaju mišiće. Drugi primjer: stimulacija simpatikusa povećava ritam i snagu srčanih kontrakcija, a iritacija vagusnog (parasimpatičkog) živca smanjuje ritam i snagu srčanih kontrakcija. Štaviše, studije su pokazale da između ovih dijelova nervnog autonomnog sistema ne postoji samo antagonizam (višesmjeran), već i sinergija (jednosmjeran). Povećanje tonusa jednog dijela nervnog autonomnog sistema, po pravilu, dovodi do povećanja tonusa drugog dijela. Štaviše, pokazalo se da postoje organi i tkiva sa samo jednom vrstom inervacije. Na primjer, žile kože, srži nadbubrežne žlijezde, maternice, skeletni mišići i neki drugi imaju samo simpatičku inervaciju, a pljuvačne žlijezde inerviraju samo parasimpatička vlakna.
Autonomni refleksi. Ovi refleksi su brojni. Oni su uključeni u mnoge regulacije ljudskog tijela. Kada se provode vegetativni refleksi, uticaji se prenose duž odgovarajućih nerava (simpatičkih ili parasimpatičkih) iz centralnog nervnog sistema. U medicinskoj praksi najveća vrijednost daju viscero-visceralne (od jednog unutrašnjeg organa do drugog), viscero-dermalne (od unutrašnjih organa do kože) i dermo-visceralne (od kože do unutrašnjih organa) reflekse.
Viscero-visceralni uključuju refleksne promjene u srčanoj aktivnosti, vaskularnom tonusu, dotoku krvi u slezinu s povećanjem ili smanjenjem tlaka u aorti, karotidnom sinusu ili plućnim žilama. Na primjer, zbog uključivanja takvog refleksa dolazi do zastoja srca kada su trbušni organi iritirani. Viscero-dermalni refleksi nastaju kada su unutrašnji organi nadraženi i manifestuju se u promeni osetljivosti odgovarajućih delova kože (u skladu sa tim koji organ je nadražen), znojenju i vaskularnoj reakciji. Dermo-visceralni refleksi očituju se u tome da se kod iritacije određenih dijelova kože mijenja rad odgovarajućih unutarnjih organa. Prava upotreba zagrijavanja ili hlađenja određenih dijelova kože u medicinske svrhe, na primjer kod bolova u unutrašnjim organima, zasniva se na mehanizmu ovih refleksa.
Autonomne reflekse doktori često koriste za procjenu funkcionalnog stanja nervnog autonomnog sistema. Na primjer, u klinici se često proučavaju refleksne promjene krvnih žila prilikom mehaničke iritacije kože (na primjer, kada se tupim predmetom pređe preko kože). Kod zdrave osobe to uzrokuje kratkotrajno blanširanje nadraženog područja kože (bijeli dermografizam, derma-koža). Kod visoke ekscitabilnosti nervnog autonomnog sistema, na mestu iritacije kože pojavljuje se crvena pruga, oivičena bledim prugama suženih sudova (crveni dermografizam), a sa još većom osetljivošću - otok kože na ovom mestu. Često se u klinici koriste funkcionalni autonomni testovi za procjenu stanja nervnog autonomnog sistema. Na primjer, ortostatska reakcija: pri prelasku iz ležećeg u stojeći položaj povećava se krvni tlak i povećava se broj otkucaja srca. Obrazac promjena krvnog pritiska i srčane aktivnosti tokom ovog testa može poslužiti kao dijagnostički znak bolesti u sistemu kontrole krvnog pritiska. Drugi primjer je očno-srčana reakcija (Aschnerov refleks): kada se pritisne na očne jabučice, dolazi do kratkotrajnog smanjenja broja otkucaja srca.
Vegetativni centri. Oblongata medulla sadrži nervne centre koji inhibiraju aktivnost srca (jezgra vagusnog živca). U retikularnoj formaciji produžene moždine nalazi se vazomotorni centar koji se sastoji od dvije zone: presorne i depresorne. Ekscitacija presorske zone dovodi do vazokonstrikcije, a ekscitacija depresorne zone dovodi do njihove dilatacije. Vazomotorni centar i jezgra vagusnog živca neprestano šalju impulse, zahvaljujući kojima se održava konstantan ton: arterije i arteriole su stalno nešto sužene, a srčana aktivnost je usporena.
Oblongata medulla sadrži respiratorni centar, koji se zauzvrat sastoji od centara za udisaj i izdisaj. Na nivou mosta nalazi se centar za disanje višeg nivoa (pneumotaksički centar), koji prilagođava disanje promenama u fizičkoj aktivnosti. Disanje kod ljudi takođe se može kontrolisati dobrovoljno iz moždane kore, na primer tokom govora.
U produženoj moždini nalaze se centri koji stimulišu lučenje pljuvačnih, suznih i želudačnih žlezda, lučenje žuči iz žučne kese i lučenje pankreasa. U srednjem mozgu, ispod prednjih tuberkula kvadrigeminusa, nalaze se parasimpatički centri akomodacije oka i zjenički refleks. Svi navedeni centri simpatičkog i parasimpatičkog sistema su podređeni višem autonomnom centru - hipotalamusu.
Uloga hipotalamusa u regulaciji autonomnih funkcija. Utjecaj na simpatičku i parasimpatičku regulaciju omogućava hipotalamusu da utječe na autonomne funkcije tijela putem humoralnih i neuralnih puteva. Ranije je bilo poznato da je iritacija jezgara prednje grupe praćena parasimpatičkim efektima. Iritacija jezgara zadnje grupe izaziva simpatičke efekte u funkcionisanju organa. Nuklearna stimulacija srednja grupa dovodi do smanjenja utjecaja simpatičkog odjela autonomnog nervnog sistema. Navedena distribucija hipotalamusa nije apsolutna. Sve strukture hipotalamusa su sposobne da proizvode simpatičke i parasimpatičke efekte u različitom stepenu. Posljedično, postoje funkcionalno komplementarni, međusobno kompenzirajući odnosi između struktura hipotalamusa.
Sveukupno zbog velika količina povezanosti, multifunkcionalnosti struktura, hipotalamus obavlja integrativnu funkciju autonomne, somatske i endokrine regulacije, koja se manifestuje i u organizaciji niza specifičnih funkcija po svojim jezgrama. Tako se u hipotalamusu nalaze centri homeostaze, termoregulacije, gladi i sitosti, žeđi i njenog zadovoljenja, seksualnog ponašanja, straha, bijesa, regulacije ciklusa budnost-san. Svi ovi centri ostvaruju svoje funkcije aktiviranjem ili inhibicijom autonomnog nervnog sistema, endokrinog sistema i struktura moždanog stabla i prednjeg mozga.
Na hipotalamus, pak, utječu brojni viši centri mozga, uključujući korteks.
dakle, Autonomni nervni sistem ima niz anatomskih i fizioloških karakteristika koje određuju mehanizme njegovog rada:
Anatomska svojstva
1. Trokomponentni raspored nervnih centara. Najniži nivo simpatičkog odjela predstavljaju bočni rogovi od VII vratnog do III–IV lumbalnog pršljena, a parasimpatički odjel predstavljaju sakralni segmenti i moždano stablo. Viši subkortikalni centri nalaze se na granici hipotalamusa (simpatikus je zadnja grupa, a parasimpatikus je prednja grupa). Kortikalni nivo se nalazi u području od šestog do osmog Brodmanovog područja (motosenzorno područje), u kojem se postiže lokalizacija dolaznih nervnih impulsa. Zbog prisustva takve strukture autonomnog nervnog sistema, rad unutrašnjih organa ne dostiže prag naše svesti.
2. Prisustvo autonomnih ganglija. U simpatičkom odjelu nalaze se ili s obje strane duž kičme (simpatički nervni lanac) ili su dio pleksusa. Dakle, luk ima kratku preganglionsku i dugu postganglionsku putanju. Neuroni parasimpatičkog odjela nalaze se u gangliju koji se nalazi u blizini radnog organa ili u njegovom zidu, tako da luk ima dugu preganglionsku i kratku postganglionsku stazu.
1. Osobine funkcioniranja autonomnih ganglija. Prisutnost fenomena animacije (istovremena pojava dva suprotna procesa - divergencije i konvergencije). Divergencija je divergencija nervnih impulsa od tijela jednog neurona do nekoliko postganglionskih vlakana drugog. Konvergencija je konvergencija na tijelu svakog postganglijskog neurona impulsa iz nekoliko preganglijskih. Time se osigurava pouzdanost prijenosa informacija od centralnog nervnog sistema do radnog organa. Povećanje trajanja postsinaptičkog potencijala, prisustvo hiperpolarizacije u tragovima i sinaptičko kašnjenje doprinose prijenosu ekscitacije brzinom od 1,5-3,0 m/s. Međutim, impulsi su djelomično ugašeni ili potpuno blokirani u autonomnim ganglijama. Na taj način regulišu protok informacija iz centralnog nervnog sistema. Zbog ovog svojstva nazivaju se nervnim centrima koji se nalaze na periferiji, a autonomni nervni sistem autonomnim.
2. Osobine nervnih vlakana. Preganglijska nervna vlakna pripadaju grupi B i provode ekscitaciju brzinom od 3-18 m/s, postganglijska nervna vlakna pripadaju grupi C. Ekscitaciju provode brzinom od 0,5-3,0 m/s. Kako eferentni put simpatičkog odjela predstavljaju preganglijska vlakna, a parasimpatička postganglijska vlakna, brzina prijenosa impulsa veća je u parasimpatičkom nervnom sistemu.
Općenito, simpatički nervni sistem obavlja adaptivno-trofičku funkciju, uključuje se u fizičku aktivnost, emocionalne reakcije, stres, bol i gubitak krvi. Osigurava adaptaciju tijela na promjenjive uslove okoline.
Parasimpatički nervni sistem je antagonist simpatičkog nervnog sistema i obavlja homeostatske i zaštitne funkcije, reguliše pražnjenje šupljih organa. Homeostatska uloga je restorativne prirode i djeluje u stanju mirovanja. To se manifestira u vidu smanjenja učestalosti i snage srčanih kontrakcija, stimulacije gastrointestinalnog trakta sa smanjenjem razine glukoze u krvi itd.