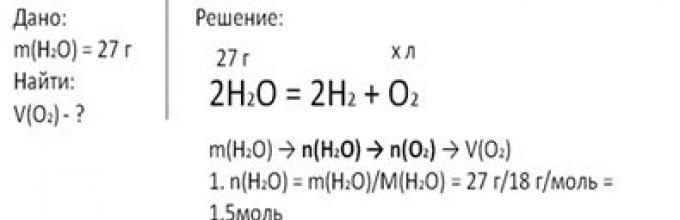Prilikom rješavanja poravnanja hemijski problemi potrebna je sposobnost izvođenja proračuna pomoću jednačine hemijske reakcije. Lekcija je posvećena proučavanju algoritma za izračunavanje mase (volumena, količine) jednog od učesnika reakcije iz poznate mase (volumena, količine) drugog učesnika reakcije.
Tema: Supstance i njihove transformacije
lekcija:Proračuni pomoću jednadžbe kemijske reakcije
Razmotrimo jednadžbu reakcije za formiranje vode iz jednostavne supstance:
2H 2 + O 2 = 2H 2 O
Možemo reći da su dva molekula vode formirana od dva molekula vodonika i jednog molekula kiseonika. S druge strane, isti unos kaže da je za formiranje svaka dva mola vode potrebno uzeti dva mola vodonika i jedan mol kiseonika.
Molarni odnos učesnika u reakciji pomaže da se naprave proračuni važni za hemijsku sintezu. Pogledajmo primjere takvih proračuna.
ZADATAK 1. Odredimo masu vode koja nastaje kao rezultat sagorevanja vodika u 3,2 g kiseonika.
Da biste riješili ovaj problem, prvo morate napraviti jednadžbu za kemijsku reakciju i zapisati zadate uslove problema nad njom.
Kad bismo znali količinu kisika koja je reagirala, mogli bismo odrediti količinu vode. A onda bismo izračunali masu vode, znajući njenu količinu supstance i. Da biste pronašli količinu kiseonika, morate masu kiseonika podeliti sa njegovom molarna masa.
Molarna masa je numerički jednaka relativnoj masi. Za kiseonik, ova vrijednost je 32. Zamijenimo je u formulu: količina kisikove supstance jednaka je omjeru od 3,2 g prema 32 g/mol. Ispostavilo se da je 0,1 mol.
Da bismo pronašli količinu vodene tvari, ostavimo proporciju koristeći molarni omjer sudionika reakcije:
Na svakih 0,1 mol kiseonika postoji nepoznata količina vode, a na svaki mol kiseonika 2 mola vode.
Stoga je količina vodene supstance 0,2 mol.
Da biste odredili masu vode, potrebno je pomnožiti pronađenu vrijednost količine vode njenom molarnom masom, tj. pomnožimo 0,2 mol sa 18 g/mol, dobijemo 3,6 g vode.
Rice. 1. Snimanje kratkog stanja i rješenja za problem 1
Osim mase, možete izračunati zapreminu učesnika gasovite reakcije (pri normalnim uslovima) koristeći vam poznatu formulu, prema kojoj je zapremina gasa u normalnim uslovima. jednak proizvodu količine gasovite supstance i molarne zapremine. Pogledajmo primjer rješavanja problema.
ZADATAK 2. Izračunajmo zapreminu kiseonika (u normalnim uslovima) koji se oslobađa pri razgradnji 27 g vode.
Zapišimo jednačinu reakcije i date uslove zadatka. Da biste pronašli zapreminu oslobođenog kiseonika, prvo morate pronaći količinu vodene supstance kroz masu, zatim pomoću jednačine reakcije odrediti količinu kiseonika, nakon čega možete izračunati njen volumen na nivou tla.
Količina vodene tvari jednaka je omjeru mase vode i njene molarne mase. Dobijamo vrijednost od 1,5 mol.
Napravimo proporciju: iz 1,5 mola vode nastaje nepoznata količina kiseonika, iz 2 mola vode formira se 1 mol kiseonika. Dakle, količina kiseonika je 0,75 mol. Izračunajmo zapreminu kiseonika u normalnim uslovima. On je jednak proizvodu količine kiseonika i molarne zapremine. Molarna zapremina bilo koje gasovite supstance u uslovima okoline. jednako 22,4 l/mol. Zamjenom numeričkih vrijednosti u formulu, dobivamo volumen kisika jednak 16,8 litara.
Rice. 2. Snimanje kratkog stanja i rješenja za problem 2
Poznavajući algoritam za rješavanje ovakvih problema, moguće je izračunati masu, zapreminu ili količinu supstance jednog od učesnika reakcije iz mase, zapremine ili količine supstance drugog učesnika u reakciji.
1. Zbirka zadataka i vježbi iz hemije: 8. razred: za udžbenike. P.A. Oržekovski i dr. „Hemija. 8. razred” / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. - M.: AST: Astrel, 2006. (str.40-48)
2. Ushakova O.V. Radna sveska iz hemije: 8. razred: do udžbenika P.A. Oržekovski i dr. „Hemija. 8. razred” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; ispod. ed. prof. P.A. Oržekovski - M.: AST: Astrel: Profizdat, 2006. (str. 73-75)
3. Hemija. 8. razred. Udžbenik za opšte obrazovanje institucije / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M.: Astrel, 2013. (§23)
4. Hemija: 8. razred: udžbenik. za opšte obrazovanje institucije / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005. (§29)
5. Hemija: neorganska. hemija: udžbenik. za 8. razred opšte obrazovanje osnivanje /G.E. Rudžitis, F.G. Feldman. - M.: Obrazovanje, OJSC “Moskovski udžbenici”, 2009. (str.45-47)
6. Enciklopedija za djecu. Tom 17. Hemija / Pogl. ed.V.A. Volodin, Ved. naučnim ed. I. Leenson. - M.: Avanta+, 2003.
Dodatni web resursi
2. Pojedinačna zbirka digitalnih obrazovnih resursa ().
1) str. 73-75, br. 2, 3, 5 od Radna sveska iz hemije: 8. razred: do udžbenika P.A. Oržekovski i dr. „Hemija. 8. razred” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; ispod. ed. prof. P.A. Oržekovski - M.: AST: Astrel: Profizdat, 2006.
2) str.135 br.3,4 iz udžbenika P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Šalašova „Hemija: 8. razred“, 2013
Šta god da učiš, ti
učiš za sebe.
Petronije
Ciljevi lekcije:
- upoznati učenike sa osnovnim načinima rješavanja zadataka primjenom hemijskih jednačina:
- odrediti količinu, masu i zapreminu produkta reakcije iz količine, mase ili zapremine polaznih supstanci,
- nastaviti razvijati vještine u radu sa tekstom zadatka, sposobnost razumnog odabira načina rješavanja obrazovnog problema, sposobnost pisanja jednačina hemijske reakcije.
- razviti sposobnost analiziranja, poređenja, isticanja glavne stvari, sastavljanja akcioni plan, doneti zaključke.
- negovati toleranciju prema drugima, samostalnost u donošenju odluka i sposobnost objektivnog vrednovanja rezultata svog rada.
Oblici rada: frontalni, individualni, parovi, grupni.
Vrsta lekcije: u kombinaciji s korištenjem IKT-a
I Organizacioni momenat.
Zdravo momci. Danas ćemo naučiti kako rješavati probleme koristeći jednačine kemijskih reakcija. Slajd 1 (pogledajte prezentaciju).
Ciljevi lekcije Slajd 2.
II.Ažuriranje znanja, vještina i sposobnosti.
Hemija je veoma interesantna i u isto vreme kompleksna nauka. Da biste poznavali i razumjeli hemiju, morate ne samo usvojiti gradivo, već i biti u stanju primijeniti stečeno znanje. Naučili ste koji znakovi ukazuju na nastanak kemijskih reakcija, naučili pisati jednačine za kemijske reakcije. Nadam se da dobro razumijete ove teme i da možete bez poteškoća odgovoriti na moja pitanja.
Koja pojava nije znak hemijskih transformacija:
a) izgled sedimenta; c) promjena zapremine;
b) oslobađanje gasa; d) pojava mirisa. Slajd 3
Molimo navedite u brojevima:
a) jednačine složenih reakcija
b) jednadžbe supstitucijskih reakcija
c) jednačine reakcija razlaganja Slajd 4
Da biste naučili kako rješavati probleme, potrebno je kreirati algoritam radnji, tj. odrediti redoslijed radnji.
Algoritam za proračun pomoću hemijskih jednačina (na stolu svakog učenika)
5. Zapišite odgovor.
Počnimo rješavati probleme koristeći algoritam
Izračunavanje mase supstance iz poznate mase druge supstance koja učestvuje u reakciji
Izračunajte masu kisika oslobođenog kao rezultat razgradnje
porcije vode težine 9 g.
Nađimo molarnu masu vode i kiseonika:
M(H 2 O) = 18 g/mol
M(O 2) = 32 g/mol Slajd 6
Napišimo jednačinu hemijske reakcije:
2H 2 O = 2H 2 + O 2
Iznad formule u jednadžbi reakcije upisujemo ono što smo pronašli
vrijednost količine tvari, a prema formulama tvari -
prikazani stehiometrijski odnosi
hemijska jednačina
0.5mol x mol
2H 2 O = 2H 2 + O 2
2mol 1mol
Izračunajmo količinu tvari čiju masu želimo pronaći.
Da bismo to učinili, kreiramo proporciju
0,5mol = hopmol
2mol 1mol
gdje je x = 0,25 mol Slajd 7
Dakle, n(O 2) = 0,25 mol
Pronađite masu supstance koju treba izračunati
m(O 2)= n(O 2)*M(O 2)
m(O 2) = 0,25 mol 32 g/mol = 8 g
Hajde da zapišemo odgovor
Odgovor: m(O 2) = 8 g Slajd 8
Izračunavanje zapremine supstance iz poznate mase druge supstance koja učestvuje u reakciji
Izračunajte volumen kisika (br.) koji se oslobađa kao rezultat razgradnje dijela vode težine 9 g.

V(0 2)=?l(n.s.)
M(H 2 O) = 18 g/mol
Vm=22,4l/mol Slajd 9
Zapišimo jednačinu reakcije. Složimo koeficijente
2H 2 O = 2H 2 + O 2
Iznad formule u jednadžbi reakcije upisujemo pronađenu vrijednost količine supstance, a ispod formula supstanci - stehiometrijske odnose prikazane hemijskom jednadžbom
0,5 mol - x mol
2H 2 O = 2H 2 + O 2 Slajd10
2mol - 1mol
Izračunajmo količinu tvari čiju masu želimo pronaći. Da bismo to učinili, napravimo proporciju
![]()
gdje je x = 0,25 mol
Nađimo zapreminu supstance koju treba izračunati
V(0 2)=n(0 2) Vm
V(O 2) = 0,25 mol 22,4 l/mol = 5,6 l (br.)
Odgovor: 5,6 l Slajd 11
III Konsolidacija proučenog materijala.
Zadaci za samostalno rješavanje:
1. Prilikom redukcije oksida Fe 2 O 3 i SnO 2 ugljem dobijeno je 20 g Fe i Sn. Koliko grama svakog oksida je uzeto?
2. U kom slučaju se stvara više vode:
a) pri redukciji 10 g bakar (I) oksida (Cu 2 O) vodonikom ili
b) kod redukcije 10 g bakar(II) oksida (CuO) vodonikom? Slajd 12
Provjerimo rješenje zadatka 1

M(Fe 2 O 3)=160g/mol
M(Fe)=56g/mol, ![]()
m(Fe 2 O 3)=, m(Fe 2 O 3)= 0,18*160=28,6g
Odgovor: 28,6g
Slajd 13
Provjerimo rješenje zadatka 2

M(CuO) = 80 g/mol
4. ![]()
x mol = 0,07 mol,
n(H 2 O)=0,07 mol
m(H 2 O) = 0,07 mol*18 g/mol = 1,26 g
Slajd 14
CuO + H 2 = Cu + H 2 O
n(CuO) = m/ M(CuO)
n(CuO) = 10 g/ 80 g/mol = 0,125 mol
0,125 mol hmelj
CuO + H 2 = Cu + H 2 O
1mol 1mol
![]()
x mol = 0,125 mol, n(H 2 O) = 0,125 mol
m (H 2 O) = n * M (H 2 O);
m(H 2 O) = 0,125mol*18g/mol=2,25g
Odgovor: 2,25g Slajd 15
Domaći zadatak: proučiti materijal iz udžbenika str. 45-47, riješite problem
Kolika je masa kalcijum oksida, a kolika zapremina ugljičnog dioksida (n.s.)
može se dobiti razlaganjem kalcijum karbonata težine 250 g?
CaCO 3 = CaO + CO Slajd 16.
Književnost
1. Gabrielyan O.S. Program kursa hemije za 8-11 razred obrazovne institucije. M. Drfa 2006
2. Gabrielyan O.S. hemija. 8. razred. Udžbenik za opšteobrazovne ustanove. Drolja. M. 2005
3. Gorbuntsova S.V. Testovi iz glavnih dijelova školskog kursa. 8. - 9. razredi VAKO, Moskva, 2006.
4. Gorkovenko M.Yu Razvoj lekcija iz hemije. Udžbenicima O.S. Gabrielyan, L.S. Guzey, V.V. Sorokin, R.P. Surovtseva i G.E. Rudzitis, F.G. Feldman. 8. razred VAKO, Moskva, 2004.
5. Gabrielyan O.S. hemija. Ocjena 8: Testovi i testovi. – M.: Drfa, 2003.
6. Radecki A.M., Gorškova V.P. Didaktički materijal iz hemije za 8-9 razred: Priručnik za nastavnike. – M.: Obrazovanje, 2000
Aplikacija.
Proračuni pomoću hemijskih jednadžbi
Algoritam akcija.
Da biste riješili računski problem u hemiji, možete koristiti sljedeći algoritam - napravite pet koraka:
1. Napišite jednačinu za hemijsku reakciju.
2. Iznad formula supstanci upisati poznate i nepoznate količine sa odgovarajućim mernim jedinicama (samo za čiste supstance, bez primesa). Ako, prema uvjetima problema, tvari koje sadrže nečistoće uđu u reakciju, tada prvo morate odrediti sadržaj čiste tvari.
3. Pod formulama supstanci sa poznatim i nepoznatim, upiši odgovarajuće vrijednosti ovih veličina koje se nalaze iz jednačine reakcije.
4. Sastavite i riješite proporciju.
5. Zapišite odgovor.
Odnos između nekih fizičkih i hemijskih veličina i njihovih jedinica
Masa (m) : g; kg; mg
Količina tvari (n): mol; kmol; mmol
Molarna masa (M): g/mol; kg/kmol; mg/mmol
Volumen (V) : l; m 3 /kmol; ml
Molarni volumen (Vm) : l/mol; m 3 /kmol; ml/mmol
Broj čestica (N): 6 1023 (Avagadro broj – N A); 6 1026 ; 6 1020
Vježbajte. Koliko litara kiseonika (n.o.) će reagovati tokom sagorevanja 4,8 g magnezijuma?
Periodični zakon (PL) i periodični sistem (PS)
elementi D. I. Mendeljejeva
Otkriće PZ i izgradnja PS bili su vrhunac razvoja hemije u 19. veku (1869). DI. Mendeljejev je rasporedio sve tada poznate elemente (63) po rastućem redosledu njihovih atomskih masa i istovremeno otkrio vezu između svojstava hemijski elementi sa njihovim atomskim masama, što se sastojalo u tome da su se u određenim intervalima svojstva elemenata ponavljala. D. I. Mendeljejev je formulisao periodični zakon dakle: Svojstva jednostavnih supstanci, kao i oblici i svojstva spojeva elemenata, periodično zavise od veličine atomskih masa elemenata.
Uprkos ogromnom značaju takvog zaključka, PZ i PS su predstavljali samo briljantnu empirijsku (eksperimentalnu) generalizaciju činjenica, a njihovo fizičko značenje dugo je ostalo nejasno. Razlog za to je što je u 19. veku bilo potpuno nerazumevanje složenosti strukture atoma.
Najčešće se koriste tri PS opcije:
1. Kratak period;
2. Poludugi (svi elementi 4. i 5. perioda su produženi u jednom redu od 18 elemenata;
3. Dugoperiod (svi s, p, d i f elementi su nacrtani u jednu liniju.
Kratki oblik PS sastoji se od 7 perioda i 8 grupa.
Period je horizontalni niz koji počinje alkalnim metalom(osim prvog perioda) a završava se inertnim elementom(osim sedmog perioda).
Prvi, drugi i treći period sastoje se od jednog reda i nazivaju se malim. Četvrti, peti i šesti period sastoje se od dva reda i nazivaju se velikim. Ukupno in periodni sistem 10 redova. Gornji red je paran, donji je neparan. Parni redovi sadrže samo metale i svojstva elemenata se malo mijenjaju s lijeva na desno. Parni niz velikog perioda završava se sa tri elementa slična po svojstvima: trozvukom. Neparni redovi sadrže metale i nemetale, u njima s lijeva na desno dolazi do postepenog prijelaza od metalna svojstva do nemetalnih.
U šestom periodu postlantan La (br. 57) postoji 14 elemenata sličnih svojstava (br. 58 - 71): lantanidi. Svi su reaktivni metali, reagiraju s vodom i imaju snažnu horizontalnu analogiju.
U sedmom periodu nakon aktinijuma Ac (br. 89) slično je locirano 14 elemenata (br. 90 - 103) sličnih aktinijumu: aktinidi. Jezgra njihovih atoma su izuzetno nestabilna, odnosno radioaktivna.
Svaka grupa se sastoji od dvije podgrupe: glavne i sekundarne.
Podgrupe koje uključuju elemente malih i velikih perioda nazivaju se glavnim (A). Podgrupe koje uključuju elemente samo velikih perioda nazivaju se sekundarnim (B). Podgrupe kombinuju elemente koji su najsličniji jedni drugima.
Elemente jedne grupe karakteriziraju sljedeći obrasci:
1. Svi elementi, osim plemenitih gasova, formiraju jedinjenja kiseonika.
2. Viša valencija i najviša pozitivan stepen oksidacija obično odgovara broju grupe. Izuzeci: 1) u grupi 8 samo rutenijum Ru i Os imaju valenciju VIII; Cu +1, Cu +2; O–2; Ž –1.
3. Elementi glavne podgrupe od IV do VIII grupe formiraju isparljiva jedinjenja sa vodonikom. Njihova valencija u ovim jedinjenjima jednaka je razlici između broja 8 i broja grupe. Na primjer, N je in V grupa a njegova valencija je 8 – 5 = 3 u jedinjenju NH 3.
Atomska struktura
U 19. vijeku vjerovali da je atom nedjeljiva čestica koja se ne mijenja tokom hemijskih reakcija. Krajem 19. i početkom 20. vijeka. Otkriveno je rendgensko zračenje (njemački naučnik K. Roentgen, 1895), radioaktivnost (francuski naučnik A. Becquerel, 1896) i elektron (engleski naučnik J. Thomson, 1897). Masa m(e)=9,109×10 –28 g i negativni naboj q(e)=1,602×10 –19 C. Vrijednost naboja elektrona uzima se kao jedinica elementarnog električnog naboja.
J. Thomson je 1903. godine predložio model strukture atoma, prema kojem je pozitivni naboj ravnomjerno raspoređen po volumenu atoma i neutraliziran je elektronima koji se u njemu nalaze. Razvijajući ove ideje, E. Rutherford je 1911. god. predložio planetarni model strukture atoma. Prema ovoj teoriji, u centru atoma nalazi se pozitivno nabijeno jezgro oko koje se kreću elektroni. Zbirka elektrona u atomu naziva se njegova elektronska školjka. Godine 1913. engleski naučnik D. Moseley otkrio je da je vrijednost pozitivnog naboja jezgra atoma jednaka atomskom broju elementa u periodnom sistemu elemenata D. I. Mendeljejeva. Stoga je atom električno neutralan broj elektrona u elektronska školjka atom je jednak naboju jezgra Z ili atomskom broju elementa u periodnom sistemu.
Godine 1932. sovjetski naučnici D. D. Ivanenko i E. N. Gapon i, nezavisno od njih, njemački naučnik W. Heisenberg stvorili su proton-neutronska teorija nuklearne strukture. Proton p je čestica mase 1 a. jesti.
(1,66 × 10 –24 g) i punjenje + 1. Neutron n je električki neutralna čestica s masom bliskom masi protona. Protoni i neutroni se nazivaju nukleoni.
Naboj jezgra atoma određen je brojem protona. dakle, broj protona u jezgru atoma je također jednak atomskom broju elementa u periodnom sistemu. Ukupan broj protona i neutrona naziva se maseni broj (A). Jednaka je vrijednosti relativne atomske mase zaokruženoj na najbliži cijeli broj.
Vježbajte. Koliki je nuklearni naboj i koliko elektrona, protona, neutrona ima u atomu cinka?
Z=+30, p=30, e=30, n = 65–30 = 35.
Izotopi
Raznolikosti atoma istog elementa koji imaju isti nuklearni naboj, ali različite masene brojeve (isti broj protona i različit broj neutrona) nazivaju se izotopi. Hemijska svojstva Svi izotopi jednog elementa su isti.
Svaki izotop karakteriziraju dvije veličine: maseni broj (naveden u gornjem lijevom kutu hemijski znak) I serijski broj(smješten ispod lijevo od hemijskog simbola) i označen je simbolom odgovarajućeg elementa. Na primjer, element vodonik ima tri izotopa. N – protij (1 p); D(H) - deuterijum (1p, 1n); T(H) - tricijum (1 p, 2 n).
Sažetak lekcije “Proračuni pomoću hemijskih jednačina”
1. Provjera domaćeg zadatka
Kao domaći zadatak, od vas se tražilo da postavite koeficijente u jednačine reakcije.Možete vidjeti obavljeni posao tokom pauze. Greške će sigurno biti.Je li sve uspjelo, ima li neko pitanja?Neka pričaju o svom kućnom iskustvu.
2. Najava teme i ažuriranje znanja
Tema današnje lekcije su proračuni pomoću hemijskih jednačina. Prvo, prisjetimo se svega što nam danas može biti od koristi. Već smo se susreli sa hemijskim jednačinama prošle nedelje. laboratorijski rad, u domaćem zadatku, još ranije - na temu binarnih spojeva. Prisjetimo se definicije jednadžbe kemijske reakcije.
(ovo je konvencionalna oznaka hemijske reakcije pomoću hemijske formule i koeficijenti.)
Nevjerovatno.
Kada proizvodite bilo koje spojeve, morate znati koliko polaznog materijala uzeti da biste dobili potrebnu masu produkta reakcije. Da biste to učinili, kreirajte jednadžbu za tekuću kemijsku reakciju i prilikom izračunavanja mase uzimaju u obzir molarne mase supstanci, a prilikom izračunavanja zapremine gasova uzeti u obzir vrijednostmolarni volumen gasovi
Ko pamti vrijednost molarne zapremine gasova u normalnim uslovima? (22,4 l/mol)
A šta je ovo normalnim uslovima? (pritisak 101,3 kPa i temperatura 0 o C)
Odnosno, pod ovim uslovima, 1 mol BILO KOGA gasa zauzima zapreminu od 22,4 litara.
Zapravo, da bismo riješili probleme, moramo zapamtiti nekoliko veličina:
Molarna masa – M (g/mol)
Količina supstance – n (mol)
Volumen – V (l)
Bolje je ovako: zapamtite da je molarna masa numerički jednaka relativnoj atomskoj masi ili relativnoj molekulskoj masi supstance. Da biste to učinili, trebate koristiti periodičnu tablicu, gdje je na dnu svake "ćelije" srodnik atomska masa. Ne zaboravljajući pravila zaokruživanja, koristimo cijelu vrijednost ove mase u proračunima.
Hemija je vrlo jasna, logična i konzistentna nauka, pa će za rješavanje problema biti zgodno koristiti ALGORITAM koji je dat u udžbeniku. Ovo je univerzalni slijed radnji koji se koristi za rješavanje bilo kojeg problema ove vrste.
Molimo vas da otvorite udžbenik i da se svi upoznamo sa algoritmom.
(ovdje svi zajedno otvaramo naše udžbenike, jedna osoba, možda ja, čita algoritam, ostali slijede da shvate šta sada moraju da urade)
Zvuči opširno, ali nadam se da nije previše zbunjujuće. Pokušajmo to shvatiti na primjeru.
Zadatak 1. Za proizvodnju vodonika, aluminijum se rastvara u sumpornoj kiselini: 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 (Prva tačka našeg algoritma). Za reakciju smo uzeli 10,8 g aluminijuma. Izračunajte masu potrošene sumporne kiseline.
Dato: m(Al) = 10,8 g | Rješenje: m=10,8 g m - ? 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 M=27g/mol M=98g/mol Ovdje možemo spomenuti da zapravo u reakciju ne ulaze 2 atoma aluminija i 3 molekula kiseline, već dio atoma aluminija i dio molekula kiseline. Ovaj dio u hemiji naziva se kratkom riječju "krtica". n=2 mol n=3 mol m = M ∙ n m=54 g m=294 g Obračun po proporcijama: |
||||
m (H 2 SO 4 ) - ? |
|||||
10,8 g | |||||
54 g | 294 g | ||||
10,8 g ∙ 294 g | |||||
54 g | |||||
X = 58,8 g Odgovor: m (H 2 SO 4 ) = 58,8 g |
|||||
To je sve rješenje problema. Imate pitanja? Hajdemo još jednom o rješenju:
Napravio jednačinu
Iznad supstanci smo potpisali ono što ZNAMO i šta ŽELIMO NAĆI
Pod formulama smo zapisali molarnu masu, količinu supstance istehiometrijski masa supstance ( bolje je navesti "masu prema periodnom sistemu")
Napravio proporciju
Rešena proporcija
Snimio odgovor
Rešimo sličan problem, ali sa gasovitim supstancama (ovde nećemo koristiti molarnu masu supstance, ali šta?...molarnu zapreminu)
Zadatak 2. 25 grama cink se rastvara u hlorovodoničkoj kiselini, tokom hemijske reakcije oslobađa se gas - vodonik. Izračunajte zapreminu oslobođenog vodonika.
Dato: m(Zn) = 10,8 g | Rješenje: m=25 g V - ? Zn + 2HCl → ZnCl 2 + H 2 M=65 g/mol V m=22,4 l/mol n=1 mol n=1 mol m=65 g V=22,4 l Obračun po proporcijama: |
||||
m(HCl) - ? |
|||||
25 g | |||||
65 g | 22,4 l | ||||
25 g ∙ 22,4 l | |||||
65 g | |||||
X = 8,61 l Odgovor: V(H 2 ) = 8,61 l |
|||||
Hajde da provjerimo kako ste savladali gradivo. Koristeći isti algoritam riješite problem:
NIJE ČINJENICA DA ĆETE BITI USPJEŠNI:
Kada reaguje sa korišćenjem ugljenih oksida Fe2O3 (prva opcija) i SnO2 (druga opcija) dobija se po 20 g Fe i Sn. Koliko grama svakog oksida je uzeto?
Imajte na umu da sada izračunavamo masu početnih supstanci, a ne produkta reakcije)
(neka svi to riješe u svesci i selektivno zamolite da pokažu rješenje, zapisaćemo jednačinu svi zajedno na ploču, a svako će pokušati da je riješi sam)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 g
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 g
Domaći zadatak: proučiti materijal iz udžbenika str. 146-150, riješite problem
Kolika je masa kalcijum oksida, a kolika zapremina ugljičnog dioksida (n.s.)
može se dobiti razlaganjem kalcijum karbonata težine 250 g?TREBA DA SE DAJU ŠKOLAMAREADY EQUATIONDA DOVRŠITE OVAJ ZADATAK
Detaljan pregled lekcije „Proračuni pomoću hemijskih jednačina“.
udžbenik: O.S. Gabrielyan.
klasa: 8
Tema lekcije: Proračuni pomoću hemijskih jednadžbi.
Vrsta lekcije: kombinovano.
Obrazovni ciljevi: uvesti proračune koristeći hemijske jednačine; razvijati znanje učenika o proračunima pomoću hemijskih jednačina; početi razvijati vještine sastavljanja hemijskih jednačina i izračunavanja jednačina.
Edukativni zadaci: nastaviti formiranje prirodnonaučnog pogleda na svijet, ideje pojedinca i cjeline.
Razvojni zadaci: nastaviti razvijati sposobnost zapažanja, analiziranja, objašnjavanja i izvođenja zaključaka.
Nastavne metode: verbalno (objašnjenje i priča nastavnika), verbalno - vizuelno (objašnjenje uz pomoć beleški na tabli).
Oprema: tabla, tabela D.I. Mendeljejeva.
Tokom nastave:
1. Organizacioni trenutak (2-5 min.)
Zdravo momci, sedite. Danas u lekciji vi i ja ćemo morati da naučimo kako da izvršimo proračune koristeći hemijske jednačine.
2. Provjera znanja i vještina (10 – 15 min.)
U prethodnim časovima smo prošli kroz jednačine hemijskih reakcija, da se prisetimo šta je hemijska jednačina? (Hemijska jednačina je konvencionalni prikaz hemijske reakcije koristeći hemijske formule i matematičke simbole).
Na osnovu kog zakona se pišu hemijske reakcije? (Zakon održanja mase supstanci).
Kako to zvuči? (Masa supstanci koje su ušle u hemijsku reakciju jednaka je masi supstanci koje iz nje nastaju).
3. Objašnjenje novog materijala (20 – 30 min.)
Pomoću hemijske jednačine možete odrediti koje su supstance reagovale, a koje su nastale, a možete koristiti i hemijsku jednadžbu za izračunavanje mase, zapremine i količine reagujućih supstanci.
Za proračune je vrlo važno odabrati jedinice mase, zapremine i količine tvari koje odgovaraju jedna drugoj. Otvorimo udžbenike na strani 146 i pronađemo tabelu br. 7. Koristeći ovu tabelu, razmotrimo odnos nekih jedinica fizičkih i hemijskih veličina.
Da biste riješili računske probleme u hemiji, možete koristiti algoritam. Algoritam za rješavanje zadataka dat je u udžbeniku na strani 147.
Koristeći algoritam za rješavanje problema, riješimo sljedeći problem:
zadatak: Izračunajte volumen vodonika (br.) koji će biti potreban za reakciju sa 230 kg željeznog (III) oksida. Izračunajte količinu vode koja se formira u ovom slučaju.
Dato: Rješenje:
m(Fe 2 O 3) = 230 kg 1. Napišite jednačinu hemijske reakcije:
V(H 2) - ?
n(H 2 O) - ? 2. Zapišite poznate i nepoznate numeričke vrijednosti iznad formula supstanci u jednadžbi.
Pošto je masa data u kilogramima, nalazimo zapreminu u kubnim metrima, a količinu supstance u kilomolima. I onda:
230kg x m 3 y kmol
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
gdje je x zapremina vodonika V(H 2), y količina vodene supstance n(H 2 O).
3. a) Nađite masu 1 kmol Fe 2 O 3 određenu hemijskom jednadžbom i zapišite rezultujuću vrijednost pod njenom formulom:
Mr(Fe 2 O 3) = 56 * 2 + 16 * 3 = 160,
M(Fe 2 O 3) = 160 kg/kmol.
b) Nađite zapreminu od 3 kmol vodonika V = Vm*n zadanu jednačinom, upišite pronađenu vrijednost pod formulom vodonika: V(3H 2) = 22,4 m 3 /kmol * 3 kmol = 67,2 m 3.
c) Pod formulom vode označavamo njenu količinu, dato jednačinom, - 3 kmol.
Jednačina postaje
230kg x m 3 y kmol
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
160 kg 67,2 m 3 3 kmol
4. Sastavimo i riješimo proporcije:
a) 230 = x, x = 230*67,2 = 201,6 (m3) – zapremina vodonika V(H2)
b) 230 = y, y = 230*3 = 9 (kmol) – količina vodene supstance n(H 2 O).
4.Primarna konsolidacija znanja (10 – 12 min.)
Riješite probleme (ako je moguće, na nekoliko načina):
Zadatak 1. 0,1 mol cinka reaguje sa kiseonikom. Koliko je kiseonika potrebno? Koliko cink oksida nastaje?
Zadatak 2. Cink reaguje sa kiseonikom u količini od 0,1 mol. Odredite masu kiseonika koji reaguje, kao i masu nastalog cink oksida.
Zadatak 3. Aluminij mase 6,3 g reagira s kisikom. Odredite mase kisika i rezultirajućeg željeznog oksida ako aluminij sadrži 20% nečistoća.
Zadatak 4. Koja zapremina vodonika (n.o.) će se osloboditi tokom interakcije 2,7 g od 25% hlorovodonične kiseline sa količinom aluminijuma potrebnom za reakciju? Kolika je ova količina supstance?
Zadatak 5. Kolika će se količina ugljičnog dioksida osloboditi kada se sagori 60 kg uglja?
Zadatak 6. Koliko molova kalcijum oksida nastaje kada se 8 g kalcija koji sadrži 30% nečistoća sagori u kisiku?
5. Sažetak lekcije (1 -3 min.)
Danas smo se na času još jednom prisjetili pisanja hemijskih jednadžbi i naučili kako izvršiti proračune pomoću hemijskih jednačina.
6. Domaći (1 – 4 min.)
§28, zadaci u radnim sveskama.
Kolika masa željeznog (III) oksida nastaje kada se 0,6 mol željeza sagori u zraku?
Izračunajte masu aluminijum sulfida koji nastaje kada se 5,4 g aluminijumskog praha stapa sa sumporom. Koliko grama željeznog (II) sulfida nastaje kada se 11,2 g željeznog praha spoji sa sumporom?
Odredite masu magnezijuma potrebnu za dobijanje 19 g magnezijum hlorida (na primer, sagorevanjem magnezijuma u hloru).
Koliko litara hlorovodonika nastaje kada hlor reaguje sa 5,5 litara vodonika?
Koja zapremina vodonika može reagovati sa 150 litara kiseonika?
Koliki volumen ugljičnog dioksida nastaje kada se sagori 8 litara metana CH4?
Koliki volumen ugljičnog dioksida nastaje kada se sagori 480 g uglja?
Koliko kiseonika će se osloboditi tokom raspadanja? strujni udar 100g vode?
Kolika zapremina azota nastaje prilikom eksplozije 1 g azot-jodida:
2NJ 3 = N 2 + 3J 2
Koliko grama sumpor-oksida (IV) nastaje kada se sagori 12,8 sumpora?
Koja je masa magnezijevog oksida nastala kada je 6 g magnezijevih strugotina spaljeno u kisiku?
Koliko grama vode nastaje kada se 9 g vodonika sagori u kiseoniku?
Koliko grama aluminijuma treba uzeti da bi se dobilo 30,6 g aluminijum oksida?
Koliko grama litijuma treba sagorjeti u kisiku da bi se proizvelo 15 g litijum oksida?
Koliko grama natrijum hlorida nastaje kada se 11,5 g natrijuma sagori u hloru?
Koliko molova gvožđa treba uzeti da bi se dobilo 32,5 g gvožđe (III) hlorida?
Koliko grama aluminijuma je potrebno da se dobije 80,1 g aluminijum hlorida?
Koliko molova kalcijum oksida nastaje kada se 8 g kalcija sagori u kiseoniku?
Koliko grama aluminij hlorida nastaje kada se 10,8 g aluminijske folije sagori u hloru?