4. Priroda i vrste hemijskih veza. Kovalentna veza
Aplikacija. Prostorna struktura molekule
Svaki molekul (na primjer, CO 2, H 2 O, NH 3) ili molekularni ion (na primjer, CO 3 2 −, H 3 O +, NH 4 +) ima određeni kvalitativni i kvantitativni sastav, kao i strukturu ( geometrija). Geometrija molekula nastaje zbog fiksnog relativnu poziciju atoma i vrijednosti uglova veze.
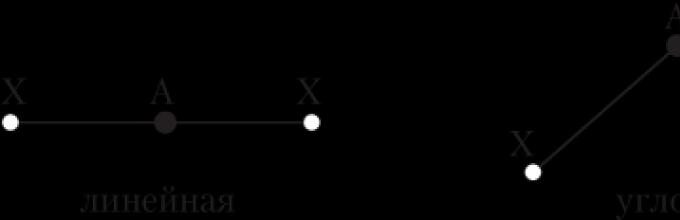
Ugao veze je ugao između zamišljenih pravih linija koje prolaze kroz jezgra hemijski povezanih atoma. Također možemo reći da je to ugao između dvije linije veze koje imaju zajednički atom.
Linija veze je linija koja povezuje jezgra dva hemijski vezana atoma.
Samo u slučaju dvoatomskih molekula (H 2, Cl 2 itd.) ne postavlja se pitanje njihove geometrije – one su uvijek linearne, tj. jezgra atoma nalaze se na istoj pravoj liniji. Struktura složenijih molekula može biti drugačija geometrijske figure, Na primjer:
- triatomske molekule i joni tipa AX 2 (H 2 O, CO 2, BeCl 2)

- tetraatomske molekule i joni tipa AX 3 (NH 3, BF 3, PCl 3, H 3 O +, SO 3) ili A 4 (P 4, As 4)

- pentaatomske molekule i joni tipa AX 4 (CH 4, XeF 4, GeCl 4)

Postoje čestice i više složena struktura(oktaedar, trigonalna bipiramida, ravni pravilni šestougao). Osim toga, molekuli i ioni mogu imati oblik iskrivljenog tetraedra, nepravilnog trokuta; u molekulima ugaone strukture, vrijednosti α mogu biti različite (90°, 109°, 120°).
Struktura molekula pouzdano se utvrđuje eksperimentalno različitim fizičkim metodama. Da bi se objasnili razlozi za formiranje određene strukture i predvidjela geometrija molekula, razvijeni su različiti teorijski modeli. Najlakši za razumijevanje su model odbijanja valentnih elektronskih parova (OVEP model) i model hibridizacije valentnih atomskih orbitala (GVAO model).
Osnova svih (uključujući dva spomenuta) teorijskih modela koji objašnjavaju strukturu molekula je sljedeća tvrdnja: stabilno stanje molekule (jona) odgovara prostornom rasporedu atomskih jezgara u kojem je međusobno odbijanje elektrona u valenciji sloj je minimalan.
Ovo uzima u obzir odbijanje elektrona koji učestvuju u formiranju hemijske veze (vezni elektroni) i onih koji ne učestvuju (usamljeni parovi elektrona). Uzeto je u obzir da je orbitala vezanog elektronskog para kompaktno koncentrirana između dva atoma i stoga zauzima manje prostora od orbitale usamljenog para elektrona. Iz tog razloga, odbojni efekat nevezujućeg (usamljenog) para elektrona i njegov uticaj na vezne uglove je izraženiji od veznog.
OVEP model. Ova teorija se zasniva na sledećim osnovnim principima (izloženim na pojednostavljen način):
- geometrija molekula određena je samo σ-vezama (ali ne i π-);
- Uglovi između veza zavise od broja usamljenih parova elektrona u centralnom atomu.
Ove odredbe treba razmotriti zajedno, jer se i elektroni kemijske veze i usamljeni parovi elektrona odbijaju, što u konačnici dovodi do formiranja molekularne strukture u kojoj je ovo odbijanje minimalno.
Razmotrimo geometriju nekih molekula i jona sa stanovišta OVEP metode; elektroni σ veze će biti označeni sa dve tačke (:), usamljeni parovi elektrona konvencionalnim simbolom ( ili ) ili crticom.
Počnimo s molekulom metana CH4 od pet atoma. U ovom slučaju, centralni atom (ovaj ugljik) je u potpunosti iscrpio svoje valentne mogućnosti i ne sadrži usamljene parove valentnih elektrona, tj. sva četiri valentna elektrona formiraju četiri σ veze. Kako bi elektroni σ veze trebali biti pozicionirani jedan u odnosu na drugi tako da odbijanje između njih bude minimalno? Očigledno, pod uglom od 109°, tj. duž linija usmjerenih na vrhove imaginarnog tetraedra, u čijem se središtu nalazi atom ugljika. U ovom slučaju, elektroni koji učestvuju u formiranju veze su što dalje jedan od drugog (za kvadratnu konfiguraciju, udaljenost između ovih elektrona veze je veća, a međuelektronsko odbijanje je manje). Iz tog razloga, molekul metana, kao i molekuli CCl 4, CBr 4, CF 4, imaju oblik pravilni tetraedar(rečeno je da ima tetraedarsku strukturu):

Amonijum kation NH + 4 i anjon BF 4 − imaju istu strukturu, jer atomi azota i bora formiraju svaki po četiri σ veze i nemaju usamljene parove elektrona.
Razmotrimo strukturu tetraatomske molekule amonijaka NH 3. Molekula amonijaka ima tri para veznih elektrona i jedan usamljeni par elektrona na atomu azota, tj. takođe četiri para elektrona. Međutim, hoće li vezni ugao ostati na 109°? Ne, budući da usamljeni par elektrona, koji zauzimaju veći volumen u prostoru, ima snažan odbojni učinak na elektrone σ veze, što dovodi do blagog smanjenja veznog ugla, u ovom slučaju ovaj kut iznosi približno 107°. Molekula amonijaka ima oblik trigonalne piramide (piramidalna struktura):

Tetraatomski hidronijev ion H 3 O + također ima piramidalnu strukturu: atom kisika formira tri σ veze i sadrži jedan usamljeni par elektrona.
U molekulu BF 3 sa četiri atoma, broj σ veza je također tri, ali atom bora nema usamljene parove elektrona. Očigledno, međuelektronsko odbijanje će biti minimalno ako molekula BF 3 ima oblik pravilnog ravnog trokuta sa veznim uglom od 120°:

Molekuli BCl 3, BH 3, AlH 3, AlF 3, AlCl 3, SO 3 imaju istu strukturu i iz istih razloga.
Kakvu će strukturu imati molekul vode?
Triatomska molekula vode ima četiri para elektrona, ali samo dva od njih su elektroni σ-veze, a preostala dva su usamljena para elektrona atoma kisika. Odbojni efekat dva usamljena para elektrona u molekuli H 2 O je jači nego u molekuli amonijaka sa jednim usamljenim parom, stoga je vezni ugao H–O–H manji od ugla H–N–H u molekuli amonijaka : u molekuli vode ugao veze je približno 105°:

Molekul CO 2 (O=C=O) također ima dva para veznih elektrona (razmatramo samo σ veze), međutim, za razliku od molekula vode, atom ugljika nema usamljene parove elektrona. Očigledno je da će odbijanje između parova elektrona u ovom slučaju biti minimalno ako se nalaze pod uglom od 180°, tj. at linearni oblik CO 2 molekuli:
Molekuli BeH 2, BeF 2, BeCl 2 imaju sličnu strukturu i iz istih razloga. U troatomskoj SO 2 molekuli, centralni atom (atom sumpora) također formira dvije σ veze, ali ima usamljeni par elektrona, stoga molekula sumpor(IV) oksida ima ugaonu strukturu, ali je ugao veze u njemu veći od u molekuli vode (atom kisika dva usamljena para elektrona, a atom sumpora ima samo jedan):

Neki troatomski molekuli ABC sastava (na primjer, H–C≡N, Br–C≡N, S=C=Te, S=C=O) također imaju linearnu strukturu, u kojoj centralni atom nema osam parovi elektrona. Ali molekul HClO ima ugaonu strukturu (α ≈ 103°), budući da centralni atom, atom kiseonika, sadrži dva usamljena para elektrona.
Koristeći OVEP model, također možete predvidjeti strukturu molekula organska materija. Na primjer, u molekuli acetilena C 2 H 2, svaki atom ugljika formira dvije σ veze, a atomi ugljika nemaju usamljene parove elektrona; stoga, molekul ima linearnu strukturu H–C≡C–H.
U molekuli etena C 2 H 4 svaki atom ugljika formira tri σ veze, što, u odsustvu usamljenih parova elektrona na atomima ugljika, dovodi do trokutastog rasporeda atoma oko svakog atoma ugljika:
U tabeli 4.2 sumira neke podatke o strukturi molekula i jona.
Tabela 4.2
Odnos između strukture molekula (jona) i broja σ -veze i usamljeni parovi elektrona centralnog atoma
| Vrsta molekula (jon) | Broj σ veza koje formira centralni atom | Broj usamljenih parova elektrona | Struktura, vezni ugao | Primjeri čestica (središnji atom istaknut) |
|---|---|---|---|---|
| AB 2 | 2 | 0 | Linearno, α = 180° | CO 2 , Be H 2 , HC N , Be Cl 2 , C 2 H 2 , N 2 O , C S 2 |
| 1 | Ugaoni, 90°< α < 120° | Sn Cl 2, S O 2, N O 2 − | ||
| 2 | Ugaoni, α< 109° | H 2 O , O F 2 , H 2 S , H 2 Se , S F 2 , Xe O 2 , − | ||
| AB 3 | 3 | 0 | Trouglasti, α ≈ 120° | B F 3, B H 3, B Cl 3, Al F 3, S O 3, C O 3 2 −, N O 3 − |
| 1 | Trigonalna piramida, α< 109° | N H 3 , H 3 O + , N F 3 , S O 3 2 − , P F 3 , P Cl 3 , As H 3 | ||
| AB 4 | 4 | 0 | Tetraedar, α = 109° | N H 4 + , CH 4 , Si H 4 , B F 4 , B H 4 - , S O 4 2 - , A l H 4 - |
GVAO model. Glavni stav ovog modela je da formiranje kovalentnih veza ne uključuje “čiste” valentne s -, p - i d - orbitale, već tzv. hibridne orbitale. Zatim se razmatra hibridizacija koja uključuje samo 2p- i 2s-AO.
Hibridizacija je fenomen miješanja valentnih orbitala, uslijed čega se one usklađuju u obliku i energiji.
Koncept hibridizacije se uvijek koristi kada u formiranju hemijskih veza učestvuju elektroni različitih energetskih podnivoa koji se ne razlikuju mnogo po energiji: 2s i 2p, 4s, 4p i 3d itd.
Hibridna orbitala po obliku nije slična originalnoj 2p- i 2s-AO. Ima oblik nepravilne trodimenzionalne osmice:
Kao što vidimo, hibridni AO su izduženiji, pa se mogu bolje preklapati i formirati jače kovalentne veze. Kada se hibridne orbitale preklapaju, formiraju se samo σ veze; Zbog svog specifičnog oblika, hibridni AO ne učestvuju u formiranju π-veza (samo nehibridne AO formiraju π-veze). Broj hibridnih orbitala je uvijek jednak broju početnih AO koji učestvuju u hibridizaciji. Hibridne orbitale moraju biti orijentirane u prostoru na način da osiguraju njihovu maksimalnu udaljenost jedna od druge. U ovom slučaju, odbijanje elektrona koji se nalaze na njima (vezujući i nevezujući) bit će minimalno; energija cijelog molekula će također biti minimalna.
GVAO model pretpostavlja da hibridizacija uključuje orbitale sa sličnim energetskim vrijednostima (tj. valentne orbitale) i dovoljno velikom gustoćom elektrona. Gustoća elektrona orbitale opada kako njena veličina raste, pa je uloga u hibridizaciji posebno značajna za molekule elemenata malih perioda.
Treba imati na umu da GVAO nije stvaran fizički fenomen, ali zgodan koncept (matematički model) koji vam omogućava da opišete strukturu nekih molekula. Formiranje hibridnih AO nije otkriveno nijednom fizikalnom metodom. Ipak, teorija hibridizacije ima određeno fizičko opravdanje.
Razmotrimo strukturu molekula metana. Poznato je da molekula CH4 ima oblik pravilnog tetraedra sa atomom ugljika u centru; sve četiri veze C–H nastaju razmjenskim mehanizmom i imaju istu energiju i dužinu, tj. su ekvivalentni. Sasvim je jednostavno objasniti prisustvo četiri nesparena elektrona u atomu ugljika, uz pretpostavku njegovog prijelaza u pobuđeno stanje:

Međutim, ovaj proces ni na koji način ne objašnjava ekvivalentnost sve četiri veze C–H, jer prema gornjoj shemi tri od njih nastaju uz učešće 2p-AO atoma ugljika, jedna uz učešće 2s-AO, a oblik i energija 2p i 2s-AO su različiti.
Da bi objasnio ovu i druge slične činjenice, L. Pauling je razvio koncept GVAO. Pretpostavlja se da do miješanja orbitala dolazi u trenutku stvaranja hemijskih veza. Ovaj proces zahtijeva utrošak energije za uparivanje elektrona, koji se, međutim, kompenzira oslobađanjem energije kada hibridni AO formiraju jače (u poređenju s nehibridnim) vezama.
Na osnovu prirode i broja AO uključenih u hibridizaciju, razlikuje se nekoliko tipova.
U slučaju sp 3 hibridizacije, jedna s i tri p orbitale se miješaju (otuda naziv vrste hibridizacije). Za atom ugljika, proces se može predstaviti na sljedeći način:
1 s 2 2 s 2 2 p x 1 2 p y 1 → tranzicija elektrona 1 s 2 2 s 1 2 p x 1 2 p y 1 2 p z 1 → hibridizacija 1 s 2 2 (s p 3) 4
ili koristeći elektronske konfiguracije:

Četiri sp 3 -hibridna AO zauzimaju srednju poziciju u energiji između 2p i 2s AO.
Shema sp 3 hibridizacije može se predstaviti korištenjem slika AO oblika atoma ugljika:

Dakle, kao rezultat sp 3 hibridizacije, formiraju se četiri hibridne orbitale, od kojih svaka sadrži nespareni elektron. Ove orbitale se nalaze pod uglom od 109°28′ u prostoru, što osigurava minimalno odbijanje elektrona koji se nalaze na njima. Ako povežete vrhove hibridnih orbitala, dobijate trodimenzionalni lik - tetraedar. Iz tog razloga, molekuli sastava AX 4 (CH 4, SiH 4, CCl 4 itd.), u kojima se realizuje ova vrsta hibridizacije, imaju oblik tetraedra.
Koncept sp 3 hibridizacije AO takođe dobro objašnjava strukturu molekula H 2 O i NH 3 . Pretpostavlja se da 2s - i 2p -AO atoma dušika i kisika učestvuju u hibridizaciji. U ovim atomima broj valentnih elektrona (5 odnosno 6) je veći od broja sp 3 -hibridnih AO (4), stoga neki hibridni AO sadrže nesparene elektrone, a neki usamljene parove elektrona:

Vidimo da se u atomu dušika usamljeni par elektrona nalazi na jednom hibridnom AO, a u atomu kisika - na dva. Samo AO sa nesparenim elektronima učestvuju u stvaranju veza sa atomima vodonika, a usamljeni parovi elektrona će imati odbojni efekat (slika 4.5) jedni na druge (u slučaju kiseonika) i na vezne elektrone (za kiseonik i azot). ).

Rice. 4.5. Shema odbojnog djelovanja veznih i nevezujućih orbitala u molekuli amonijaka (a) i vode (b)
Odbijanje je jače u slučaju molekula vode. Pošto atom kiseonika ima dva usamljena para elektrona, odstupanje od idealnog ugla veze za ovu vrstu hibridizacije (109°28′) u molekuli vode je veće nego u molekuli amonijaka (kod molekula H2O i NH3 vezni ugao je 104, 5° i 107°).
Model sp 3 hibridizacije se koristi za objašnjenje strukture dijamanta, silicijuma, NH 4 + i H 3 O + jona, alkana, cikloalkana, itd. U slučaju ugljika, ovaj tip hibridizacije se uvijek koristi kada atom ovog element formira samo σ veze.
U slučaju sp 2 hibridizacije, jedna s i dvije p orbitale se miješaju. Razmotrimo ovu vrstu hibridizacije koristeći atom bora kao primjer. Proces je predstavljen pomoću energetskih dijagrama


Tako, kao rezultat sp 2 hibridizacije valentnih orbitala atoma bora, formiraju se tri hibridna AO, usmjerena pod uglom od 120°, a jedna od 2p orbitala ne učestvuje u hibridizaciji. Hibridne orbitale sadrže jedan nespareni elektron, nalaze se u istoj ravni, a ako povežete njihove vrhove, dobijate pravilan trougao. Iz tog razloga, molekuli sastava AX 3 sa sp 2 hibridizacijom orbitala atoma A imaju trokutastu strukturu, kao što je prikazano za molekulu BF 3:

Nehibridni 2p-AO atoma bora je slobodan (nezauzet) i orijentisan okomito na ravan B–F veza, pa je molekula BF 3 akceptor elektrona kada formira kovalentnu vezu prema mehanizmu donor-akceptor kada u interakciji s molekulom amonijaka.
Koncept sp 2 hibridizacije koristi se za objašnjenje prirode dvostruke veze ugljik-ugljik u alkenima, strukture benzena i grafita, tj. u slučajevima kada atom ugljika formira tri σ i jednu π vezu.
Prostorni raspored orbitala atoma ugljika za sp 2 hibridizaciju izgleda ovako: nehibridni 2p AO je orijentisan okomito na ravan u kojoj se nalaze hibridne orbitale (i hibridni i nehibridni AO sadrže nespareni elektron) .

Razmotrimo stvaranje hemijskih veza u molekulu etilena H 2 C=CH 2. U njemu se hibridni AO preklapaju jedan s drugim i sa 1s-AO atoma vodika, formirajući pet σ veza: jednu C–C i četiri C–H. Nehibridni 2p-AO se preklapaju bočno i formiraju π vezu između atoma ugljika (slika 4.6).

Rice. 4.6. Šema formiranja σ-veze (a) i π-veze (b) u molekuli etilena
U slučaju sp hibridizacije, jedna s i jedna p orbitala se miješaju. Razmotrimo ovu vrstu hibridizacije na primjeru atoma berilija. Zamislimo proces hibridizacije koristeći energetski dijagram:

i sa slikom oblika orbitala
Tako, kao rezultat sp-hibridizacije, formiraju se dva hibridna AO, od kojih svaki sadrži po jedan nespareni elektron. Dva 2p-AO ne učestvuju u hibridizaciji i, u slučaju berilija, ostaju prazna. Hibridne orbitale su orijentisane pod uglom od 180°, stoga molekuli tipa AX 2 sa sp-hibridizacijom orbitala atoma A imaju linearnu strukturu (slika 4.7).

Rice. 4.7. Prostorna struktura molekula BeCl 2
Koristeći model sp-hibridizacije orbitala atoma ugljika, objašnjena je priroda trostruke veze u molekulima alkina. U ovom slučaju, dva hibridna i dva nehibridna 2p-AO (prikazano horizontalnim strelicama →, ←) sadrže po jedan nespareni elektron:

U molekuli acetilena HC≡CH, zbog hibridnih AO, formiraju se σ-veze C–H i C–C:

Hibridni 2p-AO se preklapaju u dve okomite ravni i formiraju dve π veze između atoma ugljenika (slika 4.8).

Rice. 4.8. Šematski prikaz π-veza (a) i ravni π-veza (b) u molekuli acetilena (valovita linija pokazuje bočno preklapanje 2p-AO atoma ugljika)
Koncept sp-hibridizacije orbitala atoma ugljenika omogućava objašnjenje stvaranja hemijskih veza u molekulima karbina, CO i CO 2 , propadijena (CH 2 =C=CH 2), tj. u svim slučajevima kada atom ugljika formira dvije σ i dvije π veze.
Glavne karakteristike razmatranih tipova hibridizacije i geometrijske konfiguracije molekula koje odgovaraju nekim tipovima hibridizacije orbitala centralnog atoma A (uzimajući u obzir uticaj nevezujućih elektronskih parova) prikazane su u tabeli. 4.3 i 4.4.
Tabela 4.3
Glavne karakteristike različite vrste hibridizacija
Upoređujući podatke u tabeli. 4.2 i 4.4, možemo zaključiti da oba modela – OVEP i GVAO – dovode do istih rezultata u pogledu strukture molekula.
Tabela 4.4
Vrste prostorne konfiguracije molekula koje odgovaraju određenim tipovima hibridizacije
Hemijska veza
Sve interakcije koje dovode do spajanja hemijskih čestica (atoma, molekula, jona, itd.) u supstance se dele na hemijske veze i međumolekularne veze (intermolekularne interakcije).
Hemijske veze- veze direktno između atoma. Postoje jonske, kovalentne i metalne veze.
Intermolekularne veze- veze između molekula. To su vodikove veze, ion-dipol veze (zbog stvaranja ove veze, na primjer, dolazi do stvaranja hidratacijske ljuske iona), dipol-dipol (zbog stvaranja ove veze spajaju se molekuli polarnih tvari na primjer, u tekućem acetonu) itd.
Jonska veza- hemijska veza nastala zbog elektrostatičke privlačnosti suprotno nabijenih jona. U binarnim jedinjenjima (spojenjima dva elementa) nastaje kada se veličine povezanih atoma jako razlikuju jedna od druge: neki atomi su veliki, drugi mali - to jest, neki atomi lako odustaju od elektrona, dok drugi teže prihvati ih (obično su to atomi elemenata koji formiraju tipične metale i atomi elemenata koji formiraju tipične nemetale); elektronegativnost takvih atoma je također vrlo različita.
Jonska veza je neusmjerena i nezasićena.
Kovalentna veza- hemijska veza koja nastaje zbog formiranja zajedničkog para elektrona. Kovalentna veza nastaje između malih atoma istog ili sličnog polumjera. Neophodan uslov je prisustvo nesparenih elektrona u oba vezana atoma ( mehanizam razmene) ili usamljeni par na jednom atomu i slobodna orbitala na drugom (mehanizam donor-akceptor):
| A) | H· + ·H H:H | H-H | H 2 | (jedan zajednički par elektrona; H je monovalentan); |
| b) | NN | N 2 | (tri zajednička para elektrona; N je trovalentan); | |
| V) | H-F | HF | (jedan zajednički par elektrona; H i F su jednovalentni); | |
| G) | NH4+ | (četiri zajednička para elektrona; N je četverovalentan) |
- Na osnovu broja zajedničkih elektronskih parova, kovalentne veze se dijele na
- jednostavno (single)- jedan par elektrona,
- duplo- dva para elektrona,
- trostruki- tri para elektrona.
Dvostruke i trostruke veze nazivaju se višestrukim vezama.
Prema raspodjeli elektronske gustine između vezanih atoma kovalentna veza podijeljena nepolarni I polar. Nepolarna veza nastaje između identičnih atoma, polarna - između različitih.
Elektronegativnost- mjera sposobnosti atoma u tvari da privuče uobičajene elektronske parove.
Elektronski parovi polarnih veza su pomaknuti prema elektronegativnijim elementima. Sam pomak elektronskih parova naziva se polarizacija veze. Djelomični (višak) naboja koji nastaju tokom polarizacije označeni su + i -, na primjer: .
Na osnovu prirode preklapanja elektronskih oblaka ("orbitala"), kovalentna veza se dijeli na -vezu i -vezu.
-Veza nastaje usled direktnog preklapanja elektronskih oblaka (duž prave linije koja spaja atomska jezgra), -veza nastaje usled bočnog preklapanja (sa obe strane ravni u kojoj leže atomska jezgra).
Kovalentna veza je usmjerena i zasićena, kao i polarizabilna.
Hibridizacijski model se koristi za objašnjenje i predviđanje međusobnog smjera kovalentnih veza.
Hibridizacija atomskih orbitala i elektronskih oblaka- pretpostavljeno poravnanje atomskih orbitala u energiji, i elektronskih oblaka u obliku kada atom formira kovalentne veze.
Tri najčešće vrste hibridizacije su: sp-, sp 2 i sp 3 -hibridizacija. Na primjer:
sp-hibridizacija - u molekulima C 2 H 2, BeH 2, CO 2 (linearna struktura);
sp 2-hibridizacija - u molekulima C 2 H 4, C 6 H 6, BF 3 (ravni trouglasti oblik);
sp 3-hibridizacija - u molekulima CCl 4, SiH 4, CH 4 (tetraedarski oblik); NH 3 (piramidalni oblik); H 2 O (ugaoni oblik).
Metalni priključak- hemijska veza nastala deljenjem valentnih elektrona svih vezanih atoma metalnog kristala. Kao rezultat, formira se jedan elektronski oblak kristala, koji se lako kreće pod utjecajem električnog napona - otuda i visoka električna provodljivost metala.
Metalna veza nastaje kada su atomi koji se vezuju veliki i stoga imaju tendenciju da odustanu od elektrona. Jednostavne supstance sa metalnom vezom su metali (Na, Ba, Al, Cu, Au itd.), složene supstance su intermetalna jedinjenja (AlCr 2, Ca 2 Cu, Cu 5 Zn 8 itd.).
Metalna veza nema usmjerenost ili zasićenost. Takođe se čuva u metalnim topljenjima.
Vodikova veza- međumolekularna veza nastala zbog djelomičnog prihvatanja para elektrona iz visoko elektronegativnog atoma od strane atoma vodika s velikim pozitivnim djelomičnim nabojem. Nastaje u slučajevima kada jedna molekula sadrži atom sa usamljenim parom elektrona i visokom elektronegativnošću (F, O, N), a druga sadrži atom vodika vezan visokopolarnom vezom za jedan od takvih atoma. Primjeri međumolekularnih vodikovih veza:
H—O—H OH 2 , H—O—H NH 3 , H—O—H F—H, H—F H—F.
Intramolekularne vodikove veze postoje u polipeptidnim molekulima, nukleinske kiseline, proteini itd.
Mjera snage bilo koje veze je energija veze.
Energija komunikacije- energija potrebna za prekid date hemijske veze u 1 molu supstance. Mjerna jedinica je 1 kJ/mol.
Energije jonske i kovalentne veze su istog reda, energija vodikovih veza je za red veličine manja.
Energija kovalentne veze zavisi od veličine vezanih atoma (dužine veze) i od višestrukosti veze. Što su atomi manji i što je višestrukost veze veća, to je njena energija veća.
Energija jonske veze zavisi od veličine jona i njihovog naboja. Što su joni manji i što je njihov naboj veći, to je veća energija vezivanja.
Struktura materije
Prema vrsti strukture, sve tvari se dijele na molekularni I nemolekularni. Među organskim supstancama prevladavaju molekularne, a među neorganskim tvarima nemolekularne.
Na osnovu vrste hemijske veze, supstance se dele na supstance sa kovalentnom vezom, supstance sa jonskim vezama (jonske supstance) i supstance sa metalnim vezama (metali).
Supstance s kovalentnim vezama mogu biti molekularne i nemolekularne. To značajno utiče na njihova fizička svojstva.
Molekularne supstance sastoje se od molekula povezanih međusobno slabim međumolekularnim vezama, a to su: H 2, O 2, N 2, Cl 2, Br 2, S 8, P 4 i drugi jednostavne supstance; CO 2, SO 2, N 2 O 5, H 2 O, HCl, HF, NH 3, CH 4, C 2 H 5 OH, organski polimeri i mnoge druge supstance. Ove supstance nemaju veliku čvrstoću, već imaju niske temperature topljenja i ključanja, ne izvoditi struja, neki od njih su rastvorljivi u vodi ili drugim rastvaračima.
Nemolekularne supstance sa kovalentnim vezama ili atomske supstance (dijamant, grafit, Si, SiO 2, SiC i druge) formiraju veoma jake kristale (sa izuzetkom slojevitog grafita), nerastvorljive su u vodi i drugim otapalima, imaju visoko topljenje i tačke ključanja, većina njih ne provode električnu struju (osim grafita, koji je električno provodljiv, i poluvodiča - silicija, germanija itd.)
Sve jonske supstance su prirodno nemolekularne. To su čvrste, vatrostalne tvari, čije otopine i taline provode električnu struju. Mnogi od njih su rastvorljivi u vodi. Treba napomenuti da u jonske supstance ah, čiji se kristali sastoje od kompleksnih jona, postoje i kovalentne veze, na primjer: (Na +) 2 (SO 4 2-), (K +) 3 (PO 4 3-), (NH 4 +)( NO 3-) itd. Atomi koji čine kompleksne jone povezani su kovalentnim vezama.
Metali (tvari s metalnim vezama) veoma raznolike po svojim fizičkim svojstvima. Među njima su tečni (Hg), vrlo meki (Na, K) i vrlo tvrdi metali (W, Nb).
Karakteristično fizička svojstva metali su njihova visoka električna provodljivost (za razliku od poluvodiča, ona opada sa povećanjem temperature), visok toplotni kapacitet i duktilnost (za čiste metale).
U čvrstom stanju, gotovo sve supstance su sastavljene od kristala. Na osnovu vrste strukture i tipa hemijske veze, kristali („kristalne rešetke“) se dele na atomski(kristali nemolekularnih supstanci sa kovalentnim vezama), jonski(kristali jonskih supstanci), molekularni(kristali molekularnih supstanci sa kovalentnim vezama) i metal(kristali supstanci sa metalnom vezom).
Zadaci i testovi na temu „Tema 10. „Hemijsko vezivanje. Struktura materije."
- Vrste hemijskih veza - Struktura materije 8–9
Lekcije: 2 Zadaci: 9 Testovi: 1
- Zadaci: 9 Testovi: 1
Nakon rada na ovoj temi, trebali biste razumjeti sljedeće koncepte: hemijska veza, intermolekularna veza, jonska veza, kovalentna veza, metalni spoj, vodikova veza, jednostruka veza, dvostruka veza, trostruka veza, višestruke veze, nepolarna veza, polarna veza, elektronegativnost, polarizacija veze, - i - veza, hibridizacija atomskih orbitala, energija veze.
Morate znati klasifikaciju supstanci po vrsti strukture, po vrsti hemijske veze, zavisnost svojstava jednostavnih i složene supstance o vrsti hemijske veze i tipu „kristalne rešetke“.
Morate biti u stanju da: odredite vrstu hemijske veze u supstanci, vrstu hibridizacije, sastavite dijagrame formiranja veze, koristite koncept elektronegativnosti, broj elektronegativnosti; znati kako se mijenja elektronegativnost hemijski elementi jedan period i jedna grupa za određivanje polariteta kovalentne veze.
Nakon što se uvjerite da ste naučili sve što vam je potrebno, nastavite s izvršavanjem zadataka. Želimo vam uspjeh.
Preporučeno čitanje:
- O. S. Gabrielyan, G. G. Lysova. Hemija 11. razred. M., Drfa, 2002.
- G. E. Rudzitis, F. G. Feldman. Hemija 11. razred. M., Obrazovanje, 2001.
Opcija 2
dio A:
A 1. Par elemenata između kojih se formira ionska hemijska veza:
a) ugljenik i sumpor, b) vodonik i azot, c) kalijum i kiseonik, d) silicijum i vodonik.
A 2.Formula supstance sa kovalentnom vezom:
a) NaCl, b) HCl, c) BaO, d) Ca 3 N 2.
A 3.Najmanja polarna veza je:
a) C – H, b) C – Cl, c) C – F, d) C – Br.
A 4. Tvrdnja da je δ veza, za razliku od π, je tačna:
a) manje jake, b) nastale kada se atomske orbitale preklapaju bočno,
c) nije kovalentna, d) formirana je aksijalnim preklapanjem atomskih orbitala.
A 5.Supstanca u čijoj molekuli nema π veze:
a) etilen, b) benzen, c) amonijak, d) azot.
A 6. Najjači molekul je:
a) H 2, b) N 2, c) F 2, d) O 2.
A 7. U CO 3 2- jonu, atom ugljika je u sp 2 - hibridnom stanju, pa ion ima oblik:
a) linearni, b) tetraedar, c) trougao, d) oktaedar.
A 8. Atom ugljika ima oksidacijski broj -3 i valenciju 4 kada se kombinuje sa formulom:
a) CO 2, b) C 2 H 6, c) CH 3 Cl, d) CaC 2.
A 9. Atomska kristalna rešetka ima:
a) soda, b) voda, c) dijamant, d) parafin.
A 10. Supstanca između molekula za koju postoji vodikova veza:
a) etan, b) natrijum fluorid, c) ugljen monoksid (4), d) etanol.
A 11. Odaberite grupu elemenata raspoređenih po rastućoj elektronegativnosti:
a) Cl, Si, N, O, b) Si, P, N, F, c) F, Cl, O, Si, d) O, N, F, Cl.
A 12. Postoji kovalentna veza između atoma, formirana donor-akceptorskim mehanizmom u supstanciji, čija je formula:
13.
A 14.Stvaranje vodoničnih veza može se objasniti:
a) rastvorljivost sirćetna kiselina u vodi, b) kiselinska svojstva etanol,
c) visoka tačka topljenja mnogih metala, d) nerastvorljivost metana u vodi.
A 15.Formula supstance sa polarnom kovalentnom vezom:
a) Cl 2, b) KCl, c) NH 3, d) O 2.
dio B:
B 1. Među predloženim, odaberite tvar čija molekula sadrži π veze: H 2, CH 4, Br 2, N 2, H 2 S, CH 3 OH, NH 3. Napišite naziv ove supstance.
B 2. Proces interakcije orbitala elektrona, koji dovodi do njihovog poravnanja u obliku i energiji, naziva se......
B 3. Kako se zove fenomen uvećanja koloidnih čestica i njihovog taloženja iz koloidnog rastvora?
B 4. Navedite primjer tvari čija molekula sadrži tri δ – i jednu π – veze. Imenujte supstancu u nominativu.
B 5. U kojoj su od sljedećih tvari veze najpolarnije: hlorovodonik, fluor, voda, amonijak, sumporovodik. Zapišite odabranu supstancu formulom.
dio C:
Od 1. Pisati strukturne formule sve izomerne supstance sastava C 4 H 8. Imenujte svaku supstancu.
C 2. Napravite strukturne formule supstanci: CHF 3, C 2 H 2 Br 2, O 2.
Compose grafičke formule: Mg 3 N 2, Na 2 SO 4, KHCO 3.
C 3.
Mg 3 N 2, Cl 2, ZnSO 4, KHS, CH 3 Cl, FeOHCl 2, BrO 2, AsO 4 3-, NH 4 +
Test br. 2 “STRUKTURA MATERIJE”.
Opcija 3
dio A:
A 1. Hemijske veze u supstancama čije su formule CH 4 i CaCl 2, respektivno:
a) ionski i kovalentni polarni, b) kovalentni polarni i ionski,
c) kovalentni nepolarni i jonski, d) kovalentni polarni i metalni.
A 2.Polaritet veze je veći u tvari s formulom:
a) Br 2, b) LiBr, c) HBr, d) KBr
A 3.Jonska priroda veze u nizu jedinjenja Li 2 O - Na 2 O - K 2 O - Rb 2 O:
a) raste, b) opada, c) se ne mijenja, d) prvo opada, a zatim raste.
A 4. Postoji kovalentna veza između atoma, formirana donor-akceptorskim mehanizmom u supstanciji, čija je formula:
a) Al(OH) 3, b) [CH 3 NH 3 ]Cl, c) C 2 H 5 OH, d) C 6 H 12 O 6.
A 5.Nekoliko formula za supstance čije molekule sadrže samo δ veze:
a) CH 4 i O 2, b) C 2 H 5 OH i H 2 O, c) N 2 i CO 2, d) HBr i C 2 H 4.
A 6. Najjača veza između njih:
a) C - Cl, b) C - F, c) C - Br, d) C - I.
A 7. Grupa formula spojeva u kojima postoji sličan smjer veza, zbog sp 3 - hibridizacije elektronskih orbitala:
a) CH 4, C 2 H 4, C 2 H 2, b) NH 3, CH 4, H 2 O, c) H 2 O, C 2 H 6, C 6 H 6, d) C 3 H 8, BCl 3, BeCl 2.
A 8. Valentnost i oksidaciono stanje atoma ugljika u molekuli metanola jednaki su:
a) 4 i +4, b) 4 i -2, c) 3 i +2, d) 4 i -3.
A 9. Supstance s ionskom kristalnom rešetkom karakteriziraju:
a) slaba rastvorljivost u vodi, b) visoka tačka ključanja, c) topljivost, d) isparljivost.
A 10. Stvaranje vodikove veze između molekula dovodi do:
a) da se smanje tačke ključanja supstanci, b) da se smanji rastvorljivost supstanci u vodi,
c) do povećanja tačaka ključanja supstanci, d) do povećanja isparljivosti supstanci.
A 11. Formula supstance sa jonskom vezom:
a) NH 3, b) C 2 H 4, c) KH, d) CCl 4.
A 12. U molekulu je prisutna samo δ – veza:
a) dušik, b) etanol, c) etilen, d) ugljični monoksid (4).
13. Molekularna struktura ima supstancu sa formulom:
a) CH 4, b) NaOH, c) SiO 2, d) Al.
A 14.Vodikova veza nastaje između:
a) molekule vode, b) molekule vodonika,
c) molekule ugljovodonika, d) atome metala i atome vodonika.
A 15.Ako snažno promućkate mješavinu biljnog ulja i vode, dobijete:
a) suspenzija, b) emulzija, c) pjena, d) aerosol.
dio B:
B 1. Broj zajedničkih elektronskih parova između atoma broma u molekuli Br 2 je……
B 2. Koje veze čine trostruku vezu u molekulu N 2 (izložite svoj odgovor u nominativu).
B 3. Na čvorovima metalne kristalne rešetke nalaze se…….. .
B 4. Navedite primjer tvari čija molekula sadrži pet δ - i dvije π - veze. Imenujte supstancu u nominativu.
B 5. Koliki je maksimalni broj π veza koje se mogu formirati između dva atoma u molekulu? (predstavite odgovor kao broj)
dio C:
Od 1. Napišite strukturne formule svih izomernih supstanci sastava C 5 H 10 O. Navedite svaku supstancu.
C 2. Napravite strukturne formule supstanci: CHCl 3, C 2 H 2 Cl 2, F 2.
Napravite grafičke formule: AlN, CaSO 4, LiHCO 3.
C 3. Odredite oksidaciono stanje u hemijska jedinjenja i joni:
HNO 3, HClO 4, K 2 SO 3, KMnO 4, CH 3 F, MgOHCl 2, ClO 3 -, CrO 4 2-, NH 4 +
Povezane informacije.
Test br. 2 DKR “STRUKTURA SUPSTANCE”.
A 1. Hemijske veze u supstancama čije su formule CH 4 i CaCl 2, respektivno:
a) ionski i kovalentni polarni, b) kovalentni polarni i ionski,
c) kovalentni nepolarni i jonski, d) kovalentni polarni i metalni.
A 2. Polaritet veze je veći u tvari s formulom:
a) Br 2, b) LiBr, c) HBr, d) KBr
A 3. Jonska priroda veze u nizu jedinjenja Li 2 O - Na 2 O - K 2 O - Rb 2 O:
a) raste, b) opada, c) se ne mijenja, d) prvo opada, a zatim raste.
A 4. Postoji kovalentna veza između atoma, formirana donor-akceptorskim mehanizmom u supstanciji, čija je formula:
a) Al(OH) 3, b) [CH 3 NH 3 ]Cl, c) C 2 H 5 OH, d) C 6 H 12 O 6.
A 5. Nekoliko formula za supstance čije molekule sadrže samo δ veze:
a) CH 4 i O 2, b) C 2 H 5 OH i H 2 O, c) N 2 i CO 2, d) HBr i C 2 H 4.
A 6. Najjača veza između njih:
a) C - Cl, b) C - F, c) C - Br, d) C - I.
A 7. Grupa formula spojeva u kojima postoji sličan smjer veza, zbog sp 3 - hibridizacije elektronskih orbitala:
a) CH 4, C 2 H 4, C 2 H 2, b) NH 3, CH 4, H 2 O, c) H 2 O, C 2 H 6, C 6 H 6, d) C 3 H 8, BCl 3, BeCl 2.
A 8. Valentnost i oksidaciono stanje atoma ugljika u molekuli metanola jednaki su:
a) 4 i +4, b) 4 i -2, c) 3 i +2, d) 4 i -3.
A 9. Supstance s ionskom kristalnom rešetkom karakteriziraju:
a) slaba rastvorljivost u vodi, b) visoka tačka ključanja, c) topljivost, d) isparljivost.
A 10. Stvaranje vodikove veze između molekula dovodi do:
a) da se smanje tačke ključanja supstanci, b) da se smanji rastvorljivost supstanci u vodi,
c) do povećanja tačaka ključanja supstanci, d) do povećanja isparljivosti supstanci.
A 11. Formula supstance sa jonskom vezom:
a) NH 3, b) C 2 H 4, c) KH, d) CCl 4.
A 12
A13. Molekularna struktura ima supstancu sa formulom:
A 14. Vodikova veza nastaje između:
a) molekule vode, b) molekule vodonika,
c) molekule ugljovodonika, d) atome metala i atome vodonika.
A 15. Ako snažno promućkate mješavinu biljnog ulja i vode, dobijete:
a) suspenzija, b) emulzija, c) pjena, d) aerosol.
A 16. Formula supstance sa polarnom kovalentnom vezom:
a) Cl 2, b) KCl, c) NH 3, d) O 2.
A 17. Supstanca između molekula za koju postoji vodikova veza:
a) etanol, b) metan, c) vodonik, d) benzol.
A 18. Broj zajedničkih elektronskih parova u molekuli vodonika:
a) jedan, b) dva, c) tri, d) četiri.
A 19. Polaritet hemijske veze se povećava u nizu jedinjenja čije su formule:
a) NH 3, HI, O 2, b) CH 4, H 2 O, HF, c) PH 3, H 2 S, H 2, d) HCl, CH 4, CL 2.
A 20. Kristalna rešetka natrijum hlorida:
a) atomski, b) jonski, c) metalni, d) molekularni.
A 21. Broj δ i π veza u molekuli acetilena:
a) 5 δ i π - ne, b) 2 δ i 3 π, c) 3 δ i 2 π, d) 4 δ i 1 π.
A 22. Supstance čije su formule: CH 3 – CH 2 – OH i CH 3 – O – CH 3 su:
a) homolozi, b) izomeri, c) ista supstanca, d) i homolozi i izomeri.
A 23. Homolog supstance čija je formula CH 2 = CH – CH 3 je:
a) butan, b) buten - 1, c) buten - 2, d) buten - 1.
A 24. Između atoma nastaje kovalentna nepolarna veza:
a) vodonik i kiseonik, b) ugljenik i vodonik, c) hlor, d) magnezijum.
A 25. U molekulu je prisutna samo δ – veza:
a) dušik, b) etanol, c) etilen, d) ugljični monoksid (4).
A 26. Atom dušika ima valenciju 3 i oksidacijsko stanje 0 u molekuli tvari čija je formula:
a) NH 3, b) N 2, c) CH 3 NO 2, d) N 2 O 3.
A 27. Molekularna struktura ima supstancu sa formulom:
a) CH 4, b) NaOH, c) SiO 2, d) Al.
A28. C–H veza je jača od Si–H veze jer:
a) dužina veze je kraća, b) dužina veze je duža,
c) polaritet veze je manji, d) polaritet veze je veći.
A 29. Postoji kovalentna veza između atoma, formirana donor-akceptorskim mehanizmom u supstanciji, čija je formula:
a) CH 3 NO 2, b) NH 4 NO 2, c) C 5 H 8, d) H 2 O.
A 30. Najmanja polarna veza je:
a) C – H, b) C – Cl, c) C – F, d) C – Br
dio B:
B 1. Broj zajedničkih elektronskih parova između atoma broma u molekuli Br 2 je……
B 2. Koje veze čine trostruku vezu u molekulu N 2 (izložite svoj odgovor u nominativu).
B 3. Na čvorovima metalne kristalne rešetke nalaze se…….. .
B 4. Navedite primjer tvari čija molekula sadrži pet δ - i dvije π - veze. Imenujte supstancu u nominativu.
B 5.
B 6. Broj zajedničkih elektronskih parova između atoma broma u molekuli N2 je……
B 7. Koje veze čine trostruku vezu u molekulu C 2 H 2 (izložite svoj odgovor u nominativu).
B 8. Na čvorovima jonske kristalne rešetke nalaze se........ .
B 9. Navedite primjer tvari čija molekula sadrži pet δ – i jednu π – veza. Imenujte supstancu u nominativu.
B 10. Koliki je maksimalni broj π veza koje se mogu formirati između dva atoma u molekulu? (predstavite odgovor kao broj)
dio C:
Od 1. Napišite strukturne formule svih izomernih supstanci sastava C 5 H 10 O. Navedite svaku supstancu.
C 2 .
Napravite strukturne formule supstanci: CHCl 3, C 2 H 2 Cl 2, F 2.
Napravite grafičke formule: AlN, CaSO 4, LiHCO 3.
C 3.
HNO 3, HClO 4, K 2 SO 3, KMnO 4, CH 3 F, MgOHCl 2, ClO 3 -, CrO 4 2-, NH 4 +
C 4. Napišite strukturne formule svih izomernih supstanci sastava C 4 H 8 O 2. Imenujte svaku supstancu.
C 5 .
Napravite strukturne formule supstanci: CHBr 3, C 2 H 2 Br 2, Br 2.
Napravite grafičke formule: Al 2 S 3, MgSO 4, Li 2 CO 3.
Od 6. Odredite stepen oksidacije hemijskih jedinjenja i jona:
CCl 4, Ba(NO 3) 2, Al 2 S 3, HClO 3, Na 2 Cr 2 O 7, K 2 O 4, SrO 2-, Cr 2 O 3 2
Stranica 1
Novikova Olesya Vladimirovna
Nastavnik hemije i biologije
Opštinska obrazovna ustanova - srednja škola s. Prokudino
Atkarsky okrug
Saratov region.
Test br. 1 na temu: "Struktura supstanci."
Opcija I .
a) hlorovodonik
b) natrijum hidroksid
c) ugljen monoksid (II)
d) ugljen monoksid (IV)
2. U molekulu je prisutna polarna kovalentna veza
a) kiseonik
b) rombični sumpor
d) vodonik
3. Hemijska veza u molekulu ugljičnog dioksida
a) kovalentni nepolarni
b) kovalentno polarni
c) metal
d) jonski
4. Najjači molekul je:
A) H 2 ;
b) N 2 ;
V) F 2 ;
G) O 2 .
5. Supstanca između molekula čija je vodikova veza:
b) natrijum fluorid;
c) ugljen monoksid(II);
d) etanol.
6. Supstance sa jonskom kristalnom rešetkom karakterišu:
a) slaba rastvorljivost u vodi; c) topljivost;
b) visoka tačka ključanja; d) volatilnost.
7. Stvaranje vodikove veze između molekula dovodi do:
a) do smanjenja tačaka ključanja;
b) da se smanji rastvorljivost supstanci u vodi;
c) za povećanje temperature ključanja;
d) da se poveća isparljivost supstanci.
8. Koja supstanca sadrži više kiseonika u Na 2 CO 3 ili u Ca(HCO 3 ) 2?
9. :
A) SO 2 +H 2 O͢͢→
B) Na+H 2 O→
B) Na 2 O+H 2 O→
D) S+H 2 O→
10. Riješite problem :
Koliko vode i natrijum hidroksida je potrebno za pripremu 180 g 15% rastvora?
11 . Riješite problem :
Kolika je masa kiseonika dobijenog frakcionom destilacijom od 200 m 3 (n.s.) vazduh, ako je zapreminski udio kiseonika 0,21?
Test br. 1 na temu „Struktura supstanci“.
Opcija II .
Jonska hemijska veza se javlja u
a) kristalni sumpor
b) čvrsti jod
c) kalcijum jodid
d) fosforov oksid (v)
2. U molekulu je prisutna kovalentna polarna veza
a) sumporna kiselina
b) plastični sumpor
d) rubidijum sulfid
3. Hemijska veza u molekulu vodonika
a) kovalentni nepolarni
b) kovalentno polarni
c) metal
d) jonski
4. Najjače veze u molekulu supstance čija je formula:
A) H 2 S ;
b) H 2 Se ;
V) H 2 O ;
G) H 2 Te .
5. Molekularna struktura ima supstance sa formulom:
A) CH 4 ;
b) NaOH ;
V) SiO 2 ;
G) Al .
6. Vodikova veza nastaje između:
a) molekuli vode; c) molekule ugljovodonika;
b) molekule vodonika; d) atomi metala i atomi vodonika.
7. Stvaranje vodoničnih veza može se objasniti:
a) rastvorljivost sirćetne kiseline u vodi;
b) kisela svojstva etanola;
c) visoka tačka topljenja mnogih metala;
d) nerastvorljivost metana u vodi.
8. Uporedite sadržaj sumpora u Mg(HSO 4) 2 i CuSO 4?
9. Dopuni jednadžbe mogućih reakcija :
A) CO 2 +H 2 O͢͢→
B) Al+H 2 O→
B) Fe+H 2 O→
D) C+H 2 O→
10. Riješite problem:
Potrebno je pripremiti 540 g 12% rastvora azotne kiseline. Izračunajte koliko vode i kiseline treba uzeti za pripremu takvog rastvora.
11. Riješite problem:
Kolika je masa azota dobijena iz 143,6 litara vazduha koji sadrži 78% zapremine azota?