Vjeverice- visoka molekularna težina organska jedinjenja, koji se sastoji od α-aminokiselinskih ostataka.
IN sastav proteina uključuje ugljenik, vodonik, azot, kiseonik, sumpor. Neki proteini formiraju komplekse s drugim molekulima koji sadrže fosfor, željezo, cink i bakar.
Proteini imaju veliku molekulsku masu: albumin jajeta - 36 000, hemoglobin - 152 000, miozin - 500 000. Za poređenje: molekulska težina alkohola je 46, sirćetna kiselina- 60, benzol - 78.
Aminokiselinski sastav proteina
Vjeverice- neperiodični polimeri, čiji su monomeri α-aminokiseline. Tipično, 20 vrsta α-aminokiselina se nazivaju proteinski monomeri, iako se preko 170 njih nalazi u ćelijama i tkivima.
Ovisno o tome da li se aminokiseline mogu sintetizirati u tijelu ljudi i drugih životinja, razlikuju se: neesencijalne aminokiseline- može se sintetizirati; esencijalne aminokiseline- ne može se sintetizirati. Esencijalne aminokiseline moraju ući u organizam sa hranom. Biljke sintetiziraju sve vrste aminokiselina.
Ovisno o sastavu aminokiselina, proteini su: potpuni- sadrže kompletan set aminokiselina; neispravan- neke aminokiseline nedostaju u njihovom sastavu. Ako se proteini sastoje samo od aminokiselina, nazivaju se jednostavno. Ako proteini sadrže pored aminokiselina i neaminokiselinsku komponentu (protetičku grupu), nazivaju se kompleks. Protetičku grupu mogu predstavljati metali (metaloproteini), ugljikohidrati (glikoproteini), lipidi (lipoproteini), nukleinske kiseline (nukleoproteini).
Sve aminokiseline sadrže: 1) karboksilna grupa (-COOH), 2) amino grupa (-NH 2), 3) radikal ili R-grupa (ostatak molekula). Struktura radikala različite vrste aminokiseline - razne. Ovisno o broju amino grupa i karboksilnih grupa uključenih u sastav aminokiselina, razlikuju se: neutralne aminokiseline imaju jednu karboksilnu grupu i jednu amino grupu; bazične aminokiseline imaju više od jedne amino grupe; kiselih aminokiselina ima više od jedne karboksilne grupe.
Aminokiseline su amfoterna jedinjenja , jer u rastvoru mogu delovati i kao kiseline i kao baze. IN vodeni rastvori aminokiseline postoje u različitim jonskim oblicima.
Peptidna veza
Peptidi- organske supstance koje se sastoje od ostataka aminokiselina povezanih peptidnim vezama.
Formiranje peptida nastaje kao rezultat kondenzacijske reakcije aminokiselina. Kada amino grupa jedne aminokiseline stupi u interakciju s karboksilnom grupom druge, između njih nastaje kovalentna veza dušik-ugljik, koja se naziva peptid. U zavisnosti od broja aminokiselinskih ostataka uključenih u peptid, postoje dipeptidi, tripeptidi, tetrapeptidi itd. Formiranje peptidne veze može se ponoviti mnogo puta. To dovodi do formiranja polipeptidi. Na jednom kraju peptida nalazi se slobodna amino grupa (nazvana N-terminus), a na drugom je slobodna karboksilna grupa (nazvana C-terminus).

Prostorna organizacija proteinskih molekula
Obavljanje određenih specifičnih funkcija proteina zavisi od prostorne konfiguracije njihovih molekula; osim toga, energetski je nepovoljno za ćeliju da proteine drži u nesavijenom obliku, u obliku lanca, pa se polipeptidni lanci savijaju, dobijajući određena trodimenzionalna struktura ili konformacija. Postoje 4 nivoa prostorna organizacija proteini.
Primarna struktura vjeverica- redoslijed rasporeda aminokiselinskih ostataka u polipeptidnom lancu koji čini proteinski molekul. Veza između aminokiselina je peptidna veza.

Ako se proteinska molekula sastoji od samo 10 aminokiselinskih ostataka, tada je taj broj teoretski moguće opcije proteinski molekuli koji se razlikuju po redoslijedu izmjene aminokiselina - 10 20. Sa 20 aminokiselina, od njih možete napraviti još raznovrsnije kombinacije. U ljudskom tijelu pronađeno je oko deset hiljada različitih proteina, koji se razlikuju kako jedni od drugih, tako i od proteina drugih organizama.
To je primarna struktura proteinske molekule koja određuje svojstva proteinskih molekula i njihovu prostornu konfiguraciju. Zamjena samo jedne aminokiseline drugom u polipeptidnom lancu dovodi do promjene svojstava i funkcija proteina. Na primjer, zamjena šeste glutaminske amino kiseline valinom u β-podjedinici hemoglobina dovodi do činjenice da molekula hemoglobina kao cjelina ne može obavljati svoju glavnu funkciju - transport kisika; U takvim slučajevima, osoba razvija bolest koja se zove anemija srpastih ćelija.
Sekundarna struktura- naređeno savijanje polipeptidnog lanca u spiralu (izgleda kao produžena opruga). Zavoji spirale su ojačani vodoničnim vezama koje nastaju između karboksilnih grupa i amino grupa. Gotovo sve CO i NH grupe učestvuju u formiranju vodoničnih veza. Oni su slabiji od peptidnih, ali, ponovljeni mnogo puta, daju stabilnost i krutost ovoj konfiguraciji. Na nivou sekundarne strukture nalaze se proteini: fibroin (svila, paučina), keratin (kosa, nokti), kolagen (tetive).



Tercijarna struktura- pakovanje polipeptidnih lanaca u globule koje nastaje usled pojave hemijske veze(vodonik, jonski, disulfid) i uspostavljanje hidrofobnih interakcija između radikala aminokiselinskih ostataka. Glavnu ulogu u formiranju tercijarne strukture imaju hidrofilno-hidrofobne interakcije. U vodenim otopinama, hidrofobni radikali imaju tendenciju da se sakriju od vode, grupirajući se unutar globule, dok hidrofilni radikali, kao rezultat hidratacije (interakcija s vodenim dipolima), imaju tendenciju da se pojave na površini molekule. U nekim proteinima tercijarna struktura je stabilizirana disulfidnim kovalentnim vezama formiranim između atoma sumpora dva cisteinska ostatka. Na nivou tercijarne strukture nalaze se enzimi, antitela i neki hormoni.

Kvartarna struktura karakterističan za složene proteine čije molekule čine dvije ili više globula. Podjedinice se drže u molekulu jonskim, hidrofobnim i elektrostatičkim interakcijama. Ponekad, tokom formiranja kvartarne strukture, između podjedinica nastaju disulfidne veze. Najistraženiji protein sa kvartarnom strukturom je hemoglobin. Formiraju ga dvije α-podjedinice (141 aminokiselinski ostatak) i dvije β-podjedinice (146 aminokiselinskih ostataka). Uz svaku podjedinicu je povezan molekul hema koji sadrži željezo.
Ako iz nekog razloga prostorna konformacija proteina odstupa od normalne, protein ne može obavljati svoje funkcije. Na primjer, uzrok "bolesti kravljeg ludila" (spongiformna encefalopatija) je abnormalna konformacija priona, površinskih proteina nervnih ćelija.
Osobine proteina
Sastav aminokiselina i struktura proteinske molekule to određuju svojstva. Proteini kombinuju bazična i kisela svojstva, određena radikalima aminokiselina: što je više kiselih aminokiselina u proteinu, to su njegova kisela svojstva izraženija. Određuje se sposobnost doniranja i dodavanja H+ puferska svojstva proteina; Jedan od najmoćnijih pufera je hemoglobin u crvenim krvnim zrncima, koji održava pH krvi na konstantnom nivou. Postoje rastvorljivi proteini (fibrinogen), a postoje i netopivi proteini koji obavljaju mehaničke funkcije (fibroin, keratin, kolagen). Postoje proteini koji su hemijski aktivni (enzimi), postoje hemijski neaktivni proteini koji su otporni na različite uslove okoline i oni koji su izuzetno nestabilni.
Vanjski faktori (toplina, ultraljubičasto zračenje, teški metali i njihove soli, pH promjene, zračenje, dehidracija)
može uzrokovati poremećaj strukturne organizacije proteinske molekule. Proces gubitka trodimenzionalne konformacije svojstvene datoj proteinskoj molekuli naziva se denaturacija. Uzrok denaturacije je kidanje veza koje stabiliziraju određenu proteinsku strukturu. U početku se prekidaju najslabije veze, a kako uslovi postaju strožiji, prekidaju se i one jače. Stoga se prvo gube kvartarne, zatim tercijarne i sekundarne strukture. Promjena prostorne konfiguracije dovodi do promjene svojstava proteina i, kao rezultat, onemogućuje proteinu da obavlja svoje inherentne biološke funkcije. Ako denaturacija nije praćena uništavanjem primarne strukture, onda može biti reverzibilan, u ovom slučaju dolazi do samooporavka konformacije karakteristične za protein. Na primjer, proteini membranskih receptora prolaze kroz takvu denaturaciju. Proces obnavljanja strukture proteina nakon denaturacije naziva se renaturacija. Ako je obnova prostorne konfiguracije proteina nemoguća, onda se naziva denaturacija nepovratan.
Funkcije proteina
| Funkcija | Primjeri i objašnjenja |
|---|---|
| Izgradnja | Proteini su uključeni u formiranje ćelijskih i ekstracelularnih struktura: dio su ćelijskih membrana (lipoproteini, glikoproteini), kose (keratin), tetiva (kolagen) itd. |
| Transport | Krvni protein hemoglobin vezuje kisik i prenosi ga iz pluća u sva tkiva i organe, a iz njih prenosi ugljični dioksid u pluća; Sastav ćelijskih membrana uključuje posebne proteine koji osiguravaju aktivan i strogo selektivan prijenos određenih tvari i iona iz stanice u vanjsko okruženje i natrag. |
| Regulatorno | Proteinski hormoni učestvuju u regulaciji metaboličkih procesa. Na primjer, hormon inzulin reguliše razinu glukoze u krvi, potiče sintezu glikogena i povećava stvaranje masti iz ugljikohidrata. |
| Zaštitni | Kao odgovor na prodor stranih proteina ili mikroorganizama (antigena) u tijelo nastaju posebni proteini - antitijela koja ih mogu vezati i neutralizirati. Fibrin, nastao iz fibrinogena, pomaže u zaustavljanju krvarenja. |
| Motor | Kontraktilni proteini aktin i miozin osiguravaju kontrakciju mišića kod višećelijskih životinja. |
| Signal | U površinsku membranu ćelije ugrađeni su proteinski molekuli koji su sposobni da promene svoju tercijarnu strukturu kao odgovor na faktore okoline, primajući na taj način signale iz spoljašnje sredine i prenoseći komande ćeliji. |
| Skladištenje | U tijelu životinja, proteini se po pravilu ne pohranjuju, s izuzetkom albumina iz jaja i mliječnog kazeina. Ali zahvaljujući proteinima, neke tvari se mogu pohraniti u tijelu; na primjer, tokom razgradnje hemoglobina, željezo se ne uklanja iz tijela, već se skladišti, formirajući kompleks s proteinom feritinom. |
| Energija | Kada se 1 g proteina razgradi u finalne proizvode, oslobađa se 17,6 kJ. Prvo se proteini razgrađuju na aminokiseline, a zatim na konačne proizvode - vodu, ugljični dioksid i amonijak. Međutim, proteini se koriste kao izvor energije samo kada se potroše drugi izvori (ugljikohidrati i masti). |
| Katalitički | Jedna od najvažnijih funkcija proteina. Obezbeđuju ga proteini - enzimi koji ubrzavaju biohemijske reakcije koje se dešavaju u ćelijama. Na primjer, ribuloza bifosfat karboksilaza katalizira fiksaciju CO 2 tokom fotosinteze. |
Enzimi
Enzimi, ili enzimi, su posebna klasa proteina koji su biološki katalizatori. Zahvaljujući enzimima, biohemijske reakcije se odvijaju ogromnom brzinom. Brzina enzimskih reakcija je desetine hiljada puta (a ponekad i milione) veća od brzine reakcija koje se odvijaju uz učešće anorganskih katalizatora. Naziva se supstanca na koju enzim djeluje supstrat.
Enzimi su globularni proteini, strukturne karakteristike enzimi se mogu podijeliti u dvije grupe: jednostavne i složene. Jednostavni enzimi su jednostavni proteini, tj. sastoje se samo od aminokiselina. Kompleksni enzimi su kompleksni proteini, tj. Osim proteinskog dijela, sadrže i grupu neproteinske prirode - kofaktor. Neki enzimi koriste vitamine kao kofaktore. Molekul enzima sadrži poseban dio koji se naziva aktivni centar. Aktivan centar- mali dio enzima (od tri do dvanaest aminokiselinskih ostataka), gdje dolazi do vezivanja supstrata ili supstrata kako bi se formirao kompleks enzim-supstrat. Po završetku reakcije, kompleks enzim-supstrat se razlaže na enzim i produkt(e) reakcije. Neki enzimi imaju (osim aktivnih) alosterični centri- područja na koja su pričvršćeni regulatori brzine enzima ( alosterični enzimi).

Reakcije enzimske katalize karakteriše: 1) visoka efikasnost, 2) stroga selektivnost i smer delovanja, 3) specifičnost supstrata, 4) fina i precizna regulacija. Supstrat i specifičnost reakcije enzimske katalize objašnjeni su hipotezama E. Fischera (1890) i D. Koshlanda (1959).
E. Fisher (hipoteza ključ-brava) sugerira da prostorne konfiguracije aktivnog mjesta enzima i supstrata moraju tačno odgovarati jedna drugoj. Supstrat se poredi sa "ključem", enzim sa "bravom".
D. Koshland (hipoteza o rukavicama) sugerira da se prostorna korespondencija između strukture supstrata i aktivnog centra enzima stvara samo u trenutku njihove međusobne interakcije. Ova hipoteza se još naziva hipoteza indukovane korespondencije.
Brzina enzimskih reakcija zavisi od: 1) temperature, 2) koncentracije enzima, 3) koncentracije supstrata, 4) pH vrednosti. Treba naglasiti da s obzirom da su enzimi proteini, njihova aktivnost je najveća kada je fiziološki normalnim uslovima.
Većina enzima može raditi samo na temperaturama između 0 i 40°C. Unutar ovih granica, brzina reakcije raste približno 2 puta sa svakih 10 °C porasta temperature. Na temperaturama iznad 40 °C, protein podliježe denaturaciji i aktivnost enzima opada. Na temperaturama blizu nule, enzimi se inaktiviraju.
Kako se količina supstrata povećava, brzina enzimske reakcije raste sve dok se broj molekula supstrata ne izjednači sa brojem molekula enzima. Daljnjim povećanjem količine supstrata, brzina se neće povećati, jer su aktivni centri enzima zasićeni. Povećanje koncentracije enzima dovodi do povećane katalitičke aktivnosti, jer veći broj molekula supstrata prolazi kroz transformaciju u jedinici vremena.

Za svaki enzim postoji optimalna pH vrijednost pri kojoj ispoljava maksimalnu aktivnost (pepsin - 2,0, pljuvačka amilaza - 6,8, pankreatična lipaza - 9,0). Pri višim ili nižim pH vrijednostima, aktivnost enzima se smanjuje. S naglim promjenama pH, enzim denaturira.
Brzina alosteričnih enzima regulirana je supstancama koje se vežu za alosterične centre. Ako ove tvari ubrzavaju reakciju, nazivaju se aktivatori, ako uspore - inhibitori.
Klasifikacija enzima
Prema vrsti hemijskih transformacija koje kataliziraju, enzimi se dijele u 6 klasa:
- oksireduktaze(prijenos atoma vodika, kisika ili elektrona s jedne supstance na drugu - dehidrogenaza),
- transferaze(prijenos metilne, acilne, fosfatne ili amino grupe s jedne supstance na drugu - transaminaza),
- hidrolaze(reakcije hidrolize u kojima se iz supstrata formiraju dva produkta - amilaza, lipaza),
- lyases(nehidrolitičko dodavanje na supstrat ili odvajanje grupe atoma od njega, pri čemu se mogu prekinuti C-C, C-N, C-O, C-S veze - dekarboksilaza),
- izomeraze(intramolekulsko preuređenje - izomeraza),
- ligaze(veza dvaju molekula kao rezultat formiranja C-C konekcije, C-N, C-O, C-S - sintetaza).
Klase se zauzvrat dijele na podklase i potklase. U toku međunarodna klasifikacija Svaki enzim ima specifičan kod, koji se sastoji od četiri broja odvojena tačkama. Prvi broj je klasa, drugi je potklasa, treći je potklasa, četvrti je serijski broj enzim u ovoj podklasi, na primjer, kod arginaze je 3.5.3.1.
Idi predavanja br. 2"Struktura i funkcije ugljikohidrata i lipida"
Idi predavanja br. 4„Struktura i funkcije nukleinske kiseline ATP"
Kratki opis:
Fragment udžbenika: Biološka hemija sa vežbama i zadacima: udžbenik / ur. dopisni član RAMS S.E. Severina. M.: GEOTAR-Media, 2011. - 624 str.: ilustr. MODUL 1: STRUKTURA, SVOJSTVA I FUNKCIJE PROTEINA
MODUL 1: STRUKTURA, SVOJSTVA I FUNKCIJE PROTEINA
Struktura modula | Teme |
Modularna jedinica 1 | 1.1. Strukturna organizacija proteina. Faze formiranja konformacije nativnog proteina 1.2. Osnove funkcionisanja proteina. Lijekovi kao ligandi koji utječu na funkciju proteina 1.3. Denaturacija proteina i mogućnost njihove spontane renativacije |
Modularna jedinica 2 | 1.4. Značajke strukture i funkcioniranja oligomernih proteina na primjeru hemoglobina 1.5. Održavanje konformacije nativnog proteina u ćelijskim uslovima 1.6. Raznolikost proteina. Porodice proteina na primjeru imunoglobulina 1.7. Fizičko-hemijska svojstva proteina i metode za njihovo odvajanje |
Modularna jedinica 1 STRUKTURNA ORGANIZACIJA MONOMERNIH PROTEINA I OSNOVE NJIHOVOG FUNKCIONISANJA
Ciljevi učenja Biti u stanju:
1. Iskoristiti znanje o strukturnim karakteristikama proteina i ovisnosti funkcija proteina o njihovoj strukturi za razumijevanje mehanizama razvoja nasljednih i stečenih proteinopatija.
2. Objasniti mehanizme terapijskog djelovanja nekih lijekova kao liganada koji stupaju u interakciju s proteinima i mijenjaju njihovu aktivnost.
3. Koristite znanje o strukturi i konformacionoj labilnosti proteina da biste razumeli njihovu strukturnu i funkcionalnu nestabilnost i sklonost denaturaciji u promenljivim uslovima.
4. Objasniti upotrebu denaturirajućih sredstava kao sredstava za sterilizaciju medicinskog materijala i instrumenata, kao i antiseptika.
znati:
1. Nivoi strukturne organizacije proteina.
2. Značaj primarne strukture proteina, koja određuje njihovu strukturnu i funkcionalnu raznolikost.
3. Mehanizam formiranja aktivnog centra u proteinima i njegova specifična interakcija sa ligandom koji je u osnovi funkcionisanja proteina.
4. Primjeri utjecaja egzogenih liganada (lijekova, toksina, otrova) na konformaciju i funkcionalnu aktivnost proteina.
5. Uzroci i posljedice denaturacije proteina, faktori koji uzrokuju denaturaciju.
6. Primjeri upotrebe denaturirajućih faktora u medicini kao antiseptika i sredstava za sterilizaciju medicinskih instrumenata.
TEMA 1.1. STRUKTURNA ORGANIZACIJA PROTEINA. FAZE FORMIRANJA DOMAĆEG
PROTEINSKA KONFORMACIJA
Vjeverice - ovo su heteropolimeri molekule (tj. koji se sastoji od raznih monomera). Proteinski monomeri su 20 vrsta α-aminokiselina međusobno povezanih peptidnim vezama.
Skup i red kombinacije aminokiselina u proteinu određen je strukturom odgovarajućih gena u DNK pojedinca. Svaki protein, u skladu sa svojom specifičnom strukturom, obavlja svoju funkciju. Skup proteina datog organizma ( proteome) određuje njegove fenotipske karakteristike, kao i prisustvo nasljednih bolesti ili predispoziciju za njihov razvoj.
1. Aminokiseline koje čine proteine. Peptidna veza.
Proteini su heteropolimeri izgrađeni od monomera - 20 α-amino kiselina.
Opća formula aminokiselina je prikazana u nastavku.

Aminokiseline se razlikuju po strukturi, veličini i fizičko-hemijskim svojstvima radikala vezanih za α-ugljikov atom. Funkcionalne grupe aminokiselina određuju karakteristike svojstava različitih α-amino kiselina. Radikali koji se nalaze u α-amino kiselinama mogu se podijeliti u nekoliko grupa:
prolin, Za razliku od ostalih 19 proteinskih monomera, on nije aminokiselina, već iminokiselina; radikal u prolinu je povezan i sa α-ugljičnim atomom i imino grupom

Aminokiseline variraju u rastvorljivosti u vodi. To je zbog sposobnosti radikala da komuniciraju s vodom (hidratom).
TO hidrofilna uključuju radikale koji sadrže anionske, kationske i polarne nenabijene funkcionalne grupe.
TO hidrofobna uključuju radikale koji sadrže metilne grupe, alifatske lance ili prstenove.
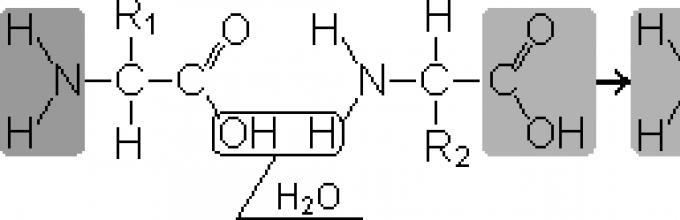
2. Peptidne veze povezuju aminokiseline u peptide. Tokom sinteze peptida, α-karboksilna grupa jedne aminokiseline stupa u interakciju sa α-amino grupom druge amino kiseline i formira peptidna veza:
Proteini su polipeptidi, tj. linearni polimeri α-amino kiselina povezanih peptidnom vezom (slika 1.1.)
 Rice. 1.1. Termini koji se koriste za opisivanje strukture peptida
Rice. 1.1. Termini koji se koriste za opisivanje strukture peptida
Monomeri aminokiselina koji čine polipeptide nazivaju se aminokiselinskih ostataka. Lanac ponavljajućih grupa - NH-CH-CO- forme peptidna kičma. Aminokiselinski ostatak koji ima slobodnu α-amino grupu naziva se N-terminal, a onaj koji ima slobodnu α-karboksilnu grupu naziva se C-terminal. Peptidi se pišu i čitaju od N-kraja do C-kraja.
Peptidna veza koju formira imino grupa prolina razlikuje se od ostalih peptidnih veza: atomu azota peptidne grupe nedostaje vodonik,
umjesto toga, postoji veza s radikalom, zbog čega je jedna strana prstena uključena u peptidnu kičmu:

Peptidi se razlikuju po sastavu aminokiselina, broju aminokiselina i redoslijedu veze aminokiselina, na primjer, Ser-Ala-Glu-Gis i His-Glu-Ala-Ser su dva različita peptida.
Peptidne veze su veoma jake, a njihova hemijska neenzimska hidroliza zahteva stroge uslove: analizirani protein se hidrolizira u koncentrovanom hlorovodonične kiseline na temperaturi od oko 110° tokom 24 sata. U živoj ćeliji peptidne veze može se rastrgati proteolitički enzimi, pozvao proteaze ili peptidne hidrolaze.
3. Primarna struktura proteina. Aminokiselinski ostaci u peptidnim lancima različitih proteina ne izmjenjuju se nasumično, već su raspoređeni određenim redoslijedom. Linearni slijed ili alternacijski red aminokiselinskih ostataka u polipeptidnom lancu naziva se primarna struktura proteina.
Primarna struktura svakog pojedinačnog proteina je kodirana u molekulu DNK (u regionu koji se zove gen) i ostvaruje se tokom transkripcije (kopiranje informacija na mRNA) i translacije (sinteza primarne strukture proteina). Shodno tome, primarna struktura proteina pojedinca je informacija koja se nasledno prenosi od roditelja do dece, a koja određuje strukturne karakteristike proteina datog organizma, od kojih zavisi funkcija postojećih proteina (slika 1.2.).
 Rice. 1.2. Odnos između genotipa i konformacije proteina sintetiziranih u tijelu pojedinca
Rice. 1.2. Odnos između genotipa i konformacije proteina sintetiziranih u tijelu pojedinca
Svaki od otprilike 100.000 pojedinačnih proteina u ljudskom tijelu ima jedinstven primarna struktura. Molekuli istog tipa proteina (na primjer, albumin) imaju istu izmjenu aminokiselinskih ostataka, što albumin razlikuje od bilo kojeg drugog pojedinačnog proteina.
Redoslijed aminokiselinskih ostataka u peptidnom lancu može se smatrati oblikom snimanja informacija. Ove informacije određuju prostorni raspored linearnog peptidnog lanca u kompaktniju trodimenzionalnu strukturu tzv. konformacija vjeverica. Proces formiranja funkcionalno aktivne proteinske konformacije naziva se preklapanje
4. Konformacija proteina. Slobodna rotacija u peptidnoj kičmi je moguća između atoma dušika peptidne grupe i susjednog α-ugljičnog atoma, kao i između α-ugljičnog atoma i ugljika karbonilne grupe. Zbog interakcije funkcionalnih grupa aminokiselinskih ostataka, primarna struktura proteina može dobiti složenije prostorne strukture. U globularnim proteinima postoje dva glavna nivoa savijanja konformacije peptidnih lanaca: sekundarno I tercijarne strukture.
Sekundarna struktura proteina je prostorna struktura nastala kao rezultat formiranja vodoničnih veza između funkcionalnih grupa -C=O i -NH- peptidne kičme. U ovom slučaju, peptidni lanac može dobiti pravilne strukture dva tipa: α-heliksa I β-strukture.
IN α-heliksa formiraju se vodikove veze između atoma kisika karbonilne grupe i vodika amidnog dušika iz 4. aminokiseline; bočni lanci aminokiselinskih ostataka
nalaze se duž periferije spirale, bez učešća u formiranju sekundarne strukture (slika 1.3.).
Masovni radikali, ili radikali koji nose jednake naboje, sprečavaju stvaranje α-heliksa. Ostatak prolina, koji ima prstenastu strukturu, prekida α-heliks, jer je zbog nedostatka vodonika na atomu dušika u peptidnom lancu nemoguće formirati vodikovu vezu. Veza između dušika i α-ugljičnog atoma je dio prolinskog prstena, tako da se peptidna kičma u ovom trenutku savija.
β-struktura formira se između linearnih regiona peptidne kičme jednog polipeptidnog lanca, čime se formiraju presavijene strukture. Mogu se formirati polipeptidni lanci ili njihovi dijelovi paralelno ili antiparalelne β-strukture. U prvom slučaju, N- i C-krajevi peptidnih lanaca u interakciji se poklapaju, au drugom imaju suprotan smjer (slika 1.4).
Rice. 1.3. Sekundarna struktura proteina - α-helix
 Rice. 1.4. Paralelne i antiparalelne strukture β-lista
Rice. 1.4. Paralelne i antiparalelne strukture β-lista
β-strukture su označene širokim strelicama: A - Antiparalelna β-struktura. B - Paralelne strukture β-lista
U nekim proteinima, β-strukture mogu nastati zbog formiranja vodoničnih veza između atoma peptidne kičme različitih polipeptidnih lanaca.
Takođe se nalazi u proteinima područja sa nepravilnim sekundarnim strukturu, koja uključuje krivine, petlje i zavoje polipeptidne kičme. Često se nalaze na mjestima gdje se mijenja smjer peptidnog lanca, na primjer, kada se formira paralelna struktura β-listova.
Na osnovu prisustva α-heliksa i β-struktura, globularni proteini se mogu podijeliti u četiri kategorije.
Rice. 1.5. Sekundarna struktura mioglobina (A) i β-lanca hemoglobina (B), koji sadrži osam α-heliksa
 Rice. 1.6. Sekundarna struktura domena triosefosfat izomeraze i piruvat kinaze
Rice. 1.6. Sekundarna struktura domena triosefosfat izomeraze i piruvat kinaze
 Rice. 1.7. Sekundarna struktura konstantne domene imunoglobulina (A) i enzima superoksid dismutaze (B)
Rice. 1.7. Sekundarna struktura konstantne domene imunoglobulina (A) i enzima superoksid dismutaze (B)
IN četvrta kategorija uključeni proteini koji sadrže malu količinu regularnih sekundarnih struktura. Ovi proteini uključuju male proteine bogate cisteinom ili metaloproteine.
Tercijarna struktura proteina- vrsta konformacije nastala zbog interakcije između radikala aminokiselina, koji se mogu nalaziti na znatnoj udaljenosti jedan od drugog u peptidnom lancu. Većina proteina formira prostornu strukturu koja liči na globulu (globularni proteini).
Budući da hidrofobni radikali aminokiselina imaju tendenciju spajanja preko tzv hidrofobne interakcije i intermolekularnih van der Waalsovih sila, unutar proteinske globule formira se gusto hidrofobno jezgro. Hidrofilni jonizovani i nejonizovani radikali uglavnom se nalaze na površini proteina i određuju njegovu rastvorljivost u vodi.
 Rice. 1.8. Vrste veza koje nastaju između radikala aminokiselina tokom formiranja tercijarne strukture proteina
Rice. 1.8. Vrste veza koje nastaju između radikala aminokiselina tokom formiranja tercijarne strukture proteina
1 - jonska veza- javlja se između pozitivno i negativno nabijenih funkcionalnih grupa;
2 - vodoničnu vezu- javlja se između hidrofilne nenabijene grupe i bilo koje druge hidrofilne grupe;
3 - hidrofobne interakcije- nastaju između hidrofobnih radikala;
4 - disulfidna veza- nastaju zbog oksidacije SH grupa cisteinskih ostataka i njihove međusobne interakcije
Hidrofilni aminokiselinski ostaci koji se nalaze unutar hidrofobnog jezgra mogu međusobno komunicirati pomoću jonski I vodonične veze(Sl. 1.8).
Jonske i vodikove veze, kao i hidrofobne interakcije, su slabe: njihova energija nije mnogo veća od energije toplotnog kretanja molekula pri sobnoj temperaturi. Konformacija proteina se održava stvaranjem mnogih takvih slabih veza. Budući da su atomi koji čine protein u stalnom kretanju, moguće je raskinuti neke slabe veze i formirati druge, što dovodi do blagih pomjeranja pojedinih dijelova polipeptidnog lanca. Ovo svojstvo proteina da mijenjaju konformaciju kao rezultat prekida nekih i formiranja drugih slabih veza naziva se konformaciona labilnost.
Ljudsko tijelo ima sisteme koji podržavaju homeostaza- konzistentnost unutrašnje okruženje u određenim granicama prihvatljivim za zdrav organizam. U uslovima homeostaze, male promjene u konformaciji ne remete ukupnu strukturu i funkciju proteina. Funkcionalno aktivna konformacija proteina se naziva nativna konformacija. Promjene u unutrašnjem okruženju (na primjer, koncentracija glukoze, Ca jona, protona itd.) dovode do promjena u konformaciji i poremećaja funkcija proteina.
Tercijarna struktura nekih proteina je stabilizirana disulfidne veze, nastao zbog interakcije -SH grupa dva ostatka
 Rice. 1.9. Formiranje disulfidne veze u proteinskom molekulu
Rice. 1.9. Formiranje disulfidne veze u proteinskom molekulu
cistein (slika 1.9). Većina intracelularnih proteina nema kovalentne disulfidne veze u svojoj tercijarnoj strukturi. Njihovo prisustvo je karakteristično za proteine koje luči ćelija, što im obezbeđuje veću stabilnost u vanćelijskim uslovima. Dakle, disulfidne veze su prisutne u molekulima inzulina i imunoglobulina.
Insulin- proteinski hormon koji se sintetizira u β-ćelijama pankreasa i izlučuje u krv kao odgovor na povećanje koncentracije glukoze u krvi. U strukturi insulina postoje dve disulfidne veze koje povezuju polipeptidne A i B lance, i jedna disulfidna veza unutar A lanca (slika 1.10).
 Rice. 1.10. Disulfidne veze u strukturi inzulina
Rice. 1.10. Disulfidne veze u strukturi inzulina
5. Supersekundarna struktura proteina. U proteinima s različitom primarnom strukturom i funkcijama ponekad se otkrivaju slične kombinacije i relativne pozicije sekundarnih struktura, koje se nazivaju supersekundarna struktura. Zauzima srednju poziciju između sekundarne i tercijarne strukture, jer je specifična kombinacija elemenata sekundarne strukture u formiranju tercijarne strukture proteina. Supersekundarne strukture imaju specifična imena, kao što su “α-helix-turn-a-helix”, “leucinski zatvarač”, “cinkovi prsti” itd. Takve supersekundarne strukture su karakteristične za proteine koji se vezuju za DNK.
"Leucinski patentni zatvarač." Ova vrsta supersekundarne strukture se koristi za spajanje dva proteina zajedno. Na površini proteina u interakciji postoje α-helikalni regioni koji sadrže najmanje četiri leucinska ostatka. Leucinski ostaci u α-heliksu nalaze se na udaljenosti od šest aminokiselina. Budući da svaki zavoj α-heliksa sadrži 3,6 aminokiselinskih ostataka, leucinski radikali se nalaze na površini svakog drugog zavoja. Leucinski ostaci α-heliksa jednog proteina mogu stupiti u interakciju sa ostacima leucina drugog proteina (hidrofobne interakcije), povezujući ih zajedno (slika 1.11.). Mnogi proteini koji se vezuju za DNK funkcionišu u oligomernim kompleksima gde su pojedinačne podjedinice međusobno povezane „leucinskim patentnim zatvaračima“.
 Rice. 1.11. "Leucinski zatvarač" između α-helikalnih regiona dva proteina
Rice. 1.11. "Leucinski zatvarač" između α-helikalnih regiona dva proteina
Primjer takvih proteina su histoni. Histoni- nuklearni proteini, koji sadrže veliki broj pozitivno nabijenih aminokiselina - arginin i lizin (do 80%). Molekuli histona se kombinuju u oligomerne komplekse koji sadrže osam monomera pomoću "leucinskih patentnih zatvarača", uprkos značajnom homonimnom naboju ovih molekula.
"cink prst"- varijanta supersekundarne strukture, karakteristična za proteine koji se vezuju za DNK, ima oblik izduženog fragmenta na površini proteina i sadrži oko 20 aminokiselinskih ostataka (slika 1.12). Oblik “proširenog prsta” podržava atom cinka vezan za četiri radikala aminokiselina - dva cisteinska i dva histidina. U nekim slučajevima, umjesto ostataka histidina, postoje ostaci cisteina. Dva usko ležeća cisteinska ostatka odvojena su od druga dva Gisili ostatka Cys sekvencom koja se sastoji od otprilike 12 aminokiselinskih ostataka. Ovaj region proteina formira α-heliks, čiji se radikali mogu specifično vezati za regulatorne regione glavnog žleba DNK. Individualna specifičnost vezivanja
 Rice. 1.12. Primarna struktura regije proteina koji se vezuju za DNK koji formiraju strukturu "cinkovog prsta" (slova označavaju aminokiseline koje čine ovu strukturu)
Rice. 1.12. Primarna struktura regije proteina koji se vezuju za DNK koji formiraju strukturu "cinkovog prsta" (slova označavaju aminokiseline koje čine ovu strukturu)
Regulatorni protein koji vezuje DNK zavisi od sekvence aminokiselinskih ostataka koji se nalaze u regionu cinkovog prsta. Takve strukture sadrže, posebno, receptore za steroidne hormone uključene u regulaciju transkripcije (čitanje informacija od DNK do RNK).
TEMA 1.2. OSNOVE FUNKCIONISANJA PROTEINA. LIJEKOVI KAO LIGANDI KOJI UTIČU NA FUNKCIJU PROTEINA
1. Aktivni centar proteina i njegova interakcija sa ligandom. Tokom formiranja tercijarne strukture, na površini funkcionalno aktivnog proteina formira se regija, obično u udubljenju, formirana od radikala aminokiselina koji su u primarnoj strukturi udaljeni jedan od drugog. Ova regija, koja ima jedinstvenu strukturu za dati protein i koja je sposobna za specifičnu interakciju s određenim molekulom ili grupom sličnih molekula, naziva se mjesto vezivanja protein-ligand ili aktivno mjesto. Ligandi su molekuli koji stupaju u interakciju s proteinima.
Visoka specifičnost Interakcija proteina s ligandom je osigurana komplementarnošću strukture aktivnog centra sa strukturom liganda.
Komplementarnost- ovo je prostorna i hemijska korespondencija površina u interakciji. Aktivni centar ne samo da mora prostorno odgovarati ligandu koji je u njemu uključen, već se moraju formirati i veze (ionske, vodikove i hidrofobne interakcije) između funkcionalnih grupa radikala uključenih u aktivni centar i liganda koji drži ligand. u aktivnom centru (slika 1.13).
 Rice. 1.13. Komplementarna interakcija proteina sa ligandom
Rice. 1.13. Komplementarna interakcija proteina sa ligandom
Neki ligandi, kada su vezani za aktivni centar proteina, igraju pomoćnu ulogu u funkcionisanju proteina. Takvi ligandi se nazivaju kofaktori, a proteini koji sadrže neproteinski dio nazivaju se kompleksnih proteina(za razliku od jednostavnih proteina, koji se sastoje samo od proteinskog dijela). Neproteinski dio, čvrsto povezan s proteinom, naziva se protetska grupa. Na primjer, mioglobin, hemoglobin i citokromi sadrže prostetičku grupu, hem, koji sadrži ion željeza, čvrsto vezan za aktivni centar. Složeni proteini koji sadrže hem nazivaju se hemoproteini.
Kada su specifični ligandi vezani za proteine, očituje se funkcija ovih proteina. Dakle, albumin, najvažniji protein u krvnoj plazmi, ispoljava svoju transportnu funkciju vezivanjem hidrofobnih liganda, kao što su masne kiseline, bilirubin, neki lijekovi, itd. za aktivni centar (slika 1.14)
Ligandi koji stupaju u interakciju s trodimenzionalnom strukturom peptidnog lanca mogu biti ne samo niskomolekularne organske i neorganske molekule, već i makromolekule:
DNK (primjeri sa DNK-vezujućim proteinima o kojima se raspravljalo gore);
Polisaharidi;
 Rice. 1.14. Odnos genotipa i fenotipa
Rice. 1.14. Odnos genotipa i fenotipa
Jedinstvena primarna struktura ljudskih proteina, kodirana u molekuli DNK, realizuje se u ćelijama u obliku jedinstvene konformacije, strukture aktivnog centra i proteinskih funkcija.
U ovim slučajevima, protein prepoznaje specifičnu regiju liganda koja je proporcionalna i komplementarna mjestu vezivanja. Tako se na površini hepatocita nalaze receptorski proteini za hormon inzulin, koji takođe ima proteinsku strukturu. Interakcija insulina sa receptorom izaziva promenu njegove konformacije i aktivaciju signalnih sistema, što dovodi do skladištenja nutrijenata u hepatocitima nakon jela.
dakle, Funkcionisanje proteina zasniva se na specifičnoj interakciji aktivnog centra proteina sa ligandom.
2. Struktura domena i njena uloga u funkcionisanju proteina. Dugi polipeptidni lanci globularnih proteina često se savijaju u nekoliko kompaktnih, relativno nezavisnih regija. Imaju nezavisnu tercijarnu strukturu, koja podsjeća na onu globularnih proteina, i nazivaju se domene. Zbog domenske strukture proteina, njihova tercijarna struktura se lakše formira.
U domenskim proteinima, mjesta vezivanja liganda se često nalaze između domena. Dakle, tripsin je proteolitički enzim koji proizvodi egzokrini dio pankreasa i neophodan je za probavu proteina hrane. Ima dvodomensku strukturu, a centar vezivanja tripsina sa njegovim ligandom - proteinom hrane - nalazi se u žlijebu između dva domena. U aktivnom centru stvaraju se uslovi neophodni za efikasno vezivanje određenog mesta proteina hrane i hidrolizu njegovih peptidnih veza.
Različiti domeni u proteinu mogu se kretati relativno jedni prema drugima kada aktivni centar stupi u interakciju sa ligandom (slika 1.15).
Heksokinaza- enzim koji katalizuje fosforilaciju glukoze pomoću ATP-a. Aktivno mjesto enzima nalazi se u rascjepu između dva domena. Kada se heksokinaza veže za glukozu, domeni koji je okružuju se zatvaraju i supstrat postaje zarobljen, gde dolazi do fosforilacije (vidi sliku 1.15).
 Rice. 1.15. Vezivanje heksokinaznih domena za glukozu
Rice. 1.15. Vezivanje heksokinaznih domena za glukozu
U nekim proteinima, domeni obavljaju nezavisne funkcije vezujući se za različite ligande. Takvi proteini se nazivaju multifunkcionalnim.
3. Lijekovi su ligandi koji utiču na funkciju proteina. Interakcija proteina sa ligandima je specifična. Međutim, zbog konformacijske labilnosti proteina i njegovog aktivnog centra, moguće je odabrati drugu supstancu koja bi također mogla stupiti u interakciju s proteinom u aktivnom centru ili drugom dijelu molekule.
Tvar slična po strukturi prirodnom ligandu naziva se strukturni analog liganda ili ne-prirodni ligand. Također stupa u interakciju s proteinom na aktivnom mjestu. Strukturni analog liganda može poboljšati funkciju proteina (agonist), i smanjiti ga (antagonista). Ligand i njegovi strukturni analozi se međusobno natječu za vezivanje za protein na istom mjestu. Takve supstance se nazivaju kompetitivni modulatori(regulatori) proteinskih funkcija. Mnogi lijekovi djeluju kao inhibitori proteina. Neki od njih se dobijaju hemijskom modifikacijom prirodnih liganada. Inhibitori funkcija proteina mogu biti lijekovi i otrovi.
Atropin je kompetitivni inhibitor M-holinergičkih receptora. Acetilholin je neurotransmiter za prijenos nervnih impulsa kroz holinergičke sinapse. Za izvođenje uzbuđenja, pušten u sinaptički rascjep acetilholin mora stupiti u interakciju sa receptorskim proteinom postsinaptičke membrane. Pronađene dvije vrste holinergički receptori:
M receptor pored acetilkolina, selektivno stupa u interakciju s muskarinom (toksinom mušice). M - holinergički receptori su prisutni na glatkim mišićima i, u interakciji s acetilkolinom, uzrokuju njihovu kontrakciju;
H receptor specifično vezujući za nikotin. N-holinergički receptori se nalaze na sinapsama prugasto-prugastih skeletnih mišića.
Specifični inhibitor M-holinergički receptori je atropin. Nalazi se u biljkama beladone i kokošije.
 Atropin ima funkcionalne grupe slične acetilkolinu i njihovom prostornom rasporedu, stoga je kompetitivni inhibitor M-holinergičkih receptora. S obzirom da vezivanje acetilholina za M-holinergičke receptore izaziva kontrakciju glatkih mišića, atropin se koristi kao lijek koji ublažava njihov grč. (antispazmodik). Tako je poznato da se atropin koristi za opuštanje očnih mišića prilikom gledanja fundusa, kao i za ublažavanje grčeva tokom gastrointestinalnih kolika. M-holinergički receptori su takođe prisutni u centralnom nervni sistem(CNS), stoga velike doze atropina mogu izazvati neželjenu reakciju centralnog nervnog sistema: motoričku i mentalnu agitaciju, halucinacije, konvulzije.
Atropin ima funkcionalne grupe slične acetilkolinu i njihovom prostornom rasporedu, stoga je kompetitivni inhibitor M-holinergičkih receptora. S obzirom da vezivanje acetilholina za M-holinergičke receptore izaziva kontrakciju glatkih mišića, atropin se koristi kao lijek koji ublažava njihov grč. (antispazmodik). Tako je poznato da se atropin koristi za opuštanje očnih mišića prilikom gledanja fundusa, kao i za ublažavanje grčeva tokom gastrointestinalnih kolika. M-holinergički receptori su takođe prisutni u centralnom nervni sistem(CNS), stoga velike doze atropina mogu izazvati neželjenu reakciju centralnog nervnog sistema: motoričku i mentalnu agitaciju, halucinacije, konvulzije.
Ditilin je kompetitivni agonist H-holinergičkih receptora, koji inhibira funkciju neuromuskularnih sinapsi.
 Neuromuskularne sinapse skeletnih mišića sadrže H-holinergičke receptore. Njihova interakcija s acetilkolinom dovodi do mišićnih kontrakcija. Prilikom nekih hirurških operacija, kao i kod endoskopskih studija, koriste se lijekovi koji uzrokuju opuštanje skeletnih mišića (mišićni relaksanti). To uključuje ditilin, koji je strukturni analog acetilholina. Veže se za H-holinergičke receptore, ali se za razliku od acetilholina vrlo sporo uništava enzimom acetilholinesterazom. Kao rezultat dugotrajnog otvaranja jonskih kanala i uporne depolarizacije membrane, poremećeno je provođenje nervnih impulsa i dolazi do opuštanja mišića. U početku su ova svojstva otkrivena u otrovu kurare, zbog čega se takvi lijekovi nazivaju curare-like.
Neuromuskularne sinapse skeletnih mišića sadrže H-holinergičke receptore. Njihova interakcija s acetilkolinom dovodi do mišićnih kontrakcija. Prilikom nekih hirurških operacija, kao i kod endoskopskih studija, koriste se lijekovi koji uzrokuju opuštanje skeletnih mišića (mišićni relaksanti). To uključuje ditilin, koji je strukturni analog acetilholina. Veže se za H-holinergičke receptore, ali se za razliku od acetilholina vrlo sporo uništava enzimom acetilholinesterazom. Kao rezultat dugotrajnog otvaranja jonskih kanala i uporne depolarizacije membrane, poremećeno je provođenje nervnih impulsa i dolazi do opuštanja mišića. U početku su ova svojstva otkrivena u otrovu kurare, zbog čega se takvi lijekovi nazivaju curare-like.
TEMA 1.3. DENATURACIJA PROTEINA I MOGUĆNOST NJIHOVE SPONTANE RENATIVACIJE
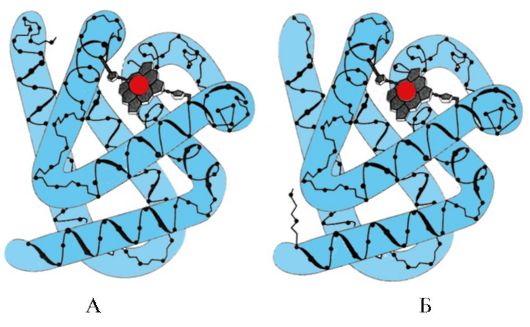
1. Budući da se nativna konformacija proteina održava zbog slabih interakcija, promjene u sastavu i svojstvima okoline koja okružuje protein, izlaganje hemijskim reagensima i fizičkim faktorima uzrokuju promjenu njihove konformacije (svojstvo konformacijske labilnosti). Gap velika količina veze dovode do uništenja prirodne konformacije i denaturacije proteina.
Denaturacija proteina- to je uništavanje njihove prirodne konformacije pod utjecajem denaturirajućih agenasa, uzrokovano kidanjem slabih veza koje stabiliziraju prostornu strukturu proteina. Denaturacija je praćena uništavanjem jedinstvene trodimenzionalne strukture i aktivnog centra proteina i gubitkom njegove biološke aktivnosti (slika 1.16).
Svi denaturirani molekuli jednog proteina dobijaju nasumičnu konformaciju koja se razlikuje od ostalih molekula istog proteina. Ispostavlja se da su radikali aminokiselina koji formiraju aktivni centar prostorno udaljeni jedan od drugog, tj. specifično vezno mjesto proteina sa ligandom je uništeno. Tokom denaturacije, primarna struktura proteina ostaje nepromijenjena.
Primjena denaturirajućih sredstava u biološkim istraživanjima i medicini. IN biohemijsko istraživanje Prije određivanja spojeva male molekularne težine u biološkom materijalu, proteini se obično prvo uklanjaju iz otopine. U tu svrhu najčešće se koristi trihloroctena kiselina (TCA). Nakon dodavanja TCA u otopinu, denaturirani proteini se talože i lako se uklanjaju filtracijom (Tabela 1.1.)
U medicini se denaturirajuća sredstva često koriste za sterilizaciju medicinskih instrumenata i materijala u autoklavima (sredstvo za denaturiranje je visoka temperatura) i kao antiseptici (alkohol, fenol, hloramin) za tretiranje kontaminiranih površina koje sadrže patogenu mikrofloru.
2. Spontana reaktivacija proteina- dokaz determinizma primarne strukture, konformacije i funkcije proteina. Pojedinačni proteini su proizvodi jednog gena koji imaju identičnu sekvencu aminokiselina i stiču istu konformaciju u ćeliji. Osnovni zaključak da primarna struktura proteina već sadrži informacije o njegovoj konformaciji i funkciji donesen je na osnovu sposobnosti nekih proteina (posebno ribonukleaze i mioglobina) da se spontano renativiraju - obnove svoju nativnu konformaciju nakon denaturacije.
Formiranje prostornih proteinskih struktura vrši se metodom samosastavljanja - spontanog procesa u kojem polipeptidni lanac, koji ima jedinstvenu primarnu strukturu, teži da usvoji konformaciju sa najnižom slobodnom energijom u rastvoru. Sposobnost renativacije proteina koji zadrže svoju primarnu strukturu nakon denaturacije opisana je u eksperimentu sa enzimom ribonukleazom.
Ribonukleaza je enzim koji razbija veze između pojedinačnih nukleotida u molekuli RNK. Ovaj globularni protein ima jedan polipeptidni lanac, čija je tercijarna struktura stabilizirana mnogim slabim i četiri disulfidne veze.
Tretman ribonukleaze ureom, koja razbija vodikove veze u molekuli, i redukcijskim sredstvom, koji razbija disulfidne veze, dovodi do denaturacije enzima i gubitka njegove aktivnosti.
Uklanjanje denaturirajućih agenasa dijalizom dovodi do obnavljanja konformacije i funkcije proteina, tj. do ponovnog rođenja. (Sl. 1.17).
 Rice. 1.17. Denaturacija i renativacija ribonukleaze
Rice. 1.17. Denaturacija i renativacija ribonukleaze
A - nativna konformacija ribonukleaze, u čijoj tercijarnoj strukturi postoje četiri disulfidne veze; B - denaturirani molekul ribonukleaze;
B - reaktivirana molekula ribonukleaze sa obnovljenom strukturom i funkcijom
1. Popuniti tabelu 1.2.
Tabela 1.2. Klasifikacija aminokiselina prema polaritetu radikala
2. Napišite formulu tetrapeptida:
Asp - Pro - Fen - Liz
a) istaći ponavljajuće grupe u peptidu koje čine peptidnu kičmu i varijabilne grupe predstavljene radikalima aminokiselina;
b) označiti N- i C-kraj;
c) istaći peptidne veze;
d) napišite drugi peptid koji se sastoji od istih aminokiselina;
e) izbrojati broj mogućih varijanti tetrapeptida sa sličnim sastavom aminokiselina.
3. Objasnite ulogu primarne strukture proteina na primjeru komparativne analize dva strukturno slična i evolucijski bliska peptidna hormona neurohipofize sisara – oksitocina i vazopresina (tabela 1.3).
Tabela 1.3. Struktura i funkcije oksitocina i vazopresina
 Za ovo:
Za ovo:
a) uporediti sastav i sekvencu aminokiselina dva peptida;
b) pronaći sličnost primarne strukture dva peptida i sličnost njihovog biološkog djelovanja;
c) pronaći razlike u strukturi dva peptida i razlike u njihovim funkcijama;
d) izvući zaključak o uticaju primarne strukture peptida na njihove funkcije.
4. Opisati glavne faze formiranja konformacije globularnih proteina (sekundarne, tercijarne strukture, koncept supersekundarne strukture). Navedite vrste veza koje su uključene u formiranje proteinskih struktura. Koji radikali aminokiselina mogu učestvovati u formiranju hidrofobnih interakcija, jonskih, vodikovih veza.
Navedite primjere.
5. Definisati pojam „konformacione labilnosti proteina“, navesti razloge njegovog postojanja i značaja.
6. Proširite značenje sljedeće fraze: “Funkcioniranje proteina je zasnovano na njihovoj specifičnoj interakciji sa ligandom”, koristeći izraze i objašnjavajući njihovo značenje: proteinska konformacija, aktivni centar, ligand, komplementarnost, funkcija proteina.
7. Na jednom primjeru objasnite što su domeni i koja je njihova uloga u funkcioniranju proteina.
ZADACI SAMOKONTROLE
1. Match.
Funkcionalna grupa u aminokiselinskom radikalu:
A. Karboksilna grupa B. Hidroksilna grupa C Gvanidinska grupa D. Tiol grupa E. Amino grupa
2. Odaberite tačne odgovore.
Aminokiseline sa polarnim nenabijenim radikalima su:
A. Cis B. Asn
B. Glu G. Tri
3. Odaberite tačne odgovore.
radikali aminokiselina:
A. Navedite specifičnost primarne strukture B. Učestvujte u formiranju tercijarne strukture
B. Smješteni na površini proteina, utiču na njegovu rastvorljivost D. Formiraju aktivni centar
D. Učestvuju u formiranju peptidnih veza
4. Odaberite tačne odgovore.
Hidrofobne interakcije mogu nastati između radikala aminokiselina:
A. Tre Lay B. Pro Three
B. Met Ile G. Tir Ala D. Val Fen
5. Odaberite tačne odgovore.
Jonske veze mogu se formirati između radikala aminokiselina:
A. Gln Asp B. Apr Liz
B. Liz Glu G. Gis Asp D. Asn Apr
6. Odaberite tačne odgovore.
Vodikove veze mogu nastati između radikala aminokiselina:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. Match.
Vrsta veze koja je uključena u formiranje proteinske strukture:
A. Primarna struktura B. Sekundarna struktura
B. Tercijarna struktura
D. Supersekundarna struktura E. Konformacija.
1. Vodikove veze između atoma peptidne kičme
2. Slabe veze između funkcionalnih grupa radikala aminokiselina
3. Veze između α-amino i α-karboksilnih grupa aminokiselina
8. Odaberite tačne odgovore. tripsin:
A. Proteolitički enzim B. Sadrži dva domena
B. Hidrolizuje skrob
D. Aktivna lokacija se nalazi između domena. D. Sastoji se od dva polipeptidna lanca.
9. Odaberite tačne odgovore. atropin:
A. Neurotransmiter
B. Strukturni analog acetilholina
B. Interagira sa H-holinergičkim receptorima
D. Jača provodljivost nervnih impulsa kroz holinergičke sinapse
D. Kompetitivni inhibitor M-holinergičkih receptora
10. Odaberite tačne izjave. U proteinima:
O. Primarna struktura sadrži informacije o strukturi svoje aktivne lokacije
B. Aktivni centar se formira na nivou primarne strukture
B. Konformacija je kruto fiksirana kovalentnim vezama
D. Aktivno mjesto može stupiti u interakciju sa grupom sličnih liganada
zbog konformacijske labilnosti proteina D. Promjena okruženje, može utjecati na afinitet aktivnog
centar za ligand
1. 1-B, 2-G, 3-B.
3. A, B, C, D.
7. 1-B, 2-D, 3-A.
8. A, B, C, D.
OSNOVNI POJMOVI I POJMOVI
1. Proteini, polipeptidi, aminokiseline
2. Primarne, sekundarne, tercijarne strukture proteina
3. Konformacija, nativna proteinska konformacija
4. Kovalentne i slabe veze u proteinu
5. Konformaciona labilnost
6. Protein aktivno mjesto
7. Ligandi
8. Savijanje proteina
9. Strukturni analozi liganada
10. Proteini domena
11. Jednostavni i složeni proteini
12. Denaturacija proteina, denaturirajuća sredstva
13. Reaktivacija proteina
Riješiti probleme
“Strukturna organizacija proteina i osnova njihovog funkcioniranja”
1. Glavna funkcija proteina - hemoglobina A (HbA) je transport kiseonika do tkiva. U ljudskoj populaciji poznati su višestruki oblici ovog proteina sa izmijenjenim svojstvima i funkcijom - takozvani abnormalni hemoglobini. Na primjer, otkriveno je da hemoglobin S, koji se nalazi u crvenim krvnim zrncima pacijenata sa anemije srpastih stanica (HbS), ima nisku rastvorljivost u uslovima niskog parcijalnog pritiska kiseonika (kao što je slučaj u venskoj krvi). To dovodi do stvaranja agregata ovog proteina. Protein gubi svoju funkciju, taloži se, a crvena krvna zrnca dobijaju nepravilnog oblika(neki od njih imaju oblik srpa) i uništavaju se brže nego inače u slezeni. Kao rezultat, razvija se anemija srpastih stanica.
Jedina razlika u primarnoj strukturi HbA pronađena je u N-terminalnom području β-lanca hemoglobina. Uporedite N-terminalne regije β-lanca i pokažite kako promjene u primarnoj strukturi proteina utiču na njegova svojstva i funkcije.
 Za ovo:
Za ovo:
a) napišite formule aminokiselina po kojima se HbA razlikuje i uporedite svojstva ovih aminokiselina (polaritet, naboj).
b) izvući zaključak o razlozima smanjenja rastvorljivosti i poremećaja transporta kiseonika u tkiva.
2. Na slici je prikazan dijagram strukture proteina koji ima centar vezivanja sa ligandom (aktivni centar). Objasnite zašto je protein selektivan u izboru liganda. Za ovo:
a) zapamtite šta je aktivni centar proteina i razmotrite strukturu aktivnog centra proteina prikazanu na slici;
b) napišite formule radikala aminokiselina koji čine aktivni centar;
c) nacrtati ligand koji bi mogao specifično stupiti u interakciju s aktivnim mjestom proteina. Označite na njemu funkcionalne grupe koje mogu formirati veze s radikalima aminokiselina koji čine aktivni centar;
d) naznačiti tipove veza koje nastaju između liganda i radikala aminokiselina aktivnog centra;
e) objasniti na čemu se zasniva specifičnost interakcije protein-ligand.
 3.
Slika prikazuje aktivno mjesto proteina i nekoliko liganada.
3.
Slika prikazuje aktivno mjesto proteina i nekoliko liganada.
Odredite koji ligand će najvjerovatnije stupiti u interakciju s aktivnim mjestom proteina i zašto.
 Koje vrste veza nastaju tokom formiranja kompleksa protein-ligand?
Koje vrste veza nastaju tokom formiranja kompleksa protein-ligand?
4. Strukturni analozi prirodnih proteinskih liganda mogu se koristiti kao lijekovi za modificiranje aktivnosti proteina.
Acetilholin je posrednik u prijenosu ekscitacije u neuromuskularnim sinapsama. Kada acetilholin stupi u interakciju s proteinima - receptorima postsinaptičke membrane skeletnih mišića, otvaraju se jonski kanali i dolazi do kontrakcije mišića. Ditilin je lijek koji se koristi u nekim operacijama za opuštanje mišića, jer remeti prijenos nervnih impulsa kroz neuromišićne sinapse. Objasniti mehanizam djelovanja ditilina kao mišićnog relaksansa. Za ovo:
a) napišite formule acetilholina i ditilina i uporedite njihove strukture;
b) opisati mehanizam opuštajućeg efekta ditilina.
5. Kod nekih bolesti dolazi do porasta tjelesne temperature pacijenta, što se smatra zaštitnom reakcijom tijela. Međutim, visoke temperature su štetne za tjelesne proteine. Objasnite zašto se na temperaturama iznad 40 °C narušava funkcija proteina i javlja opasnost po život ljudi. Da biste to učinili, zapamtite:
1) Struktura proteina i veze koje drže njegovu strukturu u prirodnoj konformaciji;
2) Kako se struktura i funkcija proteina mijenja sa porastom temperature?;
3) Šta je homeostaza i zašto je važna za očuvanje zdravlja ljudi.
Modularna jedinica 2 OLIGOMERICK PROTEINI KAO CILJE REGULATORNIH UTICAJA. STRUKTURALNA I FUNKCIONALNA RAZNOLIKOST PROTEINA. METODE ODJELJAVANJA I PROČIŠĆAVANJA PROTEINA
Ciljevi učenja Biti u stanju:
1. Iskoristiti znanje o karakteristikama strukture i funkcijama oligomernih proteina za razumijevanje adaptivnih mehanizama regulacije njihovih funkcija.
2. Objasniti ulogu pratilaca u sintezi i održavanju proteinske konformacije u ćelijskim uslovima.
3. Objasnite raznolikost manifestacija života raznolikošću struktura i funkcija proteina koji se sintetiziraju u tijelu.
4. Analizirati odnos strukture proteina i njihove funkcije na primjerima poređenja srodnih hemoproteina - mioglobina i hemoglobina, kao i predstavnika pet klasa proteina porodice imunoglobulina.
5. Primijeniti znanje o posebnostima fizičkih i hemijskih svojstava proteina da bi odabrali metode za njihovo prečišćavanje od drugih proteina i nečistoća.
6. Interpretirajte rezultate kvantitativnog i kvalitetan sastav proteina krvne plazme za potvrdu ili pojašnjenje kliničke dijagnoze.
znati:
1. Osobine strukture oligomernih proteina i adaptivni mehanizmi za regulaciju njihovih funkcija na primjeru hemoglobina.
2. Struktura i funkcije šaperona i njihov značaj za održavanje prirodne konformacije proteina u ćelijskim uslovima.
3. Principi kombinovanja proteina u porodice na osnovu sličnosti njihove konformacije i funkcija na primjeru imunoglobulina.
4. Metode odvajanja proteina na osnovu karakteristika njihovih fizičko-hemijskih svojstava.
5. Elektroforeza krvne plazme kao metoda za procjenu kvalitativnog i kvantitativnog sastava proteina.
TEMA 1.4. OSOBINE STRUKTURE I FUNKCIONISANJA OLIGOMERNIH PROTEINA NA PRIMJERU HEMOGLOBINA
1. Mnogi proteini sadrže nekoliko polipeptidnih lanaca. Takvi proteini se nazivaju oligomerni, i pojedinačni lanci - protomeri. Protomeri u oligomernim proteinima povezani su mnogim slabim nekovalentnim vezama (hidrofobne, jonske, vodikove). Interakcija
protomeri se izvode zahvaljujući komplementarnost njihove dodirne površine.
Broj protomera u oligomernim proteinima može značajno varirati: hemoglobin sadrži 4 protomera, enzim aspartat aminotransferaza ima 12 protomera, a protein virusa mozaika duhana sadrži 2120 protomera povezanih nekovalentnim vezama. Posljedično, oligomerni proteini mogu imati vrlo visoke molekularne težine.
Interakcija jednog protomera sa drugim može se smatrati kao poseban slučaj protein-ligand interakcije, budući da svaki protomer služi kao ligand za druge protomere. Broj i način spajanja protomera u protein se naziva kvarterna struktura proteina.
Proteini mogu sadržavati protomere iste ili različite strukture, na primjer, homodimeri su proteini koji sadrže dva identična protomera, a heterodimeri su proteini koji sadrže dva različita protomera.
Ako proteini sadrže različite protomere, tada se na njima mogu formirati vezni centri s različitim ligandima koji se razlikuju po strukturi. Kada se ligand veže za aktivno mjesto, očituje se funkcija ovog proteina. Centar koji se nalazi na drugom protomeru naziva se alosteričan (različit od aktivnog). Kontaktiranje alosterični ligand ili efektor, vrši regulatornu funkciju (slika 1.18). Interakcija alosteričkog centra sa efektorom uzrokuje konformacijske promjene u strukturi cjelokupnog oligomernog proteina zbog njegove konformacijske labilnosti. Ovo utiče na afinitet aktivnog mesta za određeni ligand i reguliše funkciju tog proteina. Promjena konformacije i funkcije svih protomera tokom interakcije oligomernog proteina s najmanje jednim ligandom naziva se kooperativne konformacijske promjene. Zovu se efektori koji poboljšavaju funkciju proteina aktivatori, i efektori koji inhibiraju njegovu funkciju - inhibitori.
Dakle, oligomerni proteini, kao i proteini sa strukturom domena, imaju novo svojstvo u odnosu na monomerne proteine – sposobnost alosterične regulacije funkcija (regulacija vezivanjem različitih liganada za protein). To se može vidjeti poređenjem struktura i funkcija dva blisko povezana kompleksna proteina, mioglobina i hemoglobina.
 Rice. 1.18. Shema strukture dimernog proteina
Rice. 1.18. Shema strukture dimernog proteina
2. Formiranje prostornih struktura i funkcioniranje mioglobina.
Mioglobin (Mb) je protein koji se nalazi u crvenim mišićima, čija je glavna funkcija stvaranje rezervi O 2 neophodnih za intenzivan rad mišića. Mb je kompleksni protein koji sadrži proteinski dio - apoMb i neproteinski dio - hem. Primarna struktura apoMB određuje njegovu kompaktnu globularnu konformaciju i strukturu aktivnog centra za koji je vezan neproteinski dio mioglobina, hem. Kiseonik koji dolazi iz krvi u mišiće vezuje se za Fe+ 2 heme u mioglobinu. Mb je monomerni protein koji ima veoma visok afinitet za O 2, pa se oslobađanje kiseonika mioglobinom dešava samo tokom intenzivnog mišićnog rada, kada parcijalni pritisak O 2 naglo opada.
Formiranje Mv konformacije. U crvenim mišićima, na ribosomima tokom translacije, sintetiše se primarna struktura MB, predstavljena specifičnom sekvencom od 153 aminokiselinska ostatka. Sekundarna struktura Mb sadrži osam α-heliksa, nazvanih latiničnim slovima od A do H, između kojih se nalaze ne-helikalne regije. Tercijarna struktura Mb ima oblik kompaktne globule, u čijem se udubljenju nalazi aktivni centar između F i E α-heliksa (slika 1.19).
 Rice. 1.19. Struktura mioglobina
Rice. 1.19. Struktura mioglobina
3. Osobine strukture i funkcionisanja aktivnog centra MV. Aktivni centar Mb formiran je pretežno od hidrofobnih aminokiselinskih radikala, široko razmaknutih jedan od drugog u primarnoj strukturi (na primjer, Tri 3 9 i Fen 138) Slabo rastvorljivi u vodi ligandi - hem i O 2 - vezuju se za aktivni centar. Hem je specifični ligand apoMB (slika 1.20), čiju osnovu čine četiri pirolna prstena povezana metenilnim mostovima; u centru se nalazi atom Fe+ 2 povezan sa atomima azota pirolnih prstenova pomoću četiri koordinacione veze. U aktivnom centru Mb, pored hidrofobnih aminokiselinskih radikala, nalaze se i ostaci dvije aminokiseline sa hidrofilnim radikalima - Gis E 7(Gis 64) i GIS F 8(Njegovih 93) (Sl. 1.21).
 Rice. 1.20. Struktura hema - neproteinski dio mioglobina i hemoglobina
Rice. 1.20. Struktura hema - neproteinski dio mioglobina i hemoglobina
 Rice. 1.21. Lokacija hema i O2 u aktivnom mjestu apomioglobina i protomera hemoglobina
Rice. 1.21. Lokacija hema i O2 u aktivnom mjestu apomioglobina i protomera hemoglobina
Hem je kovalentno vezan za His F8 preko atoma gvožđa. O 2 se vezuje za gvožđe sa druge strane ravni hema. Njegov E 7 je neophodan za ispravnu orijentaciju O 2 i olakšava dodavanje kisika Fe + 2 hemu
GIS F 8 formira koordinacionu vezu sa Fe+ 2 i čvrsto fiksira hem u aktivnom centru. Gis E 7 neophodan za ispravnu orijentaciju u aktivnom centru drugog liganda - O 2 tokom njegove interakcije sa Fe + 2 hemom. Mikrookolina hema stvara uslove za snažno ali reverzibilno vezivanje O 2 za Fe + 2 i sprečava ulazak vode u hidrofobno aktivno mesto, što može dovesti do njegove oksidacije u Fe + 3.
Monomerna struktura Mb i njegovog aktivnog centra određuju visok afinitet proteina za O2.
4. Oligomerna struktura Hb i regulacija afiniteta Hb za O 2 ligande. Ljudski hemoglobini- porodica proteina, poput mioglobina, srodnih kompleksnim proteinima (hemoproteini). Imaju tetramernu strukturu i sadrže dva α-lanca, ali se razlikuju po strukturi druga dva polipeptidna lanca (2α-, 2x-lanci). Struktura drugog polipeptidnog lanca određuje karakteristike funkcionisanja ovih oblika Hb. Oko 98% hemoglobina u crvenim krvnim zrncima odrasle osobe je hemoglobin A(2α-, 2p-lanci).
Tokom fetalnog razvoja funkcionišu dvije glavne vrste hemoglobina: embrionalni Hb(2α, 2ε), koji se nalazi na ranim fazama razvoj fetusa, i hemoglobin F (fetalni)- (2α, 2γ), koji zamjenjuje rani fetalni hemoglobin u šestom mjesecu intrauterinog razvoja i tek nakon rođenja zamjenjuje se Hb A.
HB A je protein srodan mioglobinu (MB) koji se nalazi u crvenim krvnim zrncima odraslih ljudi. Struktura njegovih pojedinačnih protomera slična je strukturi mioglobina. Sekundarne i tercijarne strukture protomera mioglobina i hemoglobina su vrlo slične, uprkos činjenici da su u primarnoj strukturi njihovih polipeptidnih lanaca samo 24 aminokiselinska ostatka identične (sekundarna struktura protomera hemoglobina, poput mioglobina, sadrži osam α-heliksa, označena latiničnim slovima od A do H, a tercijarna struktura ima oblik kompaktne globule). Ali za razliku od mioglobina, hemoglobin ima oligomernu strukturu, koja se sastoji od četiri polipeptidna lanca povezana nekovalentnim vezama (slika 1.22).
Svaki Hb protomer povezan je sa ne-proteinskim dijelom - hemom i susjednim protomerima. Veza proteinskog dijela Hb sa hemom slična je onoj kod mioglobina: u aktivnom centru proteina, hidrofobni dijelovi hema su okruženi hidrofobnim radikalima aminokiselina s izuzetkom His F 8 i His E 7, koji se nalaze sa obe strane ravni hema i igraju sličnu ulogu u funkcionisanju proteina i njegovom vezivanju sa kiseonikom (vidi strukturu mioglobina).
 Rice. 1.22. Oligomerna struktura hemoglobina
Rice. 1.22. Oligomerna struktura hemoglobina
osim toga, Gis E 7 obavlja važnu dodatnu ulogu u funkcionisanju Nv. Slobodni hem ima 25.000 puta veći afinitet za CO nego za O2. CO se stvara u malim količinama u tijelu i, s obzirom na njegov visok afinitet za hem, mogao bi poremetiti transport O2 neophodnog za život ćelije. Međutim, u sastavu hemoglobina, afinitet hema prema ugljičnom monoksidu premašuje afinitet za O 2 samo 200 puta zbog prisustva His E 7 u aktivnom centru. Ostatak ove aminokiseline stvara optimalne uslove za vezivanje hema za O 2 i slabi interakciju hema sa CO.
5. Glavna funkcija HB je transport O2 iz pluća u tkiva. Za razliku od monomernog mioglobina, koji ima vrlo visok afinitet prema O2 i obavlja funkciju skladištenja kisika u crvenim mišićima, oligomerna struktura hemoglobina osigurava:
1) brzo zasićenje HB kiseonikom u plućima;
2) sposobnost HB da oslobađa kiseonik u tkivima pri relativno visokom parcijalnom pritisku od O 2 (20-40 mm Hg);
3) mogućnost regulacije afiniteta Hb prema O2.
6. Kooperativne promjene u konformaciji protomera hemoglobina ubrzavaju vezivanje O 2 u plućima i njegovo oslobađanje u tkiva. U plućima, visoki parcijalni pritisak O 2 podstiče njegovo vezivanje za Hb u aktivnom mestu četiri protomera (2α i 2β). Aktivni centar svakog protomera, kao u mioglobinu, nalazi se između dvije α-heliksa (F i E) u hidrofobnom džepu. Sadrži neproteinski dio - hem, vezan za proteinski dio mnogim slabim hidrofobnim interakcijama i jednu jaku vezu između Fe 2 + hema i His F 8 (vidi sliku 1.21).
U deoksihemoglobinu, zbog ove veze sa His F 8, atom Fe 2 + strši iz ravni hema prema histidinu. Vezivanje O 2 za Fe 2 + se dešava na drugoj strani hema u His E 7 regionu koristeći jednu slobodnu koordinacionu vezu. Njegov E 7 pruža optimalne uslove za vezivanje O2 za hem gvožđe.
Dodavanje O 2 atomu Fe + 2 jednog protomera uzrokuje njegovo pomicanje u ravninu hema, praćeno ostatkom histidina koji je povezan s njim
 Rice. 1.23. Promjena konformacije protomera hemoglobina u kombinaciji s O2
Rice. 1.23. Promjena konformacije protomera hemoglobina u kombinaciji s O2
To dovodi do promjene u konformaciji svih polipeptidnih lanaca zbog njihove konformacijske labilnosti. Promjena konformacije drugih lanaca olakšava njihovu interakciju sa sljedećim molekulima O2.
Četvrti molekul O 2 se veže za hemoglobin 300 puta lakše nego prvi (slika 1.24).
 Rice. 1.24. Kooperativne promjene u konformaciji protomera hemoglobina tokom njegove interakcije sa O2
Rice. 1.24. Kooperativne promjene u konformaciji protomera hemoglobina tokom njegove interakcije sa O2
U tkivima se svaki sljedeći molekul O 2 lakše odcjepljuje od prethodnog, također zbog kooperativnih promjena u konformaciji protomera.
7. CO 2 i H+ formirani tokom katabolizma organska materija, smanjuju afinitet hemoglobina za O 2 proporcionalno njihovoj koncentraciji. Energija potrebna za funkcionisanje ćelije proizvodi se prvenstveno u mitohondrijima tokom oksidacije organskih supstanci pomoću O 2 koji se isporučuje iz pluća hemoglobinom. Kao rezultat oksidacije organskih tvari nastaju konačni produkti njihovog raspadanja: CO 2 i K 2 O, čija je količina proporcionalna intenzitetu tekućih oksidacijskih procesa.
CO 2 difundira iz ćelija u krv i prodire u crvena krvna zrnca, gdje se pod djelovanjem enzima karbanhidraze pretvara u ugljična kiselina. Ova slaba kiselina disocira na proton i bikarbonatni ion.
H+ su sposobni da se pridruže Njegovim radikalima 14 6 u α- i β-lancima hemoglobina, tj. u područjima udaljenim od hema. Protoniranje hemoglobina smanjuje njegov afinitet za O 2, pospješuje uklanjanje O 2 iz oksiHb, stvaranje deoksiHb i povećava opskrbu tkiva kisikom srazmjerno broju nastalih protona (slika 1.25).
Povećanje količine oslobođenog kisika ovisno o povećanju koncentracije H+ u crvenim krvnim zrncima naziva se Bohrov efekt (nazvan po danskom fiziologu Christianu Boru, koji je prvi otkrio ovaj efekat).
U plućima, visok parcijalni pritisak kiseonika pospešuje njegovo vezivanje za deoksiHb, što smanjuje afinitet proteina za H+. Oslobođeni protoni pod dejstvom ugljene kiseline reaguju sa bikarbonatima i formiraju CO 2 i H 2 O

 Rice. 1.25. Ovisnost afiniteta Hb za O 2 o koncentraciji CO 2 i protona (Bohrov efekat):
Rice. 1.25. Ovisnost afiniteta Hb za O 2 o koncentraciji CO 2 i protona (Bohrov efekat):
A- uticaj koncentracije CO 2 i H+ na oslobađanje O 2 iz kompleksa sa HB (Bohrov efekat); B- oksigenacija deoksihemoglobina u plućima, stvaranje i oslobađanje CO2.
Nastali CO 2 ulazi u alveolarni prostor i uklanja se izdahnutim zrakom. Dakle, količina kisika koji hemoglobin oslobađa u tkivima regulirana je produktima katabolizma organskih tvari: što je intenzivnija razgradnja tvari, na primjer tijekom fizičkog vježbanja, to je veća koncentracija CO 2 i H + i više kisika. tkiva primaju kao rezultat smanjenja afiniteta Hb za O2.
8. Alosterična regulacija afiniteta Hb za O2 pomoću liganda - 2,3-bisfosfoglicerat. U eritrocitima, alosterični ligand hemoglobina, 2,3-bisfosfoglicerat (2,3-BPG), sintetizira se iz produkta oksidacije glukoze - 1,3-bisfosfoglicerata. U normalnim uslovima, koncentracija 2,3-BPG je visoka i uporediva sa koncentracijom Hb. 2,3-BPG ima jak negativni naboj od -5.
 Bisfosfoglicerat u kapilarima tkiva, vezujući se za deoksihemoglobin, povećava oslobađanje kisika u tkiva, smanjujući afinitet Hb za O2.
Bisfosfoglicerat u kapilarima tkiva, vezujući se za deoksihemoglobin, povećava oslobađanje kisika u tkiva, smanjujući afinitet Hb za O2.
U središtu tetramernog molekula hemoglobina nalazi se šupljina. Formiran je od aminokiselinskih ostataka sva četiri protomera (vidi sliku 1.22). U kapilarama tkiva, protonacija Hb (Bohrov efekat) dovodi do kidanja veze između hem gvožđa i O2. U molekulu
deoksihemoglobin u odnosu na oksihemoglobin postoje dodatni jonske veze, povezujući protomere, zbog čega se dimenzije centralne šupljine povećavaju u odnosu na oksihemoglobin. Centralna šupljina je mjesto vezivanja 2,3-BPG za hemoglobin. Zbog razlike u veličini centralne šupljine, 2,3-BPG se može vezati samo za deoksihemoglobin.
2,3-BPG stupa u interakciju s hemoglobinom na mjestu udaljenom od aktivnih centara proteina i pripada alosterični(regulatorni) ligandi, a centralna šupljina Hb je alosterični centar. 2,3-BPG ima jak negativni naboj i u interakciji je sa pet pozitivno nabijenih grupa dva β-lanca Hb: N-terminalnom α-amino grupom Val i Lys 82 His 143 radikalima (slika 1.26).
 Rice. 1.26. BPG u centralnoj šupljini deoksihemoglobina
Rice. 1.26. BPG u centralnoj šupljini deoksihemoglobina
BPG se vezuje za tri pozitivno nabijene grupe na svakom β-lancu.
U kapilarama tkiva nastali deoksihemoglobin stupa u interakciju sa 2,3-BPG i formiraju se ionske veze između pozitivno nabijenih radikala β-lanaca i negativno nabijenog liganda, koji mijenjaju konformaciju proteina i smanjuju afinitet Hb za O2. . Smanjenje afiniteta Hb za O 2 doprinosi efikasnijem oslobađanju O 2 u tkivo.
U plućima, pri visokom parcijalnom pritisku, kiseonik stupa u interakciju sa Hb, spajajući hem gvožđe; u ovom slučaju, konformacija proteina se mijenja, centralna šupljina se smanjuje i 2,3-BPG se pomiče iz alosteričnog centra
Dakle, oligomerni proteini imaju nova svojstva u poređenju sa monomernim proteinima. Vezanje liganada na mjestima
prostorno udaljene jedna od druge (alosterične), mogu uzrokovati konformacijske promjene u cijeloj proteinskoj molekuli. Usljed interakcije s regulatornim ligandima dolazi do promjene konformacije i prilagođavanja funkcije proteinske molekule promjenama okoline.
TEMA 1.5. ODRŽAVANJE NATIVNE KONFORMACIJE PROTEINA U ĆELIJSKIM USLOVIMA
U ćelijama, tokom sinteze polipeptidnih lanaca, njihov transport kroz membrane do odgovarajućih delova ćelije, tokom procesa savijanja (formiranje nativne konformacije) i tokom sklapanja oligomernih proteina, kao i tokom njihovog funkcionisanja, intermedijer U strukturi proteina nastaju nestabilne konformacije sklone agregaciji. Hidrofobni radikali, obično skriveni unutar proteinske molekule u prirodnoj konformaciji, pojavljuju se na površini u nestabilnoj konformaciji i imaju tendenciju da se kombinuju sa grupama drugih proteina koji su slabo rastvorljivi u vodi. U ćelijama svih poznatih organizama pronađeni su posebni proteini koji obezbeđuju optimalno savijanje ćelijskih proteina, stabilizuju njihovu nativnu konformaciju tokom funkcionisanja i, što je najvažnije, održavaju strukturu i funkcije intracelularnih proteina kada je poremećena homeostaza. Ovi proteini se nazivaju "pratitelji"što na francuskom znači "dadilja".
1. Molekularni šaperoni i njihova uloga u sprječavanju denaturacije proteina.
Šaperoni (CH) su klasifikovani prema masi njihovih podjedinica. Šaperoni visoke molekularne težine imaju masu od 60 do 110 kDa. Među njima su najviše proučavane tri klase: Sh-60, Sh-70 i Sh-90. Svaka klasa uključuje porodicu srodnih proteina. Dakle, Sh-70 uključuje proteine sa molekulskom težinom od 66 do 78 kDa. Šaperoni niske molekularne težine imaju molekulsku težinu od 40 do 15 kDa.
Među pratiocima ima konstitutivni proteini, čija visoka bazalna sinteza ne zavisi od uticaja stresa na ćelije tela, i inducibilno,čija je sinteza u normalnim uslovima slaba, ali se naglo povećava pod stresom. Inducibilni šaperoni se nazivaju i "proteini toplotnog šoka" jer su prvi put otkriveni u ćelijama izloženim visokim temperaturama. U stanicama, zbog visoke koncentracije proteina, spontana reaktivacija djelomično denaturiranih proteina je otežana. Sh-70 može spriječiti početak denaturacije i pomoći u obnavljanju prirodne konformacije proteina. Molekularni pratioci-70- visoko konzervirana klasa proteina koja se nalazi u svim dijelovima ćelije: citoplazma, jezgro, endoplazmatski retikulum, mitohondrije. Na karboksilnom kraju jednog polipeptidnog lanca Š-70 nalazi se region koji je žljeb sposoban za interakciju s peptidima dužine
od 7 do 9 aminokiselinskih ostataka obogaćenih hidrofobnim radikalima. Takve regije u globularnim proteinima javljaju se otprilike na svakih 16 aminokiselina. Sh-70 je sposoban zaštititi proteine od temperaturne inaktivacije i vratiti konformaciju i aktivnost djelomično denaturiranih proteina.
2. Uloga šaperona u savijanju proteina. Tokom sinteze proteina na ribosomu, N-terminalni region polipeptida se sintetiše pre C-terminalnog. Da bi se formirala nativna konformacija, potrebna je kompletna sekvenca aminokiselina proteina. U procesu sinteze proteina, šaperoni-70, zbog strukture svog aktivnog centra, mogu zatvoriti područja polipeptida koja su sklona agregaciji, obogaćena hidrofobnim radikalima aminokiselina dok se sinteza ne završi (slika 1.27, A ).
 Rice. 1.27. Učešće pratilaca u savijanju proteina
Rice. 1.27. Učešće pratilaca u savijanju proteina
A - učešće šaperona-70 u prevenciji hidrofobnih interakcija između sekcija sintetizovanog polipeptida; B - formiranje nativne konformacije proteina u šaperonskom kompleksu
Mnogi visokomolekularni proteini koji imaju složenu konformaciju, kao što je struktura domena, savijaju se u poseban prostor koji formira Sh-60. Š-60 funkcioniraju kao oligomerni kompleks koji se sastoji od 14 podjedinica. Oni formiraju dva šuplja prstena, od kojih se svaki sastoji od sedam podjedinica, ti prstenovi su međusobno povezani. Svaka podjedinica Sh-60 sastoji se od tri domena: apikalnog (apikalnog), obogaćenog hidrofobnim radikalima okrenutih ka šupljini prstena, srednjeg i ekvatorijalnog (slika 1.28).
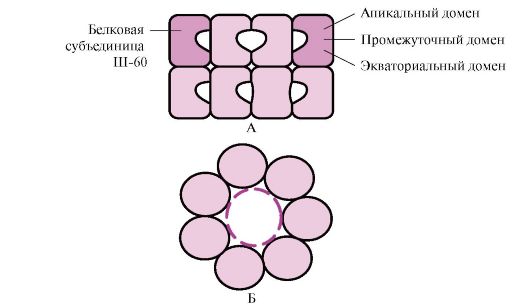 Rice. 1.28. Struktura kompleksa šaperonina koji se sastoji od 14 Š-60
Rice. 1.28. Struktura kompleksa šaperonina koji se sastoji od 14 Š-60
A - pogled sa strane; B - pogled odozgo
Sintetizirani proteini, koji na površini imaju elemente karakteristične za nesavijene molekule, posebno hidrofobne radikale, ulaze u šupljinu šaperonskih prstenova. U specifičnom okruženju ovih šupljina traže se moguće konformacije dok se ne pronađe jedina energetski najpovoljnija (slika 1.27, B). Formiranje konformacija i oslobađanje proteina je praćeno ATP hidroliza u ekvatorijalnoj oblasti. Tipično, takvo savijanje ovisno o šaperonu zahtijeva značajnu količinu energije.
Osim što sudjeluju u formiranju trodimenzionalne strukture proteina i renativaciji djelomično denaturiranih proteina, chaperoni su također neophodni za nastanak takvih fundamentalnih procesa kao što su sklapanje oligomernih proteina, prepoznavanje i transport denaturiranih proteina u lizozome, transport proteina kroz membrane i učešće u regulaciji aktivnosti proteinskih kompleksa.
TEMA 1.6. RAZNOLIKE PROTEINA. PORODICE PROTEINA: PRIMJER IMUNOGLOBULINA
1. Proteini igraju ključnu ulogu u životu pojedinačnih ćelija i svega višećelijski organizam, a njihove funkcije su iznenađujuće raznolike. Ovo je određeno karakteristikama primarne strukture i konformacija proteina, jedinstvenom strukturom aktivnog centra i sposobnošću vezivanja specifičnih liganada.
Samo vrlo mali dio svih mogućih varijanti peptidnih lanaca može usvojiti stabilnu prostornu strukturu; većina
od njih mogu uzeti mnoge konformacije sa približno istom Gibbsovom energijom, ali s različitim svojstvima. Odabrana primarna struktura najpoznatijih proteina biološka evolucija, obezbeđuje izuzetnu stabilnost jedne od konformacija, što određuje posebnosti funkcionisanja ovog proteina.
2. Porodice proteina. Unutar iste biološke vrste, zamjene aminokiselinskih ostataka mogu dovesti do pojave različitih proteina koji obavljaju srodne funkcije i imaju homologne sekvence amino kiseline. Takvi srodni proteini imaju zapanjujuće slične konformacije: broj i relativni položaj α-heliksa i/ili β-struktura, i većina zavoja i krivina polipeptidnih lanaca su slični ili identični. Proteini sa homolognim regionima polipeptidnog lanca, sličnom konformacijom i srodnim funkcijama klasifikovani su u porodice proteina. Primeri porodica proteina: serinske proteinaze, porodica imunoglobulina, porodica mioglobina.
Serinske proteinaze- porodica proteina koji obavljaju funkciju proteolitičkih enzima. To uključuje probavne enzime - himotripsin, tripsin, elastazu i mnoge faktore zgrušavanja krvi. Ovi proteini imaju identične aminokiseline na 40% svojih pozicija i vrlo sličnu konformaciju (slika 1.29).

Rice. 1.29. Prostorne strukture elastaza (A) i kimotripsin (B)
Neke zamjene aminokiselina dovele su do promjena u specifičnosti supstrata ovih proteina i do pojave funkcionalne raznolikosti unutar porodice.
3. Porodica imunoglobulina. U funkcionisanju imunološkog sistema veliku ulogu igraju proteini superfamilije imunoglobulina, koja uključuje tri porodice proteina:
Antitijela (imunoglobulini);
T-limfocitni receptori;
Proteini glavnog kompleksa histokompatibilnosti - MHC klase 1 i 2 (Major Histocompatibility Complex).
Svi ovi proteini imaju strukturu domena, sastoje se od homolognih imunosnih domena i obavljaju slične funkcije: u interakciji su sa stranim strukturama, bilo otopljenim u krvi, limfi ili međućelijskoj tekućini (antitijela), bilo lociranim na površini ćelije (vlastite ili strani).
4. Antitijela- specifični proteini koje proizvode B limfociti kao odgovor na ulazak strane strukture u tijelo, tzv antigen.
Karakteristike strukture antitijela
Najjednostavniji molekuli antitijela sastoje se od četiri polipeptidna lanca: dva identična laka - L, koja sadrže oko 220 aminokiselina, i dva identična teška - H, koja se sastoje od 440-700 aminokiselina. Sva četiri lanca u molekulu antitijela povezana su mnogim nekovalentnim vezama i četiri disulfidne veze (slika 1.30).
Laki lanci antitijela sastoje se od dva domena: varijabilnog domena (VL), smještenog u N-terminalnom području polipeptidnog lanca, i konstantnog domena (CL), smještenog na C-terminusu. Teški lanci obično imaju četiri domena: jedan varijabilni (VH), koji se nalazi na N-terminusu, i tri konstantna domena (CH1, CH2, CH3) (vidi sliku 1.30). Svaka domena imunoglobulina ima β-listu superstrukturu u kojoj su dva cisteinska ostatka povezana disulfidnom vezom.
Između dva konstantna domena CH1 i CH2 nalazi se region koji sadrži veliki broj prolinskih ostataka, koji sprečavaju stvaranje sekundarne strukture i interakciju susednih H-lanaca u ovom segmentu. Ovaj zglobni region daje fleksibilnost molekulu antitijela. Između varijabilnih domena teškog i lakog lanca postoje dva identična mjesta vezanja antigena (aktivna mjesta za vezivanje antigena), pa se takva antitijela često nazivaju bivalenti. Nije cela aminokiselinska sekvenca varijabilnih regiona oba lanca uključena u vezivanje antigena za antitelo, već samo 20-30 aminokiselina koje se nalaze u hipervarijabilnim regionima svakog lanca. Upravo ovi regioni određuju jedinstvenu sposobnost svakog tipa antitela da interaguje sa odgovarajućim komplementarnim antigenom.
Antitijela su jedna od linija odbrane tijela od invazije stranih organizama. Njihovo funkcionisanje se može podijeliti u dvije faze: prva faza je prepoznavanje i vezivanje antigena na površini stranih organizama, što je moguće zbog prisustva mjesta za vezivanje antigena u strukturi antitijela; druga faza je pokretanje procesa inaktivacije i uništavanja antigena. Specifičnost druge faze zavisi od klase antitela. Postoji pet klasa teških lanaca, koji se međusobno razlikuju po strukturi konstantnih domena: α, δ, ε, γ i μ, prema kojima se razlikuje pet klasa imunoglobulina: A, D, E, G i M.
Strukturne karakteristike teških lanaca daju zglobnim regionima i C-terminalnim regionima teških lanaca konformaciju karakterističnu za svaku klasu. Nakon što se antigen veže za antitelo, konformacione promene u konstantnim domenima određuju put za uklanjanje antigena.
 Rice. 1. 30. Struktura domena IgG
Rice. 1. 30. Struktura domena IgG
Imunoglobulini M
Imunoglobulini M imaju dva oblika.
Monomerni oblik- 1. klasa antitela proizvedenih razvojem B limfocita. Nakon toga, mnoge B ćelije prelaze na proizvodnju drugih klasa antitela, ali sa istim mestom za vezivanje antigena. IgM je ugrađen u membranu i djeluje kao receptor za prepoznavanje antigena. Integracija IgM u ćelijsku membranu moguća je zbog prisustva 25 hidrofobnih aminokiselinskih ostataka u repnom dijelu regije.
Sekretorni oblik IgM sadrži pet monomernih podjedinica povezanih jedna s drugom disulfidnim vezama i dodatni polipeptidni J lanac (slika 1.31). Teški lanci monomera ovog oblika ne sadrže hidrofobni rep. Pentamer ima 10 mjesta za vezivanje antigena i stoga je efikasan u prepoznavanju i uklanjanju antigena koji prvi uđe u tijelo. Sekretorni oblik IgM je glavna klasa antitijela koja se izlučuju u krv tokom primarnog imunološkog odgovora. Vezivanje IgM za antigen menja konformaciju IgM i indukuje njegovo vezivanje za prvu proteinsku komponentu sistema komplementa (sistem komplementa je skup proteina uključenih u uništavanje antigena) i aktivaciju ovog sistema. Ako se antigen nalazi na površini mikroorganizma, sistem komplementa uzrokuje narušavanje integriteta stanične membrane i smrt bakterijske ćelije.
Imunoglobulini G
Kvantitativno, ova klasa imunoglobulina dominira u krvi (75% svih Ig). IgG - monomeri, glavna klasa antitela koja se izlučuju u krv tokom sekundarnog imunološkog odgovora. Nakon interakcije IgG sa površinskim antigenima mikroorganizama, kompleks antigen-antitelo je u stanju da veže i aktivira proteine sistema komplementa ili može da stupi u interakciju sa specifičnim receptorima makrofaga i neutrofila. Interakcija sa fagocitima vodi
 Rice. 1.31. Struktura sekretornog oblika IgM
Rice. 1.31. Struktura sekretornog oblika IgM
na apsorpciju kompleksa antigen-antitijelo i njihovo uništavanje u ćelijskim fagosomima. IgG je jedina klasa antitijela koja mogu prodrijeti kroz placentnu barijeru i pružiti intrauterinu zaštitu fetusa od infekcija.
Imunoglobulini A
Glavna klasa antitela prisutna je u sekretima (mleko, pljuvačka, sekreti respiratornog i crevnog trakta). IgA se prvenstveno luči u dimernom obliku, gde su monomeri međusobno povezani preko dodatnog J lanca (slika 1.32).
IgA ne stupa u interakciju sa sistemom komplementa i fagocitnim ćelijama, ali vezujući se za mikroorganizme, antitela sprečavaju njihovo vezivanje za epitelne ćelije i prodiranje u organizam.
Imunoglobulini E
Imunoglobulini E su predstavljeni monomerima u kojima teški ε-lanci sadrže, poput μ-lanaca imunoglobulina M, jedan varijabilni i četiri konstantna domena. Nakon izlučivanja, IgE se vezuje za svoj
 Rice. 1.32. Struktura IgA
Rice. 1.32. Struktura IgA
C-terminalne regije sa odgovarajućim receptorima na površini mastocita i bazofila. Kao rezultat, oni postaju receptori za antigene na površini ovih ćelija (slika 1.33).
 Rice. 1.33. Interakcija IgE sa antigenom na površini mastocita
Rice. 1.33. Interakcija IgE sa antigenom na površini mastocita
Nakon što se antigen veže za odgovarajuća mjesta vezanja antigena IgE, stanice primaju signal za biološki lučenje aktivne supstance(histamin, serotonin), koji su u velikoj mjeri odgovorni za nastanak upalne reakcije i za ispoljavanje alergijskih reakcija kao što su astma, urtikarija, peludna groznica.
Imunoglobulini D
Imunoglobulini D se nalaze u vrlo malim količinama u serumu; oni su monomeri. Teški δ lanci imaju jedan varijabilni i tri konstantna domena. IgD djeluju kao receptori za B limfocite; druge funkcije su još uvijek nepoznate. Interakcija specifičnih antigena sa receptorima na površini B-limfocita (IgD) dovodi do prenošenja ovih signala u ćeliju i aktivacije mehanizama koji osiguravaju proliferaciju datog limfocitnog klona.
TEMA 1.7. FIZIČKA I HEMIJSKA SVOJSTVA PROTEINA I METODE NJIHOVOG ODJELJAVANJA
1. Pojedini proteini se razlikuju po fizičkim i hemijskim svojstvima:
Oblik molekula;
Molekularna težina;
Ukupni naboj, čija veličina ovisi o omjeru anjonskih i kationskih grupa aminokiselina;
Odnos polarnih i nepolarnih radikala aminokiselina na površini molekula;
Stepeni otpornosti na različite denaturacijske agense.
2. Rastvorljivost proteina zavisi na svojstva gore navedenih proteina, kao i na sastav medijuma u kome je protein otopljen (pH vrednosti, sastav soli, temperatura, prisustvo drugih organskih supstanci koje mogu da stupe u interakciju sa proteinom). Količina naelektrisanja proteinskih molekula je jedan od faktora koji utiče na njihovu rastvorljivost. Kada se naboj u izoelektričnoj tački izgubi, proteini se lakše agregiraju i talože. Ovo je posebno tipično za denaturirane proteine, kod kojih se na površini pojavljuju hidrofobni radikali aminokiselina.
Na površini proteinske molekule nalaze se i pozitivno i negativno nabijeni radikali aminokiselina. Broj ovih grupa, a samim tim i ukupni naboj proteina, zavisi od pH sredine, tj. odnos koncentracija H+ - i OH - grupa. U kiseloj sredini Povećanje koncentracije H+ dovodi do supresije disocijacije karboksilnih grupa -COO - + H+ > - COOH i smanjenja negativnog naboja proteina. U alkalnom okruženju, vezivanje viška OH - od strane protona nastalih pri disocijaciji amino grupa -NH 3 + + OH - - NH 2 + H 2 O sa formiranjem vode, dovodi do smanjenja pozitivnog naboja proteina . Naziva se pH vrijednost pri kojoj protein ima neto nulti naboj izoelektrična tačka (IEP). U IET-u je isti broj pozitivno i negativno nabijenih grupa, tj. protein je u izoelektričnom stanju.
3. Odvajanje pojedinačnih proteina. Osobine strukture i funkcioniranja tijela zavise od skupa proteina koji se sintetiziraju u njemu. Proučavanje strukture i svojstava proteina nemoguće je bez njihove izolacije iz ćelije i pročišćavanja od drugih proteina i organskih molekula. Faze izolacije i pročišćavanja pojedinačnih proteina:
Uništavanje ćelija tkivo koje se proučava i dobijanje homogenata.
Odvajanje homogenata na frakcije centrifugiranjem, dobivanjem nuklearne, mitohondrijske, citosolne ili druge frakcije koja sadrži željeni protein.
Selektivna termička denaturacija- kratkotrajno zagrevanje rastvora proteina, tokom kojeg se može ukloniti deo denaturisanih proteinskih nečistoća (ako je protein relativno toplotno stabilan).
Salting out. Različiti proteini precipitiraju pri različitim koncentracijama soli u otopini. Postepenim povećanjem koncentracije soli moguće je dobiti veći broj zasebnih frakcija sa dominantnim sadržajem izolovanog proteina u jednoj od njih. Amonijum sulfat se najčešće koristi za frakcionisanje proteina. Proteini sa najmanjom rastvorljivošću talože se pri niskim koncentracijama soli.
Gel filtracija- metoda prosijavanja molekula kroz nabubrele granule sefadeksa (trodimenzionalni polisaharidni lanci dekstrana koji imaju pore). Brzina kojom proteini prolaze kroz kolonu ispunjenu Sephadexom ovisit će o njihovoj molekularnoj težini: što je manja masa proteinskih molekula, to lakše prodiru u granule i ostaju tamo duže od više mase, što brže eluiraju iz kolone.
Ultracentrifugiranje- metoda koja uključuje stavljanje proteina u cijev za centrifugu u rotor ultracentrifuge. Kada se rotor rotira, brzina sedimentacije proteina je proporcionalna njihovoj molekularnoj težini: frakcije težih proteina nalaze se bliže dnu epruvete, lakših - bliže površini.
Elektroforeza- metoda zasnovana na razlikama u brzini kretanja proteina u električnom polju. Ova vrijednost je proporcionalna naboju proteina. Elektroforeza proteina se izvodi na papiru (u ovom slučaju brzina kretanja proteina je proporcionalna samo njihovom naboju) ili u poliakrilamidnom gelu sa određenom veličinom pora (brzina kretanja proteina je proporcionalna njihovom naboju i molekulskoj težini) .
Ionska izmjenjivačka hromatografija- metoda frakcionisanja zasnovana na vezivanju jonizovanih grupa proteina sa suprotno nabijenim grupama jonoizmenjivačkih smola (nerastvorljivi polimerni materijali). Snaga vezivanja proteina za smolu proporcionalna je naboju proteina. Proteini adsorbovani na polimer za ionsku izmjenu mogu se isprati povećanjem koncentracija otopina NaCl; što je niži naboj proteina, to je manja koncentracija NaCl potrebna da bi se isprao protein vezan za jonske grupe smole.
Afinitetna hromatografija- najspecifičnija metoda za izolaciju pojedinačnih proteina.Ligand proteina je kovalentno vezan za inertni polimer. Kada se rastvor proteina prođe kroz kolonu sa polimerom, samo protein specifičan za dati ligand se adsorbuje na koloni zbog komplementarnog vezivanja proteina za ligand.
Dijaliza- metoda koja se koristi za uklanjanje jedinjenja male molekularne težine iz rastvora izolovanog proteina. Metoda se zasniva na nemogućnosti proteina da prođu kroz polupropusnu membranu, za razliku od supstanci male molekularne težine. Koristi se za pročišćavanje proteina od niskomolekularnih nečistoća, na primjer, soli nakon soljenja.
ZADACI ZA VANNASTAVNI RAD
1. Popunite tabelu. 1.4.
Tabela 1.4. Komparativna analiza struktura i funkcije srodnih proteina - mioglobina i hemoglobina
a) zapamtite strukturu aktivnog centra Mb i Hb. Kakvu ulogu imaju hidrofobni radikali aminokiselina u formiranju aktivnih centara ovih proteina? Opisati strukturu aktivnog centra Mb i Hb i mehanizme vezivanja liganada za njega. Koju ulogu igraju ostaci His F 8 i His E 7 u funkcionisanju aktivnog centra Mv iHv?
b) koja nova svojstva u poređenju sa monomernim mioglobinom ima blisko srodni oligomerni protein, hemoglobin? Objasniti ulogu kooperativnih promjena u konformaciji protomera u molekuli hemoglobina, utjecaj koncentracije CO 2 i protona na afinitet hemoglobina za kisik, kao i ulogu 2,3-BPG u alosteričnoj regulaciji Hb funkcije .
2. Okarakterizirajte molekularne pratioce, obraćajući pažnju na odnos između njihove strukture i funkcije.
3. Koji su proteini grupisani u porodice? Koristeći primjer porodice imunoglobulina, identificirajte slične strukturne karakteristike i srodne funkcije proteina ove porodice.
4. Pročišćeni pojedinačni proteini su često potrebni u biohemijske i medicinske svrhe. Objasnite koje fizička i hemijska svojstva proteini se zasnivaju na metodama koje se koriste za njihovo odvajanje i prečišćavanje.
ZADACI SAMOKONTROLE
1. Odaberite tačne odgovore.
Funkcije hemoglobina:
A. Transport O2 iz pluća u tkivo B. Transport H+ iz tkiva u pluća
B. Održavanje konstantnog pH krvi D. Transport CO 2 iz pluća u tkiva
D. Transport CO 2 iz tkiva u pluća
2. Odaberite tačne odgovore. Ligandα -protomer Hb je: A. Heme
B. Kiseonik
B. CO G. 2,3-BPG
D. β-protomer
3. Odaberite tačne odgovore.
Hemoglobin za razliku od mioglobina:
A. Ima kvartarnu strukturu
B. Sekundarna struktura je predstavljena samo α-helicima
B. Pripada kompleksnim proteinima
D. Interagira sa alosteričnim ligandom D. Kovalentno vezan za hem
4. Odaberite tačne odgovore.
Smanjuje se afinitet Hb prema O2:
A. Kada se doda jedan O 2 molekul B. Kada se ukloni jedan O 2 molekul
B. Kod interakcije sa 2,3-BPG
D. Kada se veže na protomere H + D. Kada se koncentracija 2,3-BPG smanji
5. Match.
Tipove HB karakteriziraju:
A. U deoksi obliku formira fibrilarne agregate B. Sadrži dva α- i dva δ-lanca
B. Preovlađujući oblik Hb u eritrocitima odraslih D. Sadrži hem sa Fe+ 3 u aktivnom centru
D. Sadrži dva α- i dva γ-lanca 1. HbA 2.
6. Match.
Hb ligandi:
A. Veže se za Hb u alosteričnom centru
B. Ima vrlo visok afinitet za aktivno mjesto Hb
B. Spajanjem povećava afinitet Hb za O 2 G. Oksidira Fe+ 2 u Fe+ 3
D. Obrasci kovalentna veza sa gisF8
7. Odaberite tačne odgovore.
pratioci:
A. Proteini prisutni u svim dijelovima ćelije
B. Sinteza se povećava pod stresom
B. Učestvuje u hidrolizi denaturiranih proteina
D. Učestvuje u održavanju prirodne konformacije proteina
D. Stvaraju organele u kojima se formira konformacija proteina.
8. Utakmica. Imunoglobulini:
A. Sekretorni oblik je pentameričan.
B. Klasa Ig koja prodire kroz placentnu barijeru
B. Ig - receptor mastocita
D. Glavna klasa Ig prisutna u sekretima epitelnih ćelija. D. B-limfocitni receptor, čija aktivacija osigurava proliferaciju ćelija
9. Odaberite tačne odgovore.
Imunoglobulini E:
A. Proizvode ih makrofagi B. Imaju teške ε lance.
B. Ugrađen u membranu T-limfocita
D. Djeluju kao receptori membranskog antigena na mastocitima i bazofilima
D. Odgovoran za alergijske reakcije
10. Odaberite tačne odgovore.
Metoda odvajanja proteina zasniva se na razlikama u njihovoj molekularnoj težini:
A. Gel filtracija
B. Ultracentrifugiranje
B. Elektroforeza na poliakrilamidnom gelu D. Jonska izmjenjivačka hromatografija
D. Afinitetna hromatografija
11. Izaberi tačan odgovor.
Metoda odvajanja proteina zasniva se na razlikama u njihovoj rastvorljivosti u vodi:
A. Gel filtracija B. Soljenje
B. Hromatografija jonske izmjene D. Afinitetna hromatografija
D. Elektroforeza u poliakrilamidnom gelu
STANDARDI ODGOVORA NA “ZADAKE SAMOKONTROLE”
1. A, B, C, D
2. A, B, C, D
5. 1-B, 2-A, 3-G
6. 1-B, 2-B, 3-A
7. A, B, D, D
8. 1-G; 2-B, 3-B
OSNOVNI POJMOVI I POJMOVI
1. Oligomerni proteini, protomer, kvaternarna struktura proteina
2. Kooperativne promjene u konformaciji protomera
3. Borov efekat
4. Alosterična regulacija proteinskih funkcija, alosterični centar i alosterični efektor
5. Molekularni pratioci, proteini toplotnog šoka
6. Porodice proteina (serinske proteaze, imunoglobulini)
7. IgM-, G-, E-, A-struktura-funkcija odnos
8. Ukupan naboj proteina, izoelektrična tačka proteina
9. Elektroforeza
10. Soljenje
11. Gel filtracija
12. Jonska izmjenjivačka hromatografija
13. Ultracentrifugiranje
14. Afinitetna hromatografija
15. Elektroforeza proteina krvne plazme
ZADACI ZA RAD U UČIONICI
1. Uporedite zavisnosti stepena zasićenosti hemoglobina (Hb) i mioglobina (Mb) kiseonikom o njegovom parcijalnom pritisku u tkivima
 Rice. 1.34. Zavisnost zasićenja Mv iNHkiseonik iz njegovog parcijalnog pritiska
Rice. 1.34. Zavisnost zasićenja Mv iNHkiseonik iz njegovog parcijalnog pritiska
Imajte na umu da je oblik krivulja zasićenosti proteina kisikom različit: za mioglobin - hiperbola, za hemoglobin - sigmoidni oblik.
1. uporediti vrednosti parcijalnog pritiska kiseonika pri kojem su Mb i Hb zasićeni O 2 za 50%. Koji od ovih proteina ima veći afinitet za O2?
2. Koje strukturne karakteristike Mb određuju njegov visok afinitet za O 2?
3. Koje strukturne karakteristike HB mu omogućavaju da otpušta O2 u kapilare tkiva u mirovanju (pri relativno visokom parcijalnom pritisku O2) i naglo povećava ovo oslobađanje u mišićima koji rade? Koje svojstvo oligomernih proteina obezbeđuje ovaj efekat?
4. Izračunajte koju količinu O 2 (u%) hemoglobina sa kiseonikom daje mišićima koji se odmaraju i rade?
5. izvući zaključke o odnosu između strukture proteina i njegove funkcije.
2. Količina kiseonika koju hemoglobin oslobađa u kapilarama zavisi od intenziteta kataboličkih procesa u tkivima (Bohrov efekat). Kako promjene u metabolizmu tkiva regulišu afinitet Hb prema O2? Utjecaj CO 2 i H+ na afinitet Hb za O 2
 1. opisati Bohrov efekat.
1. opisati Bohrov efekat.
2. u kom pravcu se odvija proces prikazan na dijagramu:
a) u kapilarama pluća;
b) u tkivnim kapilarama?
3. Koji je fiziološki značaj Bohrovog efekta?
4. Zašto interakcija Hb sa H+ na mjestima udaljenim od hema mijenja afinitet proteina za O 2?
3. Afinitet Hb za O2 zavisi od koncentracije njegovog liganda - 2,3-bisfosfoglicerata, koji je alosterički regulator afiniteta Hb za O2. Zašto interakcija liganda na mjestu udaljenom od aktivnog mjesta utječe na funkciju proteina? Kako 2,3-BPG reguliše afinitet Hb prema O2? Da biste riješili problem, odgovorite na sljedeća pitanja:
1. gdje i od čega se sintetiše 2,3-bisfosfoglicerat (2,3-BPG)? Napišite njegovu formulu, označite naboj ovog molekula.
2. S kojim oblikom hemoglobina (oksi ili deoksi) BPG stupa u interakciju i zašto? U kom dijelu molekula Hb dolazi do interakcije?
3. u kom pravcu se odvija proces prikazan na dijagramu?
a) u tkivnim kapilarama;
b) u kapilarama pluća?
4. gdje bi koncentracija kompleksa trebala biti veća
Nv-2,3-BFG:
a) u kapilarama mišića u mirovanju,
b) u kapilarama mišića koji rade (pod uslovom da ista koncentracija BPG u eritrocitima)?
5. Kako će se promijeniti afinitet HB prema kiseoniku kada se osoba prilagodi visinskim uslovima, ako se poveća koncentracija BPG u eritrocitima? Koji je fiziološki značaj ovog fenomena?
4. Uništavanje 2,3-BPG tokom skladištenja konzervirane krvi narušava funkcije HB. Kako će se promijeniti afinitet HB prema O 2 u očuvanoj krvi ako se koncentracija 2,3-BPG u eritrocitima može smanjiti sa 8 na 0,5 mmol/l. Je li moguće transfuzirati takvu krv teškim bolesnicima ako se koncentracija 2,3-BPG vrati najkasnije nakon tri dana? Da li je moguće vratiti funkcije crvenih krvnih zrnaca dodavanjem 2,3-BPG u krv?
5. Zapamtite strukturu najjednostavnijih molekula imunoglobulina. Kakvu ulogu imaju imunoglobulini u imunološkom sistemu? Zašto se Ig često nazivaju bivalentnim? Kako je struktura Ig vezana za njihovu funkciju? (Opišite na primjeru klase imunoglobulina.)
Fizičko-hemijska svojstva proteina i metode njihovog odvajanja.
6. Kako neto naboj proteina utiče na njegovu rastvorljivost?
a) odrediti ukupni naboj peptida pri pH 7
Ala-Glu-Tre-Pro-Asp-Liz-Cis
b) kako će se promijeniti naboj ovog peptida pri pH >7, pH<7, рН <<7?
c) koja je izoelektrična tačka proteina (IEP) i u kojoj sredini leži?
IET ovog peptida?
d) pri kojoj pH vrijednosti će se uočiti najniža rastvorljivost ovog peptida.
7. Zašto se kiselo mlijeko, za razliku od svježeg mlijeka, „sgruša“ kada se prokuha (tj. mliječni protein kazein precipitira)? U svježem mlijeku molekuli kazeina imaju negativan naboj.
8. Za odvajanje pojedinačnih proteina koristi se gel filtracija. Smjesa koja sadrži proteine A, B, C molekulske težine jednake 160.000, 80.000 i 60.000, analizirana je gel filtracijom (slika 1.35). Nabubrele granule gela su propusne za proteine sa molekulskom težinom manjom od 70 000. Koji princip leži u osnovi ove metode razdvajanja? Koji grafikon ispravno odražava rezultate frakcioniranja? Navedite redoslijed kojim se proteini A, B i C oslobađaju iz kolone.
 Rice. 1.35. Korištenje gel filtracije za odvajanje proteina
Rice. 1.35. Korištenje gel filtracije za odvajanje proteina
9. Na sl. 1.36, A prikazuje dijagram elektroforeze na papiru proteina krvnog seruma zdrave osobe. Relativne količine proteinskih frakcija dobijenih ovom metodom su: albumini 54-58%, α1-globulini 6-7%, α2-globulini 8-9%, β-globulini 13%, γ-globulini 11-12% .
 Rice. 1.36 Elektroforeza na papiru proteina krvne plazme zdrave osobe (A) i pacijenta (B)
Rice. 1.36 Elektroforeza na papiru proteina krvne plazme zdrave osobe (A) i pacijenta (B)
I - γ-globulini; II - β-globulini; III -α 2 -globulin; IV -α 2 -globulin; V - albumini
Mnoge bolesti su praćene kvantitativnim promjenama u sastavu serumskih proteina (disproteinemija). Priroda ovih promjena uzima se u obzir prilikom postavljanja dijagnoze i procjene težine i stadijuma bolesti.
1. Zašto se proteini smatraju polimerima?
Odgovori. Proteini su polimeri, odnosno molekuli izgrađeni poput lanaca od ponavljajućih monomernih jedinica, ili podjedinica, koje se sastoje od aminokiselina povezanih u određenom nizu peptidnom vezom. One su osnovne i neophodne komponente svih organizama.
Postoje jednostavni proteini (proteini) i složeni proteini (proteidi). Proteini su proteini čiji molekuli sadrže samo proteinske komponente. Kada se potpuno hidroliziraju, nastaju aminokiseline.
Proteidi su složeni proteini čije se molekule značajno razlikuju od proteinskih molekula po tome što, pored same proteinske komponente, sadrže komponentu niske molekularne težine neproteinske prirode
2. Koje funkcije proteina znate?
Odgovori. Proteini obavljaju sljedeće funkcije: konstrukcijsku, energetsku, katalitičku, zaštitnu, transportnu, kontraktilnu, signalnu i druge.
Pitanja nakon § 11
1. Koje supstance se nazivaju proteini?
Odgovori. Proteini ili proteini su biološki polimeri čiji su monomeri aminokiseline. Sve aminokiseline imaju amino grupu (-NH2) i karboksilnu grupu (-COOH) i razlikuju se po strukturi i svojstvima radikala. Aminokiseline su međusobno povezane peptidnim vezama, zbog čega se proteini nazivaju i polipeptidi.
Odgovori. Molekuli proteina mogu poprimiti različite prostorne oblike – konformacije, koje predstavljaju četiri nivoa njihove organizacije. Linearna sekvenca aminokiselina unutar polipeptidnog lanca predstavlja primarnu strukturu proteina. Jedinstven je za svaki protein i određuje njegov oblik, svojstva i funkcije.
3. Kako nastaju sekundarne, tercijarne i kvartarne strukture proteina?
Odgovori. Sekundarna struktura proteina formirana je formiranjem vodikovih veza između -CO- i -NH- grupa. U ovom slučaju, polipeptidni lanac se uvija u spiralu. Heliks može dobiti konfiguraciju globule, budući da nastaju različite veze između radikala aminokiselina u spirali. Globula je tercijarna struktura proteina. Ako se nekoliko globula spoji u jedan složeni kompleks, nastaje kvartarna struktura. Na primjer, hemoglobin u ljudskoj krvi formiraju četiri globule.
4. Šta je denaturacija proteina?
Odgovori. Kršenje prirodne strukture proteina naziva se denaturacija. Pod uticajem niza faktora (hemijskih, radioaktivnih, temperaturnih, itd.) kvartarne, tercijarne i sekundarne strukture proteina mogu biti uništene. Ako prestane djelovanje faktora, protein može obnoviti svoju strukturu. Ako se učinak faktora poveća, primarna struktura proteina - polipeptidni lanac - također je uništena. Ovo je nepovratan proces - protein ne može obnoviti svoju strukturu
5. Na osnovu čega se proteini dijele na jednostavne i složene?
Odgovori. Jednostavni proteini se sastoje isključivo od aminokiselina. Složeni proteini mogu uključivati i druge organske tvari: ugljikohidrate (tada se zovu glikoproteini), masti (lipoproteini), nukleinske kiseline (nukleoproteini).
6. Koje funkcije proteina znate?
Odgovori. Konstrukcijska (plastična) funkcija. Proteini su strukturna komponenta bioloških membrana i ćelijskih organela, a također su dio potpornih struktura tijela, kose, noktiju i krvnih žila. Enzimska funkcija. Proteini služe kao enzimi, odnosno biološki katalizatori koji ubrzavaju brzinu biohemijskih reakcija desetine i stotine miliona puta. Primjer je amilaza, koja razlaže škrob na monosaharide. Kontraktilna (motorna) funkcija. Izvode ga posebni kontraktilni proteini koji osiguravaju kretanje stanica i unutarćelijskih struktura. Zahvaljujući njima, hromozomi se pomeraju tokom deobe ćelije, a flagele i cilije pomeraju ćelije protozoa. Kontraktilna svojstva proteina aktina i miozina su u osnovi mišićne funkcije. Transportna funkcija. Proteini su uključeni u transport molekula i jona unutar tijela (hemoglobin prenosi kisik iz pluća do organa i tkiva, serumski albumin je uključen u transport masnih kiselina). Zaštitna funkcija. Sastoji se od zaštite tijela od oštećenja i invazije stranih proteina i bakterija. Proteini antitijela koje proizvode limfociti stvaraju odbranu tijela od strane infekcije; trombin i fibrin su uključeni u formiranje krvnog ugruška, čime pomažu tijelu da izbjegne velike gubitke krvi. Regulatorna funkcija. Obavljaju ga hormonski proteini. Učestvuju u regulaciji aktivnosti ćelija i svih vitalnih procesa u telu. Dakle, insulin reguliše nivo šećera u krvi i održava ga na određenom nivou. Funkcija signala. Proteini ugrađeni u ćelijsku membranu su sposobni da promene svoju strukturu kao odgovor na iritaciju. Dakle, signali se prenose iz vanjskog okruženja u ćeliju. Energetska funkcija. Ostvaruju ga proteini izuzetno rijetko. Potpunom razgradnjom 1 g proteina može se osloboditi 17,6 kJ energije. Međutim, proteini su veoma vrijedan spoj za tijelo. Stoga se razgradnja proteina obično događa do aminokiselina, od kojih se grade novi polipeptidni lanci. Hormonski proteini regulišu aktivnost ćelije i sve životne procese u telu. Dakle, u ljudskom tijelu somatotropin je uključen u regulaciju rasta tijela, inzulin održava razinu glukoze u krvi na konstantnom nivou.
7. Kakvu ulogu imaju proteini hormona?
Odgovori. Regulatorna funkcija je inherentna hormonskim proteinima (regulatorima). Regulišu različite fiziološke procese. Na primjer, najpoznatiji hormon je inzulin, koji reguliše nivo glukoze u krvi. Kada u tijelu nema dovoljno inzulina, javlja se bolest poznata kao dijabetes melitus.
8. Koju funkciju obavljaju proteini enzima?
Odgovori. Enzimi su biološki katalizatori, odnosno ubrzavaju hemijske reakcije stotine miliona puta. Enzimi imaju strogu specifičnost za supstancu koja reaguje. Svaku reakciju katalizira vlastiti enzim.
9. Zašto se proteini rijetko koriste kao izvor energije?
Odgovori. Proteinski monomeri aminokiselina su vrijedne sirovine za izgradnju novih proteinskih molekula. Zbog toga retko dolazi do potpunog razlaganja polipeptida u neorganske supstance. Posljedično, energetsku funkciju, koja se sastoji u oslobađanju energije nakon potpunog razgradnje, proteini obavljaju prilično rijetko.
Bjelanjak je tipičan protein. Saznajte šta će se s njim dogoditi ako bude izloženo vodi, alkoholu, acetonu, kiselini, lužini, biljnom ulju, visokoj temperaturi itd.
Odgovori. Kao rezultat djelovanja visoke temperature na bjelanjak, doći će do denaturacije proteina. Kada su izloženi alkoholu, acetonu, kiselinama ili alkalijama, dešava se otprilike ista stvar: protein se koagulira. Ovo je proces u kojem se tercijarna i kvarterna struktura proteina poremeti zbog pucanja vodikovih i jonskih veza.
U vodi i biljnom ulju, proteini zadržavaju svoju strukturu.
Sameljite sirovi gomolj krompira u kašu. Uzmite tri epruvete i u svaku stavite malu količinu nasjeckanog krompira.
Prvu epruvetu stavite u zamrzivač frižidera, drugu na donju policu frižidera, a treću u teglu tople vode (t = 40 °C). Nakon 30 minuta izvadite epruvete i u svaku ukapajte malu količinu vodikovog peroksida. Posmatrajte šta se dešava u svakoj epruveti. Objasnite svoje rezultate
Odgovori. Ovaj eksperiment ilustruje aktivnost enzima katalaze u živoj ćeliji na vodikovom peroksidu. Kao rezultat reakcije, oslobađa se kisik. Dinamika oslobađanja mjehurića može se koristiti za procjenu aktivnosti enzima.
Iskustvo nam je omogućilo da zabilježimo sljedeće rezultate:
Aktivnost katalaze zavisi od temperature:
1. Epruveta 1: nema mjehurića - to je zato što su se na niskim temperaturama ćelije krompira srušile.
2. Epruveta 2: postoji mali broj mjehurića - jer je aktivnost enzima na niskim temperaturama niska.
3. Epruveta 3: ima puno mjehurića, temperatura je optimalna, katalaza je vrlo aktivna.
U prvu epruvetu sa krompirom kapnite nekoliko kapi vode, u drugu nekoliko kapi kiseline (stonog sirćeta), a u treću lužinu.
Posmatrajte šta se dešava u svakoj epruveti. Objasnite svoje rezultate. Izvucite zaključke.
Odgovori. Kada se doda voda, ništa se ne dešava, kada se doda kiselina, dolazi do malo potamnjivanja, kada se doda lužina dolazi do “pjenjenja” - alkalne hidrolize.
Kao što znate, proteini su osnova za nastanak života na našoj planeti. Ali upravo je koacervatna kapljica, koja se sastoji od peptidnih molekula, postala osnova za nastanak živih bića. To je nesumnjivo, jer analiza unutrašnjeg sastava bilo kojeg predstavnika biomase pokazuje da su te tvari prisutne u svemu: biljkama, životinjama, mikroorganizmima, gljivama, virusima. Štaviše, vrlo su raznolike i makromolekularne prirode.
Ove strukture imaju četiri imena, svi su sinonimi:
- proteini;
- proteini;
- polipeptidi;
- peptidi.
Proteinski molekuli
Njihov broj je zaista nebrojen. U ovom slučaju, svi proteinski molekuli mogu se podijeliti u dvije velike grupe:
- jednostavno - sastoje se samo od sekvenci aminokiselina povezanih peptidnim vezama;
- kompleks - strukturu i strukturu proteina karakteriziraju dodatne protolitičke (prostetske) grupe, koje se nazivaju i kofaktori.
U isto vrijeme, složeni molekuli također imaju svoju klasifikaciju.
Gradacija kompleksnih peptida
- Glikoproteini su blisko povezani spojevi proteina i ugljikohidrata. Protetske grupe mukopolisaharida su utkane u strukturu molekula.
- Lipoproteini su složeno jedinjenje proteina i lipida.
- Metaloproteini - metalni joni (gvožđe, mangan, bakar i drugi) deluju kao protetička grupa.
- Nukleoproteini su veza između proteina i nukleinskih kiselina (DNK, RNA).
- Fosfoproteini - konformacija proteina i ostatka ortofosforne kiseline.
- Hromoproteini su vrlo slični metaloproteinima, međutim, element koji je dio protetske grupe je cijeli obojeni kompleks (crvena - hemoglobin, zelena - hlorofil i tako dalje).
U svakoj razmatranoj grupi, struktura i svojstva proteina su različiti. Funkcije koje obavljaju također variraju ovisno o vrsti molekula.

Hemijska struktura proteina
Sa ove tačke gledišta, proteini su dugačak, masivni lanac aminokiselinskih ostataka koji su međusobno povezani specifičnim vezama koje se nazivaju peptidne veze. Grane koje se nazivaju radikali protežu se od bočnih struktura kiselina. Ovu molekularnu strukturu otkrio je E. Fischer početkom 21. stoljeća.
Kasnije su proteini, struktura i funkcije proteina detaljnije proučavani. Postalo je jasno da postoji samo 20 aminokiselina koje čine strukturu peptida, ali se one mogu kombinovati na različite načine. Otuda i raznolikost polipeptidnih struktura. Osim toga, u procesu života i obavljanju svojih funkcija, proteini su u stanju proći niz kemijskih transformacija. Kao rezultat toga, mijenjaju strukturu i pojavljuje se potpuno nova vrsta veze.
Da biste prekinuli peptidnu vezu, odnosno poremetili protein i strukturu lanaca, potrebno je odabrati vrlo stroge uslove (visoke temperature, kiseline ili alkalije, katalizator). To je zbog velike snage u molekuli, odnosno u peptidnoj grupi.

Detekcija strukture proteina u laboratoriji vrši se biuret reakcijom – izlaganjem svježe precipitiranom polipeptidu (II). Kompleks peptidne grupe i jona bakra daje jarko ljubičastu boju.
Postoje četiri glavne strukturne organizacije, od kojih svaka ima svoje strukturne karakteristike proteina.
Nivoi organizacije: primarna struktura
Kao što je gore spomenuto, peptid je sekvenca aminokiselinskih ostataka sa ili bez inkluzija, koenzima. Dakle, primarna je struktura molekule koja je prirodne, prirodne, istinski aminokiseline povezane peptidnim vezama, i ništa više. To jest, polipeptid sa linearnom strukturom. Štaviše, strukturne karakteristike proteina ovog tipa su da je takva kombinacija kiselina odlučujuća za obavljanje funkcija proteinske molekule. Zahvaljujući prisutnosti ovih karakteristika, moguće je ne samo identificirati peptid, već i predvidjeti svojstva i ulogu potpuno novog, još neotkrivenog. Primeri peptida sa prirodnom primarnom strukturom su insulin, pepsin, himotripsin i drugi.

Sekundarna konformacija
Struktura i svojstva proteina u ovoj kategoriji se donekle razlikuju. Takva struktura može se formirati u početku po prirodi ili kada je primarna izložena jakoj hidrolizi, temperaturi ili drugim uvjetima.
Ova konformacija ima tri varijante:
- Glatki, pravilni, stereoregularni zavoji, izgrađeni od ostataka aminokiselina, koji se uvijaju oko glavne ose veze. Zajedno ih drže samo oni koji nastaju između kiseonika jedne peptidne grupe i vodonika druge. Štoviše, struktura se smatra ispravnom zbog činjenice da se zavoji ravnomjerno ponavljaju svaka 4 veze. Takva struktura može biti ljevoruka ili desnoruka. Ali u većini poznatih proteina prevladava desnorotirajući izomer. Takve konformacije se obično nazivaju alfa strukture.
- Sastav i struktura proteina sljedećeg tipa razlikuje se od prethodnog po tome što se vodikove veze ne formiraju između ostataka uz jednu stranu molekule, već između značajno udaljenih i na prilično velikoj udaljenosti. Iz tog razloga, cijela struktura ima oblik nekoliko valovitih polipeptidnih lanaca nalik zmiji. Postoji jedna karakteristika koju protein mora pokazati. Struktura aminokiselina na granama treba da bude što kraća, poput glicina ili alanina, na primjer. Ova vrsta sekundarne konformacije naziva se beta listovi zbog njihove sposobnosti da se drže zajedno kako bi formirali zajedničku strukturu.
- Biologija se odnosi na treći tip strukture proteina kao složene, heterogeno rasute, neuređene fragmente koji nemaju stereoregularnost i koji su sposobni da menjaju strukturu pod uticajem spoljašnjih uslova.
Nisu identificirani primjeri proteina koji prirodno imaju sekundarnu strukturu.

Tercijarno obrazovanje
Ovo je prilično složena konformacija koja se zove "globula". Šta je ovaj protein? Njegova struktura je zasnovana na sekundarnoj strukturi, međutim, dodaju se novi tipovi interakcija između atoma grupa i čini se da se čitava molekula savija, fokusirajući se na činjenicu da su hidrofilne grupe usmerene u globulu, a hidrofobne one spolja.
Ovo objašnjava naboj proteinske molekule u koloidnim otopinama vode. Koje vrste interakcija su prisutne?
- Vodikove veze - ostaju nepromijenjene između istih dijelova kao u sekundarnoj strukturi.
- interakcije - nastaju kada se polipeptid otopi u vodi.
- Jonske privlačnosti nastaju između različito nabijenih grupa aminokiselinskih ostataka (radikala).
- Kovalentne interakcije - mogu se formirati između specifičnih kiselih mjesta - molekula cisteina, odnosno njihovih repova.
Dakle, sastav i struktura proteina sa tercijarnom strukturom može se opisati kao polipeptidni lanci presavijeni u globule koje zadržavaju i stabilizuju svoju konformaciju usled različitih vrsta hemijskih interakcija. Primjeri takvih peptida: fosfoglicerat kenaza, tRNA, alfa-keratin, fibroin svile i drugi.
Kvartarna struktura
Ovo je jedna od najsloženijih kuglica koje formiraju proteini. Struktura i funkcije proteina ovog tipa vrlo su višestruke i specifične.
Kakva je ovo konformacija? To je nekoliko (u nekim slučajevima i desetine) velikih i malih polipeptidnih lanaca koji se formiraju nezavisno jedan od drugog. Ali onda, zbog istih interakcija koje smo razmatrali za tercijarnu strukturu, svi ovi peptidi se uvijaju i isprepliću jedan s drugim. Na taj način se dobijaju složene konformacijske globule koje mogu sadržavati atome metala, lipidne grupe i ugljikohidrate. Primjeri takvih proteina: DNK polimeraza, proteinska ljuska virusa duhana, hemoglobin i drugi.

Sve peptidne strukture koje smo ispitivali imaju sopstvene metode identifikacije u laboratoriji, zasnovane na savremenim mogućnostima upotrebe hromatografije, centrifugiranja, elektronske i optičke mikroskopije i visokih kompjuterskih tehnologija.
Izvršene funkcije
Struktura i funkcije proteina su usko povezane jedna s drugom. Odnosno, svaki peptid igra specifičnu ulogu, jedinstvenu i specifičnu. Postoje i oni koji su sposobni da izvrše nekoliko značajnih operacija odjednom u jednoj živoj ćeliji. Međutim, moguće je izraziti u generaliziranom obliku glavne funkcije proteinskih molekula u živim organizmima:
- Obezbeđivanje kretanja. Jednoćelijski organizmi, ili organele, ili neke vrste ćelija su sposobni za kretanje, kontrakciju i kretanje. To osiguravaju proteini koji čine strukturu njihovog motoričkog aparata: cilije, flagele i citoplazmatsku membranu. Ako govorimo o ćelijama nesposobnim za kretanje, onda proteini mogu doprinijeti njihovoj kontrakciji (miozin mišića).
- Nutritivna ili rezervna funkcija. To je nakupljanje proteinskih molekula u jajima, embrionima i sjemenkama biljaka kako bi se dodatno nadoknadili nedostajući nutrijenti. Kada se razgrade, peptidi proizvode aminokiseline i biološki aktivne tvari koje su neophodne za normalan razvoj živih organizama.
- Energetska funkcija. Osim ugljikohidrata, bjelančevine također mogu pružiti snagu tijelu. Razgradnjom 1 g peptida oslobađa se 17,6 kJ korisne energije u obliku adenozin trifosforne kiseline (ATP), koja se troši na vitalne procese.
- Signalizacija se sastoji od pažljivog praćenja tekućih procesa i prenošenja signala od ćelija do tkiva, od njih do organa, od ovih do sistema itd. Tipičan primjer je inzulin, koji striktno fiksira količinu glukoze u krvi.
- Funkcija receptora. Izvodi se promjenom konformacije peptida na jednoj strani membrane i uključivanjem drugog kraja u restrukturiranje. Istovremeno se prenosi signal i potrebne informacije. Najčešće su takvi proteini ugrađeni u citoplazmatske membrane ćelija i vrše strogu kontrolu nad svim supstancama koje prolaze kroz nju. Oni također pružaju informacije o kemijskim i fizičkim promjenama u okolišu.
- Transportna funkcija peptida. Izvode ga kanalni proteini i proteini transporteri. Njihova uloga je očigledna - transport potrebnih molekula na mjesta sa niskom koncentracijom iz dijelova s visokom koncentracijom. Tipičan primjer je transport kisika i ugljičnog dioksida kroz organe i tkiva pomoću proteina hemoglobina. Oni također sprovode isporuku spojeva male molekularne težine kroz ćelijsku membranu u unutrašnjost.
- Strukturna funkcija. Jedna od najvažnijih funkcija koju obavljaju proteini. Strukturu svih ćelija i njihovih organela osiguravaju peptidi. Oni, poput okvira, određuju oblik i strukturu. Osim toga, oni ga podržavaju i modificiraju ako je potrebno. Stoga, za rast i razvoj, svi živi organizmi trebaju proteine u svojoj ishrani. Takvi peptidi uključuju elastin, tubulin, kolagen, aktin, keratin i druge.
- Katalitička funkcija. Obavljaju ga enzimi. Brojni i raznovrsni, ubrzavaju sve hemijske i biohemijske reakcije u organizmu. Bez njihovog učešća, obična jabuka u želucu mogla bi se probaviti za samo dva dana, najvjerovatnije pritom istrunuti. Pod uticajem katalaze, peroksidaze i drugih enzima, ovaj proces se odvija za dva sata. Općenito, zahvaljujući ovoj ulozi proteina provode se anabolizam i katabolizam, odnosno plastika i

Zaštitna uloga
Postoji nekoliko vrsta prijetnji od kojih su proteini dizajnirani da štite tijelo.
Prvo, traumatski reagensi, plinovi, molekuli, tvari različitog spektra djelovanja. Peptidi mogu kemijski stupiti u interakciju s njima, pretvarajući ih u bezopasan oblik ili ih jednostavno neutralizirajući.
Drugo, fizička prijetnja od rana - ako se protein fibrinogen ne transformiše u fibrin na mjestu ozljede na vrijeme, tada se krv neće zgrušati, što znači da neće doći do blokade. Tada će vam, naprotiv, biti potreban peptidni plazmin, koji može otopiti ugrušak i vratiti prohodnost žile.
Treće, prijetnja imunitetu. Struktura i značaj proteina koji formiraju imunološku odbranu su izuzetno važni. Antitijela, imunoglobulini, interferoni - sve su to važni i značajni elementi ljudskog limfnog i imunološkog sistema. Svaka strana čestica, štetni molekul, mrtvi dio ćelije ili cijela struktura podliježu trenutnom ispitivanju peptidnim spojem. Zato se osoba može samostalno, bez pomoći lijekova, svakodnevno zaštititi od infekcija i jednostavnih virusa.
Fizička svojstva
Struktura ćelijskog proteina je vrlo specifična i zavisi od funkcije koju obavlja. Ali fizička svojstva svih peptida su slična i svode se na sljedeće karakteristike.
- Težina molekula je do 1.000.000 Daltona.
- Koloidni sistemi nastaju u vodenom rastvoru. Tamo struktura dobiva naboj koji može varirati ovisno o kiselosti okoline.
- Kada su izloženi teškim uslovima (zračenje, kiselina ili alkalija, temperatura, itd.) oni su u stanju da pređu na druge nivoe konformacija, odnosno denaturaciju. Ovaj proces je nepovratan u 90% slučajeva. Međutim, postoji i obrnuti pomak – renaturacija.
Ovo su glavna svojstva fizičkih karakteristika peptida.
To su visokomolekularna organska jedinjenja, biopolimeri, izgrađeni od 20 vrsta ostataka L-?-amino kiselina povezanih određenim nizom u dugačke lance. Molekularna težina proteina varira od 5 hiljada do 1 milion. Ime "bijelci" prvo je dato tvari ptičjih jaja, koja se zgruša kada se zagrije u bijelu nerastvorljivu masu. Pojam je kasnije proširen na druge tvari sa sličnim svojstvima izolirane od životinja i biljaka.
Rice. 1. Najsloženiji biopolimeri su proteini. Njihove makromolekule sastoje se od monomera, koji su aminokiseline. Svaka aminokiselina ima dvije funkcionalne grupe: karboksilnu grupu i amino grupu. Sva raznolikost proteina nastaje kao rezultat različitih kombinacija 20 aminokiselina.
Proteini prevladavaju nad svim ostalim spojevima prisutnim u živim organizmima, obično čine više od polovine njihove suhe težine. Pretpostavlja se da u prirodi postoji nekoliko milijardi pojedinačnih proteina (na primjer, samo u bakteriji E. coli prisutno je više od 3 hiljade različitih proteina).
Proteini igraju ključnu ulogu u životnim procesima svakog organizma. Proteini uključuju enzime, uz čije učešće se odvijaju sve hemijske transformacije u ćeliji (metabolizam); kontrolišu delovanje gena; uz njihovo učešće ostvaruje se djelovanje hormona, provodi se transmembranski transport, uključujući generiranje nervnih impulsa. Sastavni su dio imunog sistema (imunoglobulini) i koagulacionog sistema, čine osnovu koštanog i vezivnog tkiva i učestvuju u transformaciji i korištenju energije.
Istorija istraživanja proteina
Prvi pokušaji da se izoluju proteini napravljeni su još u 18. veku. Početkom 19. veka pojavljuju se prvi radovi o hemijskom proučavanju proteina. Francuski naučnici Joseph Louis Gay-Lussac i Louis Jacques Thénard pokušali su ustanoviti elementarni sastav proteina iz različitih izvora, što je označilo početak sistematskih analitičkih istraživanja, zahvaljujući kojima je došlo do zaključka da su svi proteini slični u skupu elemenata koji su uključeni u njihov sastav. Godine 1836., nizozemski hemičar G. J. Mulder predložio je prvu teoriju strukture proteinskih supstanci, prema kojoj svi proteini imaju određeni hipotetski radikal (C 40 H 62 N 10 O 12), povezan u različitim omjerima s atomima sumpora i fosfora. On je ovaj radikal nazvao "proteinom" (od grčkog proteina - prvi, glavni). Mulderova teorija je doprinijela povećanju interesovanja za proučavanje proteina i poboljšanju metoda proteinske kemije. Razvijene su tehnike izolovanja proteina ekstrakcijom rastvorima neutralnih soli, a proteini su prvi put dobijeni u kristalnom obliku (neki biljni proteini). Za analizu proteina počeli su koristiti njihovu preliminarnu probavu kiselinama i alkalijama.
U isto vrijeme, sve veća pažnja se počela poklanjati proučavanju funkcije proteina. Jens Jakob Berzelius je bio prvi koji je 1835. godine predložio da igraju ulogu biokatalizatora. Ubrzo su otkriveni proteolitički enzimi - pepsin (T. Schwann, 1836) i tripsin (L. Corvisart, 1856), koji su privukli pažnju na fiziologiju probave i analizu proizvoda nastalih pri razgradnji nutrijenata. Dalja istraživanja strukture proteina i rad na hemijskoj sintezi peptida rezultirali su pojavom peptidne hipoteze prema kojoj su svi proteini građeni od aminokiselina. Do kraja 19. stoljeća proučavana je većina aminokiselina koje čine proteine.
Početkom 20. vijeka njemački hemičar Emil Hermann Fischer prvi je koristio metode organske hemije za proučavanje proteina i dokazao da se proteini sastoje od β-aminokiselina međusobno povezanih amidnom (peptidnom) vezom. Kasnije je, zahvaljujući primjeni fizičko-hemijskih metoda analize, određena molekulska masa mnogih proteina, ustanovljen sferni oblik globularnih proteina, urađena je rendgenska difrakcijska analiza aminokiselina i peptida, te metode hromatografske analize. razvijene (vidi hromatografiju).
Izolovan je prvi proteinski hormon (Frederick Grant Banting, John James Rickard McLeod, 1922), dokazano je prisustvo gama globulina u antitelima i opisana je enzimska funkcija mišićnog proteina miozina (Vladimir Aleksandrovič Engelhardt, M. N. Lyubimova, 1939) . Po prvi put su dobijeni enzimi u kristalnom obliku - ureaza (J.B. Saliner, 1926), pepsin (J.H. Nortron, 1929), lizozim (E.P. Abraham, Robert Robinson, 1937).

Rice. 2. Šema trodimenzionalne strukture enzima lizozima. Krugovi - aminokiseline; pramenovi - peptidne veze; zasjenjeni pravokutnici su disulfidne veze. Vidljivi su spiralizirani i izduženi dijelovi polipeptidnog lanca.
Pedesetih godina prošlog veka dokazana je trostepena organizacija proteinskih molekula – prisustvo primarne, sekundarne i tercijarne strukture; stvorio automatski analizator aminokiselina (Stanford Moore, William Howard Stein, 1950). Šezdesetih godina prošlog stoljeća pokušano je kemijski sintetizirati proteine (inzulin, ribonukleaza). Metode analize rendgenske difrakcije značajno su poboljšane; stvoren je uređaj - sekvencer (P. Edman, G. Begg, 1967), koji je omogućio određivanje sekvence aminokiselina u polipeptidnom lancu. Posljedica toga bila je uspostavljanje strukture nekoliko stotina proteina iz različitih izvora. Među njima su proteolitički enzimi (pepsin, tripsin, himotripsin, subtilizin, karboksipeptidaze), mioglobini, hemoglobini, citohromi, lizozimi, imunoglobulini, histoni, neurotoksini, proteini virusne ovojnice, protein-peptidni hormoni. Kao rezultat toga, pojavili su se preduslovi za rješavanje gorućih problema u enzimologiji, imunologiji, endokrinologiji i drugim oblastima biološke hemije.
Krajem 20. stoljeća ostvaren je značajan napredak u proučavanju uloge proteina u matričnoj sintezi biopolimera, razumijevanju mehanizama njihovog djelovanja u različitim životnim procesima organizama i uspostavljanju veze između njihove strukture i funkcije. Unapređenje istraživačkih metoda i pojava novih metoda za odvajanje proteina i peptida bili su od velikog značaja.
Razvoj efikasne metode za analizu sekvence nukleotida u nukleinskim kiselinama omogućio je značajno pojednostavljenje i ubrzanje određivanja sekvence aminokiselina u proteinima. Ovo se pokazalo mogućim jer je redoslijed aminokiselina u proteinu određen slijedom nukleotida u genu koji kodira ovaj protein (fragment). Shodno tome, znajući raspored nukleotida u ovom genu i genetski kod, može se precizno predvidjeti kojim se redoslijedom aminokiseline nalaze u polipeptidnom lancu proteina. Uz napredak u strukturnoj analizi proteina, postignuti su značajni rezultati u proučavanju njihove prostorne organizacije, mehanizama nastanka i djelovanja supramolekularnih kompleksa, uključujući ribozome i druge ćelijske organele, hromatin, viruse itd.
Struktura proteina
Gotovo svi proteini su izgrađeni od 20 α-amino kiselina koje pripadaju L-seriji i isti su u gotovo svim organizmima. Aminokiseline u proteinima povezane su jedna s drugom peptidnom vezom -CO-NH-, koju formiraju karboksilna i -amino grupa susjednih aminokiselinskih ostataka: dvije aminokiseline formiraju dipeptid u kojem je terminalni karboksil (-COOH) a amino grupa (H 2 N-) ostaje slobodna, kojoj se mogu dodati nove aminokiseline kako bi se formirao polipeptidni lanac.
Dio lanca na kojem se nalazi terminalna H 2 N-grupa naziva se N-terminal, a dio suprotan njemu naziva se C-terminal. Ogromna raznolikost proteina određena je redoslijedom rasporeda i brojem aminokiselinskih ostataka koje sadrže. Iako ne postoji jasna razlika, kratki lanci se obično nazivaju peptidi ili oligopeptidi (od oligo...), a polipeptidi (proteini) se obično shvataju kao lanci koji se sastoje od 50 ili više. Najčešći proteini su oni koji sadrže 100-400 aminokiselinskih ostataka, ali postoje i oni čije molekule čini 1000 ili više ostataka. Proteini se mogu sastojati od nekoliko polipeptidnih lanaca. U takvim proteinima, svaki polipeptidni lanac naziva se podjedinica.
Prostorna struktura proteina

Rice. 3. Protein u svim organizmima sastoji se od 20 vrsta aminokiselina. Svaki protein karakterizira određeni asortiman i kvantitativni omjer aminokiselina. U proteinskim molekulima, aminokiseline su međusobno povezane peptidnim vezama (- CO - NH -) u linearnom nizu, čineći takozvanu primarnu strukturu proteina. Gornja linija - slobodne aminokiseline sa bočnim grupama R1, R2, R3; krajnja linija - aminokiseline su povezane peptidnim vezama.
Polipeptidni lanac je sposoban da spontano formira i održava posebnu prostornu strukturu. Na osnovu oblika proteinskih molekula, proteini se dijele na fibrilarne i globularne. U globularnim proteinima, jedan ili više polipeptidnih lanaca su presavijeni u kompaktnu sferičnu strukturu, ili globulu. Obično su ovi proteini visoko rastvorljivi u vodi. To uključuje gotovo sve enzime, proteine za transport krvi i mnoge proteine za skladištenje. Fibrilarni proteini su molekule u obliku niti koje se drže zajedno poprečnim vezama i formiraju duga vlakna ili slojevite strukture. Imaju visoku mehaničku čvrstoću, nerastvorljivi su u vodi i obavljaju uglavnom strukturalne i zaštitne funkcije. Tipični predstavnici takvih proteina su keratini kose i vune, fibroin svile i kolagen tetiva.
Redoslijed kovalentno povezanih aminokiselina u polipeptidnom lancu naziva se sekvenca aminokiselina ili primarna struktura proteina. Primarna struktura svakog proteina, kodirana odgovarajućim genom, je konstantna i nosi sve informacije potrebne za formiranje struktura višeg nivoa. Potencijalni broj proteina koji se mogu formirati od 20 aminokiselina je praktično neograničen.
Kao rezultat interakcije bočnih grupa aminokiselinskih ostataka, pojedinačni relativno mali dijelovi polipeptidnog lanca poprimaju jednu ili drugu konformaciju (tip preklapanja), poznatu kao sekundarna struktura proteina. Njegovi najkarakterističniji elementi su periodično ponavljajuća α-heliksa i β-struktura. Sekundarna struktura je vrlo stabilna. Budući da je u velikoj mjeri određen sekvencom aminokiselina odgovarajućeg proteinskog regiona, postaje moguće predvidjeti je sa određenim stepenom vjerovatnoće. Termin "?-helix" uveo je američki biohemičar, fizičar i hemičar Linus Carl Pauling, koji je opisao raspored polipeptidnog lanca u proteinu?-keratinu u obliku desnog heliksa (?-helix može uporediti sa telefonskim kablom). Za svaki okret takve spirale u proteinu postoji 3,6 aminokiselinskih ostataka. To znači da -C=O grupa jedne peptidne veze formira vodoničnu vezu sa -NH grupom druge peptidne veze, četiri aminokiselinska ostatka udaljena od prve. U prosjeku, svaka α-helikalna regija uključuje do 15 aminokiselina, što odgovara 3-4 zavoja spirale. Ali u svakom pojedinačnom proteinu, dužina spirale može se znatno razlikovati od ove vrijednosti. U poprečnom presjeku, α-heliks ima oblik diska iz kojeg su bočni lanci aminokiselina usmjereni prema van.
Struktura, ili? -savijeni sloj, može biti formiran od nekoliko sekcija polipeptidnog lanca. Ovi dijelovi su razvučeni i položeni paralelno jedan s drugim, međusobno povezani vodoničnim vezama koje se javljaju između peptidnih veza. Mogu biti orijentisani u istim ili suprotnim smjerovima (obično se smatra da je smjer kretanja duž polipeptidnog lanca od N-terminusa do C-kraja). U prvom slučaju, presavijeni sloj naziva se paralelan, u drugom - antiparalelan. Potonji nastaje kada peptidni lanac napravi oštar okret unazad, formirajući krivinu (?-bend). Jesu li bočni lanci aminokiselina orijentirani okomito na ravan? -sloj.
Relativni sadržaj? -spiralni preseci i? -strukture mogu uvelike varirati među različitim proteinima. Postoje proteini u kojima dominiraju α-heliksa (oko 75% aminokiselina u mioglobinu i hemoglobinu), a glavni tip savijanja lanca u mnogim fibrilarnim proteinima (uključujući fibroin svile, β-keratin) je α-heliks. -struktura. Regije polipeptidnog lanca koje se ne mogu klasifikovati ni u jednu od gore opisanih konformacija nazivaju se petlje za povezivanje. Njihova struktura je određena uglavnom interakcijama između bočnih lanaca aminokiselina, a u molekulu bilo kojeg proteina uklapa se na strogo definiran način.
Tercijarna struktura se naziva prostorna struktura globularnih proteina. Ali često se ovaj koncept odnosi na metodu savijanja polipeptidnog lanca u prostoru, karakterističnu za svaki specifični protein. Tercijarna struktura je formirana polipeptidnim lancem proteina spontano, očigledno, duž određenog(ih) puta(a) koagulacije uz prethodno formiranje elemenata sekundarne strukture. Ako je stabilnost sekundarne strukture uzrokovana vodikovim vezama, onda je tercijarna struktura fiksirana različitim sistemom nekovalentnih interakcija: vodikovim, ionskim, intermolekularnim interakcijama, kao i hidrofobnim kontaktima između bočnih lanaca nepolarnih aminokiselina. kiseli ostaci.
U nekim proteinima tercijarna struktura se dalje stabilizuje formiranjem disulfidnih veza (-S-S- veza) između cisteinskih ostataka. Po pravilu se unutar proteinske globule nalaze bočni lanci hidrofobnih aminokiselina sklopljenih u jezgro (njihov transfer unutar proteinske globule je termodinamički povoljan), a na periferiji su hidrofilni ostaci i neki hidrofobni. Proteinska globula je okružena sa nekoliko stotina molekula hidratantne vode, koja je neophodna za stabilnost proteinske molekule i često je uključena u njeno funkcionisanje. Tercijarna struktura je pokretna, njeni pojedinačni dijelovi se mogu pomicati, što dovodi do konformacijskih prijelaza koji igraju značajnu ulogu u interakciji proteina s drugim molekulima.
Tercijarna struktura je osnova funkcionalnih svojstava proteina. Određuje formiranje ansambala funkcionalnih grupa u proteinu - aktivnih centara i veznih zona, daje im neophodnu geometriju, omogućava stvaranje unutrašnjeg okruženja, što je preduvjet za nastanak mnogih reakcija, te osigurava interakciju s drugim proteinima. .
Tercijarna struktura proteina jasno odgovara njihovoj primarnoj strukturi; verovatno postoji još nedešifrovani stereohemijski kod koji određuje prirodu savijanja proteina. Međutim, jedna te ista metoda prostornog uređenja obično ne odgovara jednoj primarnoj strukturi, već cijeloj porodici struktura u kojoj se samo mali dio (do 20-30%) aminokiselinskih ostataka može podudarati, ali u određenim mjesta u lancu je očuvana sličnost aminokiselinskih ostataka. Rezultat je formiranje velikih porodica proteina koje karakteriše slična tercijarna i manje-više slična primarna struktura i po pravilu zajednička funkcija. To su, na primjer, proteini organizama različitih vrsta koji imaju istu funkciju i evolucijski su povezani: mioglobin i hemoglobin, tripsin, kimotripsin, elastaza i druge životinjske proteinaze.

Rice. 4. Kao rezultat kombinacije nekoliko proteinskih makromolekula sa tercijarnom strukturom, kvartarna proteinska struktura se formira u kompleksan kompleks. Primjer takvih složenih proteina je hemoglobin, koji se sastoji od četiri makromolekula.
Često, posebno kod velikih proteina, do savijanja polipeptidnog lanca dolazi kroz formiranje od strane pojedinačnih delova lanca manje ili više autonomnih elemenata prostorne strukture - domena koji mogu imati funkcionalnu autonomiju, odgovorni za jednu ili drugu biološku aktivnost proteina. Dakle, N-terminalni domeni proteina koagulacije krvi osiguravaju njihovo vezivanje za ćelijsku membranu.
Postoji mnogo proteina čiji su molekuli skup globula (podjedinica) koje se drže zajedno hidrofobnim interakcijama, vodoničnim ili ionskim vezama. Takvi kompleksi se nazivaju oligomerni, multimerni ili podjedinični proteini. Raspored podjedinica u funkcionalno aktivnom proteinskom kompleksu naziva se kvarterna struktura proteina. Neki proteini su sposobni formirati strukture višeg reda, na primjer, multienzimske komplekse, proširene strukture (proteini omotača bakteriofaga), supramolekularne komplekse koji funkcioniraju kao jedna cjelina (na primjer, ribozomi ili komponente mitohondrijalnog respiratornog lanca).
Kvaternarna struktura omogućava stvaranje molekula neobične geometrije. Dakle, feritin, formiran od 24 podjedinice, ima unutrašnju šupljinu, zahvaljujući kojoj protein uspijeva vezati do 3000 iona željeza. Osim toga, kvartarna struktura omogućava obavljanje nekoliko različitih funkcija u jednoj molekuli. Triptofan sintetaza kombinuje enzime odgovorne za nekoliko uzastopnih faza sinteze aminokiseline triptofana.
Metode za proučavanje strukture proteina
Primarna struktura proteina određuje sve ostale nivoe organizacije proteinske molekule. Stoga je pri proučavanju biološke funkcije različitih proteina važno poznavanje ove strukture. Prvi protein za koji je uspostavljena aminokiselinska sekvenca bio je hormon pankreasa, insulin. Ovaj rad, koji je trajao 11 godina, izveo je engleski biohemičar Frederick Sanger (1954). Odredio je lokaciju 51 aminokiseline u molekulu hormona i pokazao da se sastoji od 2 lanca povezana disulfidnim vezama. Kasnije je većina rada na uspostavljanju primarne strukture proteina automatizirana.
Razvojem metoda genetskog inženjeringa, postalo je moguće dodatno ubrzati ovaj proces određivanjem primarne strukture proteina u skladu sa rezultatima analize nukleotidnog niza u genima koji kodiraju ove proteine. Sekundarna i tercijarna struktura proteina proučava se primjenom prilično složenih fizičkih metoda, na primjer, kružni dikroizam ili analiza rendgenske difrakcije proteinskih kristala. Tercijarnu strukturu je prvi ustanovio engleski biohemičar John Cowdery Kendrew (1957) za mišićni protein mioglobin.

Rice. 5. Model molekule mioglobina (prostorna konfiguracija molekule)
Denaturacija proteina
Relativno slabe veze odgovorne za stabilizaciju sekundarnih, tercijarnih i kvartarnih struktura proteina lako se uništavaju, što je praćeno gubitkom njegove biološke aktivnosti. Uništavanje izvorne (nativne) strukture proteina, nazvano denaturacija, događa se u prisustvu kiselina i baza, uz zagrijavanje, promjenu jonske snage i druge utjecaje. Po pravilu, denaturirani proteini su slabo ili nikako rastvorljivi u vodi. Uz kratkotrajno djelovanje i brzu eliminaciju denaturirajućih faktora, moguća je renaturacija proteina uz potpunu ili djelomičnu obnovu izvorne strukture i bioloških svojstava.
Klasifikacija proteina
Složenost strukture proteinskih molekula i ekstremna raznolikost funkcija koje obavljaju otežavaju stvaranje njihove jedinstvene i jasne klasifikacije, iako su pokušaji da se to učini u više navrata od kraja 19. stoljeća. Na osnovu svog hemijskog sastava, proteini se dele na jednostavne i složene (ponekad se nazivaju proteidi). Molekuli prvog sastoje se samo od aminokiselina. Pored samog polipeptidnog lanca, kompleksni proteini sadrže neproteinske komponente koje predstavljaju ugljikohidrati (glikoproteini), lipidi (lipoproteini), nukleinske kiseline (nukleoproteini), metalni joni (metaloproteini), fosfatne grupe (fosfoproteini), pigmenti (hromoproteini), itd.
Ovisno o funkcijama koje obavljaju, razlikuje se nekoliko klasa proteina. Najraznovrsniju i najspecijalizovaniju klasu čine proteini sa katalitičkom funkcijom - enzimi koji imaju sposobnost da ubrzaju hemijske reakcije koje se dešavaju u živim organizmima. U tom svojstvu proteini učestvuju u svim procesima sinteze i razgradnje različitih jedinjenja tokom metabolizma, u biosintezi proteina i nukleinskih kiselina, regulaciji razvoja i diferencijacije ćelija. Transportni proteini imaju sposobnost da selektivno vežu masne kiseline, hormone i druga organska i anorganska jedinjenja i jone, a zatim ih transportuju strujom do željene lokacije (npr. hemoglobin je uključen u prenos kiseonika iz pluća do svih ćelija tijelo). Transportni proteini također provode aktivan transport jona, lipida, šećera i aminokiselina kroz biološke membrane.
Strukturni proteini obavljaju potpornu ili zaštitnu funkciju; učestvuju u formiranju ćelijskog skeleta. Najčešći među njima su kolagen vezivnog tkiva, keratin, nokti i perje, elastin vaskularnih ćelija i mnogi drugi. U kombinaciji s lipidima, oni su strukturna osnova staničnih i intracelularnih membrana.
Određeni broj proteina obavlja zaštitnu funkciju. Na primjer, imunoglobulini (antitijela) kičmenjaka, koji imaju sposobnost vezanja stranih patogenih mikroorganizama i tvari, neutraliziraju njihovo patogeno djelovanje na organizam i sprječavaju proliferaciju stanica. Fibrinogen i trombin su uključeni u proces zgrušavanja krvi. Mnoge proteinske supstance koje luče bakterije, kao i komponente nekih beskičmenjaka, klasifikovane su kao toksini.
Neki proteini (regulatorni) su uključeni u regulaciju fiziološke aktivnosti tijela u cjelini, pojedinih organa, ćelija ili procesa. Oni kontrolišu transkripciju gena i sintezu proteina; oni uključuju peptidno-proteinske hormone koje luče endokrine žlijezde. Proteini za skladištenje sjemena obezbjeđuju hranjive tvari za početne faze razvoja embrija. To također uključuje kazein, albumin bjelanjka (ovalbumin) i mnoge druge. Zahvaljujući proteinima, mišićne ćelije stiču sposobnost kontrakcije i na kraju obezbeđuju kretanje telu. Primjeri takvih kontraktilnih proteina su aktin i miozin skeletnih mišića, kao i tubulin, koji su komponente cilija i flagela jednoćelijskih organizama; Oni također osiguravaju divergenciju hromozoma tokom diobe ćelije.
Receptorski proteini su meta hormona i drugih biološki aktivnih spojeva. Uz njihovu pomoć, ćelija percipira informacije o stanju vanjskog okruženja. Oni igraju važnu ulogu u prijenosu nervnog uzbuđenja i u usmjerenom kretanju stanica (hemotaksa). Transformacija i iskorišćavanje energije koja ulazi u organizam, kao i energije, odvija se i uz učešće proteina bioenergetskog sistema (na primjer, vidni pigment rodopsin, citohromi respiratornog lanca). Postoje i mnogi proteini s drugim, ponekad prilično neobičnim funkcijama (na primjer, plazma nekih antarktičkih riba sadrži proteine koji imaju svojstva protiv smrzavanja).
Biosinteza proteina
Sve informacije o strukturi određenog proteina „pohranjuju” se u odgovarajućim genima u obliku niza nukleotida i implementiraju se u procesu sinteze šablona. Najprije se informacije prenose (čitaju) s molekule DNK na glasničku RNK (mRNA) pomoću enzima DNK zavisne RNA polimeraze, a zatim u ribosom na mRNA, kao na matrici u skladu sa genetskim kodom uz učešće transportne RNK koje isporučuju aminokiseline, dolazi do formiranja polipeptidnog lanca.
Sintetizirani polipeptidni lanci koji izlaze iz ribozoma, spontano se savijaju, poprimaju konformaciju karakterističnu za protein i mogu biti podložni post-translacijskoj modifikaciji. Bočni lanci pojedinih aminokiselina mogu biti podvrgnuti modifikacijama (hidroksilacija, fosforilacija, itd.). Zato se, na primjer, hidroksiprolin i hidroksilizin nalaze u kolagenu (vidi). Modifikacija takođe može biti praćena rupturom polipeptidnih veza. Na taj način, na primjer, dolazi do formiranja aktivne molekule inzulina, koja se sastoji od dva lanca povezana disulfidnim vezama.

Rice. 6. Opća shema biosinteze proteina.
Značaj proteina u ishrani
Proteini su najvažniji sastojci životinjske i ljudske hrane. Nutritivna vrijednost proteina određena je sadržajem esencijalnih aminokiselina koje se ne proizvode u samom tijelu. U tom smislu, biljni proteini su manje vrijedni od životinjskih: siromašniji su lizinom, metioninom i triptofanom i teže se probavljaju u gastrointestinalnom traktu. Nedostatak esencijalnih aminokiselina u hrani dovodi do teških poremećaja metabolizma dušika.
Proteini se razgrađuju na slobodne aminokiseline, koje nakon apsorpcije u crijevima ulaze i distribuiraju se u sve stanice. Neki od njih se raspadaju u jednostavne spojeve uz oslobađanje energije, koju stanica koristi za različite potrebe, a neki idu na sintezu novih proteina karakterističnih za određeni organizam. (R. A. Matveeva, Enciklopedija Ćirilo i Metodije)
Nabrajanje proteina
- amiloid - amiloid;
- anjonski - anjonski;
- antivirusno - antivirusno;
- autoimune - autoimune;
- autologni - autologni;
- bakterijski - bakterijski;
- Bence Jones protein;
- virusom izazvan - virusom izazvan;
- virusni - virus;
- viral nonstructural - virus nestrukturan;
- viral structural - strukturalni virus;
- virus-specifičan - specifičan za virus;
- visoka molekularna težina - visoka molekularna težina;
- koji sadrže hem - hem;
- heterologno - strano;
- hibrid - hibrid;
- glikoziliran - glikovan;
- globular - globular;
- denaturiran - denaturiran;
- koji sadrže željezo - željezo;
- žumance - žumance;
- životinjski protein - životinjski protein;
- zaštitno - odbrambeno;
- imuni - imuni;
- imunogeni - imunološki relevantni;
- vezivanje kalcijuma;
- kiselo - kiselo;
- korpuskularno - korpuskularno;
- membrana - membrana;
- mijelom - mijelom;
- mikrosomalni - mikrosomalni;
- mlečni protein - mlečni protein;
- monoklonalni - monoklonski imunoglobulin;
- mišićni protein - mišićni protein;
- native - native;
- nonhistone - nehiston;
- neispravan - djelomičan;
- nerastvorljiv - nerastvorljiv;
- nesvarljiv - nerastvorljiv;
- neenzimski - neenzimski;
- niska molekularna težina - niska molekularna težina;
- novi protein - novi protein;
- generalno - cjelina;
- onkogeni - onkoprotein;
- protein glavne faze - anjonski;
- protein akutne faze (upala) - protein akutne faze;
- hrana - hrana;
- protein krvne plazme - protein plazme;
- placenta - placenta;
- odvajanje - odvajanje;
- protein regenerativnog živca;
- regulatorni - regulatorni;
- rekombinacija - rekombinantna;
- receptor - receptor;
- ribosomalni - ribosomalni;
- vezivanje - vezivanje;
- sekretorni protein - sekretorni protein;
- C-reaktivan - C-reaktivan;
- whey protein - whey protein, laktoprotein;
- tkivo - tkivo;
- otrovan - otrovan;
- himerni - himerni;
- cijeli - cijeli;
- cytosolic - cytosolic;
- alkalni protein - anjonski protein;
- egzogeni - egzogeni;
- endogeni - endogeni protein.
Više o proteinima pročitajte u literaturi:
- Volkenshtein M.V., Molecules and, M., 1965, ch. 3 - 5;
- Gaurowitz F., Hemija i funkcije proteina, trans. s engleskog, Moskva, 1965;
- Sissakyan N. M. i Gladilin K. L., Biohemijski aspekti sinteze proteina, u knjizi: Advances in biological chemistry, vol. 7, M., 1965, str. 3;
- Stepanov V. M. Molekularna biologija. Struktura i funkcija proteina. M., 1996;
- Shamin A.N., Razvoj hemije proteina, M., 1966;
- Proteini i peptidi. M., 1995-2000. T. 1-3;
- Biosinteza proteina i nukleinskih kiselina, ur. A. S. Spirina, M., 1965;
- Uvod u molekularnu biologiju, trans. sa engleskog, M., 1967
- Molekule i ćelije. [Sat. čl.], prev. sa engleskog, M., 1966, str. 7 - 27, 94 - 106;
- Osnovi biohemije: prevod sa engleskog M., 1981. T. 1;
- Problem sa proteinima. M., 1995. T. 1-5;
- Proteini. New York, 1975-79. 3 ed. V. 1-4.
Pronađite još nešto zanimljivo: