Za odgovore na zadatke 20-22 koristite poseban list. Prvo zapišite broj zadatka (20, 21, 22), a zatim i detaljan odgovor na njega. Zapišite svoje odgovore jasno i čitko.
Korišćenje metode elektronski balans, napišite jednačinu reakcije
Na 2 SO 3 + KMnO 4 + KOH → Na 2 SO 4 + K 2 MnO 4 + H 2 0.
Identifikujte oksidaciono sredstvo i redukciono sredstvo.
Pokaži odgovor
Na_2S^(+4)O_3+KMn^(+7)O_4+KOH\rightarrow Na_2S^(+6)O_4+H_2O
Mn^(+7)+\overline e=Mn^(+6)\;\;\;\vert\;\;\cdot\;2\;- proces oporavka
S^(+4)-2\overline e=S^(+6)\;\;\;\vert\;\;\cdot\;1\;- proces oksidacije
2Mn^(+7)\;+\;S^(+4)\;=\;2Mn^(+6)\;+\;S^(+6)
Mn +7 (KMn +7 O 4 zbog Mn +7) - oksidant S +4 (Na 2 S +4 O 3 zbog S +4) - redukcijski agens Molekularna jednadžba
Na 2 SO 3 + 2KMnO 4 + 2KOH = Na 2 SO 4 + 2K 2 MnO 4 + H 2 O.
Koja se zapremina 60% rastvora azotne kiseline gustine 1,305 g/ml može dobiti pomoću proizvoda katalitičke oksidacije 896 l (br.) amonijaka koji sadrži azot?
Pokaži odgovor
Jednačine reakcije:
4NH 3 + 5O 2 = 4NO + 6H 2 O 2NO + O 2 = 2NO 2
4NO 2 + O 2 + 2H 2 O = 4HNO 3 Budući da se svi atomi dušika uključeni u NH 3 pretvaraju u HNO 3 (u procesu se ne stvaraju nusproizvodi koji sadrže dušik), možemo napraviti proračunsku shemu:
NH 3 ... → HNO 3
2) Izračunajte količinu amonijačne supstance: n = V r / V m, n(NH 3) = 896/22,4 = 40 mol
3) Izračunajte zapreminu rastvora HNO 3:
a) prema šemi za izračunavanje n(HNO 3) = n(NH 3) = 40 mol
n = m in-va / M in-va,
M(HNO 3) = 63 g/mol; m(HNO 3) = 40 63 = 2520 g
b) ω = m in-va / m r-pa, m r-pa = m in-va / ω
m rastvora (HNO 3) = 2520/0,6 = 4200 g
V p-pa (HNO 3) = 4200 / 1,305 = 3218,4 ml ≈ 3,22 l.
Date supstance: CaCO 3, CuO, rastvori HNO 3, K 2 SO 4 NaOH, H 2 O 2. Koristeći vodu i potrebne supstance samo sa ove liste, dobiti bakar(II) hidroksid u dve faze. Opišite znakove reakcija koje se provode. Za reakciju ionske izmjene napišite skraćenu ionsku jednačinu.
Pokaži odgovor
Eksperimentalni dizajn
CuO → Cu(NO 3) 2 → Cu(OH) 2
1) CuO + 2HNO 3 = Cu(NO 3) 2 + H 2 O
CuO + 2H + = Cu 2+ + H 2 O
Reakcija jonske izmjene. Bakar(II) oksid je crna supstanca koja se rastvara azotne kiseline i formira se plavi rastvor.
2) Cu(NO 3) 2 + 2NaOH = Cu(OH) 2 ↓ + 2NaNO 3
Cu 2+ + 2OH - = Cu(OH) 2
Reakcija jonske izmjene. Kada se rastvor natrijum hidroksida doda rastvoru bakar(II) nitrata, formira se plavi talog.
hemija
5 - 9 razreda
Pomozite mi da riješim test iz hemije za 8. razred, hvala unaprijed
Odaberite supstance:
1. dušik
2. epruveta
3. vazduh
4. knjiga
Navedite gdje je riječ o hemijskoj pojavi:
1. formiranje magle
2. truljenje plodova
3. kiša
4. mljevenje komada sumpora u žuti prah
Relativna molekulska težina tvari sa formulom H2SO3, Al(NO2)3, respektivno, jednaka je:
1. 49, 76
2. 82, 165
3. 25, 44
4. 96, 342
Odaberite jednostavnu supstancu:
1. dušik N2 O
2. natrijum Na
3. sirćetna kiselina SH3COOH
4. ugljen monoksid CO
Elementi iz istog perioda
1. kalijum, kalcijum, bakar
2. vodonik, litijum, kalijum
3. natrijum, magnezijum, kalcijum
4. helijum, neon, argon
Šta znače 5H2 unosi? 3O:
1. 5 molekula vodonika i 3 atoma kiseonika
2. 5 molekula vodika i 6 atoma kisika
3. 5 atoma vodika i 2 molekula kiseonika
4. 5 atoma vodika i 3 molekula kiseonika
Možete odvojiti mješavinu alkohola i vode na sljedeći način:
1. isparavanje
2. destilacija
3.filtracija
4. pomoću lijevka za odvajanje
Elementi glavnih podgrupa:
1. kiseonik, sumpor, hrom
2. nikl, paladijum, platina
3. skandij, titanijum, vanadijum
4. litijum, berilijum, bor
Hemijski element, koji se nalazi u IV grupi perioda 5:
1. tin
2. titanijum
3. cink
4. germanijum
Odaberite supstancu:
1. srebrni novčić
2. jod
3. vazduh
4. bakarna žica
Navedite gdje je riječ o fizičkoj pojavi:
1. kiselo mleko
2. loženje drva
3. hrđanje proizvoda od željeza
4. zamrzavanje vodnih tijela zimi
Molekularna masa supstanci sa formulom MgSO4; Fe(OH)3 je prema tome jednak:
1. 70; 48
2. 120; 107
3. 142; 99
4. 142; 82
Odaberite spoj:
1. H2SO4
2. O3
3. S8
4.C60
Elementi jedne grupe:
1. berilij, bor, ugljenik
2. fosfor, sumpor, hlor
3. kalcijum, bakar, cink
4. fluor, hlor, brom
Šta znače unosi 3O2? 2N:
1. 3 atoma kiseonika i 2 molekula azota
2. 3 molekula kisika i 2 atoma dušika
3. 3 molekula kiseonika i 2 molekula azota
4. 3 atoma kiseonika i 1 molekul azota
Svi elementi sekundarne podgrupe:
1. kobalt, nikl
2. bakar, kalijum
3. helijum, neon
4. hrom, vodonik
Hemijski element, koji se nalazi u 6. periodu III grupe, sekundarne podgrupe:
1. barijum
2. talijum
3. litijum
4. sumpor
A. Prilikom zagrevanja tečnosti potrebno je da zatvorite epruvetu čepom.
B. Ako vam kiselina dospije na kožu, odmah je isperite sa dosta vode.
1. samo A je tačno
2. obje presude su tačne
3. samo B je tačno
4. obje presude su pogrešne
Jesu li istinite? sledeće presude o čistim supstancama i mješavinama?
O. Rečna voda je mešavina supstanci.
B. Vazduh je čista supstanca.
1. samo A je tačno
2. obje presude su tačne
3. samo B je tačno
4. obje presude su pogrešne
Jesu li sljedeće ocjene o metodama odvajanja mješavina tačne?
A. Bakarne strugotine se mogu odvojiti od smjese magnetom.
B. Pijesak iz vode možete ukloniti filtriranjem.
1. samo A je tačno
2. obje presude su tačne
3. samo B je tačno
4. obje presude su pogrešne
TO hemijske pojave Nije primjenjivo:
1) topljenje parafina
2) sagorevanje drva
3) rđanje eksera
4) kiselo mleko
Da biste pravilno ugasili plamen alkoholne lampe, potrebno je:
1) dunite u plamen
2) pokrijte plamen rukama
3) stavite poklopac na vatru
4) napuniti vodom
Smjesa se može odvojiti filtracijom:
1) voda i šećer
2) voda i kuhinjska so
3) voda i ugljena prašina
4) esencije vode i sirćeta
Da li su sljedeće procjene o namjeni laboratorijske opreme u hemijska laboratorija?
O. Držač epruvete se koristi za držanje epruvete tokom zagrevanja.
B. Zapremina rastvora se meri pomoću gradusanog cilindra.
1) samo A je tačno
2) obe presude su tačne
3) samo B je tačno
4) obje presude su netačne
Da li su tačne sljedeće tvrdnje o pravilima bezbjednog rada u hemijskoj laboratoriji?
O. Kada zagrevate epruvetu sa tečnošću, morate je držati pod uglom, usmeravajući otvor epruvete dalje od ljudi.
B. Ako kaustične supstance dođu u kontakt sa vašom kožom, morate odmah pozvati nastavnika.
1) samo A je tačno
2) samo B je tačno
3) obe presude su tačne
4) obje presude su netačne
Da li su sljedeći sudovi o metodama podjele tačni?
A1. Izotopi su
1) S 2- i S 6+
2) bijeli fosfor i crveni fosfor
3) 1H i 3H
4) 40 K i 40 Ar
Rješenje. Izotopi su atomi istog elementa različite mase. Maseni broj izotopa nalazi se u gornjem lijevom dijelu simbola elementa. Prva opcija odgovora pokazuje različite stupnjeve oksidacije sumpora, druga - alotropne modifikacije fosfora, treća - atome vodika različite mase. Ovo su izotopi. Četvrta opcija - atomi različitih elemenata sa istom masom. Takvi atomi se nazivaju izobare.
Tačan odgovor: 3
A2. Među elementima četvrtog perioda, maksimalni atomski radijus je
1) bakar
2) kalijum
3) nikl
4) kripton
Rješenje. U periodu se radijus atoma smanjuje s lijeva na desno, tj. od početka perioda do njegovog kraja. Kalijum se nalazi u četvrtom periodu na samom početku, dakle, njegov atom ima najveći poluprečnik.
Tačan odgovor: 2
A3. Najduža dužina veze u molekulu
1) HF
2) HCl
3) H 2 O
4) H2S
Rješenje. Od atoma koji čine navedena jedinjenja sa vodonikom, atom sumpora ima najveći poluprečnik (sumpor u periodnom sistemu navedenih elemenata je niži i desno od ostalih), uzimajući u obzir da je poluprečnik atoma vodika je ista u svim ovim jedinjenjima, dobijamo da je maksimalna dužina veze u molekulu sumporovodika.
Tačan odgovor: 4
A4. Atom hlora ima oksidaciono stanje od +3 u jedinjenju
1) ClO3
2) Cl 2 O 6
3) Ba(ClO 2) 2
4) KClO 3
Rješenje. Oksidaciona stanja hlora u navedenim jedinjenjima izračunavamo iz uslova električne neutralnosti (algebarski zbir oksidacionih stanja elemenata u električni neutralnoj molekuli je nula) i uzimajući u obzir da je oksidaciono stanje kiseonika -2, kalijuma +1, barijum +2 i uz pretpostavku da je oksidaciono stanje hlora x. Dobijamo za ClO 3: x + 3(-2) = 0, x = +6. Ne odgovara. Za Cl 2 O 6: 2x + 6(-2) = 0, x = +6. A ovaj se ne uklapa. Za Ba(ClO 2) 2: 2 + 2x + 4(-2) = 0, x = +3. U ovom spoju, oksidacijsko stanje hlora je +3. U KClO 3: 1 + x + 3(-2) = 0, x = +5.
Tačan odgovor: 3
A5. Nemolekularna struktura ima
1) gvožđe
2) vodonik
3) kiseonik
4) ugljen monoksid
Rješenje. Od navedenih supstanci samo željezo nema molekularnu strukturu.
Tačan odgovor: 1
A6. Na listi supstanci
1) CO 2 2) Fe 2 O 3 3) Fe 3 O 4 4) CaO 5) Cl 2 O 7 6) CrO 3
kiseli oksidi uključuju supstance čije su formule označene brojevima
1)
2,3,6
2) 1,5,6
3) 1,4,5
4) 2,3,5
Rješenje. Kiseli oksidi formiraju nemetale i prelazni metali V višim stepenima oksidacija. Dakle, kiseli oksidi uključuju CO 2, Cl 2 O 7 - ugljik i hlor - nemetale i CrO 3 - hrom u ovom oksidu ima maksimalno oksidaciono stanje od +6. Na listi su ove supstance označene brojevima 1,5 i 6.
Tačan odgovor: 2
A7. U cilju povećanja metalnih svojstava, elementi su raspoređeni u sljedećem redu:
1) kalcijum, cink, stroncijum
2) stroncijum, kadmijum, barijum
3) kadmijum, barijum, živa
4) kadmijum, barijum, radijum
Rješenje. Metalna svojstva se povećavaju u glavnim podgrupama od vrha do dna, u elementima sekundarnih podgrupa metalna svojstva manje izražen od onih glavnih elemenata. Opcija 1: kalcijum, cink, stroncij - cink je element sekundarne podgrupe, njegova metalna svojstva su manje izražena od kalcijuma. Više nije potrebno. Opcija 2: stroncijum, kadmijum, barijum - takođe eliminisan, kadmijum je element sekundarne podgrupe. Opcija 3: kadmijum, barijum, živa - više nije potrebno, barijum u sredini liste. Opcija 4: kadmijum, barijum, radijum - ovde se metalna svojstva povećavaju od kadmijuma do barijuma (kadmijum je sekundarna podgrupa, barijum je glavna) i do radijuma (takođe je glavna podgrupa i nalazi se ispod barijuma). Ovo je ispravna opcija.
Tačan odgovor: 4
A8. Formula superiornog telurijevog oksida
1) Te 2 O
2) TeO2
3) TeO3
4) Te 2 O 7
Rješenje. Oksidacijsko stanje elementa u višem oksidu odgovara broju grupe u kojoj se element nalazi. Izračunajmo oksidaciona stanja telura u navedenim oksidima koristeći uslov električne neutralnosti (vidi A4). Te 2 O oksidaciono stanje telurijuma je +1, TeO 2: +4, TeO 3: +6 i Te 2 O 7: +7. Primetno je da u trećem oksidu naziv grupe odgovara oksidacionom stanju telura, ovo je odgovor.
Tačan odgovor: 3
A9. Da li su sljedeće izjave o cinku tačne?
A. Cink(II) hidroksid je amfoterni hidroksid.
B. Cink se rastvara u razblaženoj azotnoj kiselini.
1) samo A je tačno
2) samo B je tačno
3) obe presude su tačne
4) obje presude su netačne
Rješenje. Cink (II) hidroksid je amfoterni hidroksid (ovo morate znati, ako niste znali, već znate). Cink nije pasiviziran dušičnom kiselinom u bilo kojoj koncentraciji i otapa se u razrijeđenoj dušičnoj kiselini. Obje presude su tačne.
Tačan odgovor: 3
A10. Fosfor(V) oksid ne stupa u interakciju sa:
1) voda
2) natrijum hlorid
3) kalijum hidroksid
4) kalcijum oksid
Rješenje. Fosfor (V) oksid je kiseli oksid koji reagira s vodom i nastaje fosforne kiseline, sa alkalijama (KOH) i bazičnim oksidima (CaO), formirajući soli. Jedina navedena supstanca s kojom fosfor (V) oksid neće stupiti u interakciju je natrijum hlorid.
Tačan odgovor: 2
A11. Da li su sljedeće tvrdnje o sumpornoj kiselini tačne?
A. Koncentrisano sumporna kiselina odnosi se na reagense za uklanjanje vode.
B. Razrijeđena sumporna kiselina otapa bakar, ali ne rastvara srebro.
1) samo A je tačno
2) samo B je tačno
3) obe presude su tačne
4) obje presude su netačne
Rješenje. Koncentrirana sumporna kiselina je sredstvo za uklanjanje vode, tako da je A ispravno. Razrijeđena sumporna kiselina nije oksidirajuća kiselina i ne stupa u interakciju s metalima koji se nalaze u naponskom nizu desno od vodonika. Bakar i cink su desno od vodonika u naponskoj seriji, stoga je B netačno.
Tačan odgovor: 1
A12. Hidrokarbonati u rastvoru pretvaraju se u karbonate kada su izloženi
1) bilo koja so
2) bilo koja kiselina
3) bilo koji oksid
4) bilo koja alkalija
Rješenje. Kiselinske soli- u ovom slučaju hidrokarbonati - prelaze u srednje karbonate (karbonate) pod dejstvom alkalija ili nekih bazičnih oksida, stoga je jedini odgovor: pod dejstvom bilo koje alkalije.
Tačan odgovor: 4
A13. Za izvođenje transformacija u skladu sa shemom:
Al amalgam Al(OH) 3 Al(NO 3) 3 mora se koristiti dosljedno
1) voda i azot
2) kalijum hidroksid i azotna kiselina
3) voda i azotna kiselina
4) kalijum hidroksid i kalijum nitrat
Rješenje. Amalgamirani aluminijum se otapa u vodi i formira hidroksid (film aluminijum-oksida je uništen):
2Al amalgama + 6H 2 O = 2Al(OH) 3 + 3H 2
Nitrat se može dobiti iz aluminijevog hidroksida djelovanjem dušične kiseline:
2Al(OH) 3 + 3HNO 3 = Al(NO 3) 3 + 3H 2 O
Tačan odgovor: 3
A14. Izomer cikloheksana je
1) 3-metilheksan
2) ciklopentan
3) benzen
4) heksen-2
Rješenje. Cikloheksan ima bruto formulu od C 6 H 12. Formula 3-metilheksana je C 7 H 16, ciklopentana je C 5 H 10, benzena je C 6 H 6, heksena-2 je C 6 H 12. Upoređujući bruto formule, možete vidjeti da se formula četvrte tvari podudara s originalnom formulom, dakle ovo je izomer cikloheksana.
Tačan odgovor: 4
A15. United -elektronski sistem formirana u molekulu
1) ciklobutan
2) buten-1
3) metilcikloheksan
4) benzen
Rješenje. Jedan elektronski sistem među navedenim supstancama nalazi se samo u molekulu benzena.
Tačan odgovor: 4
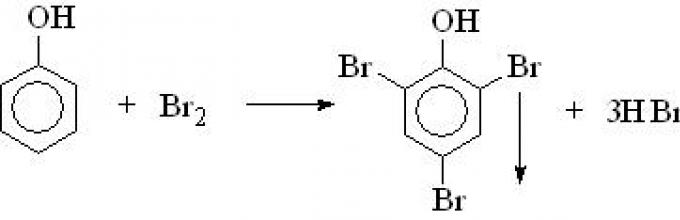
A16. Fenol formira bijeli talog kada reaguje sa
1) bromna voda
2) azotna kiselina
3) kalijum hidroksid
4) amonijak
Rješenje. Jedini slabo rastvorljivi produkt reakcije fenola sa navedenim reagensima je 2,4,6-tribromofenol, koji nastaje kada fenol reaguje sa bromnom vodom:
Tačan odgovor: 1
A17. Da li su sljedeće tvrdnje o mastima istinite?
O. Sve masti su čvrste pod normalnim uslovima.
B. Sa hemijske tačke gledišta, masti se klasifikuju kao estri.
1) samo A je tačno
2) samo B je tačno
3) obe presude su tačne
4) obje presude su netačne
Rješenje. Masti uključuju tečnosti, kao što su neke biljne masti (biljno ulje). Prema tome, izjava A je netačna. Masti su estri, tako da je B tačno.
Tačan odgovor: 2
A18. U shemi transformacije:
C2H6XC2H5OH supstanca X je
1) etin
2) etandiol
3) eten
4) dibromoetan
Rješenje. Ove transformacije se mogu izvesti na sljedeći način: prvo dehidrogenirati etan zagrijavanjem u prisustvu katalizatora
C 2 H 6 = C 2 H 4 + H 2
a zatim dodavanje vode u nastali etilen kada se zagrije u prisustvu sumporne kiseline:
C 2 H 4 + H 2 O = C 2 H 5 OH
Međusupstanca X je etilen (prema IUPAC-u - eten).
Tačan odgovor: 3
A19. Egzotermne reakcije uključuju interakciju
1) azot sa kiseonikom
2) ugljenik sa ugljendioksidom
3) voda sa ugljenikom
4) propen sa bromom
Rješenje. Prve tri reakcije su endotermne (vidi udžbenik). Jedina egzotermna reakcija je reakcija propena sa bromom.
Tačan odgovor: 4
A20. Brzina reakcije cinka sa rastvorom sumporne kiseline ne zavisi od
1) broj uzetih granula cinka
2) stepen mlevenja cinka
3) koncentracija sumporne kiseline
4) temperatura
Rješenje. Brzina rastvaranja cinka u sumpornoj kiselini zavisi od veličine površine metala (tj. od stepena mlevenja), od koncentracije kiseline i temperature. Brzina ne zavisi od broja uzetih granula cinka.
Tačan odgovor: 1
A21. Pomeriti ravnotežu prema polaznim supstancama u sistemu
N 2(g) + 3H 2(g) 2NH 3(g) + Q
neophodno
1) povećati temperaturu
2) povećati pritisak
3) povećati koncentraciju azota
4) smanjiti temperaturu
Rješenje. Direktna reakcija je egzotermna, stoga je reverzna reakcija (prema polaznim materijalima) endotermna. Ravnoteža se može pomjeriti prema endotermnoj reakciji u skladu s Le Chatelierovim principom povećanjem temperature (opcija odgovora 1). Ostale opcije za uticaj na sistem će dovesti do pomeranja ravnoteže udesno - prema amonijaku.
Tačan odgovor: 1
A22. Obje supstance su elektroliti:
1) sirćetna kiselina i etil acetat
2) bromovodonik i etanol
3) propanol i aceton
4) propionska kiselina i natrijum acetat
Rješenje. Od navedenih supstanci, elektroliti uključuju soli i organske kiseline. U isto vrijeme, obje klase su prisutne samo u 4. opciji odgovora.
Tačan odgovor: 4
A23. Pri interakciji vodenih otopina oslobađa se plin
1) CaCl 2 i Ba(NO 3) 2
2) Ba(NO 3) 2 i Al 2 (SO 4) 3
3) NaHCO 3 i HI
4) AlCl 3 i Ba(NO 3) 2
Rješenje. Jedina gasna opcija u ovom zadatku je CO 2 . Može nastati prilikom razgradnje ugljične kiseline, koja nastaje kada se istisne iz soli za više jaka kiselina. Opcija 3 je pogodna:
NaHCO 3 + HI = NaI + CO 2 + H 2 O
Tačan odgovor: 3
A24. Pokazuje najjača regenerativna svojstva
1) jod
2) vodonik
3) bakar
4) dušikov oksid (II)
Rješenje. Najmoćnije redukciono sredstvo od navedenih supstanci je vodonik (zapamtite svojstva supstanci).
Tačan odgovor: 2
A25. Medij ima kiselu reakciju vodeni rastvor
1) KHCO 3
2) K 2 SO 3
3) CuSO 4
4) Na 2 SO 4
Rješenje. Sve gore navedene tvari su soli, kiselo okruženje
Tačan odgovor:
A26. Da li su sljedeće tvrdnje o alkinima tačne?
O. Molekuli svih alkina sadrže dvije -veze.
B. Acetilen obezbojava vodeni rastvor kalijum permanganata.
1) samo A je tačno
2) samo B je tačno
3) obe presude su tačne
4) obje presude su netačne
Rješenje. Molekuli alkina sadrže jednu trostruku vezu, koja se, pak, sastoji od jedne ili dvije veze. Dakle, A je tačno. Acetilen obezbojava vodeni rastvor kalijum permanganata, ovo je kvalitativna reakcija na višestruku vezu. I B je tačno.
Tačan odgovor: 3
A27. Etanol se formira ester kada reaguje sa
1) metanol
2) glicin
3) propin
4) natrijum
Rješenje. Esteri nastaju kada alkoholi reaguju sa kiselinama (reakcija esterifikacije). Karboksilna grupa (funkcionalna grupa karboksilnih kiselina) sadrži aminokiselinu glicin.
Tačan odgovor: 2
A28. Da li su sljedeće tvrdnje o pravilima rada u laboratoriji tačne?
O: Ne možete namirisati supstance u laboratoriji.
B. Sve soli natrijuma i kalija, čak i u umjerenim dozama, otrovne su za ljude.
1) samo A je tačno
2) samo B je tačno
3) obe presude su tačne
4) obje presude su netačne
Rješenje. U laboratoriju je moguće upoznati mirise tvari (samo pažljivo), stoga je A ispravno. Soli natrija i kalija u umjerenim dozama ne samo da su bezopasne, već su čak i korisne, na primjer kuhinjska sol - natrijum hlorid (za slanu juhu) ili kalijev bromid - sedativ. Dakle, B je takođe netačan.
Tačan odgovor: 4
A29. Industrijska proizvodnja amonijak se zasniva na reakciji čija je shema:
1) Ca(OH) 2 + NH 4 Cl
2) Mg 3 N 2 + H 2 O
3) H 2 + N 2
4) NH4Cl
Rješenje. U industriji se amonijak sintetizira iz jednostavne supstance- azot i vodonik na 400-450 o C, pritisak 200-1000 at u prisustvu katalizatora - aktivirano spužvasto gvožđe.
Tačan odgovor: 3
A30. Prilikom interakcije, 40 litara kisika i 40 litara vodika će ostati u višku
1) 20 l vodonika
2) 10 l kiseonika
3) 10 litara vodonika
4) 20 l kiseonika
Rješenje. Pišemo reakciju:
2H 2 + O 2 = 2H 2 O Prema zakonu višestrukih odnosa, zapremine reagujućih gasova (ako su merene pod istim uslovima) su povezane kao koeficijenti u jednačini reakcije. Ako ima 40 litara vodonika, tada će biti potrebno 2 puta manje kisika (u jednadžbi je koeficijent za vodonik 2, za kisik 1), tj. 20 l. Od 40 litara početnog kiseonika, ostat će 40 litara - 20 litara = 20 litara.