Od nauke do tehnologije. Voda, koja je toliko rasprostranjena u prirodi, uvijek sadrži otopljene tvari. IN svježa voda Malo je rijeka i jezera, dok morska voda sadrži oko 3,6% rastvorenih soli.
U primordijalnom okeanu (tokom pojave života na Zemlji) maseni udio Pretpostavlja se da su soli niske, oko 1%.
U tom rastvoru su se prvi razvili živi organizmi i iz tog rastvora su dobijali supstance i molekule neophodne za njihov rast i život... Vremenom su živi organizmi udarali i menjali se. ŠTA im je omogućilo da napuste vodeno okruženje i pređu na kopno i potom se podignu u zrak. Oni su tu sposobnost stekli, a njihovi organizmi su zadržali vodenu otopinu u obliku tekućine koja sadrži potrebnu zalihu jona i molekula” – ovako slavni američki hemičar, laureat ocjenjuje ulogu rješenja u nastanku i razvoju života na Zemlji nobelova nagrada Linus Pauling U nama, u svakoj tvojoj ćeliji, postoji sjećanje na prvobitni okean u kojem je nastao život - vodeni rastvor koji daje sam život.
U svakom živom organizmu, magično rješenje koje čini osnovu krvi teče beskonačno kroz žile - arterije, vene i kapilare; maseni udio soli u njemu je isti kao u primarnom oceanu. - 0,0%. Složeni fizički i hemijski procesi koji se dešavaju u ljudskim i životinjskim tijelima također se javljaju u otopinama. Apsorpcija hrane povezana je s prijenosom hranjivih tvari u otopinu. Prirodni vodeni rastvori učestvuju u procesima formiranja tla i snabdevaju biljke hranljive materije. Mnogi tehnološkim procesima u hemijskoj i drugim industrijama, na primer, proizvodnja sode, đubriva, kiselina, metala, papira, javljaju se u rastvorima. Proučavanje svojstava rastvora zauzima veoma važno mesto u moderna nauka. Dakle, šta je rješenje?
Razlika između otopine i ostalih mješavina je u tome. te čestice komponente su u njemu ravnomjerno raspoređeni, a u bilo kojoj mikrovolumini takve mješavine sastav je isti.
Zbog toga rješenja znači homogene smjese koje se sastoje od dva ili više homogenih dijelova. Ovaj podnesak je došao iz fizička teorija rješenja.
Zagovornici fizičke teorije rješenja koja je razvijena van't Hoff, Lrenius i Ostwald, vjerovali su da je proces rastvaranja rezultat difuzije, odnosno prodiranja otopljene tvari u prostore između molekula vode.
Za razliku od ideja fizičke teorije rješenja. D. I. Mendeljejev i pristalice hemijske teorije rješenja su dokazala da je otapanje rezultat kemijske interakcije otopljene tvari s molekulima vode. Stoga je ispravnije (tačnije) definirati otopinu kao homogeni sistem koji se sastoji od čestica otopljene tvari, rastvarača i proizvoda njihove interakcije.
Kao rezultat kemijske interakcije otopljene tvari s vodom nastaju hidratna jedinjenja. O hemijska interakcija znakove hemijskih reakcija kao npr termalne pojave kada se rastvori. Na primjer, zapamtite da se otapanje sumporne kiseline u vodi nastavlja oslobađanjem takve velika količina zagrijte, tako da otopina proključa, i zato sipajte kiselinu u vodu (a ne obrnuto). Otapanje drugih supstanci, kao što su natrijum hlorid i amonijum nitrat, je praćeno apsorpcijom toplote.
Sadržaj lekcije beleške sa lekcija podrška okvirnoj prezentaciji lekcija metode ubrzanja interaktivne tehnologije Vježbajte zadaci i vježbe radionice za samotestiranje, obuke, slučajevi, potrage domaća zadaća diskusija pitanja retorička pitanja učenika Ilustracije audio, video i multimedija fotografije, slike, grafike, tabele, dijagrami, humor, anegdote, vicevi, stripovi, parabole, izreke, ukrštene reči, citati Dodaci sažetakačlanci trikovi za radoznale jaslice udžbenici osnovni i dodatni rječnik pojmova ostalo Poboljšanje udžbenika i lekcijaispravljanje grešaka u udžbeniku ažuriranje fragmenta u udžbeniku, elementi inovacije u lekciji, zamjena zastarjelog znanja novim Samo za nastavnike savršene lekcije kalendarski plan za godinu smjernice diskusioni programi Integrisane lekcijeU običnoj tečnosti koja nije povezana, kao što je benzin, molekuli slobodno klize jedan oko drugog. U vodi se kotrljaju radije nego klize. Poznato je da su molekule vode međusobno povezane vodoničnim vezama, tako da prije nego što dođe do pomjeranja, barem jedna od ovih veza mora biti prekinuta. Ova karakteristika određuje viskozitet vode.
Dielektrična konstanta vode je njena sposobnost da neutralizira privlačnost koja postoji između električnih naboja. Otapanje čvrstih materija u vodi je složen proces koji je određen interakcijom čestica otopljene tvari i čestica vode.
Prilikom proučavanja strukture tvari pomoću rendgenskih zraka, ustanovljeno je da većina čvrste materije ima kristalnu strukturu, odnosno čestice tvari se nalaze u prostoru određenim redoslijedom. Čestice nekih supstanci nalaze se kao da su u uglovima male kocke, čestice drugih - u uglovima, centru i sredini stranica tetraedra, prizme, piramide itd. Svaki od ovih oblika je najmanja ćelija većih kristala sličnog oblika. Neke supstance imaju svoje čvorove kristalna rešetka postoje molekuli (većina organska jedinjenja), za druge (na primjer, anorganske soli) - ioni, tj. čestice koje se sastoje od jednog ili više atoma s pozitivnim ili negativnim nabojem. Sile koje drže ione u određenom prostorno orijentiranom redu kristalne rešetke su sile elektrostatičke privlačnosti suprotno nabijenih iona koji čine kristalnu rešetku.
Ako se, na primjer, natrijum hlorid otopi u vodi, tada će se pozitivno nabijeni ioni natrija i negativno nabijeni ioni klora međusobno odbijati.
Ovo odbijanje nastaje zato što voda ima visoku dielektričnu konstantu, odnosno višu od one bilo koje druge tečnosti. Smanjuje silu međusobnog privlačenja između suprotno nabijenih jona za 100 puta. Razlog za snažno neutralizirajuće djelovanje vode mora se tražiti u rasporedu njenih molekula. Atom vodika u njima ne dijeli svoj elektron jednako s atomom kisika na koji je vezan. Ovaj elektron je uvijek bliži kisiku nego vodoniku. Stoga su atomi vodika pozitivno nabijeni, a atomi kisika negativno.
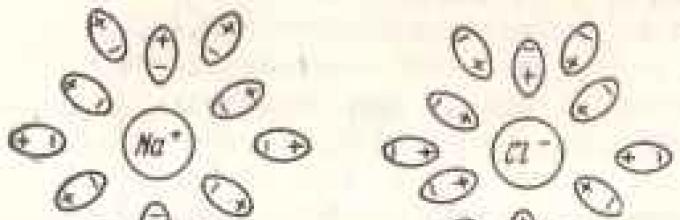
Kada se supstanca rastvara u jone, atomi kiseonika privlače se pozitivnim ionima, a atomi vodika negativnim ionima. Molekuli vode koji okružuju pozitivni ion šalju svoje atome kisika prema njemu, a molekuli koji okružuju negativni ion šalju svoje atome vodika prema njemu. Tako molekuli vode formiraju neku vrstu rešetke, koja razdvaja jone jedni od drugih i neutrališe njihovu privlačnost (slika 12). Da bi se ioni koji se nalaze u kristalnoj rešetki odvojili jedan od drugog i preneli u rastvor, potrebno je savladati privlačnu silu ove rešetke. Prilikom rastvaranja soli, ova sila je privlačenje iona rešetke od strane molekula vode, koju karakterizira takozvana energija hidratacije. Ako je energija hidratacije dovoljno visoka u odnosu na energiju kristalne rešetke, tada će se ioni odvojiti od potonje i otići u otopinu.
Odnos između molekula vode i jona odvojenih od rešetke u otopini ne samo da ne slabi, već postaje još bliži.
Kao što je već napomenuto, u rastvoru su joni okruženi i razdvojeni molekulima vode, koji, fokusirajući se na njih sa svojim delovima koji su suprotni naelektrisani, formiraju takozvanu hidratantnu ljusku (slika 13). Veličina ove školjke varira ovisno o tome različiti joni i zavisi od naboja jona, njegove veličine i, pored toga, od koncentracije jona u rastvoru.
Nekoliko godina su fizikalni hemičari proučavali vodu uglavnom kao otapalo za elektrolite. Kao rezultat toga, dobijeno je mnogo informacija o elektrolitima, ali vrlo malo o samoj vodi. Čudno, ali samo unutra poslednjih godina Pojavili su se radovi posvećeni proučavanju odnosa vode i supstanci koje su u njoj praktički netopive.
Zapažene su mnoge neverovatne pojave. Na primjer, jednog dana se pokazalo da je cijev koja je vodila prirodni plin na t = 19°C bila začepljena mokrim snijegom i vodom. Postalo je jasno da problem ovdje nije temperatura, već druga svojstva vode. Pojavila su se brojna pitanja: zašto se voda smrzavala na tako visokoj temperaturi, kako se voda može spojiti sa tvarima koje su u njoj netopive.
Ova misterija još nije bila riješena kada je otkriveno da čak i takvi plemeniti plinovi kao što su argon i ksenon, koji ne ulaze u hemijske reakcije, može da se veže sa vodom, formirajući neki privid jedinjenja.

Rice. 13. Odvajanje Na + i C1 - jona polarnih molekula vode, formirajući hidratantnu ljusku oko njih.
Zanimljivi rezultati o rastvorljivosti metana u vodi dobijeni su u Illinoisu. Molekuli metana ne stvaraju ione u vodi i ne percipiraju vodonične veze; privlačnost između njih i molekula vode je vrlo slaba. Međutim, metan se i dalje, iako slabo, otapa u vodi, a njegove disocirane molekule s njim stvaraju spojeve - hidrate, u kojima je nekoliko molekula vode vezano za jedan molekul metana. Ova reakcija oslobađa 10 puta više topline nego otapanje metana u heksanu (metan se bolje otapa u heksanu nego u vodi).
Činjenica da se metan rastvara u vodi je od velikog interesa. Na kraju krajeva, molekul metana ima duplo veći volumen više molekula vode. Da bi se metan otopio u vodi, između njegovih molekula moraju se stvoriti prilično velike "rupe". To zahtijeva značajan utrošak energije, veći nego za isparavanje vode (otprilike 10.000 kalorija za svaki mol). Odakle tolika energija? Privlačne sile između molekula metana i vode su preslabe, ne mogu pružiti toliko energije. Stoga postoji još jedna mogućnost: struktura ognjišta se mijenja u prisustvu metana. Pretpostavimo da je molekul otopljenog metana okružen omotačem od 10-20 molekula vode. Kada se formiraju takve molekularne asocijacije, oslobađa se toplina. U prostoru koji zauzima molekul metana nestaju sile međusobnog privlačenja između molekula vode, a time i unutrašnji pritisak. U takvim uslovima, kao što smo videli, voda se smrzava na temperaturama iznad nule.
Zbog toga molekuli u procjepu između metana i vode mogu kristalizirati, što se dogodilo u gore opisanom slučaju. Smrznuti hidrati se mogu apsorbirati u otopinu i osloboditi iz nje. Ova teorija je poznata kao teorija ledenog brega. U praksi, kako pokazuju studije, sve neprovodne supstance koje su testirane formiraju stabilne kristalne hidrate. Istovremeno, ova tendencija je slabo izražena u elektrolitima. Sve to dovodi do potpuno novog razumijevanja rastvorljivosti.
Vjerovalo se da otapanje elektrolita nastaje kao rezultat privlačnih sila. Sada je dokazano da se otapanje neelektrolita događa ne zbog sila privlačenja između ovih tvari i vode, već kao rezultat nedovoljne privlačnosti između njih. Tvari koje se ne raspadaju na ione spajaju se sa vodom, jer eliminišu unutrašnji pritisak i na taj način doprinose pojavi kristalnih formacija.
Da bismo bolje razumjeli stvaranje takvih hidrata, korisno je razmotriti njihovu molekularnu strukturu.
Dokazano je da nastali hidrati imaju kubične strukture(rešetka) za razliku od heksagonalne strukture leda. Dalji rad istraživači su pokazali da hidrat može imati dvije kubične rešetke: u jednoj od njih razmaci između molekula su 12 A, u drugoj - 17 A. U manjoj rešetki nalazi se 46 molekula vode, u većoj 136. Rupe od molekule plina u manjoj rešetki imaju 12-14 lica, au većoj - 12-16, štoviše, razlikuju se po veličini i ispunjene su molekulima različitih veličina, a ne mogu se sve rupe popuniti. Ovaj model objašnjava stvarnu strukturu hidrata sa visokim stepenom tačnosti.
Uloga ovakvih hidrata u životnim procesima teško se može precijeniti. Ovi se procesi odvijaju uglavnom u prostorima između vode i proteinskih molekula. Voda ima jaku tendenciju kristalizacije, budući da proteinski molekul sadrži mnogo nejonskih ili nepolarnih grupa. Svaki takav hidrat se formira pri manjoj gustoći od leda, tako da njegovo formiranje može dovesti do značajnog destruktivnog širenja.
Dakle, voda je neka vrsta spoj sa specifičnim i raznovrsnim hemijska svojstva. Ona ima vitku i istovremeno promjenjivu fizičku strukturu.
Razvoj sve žive i uglavnom nežive prirode je neraskidivo povezan sa karakteristične karakteristike vode.
Margarita Khalisova
Sažetak lekcije „Voda je rastvarač. Prečišćavanje vode"
Predmet: Voda je rastvarač. Prečišćavanje vode.
Target: učvrstiti razumijevanje da tvari u vodi ne nestaju, već rastvoriti.
Zadaci:
1. Identifikujte supstance koje rastvoriti u vodi, a koji nisu rastvoriti u vodi.
2. Uvedite način čišćenja voda – filtracijom.
3. Stvoriti uslove za identifikaciju i testiranje različitih metoda čišćenja vode.
4. Učvrstiti znanja o pravilima bezbednog ponašanja pri radu sa raznim supstancama.
5. Razvijati logičko razmišljanje modeliranjem problemskih situacija i njihovim rješavanjem.
6. Negujte tačnost i sigurno ponašanje pri radu sa raznim supstancama.
7. Negujte interesovanje za kognitivna aktivnost, eksperimentisanje.
Obrazovna područja:
Kognitivni razvoj
Društveni i komunikativni razvoj
Fizički razvoj
Rad sa vokabularom:
obogaćivanje: filter, filter
aktivacija: lijevak
Preliminarni rad: razgovori o vodi, njenoj ulozi u životu čovjeka; vršili zapažanja vode u vrtić, Kuće; eksperimenti s vodom; pogledao ilustracije na tu temu « Voda» ; upoznao se sa sigurnosnim pravilima tokom istraživanja i eksperimentisanja; postavljati zagonetke o vodi; čitanje fikcija, ekološke priče; igrice o vodi.
Demonstracijski i vizuelni materijal: lutka u plavom odijelu "kapljica".
Handout: prazne čaše sa vodom; rastvarači: šećer, so, brašno, pesak, prehrambene boje, biljno ulje; plastične kašike, levci, gaze salvete, pamučni jastučići, kecelje od uljane tkanine, šolje čaja, limuna, džema, jednokratnih tanjira, platnene krpe za stolove.
GCD potez
Educator: - Momci, pre nego što počnem razgovor sa vama želim da vam poželim zagonetka:
Živi u morima i rijekama
Ali često leti preko neba.
Kako će joj dosaditi letenje?
Ponovo pada na zemlju. (vode)
Možete li pogoditi o čemu će se razgovarati? Tako je, o vodi. To već znamo voda je tečnost.
Prisjetimo se koja svojstva vode utvrdili smo uz pomoć eksperimenata na drugima casovi. Lista.
Djeca:
1. U voda nema miris.
2. Nema ukusa.
3. Prozirno je.
4. Bezbojno.
5. Voda poprima oblik posude u koju se sipa.
6. Ima težinu.
Educator: - Tačno. Želite li ponovo eksperimentirati s vodom? Da bismo to učinili, moramo se nakratko pretvoriti u naučnike i pogledati u našu laboratoriju eksperimentisanje:
Skrenite desno, skrenite lijevo,
Pronađite se u laboratoriji.
(djeca prilaze mini laboratoriji).
Educator: - Momci, pogledajte ko nas opet dolazi u goste? A šta ima novo u laboratoriji?
Djeca: - "kapljica", unuka djeda Znalačka i lijepa kutija.
Želite li znati šta je u ovoj kutiji? Pogodi zagonetke:
1. Odvojeno - nisam tako ukusan,
Ali u hrani - svima treba (sol)
2. Ja sam bijel kao snijeg
U čast svima.
Imam ga u ustima -
Tamo je nestao. (šećer)
3. Od mene peku kolače od sira,
I palačinke i palačinke.
Ako pravite testo,
Moraju me spustiti (brasno)
4. Žuta, ne sunce,
Pljušti, ne vode,
Pjeni se u tiganju,
Prskanje i šištanje (ulje)
Boje za hranu - koriste se u kulinarstvu za ukrašavanje kolača i bojenje jaja.
Pijesak - za gradnju, igrajte se s njim u pješčaniku.
Djeca ispituju epruvete sa supstancama.
Educator: - Sve ove supstance sam doneo "kapljica" tako da joj možemo pomoći da shvati šta će se desiti sa vodom kada bude u interakciji sa njima.
Educator: - Šta nam je potrebno za početak rada sa vodom?
Djeca: - Kecelje.
(djeca stavljaju kecelje od uljane tkanine i idu do stola, gdje se na poslužavniku nalaze čaše čiste vode).
Educator: - Prisjetimo se pravila prije nego počnemo raditi s ovim supstance:
Djeca:
1. Ne možete okusiti supstance - postoji mogućnost trovanja.
2. Morate pažljivo njušiti, jer supstance mogu biti vrlo zajedljive i mogu vam izgorjeti respiratorni trakt.
Educator: - Danil će ti pokazati kako se to radi ispravno (dlanom usmjerava miris iz čaše).
I. Istraživanje Posao:
Educator: - Ljudi, šta mislite da će se promeniti ako rastvoriti ove supstance u vodi?
Slušam očekivane rezultate djece prije miješanja tvari s vodom.
Educator: - Hajde da proverimo.
Predlažem da svako dijete popije čašu vode.
Educator: - Pogledaj i odredi koji je tamo vode?
Djeca: - Voda je bistra, bezbojno, bez mirisa, hladno.
Educator: - Uzmite epruvetu sa supstancom koju ste odabrali i rastvoriti u čaši vode, mešajući kašikom.
Razmatramo. Slušam odgovore djece. Da li su tačno pogodili?
Educator: - Šta se desilo sa šećerom i solju?
Sol i šećer brzo rastvoriti u vodi, voda ostaje bistra, bezbojan.
Brašno takođe rastvoriti u vodi, Ali voda postaje mutna.
Ali posle voda će stajati neko vrijeme, brašno se slegne na dno, ali rješenje i dalje oblačno.
Voda sa peskom se zaprlja, zamuti, ako se vise ne mesi pesak je potonuo na dno stakla, vidi se, tj. ne rastvoreno.
prah za hranu rastvarač brzo promenio boju vode, znači, dobro se rastvara.
Nafta nije rastvara se u vodi: ili je namazi na njegovoj površini kao tanak film, ili pluta u vodi u obliku žutih kapljica.
Voda je rastvarač! Ali ne sve supstance rastvoriti u njemu.
Educator: - Ljudi, radili smo sa vama i "kapljica" poziva nas na odmor.
(Djeca sjede za drugim stolom i igra se.
Igra: „Pogodite ukus pića (čaj)».
Ispijanje čaja sa različitim ukusima: šećer, džem, limun.
II Eksperimentalni rad.
Prilazimo tabeli 1.
Educator: - Ljudi, da li je moguće prečistiti vodu od ovih supstanci koje mi imamo rastvoreno? Vratite ga u prethodno stanje transparentnosti, bez taloga. Kako uraditi?
Predlažem da uzmeš naočare rješenja i idite na tabelu 2.
Educator: - Možete ga filtrirati. Za ovo vam je potreban filter. Od čega se može napraviti filter? To ćemo učiniti pomoću gaze salvete i pamučnog jastučića. Pokazujem vam (u lijevak sam stavila gazu presavijenu u nekoliko slojeva i pamučni jastučić i stavila u praznu čašu).
Izrada filtera sa djecom.
Pokazujem način filtriranja, a onda djeca sama filtriraju vodu sa supstancom koju su odabrala.
Podsjećam djecu da ne žure, sipaju u mali potočić rješenje u lijevak sa filterom. ja govorim poslovica: “Ako požuriš, nasmijat ćeš ljude”.
Pogledajmo šta se dogodilo nakon filtriranja vode sa različitim supstancama.
Ulje je brzo filtrirano jer nije rastvoreno u vodi, na filteru su jasno vidljivi tragovi ulja. Ista stvar se desila i sa peskom. Praktično nije bilo filtriranih tvari koje su bile dobre rastvoreno u vodi: šećer, so.
Voda sa brašnom nakon filtriranja postalo je providnije. Većina brašna se taložila na filteru, samo su vrlo sitne čestice proklizale kroz filter i završile u čaši, tako da vode nije sasvim transparentno.
Nakon filtriranja boje, boja filtera se promijenila, ali je filtrirana rješenje takođe ostao u boji.
GCD rezultat:
1. Koje supstance rastvoriti u vodi? – šećer, so, boja, brašno.
2. Koje supstance nisu rastvara se u vodi - pijesku, ulje.
3. Kojim načinom čišćenja vode koju smo sreli? – filtriranje.
4. Sa čime? – filter.
5. Da li su se svi pridržavali sigurnosnih pravila? (jedan primjer).
6. Šta je zanimljivo (novo) jesi li saznao danas?
Educator: - Danas ste to naučili voda je rastvarač, provjerio koje supstance rastvoriti u vodi i kako možete prečistiti vodu od različitih supstanci.
"kapljica" hvala vam na pomoći i daje vam album za skiciranje vaših eksperimenata. Ovim je naše istraživanje završeno, vraćamo se iz laboratorije u grupa:
Skrenite desno, skrenite lijevo.
Ponovo ćete se naći u grupi.
Književnost:
1. A. I. Ivanova Ekološka zapažanja i eksperimenti u vrtiću
2. G. P. Tugusheva, A. E. Chistyakova Eksperimentalne aktivnosti djeca srednjeg i starijeg predškolskog uzrasta starost St. Petersburg: Childhood-Press 2010.
3. Kognitivne istraživačke aktivnosti starijih predškolaca - Dijete u vrtiću br. 3,4,5 2003.
4. Istraživačke aktivnosti predškolac - D/v br. 7 2001.
5. Eksperimentisanje sa vodom i vazduhom - D/V br. 6, 2008.
6. Eksperimentalne aktivnosti u vrtiću - Vaspitačica br. 9 2009
7. Igre - eksperimentisanje mlađi predškolac – Predškolska pedagogija br. 5 2010
Rješenje naziva se termodinamički stabilan homogeni (jednofazni) sistem promjenljivog sastava, koji se sastoji od dvije ili više komponenti ( hemijske supstance). Komponente koje čine rastvor su rastvarač i rastvor. Obično se otapačem smatra komponenta koja postoji u svom čistom obliku u istom stanje agregacije, kao rezultujući rastvor (na primer, u slučaju vodenog rastvora soli, rastvarač je, naravno, voda). Ako su obje komponente bile u istom agregacijskom stanju prije rastvaranja (na primjer, alkohol i voda), onda se komponenta koja je u većim količinama smatra rastvaračem.
Rastvori su tečni, čvrsti i gasoviti.
Tečni rastvori su rastvori soli, šećera, alkohola u vodi. Tečne otopine mogu biti vodene i nevodene. Vodeni rastvori su rastvori u kojima je rastvarač voda. Nevodeni rastvori su rastvori u kojima su rastvarači organske tečnosti (benzen, alkohol, etar itd.). Čvrste otopine su legure metala. Gasoviti rastvori - vazduh i druge mešavine gasova.
Proces rastvaranja. Otapanje je složen fizički i hemijski proces. Tokom fizičkog procesa, struktura otopljene tvari je uništena i njene čestice se raspoređuju između molekula rastvarača. Hemijski proces je interakcija molekula rastvarača sa česticama otopljene tvari. Kao rezultat ove interakcije, solvati. Ako je rastvarač voda, nastali solvati se nazivaju hidratizira. Proces nastajanja solvata naziva se solvatacija, a proces stvaranja hidrata naziva se hidratacija. Prilikom isparavanja vodeni rastvori nastaju kristalni hidrati - to su kristalne supstance, koji sadrže određeni broj molekula vode (kristalna voda). Primjeri kristalnih hidrata: CuSO 4 . 5H 2 O – bakar (II) sulfat pentahidrat; FeSO4 . 7H 2 O – gvožđe (II) sulfat heptahidrat.
Fizički proces rastvaranja se dešava sa apsorpcija energetski, hemijski - sa isticanje. Ako se kao rezultat hidratacije (solvatacije) oslobodi više energije nego što se apsorbira tijekom razaranja strukture tvari, tada je otapanje egzotermna proces. Energija se oslobađa kada se rastvore NaOH, H 2 SO 4, Na 2 CO 3, ZnSO 4 i druge supstance. Ako je za uništavanje strukture supstance potrebno više energije nego što se oslobađa tokom hidratacije, onda je otapanje endotermni proces. Apsorpcija energije nastaje kada se NaNO 3, KCl, NH 4 NO 3, K 2 SO 4, NH 4 Cl i neke druge supstance rastvore u vodi.
Količina energije koja se oslobađa ili apsorbuje tokom rastvaranja naziva se termički efekat rastvaranja.
Rastvorljivost supstanca je njena sposobnost da se distribuira u drugoj supstanci u obliku atoma, jona ili molekula kako bi se formirao termodinamički stabilan sistem promenljivog sastava. Kvantitativna karakteristika rastvorljivosti je koeficijent rastvorljivosti, koji pokazuje koliku maksimalnu masu tvari može otopiti u 1000 ili 100 g vode pri datoj temperaturi. Rastvorljivost tvari ovisi o prirodi rastvarača i tvari, o temperaturi i tlaku (za plinove). Rastvorljivost čvrstih materija općenito raste s povećanjem temperature. Rastvorljivost plinova opada s povećanjem temperature, ali raste s povećanjem tlaka.
Na osnovu njihove rastvorljivosti u vodi, supstance se dele u tri grupe:
1. Dobro rastvorljiv (r.). Rastvorljivost tvari je veća od 10 g u 1000 g vode. Na primjer, 2000 g šećera otopi se u 1000 g vode, odnosno u 1 litru vode.
2. Slabo rastvorljiv (m.). Rastvorljivost tvari je od 0,01 g do 10 g u 1000 g vode. Na primjer, 2 g gipsa (CaSO 4 . 2 H 2 O) rastvara se u 1000 g vode.
3. Praktično nerastvorljiv (n.). Rastvorljivost tvari je manja od 0,01 g u 1000 g vode. Na primjer, 1,5 rastvora se u 1000 g vode . 10 -3 g AgCl.
Kada se tvari otapaju, mogu nastati zasićene, nezasićene i prezasićene otopine.
Zasićeni rastvor je rastvor koji sadrži maksimalnu količinu rastvorene supstance pod datim uslovima. Kada se supstanca doda takvoj otopini, supstanca se više ne otapa.
Nezasićeni rastvor- rastvor koji sadrži manje rastvorene supstance od zasićenog rastvora pod datim uslovima. Kada se supstanca doda takvoj otopini, supstanca se i dalje otapa.
Ponekad je moguće dobiti otopinu koja sadrži više otopljene tvari od zasićene otopine na datoj temperaturi. Takvo rješenje naziva se prezasićeno. Ovaj rastvor se priprema pažljivim hlađenjem zasićenog rastvora do sobnoj temperaturi. Prezasićene otopine su vrlo nestabilne. Kristalizacija tvari u takvoj otopini može biti uzrokovana trljanjem stijenki posude u kojoj se otopina nalazi staklenom šipkom. Ova metoda se koristi kada se izvode neke kvalitativne reakcije.
Rastvorljivost supstance se takođe može izraziti molarnom koncentracijom njenog zasićenog rastvora (odeljak 2.2).
Konstanta rastvorljivosti. Razmotrimo procese koji nastaju pri interakciji slabo rastvorljivog, ali jakog elektrolita barijum sulfata BaSO 4 sa vodom. Pod uticajem vodenih dipola, joni Ba 2+ i SO 4 2 - iz kristalne rešetke BaSO 4 će preći u tečnu fazu. Istovremeno sa ovim procesom, pod uticajem elektrostatičko polje kristalne rešetke, deo jona Ba 2+ i SO 4 2 - ponovo će se deponovati (slika 3). Na datoj temperaturi će se konačno uspostaviti ravnoteža u heterogenom sistemu: brzina procesa rastvaranja (V 1) biće jednaka brzini procesa taloženja (V 2), tj.
BaSO 4 ⇄ Ba 2+ + SO 4 2 -
čvrsti rastvor
Rice. 3. Zasićeni rastvor barijum sulfata
Rješenje u ravnoteži sa čvrstom fazom BaSO 4 naziva se bogat u odnosu na barijum sulfat.
Zasićeni rastvor je ravnotežni heterogeni sistem koji karakteriše konstanta hemijska ravnoteža:
 , (1)
, (1)
gdje je a (Ba 2+) aktivnost barijevih jona; a(SO 4 2-) – aktivnost sulfatnih jona;
a (BaSO 4) – aktivnost molekula barijum sulfata.
Imenitelj ovog razlomka - aktivnost kristalnog BaSO 4 - je konstantna vrijednost jednaka jedinici. Proizvod dvije konstante daje novu konstantu tzv termodinamička konstanta rastvorljivosti i označimo K s °:
K s° = a(Ba 2+) . a(SO 4 2-). (2)
Ova količina je ranije nazvana proizvodom rastvorljivosti i označena kao PR.
Dakle, u zasićenom rastvoru teško rastvorljivog jakog elektrolita, proizvod ravnotežnih aktivnosti njegovih jona je konstantna vrednost na datoj temperaturi.
Ako pretpostavimo da je u zasićenom rastvoru slabo rastvorljivog elektrolita koeficijent aktivnosti f~1, tada se aktivnost jona u ovom slučaju može zamijeniti njihovim koncentracijama, budući da a( X) = f (X) . SA ( X). Termodinamička konstanta rastvorljivosti K s ° će se pretvoriti u konstantu koncentracijske rastvorljivosti K s:
K s = C(Ba 2+) . C(SO 4 2-), (3)
gdje su C(Ba 2+) i C(SO 4 2 -) ravnotežne koncentracije jona Ba 2+ i SO 4 2 - (mol/l) u zasićenom rastvoru barijum sulfata.
Da bi se pojednostavili proračuni, obično se koristi konstanta rastvorljivosti koncentracije Ks, uzimajući f(X) = 1 (Dodatak 2).
Ako slabo topiv jak elektrolit formira nekoliko iona nakon disocijacije, tada izraz K s (ili K s °) uključuje odgovarajuće snage jednake stehiometrijskim koeficijentima:
PbCl 2 ⇄ Pb 2+ + 2 Cl - ; K s = C (Pb 2+) . C 2 (Cl -);
Ag 3 PO 4 ⇄ 3 Ag + + PO 4 3 - ; K s = C 3 (Ag +) . C (PO 4 3 -).
IN opšti pogled izraz konstante koncentracijske rastvorljivosti za elektrolit A m B n ⇄ m A n++ n B m - ima oblik
K s = S m (A n+) . C n (B m -),
gdje je C koncentracija A n+ i B m jona u zasićenom rastvoru elektrolita u mol/l.
K s vrijednost se obično koristi samo za elektrolite čija rastvorljivost u vodi ne prelazi 0,01 mol/l.
Uslovi za formiranje padavina
Pretpostavimo da je c stvarna koncentracija jona slabo rastvorljivog elektrolita u rastvoru.
Ako je C m (A n +) . Sa n (B m -) > K s, tada će doći do formiranja taloga, jer rastvor postaje prezasićen.
Ako je C m (A n +) . C n (B m -)< K s , то раствор является ненасыщенным и осадок не образуется.
Svojstva rješenja. U nastavku ćemo razmotriti svojstva neelektrolitnih otopina. U slučaju elektrolita, izotonični korektivni faktor se uvodi u date formule.
Ako je nehlapljiva tvar otopljena u tekućini, tada je tlak zasićene pare iznad otopine manji od tlaka zasićene pare iznad čistog otapala. Istovremeno sa smanjenjem tlaka pare iznad otopine, uočava se promjena njegovih tačaka ključanja i smrzavanja; Tačke ključanja rastvora se povećavaju, a temperature smrzavanja se smanjuju u poređenju sa temperaturama koje karakterišu čista rastvarača.
Relativno smanjenje tačke smrzavanja ili relativno povećanje tačke ključanja rastvora proporcionalno je njegovoj koncentraciji.
zadatak: Pokažite djeci rastvorljivost i nerastvorljivost različitih supstanci u vodi.
Materijali: brašno, granulirani šećer, riječni pijesak, boje za hranu, prašak za pranje rublja, čaše čiste vode, kašike ili štapići za jelo, pladnjevi, slike koje prikazuju predstavljene supstance.
Opis. Ispred djece na tacnama su čaše vode, štapići za jelo, kašike i supstance u raznim posudama. Djeca gledaju vodu i pamte njena svojstva. Šta mislite da će se dogoditi ako se u vodu doda granulirani šećer? Deda Know dodaje šećer, meša i svi zajedno posmatraju šta se promenilo. Šta će se dogoditi ako u vodu dodamo riječni pijesak? Dodaje riječni pijesak u vodu i miješa. Je li se voda promijenila? Da li je postalo oblačno ili je ostalo vedro? Da li se rečni pesak rastvorio?
Šta će se dogoditi s vodom ako joj dodamo prehrambenu boju? Dodaje boju i miješa. Šta se promijenilo? (Voda je promijenila boju.) Da li se boja otopila? (Boja se otopila i promijenila boju vode, voda je postala neprozirna.)
Hoće li se brašno otopiti u vodi? Djeca dodaju brašno u vodu i promiješaju. Šta je voda postala? Oblačno ili vedro? Da li se brašno rastvorilo u vodi?
Hoće li se prašak za pranje otopiti u vodi? Dodajte prašak za pranje i promiješajte. Da li se prah otopio u vodi? Šta ste primijetili da je neobično? Uronite prste u smjesu i provjerite da li je i dalje isti kao čista voda? (Voda je postala sapunasta.) Koje su supstance rastvorene u našoj vodi? Koje supstance se ne otapaju u vodi?
(Rezultati se bilježe na flanelgrafu.)
COLORED SAND
Zadaci: upoznati djecu sa načinom pravljenja pijeska u boji (miješanje s kredom u boji); naučite kako koristiti rende.
Materijali: bojice u boji, pesak, prozirna posuda, sitni predmeti, 2 kesice, sitni rende, činije, kašike (štapići), male tegle sa poklopcima.
Opis. Mala čavka, Curiosity, doletjela je do djece. Traži od djece da pogode šta je u njegovim torbama. Djeca pokušavaju odrediti dodirom (U jednoj vrećici je pijesak, u drugoj komadići krede.) Učitelj otvara vrećice, djeca provjeravaju svoja nagađanja. Učiteljica i djeca pregledavaju sadržaj vrećica. Šta je ovo? Kakav pijesak? Šta možete učiniti s tim? Koje je boje kreda? Kakav je to osjećaj? Može li se pokvariti? čemu služi? Mala Gal pita: „Može li se bojiti pijesak? Kako to učiniti obojenim? Šta će se dogoditi ako pomiješamo pijesak sa kredom? Kako možeš napraviti kredu tekuću poput pijeska?” Mali Gal se hvali da ima alat za pretvaranje krede u fini prah.
Pokazuje djeci rende. Šta je ovo? Kako ga koristiti? Djeca, po uzoru na malu čavku, uzimaju činije, rende i trljaju kredu. Šta se desilo? Koje je boje tvoj puder? (Mali kamenčić pita svako dijete) Kako da sada napravim boju pijeska? Djeca sipaju pijesak u zdjelu i miješaju ga kašikama ili štapićima za jelo. Djeca gledaju pijesak u boji. Kako možemo koristiti ovaj pijesak? (Napravi prelepe slike.)
Mali Galchoff se nudi da igra. Pokazuje prozirnu posudu ispunjenu raznobojnim slojevima pijeska i pita djecu: "Kako brzo pronaći skriveni predmet?" Djeca nude svoje mogućnosti. Učiteljica objašnjava da se pijesak ne može miješati rukama, štapom ili kašikom i pokazuje kako se tresenjem posude istisnuti predmet iz pijeska.
Šta se dogodilo sa šarenim pijeskom? Djeca napominju da smo na taj način brzo pronašli predmet i pomiješali pijesak.
Djeca sakrivaju male predmete u prozirne tegle, prekrivaju ih slojevima raznobojnog pijeska, zatvaraju tegle poklopcima i pokazuju djevojčici kako brzo pronalaze skriveni predmet i miješaju pijesak. Mali Galchon daje djeci kutiju krede u boji kao oproštajni poklon.
IGRE SA PJESKOM
Zadaci: konsolidirati dječje ideje o svojstvima pijeska, razvijati radoznalost i zapažanje, aktivirati dječji govor i razvijati konstruktivne vještine.
Materijali: veliki dječiji pješčanik, u kojem su ostavljeni tragovi plastičnih životinja, igračke za životinje, lopatice, dječje grabulje, kante za zalijevanje, plan prostora za šetnje ove grupe.
Opis. Djeca izlaze van i istražuju prostor za šetnju. Učitelj im skreće pažnju na neobične otiske stopala u pješčaniku. Zašto su otisci stopala tako jasno vidljivi u pijesku? Čiji su ovo tragovi? Zašto tako misliš?
Djeca pronalaze plastične životinje i testiraju svoja nagađanja: uzimaju igračke, stavljaju šape na pijesak i traže isti otisak. Kakav će trag ostati od dlana? Djeca ostavljaju svoje tragove. Čiji je dlan veći? Čiji je manji? Provjerite prijavom.
Učitelj pronalazi slovo u šapama medvjedića i iz njega vadi plan mjesta. Šta je prikazano? Koje mjesto je zaokruženo crvenom bojom? (Peščanik.) Šta bi tu još moglo biti zanimljivo? Možda neko iznenađenje? Djeca, uranjajući ruke u pijesak, traže igračke. Ko je ovo?
Svaka životinja ima svoj dom. Lisica ima... (rupa), medvjed ima... (brlog), pas ima... (uzgajivačnica). Hajde da napravimo kućicu od peska za svaku životinju. Sa kojim pijeskom je najbolje graditi? Kako ga navlažiti?
Djeca uzimaju kante za zalijevanje i zalijevaju pijesak. Gde ide voda? Zašto je pijesak postao mokar? Djeca grade kuće i igraju se sa životinjama.