- uspio. Po upravljačkom mehanizmu: električni, hemijski i mehanički upravljani;
- nekontrolisano. Nemaju mehanizam kapije i uvijek su otvoreni, joni teku stalno, ali sporo.
Potencijal za odmor je razlika u električnom potencijalu između vanjskog i unutrašnje okruženjećelije.
Mehanizam formiranja potencijala mirovanja. Neposredni uzrok potencijala mirovanja je nejednaka koncentracija aniona i kationa unutar i izvan ćelije. Prvo, ovakav raspored jona opravdava se razlikom u permeabilnosti. Drugo, značajno više jona kalijuma napušta ćeliju nego natrijuma.
Akcioni potencijal- ovo je ekscitacija ćelije, brza fluktuacija membranskog potencijala zbog difuzije jona u i iz ćelije.
Kada stimulus deluje na ćelije ekscitabilnog tkiva, prvo se vrlo brzo aktiviraju i inaktiviraju natrijumski kanali, a zatim se kalijumovi kanali aktiviraju i inaktiviraju sa izvesnim zakašnjenjem.
Kao rezultat, ioni brzo difundiraju u ćeliju ili iz nje duž elektrohemijskog gradijenta. Ovo je uzbuđenje. Na osnovu promjene veličine i znaka naboja ćelije razlikuju se tri faze:
- 1. faza - depolarizacija. Smanjenje punjenja ćelije na nulu. Natrijum se kreće prema ćeliji prema koncentraciji i električnom gradijentu. Stanje kretanja: kapija natrijum kanala otvorena;
- 2. faza - inverzija. Obrnuti znak punjenja. Inverzija se sastoji od dva dijela: uzlaznog i silaznog.
Uzlazni dio. Natrijum nastavlja da se kreće u ćeliju u skladu sa gradijentom koncentracije, ali protiv električnog gradijenta (interferira).
Silazni dio. Kalij počinje napuštati ćeliju prema koncentraciji i električnom gradijentu. Kapija kalijumskog kanala je otvorena;
- 3. faza - repolarizacija. Kalijum nastavlja da napušta ćeliju u skladu sa gradijentom koncentracije, ali suprotno električnom gradijentu.
Kriterijumi ekscitabilnosti
S razvojem akcionog potencijala dolazi do promjene ekscitabilnosti tkiva. Ova promjena se dešava u fazama. Stanje početne polarizacije membrane tipično odražava potencijal membrane u mirovanju, koji odgovara početnom stanju ekscitabilnosti i, prema tome, početnom stanju ekscitabilne ćelije. Ovo je normalan nivo razdražljivosti. Pre-spike period je period samog početka akcionog potencijala. Ekscitabilnost tkiva je blago povećana. Ova faza ekscitabilnosti je primarna egzaltacija (primarna natprirodna ekscitabilnost). Tokom razvoja prespika, membranski potencijal se približava kritičnom nivou depolarizacije, a da bi se postigao ovaj nivo, jačina stimulusa može biti manja od praga.
U periodu razvoja špica (vršnog potencijala) dolazi do lavinskog strujanja jona natrijuma u ćeliju, usled čega se membrana puni i ona gubi sposobnost da reaguje ekscitacijom na nadražaje iznad. -granična snaga. Ova faza ekscitabilnosti naziva se apsolutna refraktornost, tj. apsolutna nerazdražljivost, koja traje do kraja punjenja membrane. Apsolutna refraktornost membrane nastaje zbog činjenice da se natrijevi kanali potpuno otvaraju, a zatim inaktiviraju.
Nakon završetka faze punjenja, njegova ekscitabilnost se postepeno vraća na prvobitni nivo - ovo je faza relativne refraktornosti, tj. relativna nerazdražljivost. Nastavlja se sve dok se naboj membrane ne vrati na vrijednost koja odgovara kritičnom nivou depolarizacije. Budući da tokom ovog perioda potencijal membrane mirovanja još nije obnovljen, ekscitabilnost tkiva je smanjena, a nova ekscitacija može nastati samo pod djelovanjem superpragovog stimulusa. Smanjenje ekscitabilnosti u relativnoj refraktornoj fazi povezano je s djelomičnom inaktivacijom natrijumskih kanala i aktivacijom kalijumovih kanala.
Sledeći period odgovara povećan nivo ekscitabilnost: faza sekundarne egzaltacije ili sekundarne natprirodne ekscitabilnosti. Budući da je membranski potencijal u ovoj fazi bliži kritičnom nivou depolarizacije, u odnosu na stanje mirovanja početne polarizacije, prag stimulacije je smanjen, tj. povećana je ekscitabilnost ćelija. Tokom ove faze, nova ekscitacija može nastati djelovanjem stimulansa ispod praga snage. Natrijumski kanali nisu potpuno inaktivirani tokom ove faze. Povećava se membranski potencijal - javlja se stanje hiperpolarizacije membrane. Udaljavajući se od kritičnog nivoa depolarizacije, prag stimulacije se neznatno povećava, a nova ekscitacija može nastati samo pod uticajem stimulusa iznad-prag vrednosti.
Mehanizam nastanka membranskog potencijala mirovanja
Svaka stanica u mirovanju karakterizira prisutnost transmembranske potencijalne razlike (potencijala mirovanja). Tipično, razlika naboja između unutrašnje i vanjske površine membrane je -80 do -100 mV i može se mjeriti korištenjem vanjskih i intracelularnih mikroelektroda (slika 1).
Razlika potencijala između vanjske i unutrašnje strane ćelijske membrane u stanju mirovanja naziva se membranski potencijal (potencijal mirovanja).
Stvaranje potencijala mirovanja osiguravaju dva glavna procesa - neravnomjerna raspodjela neorganski joni između intra- i ekstracelularnog prostora i nejednake propusnosti za njih stanične membrane. Analiza hemijski sastav ekstra- i intracelularna tečnost ukazuje na izuzetno neravnomernu raspodelu jona (tabela 1).
U mirovanju se unutar ćelije nalazi mnogo anjona organskih kiselina i K+ iona, čija je koncentracija 30 puta veća nego izvan nje; Naprotiv, izvan ćelije ima 10 puta više jona Na+ nego unutra; CI- je također veći spolja.
U mirovanju, membrana nervnih ćelija je najpropusnija za K+, manje propusna za CI- i vrlo malo propusna za Na+.Propustljivost membrane nervnih vlakana za Na+ u mirovanju je 100 puta manja nego za K+. Za mnoge anione organskih kiselina membrana u mirovanju je potpuno nepropusna.
Rice. 1. Mjerenje potencijala mirovanja mišićnog vlakna (A) pomoću intracelularne mikroelektrode: M - mikroelektroda; I - indiferentna elektroda. Snop na ekranu osciloskopa (B) pokazuje da je prije nego što je mikroelektroda probušila membranu, razlika potencijala između M i I bila jednaka nuli. U trenutku punkcije (prikazano strelicom), otkrivena je razlika potencijala, što ukazuje da je unutrašnja strana membrane negativno nabijena u odnosu na njenu vanjsku površinu (prema B.I. Khodorovu)
Table. Intra- i ekstracelularne koncentracije jona u mišićnoj ćeliji toplokrvne životinje, mmol/l (prema J. Dudelu)
|
Intracelularna koncentracija |
Ekstracelularna koncentracija |
|
|
A- (anjoni organskih jedinjenja) |
Zbog gradijenta koncentracije, K+ dospijeva do vanjske površine ćelije, noseći svoj pozitivni naboj. Anioni visoke molekularne težine ne mogu pratiti K+ jer je membrana za njih nepropusna. Jon Na+ također ne može zamijeniti izgubljene jone kalija, jer je propusnost membrane za njega znatno manja. CI- duž gradijenta koncentracije može se kretati samo unutar ćelije, povećavajući tako negativni naboj unutrašnje površine membrane. Kao rezultat ovog kretanja jona, dolazi do polarizacije membrane kada je njena vanjska površina nabijena pozitivno, a unutrašnja negativno.
Električno polje koje se stvara na membrani aktivno ometa distribuciju jona između unutrašnjeg i vanjskog sadržaja ćelije. Kako se povećava pozitivan naboj na vanjskoj površini ćelije, postaje sve teže za K+ jon, koji je pozitivno nabijen, da se kreće iznutra prema van. Čini se da se kreće uzbrdo. Što je veći pozitivni naboj na vanjskoj površini, manje K+ jona može doći do površine ćelije. Pri određenom potencijalu na membrani, broj K+ jona koji prelaze membranu u oba smjera ispada jednak, tj. Gradijent koncentracije kalija je uravnotežen potencijalom prisutnim na membrani. Potencijal pri kojem difuzijski tok iona postaje jednak fluksu sličnih jona koji ulaze u obrnuti smjer, naziva se ravnotežni potencijal za dati ion. Za K+ jone, ravnotežni potencijal je -90 mV. Kod mijeliniziranih nervnih vlakana vrijednost ravnotežnog potencijala za CI-ione je blizu vrijednosti membranskog potencijala mirovanja (-70 mV). Stoga, uprkos činjenici da je koncentracija CI-iona izvan vlakna veća nego unutar njega, njihova jednosmjerna struja se ne opaža u skladu s gradijentom koncentracije. U ovom slučaju, razlika koncentracije je uravnotežena potencijalom prisutnim na membrani.
Ion Na+ duž gradijenta koncentracije treba da uđe u ćeliju (njegov ravnotežni potencijal je +60 mV), a prisustvo negativnog naboja unutar ćelije ne bi trebalo da ometa ovaj tok. U ovom slučaju, dolazni Na+ bi neutralizirao negativne naboje unutar ćelije. Međutim, to se zapravo ne događa, jer je membrana u mirovanju slabo propusna za Na+.
Najvažniji mehanizam koji održava nisku unutarćelijsku koncentraciju Na+ iona i visoku koncentraciju K+ jona je natrijum-kalijum pumpa (aktivni transport). Poznato je da u ćelijskoj membrani postoji sistem nosača, od kojih je svaki vezan uz stremen Na+ jona koji se nalazi unutar ćelije i izvodi ih. Sa vanjske strane, nosač se vezuje za dva K+ jona smještena izvan ćelije, koji se prenose u citoplazmu. Snabdevanje energijom za rad transportnih sistema obezbeđuje ATP. Rad pumpe koja koristi takav sistem dovodi do sljedećih rezultata:
- unutar ćelije se održava visoka koncentracija K+ jona, što osigurava konstantnu vrijednost potencijala mirovanja. Zbog činjenice da se tokom jednog ciklusa jonske izmjene iz ćelije ukloni još jedan pozitivni ion nego što se unese, aktivni transport igra ulogu u stvaranju potencijala mirovanja. U ovom slučaju govore o elektrogenskoj pumpi, jer ona sama stvara malo, ali D.C. pozitivnih naboja iz ćelije, te stoga direktno doprinosi stvaranju negativnog potencijala unutar nje. Međutim, veličina doprinosa elektrogene pumpe u opšte značenje potencijal mirovanja je obično mali i iznosi nekoliko milivolti;
- unutar ćelije se održava niska koncentracija Na + iona, što s jedne strane osigurava rad mehanizma stvaranja akcionog potencijala, as druge strane osigurava očuvanje normalnog osmolarnosti i volumena ćelije;
- održavajući stabilan gradijent koncentracije Na+, natrijum-kalijum pumpa promoviše spojeni K+, Na+-transport aminokiselina i šećera kroz ćelijsku membranu.
Dakle, pojava razlike transmembranskog potencijala (potencijala mirovanja) je posljedica visoke provodljivosti stanične membrane u mirovanju za K+, CI- ione, ionske asimetrije koncentracija K+ iona i CI- iona, rada aktivni transportni sistemi (Na + / K + -ATPaza), koji stvaraju i održavaju ionsku asimetriju.
Akcioni potencijal nervnih vlakana, nervni impuls
Akcioni potencijal - Ovo je kratkotrajna fluktuacija razlike potencijala membrane ekscitabilne ćelije, praćena promjenom njenog znaka naboja.
Akcioni potencijal je glavni specifični znak ekscitacije. Njegova registracija ukazuje da su ćelija ili njene strukture na udar reagovale ekscitacijom. Međutim, kao što je već napomenuto, PD u nekim ćelijama može nastati spontano (spontano). Takve ćelije se nalaze u pejsmejkerima srca, zidovima krvnih sudova, nervni sistem. AP se koristi kao nosilac informacija, prenoseći ih u obliku električnih signala (električna signalizacija) duž aferentnih i eferentnih nervnih vlakana, provodnog sistema srca, a takođe i za pokretanje kontrakcije mišićnih ćelija.
Razmotrimo razloge i mehanizam nastanka AP u aferentnim nervnim vlaknima koja formiraju primarne senzorne receptore. Neposredni uzrok nastanka (generacije) AP u njima je receptorski potencijal.
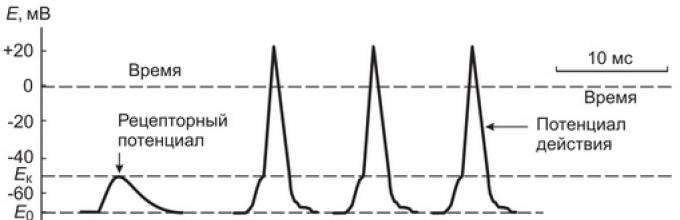
Ako izmjerimo razliku potencijala na membrani Ranvierovog čvora najbližeg nervnom završetku, tada u intervalima između udara u kapsulu Pacinijevog tjelešca ona ostaje nepromijenjena (70 mV), a tijekom izlaganja depolarizira se gotovo istovremeno s depolarizacijom receptorska membrana nervnog završetka.
S povećanjem sile pritiska na Pacinijevo tijelo, što uzrokuje povećanje potencijala receptora na 10 mV, obično se bilježi brza oscilacija membranskog potencijala na najbližem Ranvierovom čvoru, praćena punjenjem membrane - akcioni potencijal (AP), ili nervni impuls (slika 2). Ako se sila pritiska na tijelo još više poveća, povećava se amplituda receptorskog potencijala i u nervnom završetku se stvara niz akcionih potencijala određene frekvencije.

Rice. 2. Šematski prikaz mehanizma za pretvaranje receptorskog potencijala u akcioni potencijal (nervni impuls) i propagiranje impulsa duž nervnog vlakna
Suština mehanizma stvaranja AP je da receptorski potencijal uzrokuje pojavu lokalnih kružnih struja između depolarizirane receptorske membrane nemijeliniziranog dijela nervnog završetka i membrane prvog Ranvierovog čvora. Ove struje, koje nose Na+, K+, CI- i drugi mineralni joni, „teku“ ne samo duž, već i preko membrane nervnog vlakna u području Ranvierovog čvora. U membrani Ranvierovih čvorova, za razliku od receptorske membrane samog nervnog završetka, postoji velika gustoća ionskih naponsko-zavisnih natrijum i kalijum kanala.
Kada se dostigne vrijednost depolarizacije od oko 10 mV na Ranvier interceptornoj membrani, otvaraju se brzi naponski zavisni natrijumski kanali i kroz njih tok Na+ jona juri u aksoplazmu duž elektrohemijskog gradijenta. Izaziva brzu depolarizaciju i ponovno punjenje membrane na Ranvierovom čvoru. Međutim, istovremeno sa otvaranjem brzih naponsko-zavisnih natrijumskih kanala u membrani Ranvierovog čvora, otvaraju se spori naponsko-zavisni kalijumovi kanali i K+ joni počinju da napuštaju aksoilazme, čiji izlaz zaostaje za ulaskom Na+ jona. Tako ioni Na+ koji ulaze u aksoplazmu velikom brzinom brzo depolariziraju i za kratko vrijeme ponovo pune membranu (0,3-0,5 ms), a ioni K+ koji izlaze obnavljaju prvobitnu distribuciju naelektrisanja na membrani (repolariziraju membranu). Kao rezultat toga, tokom mehaničkog udara na Pacinijevo tjelešce sa silom jednakom ili većom od praga, uočava se kratkotrajna potencijalna oscilacija na membrani najbližeg Ranvierovog čvora u obliku brze depolarizacije i repolarizacije membrane. , tj. Generiše se PD (nervni impuls).
Budući da je direktni uzrok stvaranja AP potencijal receptora, u ovom slučaju se naziva i generatorski potencijal. Broj generiranih nervnih impulsa jednake amplitude i trajanja u jedinici vremena proporcionalan je amplitudi potencijala receptora, a samim tim i sili pritiska na receptor. Proces pretvaranja informacija o sili utjecaja sadržanih u amplitudi receptorskog potencijala u niz diskretnih nervnih impulsa naziva se diskretno informacijsko kodiranje.
U detaljima jonski mehanizmi i vremenska dinamika procesa generisanja AP proučavana je u eksperimentalnim uslovima pod veštačkim uticajem na nervno vlakno strujni udar različite jačine i trajanja.
Priroda akcionog potencijala nervnih vlakana (nervni impuls)
Membrana nervnog vlakna na mjestu lokalizacije stimulirajuće elektrode reagira na utjecaj vrlo slabe struje koja još nije dostigla graničnu vrijednost. Ovaj odgovor se naziva lokalnim, a oscilacija razlike potencijala na membrani naziva se lokalnim potencijalom.
Lokalni odgovor na membrani ekscitabilne ćelije može prethoditi pojavi akcionog potencijala ili se javiti kao samostalan proces. Predstavlja kratkotrajnu fluktuaciju (depolarizacija i repolarizacija) potencijala mirovanja, koja nije praćena punjenjem membrane. Depolarizacija membrane tokom razvoja lokalnog potencijala nastaje zbog naprednog ulaska Na+ jona u aksoplazmu, a repolarizacija zbog odloženog izlaska K+ jona iz aksoplazme.
Ako je membrana izložena električnoj struji sve jačine, tada pri ovoj vrijednosti, koja se naziva pragom, depolarizacija membrane može dostići kritični nivo - Ec, na kojem dolazi do otvaranja brzih naponsko ovisnih natrijevih kanala. Kao rezultat, kroz njih dolazi do lavinskog povećanja protoka Na+ jona u ćeliju. Inducirani proces depolarizacije postaje samoubrzavajući, a lokalni potencijal se razvija u akcioni potencijal.
To je već pomenuto karakteristična karakteristika PD je kratkotrajna inverzija (promjena) znaka naboja na membrani. Napolju postaje negativno naelektrisan za kratko vreme (0,3-2 ms), a iznutra pozitivno. Veličina inverzije može biti do 30 mV, a veličina cjelokupnog akcionog potencijala je 60-130 mV (slika 3).
Table. Uporedne karakteristike lokalni potencijal i akcioni potencijal
|
Karakteristično |
Lokalni potencijal |
Akcioni potencijal |
|
Provodljivost |
Lokalno se širi, 1-2 mm sa slabljenjem (dekrementom) |
Širi se bez slabljenja na velike udaljenosti duž cijele dužine nervnog vlakna |
|
zakon "sile" |
Submits |
Ne sluša |
|
Zakon na sve ili ništa |
Ne sluša |
Submits |
|
Fenomen sumiranja |
Sažeto, povećava se uz ponovljene česte stimulacije ispod praga |
Ne zbraja se |
|
Vrijednost amplitude |
||
|
Ekscitabilnost |
Povećava |
Smanjuje se do potpune nerazdražljivosti (refraktornosti) |
|
Magnituda stimulusa |
Subliminal |
Prag i superprag |
Akcijski potencijal, ovisno o prirodi promjene naboja na unutrašnjoj površini membrane, dijeli se na faze depolarizacije, repolarizacije i hiperpolarizacije membrane. Depolarizacija nazvati cijeli uzlazni dio PD, u kojem su identificirana područja koja odgovaraju lokalnom potencijalu (od nivoa E 0 prije E k), brza depolarizacija (sa nivoa E k do nivoa 0 mV), inverzije znak naelektrisanja (od 0 mV do vršne vrednosti ili početka repolarizacije). Repolarizacija naziva se silazni dio AP, koji odražava proces obnove izvorne polarizacije membrane. U početku se repolarizacija dešava brzo, ali kako se približava nivou E 0, brzina može usporiti i ova sekcija se zove trag negativnosti(ili trag negativnog potencijala). U nekim ćelijama, nakon repolarizacije, razvija se hiperpolarizacija (povećanje polarizacije membrane). Zovu je pratiti pozitivan potencijal.
Početni dio AP velike amplitude koji brzo teče također se naziva vrhunac, ili spike. Uključuje faze depolarizacije i brze repolarizacije.
U mehanizmu razvoja PD najvažnija uloga pripada naponsko zavisnim jonskim kanalima i neistovremenom povećanju permeabilnosti ćelijske membrane za jone Na+ i K+. Dakle, kada električna struja djeluje na ćeliju, ona uzrokuje depolarizaciju membrane i, kada se naboj membrane smanji na kritični nivo (Ec), otvaraju se naponski natrijumski kanali. Kao što je već spomenuto, ovi kanali su formirani od proteinskih molekula ugrađenih u membranu, unutar kojih se nalaze pora i dva mehanizma vrata. Jedan od mehanizama kapije, aktivacija, osigurava (uz učešće segmenta 4) otvaranje (aktivaciju) kanala tokom depolarizacije membrane, a drugi (uz učešće intracelularne petlje između 3. i 4. domene) osigurava njegovu inaktivaciju. , koji se razvija kada se membrana napuni (slika 4). Budući da oba ova mehanizma brzo mijenjaju položaj kapije kanala, naponski natrijumski kanali su brzi jonski kanali. Ova okolnost je od odlučujućeg značaja za nastanak PD u ekscitabilna tkiva i za njegovo provođenje duž membrana nervnih i mišićnih vlakana.

Rice. 3. Akcijski potencijal, njegove faze i jonske struje (a, o). Opis u tekstu

Rice. 4. Položaj kapije i stanje aktivnosti voltaž-zavisnih natrijumovih i kalijumovih kanala na različitim nivoima polarizacije membrane
Da bi naponski natrijumski kanal omogućio jone Na+ u ćeliju, mora se otvoriti samo aktivaciona kapija, pošto je inaktivaciona kapija otvorena u uslovima mirovanja. Ovo se dešava kada depolarizacija membrane dostigne nivo E k(sl. 3, 4).
Otvaranje aktivacijske kapije natrijumskih kanala dovodi do lavinskog ulaska natrijuma u ćeliju, vođenog silama njenog elektrohemijskog gradijenta. Budući da ioni Na+ nose pozitivan naboj, neutraliziraju višak negativnih naboja na unutrašnjoj površini membrane, smanjuju potencijalnu razliku kroz membranu i depolariziraju je. Ubrzo, ioni Na+ daju višak pozitivnih naboja na unutrašnju površinu membrane, što je praćeno inverzijom (promjenom) znaka naboja iz negativnog u pozitivan.
Međutim, natrijumski kanali ostaju otvoreni samo oko 0,5 ms i nakon tog vremenskog perioda od trenutka početka
AP zatvara kapiju inaktivacije, natrijumski kanali postaju inaktivirani i nepropusni za jone Na+, čiji je ulazak u ćeliju oštro ograničen.
Od trenutka depolarizacije membrane do nivoa E k aktivacija kalijumovih kanala i otvaranje njihovih kapija za jone K+ se takođe primećuju. K+ joni, pod utjecajem sila gradijenta koncentracije, napuštaju ćeliju, uklanjajući iz nje pozitivne naboje. Međutim, mehanizam kapije kalijumovih kanala sporo funkcioniše i brzina izlaska pozitivnih naelektrisanja sa K+ jonima iz ćelije ka spolja zaostaje za ulaskom Na+ jona. Protok K+ jona, uklanjajući višak pozitivnih naboja iz ćelije, uzrokuje obnavljanje prvobitne raspodjele naboja na membrani ili njenu repolarizaciju, a na unutrašnjoj strani, trenutak nakon ponovnog punjenja, vraća se negativni naboj.
Pojava AP na ekscitabilnim membranama i naknadna obnova izvornog potencijala mirovanja na membrani moguća je jer je dinamika ulaska i izlaska pozitivnih naboja Na+ i K+ jona u ćeliju i izlaska iz ćelije različita. Ulaz Na+ jona je ispred izlaza K+ jona. Kada bi ovi procesi bili u ravnoteži, tada se razlika potencijala preko membrane ne bi promijenila. Razvoj sposobnosti pobuđivanja i generiranja AP-a od strane ekscitabilnih mišićnih i nervnih stanica bio je posljedica formiranja dva tipa ionskih kanala različite brzine u njihovoj membrani - brzog natrijuma i sporog kalija.
Za generiranje jedne AP potrebna je relativno mala količina energije da uđe u ćeliju. veliki broj jona Na+, koji ne remeti njegovu distribuciju izvan i unutar ćelije. Ako se stvori veliki broj AP, distribucija jona na obje strane ćelijske membrane može biti poremećena. Međutim, u normalnim uslovima ovo se sprečava radom Na+, K+ pumpe.
U prirodnim uslovima, u neuronima centralnog nervnog sistema, akcioni potencijal prvenstveno nastaje u predelu brežuljka aksona, u aferentnim neuronima - u Ranvierovom čvoru nervnog završetka najbližeg senzornom receptoru, tj. u onim dijelovima membrane gdje postoje brzi selektivni naponsko-zavisni natrijumski kanali i spori kalijumovi kanali. U drugim tipovima ćelija (na primjer, pejsmejker, glatki miociti), ne samo natrijum i kalijum kanali, već i kalcijum kanali igraju ulogu u nastanku AP.
Mehanizmi percepcije i transformacije signala u akcione potencijale u sekundarnim senzornim receptorima razlikuju se od mehanizama o kojima se raspravlja za primarne senzorne receptore. U ovim receptorima percepciju signala provode specijalizovane neurosenzorne (fotoreceptorne, olfaktorne) ili senzoroepitelne (ukusne, slušne, vestibularne) ćelije. Svaka od ovih osjetljivih ćelija ima svoj poseban mehanizam za percepciju signala. Međutim, u svim ćelijama energija opaženog signala (stimulusa) se pretvara u oscilaciju razlike potencijala plazma membrane, tj. u potencijal receptora.
Dakle, ključna tačka u mehanizmima pomoću kojih senzorne ćelije pretvaraju percipirane signale u potencijal receptora je promjena permeabilnosti jonskih kanala kao odgovor na stimulus. Otvaranje Na +, Ca 2+, K + -jonskih kanala tokom percepcije i transformacije signala postiže se u ovim ćelijama uz učešće G-proteina, sekundarnih intracelularnih glasnika, vezivanja za ligande i fosforilacije jonskih kanala. Po pravilu, potencijal receptora koji nastaje u senzornim ćelijama izaziva oslobađanje sinaptički rascjep neurotransmiter koji osigurava prijenos signala na postsinaptičku membranu aferentnog nervnog završetka i stvaranje nervnog impulsa na njegovoj membrani. Ovi procesi su detaljno opisani u poglavlju o senzornim sistemima.
Akcijski potencijal se može okarakterizirati amplitudom i trajanjem, koji za isto nervno vlakno ostaju isti dok se djelovanje širi duž vlakna. Stoga se akcijski potencijal naziva diskretnim potencijalom.
Postoji određena veza između prirode uticaja na senzorne receptore i broja AP koji nastaju u aferentnom nervnom vlaknu kao odgovor na udar. Ona leži u činjenici da nakon velike jačine ili trajanja izloženosti, a veći broj nervnih impulsa, tj. kako se efekat povećava, impulsi veće frekvencije će se slati od receptora do nervnog sistema. Procesi pretvaranja informacija o prirodi efekta u frekvenciju i druge parametre nervnih impulsa koji se prenose u centralni nervni sistem nazivaju se diskretno informaciono kodiranje.
Za objašnjenje porijeklo potencijala mirovanja su predloženi razne teorije. Počeci modernog razumijevanja ovog problema leže u radu V. Yu. Chagovetsa, koji je 1896. godine, kao student medicine, izrazio ideju o jonskoj prirodi bioelektričnih procesa i pokušao primijeniti Arrheniusovu teoriju o elektrolitička disocijacija kako bi se objasnilo porijeklo ovih potencijala. Nakon toga, 1902. godine, Y. Bernstein je razvio teoriju membranskih jona, koju su modificirali i eksperimentalno potkrijepili A. Hodgkin i A. Huxley (1952), a sada je široko prihvaćena. Prema ovoj teoriji, bioelektrični potencijali su uzrokovani nejednakom koncentracijom iona K, Na i Cl unutar i izvan ćelije i različitom propusnošću površinske membrane za njih.
Protoplazma nervnih i mišićnih ćelija sadrži 30-50 puta više jona kalijuma, 8-10 puta manje jona natrijuma i 50 puta manje jona hlora nego ekstracelularna tečnost.
Prepreka brzom izjednačavanju ove razlike koncentracije je najtanja (oko 100 Å) plazma membrana koja pokriva žive ćelije.
|
Ideje o strukturi ove membrane zasnivaju se na podacima dobijenim elektronskom mikroskopijom, optičkom mikroskopijom, rendgenskom difrakcijom i hemijskom analizom. Pretpostavlja se da se membrana sastoji od dvostrukog sloja molekula fosfolipida, prekrivenih iznutra slojem proteinskih molekula, a spolja slojem složenih molekula ugljikohidrata - mukopolisaharida. Struktura troslojne membrane je shematski prikazana u pirinač. 116. Rice. 116. Šema molekularne strukture membrane. Prikazan je bimolekularni lipidni sloj Z (krugovi označavaju polarne grupe fosfolipida) i dva nelipidna monosloja: vanjski je mukopolisaharid - X, unutrašnji je protein - Y (prema Robertsonu). |
Stanična membrana sadrži vrlo tanke tubule - "pore" promjera nekoliko angstroma. Kroz ove tubule molekule vode i drugih supstanci, kao i joni čiji prečnik odgovara veličini pora, ulaze u ćeliju i izlaze iz nje.
On strukturni elementi lični ioni su fiksirani u membrani, što zidovima njenih pora daje poseban naboj i na taj način otežava ili olakšava prolazak jona kroz njih. Stoga se pretpostavlja da je prisustvo disociranih fosfatnih i karboksilnih grupa u membrani razlog što je membrana nervnih vlakana mnogo manje propusna za anione nego za katione.
Propustljivost membrane za različite katjone također nije ista, te se prirodno mijenja u različitim funkcionalnim stanjima tkiva. U mirovanju, membrana nervnih vlakana je otprilike 20-100 puta propusnija za K ione nego za Na ione, a kada je pobuđena, propusnost natrija počinje značajno da premašuje propusnost kalijuma membrane.
Da bismo razumjeli mehanizam nastanka membranskog potencijala mirovanja sa stanovišta Bernstein-Hodgkinove teorije, razmotrimo model eksperimenta. Prva polovina plovila ( pirinač. 117), odvojen umjetnom polupropusnom membranom, čije pore slobodno propuštaju pozitivno nabijene K ione i ne propuštaju negativno nabijene jone SO"4, ispunjen je koncentriranom otopinom K2SO4, a lijevo polovina je takođe ispunjena rastvorom K2SO4, ali niže koncentracije.
 |
Zbog postojanja koncentracijskog gradijenta, K ioni će početi difundirati kroz membranu pretežno od desne polovice posude (gdje je njihova koncentracija C1) na lijevu (sa koncentracijom C2). Shodno tome, negativno nabijeni SO"4 anioni, za koje je membrana nepropusna, koncentriraće se u desnoj polovini posude blizu površine membrane. Sa svojim negativnim nabojem, elektrostatički će zadržati K ione na površini membrane s lijeve strane. Kao rezultat, membrana je polarizirana: između njene dvije površine nastaje razlika potencijala. Rice. 117. Pojava razlike potencijala na umjetnoj membrani koja razdvaja otopine K2SO4 različitih koncentracija (C1 i C2). Membrana je selektivno propusna za K katjone (mali krugovi) i ne propušta anione SO4 (veliki krugovi) 1 i 2 - elektrode uronjene u rastvor 3 - električni mjerni uređaj. |
Ako sada spustimo elektrode u desnu i lijevu polovinu posude, električni mjerni uređaj će detektirati postojanje razlike potencijala, dok otopina s nižom koncentracijom iona K2SO4, u koju dolazi pretežno do difuzije pozitivno nabijenih iona K, će otkriti postojanje razlike u potencijalu. dobija pozitivan naboj u odnosu na rastvor sa višom koncentracijom K2SO4.
Razlika potencijala (E) u razmatranom slučaju može se izračunati pomoću Nernstove formule:

Mnogo je razloga da se vjeruje da se slični odnosi javljaju i u živim nervnim vlaknima, budući da je koncentracija K iona u protoplazmi više od 30 puta veća od koncentracije ovih jona u vanjskoj otopini, a organskih (bjelančevina i sl.) aniona protoplazma kroz membranu praktički ne prodire.
U stanju fiziološkog mirovanja, difuzija pozitivno nabijenih K iona iz protoplazme u vanjsku tekućinu daje vanjskoj površini membrane pozitivan naboj, a unutrašnjoj negativno.
Važan argument u prilog ispravnosti ove ideje bila je činjenica da se razlika potencijala izračunata pomoću Nernstove formule između vanjske i unutrašnje strane membrane mišićnog vlakna (oko 90 mV) pokazala bliskom onoj izmjerenoj u eksperimentima pomoću intracelularna mikroelektroda.
Također je utvrđeno da povećanje koncentracije K iona u vanjskom okruženju stanice, a samim tim i smanjenje razlike u koncentraciji ovih jona na obje strane membrane, dovodi do pada potencijala mirovanja, a u određenom rasponu koncentracija ovi pomaci kvantitativno se dobro poklapaju sa onima izračunatim pomoću Nernstove formule.
Međutim, najvažniji, direktni dokaz o ispravnosti ovih ideja dobili su A. Hodgkin i njegove kolege (1962) u eksperimentima sa zamjenom protoplazme u džinovskim nervnim vlaknima mekušaca lignje slanim otopinama. Protoplazma je pažljivo istisnuta iz vlakna prečnika oko 1 ml, a srušena ljuska je napunjena veštačkim fiziološkim rastvorom.
U slučaju kada je koncentracija kalijevih jona u ovoj otopini bila bliska intracelularnoj, utvrđena je razlika potencijala između unutrašnje i vanjske strane membrane, približno jednaka potencijalu mirovanja normalnog vlakna (50-80 mV). Smanjenje koncentracije K iona u unutrašnjem rastvoru dovelo je do prirodnog smanjenja ili čak distorzije potencijala mirovanja.
Takvi eksperimenti su pokazali da je gradijent koncentracije K iona zaista glavni faktor koji određuje vrijednost potencijala mirovanja nervnog vlakna.
Uz K jone, u nastanku potencijala mirovanja učestvuju i joni Na, koji difunduju u protoplazmu iz vanćelijske tečnosti, gde je njihova koncentracija visoka. Ovu difuziju uvelike ometa niska permeabilnost natrijum membrane u mirovanju. Međutim, difundirajući kroz membranu u protoplazmu, ioni Na ovdje prenose svoje pozitivne naboje, što donekle smanjuje vrijednost potencijala mirovanja stvorenog difuzijom K iona iz ćelije. Ovo objašnjava činjenicu da potencijal mirovanja većine nervnih ćelija i vlakana nije 90 mV, kao što bi se očekivalo da taj potencijal stvaraju samo K ioni, već 60-70 mV.
Dakle, vrijednost potencijala mirovanja nervnih vlakana i ćelija određena je omjerom broja pozitivno nabijenih K iona koji difundiraju u jedinici vremena iz ćelije prema van i pozitivno nabijenih Na iona koji difundiraju kroz membranu u suprotnom smjeru. Što je ovaj omjer veći, veći je i potencijal mirovanja, i obrnuto.
tekstualna_polja
tekstualna_polja
arrow_upward
Potencijal membrane mirovanja (MPP) ili potencijal odmora (PP) je razlika potencijala ćelije u mirovanju između unutrašnje i vanjske strane membrane. Unutrašnjost ćelijske membrane je negativno nabijena u odnosu na vanjsku stranu. Uzimajući potencijal vanjskog rješenja kao nula, MPP se piše sa predznakom minus. Magnituda MPP zavisi od vrste tkiva i varira od -9 do -100 mV. Dakle, u stanju mirovanja ćelijska membrana polarizovan. Smanjenje MPP vrijednosti se naziva depolarizacija, povećati - hiperpolarizacija, vraćanje originalne vrijednosti MPP- repolarizacija membrane.
Osnovne odredbe membranske teorije nastanka MPP svesti na sledeće. U stanju mirovanja, ćelijska membrana je visoko propusna za jone K+ (u nekim ćelijama i za SG), manje propusna za Na+ i praktično nepropusna za intracelularne proteine i druge organske jone. K+ joni difundiraju iz ćelije duž gradijenta koncentracije, a nepenetrirajući anioni ostaju u citoplazmi, osiguravajući pojavu razlike potencijala preko membrane.
Rezultirajuća razlika potencijala sprječava izlazak K+ iz ćelije i na određenoj vrijednosti dolazi do ravnoteže između izlaza K+ duž gradijenta koncentracije i ulaska ovih kationa duž rezultirajućeg električnog gradijenta. Membranski potencijal pri kojem se postiže ova ravnoteža naziva se ravnotežnu potencijugrimiz Njegova vrijednost se može izračunati iz Nernstove jednačine:
Gdje E k- ravnotežni potencijal za TO + ; R- gasna konstanta; T- apsolutna temperatura; F - Faradejev broj; P- valencija K + (+1), [Kn + ] - [K + gostionica ] - vanjske i unutrašnje koncentracije K + -
Ako idete iz prirodni logaritmi da decimalni i zamenimo numeričke vrijednosti konstanti u jednadžbu, tada će jednadžba poprimiti oblik: 
U spinalnim neuronima (Tabela 1.1) E k = -90 mV. Vrijednost MPP mjerena mikroelektrodama je primjetno niža - 70 mV.
Tabela 1.1. Koncentracije nekih jona unutar i izvan spinalnih motornih neurona sisara
| I on |
Koncentracija |
(mmol/l H 2 O) |
potencijal težine (mv) |
|
unutar ćelije |
izvan kaveza |
||
| Na+ | 15,0 | 150,0 | |
| K+ | 150,0 | 5,5 | |
| Sl - | 125,0 | ||
|
Potencijal membrane mirovanja = -70 mV |
|||
Ako je potencijal stanične membrane kalijev u prirodi, tada bi, u skladu s Nernst-ovom jednadžbom, njegova vrijednost trebala opadati linearno sa smanjenjem gradijenta koncentracije ovih iona, na primjer, s povećanjem koncentracije K + u ekstracelularnom tečnost. kako god linearna zavisnost Veličina RMP (potencijala membrane mirovanja) na gradijentu koncentracije K+ postoji samo kada je koncentracija K+ u ekstracelularnoj tekućini iznad 20 mM. Pri nižim koncentracijama K+ izvan ćelije, kriva zavisnosti E m od logaritma odnosa koncentracija kalijuma izvan i unutar ćelije razlikuje se od teorijske. Utvrđena odstupanja u eksperimentalnoj zavisnosti vrijednosti MPP i gradijenta koncentracije K+ teoretski izračunate pomoću Nernstove jednadžbe mogu se objasniti pretpostavkom da je MPP ekscitabilnih ćelija određen ne samo kalijem, već i potencijalima ravnoteže natrijuma i hlora. . Argumentirajući slično kao i prethodni, možemo napisati:
Vrijednosti potencijala ravnoteže natrijuma i klora za spinalne neurone (tabela 1.1) jednake su +60 i -70 mV, respektivno. Vrijednost E Cl je jednaka MPP vrijednosti. Ovo ukazuje na pasivnu distribuciju jona hlora preko membrane u skladu sa hemijskim i električnim gradijentima. Za natrijumove jone, hemijski i električni gradijenti su usmereni u ćeliju.
Doprinos svakog od ravnotežnih potencijala MPP vrijednosti je određen omjerom između permeabilnosti ćelijske membrane za svaki od ovih jona. Potencijal membrane se izračunava pomoću Goldmannove jednadžbe:

E m- membranski potencijal; R- gasna konstanta; T- apsolutna temperatura; F- Faradejev broj; RK, P Na I RCl- konstante propusnosti membrane za K + Na + i Cl, respektivno; [TO+ n ], [ K + vn, [ N / A+ n [ N / A + vn], [Cl - n] i [Cl - ekst] - koncentracije K +, Na + i Cl izvan (n) i unutar (u) ćelije.
Zamjenom koncentracija jona i vrijednosti MPP dobijene u eksperimentalnim istraživanjima u ovu jednačinu, može se pokazati da za džinovski akson lignje treba postojati sljedeći omjer konstanti permeabilnosti P prema: P Na: P C1 = I: 0,04: 0,45. Očigledno, budući da je membrana propusna za jone natrijuma (P N a =/ 0) i ravnotežni potencijal za ove ione ima predznak plus, tada će ulazak ovih potonjih u ćeliju duž hemijskih i električnih gradijenata smanjiti elektronegativnost citoplazme, tj. povećati RMP (potencijal membrane mirovanja).
Kada se koncentracija kalijevih jona u vanjskom rastvoru poveća iznad 15 mM, MPP raste i odnos konstanti permeabilnosti se mijenja prema značajnijem višku Pk u odnosu na P Na i P C1. P k: P Na: P C1 = 1: 0,025: 0,4. U takvim uslovima MPP je gotovo isključivo određen gradijentom kalijevih jona, pa eksperimentalna i teorijska ovisnost vrijednosti MPP o logaritmu odnosa koncentracija kalija izvan i unutar ćelije počinju da se podudaraju.
Dakle, prisustvo stacionarne potencijalne razlike između citoplazme i vanjskog okruženja u stanici koja miruje posljedica je postojećih koncentracijskih gradijenta za K+, Na+ i Cl i različite permeabilnosti membrane za ove ione. Glavnu ulogu u stvaranju MPP igra difuzija kalijevih jona iz ćelije u spoljašnji rastvor. Uz to, MPP je određen i ravnotežnim potencijalima natrijuma i hlora, a doprinos svakog od njih određen je odnosima između permeabiliteta ćelijske plazma membrane za ove jone.
Svi gore navedeni faktori čine tzv jonska komponenta RMP (potencijal membrane mirovanja). Budući da potencijali ravnoteže ni kalijuma ni natrijuma nisu jednaki MPP. ćelija mora apsorbovati Na+ i izgubiti K+. Konstantnost koncentracija ovih jona u ćeliji održava se zahvaljujući radu Na + K + -ATPaze.
Međutim, uloga ove jonske pumpe nije ograničena na održavanje gradijenta natrijuma i kalija. Poznato je da je natrijum pumpa elektrogena i kada funkcioniše, neto protok pozitivnih naelektrisanja nastaje iz ćelije u ekstracelularnu tečnost, izazivajući povećanje elektronegativnosti citoplazme u odnosu na okolinu. Elektrogenost natrijeve pumpe otkrivena je u eksperimentima na gigantskim neuronima mekušaca. Elektroforetsko ubrizgavanje Na+ jona u tijelo jednog neurona izazvalo je hiperpolarizaciju membrane, pri čemu je MPP bio značajno niži od potencijala ravnoteže kalija. Ova hiperpolarizacija je oslabljena smanjenjem temperature rastvora u kojoj se ćelija nalazila i potisnuta je specifičnim inhibitorom Na +, K + -ATPaze ouabainom.
Iz navedenog proizilazi da se MPP može podijeliti na dvije komponente - "jonski" I "metabolički". Prva komponenta ovisi o koncentracijskim gradijentima iona i propusnosti membrane za njih. Drugi, "metabolički", nastaje zbog aktivnog transporta natrijuma i kalija i ima dvostruki učinak na MPP. S jedne strane, natrijeva pumpa održava gradijente koncentracije između citoplazme i vanjskog okruženja. S druge strane, budući da je elektrogena, natrijum pumpa ima direktan uticaj na MPP. Njegov doprinos MPP vrijednosti ovisi o gustoći struje "pumpanja" (struja po jedinici površine površine ćelijske membrane) i otporu membrane.
Akcioni potencijal membrane
tekstualna_polja
tekstualna_polja
arrow_upward
Ako se iritacija primeni na nerv ili mišić iznad praga ekscitacije, tada će se MPP nerva ili mišića brzo smanjiti i za kratko vreme (milisekunde) membrana će se ponovo napuniti: njena unutrašnja strana će postati pozitivno naelektrisana u odnosu na spoljašnji. Ovo kratkoročna promjena MPP-a koja se javlja tokom pobuđivanja ćelije, koja na ekranu osciloskopa ima oblik jednog vrha, naziva se membranski akcioni potencijal (MPD).
IVD u nervnom i mišićnom tkivu nastaje kada dođe do smanjenja apsolutna vrijednost MPP (depolarizacija membrane) do određene kritične vrijednosti tzv prag generacije MTD. U gigantskim nervnim vlaknima lignje, IVD je 60 mV. Kada je membrana depolarizovana na -45 mV (prag generisanja IVD), dolazi do IVD (slika 1.15).
Rice. 1.15 Akcijski potencijal nervnog vlakna (A) i promjena provodljivosti membrane za jone natrijuma i kalija (B).Prilikom pojave IVD u aksonu lignje otpor membrane se smanjuje 25 puta, sa 1000 na 40 Ohm.cm 2, dok se električna kapacitivnost ne mijenja. Ovo smanjenje otpora membrane je posljedica povećanja ionske permeabilnosti membrane nakon ekscitacije.
U svojoj amplitudi (100-120 mV), MAP (Potencijal membranskog djelovanja) je 20-50 mV veći od MPP (Potencijal mirovanja membrane). Drugim riječima, unutrašnja strana membrane za kratko vrijeme postaje pozitivno nabijena u odnosu na vanjsku - „preskočiti“ ili preokret naplate.
Iz Goldmanove jednadžbe proizilazi da samo povećanje propusnosti membrane za jone natrija može dovesti do ovakvih promjena u membranskom potencijalu. Vrijednost E k je uvijek manja od vrijednosti MPP, tako da će povećanje propusnosti membrane za K + povećati apsolutnu vrijednost MPP. Potencijal ravnoteže natrijuma ima predznak plus, tako da naglo povećanje permeabilnosti membrane za ove katjone dovodi do ponovnog punjenja membrane.
Tokom IVD, permeabilnost membrane za jone natrijuma se povećava. Proračuni su pokazali da ako je u mirovanju odnos konstanti membranske permeabilnosti za K+, Na+ i SG 1:0,04:0,45, onda kod MTD - P prema: P Na: P = 1:20:0,45. Posljedično, u stanju ekscitacije, membrana nervnog vlakna ne gubi jednostavno svoju selektivnu ionsku permeabilnost, već, naprotiv, od selektivne propusnosti za jone kalija u mirovanju, postaje selektivno propusna za jone natrija. Povećanje permeabilnosti natrijuma membrane povezano je s otvaranjem voltaž-zavisnih natrijumskih kanala.
Mehanizam koji osigurava otvaranje i zatvaranje jonskih kanala naziva se kapija kanala. Uobičajeno je razlikovati aktivacija(m) i inaktivacija(h) kapija. Jonski kanal može biti u tri glavna stanja: zatvoren (m-kapija zatvorena; h-kapija otvorena), otvorena (m- i h-kapija otvorena) i neaktivirana (m-kapija otvorena, h-kapija zatvorena) (slika 1.16) .
Rice. 1.16 Dijagram položaja aktivacijskih (m) i inaktivacionih (h) kapija natrijumskih kanala, koji odgovaraju zatvorenim (mirovanje, A), otvorenim (aktivacija, B) i inaktiviranim (C) stanjima.
Depolarizacija membrane, uzrokovana iritirajućim stimulusom, na primjer, električnom strujom, otvara m-kapija natrijevih kanala (prijelaz iz stanja A u B) i osigurava pojavu unutrašnjeg protoka pozitivnih naboja - natrijevih jona. To dovodi do dalje depolarizacije membrane, što zauzvrat povećava broj otvorenih natrijumskih kanala i, samim tim, povećava permeabilnost membrane na natriju. Dolazi do "regenerativne" depolarizacije membrane, kao rezultat čega potencijal unutrašnje strane membrane teži da dostigne potencijal ravnoteže natrijuma.
Razlog za prestanak rasta IVD (membranski akcijski potencijal) i repolarizaciju ćelijske membrane je:
A) Povećana depolarizacija membrane, tj. kada E m -» E Na, što rezultira smanjenjem elektrohemijskog gradijenta za natrijumove jone, jednako E m -> E Na. Drugim riječima, sila koja „gura“ natrijum u ćeliju se smanjuje;
b) Depolarizacija membrane dovodi do procesa inaktivacije natrijumskih kanala (zatvaranje h-gejta; stanje kanala B), što inhibira rast natrijum permeabilnosti membrane i dovodi do njenog smanjenja;
V) Depolarizacija membrane povećava njenu permeabilnost za jone kalija. Odlazeća kalijumova struja teži pomjeranju membranskog potencijala prema potencijalu ravnoteže kalija.
Smanjenje elektrohemijskog potencijala za jone natrijuma i inaktivacija natrijumovih kanala smanjuje veličinu dolazne natrijumove struje. U određenom trenutku, veličina dolazne natrijeve struje se upoređuje sa povećanom izlaznom strujom - rast IVD se zaustavlja. Kada ukupna izlazna struja premaši ulaznu, počinje repolarizacija membrane, koja također ima regenerativnu prirodu. Početak repolarizacije dovodi do zatvaranja aktivacijske kapije (m), što smanjuje natrijevu permeabilnost membrane, ubrzava repolarizaciju, a potonja povećava broj zatvorenih kanala itd.
Faza repolarizacije IVD u nekim ćelijama (na primjer, u kardiomiocitima i nekim ćelijama glatkih mišića) može se usporiti, formirajući plato AP uzrokovan kompleksnim promjenama vremena ulaznih i izlaznih struja kroz membranu. Kao posljedica IVD, može doći do hiperpolarizacije i/ili depolarizacije membrane. To su tzv potencijali u tragovima. Hiperpolarizacija tragova ima dvostruku prirodu: jonski I metaboličkiJa falsifikujem. Prvi je zbog činjenice da propusnost kalija u nervnom vlaknu membrane ostaje povišena neko vrijeme (desetine pa čak i stotine milisekundi) nakon generiranja IVD i pomjera potencijal membrane prema potencijalu ravnoteže kalija. Hiperpolarizacija u tragovima nakon ritmičke stimulacije ćelija povezana je prvenstveno sa aktivacijom elektrogene natrijumove pumpe, zbog akumulacije jona natrijuma u ćeliji.
Razlog za depolarizaciju koja se razvija nakon stvaranja MAP-a (Potencijal membranskog djelovanja) je nakupljanje kalijevih jona na vanjskoj površini membrane. Ovo posljednje, kao što slijedi iz Goldmanove jednačine, dovodi do povećanja RMP-a (potencijala membrane mirovanja).
Inaktivacija natrijumskih kanala povezana je sa važnim svojstvom nervnog vlakna tzvrefraktornost .
Tokom absolutnja refraktorni period nervno vlakno potpuno gubi sposobnost da bude uzbuđeno stimulusom bilo koje snage.
Relativno refraktornost, nakon apsolutne, karakteriše viši prag za nastanak MTD (membranski akcijski potencijal).
Ideja o membranskim procesima koji se javljaju tokom ekscitacije nervnog vlakna služi kao osnova za razumevanje i fenomen smještaj. Osnova akomodacije tkiva pri niskoj stopi povećanja iritirajuće struje je povećanje praga ekscitacije, što nadmašuje sporu depolarizaciju membrane. Povećanje praga ekscitacije gotovo je u potpunosti određeno inaktivacijom natrijumskih kanala. Uloga povećanja kalijum permeabilnosti membrane u razvoju akomodacije je da to dovodi do pada otpornosti membrane. Zbog smanjenja otpora, stopa depolarizacije membrane postaje još sporija. Brzina akomodacije je veća, što je veći broj natrijumskih kanala u potencijalu mirovanja u inaktiviranom stanju, to je veća stopa razvoja inaktivacije i veća je kalijumska permeabilnost membrane.
Provođenje ekscitacije
tekstualna_polja
tekstualna_polja
arrow_upward
Provođenje ekscitacije duž nervnog vlakna vrši se zahvaljujući lokalnim strujama između pobuđenih i mirnih dijelova membrane. Slijed događaja u ovom slučaju je predstavljen na sljedeći način.
Kada se tačkasti stimulans primeni na nervno vlakno u odgovarajućem delu membrane, javlja se akcioni potencijal. Ispostavlja se da je unutrašnja strana membrane u datoj tački pozitivno nabijena u odnosu na susjednu u mirovanju. Struja nastaje između tačaka vlakna koje imaju različite potencijale. (lokalna struja), usmjereno od pobuđenog (znak (+) na unutrašnjoj strani membrane) do ne-pobuđenog (znak (-) na unutrašnjoj strani membrane) do dijela vlakna. Ova struja ima depolarizujući efekat na membranu vlakana u zoni mirovanja, a kada se dostigne kritični nivo depolarizacije membrane u ovoj oblasti, javlja se MAP (Potencijal membranskog dejstva). Ovaj proces se sekvencijalno širi kroz sva područja nervnog vlakna.
U nekim ćelijama (neuroni, glatki mišići), IVD nije prirode natrijuma, već je uzrokovan ulaskom Ca 2+ jona kroz naponsko zavisne kalcijumove kanale. U kardiomiocitima, IVD generacija je povezana sa dolaznim natrijum i natrijum-kalcijum strujama.
U ovoj temi će se raspravljati o dva katjona - natrijum (Na) i kalij (K). Govoreći o anionima, uzmimo u obzir da se određeni broj aniona nalazi na vanjskoj i unutrašnjoj strani ćelijske membrane.
Oblik ćelije zavisi od toga kojem tkivu pripada. Na svoj način formućelije mogu biti:
· cilindrične i kubične (ćelije kože);
· u obliku diska (eritrociti);
· sferni (ovule);
· fusiform (glatki mišići);
· zvezdasti i piramidalni (nervne ćelije);
· nemaju trajni oblik - ameboid (leukociti).
Ćelija ima broj svojstva: hrani se, raste, razmnožava se, oporavlja, prilagođava se svom okruženju, razmjenjuje energiju i tvari sa okruženje, obavlja svoje inherentne funkcije (u zavisnosti od toga kojem tkivu ćelija pripada). Osim toga, ćelija ima razdražljivost.
Ekscitabilnost – Ovo je sposobnost ćelije da, kao odgovor na stimulaciju, pređe iz stanja mirovanja u stanje aktivnosti.
Iritacije mogu doći iz vanjskog okruženja ili nastati unutar ćelije. Podražaji koji izazivaju ekscitaciju mogu biti: električni, hemijski, mehanički, temperaturni i drugi podražaji.
Ćelija može biti u dva glavna stanja: u mirovanju i uzbuđenju. Mirovanje i ekscitacija ćelije se inače nazivaju - membranski potencijal mirovanja i membranski akcijski potencijal.
Kada ćelija ne doživi nikakvu iritaciju, ona je u stanju mirovanja. Odmor ćelije se takođe naziva membranski potencijal mirovanja (RMP).
U mirovanju, unutrašnja površina njegove membrane je negativno nabijena, a vanjska je pozitivno nabijena. To se objašnjava činjenicom da unutar ćelije ima mnogo aniona i malo kationa, dok iza ćelije, naprotiv, prevladavaju kationi.
Pošto ćelija sadrži električnih naboja, tada se električna energija koju stvaraju može izmjeriti. Potencijal membrane mirovanja je: - 70 mV (minus 70, pošto postoji negativan naboj unutar ćelije). Ova vrijednost je uslovna, jer svaka ćelija može imati vlastitu vrijednost potencijala mirovanja.
U mirovanju, pore na membrani su otvorene za jone kalija i zatvorene za jone natrijuma. To znači da joni kalija mogu lako ulaziti i izlaziti iz ćelije. Joni natrija ne mogu ući u ćeliju jer su im pore na membrani zatvorene. Ali mali broj jona natrijuma prodire u ćeliju jer ih privlači veliki broj anjona koji se nalaze na unutrašnjoj površini membrane (suprotna naelektrisanja se privlače). Ovo kretanje jona je pasivno , jer ne zahteva energiju.
Za normalno funkcionisanje ćelije, vrijednost njenog MPP-a mora ostati na konstantnom nivou. Međutim, kretanje jona natrijuma i kalija kroz membranu uzrokuje fluktuacije ove vrijednosti, što može dovesti do smanjenja ili povećanja vrijednosti: - 70 mV.
Da bi MPP vrijednost ostala relativno konstantna, tzv natrijum-kalijum pumpa . Njegova funkcija je da uklanja ione natrija iz ćelije i pumpa kalijeve ione u ćeliju. Određeni omjer jona natrijuma i kalija u ćeliji i iza ćelije stvara potrebnu vrijednost MPP. Rad pumpe je aktivni mehanizam , jer je potrebna energija.
Izvor energije u ćeliji je ATP. ATP daje energiju samo kada se razdvoji na jednostavniju kiselinu - ADP, uz obavezno učešće enzima ATPaze u reakciji:
ATP + enzim ATPaza ADP + energija
Sve žive ćelije imaju sposobnost da pod uticajem podražaja pređu iz stanja fiziološkog mirovanja u stanje aktivnosti ili ekscitacije.
Uzbuđenje je kompleks aktivnih električnih, hemijskih i funkcionalnih promena u ekscitabilnim tkivima (nervnim, mišićnim ili žlezdanim), kojima tkivo reaguje na spoljašnje uticaje. Važnu ulogu u ekscitaciji imaju električni procesi koji osiguravaju provođenje ekscitacije duž nervnih vlakana i dovode tkiva u aktivno (radno) stanje.
Potencijal membrane
Žive ćelije imaju važno svojstvo: unutrašnja površina ćelije je uvek negativno naelektrisana u odnosu na njenu vanjsku stranu. Između spoljašnje površine ćelije, naelektrisane elektropozitivno u odnosu na protoplazmu, i unutrašnje strane ćelijske membrane postoji razlika potencijala koja se kreće od 60-70 mV. Prema P. G. Kostyuku (2001.), nervne ćelije ova razlika se kreće od 30 do 70 mV. Razlika potencijala između vanjske i unutrašnje strane ćelijske membrane naziva se membranski potencijal, ili potencijal odmora(Sl. 2.1).
Potencijal membrane u mirovanju prisutan je na membrani sve dok je ćelija živa i nestaje kada ćelija umre. L. Galvani je još 1794. godine pokazao da ako na taj način oštetite nerv ili mišić presjek a nanošenjem elektroda spojenih na galvanometar na oštećeni dio i na mjesto oštećenja, galvanometar će pokazati struju koja uvijek teče od neoštećenog dijela tkiva do mjesta posjekotine. On je ovaj tok nazvao strujom mirovanja. U svojoj fiziološkoj suštini, struja mirovanja i membranski potencijal mirovanja su jedno te isto. Razlika potencijala izmjerena u ovom eksperimentu je 30-50 mV, jer kada je tkivo oštećeno, dio struje se šantira u međućelijski prostor i tekućinu koja okružuje strukturu koja se proučava. Razlika potencijala može se izračunati pomoću Nernstove formule:
gdje je R plinska konstanta, T apsolutna temperatura, F je Faradejev broj, [K] int. i [K] adv. - koncentracija kalija unutar i izvan ćelije.

Rice. 2.1.
Uzrok potencijala mirovanja je zajednički za sve ćelije. Između protoplazme ćelije i vanćelijske sredine postoji neujednačena distribucija jona (jonska asimetrija). Sastav ljudske krvi u smislu ravnoteže soli podsjeća na sastav okeanske vode. Ekstracelularno okruženje u centralnom nervnom sistemu takođe sadrži mnogo natrijum hlorida. Jonski sastav ćelijske citoplazme je lošiji. Unutar ćelija ima 8-10 puta manje jona Na+ i 50 puta manje C jona!“. Glavni kation citoplazme je K+. Njegova koncentracija unutar ćelije je 30 puta veća nego u vanćelijskom okruženju, i približno je jednaka ekstracelularnoj koncentraciji Na. Glavni protujoni za K+ u citoplazmi su organski anioni, posebno anjoni asparaginske, histaminske i drugih aminokiselina. Takva asimetrija je narušavanje termodinamičke ravnoteže. Da bi se ona obnovila, kalijum joni moraju postepeno napuštati ćeliju, a joni natrijuma moraju težiti tome, međutim, to se ne dešava.
Prva prepreka za izjednačavanje razlike u koncentraciji jona je plazma membrana ćelije. Sastoji se od dvostrukog sloja molekula fosfolipida, prekrivenih iznutra slojem proteinskih molekula, a spolja slojem ugljikohidrata (mukopolisaharida). Neki ćelijski proteini su ugrađeni direktno u lipidni dvosloj. To su unutrašnji proteini.
Membranski proteini svih ćelija podijeljeni su u pet klasa: pumpe, kanali, receptori, enzimi I strukturnih proteina. Pumpe služe za kretanje iona i molekula protiv gradijenata koncentracije koristeći metaboličku energiju. Proteinski kanali, ili pore, osiguravaju selektivnu propusnost (difuziju) kroz membranu jona i molekula koja odgovara njihovoj veličini. Receptorski proteini posjedujući visoku specifičnost, prepoznaju i vezuju, vezujući se za membranu, mnoge vrste molekula neophodnih za život ćelije u bilo kojem trenutku. Enzimi ubrzati protok hemijske reakcije na površini membrane. Strukturni proteini osiguravaju povezanost ćelija u organe i održavanje subćelijske strukture.
Svi ovi proteini su specifični, ali ne striktno. Pod određenim uslovima, određeni protein može istovremeno biti pumpa, enzim i receptor. Kroz membranske kanale, molekuli vode, kao i joni koji odgovaraju veličini pora, ulaze i izlaze iz ćelije. Propustljivost membrane za različite katjone nije ista i mijenja se u različitim funkcionalnim stanjima tkiva. U mirovanju, membrana je 25 puta propusnija za jone kalijuma nego za jone natrijuma, a kada je pobuđena, propusnost natrijuma je približno 20 puta veća od kalijuma. U mirovanju, jednake koncentracije kalijuma u citoplazmi i natrijuma u vanćelijskom okruženju trebale bi da obezbede jednak broj pozitivnih naelektrisanja sa obe strane membrane. Ali budući da je propusnost za kalijeve ione 25 puta veća, kalij, napuštajući ćeliju, čini njenu površinu sve pozitivnije nabijenom u odnosu na unutrašnju stranu membrane, u čijoj su blizini negativno nabijeni molekuli asparagina, histamina i drugih, preveliki. za pore membrane, sve više akumuliraju aminokiseline koje "oslobađaju" kalij van ćelije, ali je "sprečavaju" da ode daleko zbog svog negativnog naboja. Negativni naboji se akumuliraju na unutarnjoj strani membrane, a pozitivni na vanjskoj strani. Pojavljuje se potencijalna razlika. Difuzna struja jona natrijuma u protoplazmu iz ekstracelularne tečnosti održava ovu razliku na nivou od 60-70 mV, sprečavajući njeno povećanje. Difuzna struja jona natrijuma u mirovanju je 25 puta slabija od protustruje jona kalija. Ioni natrija, prodirući u ćeliju, smanjuju potencijal mirovanja, omogućavajući mu da ostane na određenom nivou. Dakle, vrijednost potencijala mirovanja mišićnih i nervnih ćelija, kao i nervnih vlakana, određena je omjerom broja pozitivno nabijenih kalijevih jona koji difundiraju u jedinici vremena iz ćelije prema van i pozitivno nabijenih iona natrijuma koji difundiraju kroz membranu u suprotnom smjeru. Što je ovaj omjer veći, veći je i potencijal mirovanja, i obrnuto.
Druga prepreka koja drži razliku potencijala na određenom nivou je natrijum-kalijum pumpa (slika 2.2). Naziva se natrijum-kalijum ili jonski, jer aktivno uklanja (ispumpava) ione natrija koji prodiru u nju iz protoplazme i uvodi (pumpa) kalijeve ione u nju. Izvor energije za rad jonske pumpe je razgradnja ATP-a (adenozin trifosfata), koja nastaje pod uticajem enzima adenozin trifosfataze, lokalizovanog u ćelijskoj membrani i aktiviranog istim jonima, tj. kalijumom i natrijem (natrijum). - kalijum zavisna ATPaza).

Rice. 2.2.
Ovo je veliki protein, koji premašuje debljinu ćelijske membrane. Molekul ovog proteina, prodirući kroz membranu, veže pretežno natrijum i ATP iznutra, a kalijum i razne inhibitore kao što su glikozidi izvana. U tom slučaju dolazi do membranske struje. Zahvaljujući ovoj struji, osiguran je odgovarajući smjer transporta jona. Prijenos jona se odvija u tri faze. Prvo, ion se kombinuje sa molekulom nosačem da bi formirao kompleks ion-transporter. Ovaj kompleks zatim prolazi kroz membranu ili prenosi naboj preko nje. Konačno, ion se oslobađa iz nosača na suprotnoj strani membrane. Istovremeno se događa sličan proces, transportirajući ione u suprotnom smjeru. Ako pumpa prenosi jedan natrijev ion na jedan kalijev ion, onda jednostavno održava gradijent koncentracije na obje strane membrane, ali ne doprinosi stvaranju membranskog potencijala. Da bi dala ovaj doprinos, jonska pumpa mora transportovati natrijum i kalijum u omjeru 3:2, tj. za svaka 2 jona kalijuma koja uđe u ćeliju, mora ukloniti 3 jona natrijuma iz ćelije. Radeći pri maksimalnom opterećenju, svaka pumpa je sposobna da pumpa oko 130 jona kalijuma i 200 jona natrijuma u sekundi kroz membranu. Ovo najveća brzina. U realnim uslovima rad svake pumpe se prilagođava potrebama ćelije. Većina neurona ima između 100 i 200 ionskih pumpi po kvadratnom mikronu površine membrane. Shodno tome, membrana bilo koje nervne ćelije sadrži 1 milion jonskih pumpi sposobnih da pokreću do 200 miliona jona natrijuma u sekundi.
Dakle, membranski potencijal (potencijal mirovanja) nastaje kao rezultat i pasivnih i aktivnih mehanizama. Stepen učešća određenih mehanizama u različitim ćelijama nije isti, što znači da membranski potencijal može biti različit u različitim strukturama. Aktivnost pumpi može ovisiti o promjeru nervnih vlakana: što je vlakno tanje, to je veći omjer veličine površine i volumena citoplazme; shodno tome, aktivnost pumpi neophodna za održavanje razlike u koncentraciji jona na površini i unutar vlakna treba biti veći. Drugim riječima, membranski potencijal može ovisiti o strukturi nervnog tkiva, a samim tim i o njegovoj funkcionalnoj namjeni. Električna polarizacija membrane je glavni uslov za podražljivost ćelije. To je njena stalna spremnost za akciju. Ovo je dionica potencijalna energijaćelije koje može koristiti u slučaju da nervni sistem treba njen trenutni odgovor.