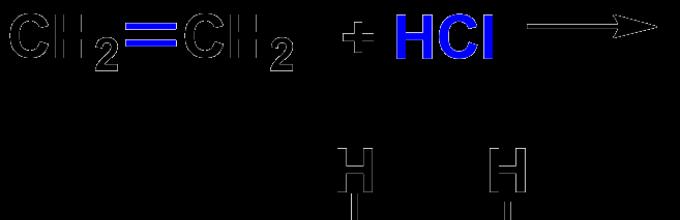>> Химия: Типы химических реакций в органической химии
Реакции органических веществ можно формально разделить на четыре основных типа: замещения, присоединения, отщепления (элиминирования) и перегруппировки (изомеризации). Очевидно, что все многообразие реакций органических соединений невозможно свести в рамки предложенной классификации (например, реакции горения). Однако такая классификация поможет установить аналогии с уже знакомыми вам из курса неорганической химии классификациями реакций, протекающих между неорганическими веществами.
Как правило, основное органическое соединение, участвующее в реакции, называют субстратом, а другой компонент реакции условно рассматривают как реагент.
Реакции замещения
Реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле (субстрате) на другие атомы или группы атомов, называются реакциями замещения.
В реакции замещения вступают предельные и ароматические соединения, такие, как, например, алканы, циклоалканы или арены.
Приведем примеры таких реакций.
Занятие 2. Классификация реакций в органической химии. Упражнения на изомерию и гомологи
КЛАССИФИКАЦИЯ РЕАКЦИЙ В ОРГАНИЧЕСКОЙ ХИМИИ.
Существуют три основные классификации органических реакций.
1 Классификация по способу разрыва ковалентных связей в молекулах реагирующих веществ.
§ Реакции, протекающие по механизму свободнорадикального (гомолитического) разрыва связей. Такому разрыву подвергаются малополярные ковалентные связи. Образующиеся частицы называются свободными радикалами – хим. частица с неспаренным электроном, обладающая высокой химической активностью. Типичным примером такой реакции является галогенирование алканов, например :
§ Реакции, протекающие по механизму ионного (гетеролитического) разрыва связей. Такому разрыву подвергаются полярные ковалентные связи. В момент реакции образуются органические ионные частицы – карбкатион (ион, содержащий атом углерода с положительным зарядом) и карбанион (ион, содержащий атом углерода с отрицательным зарядом). Примером такой реакции может служить реакция гидрогалогенирования спиртов, например:
2. Классификация по механизму протекания реакции.
§ Реакции присоединения – реакция, в ходе которой из двух реагирующих молекул образуется одна (вступают непредельные или циклические соединения). В качестве примера приведите реакцию присоединения водорода к этилену:
§ Реакции замещения – реакция, в результате которой происходит обмен одного атома или группы атомов на другие группы или атомы. В качестве примера приведите реакцию взаимодействия метана с азотной кислотой:
§ Реакции отщепления (элиминирования) – отделение небольшой молекулы от исходного органического вещества. Выделяют a-элиминирование (отщепление происходит от одного и того же атома углерода, образуются неустойчивые соединения – карбены); b-элиминирование (отщепление происходит от двух соседних атомов углерода, образуются алкены и алкины); g-элиминирование (отщепление происходит от более удаленных атомов углерода, образуются циклоалканы). Приведите примеры вышеперечисленных реакций:
§ Реакции разложения – реакции, в результате которой из одной молекулы орг. соединения образуется несколько более простых. Типичным примером такой реакции служит крекинг бутана:
§ Реакции обмена – реакции, в процессе которых молекулы сложных реагентов обмениваются своими составными частями. В качестве примера приведите реакцию взаимодействия уксусной кислоты и гидроксида натрия:
§ Реакции циклизации – процесс образования циклической молекулы из одной или нескольких ациклических. Напишите реакцию получения циклогексана из гексана:
§ Реакции изомеризации – реакция перехода одного изомера в другой при определенных условиях. Приведите пример изомеризации бутана:
§ Реакции полимеризации – цепной процесс, последовательное соединение низкомолекулярных молекул в более крупные высокомолекулярные путем присоединения мономера к активному центру, находящемуся на конце растущей цепи. Полимеризация не сопровождается образованием побочных продуктов. Типичным примером является реакция образования полиэтилена:
§ Реакции поликонденсации – последовательное соединение мономеров в полимер, сопровождающееся образованием низкомолекулярных побочных продуктов (воды, аммиака, галогеноводорода и т.д.). В качестве примера напишите реакцию образования фенолформальдегидной смолы:
§ Реакции окисления
а) полное окисление (горение), например:
б) неполное окисление (возможно окисление кислородом воздуха или сильными окислителями в растворе – KMnO 4 , K 2 Cr 2 O 7). В качестве примера запишите реакции каталитического окисления метана кислородом воздуха и варианты окисления этилена в растворах с разным значением рН:
3. Классификация по химизму реакции.
· Реакция галогенирования – введение в молекулу орг. соединения атома галогена путем замещения или присоединения (заместительное или присоединительное галогенирование). Напишите реакции галогенирования этана и этена:
· Реакция гидрогалогенирования – присоединение галогеноводородов к непредельным соединениям. Реакционная способность возрастает с увеличением молярной массы Hhal. В случае ионного механизма реакции присоединение идет по правилу Марковникова: ион водорода присоединяется к наиболее гидрогенизированному атому углерода. Приведите пример реакции взаимодействия пропена и хлороводорода:
· Реакция гидратации – присоединение воды к исходному органическому соединению, подчиняется правилу Марковникова. В качестве примера запишите реакцию гидратации пропена:
· Реакция гидрирования – присоединение водорода к органическому соединению. Обычно проводят в присутствии металлов VIII группы Периодической системы (платина, палладий) в качестве катализаторов. Напишите реакцию гидрирования ацетилена:
· Реакция дегалогенирования – отщепление атома галогена от молекулы орг. соединения. В качестве примера приведите реакцию получения бутена-2 из 2,3-дихлорбутана:
· Реакция дегидрогалогенирования – отщепление молекулы галогеноводорода от органической молекулы с образованием кратной связи или цикла. Обычно подчиняется правилу Зайцева: водород отщепляется от наименее гидрогенизированного атома углерода. Запишите реакцию взаимодействия 2-хлорбутана со спиртовым раствором гидроксида калия:
· Реакция дегидратации – отщепление молекулы воды от одной или нескольких молекул орг. вещества (внутримолекулярная и межмолекулярная дегидратация). Осуществляется при высокой температуре или в присутствии водоотнимающих средств (конц. H 2 SO 4 , P 2 O 5). Приведите примеры дегидратации этилового спирта:
· Реакция дегидрирования – отщепление молекулы водорода от орг. соединения. Напишите реакцию дегидрирования этилена:
· Реакция гидролиза – обменная реакция между веществом и водой. Т.к. гидролиз в большинстве случаев обратим, его проводят в присутствии веществ, связывающих продукты реакции, или удаляют продукты из сферы реакции. Гидролиз ускоряется в кислой или щелочной среде. Приведите примеры водного и щелочного (омыление) гидролиза этилового эфира уксусной кислоты:
· Реакция этерификации – образование сложного эфира из органической или неорганической кислородсодержащей кислоты и спирта. В качестве катализатора применяют конц. серную или соляную кислоты. Процесс этерификации обратим, поэтому продукты необходимо удалять из сферы реакции. Запишите реакции этерификации этилового спирта с муравьиной и с азотной кислотами:
· Реакция нитрования – введение группы –NO 2 в молекулы орг. соединений, например реакция нитрования бензола:
· Реакция сульфирования – введение группы –SO 3 Н в молекулы орг. соединений. Запишите реакцию сульфирования метана:
· Реакция алкилирования – введение радикала в молекулы орг. соединений вследствие реакций обмена или присоединения. В качестве примера запишите реакции взаимодействия бензола с хлорэтаном и с этиленом:
Упражнения на изомерию и гомологи
1. Укажите, какие из следующих веществ являются гомологами по отношению друг к другу: С 2 Н 4 , С 4 Н 10 , С 3 Н 6 , С 6 Н 14 , С 6 Н 6 , С 6 Н 12 , С 7 Н 12 , С 5 Н 12 , С 2 Н 2 .
2. Составьте структурные формулы и дайте названия всем изомерам состава С 4 Н 10 О (7 изомеров).
3. Продукты полного сгорания 6,72л смеси этана и его гомолога, имеющего на один атом углерода больше, обработали избытком известковой воды, при этом образовалось 80г осадка. Какого гомолога в исходной смеси было больше? Определите состав исходной смеси газов. (2,24л этана и 4,48л пропана).
4. Составьте структурную формулу алкана с относительной плотностью паров по водороду 50, в молекуле которого имеется по одному третичному и четвертичному атому углерода.
5. Среди предложенных веществ выделите изомеры и составьте их структурные формулы: 2,2,3,3,-тетраметилбутан; н-гептан; 3-этилгексан; 2,2,4-триметилгексан; 3-метил-3-этилпентан.
6. Вычислите плотность паров по воздуху, по водороду и по азоту пятого члена гомологического ряда алкадиенов (2,345; 34; 2,43).
7. Напишите структурные формулы всех алканов, содержащих 82,76% углерода и 17,24% водорода по массе.
8. На полное гидрирование 2,8г этиленового углеводорода израсходовали 0,896л водорода (н.у.). Определите углеводород, если известно, что он имеет неразветвленное строение.
9. При добавлении какого газа к смеси равных объемов пропана и пентана ее относительная плотность по кислороду увеличится; уменьшится?
10. Приведите формулу простого газообразного вещества, имеющего такую же плотность по воздуху, как простейший алкен.
11. Составьте структурные формулы и назовите все углеводороды, содержащие 32е в молекуле 5 изомеров).
Теория замещения в ароматических соединениях. Реакции электрофильного замещения. Ориентанты 2 рода (мета- ориентанты).
Заместители, обладающие отрицательным индуктивным эффектом или отрицательными как индуктивным, так и мезомерным эффектами, направляют электрофильное замещение в мета-положение бензольного кольца и носят название ориентантов второго рода.
Органические реакции, как и неорганические, подразделяются на 3 основных типа:
1) реакция замещения: СН 4 + CI 2 → СН 3 CI + НCI;
2) реакция отщепления: СН 3 СН 2 Br → СН 2 = СН 2 + НBr;
3) реакция присоединения: СН 2 = СН 2 + НBr → CН 3 СН 2 Br.( реакции полимеризации)
Классифицировать по механизму разрыва ковалентных связей в реагирующих молекулах.
Два способа разрыва ковалентных связей.
1. Если общая электронная пара делится между атомами, образуя радикалы. Радикалы -частицы, имеющие неспаренные электроны. Такой разрыв связи называется радикальным (гомолитическим). Особенность данной связи заключается в том, что радикалы, которые образуются, взаимодействуют с имеющимися в реакционной системе молекулами или друг с другом.
Образующиеся радикалы взаимодействуют с имеющимися в реакционной системе молекулами или друг с другом: CН· 3 + CI 2 → СН 3 CI + CI.
По радикальному механизму протекают реакции, в которых разрыву подвергаются связи малой полярности (С-С, С-Н, N-N) при высокой температуре, под действием света или радиоактивного излучения.
2. Если при разрыве связи общая электронная пара остается у одного атома, то образуются ионы – катион и анион. Такой механизм называется ионным или гетеролитическим. Он приводит к образованию органических катионов или анионов: 1) хлористый метил образует метил-катион и хлорид-анион; 2) метил-литий образует литий-катион и метил-анион.
Органические ионы вступают в дальнейшие превращения. При этом катионы взаимодействуют с нуклеофильными («любящими ядра») частицами, а органические анионы – с электрофильными («любящими электроны») частицами (катионы металлов, галогены и др.).
Ионный механизм наблюдается при разрыве полярной ковалентной связи (углерод – галоген, углерод – кислород и др.).
Органические ионные частицы подобны ионам в неорганической химии – имеют соответствующие заряды. Однако они и резко отличаются: ионы неорганических соединений присутствуют в водных растворах постоянно, а органические ионные частицы возникают только в момент реакции.
Поэтому во многих случаях необходимо говорить не о свободных органических ионах, а о сильно поляризованных молекулах.
Радикальный механизм наблюдается при разрыве неполярной или малополярной ковалентной связи (углерод – углерод, углерод – водород и т. д.).
Органические ионные частицы подобны ионам в неорганической химии – они имеют соответствующие заряды.
Существуют разные системы классификации органических реакций, которые основаны на различных признаках. Среди них можно выделить классификации:
- по конечному результату реакции , то есть изменению в структуре субстрата;
- по механизму протекания реакции , то есть по типу разрыва связей и типу реагентов.
Взаимодействующие в органической реакции вещества подразделяют на реагент и субстрат . При этом считается, что реагент атакует субстрат.
ОПРЕДЕЛЕНИЕ
Реагент - вещество, действующее на объект - субстрат - и вызывающее в нем изменение химической связи. Реагенты делятся на радикальные, электрофильные и нуклеофильные.
ОПРЕДЕЛЕНИЕ
Субстратом , как правило, считают молекулу, которая предоставляет атом углерода для новой связи.
КЛАССИФИКАЦИЯ РЕАКЦИЙ ПО КОНЕЧНОМУ РЕЗУЛЬТАТУ (ИЗМЕНЕНИЮ В СТРУКТУРЕ СУБСТРАТА)
В органической химии различают четыре вида реакций по конечному результату и изменению в структуре субстрата: присоединения, замещения, отщепления, или элиминирования (от англ. to eliminate - удалять, отщеплять), и перегруппировки (изомеризации ). Такая классификация аналогична классификации реакций в неорганической химии по числу исходных реагентов и образующихся веществ, с изменением или без изменения состава. Классификация по конечному результату основана на формальных признаках, так как стехиометрическое уравнение, как правило, не отражает механизм реакции. Сравним типы реакций в неорганической и органической химии.
Тип реакции в неорганической химии | Пример | Тип реакции в органической химии | Разновидность и пример Реакции |
|---|---|---|---|
1. Соединение | C l 2 + H 2 = 2 H C l | Присоединение по кратным связям | Гидрирование |
Гидрогалогенирование
|
|||
Галогенирование
|
|||
Гидратация
|
|||
2. Разложение | 2
H
2
O
=
2
H
2
+
O
2
| Элиминирование | Дегидрирование
|
Дегидрогалогенирование
|
|||
Дегалогенирование
|
|||
Дегидратация
|
|||
3. Замещение | Z n + 2 H C l = ZnCl2+H2 | Замещение |
|
4. Обмен (частный случай - нейтрализация) | H 2 S O 4 + 2 N a O H =N a 2 S O 4 + 2 H2 O | частный случай - этерификация |
|
5.Аллотропизация | графит⇔ алмаз P красн. ⇔ P бел. Pкрасн.⇔P бел. S ромб. ⇔ S пласт. Sромб.⇔Sпласт. | Изомеризация | Изомеризация алканов
|
п) без замены их другими.
В зависимости от того, какие атомы отщепляются - соседние C –C или изолированные двумя-тремя или более атомами углерода –C –C–C–C –, –C –C–C–C–C –, могут образовываться соединения с кратными связям и или циклические соединения . Отщепление галогеноводородов из алкилгалогенидов либо воды из спиртов происходит по правилу Зайцева.
ОПРЕДЕЛЕНИЕ
Правило Зайцева : атом водорода Н отщепляется от наименее гидрогенизированного атома углерода.
Например, отщепление молекулы бромоводорода происходит от соседних атомов в присутствии щелочи, при этом образуется бромид натрия и вода.
ОПРЕДЕЛЕНИЕ
Перегруппировка - химическая реакция, в результате которой происходит изменение взаимного расположения атомов в молекуле, перемещение кратных связей или изменение их кратности.
Перегруппировка может осуществляться с сохранением атомного состава молекулы (изомеризация) или с его изменением.
ОПРЕДЕЛЕНИЕ
Изомеризация - частный случай реакции перегруппировки, приводящая к превращению химического соединения в изомер путем структурного изменения углеродного скелета.
Перегруппировка тоже может осуществляться по гомолитическому или гетеролитическому механизму. Молекулярные перегруппировки могут классифицироваться по разным признакам, например по насыщенности систем, по природе мигрирующей группы, по стереоспецифичности и др. Многие реакции перегруппировки имеют специфические названия - перегруппировка Кляйзена, перегруппировка Бекмана и др.
Реакции изомеризации широко используются в промышленных процессах, например при переработке нефти для повышения октанового числа бензина. Примером изомеризации является превращение н -октана в изооктан:
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ ПО ТИПУ РЕАГЕНТА
РАЗРЫВ СВЯЗИ
Разрыв связи в органических соединениях может гомолитическим и гетеролитическим.
ОПРЕДЕЛЕНИЕ
Гомолитический разрыв связи - это такой разрыв, в результате которого каждый атом получает неспаренный электрон и образуются две частицы, имеющие сходное электронное строение - свободные радикалы .
Гомолитический разрыв характерен для неполярных или слабополярных связей, например C–C, Cl–Cl, C–H, и требует большого количества энергии.
Образующиеся радикалы, имеющие неспаренный электрон, обладают высокой реакционной способностью, поэтому химические процессы, протекающие с участием таких частиц, часто носят «цепной» характер, их трудно контролировать, а в результате реакции получается набор продуктов замещения. Так, при хлорировании метана продуктами замещения являются хлорметан C H 3 C l CH3Cl , дихлорметан C H 2 C l 2 CH2Cl2 , хлороформ C H C l 3 CHCl3 и четыреххлористый углерод C C l 4 CCl4 . Реакции с участием свободных радикалов протекают по обменному механизму образования химических связей.
Образующиеся в ходе такого разрыва связи радикалы обуславливают радикальный механизм протекания реакции. Радикальные реакции обычно протекают при повышенных температурах или при излучении (например, свет).
В силу своей высокой реакционной способности свободные радикалы могут оказывать негативное воздействие на организм человека, разрушая клеточные мембраны, воздействуя на ДНК и вызывая преждевременное старение. Эти процессы связаны, в первую очередь, с пероксидным окислением липидов, то есть разрушением структуры полиненасыщенных кислот, образующих жир внутри клеточной мембраны.
ОПРЕДЕЛЕНИЕ
Гетеролитический разрыв связи - это такой разрыв, при котором электронная пара остается у более электроотрицательного атома и образуются две заряженные частицы - ионы: катион (положительный) и анион (отрицательный).
В химических реакциях эти частицы выполняют функции «нуклеофилов » («фил» - от гр. любить ) и «электрофилов », образуя химическую связь с партнером по реакции по донорно-акцепторному механизму. Частицы-нуклеофилы предоставляют электронную пару для образования новой связи. Другими словами,
ОПРЕДЕЛЕНИЕ
Нуклеофил - электроноизбыточный химический реагент, способный взаимодействовать с электронодефицитными соединениями.
Примерами нуклеофилов являются любые анионы (C l − , I − , N O − 3 Cl−,I−,NO3− и др.), а также соединения, имеющие неподеленную электронную пару (N H 3 , H 2 O NH3,H2O ).
Таким образом, при разрыве связи могут образоваться радикалы или нуклеофилы и электрофилы. Исходя из этого выделяют три механизма протекания органических реакций.
МЕХАНИЗМЫ ПРОТЕКАНИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
Свободно-радикальный механизм : реакцию начинают свободные радикалы, образующиеся при гомолитическом разрыве связи в молекуле.
Наиболее типичный вариант - образование радикалов хлора или брома при УФ-облучении.
1. Свободно-радикальное замещение

метан бромметан
Инициирование цепи

Рост цепи
Обрыв цепи
2. Свободно-радикальное присоединение
этен полиэтилен
Электрофильный механизм : реакцию начинают частицы-электрофилы, получающие положительный заряд в результате гетеролитического разрыва связи. Все электрофилы - кислоты Льюиса.
Такие частицы активно образуются под действием кислот Льюиса , которые усиливают положительный заряд частицы. Чаще других используются A l C l 3 , F e C l 3 , F e B r 3 , Z n C l 2 AlCl3,FeCl3,FeBr3,ZnCl2 , выполняющие функции катализатора.
Местом атаки частицы-электрофила являются те участки молекулы, которые имеют повышенную электронную плотность, т. е. кратная связь и бензольное кольцо.
Общий вид реакций электрофильного замещения можно выразить уравнением:
1. Электрофильное замещение

бензол бромбензол
2. Электрофильное присоединение
пропен 2-бромпропан
пропин 1,2-дихлорпропен
Присоединение к несимметричным непредельным углеводородам происходит в соответствии с правилом Марковникова.
ОПРЕДЕЛЕНИЕ
Правило Марковникова: присоединение к несимметричным алкенам молекул сложных веществ с условной формулой НХ (где Х - это атом галогена или гидроксильная группа ОН–) атом водорода присоединяется к наиболее гидрогенизированному (содержащему больше всего атомов водорода) атому углерода при двойной связи, а Х - к наименее гидрогенизированному.
Например, присоединение хлороводорода HCl к молекуле пропена C H 3 – C H = C H 2 CH3–CH=CH2 .

Реакция протекает по механизму электрофильного присоединения. За счет электронодонорного влияния C H 3 CH3 -группы электронная плотность в молекуле субстрата смещена к центральному атому углерода (индуктивный эффект), а затем по системе двойных связей - к концевому атому углерода C H 2 CH2 -группы (мезомерный эффект). Таким образом, избыточный отрицательный заряд локализован именно на этом атоме. Поэтому атаку начинает протон водорода H + H+ , являющийся электрофильной частицей. Образуется положительно заряженный карбеновый ион [ C H 3 – C H − C H 3 ] + + , к которому присоединяется анион хлора C l − Cl− .
ОПРЕДЕЛЕНИЕ
Исключения из правила Марковникова: реакция присоединения протекает против правила Марковникова, если в реакцию вступают соединения, у которых атом углерода, соседний с атомом углерода двойной связи, оттягивает на себя частично электронную плотность, то есть при наличии заместителей, проявляющих значительный электроноакцепторный эффект (– C C l 3 , – C N , – C O O H (–CCl3,–CN,–COOH и др.).

Нуклеофильный механизм : реакцию начинают частицы-нуклеофилы, имеющие отрицательный заряд, образовавшиеся в результате гетеролитического разрыва связи. Все нуклеофилы - основания Льюиса .
В нуклеофильных реакциях реагент (нуклеофил) имеет на одном из атомов свободную пару электронов и является нейтральной молекулой или анионом (H a l – , O H – , R O − , R S – , R C O O – , R – , C N – , H 2 O , R O H , N H 3 , R N H 2 Hal–,OH–,RO−,RS–,RCOO–,R–,CN–,H2O,ROH,NH3,RNH2 и др.).
Нуклеофил атакует в субстрате атом с наименьшей электронной плотностью (т. е. с частичным или полным положительным зарядом). Первой стадией реакции нуклеофильного замещения является ионизация субстрата с образованием карбкатиона. При этом новая связь образуется за счет электронной пары нуклеофила, а старая претерпевает гетеролитический разрыв с последующим отщеплением катиона. Примером нуклеофильной реакции может служить нуклеофильное замещение (символ S N SN ) у насыщенного атома углерода, например щелочной гидролиз бромпроизводных.
1. Нуклеофильное замещение
2. Нуклеофильное присоединение

этаналь циангидрин
источник http://foxford.ru/wiki/himiya
Органические реакции можно подразделить на два общих типа.
Гемолитические реакции. Эти реакции протекают по радикальному механизму. Мы подробнее познакомимся с ними в следующей главе. Кинетика и механизм реакций этого типа обсуждались в гл. 9.
Гетеролитические реакции. Эти реакции в сущности являются ионными реакциями. Их можно в свою очередь подразделить на реакции замещения, присоединения и элиминирования (отщепления).
Реакции замещения
В этих реакциях какой-либо атом или группа атомов замещается другим атомом либо группой. В качестве примера реакций данного типа приведем гидролиз хлорометана с образованием метанола:
Гидроксильный ион представляет собой нуклеофил. Поэтому рассматриваемое замещение называется нуклеофильным замещением. Оно обозначается символом SN. Замещаемая частица (в рассматриваемом случае ион хлора) называется уходящей группой.
Если обозначить нуклеофил символом а уходящую группу-символом , то можно записать обобщенное уравнение реакции нуклеофильного замещения у насыщенного атома углерода в алкильной группе R следующим образом:
Исследование скорости протекания реакций этого типа показывает, что -реакции можно подразделить на
Реакции типа Для некоторых реакций типа SN кинетическое уравнение скорости реакции (см. разд. 9.1) имеет вид
Таким образом, эти реакции имеют первый порядок по субстрату но нулевой порядок по реагенту Кинетика, характерная для реакции первого порядка, является достоверным указанием на то, что лимитирующая стадия реакции представляет собой мономолекулярный процесс. Поэтому реакции подобного типа обозначаются символом .
Реакция имеет нулевой порядок по реагенту поскольку ее скорость не зависит от концентрации реагента Поэтому можно записать:
Поскольку нуклеофил не участвует в лимитирующей стадии реакции, механизм такой реакции должен включать по меньшей мере две стадии. Для подобных реакций предложен следующий механизм:

Первая стадия представляет собой ионизацию с образованием карбкатиона Эта стадия является лимитирующей (медленной).
Примером реакций типа является щелочный гидролиз третичных алкилгало-генидов. Например
В рассматриваемом случае скорость реакции определяется уравнением
Реакции типа Для некоторых реакций нуклеофильного замещения SN уравнение скорости имеет вид
В данном случае реакция имеет первый порядок по нуклеофилу и первый порядок по . В целом она является реакцией второго порядка. Это является достаточным основанием считать, что лимитирующая стадия этой реакции представляет собой бимолекулярный процесс. Поэтому реакция рассматриваемого типа обозначается символом Поскольку в лимитирующей стадии реакции одновременно участвуют и нуклеофил, и субстрат можно думать, что эта реакция протекает в одну стадию через переходное состояние (см. разд. 9.2):
Гидролиз первичных алкилгалогенидов в щелочной среде протекает по механизму

Эта реакция имеет следующее кинетическое уравнение:
До сих пор мы рассматривали нуклеофильное замещение только у насыщенного атома углерода. Нуклеофильное замещение возможно также у ненасыщенного атома углерода:

Реакции такого типа называются нуклеофильным ацильным замещением.
Электрофильное замещение. На бензольных циклах могут протекать также реакции электрофильного замещения. При замещении такого типа бензольное кольцо поставляет электрофилу два из своих делокализованных -электронов. При этом образуется промежуточное соединение - неустойчивый -комплекс из электрофила и уходящей группы. Для схематического изображения таких комплексов используется незамкнутая окружность, указывающая на потерю двух -электронов:

Примером реакций электрофильного замещения может служить нитрование бензола:

Нитрование бензола проводится в установке с обратным холодильником при температуре от 55 до 60 °С с использованием нитрующей смеси. Такая смесь содержит равные количества концентрированных азотной и серной кислот. Реакция между этими кислотами приводит к образованию нитроильного катиона
Реакции присоединения
В реакциях этого типа происходит присоединение электрофила либо нуклеофила к ненасыщенному атому углерода. Мы рассмотрим здесь по одному примеру электрофильного присоединения и нуклеофильного присоединения.
Примером электрофильного присоединения может служить реакция между бромоводородом и каким-либо алкеном. Для получения бромоводорода в лабораторных условиях может использоваться реакция между концентрированной серной кислотой и бромидом натрия (см. разд. 16.2). Молекулы бромоводорода полярны, потому что атом брома оказывает отрицательный индуктивный эффект на водород. Поэтому молекула бромоводорода обладает свойствами сильной кислоты. Согласно современным воззрениям, реакция бромоводорода с алкенами протекает в две стадии. На первой стадии положительно заряженный атом водорода атакует двойную связь, которая выступает в роли источника электронов. В результате образуются активированный комплекс и бромид-ион:

Затем бромид-ион атакует этот комплекс, в результате чего образуется алкилбромид:

В качестве примера нуклеофильного присоединения можно привести присоединение циановодорода к какому-либо альдегиду либо кетону. Сначала альдегид или кетон обрабатывают водным раствором цианида натрия Затем добавляют избыточное количество какой-либо минеральной кислоты, что приводит к образованию циановодорода HCN. Цианидный ион является нуклеофилом. Он атакует положительно заряженный атом углерода на карбонильной группе альдегида или кетона. Положительный заряд и полярность карбонильной группы обусловлены мезомерным эффектом, который был описан выше. Реакцию можно представить следующей схемой:

Реакции элиминирования (отщепления)
Эти реакции являются обратными по отношению к реакциям присоединения. Они приводят к удалению каких-либо атомов или групп атомов от двух углеродных атомов, связанных между собой простой ковалентной связью, в результате чего между ними образуется кратная связь.
Примером подобной реакции является отщепление водорода и галогена от алкилгалогенидов:
Для проведения этой реакции алкилгалогенид обрабатывают гидроксидом калия в спирте при температуре 60 °С.
Следует отметить, что обработка алкилгалогенида гидроксидом приводит также к нуклеофильному замещению (см. выше). В результате одновременно протекают две конкурирующие между собой реакции замещения и отщепления, что приводит к образованию смеси продуктов замещения и отщепления. Какая из этих реакций окажется преобладающей, зависит от целого ряда факторов, в том числе от среды, в которой проводится реакция. Нуклеофильное замещение алкилгалогенидов проводится в присутствии воды. В отличие от этого реакции отщепления проводятся в отсутствие воды и при более высоких температурах.
Итак, повторим еще раз!
1. При гемолитическом расщеплении связи два обобществленных электрона распределяются равномерно между атомами.
2. При гетеролитическом расщеплении связи два обобществленных электрона распределяются неравномерно между атомами.
3. Карбанион это ион, содержащий атом углерода с отрицательным зарядом.
4. Карбкатион - это ион, содержащий атом углерода с положительным зарядом.
5. Эффекты растворителя могут оказывать значительное влияние на химические процессы и их константы равновесия.
6. Влияние химического окружения функциональной группы внутри молекулы на реакционную способность этой функциональной группы называется структурным эффектом.
7. Электронные эффекты и стерические эффекты вместе называются структурными эффектами.
8. Двумя важнейшими электронными эффектами являются индуктивный эффект и мезомерный (резонансный) эффект.
9. Индуктивный эффект заключается в смещении электронной плотности от одного атома к другому, что приводит к поляризации связи между двумя атомами. Этот эффект может быть положительным либо отрицательным.
10. Молекулярные частицы с кратными связями могут существовать в форме резонансных гибридов между двумя или несколькими резонансными структурами.
11. Мезомерный (резонансный) эффект заключается в стабилизации резонансных гибридов вследствие делокализации -электронов.
12. Стерическое препятствие может возникать в тех случаях, когда объемистые группы в какой-либо молекуле механически препятствуют протеканию реакции.
13. Нуклеофил - частица, которая атакует атом углерода, поставляя ему свою электронную пару. Нуклеофил представляет собой основание Льюиса.
14. Электрофил - частица, которая атакует атом углерода, акцептируя его электронную пару. Нуклеофил представляет собой кислоту Льюиса.
15. Гемолитические реакции являются радикальными реакциями.
16. Гетеролитические реакции представляют собой главным образом ионные реакции.
17. Замещение какой-либо группы в молекуле нуклеофильным реагентом называется нуклеофильным замещением. Замещаемая группа в этом случае называется уходящей группой.
18. Электрофилъное замещение на бензольном кольце включает донирование двух делокализованных электронов какому-либо электрофилу.
19. В реакциях электрофильного присоединения происходит присоединение какого-либо электрофила к ненасыщенному атому углерода.
20. Присоединение циановодорода к альдегидам или кетонам является примером нуклеофильного присоединения.
21. В реакциях элиминирования (отщепления) происходит отрыв каких-либо атомов или групп атомов от двух атомов углерода, связанных между собой простой ковалентной связью. В результате образуется кратная связь между этими атомами углерода.