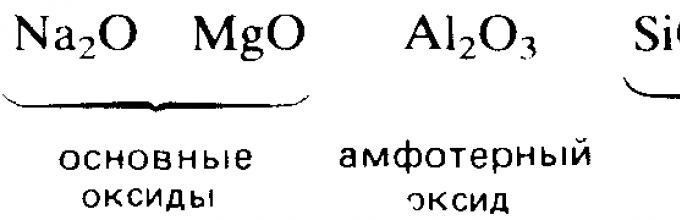Водородные соединения неметаллов. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе Д. И. Менделеева.
Гидриды . В соединениях с неметаллами водород проявляет степень окисления +1. Поскольку энергия ионизации водорода очень большая, химическая связь его с неметаллами не ионная, а полярно-ковалентная. Наиболее электроотрицательные р-элементы в правой части периодов, например сера и хлор, реагируют с водородом, образуя ковалентные гидриды, которые обладают кислотными свойствами и сила этих кислот увеличивается по мере увеличения размера атома присоединяемого к водороду неметалла. Исключениями являются метан СН 4 , представляющий собой нейтральное соединение, а также аммиак NH 3 , обладающий основными свойствами. Водородные соединения неметаллов хорошо растворимы в воде и образуют кислоты с теми же формулами.
Более электроотрицательные р-элементы, например алюминий, кремний и фосфор, в нагретом состоянии не реагируют с водородом.
Билет №14.
Высшие оксиды химических элементов третьего периода. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе Д. И. Менделеева. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
Реакционная способность элементов во взаимодействии с кислородом, вообще говоря, уменьшается при перемещении вправо вдоль каждого периода. Например, в 3-м периоде два s-металла, натрий и магний, и два р-элемента, алюминий и фосфор, бурно реагируют с кислородом, образуя оксиды. В том же периоде элементы кремний и сера способны только медленно реагировать с кислородом. Хлор и аргон, расположенные в правом конце периода, вообще не реагируют с кислородом.
Электроположительные s-металлы образуют ионные оксиды, как, например, оксид натрия Na 2 O и оксид магния MgO. Оксиды элементов, расположенных в средней и правой частях периода, являются преимущественно ковалентными соединениями, как, например, оксиды азота и серы.
Кислотно-основный характер оксидов тоже изменяется от основного у оксидов элементов левой части периода к амфотерному у оксидов элементов средней части периода и далее к кислотному у оксидов элементов правой части периода. Например, s-металлы обычно образуют оксиды, которые растворяются в воде с образованием щелочных растворов:
Молекулярные оксиды р-элементов, например диоксид углерода и триоксид серы, обычно обладают кислотными свойствами. Закономерное изменение основных свойств с переходом к кислотным свойствам наглядно проявляется у оксидов элементов 3-го периода.

Билет №15.
Кислоты, их классификация и химические свойства на основе представлений об электролитической диссоциации. Особенности свойств концентрированной серной кислоты на примере взаимодействия с медью.
Кислота - сложное вещество, при диссоциации которого образуется только один тип катионов - ионы водорода.
Классификация кислот.

Соляная кислота - водный раствор газа хлоро-водорода в воде.
Химические свойства. Кислоты изменяют цвет индикаторов: лакмус окрашивается в красный цвет, метилоранж - в желтый.
При реакции с основаниями образуется соль и вода (реакция нейтрализации). В реакцию вступают как растворимые, так и нерастворимые в воде основания:

При реакции с основными оксидами образуются со ли:

Кислоты реагируют с металлами, находящимися в ряду напряжений до водорода, при этом выделяется газообразный водород и образуется соль:

Сильные кислоты реагирует с солями слабых кислот, вытесняя слабые кислоты из их солей:
Получение кислот. Многие кислоты можно получить при реакции кислотных оксидов с водой:


Концентрированная серная кислота при обычной температуре не действует на многие металлы. По этой причине, например, безводная серная кислота в отличие от её растворов может сохраняться в железной таре.
Но концентрированная серная кислота действует почти на все металлы при нагревании. При этом образуются соли серной кислоты, однако водород не выделяется, а получаются другие вещества, например сернистый газ.
Так, при нагревании концентрированной серной кислоты с медью вначале серная кислота окисляет медь до окиси меди, а сама восстанавливается при этом до сернистой кислоты, которая тотчас же разлагается на сернистый газ и воду:

Образовавшаяся окись меди реагирует с избытком серной кислоты, образуя соль и воду:
Таким образом, окись меди является промежуточным веществом в этой реакции. Сложив эти уравнения, мы получим итоговое уравнение реакции, в которое входят только исходные и конечные вещества:

Тест составлен в четырех вариантах. Каждый вариант включает две части. Первая часть содержит 14 заданий с выбором ответа (базовый уровень сложности), вторая часть- два задания (В1 и В2) с кратким ответом (повышенный уровень сложности). Рекомендуется для учащихся 9 класса в качестве текущего контроля, а также для подготовки к ОГЭ.
Скачать:
Предварительный просмотр:
ТЕСТ по теме «Периодический закон и периодическая система
Химических элементов Д.И. Менделеева»
Вариант № 1
А1. У атома серы число электронов на внешнем уровне и заряд ядра равны соответственно
1) 4 и +16 2) 6 и +32 3) 6 и +16 4) 4 и +32
А2. Сходное строение внешнего электронного слоя имеют атомы мышьяка и
Алюминий→кремний→фосфор→сера
Высшая степень окисления
А4. Притяжение электронов внешнего слоя к ядру увеличивается в ряду
2) увеличение силы притяжения валентных электронов к ядру
3) уменьшение электроотрицательности
А6. В порядке усиления неметаллических свойств расположены
А7. Наибольший радиус у атома
1) брома 2) цинка 3) кальция 4) германия
А8. Наибольшей восстановительной активностью обладает
1) Si 2) Р 3) S 4) С1
А9. Высший оксид состава ЭО образуют все элементы
1) IV А группы 2) IIА группы 3) IV периода 4) II периода
А10. По номеру периода можно определить
1) количество электронов на внешнем уровне атома 3) заряд ядра атома
2) количество всех электронов в атоме 4) число энергетических уровней в атоме
А11. Сколько энергетических уровней в атоме скандия?
1) 1 2) 2 3) 3 4) 4
А. Металлические и восстановительные свойства элементов в главных подгруппах с ростом заряда ядра увеличиваются.
Б . В периоде с ростом заряда ядра основные свойства оксидов и гидроксидов увеличиваются.
В1.
В2.
Вариант № 2
1) Са 2+ 2) Al 3+ 3)Na + 4) F ─
А2. Сходное строение внешнего электронного слоя имеют атомы кремния и
1) фосфора 2) селена 3) германия 4) ванадия
А3. В ряду химических элементов:
алюминий→кремний→фосфор→сера радиус атома
1) увеличивается 3) не изменяется
2) уменьшается 4) сначала увеличивается, а потом уменьшается
увеличивается в ряду
А5. В ряду Ве-В-С-N происходит
1) увеличение радиуса атомов
4) уменьшение числа валентных электронов
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
1) А1 2) Мg 3) Na 4) Si
В1.
1) уменьшаются заряды ядер атомов
2) увеличивается число электронов во внешнем электронном слое
3) уменьшается электроотрицательность
4) уменьшается радиус атомов
5) усиливаются металлические свойства
В2.
Вариант № 3
А1. Число валентных электронов в атоме стронция равно
1) 2 2) 3 3) 4 4) 38
А2. Чем определяется место химического элемента в периодической системе Д.И.Менделеева?
1) количеством электронов на внешнем уровне атома 3) зарядом ядра атома
2) количеством нейтронов в ядре 4) массой атома
А3. Пара элементов, обладающих наиболее сходными химическими свойствами -это
1) Са и К 2) Nа и К 3) В и С 4) С и О
А4. В каком ряду химические элементы расположены в порядке убывания их атомных радиусов?
1) N, C, B 2) N, P, As 3) Na, Mg, K 4) Si, C, N
А5. Наибольшей восстановительной активностью обладает
1) Si 2) Р 3) S 4) С1
А6. Формула высшего оксида, образованного элементом четвертой группы
1) ЭО 2 2) Э 2 О 3 3) ЭО 3 4) Э 2 О 5
А7. В ряду химических элементов Si─ Р ─ S
1) увеличивается число валентных электронов в атомах
2) уменьшается число валентных электронов в атомах
3) уменьшается электроотрицательность
4) увеличиваются радиусы атомов
А8. Притяжение электронов внешнего слоя к ядру увеличивается в ряду
1) Si-P-N 2) S-P-As 3) Na-K-Rb 4) Si-Ca-K
А. Элементы главной подгруппы имеют одинаковое число электронов на внешнем уровне
Б. В главных подгруппах восстановительная способность усиливается с уменьшением радиуса атома
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А10. Высшая степень окисления в ряду химических элементов хлор- бром-йод
1) увеличивается 2) не изменяется 3) уменьшается 4) изменяется периодически
А11. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Br- Se- K 2) Mg- Al- Si 3) N- Li- C 4) S- Cl – P
А12. В порядке усиления неметаллических свойств расположены
1) S-Se 2) Se-Br 3) Br-I 4) I-Te
А13. Наиболее сильными основными свойствами обладает гидроксид
1) КОН 2) NaOH 3) RbOH 4) CsOH
А14. Кислотные свойства наиболее выражены у
1) Br 2 O 7 2) SeO 3 3) As 2 O 5 4) GeO 2
В1. В ряду химических элементов Na ─ Mg─ А1:
1) уменьшаются заряды ядер атомов
2) увеличивается число электронов во внешнем электронном слое
3) уменьшается электроотрицательность
4) уменьшается радиус атомов
5) усиливаются металлические свойства
В2. В ряду химических элементов F─ Br ─ I:
1) все элементы имеют высшую степень окисления, равную номеру группы
2) ослабевают неметаллические свойства
3) увеличивается высшая степень окисления
4) увеличивается радиус атомов
5) образуют летучие водородные соединения с общей формулой НЭ
Вариант № 4
А1. Число электронов в атоме аргона равно числу электронов в ионе
1) Мg 2+ 2) Al 3+ 3)Na + 4) С1 ─
А2. Сходное строение внешнего электронного слоя имеют атомы серы и
1) фосфора 2) селена 3) германия 4) ванадия
А3. В ряду химических элементов:
алюминий→кремний→фосфор→сера радиус атома
1) увеличивается 3) не изменяется
2) уменьшается 4) сначала увеличивается, а потом уменьшается
А4. Способность отдавать электроны увеличивается в ряду
1) Si-P-S 2) S-P-Cl 3) Na-K-Rb 4) Ca-K-Na
А5. В ряду Ве-В-С-N происходит
1) уменьшение числа валентных электронов
2) уменьшение силы притяжения валентных электронов к ядру
3) увеличение электроотрицательности
4) увеличение радиуса атомов
А6. Металлические свойства усиливаются в ряду
1) Mg-Ca-Ba 2) Na-Mg-Al 3) K-Ca-Fe 4) Se-Ca-Mg
А7. Наибольшую энергию надо затратить на отрыв электрона от атома
1) серы 2) кремния 3) кальция 4) мышьяка
А. В главной подгруппе с ростом заряда ядра происходит ослабление кислотных свойств гидроксидов.
Б . В периоде с ростом заряда ядра происходит усиление неметаллических свойств элементов.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А9. Наиболее сильными основными свойствами обладает гидроксид
1) фосфора 2) кальция 3) магния 4) бария
А10. Элемент, проявляющий наиболее ярко выраженные металлические свойства
1) А1 2) Мg 3) Na 4) Si
А11. В ряду В→С→N→О окислительные свойства
1) ослабевают 2) усиливаются 3) не изменяются 4) изменяются периодически
А12. В главных подгруппах с повышением порядкового номера металлические свойства элемента
1) усиливаются 2) ослабевают 3) не изменяются 4) изменяются периодически
А13. В ряду Na→К→Rb→Cs способность металлов отдавать злектроны
1) ослабевает 2) усиливается 3) не изменяется 4) изменяется периодически
А14. Элемент, в атоме которого на внешнем уровне находится четыре электрона
1) бериллий 2) титан 3) германий 4) фосфор
В1. В ряду химических элементов Li ─ Ве ─ В:
1) уменьшаются заряды ядер атомов
2) увеличивается число электронов во внешнем электронном слое
3) уменьшается электроотрицательность
4) уменьшается радиус атомов
5) усиливаются металлические свойства
В2. Для элементов 3-го периода характерны
1) уменьшение радиуса атома при увеличении заряда ядра
2) одинаковое число валентных электронов
3) одинаковое число электронных уровней у атомов
4) увеличение кислотного характера высших гидроксидов, образованными этими элементами
5) одинаковое агрегатное состояние при обычных условиях
Ответы:
варианты |
||||
Задание | ||||
1) (2 балла). Атомные ядра были открыты:
А.Д.Менделеевым. В.Дж.Томсоном.
Б.Э.Резерфордом. Г.Д.Чедвигом.
2) (2 балла). Номер периода в Периодической системе определяется:
А). Зарядом ядра атома.
Б). Числом электронов в наружном слое атома.
В). Числом электронных слоёв в атоме.
Г). Числом электронов в атоме.
3*) (2 балла). Форму электронных орбиталей характеризует:
А). Главное квантовое число.
Б). Магнитное квантовое число.
В). Орбитальное квантовое число.
Г). Спиновое квантовое число.
4) (2балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергитических уровней:
А). S и Cl. Б). Be и B. В). Kr и Xe. Г). Mo и Se.
5) (2 балла). p-Элементом является:
А). Скандий. Б). Барий. В). Мышьяк. Г). Гелий.
6) (2 балла). Электронная конфигурация …3d104s2 соответствует элементу:
A). Кальцию. Б). Криптону. В). Кадмию. Г). Цинку.
7) (2 балла). Амфотерным гидроксидом является вещество, формула которого:
А). Zn(OH)2. Б). Mg(OH)2. В). Ca(OH)2 . Г). Cr(OH)2.
8) (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
А). Mg-Ca-Zn. Б). Al-Mg-Ca. В). Sr-Rb-K. Г).Ge-Si-Sb.
9) (2 балла). Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p1 образует высший оксид, соответствующий формуле:
А). Э2О. Б). Э2О3. В). ЭО2. Г). ЭО3.
10) (2 балла) Изотоп железа, в ядре которого содержится 22 нейтрона, обозначают:
А). 40/20Ca. Б). 42/20Ca. В). 44/20Ca. Г). 48/20Ca.
11) (9 баллов). Установите соответствие.
А).1s22s22p63s23p1 1). Алюминий.
Б).1s22s22p63s2 2). Калий.
В).1s22s22p63s23p63d104s24p4 3). Селен.
Г).1s22s22p63s23p64s1 4). Магний.
Формула высшего оксида.
1.Э2O 2. Э2О3 3. ЭО 4.ЭО3.
Формула высшего гидроксида
1.ЭOН 2. Э(ОН)2 3. Э(ОН)3 4.Н2ЭО4.
12) (3 балла). На основании положения в Периодической системе расположите элементы: Германий, Мышьяк, Сера, Фосфор – в порядке убывания окислительныхсвойств. Обьясните ответ.
13) (6 баллов). Как и почему в Периодической системе изменяются металлические свойства?
А). В пределах периода.
Б). В пределах главной подгруппы.
14).(7 баллов). Составьте электронную формулу элемента с порядковым номером 30 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
15) (5 баллов). Какие химические свойства характерны для оксида элемента 3-го периода, главной подгруппы VI группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
А1. Знак химическогоэлемента азота:
А)
Al б) N в) Na
г) O
А2. Название элемента
со знаком Fe:
А) Медь
б) Железо в) Золото г) Алюминий
А3. Сложное вещество
– это …
А) углекислый газ б) медь в)
водород г) кислород
А4. Относительная молекулярная масса наибольшая у вещества
С формулой:
А) H2S б) SO2 в) K2S г) CuS
А5.
Элемент третьего периода главной подгруппы II группы
Периодической системы химических элементов Д.И. Менделеева – это …
А) Алюминий б) Бериллий в) магний г) кальций
А6. Обозначение изотопа, в ядре которого содержится 8 протонов и
8 нейтронов:
А) 168О б) 178О в) 188О г)198О
А7. Атом химического элемента, электронная оболочка которого содержит
16 электронов:
А) Кислород б) Сера
в) Хлор
г) Натрий
А8. Два электронных слоя (энергетических уровня) содержит атом:
А) Бора
б) Калия в) Алюминия г) Магния
А9. Пара химических элементов, имеющих на внешнем энергетическом уровне
по 4 электрона:
А) P и C б) Si и Ca в) N и P г) C и Si
А11. Информацию о
числе энергетических (электронных) уровней
Атома элемента дает:
А) номер периода б) номер группы в)
порядковый номер г) относительная атомная масса
А10. Наименее электроотрицательный
элемент (из перечисленных):
А) Азот
б) Водород в) Хлор г) Фосфор
А12.Химический
элемент имеющий 20е;20р11;20n01
А) Mg
б) Na в) Вe г) Ca
В1. Атом или ион,
имеющий следующее распределение электронов по энергетическим уровням 2e8e:
А) Ne
б) Ca+2 в) Мg+2 г) Na+
В2. Выберите
химические элементы, расположенные по мере уменьшения металлических свойств:
А) Li, F, Na, O б) Li, Na, O, F
в) F, Na, O, Li г) F, O, Na, Li
В3. Ионы калия и
хлора имеют:
А) одинаковый заряд ядра
Б) одинаковую относительную
молекулярную массу
В) одинаковое общее число
электронов
Г) одинаковое число электронов на
внешнем энергетическом уровне
С1. Запишите схемы
образования соединений, состоящих из атомов химических элементов:
А)
водорода и фтора б) магния и хлора
Определите тип
химической связи в них
С2. Выпишите
соединения с ковалентной полярной связью: O2, Li, H2Se, K2O, BaCl2,
Fe, J2, FeS, HJ, SO3,
S, ZnО
относятся? Почему?
2) Напишите химические формулы высших оксидов элементов Mg и S. К каким оксидам (основным, кислотным или амфотерным) они относятся? Почему?
3)Напишите химические формулы высших оксидов элементов Ca и Cl. К каким оксидам (основным, кислотным или амфотерным) они относятся? Почему?
4)Напишите химические формулы высших оксидов элементов K и N. К каким оксидам (основным, кислотным или амфотерным) они относятся? Почему?
5)Напишите химические формулы высших оксидов элементов Si и Li. К каким оксидам (основным, кислотным или амфотерным) они относятся? Почему?
Вариант 2. ЧАСТЬ А. Тестовые задания с выбором ответа. ^ 1.(2 балла). Электронная формула атома элемента главной подгруппы IV группы, 3-го периодаПериодической системы: A. 1s22s22p2. Б. 1s22s22p63s23p4. В. 1s22s22p63s23p2. Г. 1s22s22p63s23p6. ^ 2.(2 балла). Высший оксид и гидроксид элемента главной подгруппы V группы Периодической системы соответствуют общим формулам: А. Э02 и Н2ЭО3. Б. Э03 и Н2ЭО4. В. Э2О5 и НЭО3. Г. Э2О7 и НЭО4. ^ 3.(2 балла). Окислительные свойства ослабевают в ряду элементов: А. Р-N-О-F. Б. С1-S-Р-As. В. Br-C1-F-I. Г. В-С-N-Р. 4.(2 балла). Электронная формула Is22s22p63s2 соответствует частице, обозначение которой: A.S0. Б.А13+. B.S4+. Г, Si0. 5.(2 балла). Ковалентная полярная связь образуется в соединении, формула которого: А. РН3. Б. Nal. B. 02. Г. S02 6.(2 балла). Валентность и степень окисления азота в азотной кислоте соответственно равны: А. Пять и +5. Б. Четыре и +5. В. Три и +5. Г. Три и + 3. 7.(2 балла). Атомную кристаллическую решетку имеет: А. Озон. Б. Алмаз. В. Кислород. Г. Водород. 8.(2 балла). Кислотные свойства в ряду соединений, формулы которых N2O5 - P2O5 - As2O5: ^ A.Изменяются периодически. Б. Не изменяются. B.Усиливаются. Г. Ослабевают. 9.(2 балла). Простое вещество сера взаимодействует с каждым из веществ ряда: А. НС1, Na, 02. Б. К, Zn, Na2SO4. В. Mg, 02, Н2. Г. А1, Н20, 02. 10. (2 балла). Схеме превращения С-4 → С+4 соот ветствует уравнение: А. СН4 + О2 = С + 2Н2О. Б. С + О2 = СО2. В. СН4 + 2О2 = СО2 + 2Н2О. ^ Г. С02 + С = 2СО. ЧАСТЬ Б. Задания со свободным ответом. 11. (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: NH3 ← N2 → NO → NO2 → HNO3. Укажите типы химических реакций. 12.(4 балла). Какой из газов займет больший объем (н. у.): 100 г углекислого газа или 5 г водорода? Ответ подтвердите расчетами. ^ 13.(4 балла). В каком соединении ковалентная связь будет более полярной: в метане или силане? Дайте обоснованный ответ. 14.(6 баллов). Расставьте коэффициенты в схеме реакции Р + H2SO4(KOH.) → Н3РО4 + SO2 + Н2О методом электронного баланса. Укажите окислитель и восстановитель. 15. (6 баллов). В кислоту, полученную при растворении 11,2 л газообразного хлорводорода (н. у.) в воде, поместили 13 г цинка. Вычислите объем выделившегося при этом газа (н. у.).
1. Какое простое вещество – образованное элементов №11, №12 или №13 – имеет наиболее ярко выраженные металлические свойства? Почему? Напишите формулы гидроксидов этих элементов и укажите их характер.
2. Укажите наиболее типичный металл и неметалл 4-го периода. Ответ обоснуйте.
Типичный металл четвертого периода – К, неметалл – Kr (металличность усиливается справа налево по периоду). Типичные металлы содержат на внешнем энергетическом уровне 1-2 электрона (у калия - 1), а неметаллы больше 4 (у криптона - 8).
3. Какое простое вещество – образованное элементом №14, №15 или №16 – имеет наиболее ярко выраженные неметаллические свойства? Почему? Напишите формулы кислот, соответствующих высшим оксидам этих элементов.
4. Элемент с постоянной валентностью, равной двум, расположен в 4-м периоде. Его оксид и гидроксид имеют основный характер. Какой это элемент? Каково строение его атома? Составьте формулы оксида и гидроксида этого химического элемента.
Ca. Строение атома 20 электронов, 20 протонов, 20 нейтронов. Заряд ядра +20. На внешнем энергетическомуровне два электрона. CaO – оксид кальция, Ca(OH)₂ - гидроксид кальция.
5. Укажите порядковый номер, заряд ядра и рассчитайте число протонов, нейтронов и электронов в томах: а) калия (41К); б) бериллия (9Be); в) магния (24Mg); г) кальция (42Ca); д) алюминия (27Al); е) титана (48Ti); ж) ванадия (51V); з) железа (56Fe).
6. Чем различается состав ядер изотопов: а) 63Cu и 65Cu; б) 107Ag и 109Ag? Дайте обоснованный ответ на основании расчетов.
7. Вычислите молярные массы веществ, формулы которых ₂SO, NO₃, O. Напишите формулы аналогичных соединений, содержащих изотоп H, и вычислите их молярные массы.
8. Сколько разных по массе молекул оксида серы (IV) может образоваться при взаимодействии изотопов 16О, 17О, 18О и 32S? Составьте формулы всех молекул и рассчитайте их молярные массы.
9. Напишите электронные формулы атомов: а) серы и натрия; б) аргона и калия; в) кальция и хлора; г) неона и алюминия; д) кремния и брома; е) мышьяка и углерода.
10. На основе теории строения атомов объясните причины периодичности изменения свойств элементов и их соединений. Ответ подтвердите конкретными примерами.
Свойства простых веществ и соединений элементов периодически повторяются, потому что периодически повторяются электронные конфигурации атомов. Так, у атомов Be, Mg, Ca, Sr, Ba строение внешней электронной оболочки одинаково, на ней находится 2 электрона. Эти элементы легко их отдают, проявляя восстановительные свойства и степень окисления +2.
11. Как объяснить, исходя из теории строения атомов, резкий переход от инертных газов к щелочным металлам?
У инертных газов внешний энергетический уровень является завершенным, после прибавления еще одного электрона к нему происходит заполнение другого энергетического уровня, который становится внешним. Один электрон на внешнем энергетическом уровне – характеристика щелочных металлов.
12. Определите место элементов в периодической таблице по электронным формулам их атомов: 1s2 2s2 2p6 3s2; 1s2 2s2 2p6 3s2 3p6; 1s2 2s2 2p6 3s2 3p6 4s2. Составьте формулы оксидов и гидроксидов и кислот, соответствующих этим элементам.

13. На основании положения в периодической таблице охарактеризуйте элементы калий, бром и алюминий.
14. Оксид элемента (металла 3-го периода) имеет молекулярную массу 102. Определите элемент и изобразите схему строения его атома. Напишите формулы оксида и гидроксида этого элемента и укажите их характер.
15. Рассчитайте массу (н.у.): а) 8,96 л газообразного соединения фтора с водородом; б) 13,44 л газообразного соединения фосфора с водородом; в) 17,92 л газообразного соединения серы с водородом.
16. Элементы А и Б принадлежат к одному периоду. Простое вещество, образованное элементов А, бурно реагирует с водой. Простое вещество, образованное элементом Б, представляет собой тяжелую ядовитую красно-бурую жидкость с неприятным запахом. О каких элементах идет речь?
Br – элемент Б (Br₂ - тяжелая ядовитая красно-бурая жидкость). К – элемент А, бурно реагирует с водой. Ca – тоже взаимодействует с водой, но не так бурно как К.
17. Вещество, используемое в качестве минерального удобрения, состоит из двух элементов - А и Б. соответствующее элементу А простое вещество – щелочной металл. Элемент А принадлежит к тому же периоду, что и элемент, образующий единственный неметалл, жидкий при обычных условиях. Элемент Б находится в VIIA-группе, его атомы входят в состав поваренной соли. Определите элементы А и Б и напишите: а) электронные формулы их атомов; б) формулу вещества, образующегося при их взаимодействии.
18. Элементы X и Y находятся во 2-м периоде. Простое вещество, образованное элементом Х, реагирует с водой с выделением водорода. Молекулярная масса водородного соединения элемента Y равна 20. Определите эти элементы и напишите: а) электронные формулы их атомов; б) уравнение взаимодействия простых веществ, образованных этими элементами; в) уравнение реакции гидроксида элемента Х с летучим водородным соединением элемента Y.
19. Какими химическими свойствами обладает элемент с порядковым номером 34? С каким элементом он наиболее сходен по свойствам? дайте обоснованный ответ на основании положения элементов в периодической таблице.
20. Найдите в периодической таблице элемент, расположенный в 4-м периоде, 5-ряду и проявляющий в соединении с кислородом валентность, равную шести. Какова его валентность в соединении с водородом? Напишите формулы этих соединений.
Se. SeO₃ – оксид селена (VI), H₂Se (валентность селена в соединении с водородом – II).