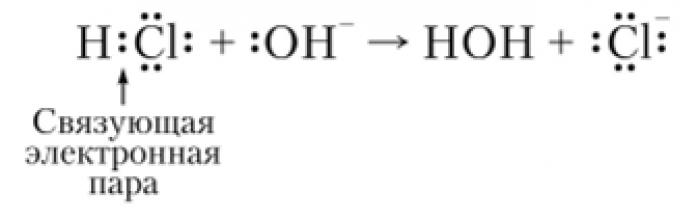Στον χώρο γύρω από τους πυρήνες σε σύγκριση με την κατανομή της πυκνότητας ηλεκτρονίων στα ουδέτερα άτομα που σχηματίζουν έναν δεδομένο δεσμό.
Τα λεγόμενα αποτελεσματικά φορτία στα άτομα χρησιμοποιούνται ως ποσοτικό μέτρο της πολικότητας του δεσμού.
Το ενεργό φορτίο ορίζεται ως η διαφορά μεταξύ του φορτίου των ηλεκτρονίων που βρίσκονται σε κάποια περιοχή του χώρου κοντά στον πυρήνα και του φορτίου του πυρήνα. Ωστόσο, αυτό το μέτρο έχει μόνο μια υπό όρους και κατά προσέγγιση έννοια, καθώς είναι αδύνατο να προσδιοριστεί με σαφήνεια μια περιοχή σε ένα μόριο που σχετίζεται αποκλειστικά με ένα μεμονωμένο άτομο και στην περίπτωση πολλών δεσμών, με έναν συγκεκριμένο δεσμό.
Η παρουσία ενός ενεργού φορτίου μπορεί να υποδηλωθεί με σύμβολα φορτίων στα άτομα (για παράδειγμα, H + δ - Cl - δ, όπου δ είναι ένα ορισμένο κλάσμα του στοιχειώδους φορτίου).
Σχεδόν όλοι οι χημικοί δεσμοί, με εξαίρεση τους δεσμούς σε διατομικά ομοπυρηνικά μόρια, είναι πολικοί στον έναν ή τον άλλο βαθμό. Οι ομοιοπολικοί δεσμοί είναι συνήθως ασθενώς πολικοί. Οι ιοντικοί δεσμοί είναι εξαιρετικά πολικοί.
δείτε επίσης
Πηγές
Ίδρυμα Wikimedia. 2010.
- πολικό βέλος
- Πολικές αποστολές
Δείτε τι είναι η "Πολικότητα των χημικών δεσμών" σε άλλα λεξικά:
Πολικότητα χημικών δεσμών- χαρακτηριστικό ενός χημικού δεσμού (Βλ. Χημικός δεσμός), που δείχνει την ανακατανομή της πυκνότητας ηλεκτρονίων στο χώρο κοντά στους πυρήνες σε σύγκριση με την αρχική κατανομή αυτής της πυκνότητας στα ουδέτερα άτομα που σχηματίζουν αυτόν τον δεσμό. ...
Πόλωση- Το Βικιλεξικό έχει ένα άρθρο "πολικότητα" Polarity (← λατ. polaris ← ... Wikipedia
Χημικός δεσμός- ... Βικιπαίδεια
Μόριο- Διάγραμμα ομοιοπολικών δεσμών μεταξύ ατόμων σε ένα μόριο οξυγόνου ... Wikipedia
Valence (χημική)- Σθένος (από το λατινικό valentia ≈ δύναμη), η ικανότητα ενός ατόμου να σχηματίζει χημικούς δεσμούς. Ένα ποσοτικό μέτρο ισχύος θεωρείται συνήθως ο αριθμός των άλλων ατόμων σε ένα μόριο με τα οποία ένα δεδομένο άτομο σχηματίζει δεσμούς. Το V. είναι μια από τις θεμελιώδεις έννοιες... ... Μεγάλη Σοβιετική Εγκυκλοπαίδεια
Σθένος- I Valence (από το λατινικό valentia force) είναι η ικανότητα ενός ατόμου να σχηματίζει χημικούς δεσμούς. Ένα ποσοτικό μέτρο ισχύος θεωρείται συνήθως ο αριθμός των άλλων ατόμων σε ένα μόριο με τα οποία ένα δεδομένο άτομο σχηματίζει δεσμούς. V. ένα από τα θεμελιώδη... ... Μεγάλη Σοβιετική Εγκυκλοπαίδεια
Κανόνας οκτάδας- Δεσμοί στο διοξείδιο του άνθρακα (CO2) όλα τα άτομα περιβάλλονται από 8 ηλεκτρόνια σύμφωνα με τον κανόνα της οκτάδας. Επομένως, το CO2 είναι ένα σταθερό μόριο. Ο κανόνας της οκτάδας (οκτάδα θεωρία) προτάθηκε από τον G. N. Lewis για να εξηγήσει τους λόγους ... ... Wikipedia
Δομική χημεία- Τμήμα δομικής χημείας, μια περιοχή χημείας που μελετά τη σχέση μεταξύ των διαφόρων φυσικών και φυσικοχημικών ιδιοτήτων διάφορες ουσίεςμε το δικό τους χημική δομήκαι αντιδραστικότητα. Η δομική χημεία δεν εξετάζει μόνο τη γεωμετρική... ... Wikipedia
Ηλεκτραρνητικότητα- (χ) θεμελιώδης χημική ιδιότηταάτομο, ένα ποσοτικό χαρακτηριστικό της ικανότητας ενός ατόμου σε ένα μόριο να μετατοπίζει κοινά ζεύγη ηλεκτρονίων προς τον εαυτό του. Η σύγχρονη έννοια της ηλεκτραρνητικότητας των ατόμων εισήχθη από τον Αμερικανό χημικό L. Pauling.... ... Wikipedia
Ισομέρεια- Να μην συγχέεται με την ισομέρεια ατομικούς πυρήνες. Ο ισομερισμός (από τα άλλα ελληνικά ἴσος «ίσος», και μέρος «μερίδιο, μέρος») είναι ένα φαινόμενο που συνίσταται στην ύπαρξη χημικών ενώσεων (ισομερών) πανομοιότυπων σε σύνθεση και μοριακό βάρος, αλλά ... ... Wikipedia
Όταν σχηματίζεται ομοιοπολικός δεσμός μεταξύ ανόμοιων ατόμων, το συνδετικό ζεύγος ηλεκτρονίων μετατοπίζεται προς το πιο ηλεκτραρνητικό άτομο. Αυτό οδηγεί στην πόλωση των μορίων, έτσι όλα τα διατομικά μόρια που αποτελούνται από ανόμοια στοιχεία αποδεικνύονται πολικά στον ένα ή τον άλλο βαθμό. Σε πιο πολύπλοκα μόρια, η πολικότητα εξαρτάται επίσης από τη γεωμετρία του μορίου. Για να εμφανιστεί η πολικότητα, είναι απαραίτητο τα κέντρα κατανομής θετικών και αρνητικών φορτίων να μην συμπίπτουν.
Στο μόριο CO 2, οι δεσμοί άνθρακα-οξυγόνου είναι πολικοί και το άτομο άνθρακα έχει ένα ορισμένο θετικό φορτίο και καθένα από τα άτομα οξυγόνου έχει το ίδιο αρνητικό φορτίο. Κατά συνέπεια, το κέντρο θετικού φορτίου συγκεντρώνεται στο άτομο άνθρακα. Δεδομένου ότι τα άτομα οξυγόνου βρίσκονται στην ίδια ευθεία γραμμή, αλλά και οι δύο πλευρές του ατόμου άνθρακα (γραμμικό μόριο) βρίσκονται σε ίσες αποστάσεις, τότε το θετικό φορτίο εξουδετερώνεται. Έτσι, παρά την πολικότητα κάθε δεσμού στο CO., ολόκληρο το μόριο ως σύνολο είναι μη πολικό και ο λόγος για αυτό είναι
Ρύζι. 434.Παραδείγματα της δομής και της πολικότητας των μορίων είναι η γραμμική δομή τους. Αντίθετα, το μόριο S=C=0 είναι πολικό, αφού οι δεσμοί άνθρακα-θείου και άνθρακα-οξυγόνου έχουν διαφορετικά μήκη και διαφορετικές πολικότητες. Στο Σχ. Το σχήμα 4.34 δείχνει τις δομές και τις πολικότητες ορισμένων μορίων.
Από τα παραπάνω παραδείγματα προκύπτει ότι εάν τα άτομα ή οι ομάδες ατόμων που συνδέονται με το κεντρικό άτομο είναι πανομοιότυπα ή βρίσκονται συμμετρικά σε σχέση με αυτό (γραμμικές, επίπεδες τριγωνικές, τετραεδρικές και άλλες δομές), τότε το μόριο θα είναι μη πολικό. Εάν άνισες ομάδες είναι συνδεδεμένες με το κεντρικό άτομο ή υπάρχει ασύμμετρη διάταξη ομάδων, τότε τα μόρια είναι πολικά.
Το αποτελεσματικό φορτίο των ατόμων στο μόριο είναι σημαντικό όταν εξετάζουμε τους πολικούς δεσμούς. Για παράδειγμα, στο μόριο HC1, το δεσμευτικό νέφος ηλεκτρονίων μετατοπίζεται προς το πιο ηλεκτραρνητικό άτομο χλωρίου, ως αποτέλεσμα του οποίου το φορτίο του πυρήνα του υδρογόνου δεν αντισταθμίζεται και στο άτομο χλωρίου η πυκνότητα ηλεκτρονίων γίνεται υπερβολική σε σύγκριση με το φορτίο του πυρήνα του. Επομένως, το άτομο υδρογόνου είναι θετικά πολωμένο και το άτομο χλωρίου είναι αρνητικά πολωμένο. Το άτομο υδρογόνου έχει θετικό φορτίο και το άτομο χλωρίου αρνητικό. Αυτό το φορτίο 8, που ονομάζεται ενεργό φορτίο, καθορίζεται συνήθως πειραματικά. Έτσι, για το υδρογόνο 8 H = +0,18 και για το χλώριο 5 C, = -0,18 απόλυτο φορτίο ηλεκτρονίων, ως αποτέλεσμα του οποίου ο δεσμός στο μόριο HC1 είναι 18% ιοντικός στη φύση (δηλαδή, ο βαθμός ιονισμού είναι 0,18 ) .
Δεδομένου ότι η πολικότητα του δεσμού εξαρτάται από το βαθμό μετατόπισης του δεσμού ζεύγους ηλεκτρονίων προς ένα πιο ηλεκτραρνητικό στοιχείο, πρέπει να ληφθούν υπόψη τα ακόλουθα:
- α) ηλεκτραρνητικότητα (EO) - όχι αυστηρή φυσική ποσότητα, το οποίο μπορεί να προσδιοριστεί άμεσα πειραματικά.
- β) η τιμή της ηλεκτραρνητικότητας δεν είναι σταθερή, αλλά εξαρτάται από τη φύση του άλλου ατόμου με το οποίο είναι συνδεδεμένο το άτομο.
- γ) το ίδιο άτομο σε έναν δεδομένο χημικό δεσμό μπορεί μερικές φορές να λειτουργήσει και ως ηλεκτροθετικό και ως ηλεκτραρνητικό.
Πειραματικά δεδομένα υποδηλώνουν ότι στα στοιχεία μπορούν να αποδοθούν τιμές σχετικής ηλεκτραρνητικότητας (REV), η χρήση των οποίων επιτρέπει σε κάποιον να κρίνει τον βαθμό πολικότητας των δεσμών μεταξύ των ατόμων σε ένα μόριο (βλ. επίσης παραγράφους 3.6 και 4.3).
Σε ένα μόριο που αποτελείται από δύο άτομα, όσο υψηλότερη είναι η OEO ενός από αυτά, τόσο μεγαλύτερη είναι η πολικότητα του ομοιοπολικού δεσμού· επομένως, όσο αυξάνεται η OEO του δεύτερου στοιχείου, αυξάνεται ο βαθμός ιονισμού της ένωσης.
Για χαρακτηριστικά αντιδραστικότηταμόρια, όχι μόνο η φύση της κατανομής της πυκνότητας ηλεκτρονίων είναι σημαντική, αλλά και η πιθανότητα αλλαγής της υπό την επίδραση εξωτερικών επιρροών. Μέτρο αυτής της αλλαγής είναι η πολικότητα του δεσμού, δηλ. την ικανότητά του να γίνεται πολικό ή ακόμα πιο πολικό. Η πόλωση της σύνδεσης συμβαίνει και υπό την επίδραση εξωτερικών ηλεκτρικό πεδίο, και υπό την επίδραση ενός άλλου μορίου που είναι εταίρος αντίδρασης. Το αποτέλεσμα αυτών των επιρροών μπορεί να είναι η πόλωση της σύνδεσης, συνοδευόμενη από την πλήρη ρήξη της. Σε αυτή την περίπτωση, το δεσμευτικό ζεύγος ηλεκτρονίων παραμένει με το πιο ηλεκτραρνητικό άτομο, το οποίο οδηγεί στο σχηματισμό διαφορετικών ιόντων. Αυτός ο τύπος διάσπασης δεσμού ονομάζεται τετραλυτική. Για παράδειγμα:

Στο παραπάνω παράδειγμα διάσπασης ασύμμετρου δεσμού, το υδρογόνο εξαλείφεται με τη μορφή ιόντος Η+ και το ζεύγος δεσμών ηλεκτρονίων παραμένει με το χλώριο, οπότε το τελευταίο μετατρέπεται στο ανιόν C1.
Εκτός από αυτόν τον τύπο διάσπασης δεσμού, είναι επίσης δυνατή μια συμμετρική διάσπαση, όταν δεν σχηματίζονται ιόντα, αλλά άτομα και ρίζες. Αυτός ο τύπος διάσπασης δεσμού ονομάζεται ομολυτική.
Ηλεκτραρνητικότητα ατόμων στοιχείων.Σχετική ηλεκτραρνητικότητα. Αλλαγές σε περιόδους και ομάδες του Περιοδικού Συστήματος. Πολικότητα χημικών δεσμών, πολικότητα μορίων και ιόντων.
Η ηλεκτροαρνητικότητα (e.o.) είναι η ικανότητα ενός ατόμου να μετατοπίζει ζεύγη ηλεκτρονίων προς τον εαυτό του.
Meroy ε.ο. είναι η ενέργεια αριθμητικά ίση με το ½ άθροισμα της ενέργειας ιοντισμού I και της ενέργειας συγγένειας ηλεκτρονίων E
Η Ε.Ο. = ½ (I+E)
Σχετική ηλεκτραρνητικότητα. (OEO)
Στο φθόριο, ως το ισχυρότερο στοιχείο EO, αποδίδεται μια τιμή 4,00 σε σχέση με την οποία λαμβάνονται υπόψη τα υπόλοιπα στοιχεία.
Αλλαγές σε περιόδους και ομάδες του Περιοδικού Πίνακα.
Μέσα σε περιόδους, καθώς το πυρηνικό φορτίο αυξάνεται από αριστερά προς τα δεξιά, αυξάνεται η ηλεκτραρνητικότητα.
ΕλάχισταΣημασία παρατηρείται για τα μέταλλα αλκαλίων και αλκαλικών γαιών.
Μεγαλύτερο- για αλογόνα.
Όσο μεγαλύτερη είναι η ηλεκτραρνητικότητα, τόσο πιο έντονες είναι οι μη μεταλλικές ιδιότητες των στοιχείων.
Η ηλεκτροαρνητικότητα (χ) είναι μια θεμελιώδης χημική ιδιότητα ενός ατόμου, ένα ποσοτικό χαρακτηριστικό της ικανότητας ενός ατόμου σε ένα μόριο να μετατοπίζει κοινά ζεύγη ηλεκτρονίων προς τον εαυτό του.
Η σύγχρονη έννοια της ηλεκτραρνητικότητας των ατόμων εισήχθη από τον Αμερικανό χημικό L. Pauling. Ο L. Pauling χρησιμοποίησε την έννοια της ηλεκτραρνητικότητας για να εξηγήσει το γεγονός ότι η ενέργεια της ετεροατομικής Συνδέσεις A-B(Α, Β - σύμβολα οποιουδήποτε χημικά στοιχεία) είναι γενικά μεγαλύτερη από τη γεωμετρική μέση τιμή του ομοατομικού Συνδέσεις Α-Ακαι Β-Β.
Η υψηλότερη αξία της ε.ο. φθόριο, και το χαμηλότερο είναι το καίσιο.
Ο θεωρητικός ορισμός της ηλεκτραρνητικότητας προτάθηκε από τον Αμερικανό φυσικό R. Mulliken. Με βάση την προφανή πρόταση ότι η ικανότητα ενός ατόμου σε ένα μόριο να προσελκύει ένα ηλεκτρονικό φορτίο εξαρτάται από την ενέργεια ιονισμού του ατόμου και τη συγγένεια ηλεκτρονίων του, ο R. Mulliken εισήγαγε την ιδέα της ηλεκτραρνητικότητας του ατόμου Α ως μέση τιμή της ενέργειας δέσμευσης των εξωτερικών ηλεκτρονίων κατά τον ιονισμό των καταστάσεων σθένους (για παράδειγμα, από το A− στο A+) και σε αυτή τη βάση πρότεινε μια πολύ απλή σχέση για την ηλεκτραρνητικότητα ενός ατόμου:
όπου J1A και εΑ είναι η ενέργεια ιοντισμού του ατόμου και η συγγένεια ηλεκτρονίων του, αντίστοιχα.
Αυστηρά μιλώντας, δεν μπορεί να εκχωρηθεί σταθερή ηλεκτραρνητικότητα σε ένα στοιχείο. Η ηλεκτραρνητικότητα ενός ατόμου εξαρτάται από πολλούς παράγοντες, ιδίως από την κατάσταση σθένους του ατόμου, την τυπική κατάσταση οξείδωσης, τον αριθμό συντονισμού, τη φύση των προσδεμάτων που συνθέτουν το περιβάλλον του ατόμου στο μοριακό σύστημα και μερικούς οι υπολοιποι. Πρόσφατα, η λεγόμενη τροχιακή ηλεκτραρνητικότητα χρησιμοποιείται όλο και περισσότερο για τον χαρακτηρισμό της ηλεκτραρνητικότητας, ανάλογα με τον τύπο του ατομικού τροχιακού που εμπλέκεται στο σχηματισμό ενός δεσμού και με τον πληθυσμό ηλεκτρονίων του, δηλ. καταλαμβάνεται μεμονωμένα από ένα ασύζευκτο ηλεκτρόνιο ή είναι κενό. Όμως, παρά τις γνωστές δυσκολίες στην ερμηνεία και τον προσδιορισμό της ηλεκτραρνητικότητας, παραμένει πάντα απαραίτητο για μια ποιοτική περιγραφή και πρόβλεψη της φύσης των δεσμών σε ένα μοριακό σύστημα, συμπεριλαμβανομένης της ενέργειας δέσμευσης, της ηλεκτρονικής κατανομής φορτίου και του βαθμού ιονισμού, της σταθεράς δύναμης, κ.λπ. από τα πιο ανεπτυγμένα στην Η τρέχουσα προσέγγιση είναι η προσέγγιση Sanderson. Αυτή η προσέγγιση βασίζεται στην ιδέα της εξίσωσης της ηλεκτραρνητικότητας των ατόμων κατά το σχηματισμό ενός χημικού δεσμού μεταξύ τους. Πολυάριθμες μελέτες έχουν βρει σχέσεις μεταξύ της ηλεκτραρνητικότητας Sanderson και της πιο σημαντικής ΦΥΣΙΚΕΣ ΚΑΙ ΧΗΜΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ανόργανες ενώσειςη συντριπτική πλειοψηφία των στοιχείων του περιοδικού πίνακα. Μια τροποποίηση της μεθόδου του Sanderson, που βασίζεται στην ανακατανομή της ηλεκτραρνητικότητας μεταξύ των ατόμων του μορίου για οργανικές ενώσεις, αποδείχθηκε επίσης πολύ γόνιμη.
2) Πολικότητα χημικών δεσμών, πολικότητα μορίων και ιόντων.
Τι υπάρχει στην περίληψη και στο σχολικό βιβλίο - Η πολικότητα συνδέεται με τη διπολική ροπή. Εκδηλώνεται ως αποτέλεσμα της μετατόπισης ενός κοινού ζεύγους ηλεκτρονίων σε ένα από τα άτομα. Η πολικότητα εξαρτάται επίσης από τη διαφορά στην ηλεκτραρνητικότητα των συνδεδεμένων ατόμων Όσο μεγαλύτερη είναι η τιμή του ε.ο. δύο άτομα, τόσο πιο πολικός είναι ο χημικός δεσμός μεταξύ τους. Ανάλογα με το πώς ανακατανέμεται η πυκνότητα των ηλεκτρονίων κατά το σχηματισμό ενός χημικού δεσμού, διακρίνονται διάφοροι τύποι. Η περιοριστική περίπτωση πόλωσης ενός χημικού δεσμού είναι η πλήρης μετάβαση από ένα άτομο σε άλλο.
Στην περίπτωση αυτή σχηματίζονται δύο ιόντα μεταξύ των οποίων προκύπτει ιονικός δεσμός Για να μπορέσουν δύο άτομα να δημιουργήσουν ιοντικό δεσμό είναι απαραίτητο η ε.ο. ήταν πολύ διαφορετικοί.Αν ε.ο. είναι ίσοι, τότε σχηματίζεται ένας μη πολικός ομοιοπολικός δεσμός Ο πιο συνηθισμένος είναι ένας πολικός ομοιοπολικός δεσμός - σχηματίζεται μεταξύ οποιωνδήποτε ατόμων που έχουν διαφορετική σημασίαε.ο.
Μια ποσοτική εκτίμηση της πολικότητας ενός δεσμού μπορεί να είναι τα ενεργά φορτία των ατόμων Το ενεργό φορτίο ενός ατόμου χαρακτηρίζεται από τη διαφορά μεταξύ του αριθμού των ηλεκτρονίων που ανήκουν σε ένα δεδομένο άτομο σε μια χημική ένωση και του αριθμού των ηλεκτρονίων μιας ελεύθερης άτομο Το άτομο ενός πιο ηλεκτραρνητικού στοιχείου έλκει τα ηλεκτρόνια πιο έντονα, έτσι τα ηλεκτρόνια είναι πιο κοντά σε αυτό και λαμβάνει ένα ορισμένο αρνητικό φορτίο, το οποίο ονομάζεται αποτελεσματικό, και ο συνεργάτης του έχει το ίδιο θετικό ενεργό φορτίο. Εάν τα ηλεκτρόνια σχηματίζουν ένα Ο δεσμός μεταξύ των ατόμων ανήκει εξίσου σε αυτά, τα ενεργά φορτία είναι μηδενικά.
Για τα διατομικά μόρια, η πολικότητα του δεσμού μπορεί να χαρακτηριστεί και τα ενεργά φορτία των ατόμων μπορούν να προσδιοριστούν με βάση τη μέτρηση της διπολικής ροπής M=q*r όπου q είναι το φορτίο του διπολικού πόλου, ίσο με το ενεργό φορτίο για ένα διατομικό μόριο, και r είναι η διαπυρηνική απόσταση.Η διπολική ροπή του δεσμού είναι ένα διανυσματικό μέγεθος. Κατευθύνεται από το θετικά φορτισμένο μέρος του μορίου στο αρνητικό του μέρος.Το ενεργό φορτίο σε ένα άτομο ενός στοιχείου δεν συμπίπτει με την κατάσταση οξείδωσης.
Η πολικότητα των μορίων καθορίζει σε μεγάλο βαθμό τις ιδιότητες των ουσιών. Τα πολικά μόρια στρέφονται το ένα προς το άλλο με αντίθετα φορτισμένους πόλους, και μεταξύ τους προκύπτει αμοιβαία έλξη. Επομένως, οι ουσίες που σχηματίζονται από πολικά μόρια έχουν υψηλότερα σημεία τήξης και βρασμού από ουσίες των οποίων τα μόρια είναι μη πολικά.
Τα υγρά των οποίων τα μόρια είναι πολικά έχουν μεγαλύτερη διαλυτική ισχύ. Επιπλέον, όσο μεγαλύτερη είναι η πολικότητα των μορίων του διαλύτη, τόσο μεγαλύτερη είναι η διαλυτότητα των πολικών ή ιοντικών ενώσεων σε αυτό. Αυτή η εξάρτηση εξηγείται από το γεγονός ότι τα μόρια των πολικών διαλυτών, λόγω αλληλεπιδράσεων διπόλου-διπόλου ή ιόντος-διπόλου με τη διαλυμένη ουσία, συμβάλλουν στην αποσύνθεση της διαλυμένης ουσίας σε ιόντα. Για παράδειγμα, ένα διάλυμα υδροχλωρίου σε νερό, του οποίου τα μόρια είναι πολικά, έχει καλή αγωγή ηλεκτρική ενέργεια. Ένα διάλυμα υδροχλωρίου σε βενζόλιο δεν έχει αισθητή ηλεκτρική αγωγιμότητα. Αυτό υποδηλώνει την απουσία ιοντισμού του υδροχλωρίου σε ένα διάλυμα βενζολίου, καθώς τα μόρια του βενζολίου είναι μη πολικά.
Τα ιόντα, όπως ένα ηλεκτρικό πεδίο, έχουν μια πολωτική επίδραση μεταξύ τους. Όταν δύο ιόντα συναντώνται, συμβαίνει η αμοιβαία πόλωση τους, δηλ. μετατόπιση ηλεκτρονίων στα εξωτερικά στρώματα σε σχέση με τους πυρήνες. Η αμοιβαία πόλωση των ιόντων εξαρτάται από τα φορτία του πυρήνα και του ιόντος, την ακτίνα του ιόντος και άλλους παράγοντες.
Εντός ομάδων ε.ο. μειώνεται.
Οι μεταλλικές ιδιότητες των στοιχείων αυξάνονται.
Μεταλλικά στοιχεία εξωτερικά επίπεδο ενέργειαςπεριέχουν 1,2,3 ηλεκτρόνια και χαρακτηρίζονται από χαμηλά δυναμικά ιοντισμού και ε.ο. επειδή τα μέταλλα παρουσιάζουν έντονη τάση να χάνουν ηλεκτρόνια.
Τα μη μεταλλικά στοιχεία έχουν υψηλότερη ενέργεια ιονισμού.
Καθώς το εξωτερικό περίβλημα των μη μετάλλων μέσα στις περιόδους γεμίζει, η ακτίνα των ατόμων μειώνεται. Στο εξωτερικό περίβλημα ο αριθμός των ηλεκτρονίων είναι 4,5,6,7,8.
Πολικότητα ενός χημικού δεσμού. Πολικότητα μορίων και ιόντων.
Η πολικότητα ενός χημικού δεσμού καθορίζεται από τη μετατόπιση των δεσμών ενός ζεύγους ηλεκτρονίων σε ένα από τα άτομα.
Ένας χημικός δεσμός προκύπτει λόγω της ανακατανομής των ηλεκτρονίων στα τροχιακά σθένους, με αποτέλεσμα το σχηματισμό ενός σταθερού ηλεκτρονική διαμόρφωσηευγενές αέριο, λόγω του σχηματισμού ιόντων ή του σχηματισμού κοινών ζευγών ηλεκτρονίων.
Ένας χημικός δεσμός χαρακτηρίζεται από ενέργεια και μήκος.
Ένα μέτρο της ισχύος ενός δεσμού είναι η ενέργεια που δαπανάται για να σπάσει ο δεσμός.
Για παράδειγμα. H – H = 435 kJmol-1
Ηλεκτραρνητικότητα ατομικών στοιχείων
Η ηλεκτροαρνητικότητα είναι μια χημική ιδιότητα ενός ατόμου, ένα ποσοτικό χαρακτηριστικό της ικανότητας ενός ατόμου σε ένα μόριο να προσελκύει ηλεκτρόνια από άτομα άλλων στοιχείων.
Σχετική ηλεκτραρνητικότητα
Η πρώτη και πιο διάσημη κλίμακα σχετικής ηλεκτραρνητικότητας είναι η κλίμακα L. Pauling, που λήφθηκε από θερμοχημικά δεδομένα και προτάθηκε το 1932. Η τιμή ηλεκτραρνητικότητας του πιο ηλεκτραρνητικού στοιχείου φθορίου, (F) = 4,0, λαμβάνεται αυθαίρετα ως σημείο εκκίνησης σε αυτό κλίμακα.
Στοιχεία ομάδας VIII Περιοδικός Πίνακας(ευγενή αέρια) έχουν μηδενική ηλεκτραρνητικότητα.
Το συμβατικό όριο μεταξύ μετάλλων και μη μετάλλων θεωρείται ότι είναι μια σχετική τιμή ηλεκτραρνητικότητας 2.
Η ηλεκτραρνητικότητα των στοιχείων του περιοδικού πίνακα, κατά κανόνα, αυξάνεται διαδοχικά από αριστερά προς τα δεξιά σε κάθε περίοδο. Σε κάθε ομάδα, με λίγες εξαιρέσεις, η ηλεκτραρνητικότητα μειώνεται σταθερά από πάνω προς τα κάτω. Η ηλεκτροαρνητικότητα μπορεί να χρησιμοποιηθεί για τον χαρακτηρισμό ενός χημικού δεσμού.
Οι δεσμοί με μικρότερη διαφορά στην ηλεκτραρνητικότητα των ατόμων ταξινομούνται ως πολικοί ομοιοπολικοί δεσμοί. Όσο μικρότερη είναι η διαφορά στην ηλεκτραρνητικότητα των ατόμων που σχηματίζουν έναν χημικό δεσμό, τόσο χαμηλότερος είναι ο βαθμός ιονισμού αυτού του δεσμού. Μια μηδενική διαφορά στην ηλεκτραρνητικότητα των ατόμων υποδηλώνει την απουσία ιοντικού χαρακτήρα στον δεσμό που σχηματίζεται από αυτά, δηλαδή την καθαρά ομοιοπολική φύση του.
Πολικότητα χημικού δεσμού, πολικότητα μορίων και ιόντων
Η πολικότητα των χημικών δεσμών, χαρακτηριστικό ενός χημικού δεσμού, που δείχνει την ανακατανομή της πυκνότητας ηλεκτρονίων στο χώρο κοντά στους πυρήνες σε σύγκριση με την αρχική κατανομή αυτής της πυκνότητας στα ουδέτερα άτομα που σχηματίζουν αυτόν τον δεσμό.
Σχεδόν όλοι οι χημικοί δεσμοί, με εξαίρεση τους δεσμούς σε διατομικά ομοπυρηνικά μόρια, είναι πολικοί στον έναν ή τον άλλο βαθμό. Τυπικά, οι ομοιοπολικοί δεσμοί είναι ασθενώς πολικοί, οι ιοντικοί δεσμοί είναι εξαιρετικά πολικοί.
Για παράδειγμα:
ομοιοπολικά μη πολικά: Cl2, O2, N2, H2, Br2
ομοιοπολικά πολικά: H2O, SO2, HCl, NH3, κ.λπ.
Στα ομοπυρηνικά μόρια (H 2 , F 2 , κ.λπ.), το ζεύγος ηλεκτρονίων που σχηματίζει δεσμό ανήκει εξίσου σε κάθε άτομο, επομένως τα κέντρα θετικών και αρνητικών φορτίων στο μόριο συμπίπτουν. Τέτοια μόρια είναι μη πολικά.
Ωστόσο, στα ετεροπυρηνικά μόρια η συμβολή στη σύζευξη των κυματοσυναρτήσεων διαφορετικά άτομαδεν είναι το ίδιο. Κοντά σε ένα από τα άτομα, εμφανίζεται μια υπερβολική πυκνότητα ηλεκτρονίων, επομένως, ένα υπερβολικό αρνητικό φορτίο και κοντά στο άλλο - ένα θετικό. Σε αυτή την περίπτωση, μιλούν για τη μετατόπιση ενός ζεύγους ηλεκτρονίων από το ένα άτομο στο άλλο, αλλά αυτό δεν πρέπει να κατανοηθεί κυριολεκτικά, αλλά μόνο ως αύξηση της πιθανότητας εύρεσης ζεύγους ηλεκτρονίων κοντά σε έναν από τους πυρήνες του μορίου.
Για να προσδιοριστεί η κατεύθυνση μιας τέτοιας μετατόπισης και να εκτιμηθεί ημιποσοτικά το μέγεθός της, εισάγεται η έννοια της ηλεκτραρνητικότητας.
Υπάρχουν διάφορες κλίμακες ηλεκτραρνητικότητας. Ωστόσο, τα στοιχεία είναι διατεταγμένα με την ίδια σειρά στη σειρά ηλεκτραρνητικότητας, επομένως οι διαφορές είναι ασήμαντες και οι κλίμακες ηλεκτραρνητικότητας είναι αρκετά συγκρίσιμες.
Η ηλεκτροαρνητικότητα σύμφωνα με τον R. Mulliken είναι το ήμισυ του αθροίσματος των ενεργειών ιονισμού και της συγγένειας ηλεκτρονίων (βλ. ενότητα 2.10.3):
Το ζεύγος ηλεκτρονίων σθένους μετατοπίζεται στο πιο ηλεκτραρνητικό άτομο.
Είναι πιο βολικό να χρησιμοποιείτε σχετικές παρά απόλυτες τιμές ηλεκτραρνητικότητας. Η ηλεκτραρνητικότητα του λιθίου 3 Li λαμβάνεται ως μία. Η σχετική ηλεκτραρνητικότητα οποιουδήποτε στοιχείου Α είναι ίση με:
Τα βαρέα αλκαλικά μέταλλα έχουν τη χαμηλότερη ηλεκτραρνητικότητα (XFr = 0,7). Το πιο ηλεκτραρνητικό στοιχείο είναι το φθόριο (X F = 4,0). Ανά περιόδους, υπάρχει μια γενική τάση αύξησης της ηλεκτραρνητικότητας και κατά υποομάδες - μείωσή της (Πίνακας 3.4).
Στο πρακτική χρήσηΤα δεδομένα από αυτόν τον πίνακα (καθώς και δεδομένα από άλλες κλίμακες ηλεκτραρνητικότητας) πρέπει να ληφθούν υπόψη ότι σε μόρια που αποτελούνται από τρία ή περισσότερα άτομα, η τιμή ηλεκτραρνητικότητας μπορεί να αλλάξει αισθητά υπό την επίδραση γειτονικών ατόμων. Αυστηρά μιλώντας, σε ένα στοιχείο δεν μπορεί να εκχωρηθεί καθόλου σταθερή ηλεκτραρνητικότητα. Εξαρτάται από την κατάσταση σθένους του στοιχείου, τον τύπο της ένωσης κ.λπ. Ωστόσο, αυτή η έννοια είναι χρήσιμη για μια ποιοτική εξήγηση των ιδιοτήτων των χημικών δεσμών και ενώσεων.
Πίνακας 3.4
Ηλεκτραρνητικότητα των στοιχείων s και p σύμφωνα με τον Pauling
|
Περίοδος |
Ομάδα |
||||||
Η πολικότητα του δεσμού καθορίζεται από τη μετατόπιση του ζεύγους ηλεκτρονίων σθένους σε διατομικά μόρια και χαρακτηρίζεται ποσοτικά διπολη ΣΤΙΓΜΗ,ή ηλεκτρική διπολική στιγμή, μόρια. Είναι ίσο με το γινόμενο της απόστασης μεταξύ των πυρήνων σολστο μόριο και το ενεργό φορτίο 5 που αντιστοιχεί σε αυτή την απόσταση:
Επειδή η σολθεωρείται διάνυσμα που κατευθύνεται από το θετικό στο αρνητικό φορτίο, η διπολική ροπή είναι επίσης διάνυσμα και έχει την ίδια κατεύθυνση. Η μονάδα διπολικής ροπής είναι debye D (1D = 3,33 Yu -30 C m).
Η διπολική ροπή ενός μιγαδικού μορίου ορίζεται ως διανυσματικό άθροισμαδιπολικές ροπές όλων των δεσμών. Επομένως, εάν το μόριο ΑΒ είναι συμμετρικό ως προς τη γραμμή κάθε δεσμού, η συνολική διπολική ροπή ενός τέτοιου μορίου, παρά την πολικότητα
η ισχύς των δεσμών Α-Β είναι ίση με μηδέν: D = ^ D; = 0. Τα παραδείγματα περιλαμβάνουν
ζωντανά θεωρούμενα προηγουμένως συμμετρικά μόρια, οι δεσμοί στους οποίους σχηματίζονται από υβριδικά τροχιακά: BeF 2, BF 3, CH 4, SF 6, κ.λπ.
Τα μόρια στα οποία σχηματίζονται δεσμοί από μη υβριδικά τροχιακά ή υβριδικά τροχιακά που περιλαμβάνουν μεμονωμένα ζεύγη ηλεκτρονίων είναι ασύμμετρα ως προς τις γραμμές δεσμού. Οι διπολικές ροπές τέτοιων μορίων δεν είναι μηδενικές. Παραδείγματα τέτοιων πολικών μορίων: H 2 S, NH 3, H 2 0, κ.λπ. Στο Σχ. Το σχήμα 3.18 δείχνει μια γραφική ερμηνεία της άθροισης των διανυσμάτων πολικών δεσμών σε ένα συμμετρικό μόριο BeF 2 (fl) και ένα ασύμμετρο μόριο H 2 S (σι).

Ρύζι. 3.18.Διπολικές ροπές μορίων BeF 2 (a) και H 2 S (b).
Όπως έχει ήδη σημειωθεί, όσο μεγαλύτερη είναι η διαφορά στην ηλεκτραρνητικότητα των ατόμων που σχηματίζουν έναν δεσμό, τόσο πιο έντονα μετατοπίζεται το ζεύγος ηλεκτρονίων σθένους, τόσο πιο πολικός είναι ο δεσμός και, επομένως, τόσο μεγαλύτερο είναι το ενεργό φορτίο b, όπως φαίνεται στον Πίνακα. 3.5.
Πίνακας 3.5
Αλλαγή στη φύση του δεσμού σε μια σειρά ενώσεων στοιχείων περιόδου II με φθόριο
Σε έναν πολικό δεσμό, δύο συστατικά μπορούν να διακριθούν χονδρικά: ιοντικά, λόγω ηλεκτροστατικής έλξης, και ομοιοπολικά, λόγω επικαλυπτόμενων τροχιακών.Καθώς αυξάνεται η διαφορά ηλεκτραρνητικότητας OHτο ζεύγος ηλεκτρονίων σθένους μετατοπίζεται όλο και περισσότερο προς το άτομο φθορίου, το οποίο αποκτά ένα ολοένα και πιο αρνητικό αποτελεσματικό φορτίο. Η συμβολή του ιοντικού συστατικού στον δεσμό αυξάνεται και το μερίδιο του ομοιοπολικού συστατικού μειώνεται. Οι ποσοτικές αλλαγές μετατρέπονται σε ποιοτικές: στο μόριο UF, το ζεύγος ηλεκτρονίων ανήκει σχεδόν εξ ολοκλήρου στο φθόριο και το ενεργό φορτίο του προσεγγίζει τη μονάδα, δηλ. στο φορτίο του ηλεκτρονίου. Μπορούμε να υποθέσουμε ότι σχηματίστηκαν δύο ιόντα: το κατιόν Li + και το ανιόν F~,και η σύνδεση οφείλεται μόνο στην ηλεκτροστατική τους έλξη (η ομοιοπολική συνιστώσα μπορεί να παραμεληθεί). Αυτή η σύνδεση ονομάζεται ιωνικός.Μπορεί να θεωρηθεί ως μια ακραία περίπτωση πολικού ομοιοπολικού δεσμού.
Το ηλεκτροστατικό πεδίο δεν έχει προτιμώμενες κατευθύνσεις. Να γιατί ιοντικός δεσμόςσε αντίθεση με το ομοιοπολικό η κατευθυντικότητα δεν είναι χαρακτηριστική.Ένα ιόν αλληλεπιδρά με οποιονδήποτε αριθμό ιόντων αντίθετου φορτίου. Αυτό εξηγεί μια άλλη διακριτική ιδιότητα του ιοντικού δεσμού - έλλειψη κορεσμού.
Για ιοντικά μόριαμπορεί να υπολογιστεί η δεσμευτική ενέργεια. Αν θεωρήσουμε τα ιόντα ως μη παραμορφώσιμες σφαίρες με φορτία ±ε,τότε η δύναμη έλξης μεταξύ τους εξαρτάται από την απόσταση μεταξύ των κέντρων των ιόντων σολμπορεί να εκφραστεί με την εξίσωση Coulomb:
Η ενέργεια της έλξης καθορίζεται από τη σχέση 
Κατά την προσέγγιση, εμφανίζεται μια απωθητική δύναμη λόγω της αλληλεπίδρασης κελύφη ηλεκτρονίων. Είναι αντιστρόφως ανάλογο της απόστασης από την ισχύ Π:
Οπου ΣΕ- κάποια σταθερά. Εκθέτης Πείναι σημαντικά μεγαλύτερη από τη μονάδα και για διάφορες διαμορφώσεις ιόντων βρίσκεται στην περιοχή από 5 έως 12. Λαμβάνοντας υπόψη ότι η δύναμη είναι η παράγωγος της ενέργειας ως προς την απόσταση, από την εξίσωση (3.6) λαμβάνουμε:

Με αλλαγή σολαλλαγή FnpΚαι Fqtt.Ξέμακρα g 0αυτές οι δυνάμεις εξισώνονται, που αντιστοιχεί στο ελάχιστο της προκύπτουσας ενέργειας αλληλεπίδρασης U Q .Μετά τις μεταμορφώσεις μπορείτε να πάρετε
Αυτή η εξίσωση είναι γνωστή ως εξίσωση Born.
Ελάχιστο στην καμπύλη εξάρτησης U=f(r)αντιστοιχούν στην απόσταση ισορροπίας r 0 και την ενέργεια U Q .Αυτή είναι η ενέργεια δέσμευσης μεταξύ των ιόντων. Ακόμη και Πείναι άγνωστο, τότε μπορούμε να υπολογίσουμε την ενέργεια δέσμευσης παίρνοντας 1 /Πίσο με μηδέν:

Το σφάλμα δεν θα υπερβαίνει το 20%.
Για ιόντα με φορτία z lκαι z 2 οι εξισώσεις (3.7) και (3.8) έχουν τη μορφή:

Δεδομένου ότι σε μόρια αυτού του τύπου η ύπαρξη δεσμού που πλησιάζει έναν καθαρά ιοντικό είναι προβληματική, οι τελευταίες εξισώσεις θα πρέπει να θεωρηθούν μια πολύ πρόχειρη προσέγγιση.
Ταυτόχρονα, τα προβλήματα της πολικότητας και της ιονικότητας των δεσμών μπορούν να προσεγγιστούν από την αντίθετη θέση - από την άποψη της πόλωσης των ιόντων. Υποτίθεται ότι λαμβάνει χώρα πλήρης μεταφορά ηλεκτρονίων και το μόριο αποτελείται από απομονωμένα ιόντα. Στη συνέχεια τα νέφη ηλεκτρονίων μετατοπίζονται υπό την επίδραση του ηλεκτρικού πεδίου που δημιουργείται από τα ιόντα - πόλωσηιόντων.
Η πόλωση είναι μια διττή διαδικασία που συνδυάζεται πολωτικό αποτέλεσμαιόντων από τους πόλωσης.Η πολωσιμότητα είναι η ικανότητα του νέφους ηλεκτρονίων ενός ιόντος, μορίου ή ατόμου να παραμορφώνεται υπό την επίδραση ηλεκτροστατικό πεδίοάλλο ιόν. Η ισχύς αυτού του πεδίου καθορίζει την πολωτική επίδραση του ιόντος. Από την εξίσωση (3.10) προκύπτει ότι η πολωτική επίδραση ενός ιόντος είναι μεγαλύτερη, τόσο μεγαλύτερο είναι το φορτίο του και όσο μικρότερη είναι η ακτίνα του. Οι ακτίνες των κατιόντων είναι, κατά κανόνα, πολύ μικρότερες από τις ακτίνες των ανιόντων, επομένως στην πράξη συναντά κανείς συχνά την πόλωση των ανιόντων υπό την επίδραση κατιόντων και όχι το αντίστροφο. Η πολικότητα των ιόντων εξαρτάται επίσης από το φορτίο και την ακτίνα τους. Τα ιόντα μεγάλου μεγέθους και φορτίου πολώνονται πιο εύκολα. Η πολωτική επίδραση ενός ιόντος μειώνεται στο να έλκει προς το μέρος του το νέφος ηλεκτρονίων ενός ιόντος με αντίθετο φορτίο. Ως αποτέλεσμα, η ιονικότητα του δεσμού μειώνεται, δηλ. ο δεσμός γίνεται πολικός ομοιοπολικός. Έτσι, η πόλωση ιόντων μειώνει τον βαθμό ιονισμού του δεσμού και έχει το αντίθετο αποτέλεσμα της πόλωσης του δεσμού.
Πόλωση ιόντων σε ένα μόριο, δηλ. Η αύξηση της αναλογίας των ομοιοπολικών δεσμών σε αυτό αυξάνει την ισχύ της αποσύνθεσής του σε ιόντα. Σε μια σειρά από ενώσεις ενός δεδομένου κατιόντος με ανιόντα του ίδιου τύπου, ο βαθμός διάστασης στα διαλύματα μειώνεται με την αύξηση της ικανότητας πόλωσης των ανιόντων. Για παράδειγμα, στη σειρά αλογονιδίων μολύβδου PbCl 2 - PbBr 2 - PI 2, η ακτίνα των ανιόντων αλογονιδίου αυξάνεται, η πολωσιμότητά τους αυξάνεται και η αποσύνθεση σε ιόντα εξασθενεί, γεγονός που αντανακλάται σε μείωση της διαλυτότητας.
Κατά τη σύγκριση των ιδιοτήτων των αλάτων με το ίδιο ανιόν και επαρκώς μεγάλα κατιόντα, θα πρέπει να λαμβάνεται υπόψη η πόλωση των κατιόντων. Για παράδειγμα, η ακτίνα του ιόντος Hg 2+ είναι μεγαλύτερη από την ακτίνα του ιόντος Ca 2+, επομένως το Hg 2+ είναι πιο πολωμένο από το Ca 2+. Ως αποτέλεσμα, το CaCl 2 είναι ένας ισχυρός ηλεκτρολύτης, δηλ. διασπάται πλήρως στο διάλυμα και το HgCl 2 είναι ένας ασθενής ηλεκτρολύτης, δηλ. πρακτικά δεν διασπάται σε λύσεις.
Η πόλωση των ιόντων σε ένα μόριο μειώνει τη δύναμή του όταν διασπάται σε άτομα ή μόρια. Για παράδειγμα, στη σειρά CaCl 2 - CaBr 2 - Ca1 2, η ακτίνα των ιόντων αλογονιδίου αυξάνεται, η πόλωσή τους από το ιόν Ca 2+ αυξάνεται και επομένως η θερμοκρασία της θερμικής διάστασης σε ασβέστιο και αλογόνο μειώνεται: CaHa1 2 = Ca + Ha1 2.
Εάν ένα ιόν πολώνεται εύκολα, τότε η διέγερσή του απαιτεί λίγη ενέργεια, η οποία αντιστοιχεί στην απορρόφηση των κβάντων του ορατού φωτός. Αυτός είναι ο λόγος για τον χρωματισμό των διαλυμάτων τέτοιων ενώσεων. Η αύξηση της ικανότητας πόλωσης οδηγεί σε αύξηση του χρώματος, για παράδειγμα, στη σειρά NiCl 2 - NiBr 2 - Nil 2 (αυξημένη ικανότητα πόλωσης του ανιόντος) ή στη σειρά KC1 - CuCl 2 (αυξημένη ικανότητα πόλωσης του κατιόντος).
Το όριο μεταξύ πολικών ομοιοπολικών και ιοντικών δεσμών είναι πολύ αυθαίρετο. Για μόρια σε αέρια κατάσταση, πιστεύεται ότι με διαφορά στην ηλεκτραρνητικότητα ΑΧ >Ο δεσμός 2,5 είναι ιοντικός. Σε διαλύματα πολικών διαλυτών, καθώς και σε κρυσταλλική κατάσταση, τα μόρια του διαλύτη και τα γειτονικά σωματίδια στους κόμβους έχουν ισχυρή επίδραση, αντίστοιχα. κρυσταλλικού πλέγματος. Επομένως, η ιοντική φύση του δεσμού εμφανίζεται με σημαντικά μικρότερη διαφορά στην ηλεκτραρνητικότητα. Στην πράξη, μπορούμε να υποθέσουμε ότι ο δεσμός μεταξύ τυπικών μετάλλων και μη μετάλλων σε διαλύματα και κρυστάλλους είναι ιοντικός.
Στα μόρια, τα θετικά φορτία των πυρήνων αντισταθμίζονται από τα αρνητικά φορτία των ηλεκτρονίων. Ωστόσο, τα θετικά και τα αρνητικά φορτία μπορούν να διαχωριστούν χωρικά. Ας υποθέσουμε ότι το μόριο αποτελείται από άτομα διαφορετικά στοιχεία(HC1, CO κ.λπ.). Σε αυτή την περίπτωση, τα ηλεκτρόνια μετατοπίζονται σε ένα άτομο με μεγαλύτερη ηλεκτραρνητικότητα και τα κέντρα βάρους θετικών και αρνητικών φορτίων δεν συμπίπτουν, σχηματίζοντας ηλεκτρικό δίπολο- ένα σύστημα δύο φορτίων ίσου μεγέθους και αντίθετου πρόσημου q,που βρίσκεται σε απόσταση μεγάλο, που ονομάζεται μήκος διπόλου.Το μήκος του διπόλου είναι διανυσματική ποσότητα. Η κατεύθυνσή του θεωρείται συμβατικά από αρνητικό σε θετικό φορτίο. Τέτοια μόρια ονομάζονται πολικά μόρια ή δίπολα.
Η πολικότητα του μορίου είναι μεγαλύτερη, τόσο μεγαλύτερη είναι η απόλυτη τιμή του φορτίου και το μήκος του διπόλου. Το μέτρο της πολικότητας είναι το γινόμενο q. μεγάλο,ονομάζεται ηλεκτρική διπολική ροπή μ: μ = q. μεγάλο.
Μονάδα μέτρησης μ Ο Debye (D) σερβίρει. 1 D = 3,3. 10 -30 Κλ. Μ.
Σε μόρια που αποτελούνται από δύο όμοια άτομα μ = 0. Ονομάζονται μη πολικό.Εάν ένα τέτοιο σωματίδιο εισέλθει σε ένα ηλεκτρικό πεδίο, τότε υπό την επίδραση του πεδίου θα εμφανιστεί πόλωση- μετατόπιση των κέντρων βάρους θετικών και αρνητικών φορτίων. Μια ηλεκτρική διπολική ροπή εμφανίζεται στο σωματίδιο, που ονομάζεται επαγόμενο δίπολο.
Η διπολική ροπή ενός διατομικού μορίου ΑΒ μπορεί να ταυτιστεί με τη διπολική ροπή Συνδέσεις A-Bμέσα σε αυτό. Εάν το κοινό ζεύγος ηλεκτρονίων μετατοπιστεί σε ένα από τα άτομα, τότε η ηλεκτρική ροπή του διπόλου του δεσμού δεν είναι μηδέν. Η σύνδεση σε αυτή την περίπτωση ονομάζεται πολικός ομοιοπολικός δεσμός.Εάν ένα ζεύγος ηλεκτρονίων βρίσκεται συμμετρικά σε σχέση με τα άτομα, τότε ο δεσμός ονομάζεται μη πολικό.
Σε ένα πολυατομικό μόριο, μια συγκεκριμένη ηλεκτρική διπολική ροπή μπορεί να εκχωρηθεί σε κάθε δεσμό. Τότε η ηλεκτρική διπολική ροπή ενός μορίου μπορεί να αναπαρασταθεί ως το διανυσματικό άθροισμα των ηλεκτρικών διπολικών ροπών μεμονωμένων δεσμών. Η ύπαρξη ή απουσία διπολικής ροπής σε ένα μόριο σχετίζεται με τη συμμετρία του. Τα μόρια με συμμετρική δομή είναι μη πολικά (μ = 0). Αυτά περιλαμβάνουν διατομικά μόρια με πανομοιότυπα άτομα (H 2, C1 2, κ.λπ.), ένα μόριο βενζολίου, μόρια με πολικούς δεσμούς BF 3, A1F 3, CO 2, BeC1 2, κ.λπ.
Η ηλεκτρική διπολική ροπή ενός μορίου είναι μια σημαντική μοριακή παράμετρος. Η γνώση της τιμής του μ μπορεί να υποδείξει τη γεωμετρική δομή του μορίου. Για παράδειγμα, η πολικότητα ενός μορίου νερού δείχνει τη γωνιακή του δομή και η απουσία διπολικής ροπής CO 2 δείχνει τη γραμμικότητά του.
Ιοντικός δεσμός
Η οριακή περίπτωση ενός ομοιοπολικού πολικού δεσμού είναι ένας ιονικός δεσμός. Εάν οι ηλεκτραρνητικότητα των ατόμων διαφέρουν πολύ (για παράδειγμα, άτομα αλκαλιμέταλλακαι αλογόνα), τότε όταν πλησιάζουν, τα ηλεκτρόνια σθένους ενός ατόμου μεταφέρονται πλήρως στο δεύτερο άτομο. Ως αποτέλεσμα αυτής της μετάβασης, και τα δύο άτομα γίνονται ιόντα και αναλαμβάνουν ηλεκτρονική δομήτο πλησιέστερο ευγενές αέριο. Για παράδειγμα, όταν τα άτομα νατρίου και χλωρίου αλληλεπιδρούν, μετατρέπονται σε ιόντα Na + και Cl -, μεταξύ των οποίων προκύπτει ηλεκτροστατική έλξη. Ο ιονικός δεσμός μπορεί να περιγραφεί στο πλαίσιο των μεθόδων BC και MO, αλλά συνήθως θεωρείται ότι χρησιμοποιεί τους κλασικούς νόμους της ηλεκτροστατικής.
Τα μόρια στα οποία υπάρχει ένας καθαρός ιοντικός δεσμός βρίσκονται στην κατάσταση ατμού της ουσίας. Οι ιονικοί κρύσταλλοι αποτελούνται από ατελείωτες σειρές εναλλασσόμενων θετικών και αρνητικών ιόντων που συνδέονται με ηλεκτροστατικές δυνάμεις. Όταν οι ιοντικοί κρύσταλλοι διαλύονται ή λιώνουν, θετικά και αρνητικά ιόντα περνούν στο διάλυμα ή λιώνουν.
Πρέπει να σημειωθεί ότι οι ιοντικοί δεσμοί είναι πολύ ισχυροί, επομένως για να καταστραφούν οι ιοντικοί κρύσταλλοι είναι απαραίτητο να ξοδέψουμε πολλή ενέργεια. Αυτό εξηγεί το γεγονός ότι οι ιοντικές ενώσεις έχουν υψηλά σημεία τήξης.
Σε αντίθεση με έναν ομοιοπολικό δεσμό, ένας ιονικός δεσμός δεν έχει τις ιδιότητες κορεσμού και κατευθυντικότητας. Ο λόγος για αυτό είναι ότι το ηλεκτρικό πεδίο που δημιουργείται από τα ιόντα έχει σφαιρική συμμετρία και δρα εξίσου σε όλα τα ιόντα. Επομένως, ο αριθμός των ιόντων που περιβάλλουν ένα δεδομένο ιόν και η χωρική τους διάταξη καθορίζονται μόνο από το μέγεθος των φορτίων ιόντων και τα μεγέθη τους.
Όταν εξετάζουμε έναν ιοντικό δεσμό, είναι απαραίτητο να έχουμε κατά νου ότι κατά την ηλεκτροστατική αλληλεπίδραση μεταξύ ιόντων, συμβαίνει η παραμόρφωσή τους, που ονομάζεται πόλωση.Στο Σχ. 2.1, ΕΝΑαπεικονίζει δύο ηλεκτροστατικά ουδέτερα ιόντα που αλληλεπιδρούν και διατηρούν ένα απόλυτα σφαιρικό σχήμα. Στο Σχ. 2.1, σιδείχνει την πόλωση των ιόντων, η οποία οδηγεί σε μείωση της αποτελεσματικής απόστασης μεταξύ των κέντρων θετικών και αρνητικών φορτίων. Όσο μεγαλύτερη είναι η πόλωση των ιόντων, τόσο μικρότερος είναι ο βαθμός ιονισμού του δεσμού, δηλαδή τόσο μεγαλύτερη είναι η ομοιοπολική φύση του μεταξύ τους δεσμού. Στους κρυστάλλους, η πόλωση αποδεικνύεται χαμηλή, καθώς τα ιόντα περιβάλλονται συμμετρικά από ιόντα του αντίθετου σημείου και το ιόν εκτίθεται στην ίδια επίδραση προς όλες τις κατευθύνσεις.