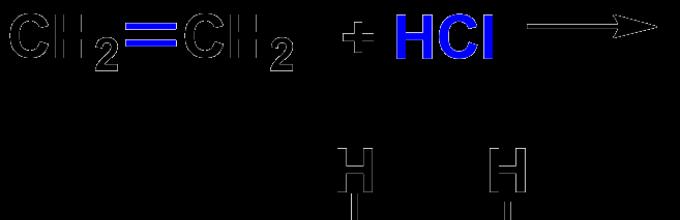>> Χημεία: Τύποι χημικών αντιδράσεων στην οργανική χημεία
Οι αντιδράσεις οργανικών ουσιών μπορούν επίσημα να χωριστούν σε τέσσερις κύριους τύπους: υποκατάσταση, προσθήκη, αποβολή (εξάλειψη) και αναδιάταξη (ισομερισμός). Είναι προφανές ότι ολόκληρη η ποικιλία των αντιδράσεων των οργανικών ενώσεων δεν μπορεί να περιοριστεί στο πλαίσιο της προτεινόμενης ταξινόμησης (για παράδειγμα, αντιδράσεις καύσης). Ωστόσο, μια τέτοια ταξινόμηση θα βοηθήσει στη δημιουργία αναλογιών με τις ταξινομήσεις των αντιδράσεων που συμβαίνουν μεταξύ ανόργανων ουσιών που είναι ήδη γνωστές σε εσάς από την πορεία της ανόργανης χημείας.
Τυπικά, η κύρια οργανική ένωση που εμπλέκεται σε μια αντίδραση ονομάζεται υπόστρωμα και το άλλο συστατικό της αντίδρασης θεωρείται συμβατικά το αντιδρόν.
Αντιδράσεις υποκατάστασης
Οι αντιδράσεις που έχουν ως αποτέλεσμα την αντικατάσταση ενός ατόμου ή ομάδας ατόμων στο αρχικό μόριο (υπόστρωμα) με άλλα άτομα ή ομάδες ατόμων ονομάζονται αντιδράσεις υποκατάστασης.
Οι αντιδράσεις υποκατάστασης περιλαμβάνουν κορεσμένες και αρωματικές ενώσεις, όπως, για παράδειγμα, αλκάνια, κυκλοαλκάνια ή αρένες.
Ας δώσουμε παραδείγματα τέτοιων αντιδράσεων.
Μάθημα 2. Ταξινόμηση αντιδράσεων στην οργανική χημεία. Ασκήσεις για ισομέρεια και ομόλογα
ΤΑΞΙΝΟΜΗΣΗ ΑΝΤΙΔΡΑΣΕΩΝ ΣΤΗΝ ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ.
Υπάρχουν τρεις κύριες ταξινομήσεις των οργανικών αντιδράσεων.
1 Ταξινόμηση σύμφωνα με τη μέθοδο διάσπασης ομοιοπολικών δεσμών στα μόρια των ουσιών που αντιδρούν.
§ Αντιδράσεις που προχωρούν μέσω του μηχανισμού διάσπασης δεσμών ελεύθερων ριζών (ομολυτικών). Οι χαμηλοπολικοί ομοιοπολικοί δεσμοί υφίστανται τέτοια διάσπαση. Τα σωματίδια που προκύπτουν ονομάζονται ελεύθερες ρίζες – χημ. ένα σωματίδιο με ένα ασύζευκτο ηλεκτρόνιο που είναι εξαιρετικά χημικά ενεργό. Χαρακτηριστικό παράδειγμα μιας τέτοιας αντίδρασης είναι η αλογόνωση των αλκανίων, Για παράδειγμα:
§ Αντιδράσεις που προχωρούν μέσω του μηχανισμού διάσπασης ιοντικού (ετερολυτικού) δεσμού. Οι πολικοί ομοιοπολικοί δεσμοί υφίστανται τέτοια διάσπαση. Τη στιγμή της αντίδρασης, σχηματίζονται οργανικά ιοντικά σωματίδια - ένα καρβοκατιόν (ένα ιόν που περιέχει ένα άτομο άνθρακα με θετικό φορτίο) και ένα καρβανιόν (ένα ιόν που περιέχει ένα άτομο άνθρακα με αρνητικό φορτίο). Ένα παράδειγμα μιας τέτοιας αντίδρασης είναι η αντίδραση υδροαλογόνωσης των αλκοολών, Για παράδειγμα:
2. Ταξινόμηση σύμφωνα με τον μηχανισμό αντίδρασης.
§ Αντιδράσεις προσθήκης - μια αντίδραση κατά την οποία σχηματίζεται ένα από δύο μόρια που αντιδρούν (εισέρχονται ακόρεστες ή κυκλικές ενώσεις). Για παράδειγμα, δώστε την αντίδραση προσθήκης υδρογόνου στο αιθυλένιο:
§ Οι αντιδράσεις υποκατάστασης είναι μια αντίδραση που έχει ως αποτέλεσμα την ανταλλαγή ενός ατόμου ή μιας ομάδας ατόμων με άλλες ομάδες ή άτομα. Για παράδειγμα, δώστε την αντίδραση του μεθανίου με το νιτρικό οξύ:
§ Αντιδράσεις αποβολής – διαχωρισμός μικρού μορίου από την αρχική οργανική ουσία. Υπάρχει α-εξάλειψη (η εξάλειψη συμβαίνει από το ίδιο άτομο άνθρακα, σχηματίζονται ασταθείς ενώσεις - καρβένια). β-εξάλειψη (η αποβολή γίνεται από δύο γειτονικά άτομα άνθρακα, σχηματίζονται αλκένια και αλκίνια). g-εξάλειψη (η αποβολή συμβαίνει από πιο απομακρυσμένα άτομα άνθρακα, σχηματίζονται κυκλοαλκάνια). Δώστε παραδείγματα των παραπάνω αντιδράσεων:
§ Αντιδράσεις αποσύνθεσης - αντιδράσεις που καταλήγουν σε ένα μόριο ορ. Σχηματίζονται αρκετές απλούστερες ενώσεις. Ένα χαρακτηριστικό παράδειγμα μιας τέτοιας αντίδρασης είναι η πυρόλυση του βουτανίου:
§ Αντιδράσεις ανταλλαγής - αντιδράσεις κατά τις οποίες μόρια σύνθετων αντιδραστηρίων ανταλλάσσουν τα συστατικά τους μέρη. Για παράδειγμα, δώστε την αντίδραση μεταξύ οξικού οξέος και υδροξειδίου του νατρίου:
§ Οι αντιδράσεις κυκλοποίησης είναι η διαδικασία σχηματισμού ενός κυκλικού μορίου από ένα ή περισσότερα άκυκλα. Γράψτε την αντίδραση για την παραγωγή κυκλοεξανίου από εξάνιο:
§ Αντιδράσεις ισομερισμού είναι η αντίδραση της μετάβασης ενός ισομερούς σε άλλο υπό ορισμένες συνθήκες. Δώστε ένα παράδειγμα ισομερισμού βουτανίου:
§ Οι αντιδράσεις πολυμερισμού είναι μια αλυσιδωτή διαδικασία, ο διαδοχικός συνδυασμός μορίων χαμηλού μοριακού βάρους σε μεγαλύτερα μορίων υψηλού μοριακού βάρους με τη σύνδεση ενός μονομερούς στο ενεργό κέντρο που βρίσκεται στο τέλος της αναπτυσσόμενης αλυσίδας. Ο πολυμερισμός δεν συνοδεύεται από σχηματισμό παραπροϊόντων. Χαρακτηριστικό παράδειγμα είναι η αντίδραση σχηματισμού πολυαιθυλενίου:
§ Οι αντιδράσεις πολυσυμπύκνωσης είναι ο διαδοχικός συνδυασμός μονομερών σε ένα πολυμερές, που συνοδεύεται από το σχηματισμό παραπροϊόντων χαμηλού μοριακού βάρους (νερό, αμμωνία, υδραλογόνο κ.λπ.). Για παράδειγμα, γράψτε την αντίδραση για το σχηματισμό ρητίνης φαινόλης-φορμαλδεΰδης:
§ Αντιδράσεις οξείδωσης
α) πλήρης οξείδωση (καύση), Για παράδειγμα:
β) ατελής οξείδωση (η οξείδωση είναι δυνατή με ατμοσφαιρικό οξυγόνο ή ισχυρά οξειδωτικά μέσα σε διάλυμα - KMnO 4, K 2 Cr 2 O 7). Για παράδειγμα, καταγράψτε τις αντιδράσεις της καταλυτικής οξείδωσης του μεθανίου με το ατμοσφαιρικό οξυγόνο και τις επιλογές για την οξείδωση του αιθυλενίου σε διαλύματα με διαφορετικές τιμές pH:
3. Ταξινόμηση σύμφωνα με τη χημεία της αντίδρασης.
· Αντίδραση αλογόνωσης – εισαγωγή ορ. στο μόριο. ενώσεις ενός ατόμου αλογόνου με υποκατάσταση ή προσθήκη (αλογόνωση υποκατάστασης ή προσθήκης). Να γράψετε τις αντιδράσεις αλογόνωσης αιθανίου και αιθενίου:
· Αντίδραση υδραλογόνωσης – προσθήκη υδραλογονιδίων σε ακόρεστες ενώσεις. Η αντιδραστικότητα αυξάνεται με την αύξηση της μοριακής μάζας του Hhal. Στην περίπτωση του μηχανισμού ιοντικής αντίδρασης, η προσθήκη προχωρά σύμφωνα με τον κανόνα του Markovnikov: ένα ιόν υδρογόνου προσκολλάται στο πιο υδρογονωμένο άτομο άνθρακα. Δώστε ένα παράδειγμα της αντίδρασης μεταξύ προπενίου και υδροχλωρίου:
· Η αντίδραση ενυδάτωσης είναι η προσθήκη νερού στην αρχική οργανική ένωση και υπακούει στον κανόνα του Markovnikov. Για παράδειγμα, γράψτε την αντίδραση ενυδάτωσης του προπενίου:
· Η αντίδραση υδρογόνωσης είναι η προσθήκη υδρογόνου σε μια οργανική ένωση. Συνήθως πραγματοποιείται παρουσία μετάλλων της Ομάδας VIII του Περιοδικού Πίνακα (πλατίνα, παλλάδιο) ως καταλύτες. Γράψτε την αντίδραση υδρογόνωσης με ακετυλένιο:
· Αντίδραση αποαλογόνωσης – αφαίρεση ατόμου αλογόνου από μόριο οργάνου. συνδέσεις. Ως παράδειγμα, δώστε την αντίδραση για την παραγωγή βουτενίου-2 από 2,3-διχλωροβουτάνιο:
· Η αντίδραση αφυδροαλογόνωσης είναι η εξάλειψη ενός μορίου υδραλογόνου από ένα οργανικό μόριο για να σχηματιστεί ένας πολλαπλός δεσμός ή δακτύλιος. Συνήθως υπακούει στον κανόνα του Zaitsev: το υδρογόνο διασπάται από το λιγότερο υδρογονωμένο άτομο άνθρακα. Γράψτε την αντίδραση του 2-χλωροβουτανίου με ένα αλκοολικό διάλυμα υδροξειδίου του καλίου:
· Αντίδραση αφυδάτωσης – διάσπαση ενός μορίου νερού από ένα ή περισσότερα οργανικά μόρια. ουσίες (ενδομοριακή και διαμοριακή αφυδάτωση). Πραγματοποιείται σε υψηλές θερμοκρασίες ή παρουσία παραγόντων αφαίρεσης νερού (συμπ. H 2 SO 4, P 2 O 5). Δώστε παραδείγματα αφυδάτωσης με αιθυλική αλκοόλη:
· Αντίδραση αφυδρογόνωσης – αφαίρεση μορίου υδρογόνου από οργαν. συνδέσεις. Γράψτε την αντίδραση αφυδρογόνωσης του αιθυλενίου:
· Η αντίδραση υδρόλυσης είναι μια αντίδραση ανταλλαγής μεταξύ μιας ουσίας και του νερού. Επειδή Η υδρόλυση είναι στις περισσότερες περιπτώσεις αναστρέψιμη· πραγματοποιείται παρουσία ουσιών που δεσμεύουν τα προϊόντα αντίδρασης ή τα προϊόντα απομακρύνονται από τη σφαίρα της αντίδρασης. Η υδρόλυση επιταχύνεται σε όξινο ή αλκαλικό περιβάλλον. Δώστε παραδείγματα υδατικής και αλκαλικής (σαπωνοποίησης) υδρόλυσης οξικού αιθυλεστέρα:
· Αντίδραση εστεροποίησης - ο σχηματισμός ενός εστέρα από ένα οργανικό ή ανόργανο οξύ που περιέχει οξυγόνο και μια αλκοόλη. Το Conc. χρησιμοποιείται ως καταλύτης. θειικό ή υδροχλωρικό οξύ. Η διαδικασία εστεροποίησης είναι αναστρέψιμη, επομένως τα προϊόντα πρέπει να αφαιρεθούν από τη σφαίρα της αντίδρασης. Καταγράψτε τις αντιδράσεις εστεροποίησης της αιθυλικής αλκοόλης με μυρμηκικό και νιτρικό οξύ:
· Αντίδραση νίτρωσης – εισαγωγή της ομάδας –NO 2 στα οργανικά μόρια. συνδέσεις, Για παράδειγμα, η αντίδραση νίτρωσης του βενζολίου:
· Αντίδραση σουλφονίωσης – εισαγωγή της ομάδας –SO 3 H σε οργανικά μόρια. συνδέσεις. Γράψτε την αντίδραση σουλφόνωσης μεθανίου:
· Αντίδραση αλκυλίωσης – εισαγωγή μιας ρίζας στα οργανικά μόρια. ενώσεις που οφείλονται σε αντιδράσεις ανταλλαγής ή προσθήκης. Για παράδειγμα, γράψτε τις αντιδράσεις του βενζολίου με το χλωροαιθάνιο και με το αιθυλένιο:
Ασκήσεις για ισομέρεια και ομόλογα
1. Υποδείξτε ποιες από τις ακόλουθες ουσίες είναι ομόλογες μεταξύ τους: C 2 H 4, C 4 H 10, C 3 H 6, C 6 H 14, C 6 H 6, C 6 H 12, C 7 H 12 , C 5 H 12 , C 2 H 2 .
2. Δημιουργήστε συντακτικούς τύπους και δώστε ονόματα σε όλα τα ισομερή της σύνθεσης C 4 H 10 O (7 ισομερή).
3. Προϊόντα πλήρους καύσης 6,72 λίτρων μίγματος αιθανίου και του ομολόγου του, που έχει ένα ακόμη άτομο άνθρακα, υποβλήθηκαν σε επεξεργασία με περίσσεια ασβεστόνερου, με αποτέλεσμα να σχηματιστούν 80 g ιζήματος. Ποιο ομόλογο ήταν πιο άφθονο στο αρχικό μείγμα; Προσδιορίστε τη σύσταση του αρχικού μείγματος αερίων. (2,24L αιθάνιο και 4,48L προπάνιο).
4. Να σχηματίσετε τον συντακτικό τύπο ενός αλκανίου με σχετική πυκνότητα ατμών υδρογόνου 50, το μόριο του οποίου περιέχει ένα τριτοταγές και τεταρτοταγές άτομο άνθρακα.
5. Από τις προτεινόμενες ουσίες, επιλέξτε τα ισομερή και συνθέστε τους συντακτικούς τύπους τους: 2,2,3,3,-τετραμεθυλοβουτάνιο. n-επτάνιο; 3-αιθυλεξάνιο; 2,2,4-τριμεθυλεξάνιο; 3-μεθυλ-3-αιθυλοπεντάνιο.
6. Υπολογίστε την πυκνότητα ατμών σε αέρα, υδρογόνο και άζωτο του πέμπτου μέλους της ομόλογης σειράς αλκαδιενίων (2.345; 34; 2.43).
7. Γράψτε τους συντακτικούς τύπους όλων των αλκανίων που περιέχουν 82,76% άνθρακα και 17,24% υδρογόνο κατά μάζα.
8. Για την πλήρη υδρογόνωση 2,8 g υδρογονάνθρακα αιθυλενίου, καταναλώθηκαν 0,896 λίτρα υδρογόνου (αρ.). Προσδιορίστε έναν υδρογονάνθρακα εάν είναι γνωστό ότι έχει δομή ευθείας αλυσίδας.
9. Όταν προστίθεται ποιο αέριο σε μείγμα ίσων όγκων προπανίου και πεντανίου, η σχετική πυκνότητα οξυγόνου του θα αυξηθεί. θα μειωθει?
10. Να δώσετε τον τύπο μιας απλής αέριας ουσίας που έχει την ίδια πυκνότητα αέρα με το απλούστερο αλκένιο.
11. Δημιουργήστε συντακτικούς τύπους και ονομάστε όλους τους υδρογονάνθρακες που περιέχουν 32e σε ένα μόριο 5 ισομερών).
Θεωρία υποκατάστασης σε αρωματικές ενώσεις. Αντιδράσεις ηλεκτρόφιλης υποκατάστασης. Ανατολίτες 2ου είδους (μετα-ανατολίτες).
Οι υποκαταστάτες που έχουν αρνητική επαγωγική επίδραση ή αρνητικά τόσο επαγωγικά όσο και μεσομερή αποτελέσματα κατευθύνουν την ηλεκτροφιλική υποκατάσταση στη μετα-θέση του δακτυλίου βενζολίου και ονομάζονται προσανατολιστές του δεύτερου είδους.
Οι οργανικές αντιδράσεις, όπως και οι ανόργανες, χωρίζονται σε 3 κύριους τύπους:
1) αντίδραση υποκατάστασης: CH 4 + CI 2 → CH 3 CI + HCI;
2) αντίδραση απομάκρυνσης: CH 3 CH 2 Br → CH 2 = CH 2 + HBr;
3) αντίδραση προσθήκης: CH 2 = CH 2 + HBr → CH 3 CH 2 Br.( αντιδράσεις πολυμερισμού)
Ταξινόμηση με τον μηχανισμό διάσπασης των ομοιοπολικών δεσμών στα αντιδρώντα μόρια.
Δύο τρόποι για να σπάσετε ομοιοπολικούς δεσμούς.
1. Εάν ένα κοινό ζεύγος ηλεκτρονίων μοιράζεται μεταξύ των ατόμων, σχηματίζοντας ρίζες. Ριζοσπάστες-σωματίδια με ασύζευκτα ηλεκτρόνια. Αυτή η αποσύνδεση ονομάζεται ριζικό (ομολυτικό).ΙδιορρυθμίαΑυτή η σύνδεση είναι ότι οι ρίζες που σχηματίζονται αλληλεπιδρούν με τα μόρια που υπάρχουν στο σύστημα αντίδρασης ή μεταξύ τους.
Οι προκύπτουσες ρίζες αλληλεπιδρούν με μόρια που υπάρχουν στο σύστημα αντίδρασης ή μεταξύ τους: CH 3 + CI 2 → CH 3 CI + CI.
Σύμφωνα με τον ριζικό μηχανισμό, συμβαίνουν αντιδράσεις στις οποίες δεσμοί χαμηλής πολικότητας (C-C, C-H, N-N) σπάνε σε υψηλές θερμοκρασίες, υπό την επίδραση του φωτός ή της ραδιενεργής ακτινοβολίας.
2. Εάν, όταν σπάσει ένας δεσμός, ένα κοινό ζεύγος ηλεκτρονίων παραμένει με ένα άτομο, τότε ιόντα – κατιόν και ανιόν.Αυτός ο μηχανισμός ονομάζεται ιωνικόςή ετερολυτικό.Οδηγεί στο σχηματισμό οργανικών κατιόντα ή ανιόντα: 1) Το μεθυλοχλωρίδιο σχηματίζει ένα κατιόν μεθυλίου και ένα ανιόν χλωριδίου. 2) Το μεθυλολίθιο σχηματίζει κατιόν λιθίου και ανιόν μεθυλίου.
Τα οργανικά ιόντα υφίστανται περαιτέρω μετασχηματισμούς. Σε αυτή την περίπτωση, τα κατιόντα αλληλεπιδρούν με πυρηνόφιλος(«πυρήνα-αγαπώντας») σωματίδια και οργανικά ανιόντα – με ηλεκτροφιλικό(«ηλεκτρονόφιλα») σωματίδια (κατιόντα μετάλλων, αλογόνα κ.λπ.).
Ο ιοντικός μηχανισμός παρατηρείται όταν σπάσει ένας πολικός ομοιοπολικός δεσμός (άνθρακας - αλογόνο, άνθρακας - οξυγόνο κ.λπ.).
Τα οργανικά ιοντικά σωματίδια είναι παρόμοια με τα ιόντα στην ανόργανη χημεία - έχουν αντίστοιχα φορτία. Ωστόσο, είναι έντονα διαφορετικά: ιόντα ανόργανων ενώσεων υπάρχουν συνεχώς σε υδατικά διαλύματα και τα οργανικά ιοντικά σωματίδια εμφανίζονται μόνο τη στιγμή της αντίδρασης.
Επομένως, σε πολλές περιπτώσεις είναι απαραίτητο να μην μιλάμε για ελεύθερα οργανικά ιόντα, αλλά για εξαιρετικά πολωμένα μόρια.
Ο ριζικός μηχανισμός παρατηρείται όταν σπάσει ένας μη πολικός ή χαμηλού πολικός ομοιοπολικός δεσμός (άνθρακας-άνθρακας, άνθρακας-υδρογόνο κ.λπ.).
Τα οργανικά ιοντικά σωματίδια είναι παρόμοια με τα ιόντα στην ανόργανη χημεία - έχουν αντίστοιχα φορτία.
Υπάρχουν διαφορετικά συστήματα ταξινόμησης για οργανικές αντιδράσεις, τα οποία βασίζονται σε διαφορετικά χαρακτηριστικά. Μεταξύ αυτών είναι οι ακόλουθες ταξινομήσεις:
- Με το τελικό αποτέλεσμα της αντίδρασης, δηλαδή, μια αλλαγή στη δομή του υποστρώματος.
- Με μηχανισμός αντίδρασης, δηλαδή από τον τύπο της θραύσης του δεσμού και τον τύπο των αντιδραστηρίων.
Οι ουσίες που αλληλεπιδρούν σε μια οργανική αντίδραση χωρίζονται σε αντιδραστήριοΚαι υπόστρωμα. Σε αυτή την περίπτωση, το αντιδραστήριο θεωρείται ότι προσβάλλει το υπόστρωμα.
ΟΡΙΣΜΟΣ
Αντιδραστήριο- μια ουσία που δρα σε ένα αντικείμενο - ένα υπόστρωμα - και προκαλεί αλλαγή στον χημικό δεσμό σε αυτό. Τα αντιδραστήρια χωρίζονται σε ριζικά, ηλεκτροφιλικά και πυρηνόφιλα.
ΟΡΙΣΜΟΣ
Υπόστρωμα, θεωρείται γενικά ότι είναι ένα μόριο που παρέχει ένα άτομο άνθρακα για έναν νέο δεσμό.
ΤΑΞΙΝΟΜΗΣΗ ΑΝΤΙΔΡΑΣΕΩΝ ΣΥΜΦΩΝΑ ΜΕ ΤΟ ΤΕΛΙΚΟ ΑΠΟΤΕΛΕΣΜΑ (ΑΛΛΑΓΗ ΣΤΗ ΔΟΜΗ ΤΟΥ ΥΠΟΣΤΡΩΜΑΤΟΣ)
Στην οργανική χημεία, διακρίνονται τέσσερις τύποι αντιδράσεων ανάλογα με το τελικό αποτέλεσμα και την αλλαγή στη δομή του υποστρώματος: προσθήκη, αντικατάσταση, απόσπαση,ή εξάλειψη(από τα Αγγλικά να εξαλείψει- αφαιρέστε, χωρίστε) και ανακατατάξεις (ισομερισμοί)). Αυτή η ταξινόμηση είναι παρόμοια με την ταξινόμηση των αντιδράσεων στην ανόργανη χημεία σύμφωνα με τον αριθμό των αρχικών αντιδραστηρίων και των ουσιών που προκύπτουν, με ή χωρίς αλλαγή στη σύνθεση. Η ταξινόμηση σύμφωνα με το τελικό αποτέλεσμα βασίζεται σε τυπικά κριτήρια, αφού η στοιχειομετρική εξίσωση, κατά κανόνα, δεν αντικατοπτρίζει τον μηχανισμό αντίδρασης. Ας συγκρίνουμε τα είδη των αντιδράσεων στην ανόργανη και οργανική χημεία.
Είδος αντίδρασης στην ανόργανη χημεία | Παράδειγμα | Είδος αντίδρασης στην οργανική χημεία | Ποικιλία και παράδειγμα Αντιδράσεις |
|---|---|---|---|
1. Σύνδεση | ντο μεγάλο2 + H2 = 2 H C l | Σύνδεση με πολλαπλές συνδέσεις | Υδρογόνωση |
Υδροαλογόνωση
|
|||
Αλογόνωση
|
|||
Ενυδάτωση
|
|||
2. Αποσύνθεση | 2
H2
Ο=2 H2
+
Ο2
| Εξάλειψη | Αφυδρογόνωση
|
Αφυδροαλογόνωση
|
|||
Αποαλογόνωση
|
|||
Αφυδάτωση
|
|||
3. Αντικατάσταση | Z n + 2 H C l =ZnCl2+H2 | Υποκατάσταση |
|
4. Ανταλλαγή (ειδική περίπτωση - εξουδετέρωση) | H2 μικρό Ο4 + 2 N a O H=N a 2 S O 4 + 2 H 2 Ο | ειδική περίπτωση - εστεροποίηση |
|
5. Αλλοτροποποίηση | γραφίτης ⇔ διαμάντι Πτο κόκκινο⇔ Πάσπρο P κόκκινο ⇔ P λευκό μικρόρόμβος.⇔ μικρόπλασ. Srhomb.⇔Splastic | Ισομερισμός | Ισομερισμός αλκάνια
|
ιδ) χωρίς να τα αντικαθιστά με άλλα.
Ανάλογα με το ποια άτομα χωρίζονται - γειτονικά ντο–ντοή απομονώνεται από δύο ή τρία ή περισσότερα άτομα άνθρακα – ντο–C–C– ντο–, –ντο–C–C–C– ντο–, μπορούν να σχηματιστούν ενώσεις με πολλαπλούς δεσμούςκαι ή κυκλικές ενώσεις. Η εξάλειψη των υδραλογονιδίων από τα αλκυλαλογονίδια ή του νερού από τις αλκοόλες γίνεται σύμφωνα με τον κανόνα του Zaitsev.
ΟΡΙΣΜΟΣ
Ο κανόνας του Ζάιτσεφ: Ένα άτομο υδρογόνου Η αφαιρείται από το λιγότερο υδρογονωμένο άτομο άνθρακα.
Για παράδειγμα, η εξάλειψη ενός μορίου υδροβρωμίου συμβαίνει από γειτονικά άτομα παρουσία αλκαλίου, με αποτέλεσμα το σχηματισμό βρωμιούχου νατρίου και νερού.
ΟΡΙΣΜΟΣ
Ανασύνταξη- μια χημική αντίδραση που έχει ως αποτέλεσμα μια αλλαγή στη σχετική διάταξη των ατόμων σε ένα μόριο, την κίνηση πολλαπλών δεσμών ή μια αλλαγή στην πολλαπλότητά τους.
Η αναδιάταξη μπορεί να πραγματοποιηθεί διατηρώντας την ατομική σύνθεση του μορίου (ισομερισμός) ή αλλάζοντας την.
ΟΡΙΣΜΟΣ
Ισομερισμός- ειδική περίπτωση αντίδρασης αναδιάταξης που οδηγεί στον μετασχηματισμό μιας χημικής ένωσης σε ισομερές μέσω μιας δομικής αλλαγής στον σκελετό άνθρακα.
Η αναδιάταξη μπορεί επίσης να συμβεί με ομολυτικό ή ετερολυτικό μηχανισμό. Οι μοριακές αναδιατάξεις μπορούν να ταξινομηθούν σύμφωνα με διάφορα κριτήρια, για παράδειγμα, από τον κορεσμό των συστημάτων, από τη φύση της μεταναστευτικής ομάδας, με στερεοειδικότητα κ.λπ. Πολλές αντιδράσεις αναδιάταξης έχουν συγκεκριμένα ονόματα - αναδιάταξη Claisen, αναδιάταξη Beckmann κ.λπ.
Οι αντιδράσεις ισομερισμού χρησιμοποιούνται ευρέως σε βιομηχανικές διεργασίες, όπως η διύλιση πετρελαίου για την αύξηση του αριθμού οκτανίων της βενζίνης. Ένα παράδειγμα ισομερισμού είναι ο μετασχηματισμός n-οκτάνιο σε ισοοκτάνιο:
ΤΑΞΙΝΟΜΗΣΗ ΟΡΓΑΝΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ ΚΑΤΑ ΤΥΠΟ ΑΝΤΙΔΡΑΣΤΗΡΙΟΥ
ΑΠΟΣΥΝΔΕΣΗ
Η διάσπαση δεσμού σε οργανικές ενώσεις μπορεί να είναι ομολυτική ή ετερολυτική. 
ΟΡΙΣΜΟΣ
Διάσπαση ομολυτικού δεσμού- αυτό είναι ένα κενό ως αποτέλεσμα του οποίου κάθε άτομο λαμβάνει ένα ασύζευκτο ηλεκτρόνιο και σχηματίζονται δύο σωματίδια που έχουν παρόμοια ηλεκτρονική δομή - δωρεάν ριζοσπάστες.
Μια ομολυτική θραύση είναι χαρακτηριστική της μη πολικής ή ασθενώς πολικήςδεσμούς, όπως C–C, Cl–Cl, C–H, και απαιτεί μεγάλη ποσότητα ενέργειας.
Οι προκύπτουσες ρίζες, οι οποίες έχουν ένα ασύζευκτο ηλεκτρόνιο, είναι εξαιρετικά αντιδραστικές, επομένως οι χημικές διεργασίες που λαμβάνουν χώρα με τη συμμετοχή τέτοιων σωματιδίων είναι συχνά «αλυσιδωτή» φύσης, είναι δύσκολο να ελεγχθούν και η αντίδραση έχει ως αποτέλεσμα ένα σύνολο προϊόντων υποκατάστασης . Έτσι, όταν το μεθάνιο χλωριώνεται, τα προϊόντα υποκατάστασης είναι το χλωρομεθάνιο ντο H3 C l CH3Clδιχλωρομεθάνιο ντο H2 ντο μεγάλο2 CH2Cl2, χλωροφόρμιο C H C μεγάλο3 CHCl3και τετραχλωράνθρακα Γ Γ μεγάλο4 CCl4. Οι αντιδράσεις που περιλαμβάνουν ελεύθερες ρίζες προχωρούν μέσω του μηχανισμού ανταλλαγής του σχηματισμού χημικών δεσμών.
Οι ρίζες που σχηματίζονται κατά τη διάρκεια μιας τέτοιας διάσπασης δεσμού προκαλούν ριζοσπαστικός μηχανισμόςτην πορεία της αντίδρασης. Οι ριζικές αντιδράσεις εμφανίζονται συνήθως σε υψηλές θερμοκρασίες ή ακτινοβολία (π.χ. φως).
Λόγω της υψηλής αντιδραστικότητάς τους, οι ελεύθερες ρίζες μπορούν να έχουν αρνητικό αντίκτυπο στο ανθρώπινο σώμα, καταστρέφοντας τις κυτταρικές μεμβράνες, επηρεάζοντας το DNA και προκαλώντας πρόωρη γήρανση. Αυτές οι διεργασίες συνδέονται κυρίως με την υπεροξείδωση των λιπιδίων, δηλαδή την καταστροφή της δομής των πολυακόρεστων οξέων που σχηματίζουν λίπος μέσα στην κυτταρική μεμβράνη.
ΟΡΙΣΜΟΣ
Διάσπαση ετερολυτικού δεσμού- αυτό είναι ένα κενό στο οποίο ένα ζεύγος ηλεκτρονίων παραμένει με ένα πιο ηλεκτραρνητικό άτομο και σχηματίζονται δύο φορτισμένα σωματίδια - ιόντα: ένα κατιόν (θετικό) και ένα ανιόν (αρνητικό).
Στις χημικές αντιδράσεις, αυτά τα σωματίδια εκτελούν τις λειτουργίες του " πυρηνόφιλα"("φιλ" - από γρ. είμαι ερωτευμένος) Και " ηλεκτρόφιλα», σχηματίζοντας χημικό δεσμό με τον εταίρο της αντίδρασης σύμφωνα με τον μηχανισμό δότη-δέκτη. Τα πυρηνόφιλα σωματίδια παρέχουν ένα ζεύγος ηλεκτρονίων για να σχηματίσουν έναν νέο δεσμό. Με άλλα λόγια,
ΟΡΙΣΜΟΣ
Πυρηνόφιλος- ένα πλούσιο σε ηλεκτρόνια χημικό αντιδραστήριο ικανό να αλληλεπιδρά με ενώσεις με έλλειψη ηλεκτρονίων.
Παραδείγματα πυρηνόφιλων είναι οποιαδήποτε ανιόντα ( ντο μεγάλο− , Εγώ− , Ν Ο− 3 Cl−,I−,NO3−κ.λπ.), καθώς και ενώσεις που έχουν ένα μόνο ζεύγος ηλεκτρονίων ( Ν H3 , H2 ΟΝΗ3, Η2Ο).
Έτσι, όταν σπάσει ένας δεσμός, μπορούν να σχηματιστούν ρίζες ή πυρηνόφιλα και ηλεκτρόφιλα. Με βάση αυτό, συμβαίνουν τρεις μηχανισμοί οργανικών αντιδράσεων.
ΜΗΧΑΝΙΣΜΟΙ ΟΡΓΑΝΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
Μηχανισμός ελεύθερων ριζών: η αντίδραση ξεκινά από τις ελεύθερες ρίζες που σχηματίζονται όταν ομολυτική ρήξηδεσμούς σε ένα μόριο.
Η πιο χαρακτηριστική επιλογή είναι ο σχηματισμός ριζών χλωρίου ή βρωμίου κατά την υπεριώδη ακτινοβολία.
1. Υποκατάσταση ελεύθερων ριζών

μεθάνιο βρωμομεθάνιο
Έναρξη αλυσίδας

Ανάπτυξη της αλυσίδας
Ανοικτό κύκλωμα
2. Προσθήκη ελεύθερων ριζών
αιθενικό πολυαιθυλένιο
Ηλεκτρόφιλος μηχανισμός: η αντίδραση ξεκινά με ηλεκτροφιλικά σωματίδια που ως αποτέλεσμα λαμβάνουν θετικό φορτίο ετερολυτική ρήξηδιαβιβάσεις. Όλα τα ηλεκτρόφιλα είναι οξέα Lewis.
Τέτοια σωματίδια σχηματίζονται ενεργά υπό την επίδραση του Οξέα Lewis, που ενισχύουν το θετικό φορτίο του σωματιδίου. Πιο συχνά χρησιμοποιείται A l C μεγάλο3 , F e C μεγάλο3 , F e B r3 , ZnC μεγάλο2 AlCl3, FeCl3, FeBr3, ZnCl2, που εκτελεί τις λειτουργίες ενός καταλύτη.
Το σημείο προσβολής του ηλεκτροφιλικού σωματιδίου είναι εκείνα τα μέρη του μορίου που έχουν αυξημένη πυκνότητα ηλεκτρονίων, δηλαδή ο πολλαπλός δεσμός και ο δακτύλιος βενζολίου.
Η γενική μορφή των αντιδράσεων ηλεκτρόφιλης υποκατάστασης μπορεί να εκφραστεί με την εξίσωση:
1. Ηλεκτρόφιλη υποκατάσταση

βενζόλιο βρωμοβενζόλιο
2. Ηλεκτροφιλική σύνδεση
προπένιο 2-βρωμοπροπάνιο
προπίνη 1,2-διχλωροπροπένιο
Η προσθήκη σε ασύμμετρους ακόρεστους υδρογονάνθρακες συμβαίνει σύμφωνα με τον κανόνα του Markovnikov.
ΟΡΙΣΜΟΣ
Ο κανόνας του Markovnikov:προσθήκη σε ασύμμετρα αλκένια μορίων σύνθετων ουσιών με τύπο υπό όρους HX (όπου Χ είναι άτομο αλογόνου ή ομάδα υδροξυλίου OH–), το άτομο υδρογόνου προστίθεται στο πιο υδρογονωμένο (που περιέχει τα περισσότερα άτομα υδρογόνου) άτομο άνθρακα στον διπλό δεσμό και Χ στο λιγότερο υδρογονωμένο.
Για παράδειγμα, η προσθήκη υδροχλωρίου HCl σε μόριο προπενίου ντο H3 – C H = C H2 CH3–CH=CH2.

Η αντίδραση προχωρά με τον μηχανισμό της ηλεκτρόφιλης προσθήκης. Λόγω της επιρροής που δίνει ηλεκτρόνια ντο H3 CH3-ομάδα, η πυκνότητα ηλεκτρονίων στο μόριο του υποστρώματος μετατοπίζεται στο κεντρικό άτομο άνθρακα (επαγωγική επίδραση) και στη συνέχεια κατά μήκος του συστήματος διπλών δεσμών - στο τερματικό άτομο άνθρακα ντο H2 CH2-ομάδες (μεσομερικό φαινόμενο). Έτσι, το πλεονάζον αρνητικό φορτίο εντοπίζεται ακριβώς σε αυτό το άτομο. Επομένως, η επίθεση ξεκινά με το πρωτόνιο υδρογόνου H+ Η+, που είναι ένα ηλεκτρόφιλο σωματίδιο. Σχηματίζεται ένα θετικά φορτισμένο ιόν καρβενίου [Γ H3 – C H − C H3 ] + + , στο οποίο προστίθεται το ανιόν χλωρίου ντο μεγάλο− Cl−.
ΟΡΙΣΜΟΣ
Εξαιρέσεις στον κανόνα του Markovnikov:η αντίδραση προσθήκης προχωρά ενάντια στον κανόνα του Markovnikov εάν η αντίδραση περιλαμβάνει ενώσεις στις οποίες το άτομο άνθρακα που βρίσκεται δίπλα στο άτομο άνθρακα του διπλού δεσμού απορροφά εν μέρει την πυκνότητα ηλεκτρονίων, δηλαδή παρουσία υποκαταστατών που παρουσιάζουν σημαντική επίδραση απόσυρσης ηλεκτρονίων (–C C μεγάλο3 , – C N , – C O O H(–CCl3,–CN,–COOHκαι τα λοιπά.).

Πυρηνόφιλος μηχανισμός: η αντίδραση ξεκινά με πυρηνόφιλα σωματίδια που έχουν αρνητικό φορτίο, που σχηματίζονται ως αποτέλεσμα ετερολυτική ρήξηδιαβιβάσεις. Όλα τα πυρηνόφιλα - τα θεμέλια του Lewis.
Στις πυρηνόφιλες αντιδράσεις, το αντιδραστήριο (πυρηνόφιλο) έχει ένα ελεύθερο ζεύγος ηλεκτρονίων σε ένα από τα άτομα και είναι ένα ουδέτερο μόριο ή ανιόν. H α μεγάλο– , Ο H– , Ρ Ο− , Ρ μικρό– , R C O Ο– , R– , C N – , H2 O, R O H, N H3 , Ρ Ν H2 Hal–,OH–,RO−,RS–,RCOO–,R–,CN–,H2O,ROH,NH3,RNH2και τα λοιπά.).
Το πυρηνόφιλο επιτίθεται στο άτομο στο υπόστρωμα με τη χαμηλότερη πυκνότητα ηλεκτρονίων (δηλαδή με μερικό ή πλήρες θετικό φορτίο). Το πρώτο βήμα στην αντίδραση πυρηνόφιλης υποκατάστασης είναι ο ιονισμός του υποστρώματος για να σχηματιστεί ένα καρβοκατιόν. Σε αυτή την περίπτωση, σχηματίζεται ένας νέος δεσμός λόγω του ζεύγους ηλεκτρονίων του πυρηνόφιλου και ο παλιός υφίσταται ετερολυτική διάσπαση ακολουθούμενη από απομάκρυνση του κατιόντος. Ένα παράδειγμα πυρηνόφιλης αντίδρασης είναι η πυρηνόφιλη υποκατάσταση (σύμβολο μικρόΝ SN) σε ένα κορεσμένο άτομο άνθρακα, για παράδειγμα αλκαλική υδρόλυση βρωμοπαραγώγων.
1. Πυρηνόφιλη υποκατάσταση
2. Πυρηνόφιλη προσθήκη

αιθανάλη κυανυδρίνη
πηγή http://foxford.ru/wiki/himiya
Οι οργανικές αντιδράσεις μπορούν να ταξινομηθούν σε δύο γενικούς τύπους.
Αιμολυτικές αντιδράσεις. Αυτές οι αντιδράσεις προχωρούν με ριζικό μηχανισμό. Θα τα δούμε αναλυτικότερα στο επόμενο κεφάλαιο. Η κινητική και ο μηχανισμός των αντιδράσεων αυτού του τύπου συζητήθηκαν στο Κεφ. 9.
Ετερολυτικές αντιδράσεις. Αυτές οι αντιδράσεις είναι ουσιαστικά ιοντικές αντιδράσεις. Μπορούν, με τη σειρά τους, να χωριστούν σε αντιδράσεις υποκατάστασης, προσθήκης και αποβολής.
Αντιδράσεις υποκατάστασης
Σε αυτές τις αντιδράσεις, ένα άτομο ή μια ομάδα ατόμων αντικαθίσταται από ένα άλλο άτομο ή ομάδα. Ως παράδειγμα αντιδράσεων αυτού του τύπου δίνουμε την υδρόλυση του χλωρομεθανίου με το σχηματισμό μεθανόλης:
Το ιόν υδροξυλίου είναι πυρηνόφιλο. Επομένως, η εν λόγω υποκατάσταση ονομάζεται πυρηνόφιλη υποκατάσταση. Υποδηλώνεται με το σύμβολο SN. Το αντικατεστημένο σωματίδιο (στην περίπτωση αυτή, ένα ιόν χλωρίου) ονομάζεται αποχωρούσα ομάδα.
Αν συμβολίσουμε το πυρηνόφιλο με το σύμβολο και την αποχωρούσα ομάδα με το σύμβολο, τότε μπορούμε να γράψουμε τη γενικευμένη εξίσωση για την αντίδραση της πυρηνόφιλης υποκατάστασης σε ένα κορεσμένο άτομο άνθρακα στην αλκυλομάδα R ως εξής:
Μια μελέτη του ρυθμού των αντιδράσεων αυτού του τύπου δείχνει ότι οι αντιδράσεις μπορούν να χωριστούν σε
Αντιδράσεις του τύπου Για ορισμένες αντιδράσεις τύπου SN, η κινητική εξίσωση για τον ρυθμό αντίδρασης (βλ. Ενότητα 9.1) έχει τη μορφή
Έτσι, αυτές οι αντιδράσεις είναι πρώτης τάξης στο υπόστρωμα αλλά μηδενικής τάξης στο αντιδρών.Η κινητική χαρακτηριστική μιας αντίδρασης πρώτης τάξης είναι μια αξιόπιστη ένδειξη ότι το στάδιο περιορισμού της ταχύτητας της αντίδρασης είναι μια μονομοριακή διαδικασία. Επομένως, αντιδράσεις αυτού του τύπου υποδεικνύονται με το σύμβολο.
Η αντίδραση έχει μηδενική τάξη σε σχέση με το αντιδραστήριο αφού ο ρυθμός της δεν εξαρτάται από τη συγκέντρωση του αντιδραστηρίου. Επομένως, μπορούμε να γράψουμε:
Εφόσον το πυρηνόφιλο δεν συμμετέχει στο στάδιο περιορισμού της ταχύτητας της αντίδρασης, ο μηχανισμός μιας τέτοιας αντίδρασης πρέπει να περιλαμβάνει τουλάχιστον δύο στάδια. Ο ακόλουθος μηχανισμός έχει προταθεί για τέτοιες αντιδράσεις:

Το πρώτο στάδιο είναι ο ιονισμός με το σχηματισμό ενός καρβοκατιόντος.Το στάδιο αυτό είναι περιοριστικό (αργό).
Ένα παράδειγμα αυτού του τύπου αντίδρασης είναι η αλκαλική υδρόλυση τριτοταγών αλκυλαλογονιδίων. Για παράδειγμα
Στην περίπτωση που εξετάζουμε, ο ρυθμός αντίδρασης καθορίζεται από την εξίσωση
Αντιδράσεις του τύπου Για ορισμένες αντιδράσεις πυρηνόφιλης υποκατάστασης SN η εξίσωση ταχύτητας έχει τη μορφή
Σε αυτή την περίπτωση, η αντίδραση είναι πρώτης τάξης στο πυρηνόφιλο και πρώτης τάξης σε . Γενικά, είναι αντίδραση δεύτερης τάξης. Αυτός είναι επαρκής λόγος για να πιστεύουμε ότι το στάδιο περιορισμού του ρυθμού αυτής της αντίδρασης είναι μια διμοριακή διαδικασία. Επομένως, η αντίδραση του υπό εξέταση τύπου συμβολίζεται με το σύμβολο Δεδομένου ότι τόσο το πυρηνόφιλο όσο και το υπόστρωμα συμμετέχουν ταυτόχρονα στο στάδιο περιορισμού του ρυθμού της αντίδρασης, μπορούμε να σκεφτούμε ότι αυτή η αντίδραση προχωρά σε ένα στάδιο μέσω μιας μεταβατικής κατάστασης (βλ. Ενότητα 9.2):
Η υδρόλυση πρωτογενών αλκυλαλογονιδίων σε αλκαλικό μέσο προχωρά σύμφωνα με τον μηχανισμό

Αυτή η αντίδραση έχει την ακόλουθη κινητική εξίσωση:
Μέχρι στιγμής έχουμε εξετάσει την πυρηνόφιλη υποκατάσταση μόνο στο κορεσμένο άτομο άνθρακα. Η πυρηνόφιλη υποκατάσταση είναι επίσης δυνατή σε ένα ακόρεστο άτομο άνθρακα:

Οι αντιδράσεις αυτού του τύπου ονομάζονται πυρηνόφιλη ακυλική υποκατάσταση.
Ηλεκτρόφιλη υποκατάσταση. Αντιδράσεις ηλεκτρόφιλης υποκατάστασης μπορούν επίσης να συμβούν σε δακτυλίους βενζολίου. Σε αυτόν τον τύπο υποκατάστασης, ο δακτύλιος βενζολίου τροφοδοτεί το ηλεκτρόφιλο με δύο από τα μετατοπισμένα ηλεκτρόνια του. Σε αυτή την περίπτωση, σχηματίζεται μια ενδιάμεση ένωση - ένα ασταθές σύμπλεγμα ενός ηλεκτροφίλου και μιας αποχωρούσας ομάδας. Για μια σχηματική αναπαράσταση τέτοιων συμπλεγμάτων, χρησιμοποιείται ένας ανοιχτός κύκλος, που υποδεικνύει την απώλεια δύο ηλεκτρονίων:

Ένα παράδειγμα αντιδράσεων ηλεκτρόφιλης υποκατάστασης είναι η νίτρωση του βενζολίου:

Η νίτρωση του βενζολίου πραγματοποιείται σε εγκατάσταση με συμπυκνωτή αναρροής σε θερμοκρασία 55 έως 60 ° C χρησιμοποιώντας μίγμα νιτροποίησης. Αυτό το μείγμα περιέχει ίσες ποσότητες συμπυκνωμένου νιτρικού και θειικού οξέος. Η αντίδραση μεταξύ αυτών των οξέων οδηγεί στο σχηματισμό ενός κατιόντος νιτροϋλίου
Αντιδράσεις προσθήκης
Σε αντιδράσεις αυτού του τύπου, ένα ηλεκτρόφιλο ή πυρηνόφιλο προστίθεται σε ένα ακόρεστο άτομο άνθρακα. Θα εξετάσουμε εδώ ένα παράδειγμα ηλεκτρόφιλης προσθήκης και πυρηνόφιλης προσθήκης.
Ένα παράδειγμα ηλεκτρόφιλης προσθήκης είναι η αντίδραση μεταξύ υδροβρωμίου και αλκενίου. Για τη λήψη υδροβρωμίου στο εργαστήριο, μπορεί να χρησιμοποιηθεί μια αντίδραση μεταξύ πυκνού θειικού οξέος και βρωμιούχου νατρίου (βλ. Ενότητα 16.2). Τα μόρια υδροβρωμίου είναι πολικά επειδή το άτομο βρωμίου έχει αρνητική επαγωγική επίδραση στο υδρογόνο. Επομένως, το μόριο υδροβρωμίου έχει τις ιδιότητες ενός ισχυρού οξέος. Σύμφωνα με τις σύγχρονες απόψεις, η αντίδραση του υδροβρωμίου με τα αλκένια γίνεται σε δύο στάδια. Στο πρώτο στάδιο, ένα θετικά φορτισμένο άτομο υδρογόνου επιτίθεται στον διπλό δεσμό, ο οποίος λειτουργεί ως πηγή ηλεκτρονίων. Ως αποτέλεσμα, σχηματίζεται ένα ενεργοποιημένο σύμπλοκο και ένα ιόν βρωμιδίου:

Το βρωμιούχο ιόν στη συνέχεια επιτίθεται σε αυτό το σύμπλοκο, με αποτέλεσμα το σχηματισμό ενός αλκυλοβρωμιδίου:

Ένα παράδειγμα πυρηνόφιλης προσθήκης είναι η προσθήκη υδροκυανίου σε οποιαδήποτε αλδεΰδη ή κετόνη. Αρχικά, η αλδεΰδη ή η κετόνη υποβάλλονται σε επεξεργασία με ένα υδατικό διάλυμα κυανιούχου νατρίου και στη συνέχεια προστίθεται μια περίσσεια ποσότητας οποιουδήποτε ανόργανου οξέος, η οποία οδηγεί στον σχηματισμό του υδροκυανίου HCN. Το κυανιούχο ιόν είναι πυρηνόφιλο. Επιτίθεται στο θετικά φορτισμένο άτομο άνθρακα στην καρβονυλική ομάδα της αλδεΰδης ή της κετόνης. Το θετικό φορτίο και η πολικότητα της καρβονυλικής ομάδας οφείλεται στο μεσομερικό αποτέλεσμα, το οποίο περιγράφηκε παραπάνω. Η αντίδραση μπορεί να αναπαρασταθεί από το ακόλουθο διάγραμμα:

Αντιδράσεις εξάλειψης
Αυτές οι αντιδράσεις είναι το αντίστροφο των αντιδράσεων προσθήκης. Οδηγούν στην απομάκρυνση τυχόν ατόμων ή ομάδων ατόμων από δύο άτομα άνθρακα που συνδέονται μεταξύ τους με έναν απλό ομοιοπολικό δεσμό, με αποτέλεσμα το σχηματισμό πολλαπλού δεσμού μεταξύ τους.
Ένα παράδειγμα τέτοιας αντίδρασης είναι η απομάκρυνση υδρογόνου και αλογόνου από αλκυλαλογονίδια:
Για να πραγματοποιηθεί αυτή η αντίδραση, το αλκυλαλογονίδιο υποβάλλεται σε επεξεργασία με υδροξείδιο του καλίου σε αλκοόλη σε θερμοκρασία 60 °C.
Θα πρέπει να σημειωθεί ότι η επεξεργασία ενός αλκυλαλογονιδίου με υδροξείδιο οδηγεί επίσης σε πυρηνόφιλη υποκατάσταση (βλ. παραπάνω). Ως αποτέλεσμα, δύο ανταγωνιστικές αντιδράσεις υποκατάστασης και αποβολής συμβαίνουν ταυτόχρονα, γεγονός που οδηγεί στον σχηματισμό ενός μείγματος προϊόντων υποκατάστασης και απομάκρυνσης. Ποια από αυτές τις αντιδράσεις θα είναι κυρίαρχη εξαρτάται από διάφορους παράγοντες, συμπεριλαμβανομένου του περιβάλλοντος στο οποίο διεξάγεται η αντίδραση. Η πυρηνόφιλη υποκατάσταση των αλκυλαλογονιδίων πραγματοποιείται παρουσία νερού. Αντίθετα, οι αντιδράσεις απομάκρυνσης πραγματοποιούνται απουσία νερού και σε υψηλότερες θερμοκρασίες.
Ας τα ξαναπούμε λοιπόν!
1. Κατά την αιμολυτική διάσπαση ενός δεσμού, δύο κοινά ηλεκτρόνια κατανέμονται ομοιόμορφα μεταξύ των ατόμων.
2. Κατά τη διάσπαση του ετερολυτικού δεσμού, δύο κοινά ηλεκτρόνια κατανέμονται άνισα μεταξύ των ατόμων.
3. Ένα καρβανιόν είναι ένα ιόν που περιέχει ένα άτομο άνθρακα με αρνητικό φορτίο.
4. Ένα καρβοκατιόν είναι ένα ιόν που περιέχει ένα άτομο άνθρακα με θετικό φορτίο.
5. Τα αποτελέσματα των διαλυτών μπορούν να έχουν σημαντικό αντίκτυπο στις χημικές διεργασίες και στις σταθερές ισορροπίας τους.
6. Η επίδραση του χημικού περιβάλλοντος μιας λειτουργικής ομάδας μέσα σε ένα μόριο στην αντιδραστικότητα αυτής της λειτουργικής ομάδας ονομάζεται δομική επίδραση.
7. Τα ηλεκτρονικά εφέ και τα στερικά εφέ ονομάζονται συλλογικά δομικά φαινόμενα.
8. Τα δύο πιο σημαντικά ηλεκτρονικά εφέ είναι το επαγωγικό φαινόμενο και το μεσομερικό (συντονιστικό) φαινόμενο.
9. Το επαγωγικό φαινόμενο είναι η μετατόπιση της πυκνότητας των ηλεκτρονίων από το ένα άτομο στο άλλο, που οδηγεί σε πόλωση του δεσμού μεταξύ των δύο ατόμων. Αυτή η επίδραση μπορεί να είναι θετική ή αρνητική.
10. Μοριακά σωματίδια με πολλαπλούς δεσμούς μπορεί να υπάρχουν με τη μορφή συντονισμένων υβριδίων μεταξύ δύο ή περισσότερων συντονιστικών δομών.
11. Το μεσομερικό (συντονισμός) φαινόμενο συνίσταται στη σταθεροποίηση των συντονισμένων υβριδίων λόγω της μετεγκατάστασης των -ηλεκτρονίων.
12. Στερική παρεμπόδιση μπορεί να συμβεί όταν ογκώδεις ομάδες σε ένα μόριο εμποδίζουν μηχανικά την αντίδραση.
13. Πυρηνόφιλο είναι ένα σωματίδιο που προσβάλλει ένα άτομο άνθρακα, τροφοδοτώντας το με το ζεύγος ηλεκτρονίων του. Το πυρηνόφιλο είναι μια βάση Lewis.
14. Ηλεκτρόφιλο είναι ένα σωματίδιο που προσβάλλει ένα άτομο άνθρακα, δεχόμενο το ζεύγος ηλεκτρονίων του. Το πυρηνόφιλο είναι ένα οξύ Lewis.
15. Οι αιμολυτικές αντιδράσεις είναι ριζικές αντιδράσεις.
16. Οι ετερολυτικές αντιδράσεις είναι κυρίως ιοντικές.
17. Η αντικατάσταση οποιασδήποτε ομάδας σε ένα μόριο με ένα πυρηνόφιλο αντιδραστήριο ονομάζεται πυρηνόφιλη υποκατάσταση. Η ομάδα που αντικαθίσταται σε αυτή την περίπτωση ονομάζεται ομάδα αποχώρησης.
18. Η ηλεκτρόφιλη υποκατάσταση σε έναν δακτύλιο βενζολίου περιλαμβάνει τη δωρεά δύο μη εντοπισμένων ηλεκτρονίων σε κάποιο ηλεκτρόφιλο.
19. Στις αντιδράσεις ηλεκτρόφιλης προσθήκης, ένα ηλεκτρόφιλο προστίθεται σε ένα ακόρεστο άτομο άνθρακα.
20. Η προσθήκη υδροκυανίου σε αλδεΰδες ή κετόνες είναι ένα παράδειγμα πυρηνόφιλης προσθήκης.
21. Στις αντιδράσεις εξάλειψης (εξάλειψης), ορισμένα άτομα ή ομάδες ατόμων διαχωρίζονται από δύο άτομα άνθρακα που συνδέονται μεταξύ τους με έναν απλό ομοιοπολικό δεσμό. Ως αποτέλεσμα, σχηματίζεται ένας πολλαπλός δεσμός μεταξύ αυτών των ατόμων άνθρακα.