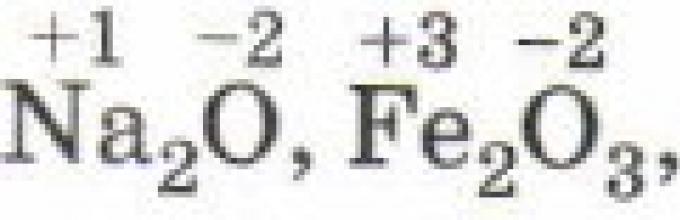Για να χαρακτηριστεί η κατάσταση των στοιχείων σε ενώσεις, εισήχθη η έννοια της κατάστασης οξείδωσης.
ΟΡΙΣΜΟΣ
Ο αριθμός των ηλεκτρονίων που μετατοπίζονται από ένα άτομο ενός δεδομένου στοιχείου ή σε ένα άτομο ενός δεδομένου στοιχείου σε μια ένωση ονομάζεται κατάσταση οξείδωσης.
Μια θετική κατάσταση οξείδωσης υποδηλώνει τον αριθμό των ηλεκτρονίων που μετατοπίζονται από ένα δεδομένο άτομο, ενώ μια αρνητική κατάσταση οξείδωσης υποδηλώνει τον αριθμό των ηλεκτρονίων που μετατοπίζονται προς ένα δεδομένο άτομο.
Από αυτόν τον ορισμό προκύπτει ότι σε ενώσεις με μη πολικούς δεσμούς, η κατάσταση οξείδωσης των στοιχείων είναι μηδέν. Παραδείγματα τέτοιων ενώσεων είναι μόρια που αποτελούνται από πανομοιότυπα άτομα (N 2, H 2, Cl 2).
Η κατάσταση οξείδωσης των μετάλλων στη στοιχειώδη κατάσταση είναι μηδέν, αφού η κατανομή της πυκνότητας ηλεκτρονίων σε αυτά είναι ομοιόμορφη.
Σε απλές ιοντικές ενώσεις, η κατάσταση οξείδωσης των συστατικών τους στοιχείων είναι ίση με το ηλεκτρικό φορτίο, αφού κατά τον σχηματισμό αυτών των ενώσεων, συμβαίνει σχεδόν πλήρης μετάβαση ηλεκτρονίων από το ένα άτομο στο άλλο: Na +1 I -1, Mg +2 Cl -1 2, Al +3 F - 1 3, Zr +4 Br -1 4.
Κατά τον προσδιορισμό της κατάστασης οξείδωσης των στοιχείων σε ενώσεις με πολικούς ομοιοπολικούς δεσμούς, συγκρίνονται οι τιμές των ηλεκτραρνητικοτήτων τους. Δεδομένου ότι κατά το σχηματισμό ενός χημικού δεσμού, τα ηλεκτρόνια μετατοπίζονται σε άτομα περισσότερων ηλεκτραρνητικών στοιχείων, τα τελευταία έχουν αρνητική κατάσταση οξείδωσης στις ενώσεις.
Χαμηλότερη κατάσταση οξείδωσης
Για στοιχεία που εμφανίζουν διαφορετικές καταστάσεις οξείδωσης στις ενώσεις τους, υπάρχουν έννοιες της υψηλότερης (μέγιστης θετικής) και της χαμηλότερης (ελάχιστης αρνητικής) κατάστασης οξείδωσης. Η χαμηλότερη κατάσταση οξείδωσης ενός χημικού στοιχείου είναι συνήθως αριθμητικά ίση με τη διαφορά μεταξύ του αριθμού ομάδας στον Περιοδικό Πίνακα του DI Mendeleev, στον οποίο βρίσκεται το χημικό στοιχείο, και του αριθμού 8. Για παράδειγμα, το άζωτο είναι στην ομάδα VA, που σημαίνει ότι η χαμηλότερη κατάσταση οξείδωσης είναι (-3): V-VIII = -3; Το θείο ανήκει στην ομάδα VIA, που σημαίνει ότι η χαμηλότερη κατάσταση οξείδωσης είναι (-2): VI-VIII = -2, κ.λπ.
Παραδείγματα επίλυσης προβλημάτων
ΠΑΡΑΔΕΙΓΜΑ 1
ΟΡΙΣΜΟΣ
Κατάσταση οξείδωσηςείναι μια ποσοτική εκτίμηση της κατάστασης ενός ατόμου ενός χημικού στοιχείου σε μια ένωση, με βάση την ηλεκτραρνητικότητα του.
Παίρνει και θετικές και αρνητικές τιμές. Για να υποδείξετε την κατάσταση οξείδωσης ενός στοιχείου σε μια ένωση, πρέπει να βάλετε έναν αραβικό αριθμό πάνω από το σύμβολό του με το αντίστοιχο πρόσημο ("+" ή "-").
Θα πρέπει να θυμόμαστε ότι η κατάσταση οξείδωσης είναι μια ποσότητα που δεν έχει φυσική σημασία, καθώς δεν αντικατοπτρίζει το πραγματικό φορτίο ενός ατόμου. Ωστόσο, αυτή η έννοια χρησιμοποιείται ευρέως στη χημεία.
Πίνακας κατάστασης οξείδωσης χημικών στοιχείων
Η μέγιστη θετική και η ελάχιστη αρνητική κατάσταση οξείδωσης μπορούν να προσδιοριστούν χρησιμοποιώντας τον Περιοδικό Πίνακα του D.I. Μεντελέεφ. Είναι ίσα με τον αριθμό της ομάδας στην οποία βρίσκεται το στοιχείο και τη διαφορά μεταξύ της τιμής της «υψηλότερης» κατάστασης οξείδωσης και του αριθμού 8, αντίστοιχα.
Αν εξετάσουμε πιο συγκεκριμένα τις χημικές ενώσεις, τότε σε ουσίες με μη πολικούς δεσμούς, η κατάσταση οξείδωσης των στοιχείων είναι μηδέν (N 2, H 2, Cl 2).
Η κατάσταση οξείδωσης των μετάλλων στη στοιχειώδη κατάσταση είναι μηδέν, αφού η κατανομή της πυκνότητας ηλεκτρονίων σε αυτά είναι ομοιόμορφη.
Σε απλές ιοντικές ενώσεις, η κατάσταση οξείδωσης των συστατικών τους στοιχείων είναι ίση με το ηλεκτρικό φορτίο, αφού κατά τον σχηματισμό αυτών των ενώσεων, συμβαίνει σχεδόν πλήρης μετάβαση ηλεκτρονίων από το ένα άτομο στο άλλο: Na +1 I -1, Mg +2 Cl -1 2, Al +3 F - 1 3, Zr +4 Br -1 4.
Κατά τον προσδιορισμό της κατάστασης οξείδωσης των στοιχείων σε ενώσεις με πολικούς ομοιοπολικούς δεσμούς, συγκρίνονται οι τιμές των ηλεκτραρνητικοτήτων τους. Δεδομένου ότι κατά το σχηματισμό ενός χημικού δεσμού, τα ηλεκτρόνια μετατοπίζονται σε άτομα περισσότερων ηλεκτραρνητικών στοιχείων, τα τελευταία έχουν αρνητική κατάσταση οξείδωσης στις ενώσεις.
Υπάρχουν στοιχεία για τα οποία είναι χαρακτηριστική μόνο μία τιμή της κατάστασης οξείδωσης (φθόριο, μέταλλα των ομάδων ΙΑ και ΙΙΑ κ.λπ.). Το φθόριο, που έχει την υψηλότερη τιμή ηλεκτραρνητικότητας, στις ενώσεις έχει πάντα μια σταθερή αρνητική κατάσταση οξείδωσης (-1).
Τα στοιχεία αλκαλικής και αλκαλικής γαίας, που χαρακτηρίζονται από σχετικά χαμηλή τιμή ηλεκτραρνητικότητας, έχουν πάντα θετική κατάσταση οξείδωσης ίση με (+1) και (+2), αντίστοιχα.
Ωστόσο, υπάρχουν και τέτοια χημικά στοιχεία, τα οποία χαρακτηρίζονται από πολλές τιμές της κατάστασης οξείδωσης (θείο - (-2), 0, (+2), (+4), (+6), κ.λπ.).
Για να είναι πιο εύκολο να θυμάστε πόσες και ποιες καταστάσεις οξείδωσης είναι χαρακτηριστικές για ένα συγκεκριμένο χημικό στοιχείο, χρησιμοποιούνται πίνακες καταστάσεων οξείδωσης χημικών στοιχείων, οι οποίοι μοιάζουν με αυτό:
|
Σειριακός αριθμός |
Ρωσικά / Αγγλικά τίτλος |
Χημικό σύμβολο |
Κατάσταση οξείδωσης |
|
Υδρογόνο / Υδρογόνο |
|||
|
Ήλιο / Ήλιο |
|||
|
Λίθιο / Λίθιο |
|||
|
Βηρύλλιο / Βηρύλλιο |
|||
|
(-1), 0, (+1), (+2), (+3) |
|||
|
Carbon / Carbon |
(-4), (-3), (-2), (-1), 0, (+2), (+4) |
||
|
Άζωτο / Άζωτο |
(-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
||
|
Οξυγόνο / Οξυγόνο |
(-2), (-1), 0, (+1), (+2) |
||
|
Φθόριο / Φθόριο |
|||
|
Νάτριο / Νάτριο |
|||
|
Μαγνήσιο / Μαγνήσιο |
|||
|
Αλουμίνιο / Αλουμίνιο |
|||
|
Πυρίτιο / Πυρίτιο |
(-4), 0, (+2), (+4) |
||
|
Φώσφορος |
(-3), 0, (+3), (+5) |
||
|
Θείο / Sulfur |
(-2), 0, (+4), (+6) |
||
|
Χλώριο / Chlorine |
(-1), 0, (+1), (+3), (+5), (+7), σπάνια (+2) και (+4) |
||
|
Argon / Argon |
|||
|
Κάλιο |
|||
|
Ασβέστιο / Ασβέστιο |
|||
|
Scandium / Scandium |
|||
|
Titanium / Titanium |
(+2), (+3), (+4) |
||
|
Βανάδιο / Vanadium |
(+2), (+3), (+4), (+5) |
||
|
Chromium / Chromium |
(+2), (+3), (+6) |
||
|
Μαγγάνιο / Μαγγάνιο |
(+2), (+3), (+4), (+6), (+7) |
||
|
Σίδερο / Σίδερο |
(+2), (+3), σπάνια (+4) και (+6) |
||
|
Κοβάλτιο / Κοβάλτιο |
(+2), (+3), σπάνια (+4) |
||
|
Νικέλιο / Νικέλιο |
(+2), σπάνια (+1), (+3) και (+4) |
||
|
Χαλκός / Χαλκός |
+1, +2, σπάνια (+3) |
||
|
Γάλλιο / Γάλλιο |
(+3), σπάνια (+2) |
||
|
Germanium / Germanium |
(-4), (+2), (+4) |
||
|
Αρσενικό / Αρσενικό |
(-3), (+3), (+5), σπάνια (+2) |
||
|
Σελήνιο / Σελήνιο |
(-2), (+4), (+6), σπάνια (+2) |
||
|
Βρώμιο / Bromine |
(-1), (+1), (+5), σπάνια (+3), (+4) |
||
|
Κρύπτον / Κρύπτον |
|||
|
Ρουβίδιο / Ρουβίδιο |
|||
|
Στρόντιο / Στρόντιο |
|||
|
Ύττριο / Ύττριο |
|||
|
Ζιρκόνιο / Ζιρκόνιο |
(+4), σπάνια (+2) και (+3) |
||
|
Νιόβιο / Νιόβιο |
(+3), (+5), σπάνια (+2) και (+4) |
||
|
Molybdenum / Molybdenum |
(+3), (+6), σπάνια (+2), (+3) και (+5) |
||
|
Τεχνήτιο |
|||
|
Ρουθήνιο / Ρουθήνιο |
(+3), (+4), (+8), σπάνια (+2), (+6) και (+7) |
||
|
Ρόδιο / Ρόδιο |
(+4), σπάνια (+2), (+3) και (+6) |
||
|
Παλλάδιο / Palladium |
(+2), (+4), σπάνια (+6) |
||
|
Ασημί / Ασήμι |
(+1), σπάνια (+2) και (+3) |
||
|
Κάδμιο / Κάδμιο |
(+2), σπάνια (+1) |
||
|
Indium / Indium |
(+3), σπάνια (+1) και (+2) |
||
|
Tin / Tin |
(+2), (+4) |
||
|
Αντιμόνιο / Αντιμόνιο |
(-3), (+3), (+5), σπάνια (+4) |
||
|
Τελλούριο / Τελλούριο |
(-2), (+4), (+6), σπάνια (+2) |
||
|
(-1), (+1), (+5), (+7), σπάνια (+3), (+4) |
|||
|
Xenon / Xenon |
|||
|
Καισίου / Καισίου |
|||
|
Βάριο / Βάριο |
|||
|
Λανθάνιο / Lanthanum |
|||
|
Δημήτριο / Cerium |
(+3), (+4) |
||
|
Πρασεοδύμιο |
|||
|
Νεοδύμιο / Νεοδύμιο |
(+3), (+4) |
||
|
Προμέθιο / Promethium |
|||
|
Σαμάριο |
(+3), σπάνια (+2) |
||
|
Europium / Europium |
(+3), σπάνια (+2) |
||
|
Γαδολίνιο / Gadolinium |
|||
|
Terbium / Terbium |
(+3), (+4) |
||
|
Δυσπρόσιο / Dysprosium |
|||
|
Holmium / Holmium |
|||
|
Έρβιο / Erbium |
|||
|
Θούλιο / Θούλιο |
(+3), σπάνια (+2) |
||
|
Υτέρβιο / Υτέρβιο |
(+3), σπάνια (+2) |
||
|
Λουτέτιο |
|||
|
Χάφνιο / Hafnium |
|||
|
Ταντάλιο / Tantalum |
(+5), σπάνια (+3), (+4) |
||
|
Βολφράμιο / Βολφράμιο |
(+6), σπάνια (+2), (+3), (+4) και (+5) |
||
|
Ρήνιο / Ρήνιο |
(+2), (+4), (+6), (+7), σπάνια (-1), (+1), (+3), (+5) |
||
|
Όσμιο / Όσμιο |
(+3), (+4), (+6), (+8), σπάνια (+2) |
||
|
Iridium / Iridium |
(+3), (+4), (+6), σπάνια (+1) και (+2) |
||
|
Πλατίνα / Platinum |
(+2), (+4), (+6), σπάνια (+1) και (+3) |
||
|
Χρυσός / Χρυσός |
(+1), (+3), σπάνια (+2) |
||
|
Ερμής / Mercury |
(+1), (+2) |
||
|
Θάλλιο / Thallium |
(+1), (+3), σπάνια (+2) |
||
|
Μόλυβδος / Μόλυβδος |
(+2), (+4) |
||
|
Βισμούθιο / Βισμούθιο |
(+3), σπάνια (+3), (+2), (+4) και (+5) |
||
|
Πολώνιο / Πολώνιο |
(+2), (+4), σπάνια (-2) και (+6) |
||
|
Αστατίνη / Αστατίνη |
|||
|
Ραδόνιο / Ραδόνιο |
|||
|
Francium / Francium |
|||
|
Ράδιο / Ράδιο |
|||
|
Ακτίνιο / Ακτίνιο |
|||
|
Θόριο / Θόριο |
|||
|
Προακτίνιο / Protactinium |
|||
|
Ουράνιο / Ουράνιο |
(+3), (+4), (+6), σπάνια (+2) και (+5) |
Παραδείγματα επίλυσης προβλημάτων
ΠΑΡΑΔΕΙΓΜΑ 1
- Η κατάσταση οξείδωσης του φωσφόρου στη φωσφίνη είναι (-3), και στο ορθοφωσφορικό οξύ - (+5). Αλλαγή στην κατάσταση οξείδωσης του φωσφόρου: +3 → +5, δηλ. πρώτη επιλογή απάντησης.
- Η κατάσταση οξείδωσης ενός χημικού στοιχείου σε μια απλή ουσία είναι μηδέν. Η κατάσταση οξείδωσης του φωσφόρου στο οξείδιο της σύνθεσης P 2 O 5 είναι (+5). Αλλαγή στην κατάσταση οξείδωσης του φωσφόρου: 0 → +5, δηλ. τρίτη επιλογή απάντησης.
- Η κατάσταση οξείδωσης του φωσφόρου στο οξύ της σύνθεσης HPO 3 είναι (+5), και H 3 PO 2 - (+1). Αλλαγή στην κατάσταση οξείδωσης του φωσφόρου: +5 → +1, δηλ. πέμπτη επιλογή απάντησης.
ΠΑΡΑΔΕΙΓΜΑ 2
| Ασκηση | Η κατάσταση οξείδωσης (-3) ο άνθρακας έχει στην ένωση: α) CH 3 Cl; β) C2H2; γ) HCOH; δ) C 2 H 6. |
| Λύση | Για να δώσουμε τη σωστή απάντηση στο ερώτημα που τέθηκε, θα προσδιορίσουμε εναλλάξ την κατάσταση οξείδωσης του άνθρακα σε κάθε μία από τις προτεινόμενες ενώσεις. α) η κατάσταση οξείδωσης του υδρογόνου είναι (+1), και το χλώριο είναι (-1). Ας πάρουμε την κατάσταση οξείδωσης του άνθρακα ως "x": x + 3 × 1 + (-1) = 0; Η απάντηση είναι λάθος. β) η κατάσταση οξείδωσης του υδρογόνου είναι (+1). Ας πάρουμε την κατάσταση οξείδωσης του άνθρακα για το "y": 2 × y + 2 × 1 = 0; Η απάντηση είναι λάθος. γ) η κατάσταση οξείδωσης του υδρογόνου είναι (+1), και το οξυγόνο είναι (-2). Ας πάρουμε την κατάσταση οξείδωσης του άνθρακα για το "z": 1 + z + (-2) +1 = 0: Η απάντηση είναι λάθος. δ) η κατάσταση οξείδωσης του υδρογόνου είναι (+1). Ας πάρουμε την κατάσταση οξείδωσης του άνθρακα για το "a": 2 × a + 6 × 1 = 0; Σωστή απάντηση. |
| Απάντηση | Επιλογή (δ) |
Κατά τη μελέτη των ιοντικών και ομοιοπολικών πολικών χημικών δεσμών, γνωρίσατε πολύπλοκες ουσίες, που αποτελούνται από δύο χημικά στοιχεία. Τέτοιες ουσίες ονομάζονται δυαδικές (από τα λατινικά bi - two) ή δύο στοιχείων.
Ας θυμηθούμε τις τυπικές δυαδικές ενώσεις, τις οποίες δώσαμε ως παράδειγμα για να εξετάσουμε τους μηχανισμούς σχηματισμού ιοντικών και ομοιοπολικών πολικών χημικών δεσμών: NaCl - χλωριούχο νάτριο και HCl - υδροχλώριο.
Στην πρώτη περίπτωση, ο δεσμός είναι ιοντικός: το άτομο νατρίου μετέφερε το εξωτερικό του ηλεκτρόνιο στο άτομο χλωρίου και μετατράπηκε σε ιόν με φορτίο +1, και το άτομο χλωρίου πήρε ένα ηλεκτρόνιο και μετατράπηκε σε ιόν με φορτίο - 1. Σχηματικά, η διαδικασία μετατροπής των ατόμων σε ιόντα μπορεί να απεικονιστεί ως εξής:
Σε ένα μόριο υδροχλωρίου HC1, σχηματίζεται ένας χημικός δεσμός λόγω του ζευγαρώματος μη ζευγαρωμένων εξωτερικών ηλεκτρονίων και του σχηματισμού ενός κοινού ζεύγους ηλεκτρονίων ατόμων υδρογόνου και χλωρίου:
Είναι πιο σωστό να αναπαραστήσουμε τον σχηματισμό ενός ομοιοπολικού δεσμού σε ένα μόριο υδροχλωρίου ως επικάλυψη του νέφους s ενός ηλεκτρονίου του ατόμου υδρογόνου με το νέφος p ενός ηλεκτρονίου του ατόμου χλωρίου:
Κατά τη χημική αλληλεπίδραση, το συνολικό ζεύγος ηλεκτρονίων μετατοπίζεται προς το πιο ηλεκτραρνητικό άτομο χλωρίου: δηλαδή, το ηλεκτρόνιο δεν θα περάσει πλήρως από το άτομο υδρογόνου στο άτομο χλωρίου και μερικώς, προκαλώντας έτσι ένα μερικό φορτίο των ατόμων 5 (βλ. § 12 ):. Αν φανταστούμε ότι στο μόριο υδροχλωρίου HCl, όπως στο χλωριούχο νάτριο NaCl, το ηλεκτρόνιο πέρασε εντελώς από το άτομο του υδρογόνου στο άτομο του χλωρίου, τότε θα λάμβαναν φορτία +1 και -1:. Τέτοια φορτία υπό όρους ονομάζονται κατάσταση οξείδωσης. Κατά τον ορισμό αυτής της έννοιας, θεωρείται συμβατικά ότι στις ομοιοπολικές πολικές ενώσεις, τα συνδετικά ηλεκτρόνια έχουν περάσει πλήρως σε ένα πιο ηλεκτραρνητικό άτομο και επομένως οι ενώσεις αποτελούνται μόνο από θετικά και αρνητικά φορτισμένα ιόντα.
Η κατάσταση οξείδωσης μπορεί να είναι αρνητική, θετική ή μηδενική, τα οποία συνήθως τοποθετούνται πάνω από το σύμβολο του στοιχείου στην κορυφή, για παράδειγμα:
Η αρνητική τιμή της κατάστασης οξείδωσης είναι εκείνα τα άτομα που έχουν λάβει ηλεκτρόνια από άλλα άτομα ή στα οποία έχουν εκτοπιστεί κοινά ζεύγη ηλεκτρονίων, δηλαδή άτομα πιο ηλεκτραρνητικών στοιχείων. Το φθόριο έχει πάντα κατάσταση οξείδωσης -1 σε όλες τις ενώσεις. Το οξυγόνο, το δεύτερο στοιχείο μετά το φθόριο από την άποψη της ηλεκτραρνητικότητας, έχει σχεδόν πάντα κατάσταση οξείδωσης -2, εκτός από τις ενώσεις με φθόριο, για παράδειγμα:
![]()
Θετική τιμή της κατάστασης οξείδωσης έχουν εκείνα τα άτομα που δωρίζουν τα ηλεκτρόνια τους σε άλλα άτομα ή από τα οποία αντλούνται κοινά ζεύγη ηλεκτρονίων, δηλαδή άτομα με λιγότερο ηλεκτραρνητικά στοιχεία. Τα μέταλλα στις ενώσεις έχουν πάντα θετική κατάσταση οξείδωσης. Για τα μέταλλα των κύριων υποομάδων: ομάδα I (ομάδα ΙΑ) σε όλες τις ενώσεις, η κατάσταση οξείδωσης είναι +1, η ομάδα II (ομάδα ΙΙΑ) είναι +2, η ομάδα III (ομάδα IIIA) - +3, για παράδειγμα:
![]()
![]()
αλλά σε ενώσεις με μέταλλα, το υδρογόνο έχει κατάσταση οξείδωσης -1:
![]()
Τα άτομα σε μόρια απλών ουσιών και τα άτομα σε ελεύθερη κατάσταση έχουν μηδενική τιμή της κατάστασης οξείδωσης, για παράδειγμα:
Κοντά στην έννοια της «κατάστασης οξείδωσης» είναι η έννοια του «σθένους», την οποία εξοικειώσατε όταν εξετάζετε έναν ομοιοπολικό χημικό δεσμό. Ωστόσο, δεν είναι το ίδιο πράγμα.
Η έννοια του «σθένους» ισχύει για ουσίες με μοριακή δομή. Η συντριπτική πλειοψηφία των οργανικών ουσιών με τις οποίες θα εξοικειωθείτε στον βαθμό 10 έχουν ακριβώς μια τέτοια δομή. Σε ένα βασικό σχολικό μάθημα, μελετάτε την ανόργανη χημεία, το αντικείμενο της οποίας είναι τόσο μοριακή όσο και μη μοριακή, όπως η ιοντική, δομή. Επομένως, είναι προτιμότερο να χρησιμοποιείται ο όρος «κατάσταση οξείδωσης».
Ποια είναι η διαφορά μεταξύ σθένους και κατάστασης οξείδωσης;
Συχνά το σθένος και η κατάσταση οξείδωσης είναι αριθμητικά ίδιες, αλλά το σθένος δεν έχει πρόσημο φορτίου, αλλά η κατάσταση οξείδωσης έχει. Για παράδειγμα, το μονοσθενές υδρογόνο έχει τις ακόλουθες καταστάσεις οξείδωσης σε διάφορες ουσίες:
![]()
Φαίνεται ότι το μονοσθενές φθόριο - το πιο ηλεκτραρνητικό στοιχείο - θα πρέπει να έχει μια πλήρη σύμπτωση των τιμών της κατάστασης οξείδωσης και του σθένους. Άλλωστε, το άτομό του είναι ικανό να σχηματίσει μόνο έναν μόνο ομοιοπολικό δεσμό, αφού του λείπει ένα ηλεκτρόνιο μέχρι την ολοκλήρωση της εξωτερικής στοιβάδας ηλεκτρονίων. Ωστόσο, υπάρχει μια διαφορά και εδώ:
Το σθένος και η κατάσταση οξείδωσης διαφέρουν ακόμη περισσότερο μεταξύ τους εάν δεν συμπίπτουν αριθμητικά. Για παράδειγμα:
Στις ενώσεις, η ολική κατάσταση οξείδωσης είναι πάντα μηδέν. Γνωρίζοντας αυτό και την κατάσταση οξείδωσης ενός από τα στοιχεία, μπορείτε να βρείτε την κατάσταση οξείδωσης ενός άλλου στοιχείου με τον τύπο, για παράδειγμα, μια δυαδική ένωση. Έτσι, βρίσκουμε την κατάσταση οξείδωσης του χλωρίου στην ένωση C1 2 O 7.
Ας ορίσουμε την κατάσταση οξείδωσης του οξυγόνου:. Επομένως, επτά άτομα οξυγόνου θα έχουν συνολικό αρνητικό φορτίο (-2) x 7 = -14. Τότε το συνολικό φορτίο δύο ατόμων χλωρίου θα είναι +14, και ενός ατόμου χλωρίου: (+14): 2 = +7. Επομένως, η κατάσταση οξείδωσης του χλωρίου είναι.
Ομοίως, γνωρίζοντας τις καταστάσεις οξείδωσης των στοιχείων, μπορείτε να σχηματίσετε μια ένωση, για παράδειγμα, καρβίδιο του αργιλίου (μια ένωση αλουμινίου και άνθρακα).
Είναι εύκολο να δει κανείς ότι παρομοίως δουλέψατε με την έννοια του "σθένους" όταν εξάγατε τον τύπο μιας ομοιοπολικής ένωσης ή προσδιορίσατε το σθένος ενός στοιχείου από τον τύπο της ένωσης του.
Τα ονόματα των δυαδικών ενώσεων σχηματίζονται από δύο λέξεις - τα ονόματα των συστατικών τους χημικών στοιχείων. Η πρώτη λέξη υποδηλώνει το ηλεκτραρνητικό μέρος της ένωσης - μη μέταλλο, το λατινικό της όνομα με το επίθημα -id είναι πάντα στην ονομαστική περίπτωση. Η δεύτερη λέξη υποδηλώνει το ηλεκτροθετικό μέρος - μέταλλο ή λιγότερο ηλεκτραρνητικό στοιχείο, το όνομά του είναι πάντα στη γενετική περίπτωση:
Για παράδειγμα: NaCl - χλωριούχο νάτριο, MgS - θειούχο μαγνήσιο, KH - υδρίδιο του καλίου, CaO - οξείδιο του ασβεστίου. Εάν το ηλεκτροθετικό στοιχείο εμφανίζει διαφορετικές καταστάσεις οξείδωσης, τότε αυτό αντανακλάται στο όνομα, δηλώνοντας την κατάσταση οξείδωσης με έναν λατινικό αριθμό, ο οποίος τοποθετείται στο τέλος του ονόματος, για παράδειγμα: - οξείδιο σιδήρου (II) (διαβάστε "οξείδιο του σιδήρου δύο"), - οξείδιο σιδήρου (III) (διαβάστε "οξείδιο σιδήρου τρία").
Εάν η ένωση αποτελείται από δύο μη μεταλλικά στοιχεία, τότε το επίθημα -id προστίθεται στο όνομα του πιο ηλεκτραρνητικού από αυτά, το δεύτερο συστατικό τίθεται στη συνέχεια στη γενετική περίπτωση. Για παράδειγμα: - φθόριο οξυγόνου (II), - οξείδιο του θείου (IV) και - οξείδιο του θείου (VI).
Σε ορισμένες περιπτώσεις, ο αριθμός των ατόμων των στοιχείων υποδεικνύεται χρησιμοποιώντας τα ονόματα των αριθμών στα ελληνικά - μονο, δι, τρία, τετρά, πεντα, εξά, κ.λπ. Για παράδειγμα: - μονοξείδιο του άνθρακα, ή μονοξείδιο του άνθρακα (II), - άνθρακας διοξείδιο ή οξείδιο του άνθρακα (IV), - τετραχλωριούχος μόλυβδος ή χλωριούχος μόλυβδος (IV).
Προκειμένου οι χημικοί από διαφορετικές χώρες να κατανοήσουν ο ένας τον άλλον, ήταν απαραίτητο να δημιουργηθεί μια ενοποιημένη ορολογία και ονοματολογία ουσιών. Οι αρχές της χημικής ονοματολογίας αναπτύχθηκαν για πρώτη φορά από τους Γάλλους χημικούς A. Lavoisier, A. Furcroix, L. Guiton de Mervaux και C. Berthollet το 1785. Επί του παρόντος, η International Union of Theoretical and Applied Chemistry (IUPAC) συντονίζει τις δραστηριότητες των επιστημόνων. από διαφορετικές χώρες και εκδίδει συστάσεις σχετικά με την ονοματολογία των ουσιών και την ορολογία που χρησιμοποιείται στη χημεία.
Λέξεις-κλειδιά και φράσεις
- Δυαδικές ή δύο στοιχείων, ενώσεις.
- Κατάσταση οξείδωσης.
- Χημική ονοματολογία.
- Προσδιορισμός των καταστάσεων οξείδωσης των στοιχείων με τον τύπο.
- Σύνταξη τύπων δυαδικών ενώσεων σύμφωνα με τις καταστάσεις οξείδωσης των στοιχείων.
Εργασία με υπολογιστή
- Ανατρέξτε στο ηλεκτρονικό συνημμένο. Μελετήστε την ύλη του μαθήματος και ολοκληρώστε τις προτεινόμενες εργασίες.
- Αναζητήστε στο Διαδίκτυο διευθύνσεις ηλεκτρονικού ταχυδρομείου που μπορούν να χρησιμεύσουν ως πρόσθετες πηγές για την αποκάλυψη του περιεχομένου των λέξεων-κλειδιών και των φράσεων της παραγράφου. Προσφερθείτε να βοηθήσετε τον δάσκαλο να προετοιμάσει ένα νέο μάθημα αναφέροντας τις λέξεις-κλειδιά και τις φράσεις στην επόμενη παράγραφο.
Ερωτήσεις και εργασίες
- Να γράψετε τους τύπους των οξειδίων του αζώτου (II), (V), (I), (III), (IV).
- Δώστε τα ονόματα των δυαδικών ενώσεων, οι τύποι των οποίων: α) C1 2 0 7, C1 2 O, C1O 2; β) FeCl2, FeCl3; γ) MnS, MnO2, MnF4, MnO, MnCl4; r) Cu2O, Mg2Si, SiCl4, Na3N, FeS.
- Βρείτε σε βιβλία αναφοράς και λεξικά κάθε είδους ονόματα ουσιών με τους τύπους: α) CO 2 και CO. β) SO 2 και SO 3. Εξηγήστε την ετυμολογία τους. Δώστε δύο ονόματα αυτών των ουσιών στη διεθνή ονοματολογία σύμφωνα με τους κανόνες που ορίζονται στην παράγραφο.
- Τι άλλο όνομα μπορείτε να δώσετε στην αμμωνία H 3 N;
- Βρείτε τον όγκο που βρίσκεται στο n. στο. 17 g υδρόθειο.
- Πόσα μόρια υπάρχουν σε αυτόν τον όγκο;
- Υπολογίστε τη μάζα 33,6 m3 μεθανίου CH 2 στο n. στο. και προσδιορίστε τον αριθμό των μορίων του που περιέχονται σε αυτόν τον όγκο.
- Προσδιορίστε την κατάσταση οξείδωσης του άνθρακα και σημειώστε τους συντακτικούς τύπους των παρακάτω ουσιών, γνωρίζοντας ότι ο άνθρακας στις οργανικές ενώσεις είναι πάντα τετρασθενής: μεθάνιο CH 4, τετραχλωράνθρακας CC1 4, αιθάνιο C 2 H 4, ακετυλένιο C 2 H 2.
Η κατάσταση οξείδωσης είναι το υπό όρους φορτίο των ατόμων ενός χημικού στοιχείου σε μια ένωση, που υπολογίζεται με την υπόθεση ότι όλοι οι δεσμοί είναι ιοντικού τύπου. Οι καταστάσεις οξείδωσης μπορεί να έχουν θετική, αρνητική ή μηδενική τιμή, επομένως, το αλγεβρικό άθροισμα των καταστάσεων οξείδωσης των στοιχείων σε ένα μόριο, λαμβάνοντας υπόψη τον αριθμό των ατόμων τους, είναι ίσο με 0, και σε ένα ιόν, το φορτίο ένα ιόν.
Αυτή η λίστα καταστάσεων οξείδωσης δείχνει όλες τις γνωστές καταστάσεις οξείδωσης των χημικών στοιχείων του περιοδικού πίνακα. Η λίστα βασίζεται στον πίνακα Greenwood με όλες τις προσθήκες. Οι γραμμές, που επισημαίνονται με χρώμα, περιέχουν αδρανή αέρια, η κατάσταση οξείδωσης των οποίων είναι μηδέν.
| 1 | −1 | H | +1 | ||||||||||
| 2 | Αυτός | ||||||||||||
| 3 | Li | +1 | |||||||||||
| 4 | -3 | Είναι | +1 | +2 | |||||||||
| 5 | −1 | σι | +1 | +2 | +3 | ||||||||
| 6 | −4 | −3 | −2 | −1 | ντο | +1 | +2 | +3 | +4 | ||||
| 7 | −3 | −2 | −1 | Ν | +1 | +2 | +3 | +4 | +5 | ||||
| 8 | −2 | −1 | Ο | +1 | +2 | ||||||||
| 9 | −1 | φά | +1 | ||||||||||
| 10 | Ne | ||||||||||||
| 11 | −1 | Να | +1 | ||||||||||
| 12 | Mg | +1 | +2 | ||||||||||
| 13 | Ο Αλ | +3 | |||||||||||
| 14 | −4 | −3 | −2 | −1 | Σι | +1 | +2 | +3 | +4 | ||||
| 15 | −3 | −2 | −1 | Π | +1 | +2 | +3 | +4 | +5 | ||||
| 16 | −2 | −1 | μικρό | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 17 | −1 | Cl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| 18 | Ar | ||||||||||||
| 19 | κ | +1 | |||||||||||
| 20 | Ca | +2 | |||||||||||
| 21 | Sc | +1 | +2 | +3 | |||||||||
| 22 | −1 | Ti | +2 | +3 | +4 | ||||||||
| 23 | −1 | V | +1 | +2 | +3 | +4 | +5 | ||||||
| 24 | −2 | −1 | Cr | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 25 | −3 | −2 | −1 | Mn | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||
| 26 | −2 | −1 | Fe | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 27 | −1 | Co | +1 | +2 | +3 | +4 | +5 | ||||||
| 28 | −1 | Ni | +1 | +2 | +3 | +4 | |||||||
| 29 | Cu | +1 | +2 | +3 | +4 | ||||||||
| 30 | Zn | +2 | |||||||||||
| 31 | Ga | +1 | +2 | +3 | |||||||||
| 32 | −4 | Γε | +1 | +2 | +3 | +4 | |||||||
| 33 | −3 | Οπως και | +2 | +3 | +5 | ||||||||
| 34 | −2 | Se | +2 | +4 | +6 | ||||||||
| 35 | −1 | Br | +1 | +3 | +4 | +5 | +7 | ||||||
| 36 | Κρ | +2 | |||||||||||
| 37 | Rb | +1 | |||||||||||
| 38 | Sr | +2 | |||||||||||
| 39 | Υ | +1 | +2 | +3 | |||||||||
| 40 | Zr | +1 | +2 | +3 | +4 | ||||||||
| 41 | −1 | Σημ | +2 | +3 | +4 | +5 | |||||||
| 42 | −2 | −1 | Μο | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 43 | −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| 44 | −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |||
| 45 | −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| 46 | Pd | +2 | +4 | ||||||||||
| 47 | Αγ | +1 | +2 | +3 | |||||||||
| 48 | CD | +2 | |||||||||||
| 49 | Σε | +1 | +2 | +3 | |||||||||
| 50 | −4 | Sn | +2 | +4 | |||||||||
| 51 | −3 | Sb | +3 | +5 | |||||||||
| 52 | −2 | Te | +2 | +4 | +5 | +6 | |||||||
| 53 | −1 | Εγώ | +1 | +3 | +5 | +7 | |||||||
| 54 | Xe | +2 | +4 | +6 | +8 | ||||||||
| 55 | Cs | +1 | |||||||||||
| 56 | Ba | +2 | |||||||||||
| 57 | Λα | +2 | +3 | ||||||||||
| 58 | Ce | +2 | +3 | +4 | |||||||||
| 59 | Πρ | +2 | +3 | +4 | |||||||||
| 60 | Nd | +2 | +3 | ||||||||||
| 61 | Μετα μεσημβριας | +3 | |||||||||||
| 62 | Sm | +2 | +3 | ||||||||||
| 63 | ΕΕ | +2 | +3 | ||||||||||
| 64 | Gd | +1 | +2 | +3 | |||||||||
| 65 | Tb | +1 | +3 | +4 | |||||||||
| 66 | Dy | +2 | +3 | ||||||||||
| 67 | Ho | +3 | |||||||||||
| 68 | Ερ | +3 | |||||||||||
| 69 | Tm | +2 | +3 | ||||||||||
| 70 | Yb | +2 | +3 | ||||||||||
| 71 | Lu | +3 | |||||||||||
| 72 | Χφ | +2 | +3 | +4 | |||||||||
| 73 | −1 | Ta | +2 | +3 | +4 | +5 | |||||||
| 74 | −2 | −1 | W | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 75 | −3 | −1 | Σχετικά με | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| 76 | −2 | −1 | Os | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||
| 77 | −3 | −1 | Ir | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 78 | Pt | +2 | +4 | +5 | +6 | ||||||||
| 79 | −1 | Au | +1 | +2 | +3 | +5 | |||||||
| 80 | Hg | +1 | +2 | +4 | |||||||||
| 81 | Tl | +1 | +3 | ||||||||||
| 82 | −4 | Pb | +2 | +4 | |||||||||
| 83 | −3 | Bi | +3 | +5 | |||||||||
| 84 | −2 | Ταχυδρομείο | +2 | +4 | +6 | ||||||||
| 85 | −1 | Στο | +1 | +3 | +5 | ||||||||
| 86 | Rn | +2 | +4 | +6 | |||||||||
| 87 | Ο π | +1 | |||||||||||
| 88 | Ra | +2 | |||||||||||
| 89 | Μετα Χριστον | +3 | |||||||||||
| 90 | Th | +2 | +3 | +4 | |||||||||
| 91 | Pa | +3 | +4 | +5 | |||||||||
| 92 | U | +3 | +4 | +5 | +6 | ||||||||
| 93 | Np | +3 | +4 | +5 | +6 | +7 | |||||||
| 94 | Pu | +3 | +4 | +5 | +6 | +7 | |||||||
| 95 | Είμαι | +2 | +3 | +4 | +5 | +6 | |||||||
| 96 | Εκ | +3 | +4 | ||||||||||
| 97 | Bk | +3 | +4 | ||||||||||
| 98 | Πρβλ | +2 | +3 | +4 | |||||||||
| 99 | Es | +2 | +3 | ||||||||||
| 100 | Fm | +2 | +3 | ||||||||||
| 101 | Md | +2 | +3 | ||||||||||
| 102 | # | +2 | +3 | ||||||||||
| 103 | Lr | +3 | |||||||||||
| 104 | Rf | +4 | |||||||||||
| 105 | Db | +5 | |||||||||||
| 106 | Sg | +6 | |||||||||||
| 107 | Bh | +7 | |||||||||||
| 108 | Hs | +8 |
Η υψηλότερη κατάσταση οξείδωσης ενός στοιχείου αντιστοιχεί στον αριθμό της ομάδας του περιοδικού συστήματος όπου βρίσκεται αυτό το στοιχείο (η εξαίρεση είναι: Au + 3 (ομάδα I), Cu + 2 (II), από την ομάδα VIII, μόνο όσμιο Το Os και το ρουθήνιο Ru μπορούν να έχουν κατάσταση οξείδωσης +8.
Καταστάσεις οξείδωσης μετάλλων σε ενώσεις
Οι καταστάσεις οξείδωσης των μετάλλων στις ενώσεις είναι πάντα θετικές, αλλά αν μιλάμε για μη μέταλλα, τότε η κατάσταση οξείδωσής τους εξαρτάται από το άτομο με το οποίο συνδέεται το στοιχείο:
- εάν με άτομο μη μετάλλου, τότε η κατάσταση οξείδωσης μπορεί να είναι θετική και αρνητική. Εξαρτάται από την ηλεκτραρνητικότητα των ατόμων των στοιχείων.
- εάν με άτομο μετάλλου, τότε η κατάσταση οξείδωσης είναι αρνητική.
Αρνητική κατάσταση οξείδωσης μη μετάλλων
Η υψηλότερη αρνητική κατάσταση οξείδωσης των μη μετάλλων μπορεί να προσδιοριστεί αφαιρώντας από το 8 τον αριθμό της ομάδας στην οποία βρίσκεται το δεδομένο χημικό στοιχείο, δηλ. η υψηλότερη θετική κατάσταση οξείδωσης είναι ίση με τον αριθμό των ηλεκτρονίων στην εξωτερική στιβάδα, που αντιστοιχεί στον αριθμό της ομάδας.
Σημειώστε ότι οι καταστάσεις οξείδωσης απλών ουσιών είναι 0, ανεξάρτητα από το αν είναι μέταλλο ή μη.
Πηγές:
- Greenwood, Norman N.; Earnshaw, A. Chemistry of the Elements - 2nd ed. - Οξφόρδη: Butterworth-Heinemann, 1997
- Πράσινες σταθερές ενώσεις μαγνησίου (Ι) με δεσμούς Mg-Mg / Jones C .; Stasch A .. - Science Journal, 2007. - Δεκέμβριος (τεύχος 318 (Αρ. 5857)
- Science journal, 1970. - Τεύχος. 3929. - Αρ. 168. - Σ. 362.
- Journal of the Chemical Society, Chemical Communications, 1975, σελ. 760b-761.
- Irving Langmuir Η διάταξη των ηλεκτρονίων σε άτομα και μόρια. - Μαρμελάδα. Chem. Soc., 1919. - Iss. 41.
Στις χημικές διεργασίες, τα άτομα και τα μόρια παίζουν τον κύριο ρόλο, οι ιδιότητες των οποίων καθορίζουν την έκβαση των χημικών αντιδράσεων. Ένα από τα σημαντικά χαρακτηριστικά ενός ατόμου είναι ο αριθμός οξείδωσης, ο οποίος απλοποιεί τη μέθοδο λήψης υπόψη της μεταφοράς ηλεκτρονίων σε ένα σωματίδιο. Πώς να προσδιορίσετε την κατάσταση οξείδωσης ή το επίσημο φορτίο ενός σωματιδίου και ποιους κανόνες πρέπει να γνωρίζετε για αυτό;
Ορισμός
Οποιαδήποτε χημική αντίδραση προκαλείται από την αλληλεπίδραση ατόμων διαφόρων ουσιών. Η διαδικασία αντίδρασης και το αποτέλεσμά της εξαρτώνται από τα χαρακτηριστικά των μικρότερων σωματιδίων.
Ο όρος οξείδωση (οξείδωση) στη χημεία σημαίνει μια αντίδραση κατά την οποία μια ομάδα ατόμων ή ένα από αυτά χάνει ηλεκτρόνια ή κερδίζει, σε περίπτωση απόκτησης, η αντίδραση ονομάζεται «αναγωγή».
Η κατάσταση οξείδωσης είναι μια ποσότητα που μετράται ποσοτικά και χαρακτηρίζει τα ανακατανεμημένα ηλεκτρόνια κατά τη διάρκεια της αντίδρασης. Εκείνοι. κατά τη διάρκεια της οξείδωσης, τα ηλεκτρόνια σε ένα άτομο μειώνονται ή αυξάνονται, ανακατανέμονται μεταξύ άλλων σωματιδίων που αλληλεπιδρούν και το επίπεδο οξείδωσης δείχνει ακριβώς πώς αναδιοργανώνονται. Αυτή η έννοια σχετίζεται στενά με την ηλεκτραρνητικότητα των σωματιδίων - την ικανότητά τους να προσελκύουν και να απωθούν ελεύθερα ιόντα από τον εαυτό τους.
Ο προσδιορισμός του επιπέδου οξείδωσης εξαρτάται από τα χαρακτηριστικά και τις ιδιότητες μιας συγκεκριμένης ουσίας, επομένως, η διαδικασία υπολογισμού δεν μπορεί να ονομαστεί ξεκάθαρα εύκολη ή πολύπλοκη, αλλά τα αποτελέσματά της βοηθούν στη συμβατική καταγραφή των διεργασιών οξειδοαναγωγικών αντιδράσεων. Πρέπει να γίνει κατανοητό ότι το ληφθέν αποτέλεσμα των υπολογισμών είναι το αποτέλεσμα της λήψης υπόψη της μεταφοράς ηλεκτρονίων και δεν έχει φυσικό νόημα, και επίσης δεν είναι το πραγματικό φορτίο του πυρήνα.
Είναι σημαντικό να γνωρίζουμε! Η ανόργανη χημεία χρησιμοποιεί συχνά τον όρο σθένος αντί για την κατάσταση οξείδωσης των στοιχείων, αυτό δεν είναι λάθος, αλλά πρέπει να ληφθεί υπόψη ότι η δεύτερη έννοια είναι πιο καθολική.
Οι έννοιες και οι κανόνες για τον υπολογισμό της κίνησης των ηλεκτρονίων αποτελούν τη βάση για την ταξινόμηση χημικών ουσιών (ονοματολογία), την περιγραφή των ιδιοτήτων τους και την κατάρτιση τύπων δεσμών. Αλλά πιο συχνά αυτή η έννοια χρησιμοποιείται για να περιγράψει και να εργαστεί με αντιδράσεις οξειδοαναγωγής.
Κανόνες για τον προσδιορισμό της κατάστασης οξείδωσης
Πώς γνωρίζετε την κατάσταση οξείδωσης; Όταν εργάζεστε με αντιδράσεις οξειδοαναγωγής, είναι σημαντικό να γνωρίζετε ότι το τυπικό φορτίο ενός σωματιδίου θα είναι πάντα ίσο με την τιμή ενός ηλεκτρονίου, εκφρασμένη σε αριθμητική τιμή. Αυτό το χαρακτηριστικό σχετίζεται με την υπόθεση ότι τα ζεύγη ηλεκτρονίων που σχηματίζουν έναν δεσμό είναι πάντα εντελώς μετατοπισμένα προς περισσότερα αρνητικά σωματίδια. Πρέπει να γίνει κατανοητό ότι μιλάμε για ιοντικούς δεσμούς, και στην περίπτωση αντίδρασης με ηλεκτρόνια θα διαιρεθούν εξίσου μεταξύ πανομοιότυπων σωματιδίων.
Ο οξειδωτικός αριθμός μπορεί να έχει θετικές και αρνητικές τιμές. Το θέμα είναι ότι κατά τη διάρκεια της αντίδρασης το άτομο πρέπει να γίνει ουδέτερο και για αυτό είναι απαραίτητο είτε να προσκολληθεί μια ορισμένη ποσότητα ηλεκτρονίων στο ιόν, εάν είναι θετικό, είτε να αφαιρεθούν, εάν είναι αρνητικό. Για να δηλώσετε αυτήν την έννοια, όταν γράφετε έναν τύπο, ένας αραβικός αριθμός με ένα αντίστοιχο πρόσημο συνήθως προδιαγράφεται πάνω από τον προσδιορισμό ενός στοιχείου. Για παράδειγμα, ή κ.λπ.
Θα πρέπει να γνωρίζετε ότι το επίσημο φορτίο των μετάλλων θα είναι πάντα θετικό και στις περισσότερες περιπτώσεις, για να το προσδιορίσετε, μπορείτε να χρησιμοποιήσετε τον περιοδικό πίνακα. Υπάρχουν μια σειρά από χαρακτηριστικά που πρέπει να ληφθούν υπόψη για να προσδιοριστούν σωστά οι δείκτες.

Βαθμός οξείδωσης:
Έχοντας θυμηθεί αυτά τα χαρακτηριστικά, θα είναι αρκετά απλό να προσδιοριστεί ο οξειδωτικός αριθμός των στοιχείων, ανεξάρτητα από την πολυπλοκότητα και τον αριθμό των ατομικών επιπέδων.
Χρήσιμο βίντεο: προσδιορισμός της κατάστασης οξείδωσης
Ο Περιοδικός Πίνακας του Mendeleev περιέχει σχεδόν όλες τις πληροφορίες που χρειάζεστε για να εργαστείτε με χημικά στοιχεία. Για παράδειγμα, οι μαθητές το χρησιμοποιούν μόνο για να περιγράψουν χημικές αντιδράσεις. Έτσι, για να προσδιορίσετε τις μέγιστες θετικές και αρνητικές τιμές του αριθμού οξείδωσης, πρέπει να ελέγξετε τον προσδιορισμό του χημικού στοιχείου στον πίνακα:
- Το πιο θετικό είναι ο αριθμός της ομάδας στην οποία βρίσκεται το στοιχείο.
- Η μέγιστη αρνητική κατάσταση οξείδωσης είναι η διαφορά μεταξύ του μέγιστου θετικού ορίου και του αριθμού 8.
Έτσι, αρκεί απλώς να ανακαλύψουμε τα ακραία όρια της επίσημης φόρτισης αυτού ή εκείνου του στοιχείου. Μια τέτοια ενέργεια μπορεί να πραγματοποιηθεί χρησιμοποιώντας υπολογισμούς που βασίζονται στον περιοδικό πίνακα.
Είναι σημαντικό να γνωρίζουμε! Ένα στοιχείο μπορεί να έχει πολλούς διαφορετικούς δείκτες οξείδωσης ταυτόχρονα.
Υπάρχουν δύο κύριες μέθοδοι για τον προσδιορισμό του επιπέδου οξείδωσης, παραδείγματα των οποίων παρουσιάζονται παρακάτω. Η πρώτη από αυτές είναι μια μέθοδος που απαιτεί γνώσεις και δεξιότητες για την εφαρμογή των νόμων της χημείας. Πώς να τακτοποιήσετε τις καταστάσεις οξείδωσης χρησιμοποιώντας αυτή τη μέθοδο;

Ο κανόνας για τον προσδιορισμό των καταστάσεων οξείδωσης
Αυτό απαιτεί:
- Προσδιορίστε εάν μια δεδομένη ουσία είναι στοιχειώδης και αν είναι εκτός ορίων. Εάν ναι, τότε ο αριθμός οξείδωσής του θα είναι ίσος με 0, ανεξάρτητα από τη σύσταση της ουσίας (μεμονωμένα άτομα ή πολυεπίπεδες ατομικές ενώσεις).
- Προσδιορίστε εάν η εν λόγω ουσία αποτελείται από ιόντα. Αν ναι, τότε ο βαθμός οξείδωσης θα είναι ίσος με το φορτίο τους.
- Εάν η εν λόγω ουσία είναι μέταλλο, τότε κοιτάξτε τους δείκτες άλλων ουσιών στον τύπο και υπολογίστε τις μετρήσεις του μετάλλου με αριθμητικές πράξεις.
- Εάν ολόκληρη η ένωση έχει ένα φορτίο (στην πραγματικότητα, αυτό είναι το άθροισμα όλων των σωματιδίων των παρουσιαζόμενων στοιχείων), τότε αρκεί να προσδιορίσετε τους δείκτες απλών ουσιών, στη συνέχεια να τους αφαιρέσετε από τη συνολική ποσότητα και να λάβετε τα δεδομένα μετάλλου.
- Εάν ο δεσμός είναι ουδέτερος, τότε το σύνολο πρέπει να είναι μηδέν.
Για παράδειγμα, θεωρήστε έναν συνδυασμό με ένα ιόν αλουμινίου, του οποίου το συνολικό φορτίο είναι μηδέν. Οι κανόνες της χημείας επιβεβαιώνουν το γεγονός ότι το ιόν Cl έχει αριθμό οξείδωσης -1 και σε αυτή την περίπτωση υπάρχουν τρία από αυτά στην ένωση. Αυτό σημαίνει ότι το ιόν Al πρέπει να είναι ίσο με +3 για να είναι ολόκληρη η ένωση ουδέτερη.
Αυτή η μέθοδος είναι πολύ καλή, γιατί η ορθότητα του διαλύματος μπορεί πάντα να επαληθευτεί προσθέτοντας όλα τα επίπεδα οξείδωσης μαζί.
Η δεύτερη μέθοδος μπορεί να εφαρμοστεί χωρίς γνώση των χημικών νόμων:
- Βρείτε τα δεδομένα των σωματιδίων, σε σχέση με τα οποία δεν υπάρχουν αυστηροί κανόνες και ο ακριβής αριθμός των ηλεκτρονίων τους είναι άγνωστος (είναι δυνατό μέσω αποκλεισμού).
- Βρείτε τους δείκτες όλων των άλλων σωματιδίων και στη συνέχεια βρείτε το επιθυμητό σωματίδιο από το σύνολο αφαιρώντας.
Ας εξετάσουμε τη δεύτερη μέθοδο χρησιμοποιώντας το παράδειγμα της ουσίας Na2SO4, στην οποία το άτομο θείου S δεν ορίζεται, είναι γνωστό μόνο ότι είναι μη μηδενικό.
Για να βρείτε τι είναι ίσες όλες οι καταστάσεις οξείδωσης, χρειάζεστε:
- Βρείτε γνωστά αντικείμενα λαμβάνοντας υπόψη τους παραδοσιακούς κανόνες και τις εξαιρέσεις.
- Ιόν Na = +1, και κάθε οξυγόνο = -2.
- Πολλαπλασιάστε τον αριθμό των σωματιδίων κάθε ουσίας με τα ηλεκτρόνια τους και λάβετε τους βαθμούς οξείδωσης όλων των ατόμων εκτός από ένα.
- Το Na2SO4 περιέχει 2 νάτριο και 4 οξυγόνο, πολλαπλασιάζοντας προκύπτει: 2 Χ +1 = 2 είναι ο οξειδωτικός αριθμός όλων των σωματιδίων νατρίου και 4 Χ -2 = -8 - οξυγόνο.
- Προσθέτοντας τα ληφθέντα αποτελέσματα 2 + (- 8) = -6 είναι το συνολικό φορτίο της ένωσης χωρίς σωματίδιο θείου.
- Παρουσιάστε μια χημική σημείωση ως εξίσωση: άθροισμα γνωστών δεδομένων + άγνωστος αριθμός = συνολικό φορτίο.
- Το Na2SO4 αντιπροσωπεύεται ως εξής: -6 + S = 0, S = 0 + 6, S = 6.
Έτσι, για να χρησιμοποιήσουμε τη δεύτερη μέθοδο, αρκεί να γνωρίζουμε τους απλούς νόμους της αριθμητικής.