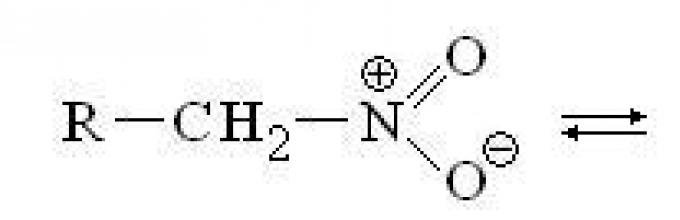Μείωση νιτροενώσεων . Όλες οι νιτροενώσεις ανάγεται σε πρωτοταγείς αμίνες. Εάν η προκύπτουσα αμίνη είναι πτητική, μπορεί να ανιχνευθεί με μια αλλαγή στο χρώμα του χαρτιού δείκτη:
Αντίδραση με νιτρώδες οξύ. Μια χαρακτηριστική ποιοτική αντίδραση σε πρωτογενείς και δευτερογενείς νιτροενώσεις είναι η αντίδραση με νιτρώδες οξύ.
Για τριτοταγείς αλειφατικές νιτροενώσειςΔεν υπάρχουν ειδικές αντιδράσεις ανίχνευσης.
Ανίχνευση αρωματικών νίτρο ενώσεων.Οι αρωματικές νιτροενώσεις έχουν συνήθως ανοιχτό κίτρινο χρώμα. Παρουσία άλλων υποκαταστατών, η ένταση και το βάθος του χρώματος συχνά αυξάνεται. Για την ανίχνευση αρωματικών νίτρο ενώσεων, ανάγονται σε πρωτοταγείς αμίνες, οι τελευταίες διαζωτώνονται και συνδυάζονται με β-ναφθόλη:
| ArNO 2 → ArNH 2 → ArN 2 Cl → ArN=N |
| OH |
Αυτή η αντίδραση, ωστόσο, δεν είναι ειδική, αφού αμίνες σχηματίζονται κατά την αναγωγή όχι μόνο νιτροενώσεων, αλλά και νιτροζο, αζωοξυ και υδραζο ενώσεων. Για να εξαχθεί ένα τελικό συμπέρασμα σχετικά με την παρουσία μιας νιτροομάδας σε μια ένωση, είναι απαραίτητο να πραγματοποιηθεί ένας ποσοτικός προσδιορισμός.
Ποιοτικές αντιδράσεις Ν-νιτροζοενώσεων
Αντίδραση με HI.Οι ενώσεις C-Nitroso μπορούν να διακριθούν από τις ενώσεις N-nitroso από τη σχέση τους με ένα οξινισμένο διάλυμα ιωδιούχου καλίου: Οι ενώσεις C-Nitroso οξειδώνουν το υδροϊωδικό οξύ, οι ενώσεις N-nitroso δεν αντιδρούν με το υδροϊωδικό οξύ.
Αντίδραση με πρωτογενείς αρωματικές αμίνες. Οι ενώσεις C-Nitroso συμπυκνώνονται με πρωτοταγείς αρωματικές αμίνες, σχηματίζοντας έγχρωμες αζω ενώσεις:
| ArN = O + H 2 N – Ar → Ar – N = N – Ar + H 2 O |
Υδρόλυση ενώσεων Ν-νιτροζο. Οι καθαρές αρωματικές και λιπαρές αρωματικές Ν-νιτροζο ενώσεις (νιτροζαμίνες) υδρολύονται εύκολα από αλκοολικά διαλύματα HCl, σχηματίζοντας δευτεροταγή αμίνη και νιτρώδες οξύ. Εάν η υδρόλυση διεξάγεται παρουσία α-ναφθυλαμίνης, τότε η τελευταία διαζωτώνεται από το προκύπτον νιτρώδες οξύ και η διαζω ένωση εισέρχεται σε μια αντίδραση αζωσύζευξης με περίσσεια α-ναφθυλαμίνης. Σχηματίζεται μια αζωχρωστική:
Το μίγμα της αντίδρασης γίνεται ροζ. Σταδιακά το χρώμα γίνεται μωβ.
Ποιοτικές αντιδράσεις νιτριλίων
Στην ανάλυση των νιτριλίων RC≡N, ArC≡N χρησιμοποιείται η ικανότητά τους να υδρολύονται και να ανάγεται. Για την ανίχνευση της ομάδας C≡N, πραγματοποιείται υδρόλυση:
| RC ≡ N + H 2 O → R – CONH 2 |
Τα νιτρίλια χαρακτηρίζονται πιο εύκολα από τα οξέα που λαμβάνονται με την υδρόλυση τους. Το οξύ απομονώνεται από το υδρόλυμα με απόσταξη ή εκχύλιση με ατμό και μετατρέπεται σε ένα από τα παράγωγα - έναν εστέρα ή ένα αμίδιο
Ποιοτικές αντιδράσεις θειολών (θειοαλκοόλες, θειοαιθέρες)
Οι πιο σημαντικές ιδιότητες των θειολών που χρησιμοποιούνται στην ανάλυση είναι η ικανότητα να υποκαθιστούν ένα άτομο υδρογόνου στην ομάδα -SH και η ικανότητα να οξειδώνονται. Οι ουσίες που περιέχουν την ομάδα -SH έχουν μια έντονη δυσάρεστη οσμή, η οποία εξασθενεί με την αύξηση του αριθμού των ατόμων άνθρακα στο μόριο.
Αντίδραση με HNO 2.Ουσίες που περιέχουν την ομάδα SH δίνουν μια χρωματική αντίδραση όταν εκτίθενται σε νιτρώδες οξύ:
Εκτός από τις θειόλες, αυτή την αντίδραση δίνουν και τα θειοξέα RCOSH. Εάν το R είναι πρωτεύον ή δευτεροταγές αλκύλιο, εμφανίζεται ένα κόκκινο χρώμα, εάν το R είναι τριτοταγές αλκύλιο ή αρύλιο, το χρώμα είναι πρώτα πράσινο και μετά κόκκινο.
Σχηματισμός μερκαπτιδίου. Χαρακτηριστική ποιοτική αντίδραση των θειολών είναι επίσης ο σχηματισμός καθίζησης μερκαπτιδίων βαρέων μετάλλων (Pb, Cu, Hg). Για παράδειγμα,
| 2RSH + PbO → (RS)2Pb + H2O |
Τα μερκαπτίδια μολύβδου και χαλκού είναι χρωματισμένα.
Οι κορεσμένες νιτροενώσεις ανοιχτής αλυσίδας (μη κυκλικές) έχουν τον γενικό τύπο C n H 2n + 1 NO 2 . Είναι ισομερή αλκυλονιτρωδών (εστέρες νιτρώδους οξέος) με γενικό τύπο R-ONO. Οι διαφορές είναι οι εξής:
Τα αλκυλονιτρώδη έχουν χαμηλότερα σημεία βρασμού
Οι νιτροενώσεις είναι εξαιρετικά πολικές και έχουν μεγάλη διπολική ροπή
Τα αλκυλονιτρώδη σαπωνοποιούνται εύκολα από αλκάλια και ανόργανα οξέα για να σχηματίσουν τις αντίστοιχες αλκοόλες και το νιτρώδες οξύ ή το άλας του.
Η αναγωγή των νιτροενώσεων οδηγεί σε αμίνες, αλκυλονιτρώδη - σε αλκοόλες και υδροξυλαμίνη.
Παραλαβή
Σύμφωνα με την αντίδραση Konovalov - νίτρωση παραφινών με αραιό νιτρικό οξύ όταν θερμαίνεται. Όλοι οι υδρογονάνθρακες εισέρχονται στην αντίδραση νίτρωσης σε υγρή φάση, αλλά ο ρυθμός αντίδρασης είναι χαμηλός και οι αποδόσεις είναι χαμηλές. Η αντίδραση συνοδεύεται από οξείδωση και σχηματισμό πολυνιρο ενώσεων. Τα καλύτερα αποτελέσματα επιτυγχάνονται με υδρογονάνθρακες που περιέχουν τριτοταγές άτομο άνθρακα. Η νίτρωση σε φάση ατμού συμβαίνει στους 250-500 o C με ατμό νιτρικού οξέος. Η αντίδραση συνοδεύεται από πυρόλυση υδρογονανθράκων, με αποτέλεσμα όλα τα είδη νιτροπαραγώγων, και οξείδωση, η οποία έχει ως αποτέλεσμα το σχηματισμό αλκοολών, αλδεΰδων, κετονών και οξέων. Σχηματίζονται επίσης ακόρεστοι υδρογονάνθρακες. Το νιτρικό οξύ μπορεί να αντικατασταθεί από οξείδια του αζώτου. Η νίτρωση λαμβάνει χώρα μέσω του μηχανισμού S R.
Αλληλεπίδραση παραγώγων αλογόνου κορεσμένων υδρογονανθράκων με νιτρώδες άργυρο όταν θερμαίνεται. Το επιτιθέμενο σωματίδιο είναι το ιόν NO 2, το οποίο εμφανίζει διπλή αντιδραστικότητα (ambidence), δηλ. Προσθέστε μια ρίζα στο άζωτο (S N 2) για να σχηματιστεί μια νίτρο ένωση R-NO 2 ή οξυγόνο για να σχηματιστεί ένας εστέρας νιτρώδους οξέος R-O-N=O. (S N 1). Ο μηχανισμός αντίδρασης και η κατεύθυνσή του εξαρτώνται σε μεγάλο βαθμό από τη φύση του διαλύτη. Οι διαλύτες (νερό, αλκοόλες) ευνοούν τον σχηματισμό αιθέρα.
Χημικές ιδιότητες
Όταν οι νιτροενώσεις μειώνονται, σχηματίζονται πρωτοταγείς αμίνες:
Οι πρωτογενείς και δευτερογενείς νιτροενώσεις είναι διαλυτές σε αλκάλια για να σχηματίσουν άλατα. Τα άτομα υδρογόνου στον άνθρακα που είναι συνδεδεμένο με τη νίτρο ομάδα ενεργοποιούνται, ως αποτέλεσμα, σε ένα αλκαλικό περιβάλλον, οι νιτροενώσεις αναδιατάσσονται στη μορφή ακίνης-νιτρο:

Όταν ένα αλκαλικό διάλυμα μιας νιτρο ένωσης υποβάλλεται σε επεξεργασία με ένα ανόργανο οξύ, σχηματίζεται μια ισχυρά όξινη μορφή οξίνου, η οποία ισομερίζεται γρήγορα στη συνήθη ουδέτερη μορφή:
Οι νιτροενώσεις ταξινομούνται ως ψευδοοξέα. Τα ψευδοξέα είναι ουδέτερα και μη αγώγιμα, αλλά παρά ταύτα σχηματίζουν ουδέτερα άλατα αλκαλιμετάλλων. Η εξουδετέρωση των νίτρο ενώσεων με αλκάλια γίνεται αργά και των αληθινών οξέων - αμέσως.
Οι πρωτογενείς και δευτερογενείς νιτροενώσεις αντιδρούν με νιτρώδες οξύ, οι τριτοταγείς δεν αντιδρούν:

Τα αλκαλικά άλατα των νιτρολικών οξέων στο διάλυμα είναι κόκκινα, τα ψευδονιτρόλια είναι μπλε ή πρασινωπό-μπλε.
Οι πρωτογενείς και δευτερογενείς νιτροενώσεις συμπυκνώνονται παρουσία αλκαλίων με αλδεΰδες, σχηματίζοντας νιτροαλκοόλες (πυρηνόφιλη προσθήκη):

Οι μορφές οξίνου πρωτοταγών και δευτερογενών νιτρο-ενώσεων σε υδατικά διαλύματα υπό τη δράση ανόργανων οξέων σχηματίζουν αλδεΰδες ή κετόνες:

Οι πρωτογενείς νιτροενώσεις, όταν θερμαίνονται με θειικό οξύ 85%, μετατρέπονται σε καρβοξυλικά οξέα με την αποβολή της υδροξυλαμίνης. Αυτό συμβαίνει ως αποτέλεσμα της υδρόλυσης της προκύπτουσας μορφής aci.
Η νίτρο ομάδα έχει μια δομή ενδιάμεση μεταξύ δύο δομών περιοριστικού συντονισμού:
Η ομάδα είναι επίπεδη. Τα άτομα Ν και Ο έχουν υβριδισμό sp 2, οι δεσμοί Ν-Ο είναι ισοδύναμοι και σχεδόν ενάμισι. μήκη δεσμών, π.χ. για CH3NO2, 0,122 nm (Ν-Ο), 0,147 nm (C-N), γωνία ONO 127°. Το σύστημα C-NO 2 είναι επίπεδο με χαμηλό εμπόδιο στην περιστροφή γύρω από τον δεσμό C-N.
Ν Οι ίτρο ενώσεις που έχουν τουλάχιστον ένα άτομο α-Η μπορούν να υπάρχουν σε δύο ταυτομερείς μορφές με ένα κοινό μεσομερικό ανιόν. Ο-μορφή καλείται οξική-νιτρο ένωση ή νιτρονική ένωση:

Διάφορα γνωστά παράγωγα νιτρονικών ενώσεων: άλατα της μορφής RR"C=N(O)O - M + (άλατα νιτρονικών ενώσεων), αιθέρες (νιτρονικοί αιθέρες) κ.λπ. Οι εστέρες των νιτρονικών ενώσεων υπάρχουν με τη μορφή is- και trans- ισομερή Υπάρχουν κυκλικοί αιθέρες, για παράδειγμα Ν-οξείδια ισοξαζολινών.
Ονομα Οι νιτροενώσεις παράγονται με την προσθήκη του προθέματος "nitro" στο όνομα. συνδέσεις βάσης, προσθέτοντας ψηφιακή ένδειξη εάν χρειάζεται, π.χ. 2-νιτροπροπάνιο. Ονομα άλατα νιτροενώσεων παράγονται από το όνομα. είτε η C-μορφή, είτε η όξινη μορφή, είτε το νιτρονικό οξύ.
Φυσικές ιδιότητες.Τα πιο απλά νιτροαλκάνια είναι άχρωμα. υγρά Phys. Οι ιδιότητες ορισμένων αλειφατικών νίτρο ενώσεων δίνονται στον πίνακα. Οι αρωματικές νιτροενώσεις είναι άχρωμες. ή ανοικτοκίτρινα υγρά υψηλού βρασμού ή στερεά χαμηλής τήξης με χαρακτηριστική οσμή, ελάχιστα διαλυτά. σε νερό, κατά κανόνα, αποστάζονται με ατμό.
ΦΥΣΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΟΡΙΣΜΕΝΩΝ ΑΛΙΦΑΤΙΚΩΝ ΝΙΤΡΟΕΝΩΣΕΩΝ

*Στους 25°C. **Στους 24°C. ***Στους 14°C.
Στα φάσματα UV των αλειφατικών νίτρο ενώσεων, l max 200-210 nm (έντονη ζώνη) και 270-280 nm (ασθενής ζώνη). για άλατα και αιθέρες του νιτρονικού οξέος, αντί. 220-230 και 310-320 nm. για που περιέχει αίμη-δινίτρο 320-380 nm; για αρωματικές νιτροενώσεις 250-300 nm (η ένταση της ζώνης μειώνεται απότομα όταν παραβιάζεται η ομοεπίπεδη).
Στο φάσμα PMR του χημ. μετατοπίσεις του ατόμου α-Η, ανάλογα με τη δομή, 4-6 ppm. Στο φάσμα NMR 14 N και 15 N χημικό. μετατόπιση 5 από - 50 σε + 20 ppm
Στα φάσματα μάζας των αλειφατικών νίτρο ενώσεων (με εξαίρεση το CH 3 NO 2), η κορυφή mol. Το ιόν απουσιάζει ή είναι πολύ μικρό. βασικός διαδικασία κατακερματισμού - η εξάλειψη του NO 2 ή δύο ατόμων οξυγόνου για να σχηματιστεί ένα θραύσμα ισοδύναμο με το νιτρίλιο. Οι αρωματικές νιτροενώσεις χαρακτηρίζονται από την παρουσία ενός κορυφαίου mol. και αυτή ; βασικός η κορυφή στο φάσμα αντιστοιχεί στο ιόν που παράγεται από την εξάλειψη του NO 2 .
Χημικές ιδιότητες.Η ομάδα νίτρο είναι μια από τις περισσότερες ισχυρές ομάδες απόσυρσης ηλεκτρονίων και είναι σε θέση να μετεγκαταστήσει αποτελεσματικά αρνητικά. χρέωση. Σε αρωματικό συν. ως αποτέλεσμα επαγωγικών και ιδιαίτερα μεσομερικών επιδράσεων, επηρεάζει την κατανομή της πυκνότητας ηλεκτρονίων: ο πυρήνας γίνεται μερικώς θετικός. χρέωση, η οποία είναι εντοπισμένη Ch. αρ. σε ορθο και παρα θέσεις? Σταθερές Hammett για την ομάδα ΝΟ 2 s m 0,71, s n 0,778, s + n 0,740, s - n 1,25. Έτσι, η εισαγωγή της ομάδας ΝΟ 2 αυξάνει απότομα την αντίδραση. ικανότητα οργαν. συν. σε σχέση με το νουκλεόφ. αντιδραστήρια και δυσχεραίνει την αντιμετώπιση του ηλεκτροφίου. αντιδραστήρια Αυτό καθορίζει την ευρεία χρήση των νιτροενώσεων σε οργαν. σύνθεση: η ομάδα NO 2 εισάγεται στην επιθυμητή θέση του μορίου ορ. σύνδεση, πραγματοποιήστε αποσύνθεση. τμήματα που σχετίζονται, κατά κανόνα, με μια αλλαγή στον σκελετό άνθρακα και στη συνέχεια μετατρέπονται σε άλλη λειτουργία ή αφαιρούνται. Σε αρωματικό Σε ορισμένες περιπτώσεις, χρησιμοποιείται συχνά ένα συντομότερο σχήμα: νίτρωση-μετασχηματισμός της ομάδας NO 2.
Mn. μετασχηματισμοί των αλειφατικών νιτρο-ενώσεων λαμβάνουν χώρα με προκατεργασία. ισομερισμός σε νιτρονικές ενώσεις ή σχηματισμός του αντίστοιχου ανιόντος. Στα διαλύματα, η ισορροπία συνήθως μετατοπίζεται σχεδόν πλήρως προς τη μορφή C. στους 20 °C η αναλογία της μορφής οξίνου για το νιτρομεθάνιο είναι 1 10 -7, για το νιτροπροπάνιο 3. 10 -3. Οι ενώσεις νιτρονίου είναι ελεύθερες. η μορφή είναι συνήθως ασταθής. λαμβάνονται με προσεκτική οξίνιση αλάτων νιτροενώσεων. Σε αντίθεση με τις νιτροενώσεις, μεταφέρουν ρεύμα στα διαλύματα και δίνουν κόκκινο χρώμα με FeCl 3. Οι ενώσεις οξύ-νιτρο είναι ισχυρότερα CH-οξέα (pK a ~ 3-5) από τις αντίστοιχες νιτροενώσεις (pK a ~ 8-10). η οξύτητα των νίτρο ενώσεων αυξάνεται με την εισαγωγή υποκαταστατών που αποσύρουν ηλεκτρόνια στη θέση α στην ομάδα ΝΟ 2.
Ο σχηματισμός ενώσεων νιτρονίου σε μια σειρά από αρωματικές νιτροενώσεις σχετίζεται με τον ισομερισμό του δακτυλίου βενζολίου στην κινοειδή μορφή. για παράδειγμα, το νιτροβενζόλιο σχηματίζεται με συμπ. Το έγχρωμο προϊόν τύπου Ι που μοιάζει με άλας H 2 SO 4, το ο-νιτροτολουόλιο εμφανίζει φωτοχρωματισμό ως αποτέλεσμα της εντραμόλης. μεταφορά πρωτονίου για να σχηματιστεί ένα φωτεινό μπλε παράγωγο Ο:

Όταν οι βάσεις δρουν σε πρωτογενείς και δευτερογενείς νιτροενώσεις, σχηματίζονται άλατα νιτροενώσεων. Τα διττά ανιόντα αλάτων σε διαλύματα με ηλεκτρόφιλα είναι ικανά να παράγουν παράγωγα Ο- και C. Έτσι, όταν αλκυλίωση αλάτων νιτρο-ενώσεων με αλκυλαλογονίδια, τριαλκυλοχλωροσιλάνια ή R3O + BF-4, σχηματίζονται προϊόντα Ο-αλκυλίωσης. Τελευταίο m.b. λαμβάνεται επίσης με τη δράση διαζωμεθανίου ή Ν,Ο-δις-(τριμεθυλσιλυλ)ακεταμιδίου σε νιτροαλκάνια με pKa< 3 или нитроновые к-ты, напр.:

Απεριοδικός Οι αλκυλεστέρες των νιτρονικών οξέων είναι θερμικά ασταθείς και διασπούν την εντραμόλη. μηχανισμός:
; Αυτό
Το διάλυμα μπορεί να χρησιμοποιηθεί για τη λήψη ενώσεων καρβονυλίου. Οι σιλυλαιθέρες είναι πιο σταθεροί. Για το σχηματισμό προϊόντων C-αλκυλίωσης, βλέπε παρακάτω.
Οι νιτροενώσεις χαρακτηρίζονται από αντιδράσεις με τη ρήξη του δεσμού C-N, κατά μήκος των δεσμών N=O, O=N O, C=N -> O, και διαλύματα με διατήρηση της ομάδας NO 2.
R-ts και s r a r s σε περίπου m με συνδέσεις και S-N. Πρωτογενείς και δευτερογενείς νιτροενώσεις όταν θερμαίνονται. με ανθρακωρύχο. Το K-tami είναι παρόν. αλκοόλη ή υδατικό διάλυμα αλκαλικών ενώσεων καρβονυλίου. (βλέπε αντίδραση Nave). Το R-tion περνά μέσα από τα κενά. σχηματισμός ενώσεων νιτρονίου:

Ως αρχική συν. Μπορούν να χρησιμοποιηθούν σιλυλονιτρονικοί αιθέρες. Η επίδραση ισχυρών ενώσεων στις αλειφατικές νιτροενώσεις μπορεί να οδηγήσει σε υδροξαμικές ενώσεις, για παράδειγμα:

Η μέθοδος χρησιμοποιείται στη βιομηχανία για τη σύνθεση CH 3 COOH και υδροξυλαμίνης από νιτροαιθάνιο. Οι αρωματικές νιτροενώσεις είναι αδρανείς στη δράση ισχυρών ενώσεων.
Όταν οι αναγωγικοί παράγοντες (για παράδειγμα, TiCl 3 -H 2 O, VCl 2 -H 2 O-DMF) δρουν σε νιτροενώσεις ή οξειδωτικά μέσα (KMnO 4 -MgSO 4, O 3) στα άλατα νιτροενώσεων, κετονών και αλδεΰδων σχηματίζονται.
Οι αλειφατικές νίτρο ενώσεις που περιέχουν ένα κινητό άτομο Η στη θέση b στην ομάδα NO 2, όταν εκτίθενται σε βάσεις, το εξαλείφουν εύκολα με τη μορφή HNO 2 με το σχηματισμό ολεφινών. Η θερμική ροή προχωρά παρόμοια. αποσύνθεση νιτροαλκανίων σε θερμοκρασίες άνω των 450°. Τα γειτονικά δινιτροσοειδή. όταν υποβάλλονται σε επεξεργασία με αμάλγαμα Ca σε εξαμστανόλη, και οι δύο ομάδες NO 2 διαχωρίζονται· τα άλατα Ag των ακόρεστων νιτροενώσεων μπορούν να διμεριστούν όταν χάνονται οι ομάδες NO 2:

Nucleof. Η υποκατάσταση της ομάδας ΝΟ 2 δεν είναι τυπική για τα νιτροαλκάνια, ωστόσο, όταν τα θειολικά ιόντα δρουν σε τριτοταγή νιτροαλκάνια σε απρωτικά διαλύματα, η ομάδα ΝΟ 2 αντικαθίσταται από ένα άτομο υδρογόνου. Η αντίδραση προχωρά μέσω του μηχανισμού ανιόντων-ριζών. Σε αλειφατικό και ετεροκυκλική. συν.η ομάδα NO 2 σε έναν πολλαπλό δεσμό αντικαθίσταται σχετικά εύκολα από ένα πυρηνόφιλο, για παράδειγμα:

Σε αρωματικό συν. πυρηνόφ. η αντικατάσταση της ομάδας NO 2 εξαρτάται από τη θέση της σε σχέση με άλλους υποκαταστάτες: η ομάδα NO 2, που βρίσκεται στη μετα-θέση ως προς τους υποκαταστάτες που έλκουν ηλεκτρόνια και στις θέσεις ορθο- και παρα- ως προς το ηλεκτρόνιο- δωρεών, έχει χαμηλή αντιδραστικότητα. ικανότητα; αντίδραση η ικανότητα της ομάδας ΝΟ 2 που βρίσκεται στις ορθο- και παρα-θέσεις να δέχεται υποκαταστάτες που έλκουν ηλεκτρόνια αυξάνεται σημαντικά. Σε ορισμένες περιπτώσεις, ο υποκαταστάτης εισέρχεται στην ορθοθέση στην ομάδα εξόδου NO 2 (για παράδειγμα, όταν θερμαίνονται αρωματικές νιτροενώσεις με διάλυμα αλκοόλης KCN, διάλυμα Richter):

R-ts και i σχετικά με τις συνδέσεις και N = O. Ένα από τα πιο σημαντικά r-tions είναι η αποκατάσταση, η οποία γενικά οδηγεί σε ένα σύνολο προϊόντων:

Αζοξυ-(II), αζω-(III) και που περιέχει υδραζο. (IV) σχηματίζονται σε αλκαλικό περιβάλλον ως αποτέλεσμα συμπύκνωσης ενδιάμεσων νιτροζοενώσεων. με αμίνες και υδροξυλαμίνες. Η διεξαγωγή της διαδικασίας σε όξινο περιβάλλον εξαλείφει τον σχηματισμό αυτών των ουσιών. Περιέχει νιτρόζο μειώνονται ταχύτερα από τις αντίστοιχες νιτροενώσεις και τις απομονώνουν από την αντίδραση. το μείγμα συνήθως αποτυγχάνει. Οι αλειφατικές νιτροενώσεις ανάγονται σε αζοξυ ή αζω ενώσεις υπό τη δράση αλκοολικών Na, αρωματικές ενώσεις υπό τη δράση του NaBH 4, η επεξεργασία του τελευταίου με LiAlH 4 οδηγεί σε αζω ενώσεις. Ηλεκτροχημ. η αναγωγή των αρωματικών νίτρο ενώσεων υπό ορισμένες συνθήκες καθιστά δυνατή τη λήψη οποιουδήποτε από τα παρουσιαζόμενα παράγωγα (με εξαίρεση τις νιτροζοενώσεις). Χρησιμοποιώντας την ίδια μέθοδο, είναι βολικό να ληφθούν υδροξυλαμίνες από μονονιτροαλκάνια και αμιδοξίμες από άλατα πολύτιμων δινιτροαλκανίων:
Υπάρχουν πολλές γνωστές μέθοδοι για την αναγωγή των νίτρο ενώσεων σε αμίνες. Τα ρινίσματα σιδήρου, Sn και Zn χρησιμοποιούνται ευρέως. εργαλειοθήκη; με καταλυτικό Στην υδρογόνωση χρησιμοποιούνται ως καταλύτες Ni-Raney, Pd/C ή Pd/PbCO 3 και άλλα.Οι αλειφατικές νίτρο ενώσεις ανάγεται εύκολα στις αμίνες LiAlH 4 και NaBH 4 παρουσία. Pd, αμαλγάματα Na και Al, με θέρμανση. με υδραζίνη πάνω από Pd/C. για αρωματικές νιτροενώσεις, TlCl 3, CrCl 2 και SnCl 2 χρησιμοποιούνται μερικές φορές, αρωματικές. Οι πολυ-νιτροενώσεις ανάγονται επιλεκτικά σε νιτραμίνες με υδροσουλφίδιο Na σε CH30H. Υπάρχουν τρόποι επιλογής. μείωση της ομάδας NO 2 σε πολυλειτουργικές νιτροενώσεις χωρίς να επηρεάζονται άλλες λειτουργίες.
Όταν το P(III) δρα σε αρωματικές νιτροενώσεις, εμφανίζεται μια αλληλουχία. αποοξυγόνωση της ομάδας NO 2 με το σχηματισμό νιτρενίων υψηλής αντίδρασης. Το διάλυμα χρησιμοποιείται για τη σύνθεση συμπυκνωτή. ετερόκυκλοι, για παράδειγμα:
Υπό τις ίδιες συνθήκες, οι σιλυλαιθέρες των νιτρονικών ενώσεων μετασχηματίζονται σε σιλυλικά παράγωγα οξιμών. Η επεξεργασία των πρωτογενών νιτροαλκανίων PCl 3 σε πυριδίνη ή NaBH 2S οδηγεί σε νιτρίλια. Οι αρωματικές νιτροενώσεις που περιέχουν έναν υποκαταστάτη διπλού δεσμού ή έναν υποκαταστάτη κυκλοπροπυλίου στην ορθο θέση αναδιατάσσονται σε όξινο περιβάλλον για να σχηματίσουν ο-νιτροσοκετόνες, για παράδειγμα:

Ν Οι ιτροενώσεις και οι εστέρες νιτρόνης αντιδρούν με περίσσεια αντιδραστηρίου Grignard για να δώσουν παράγωγα υδροξυλαμίνης:
Αναλογίες για τους δεσμούς O = N O και C = N O. Οι νιτροενώσεις εισέρχονται σε σχέσεις 1,3 διπολικής κυκλοπροσθήκης, για παράδειγμα:

Ναΐμπ. Αυτή η διαδικασία συμβαίνει εύκολα μεταξύ εστέρων νιτρονίου και ολεφινών ή ακετυλενίων. Σε προϊόντα κυκλοπροσθήκης (μονο- και δικυκλικές διαλκοξυαμίνες) υπό την επίδραση πυρηνόφιλων. και ηλεκτροφ. Τα αντιδραστήρια δεσμών N - O διασπώνται εύκολα, γεγονός που οδηγεί σε αποσύνθεση. αλιφατικός και ετεροκυκλική. συν.:

Για προπαρασκευαστικούς σκοπούς, χρησιμοποιούνται στην περιοχή σταθεροί εστέρες σιλυλονιτρονών.
R-ts και διατήρηση της ομάδας NO 2. Οι αλειφατικές νιτροενώσεις που περιέχουν ένα άτομο α-Η αλκυλιώνονται και ακυλιώνονται εύκολα, σχηματίζοντας συνήθως Ο-παράγωγα. Ωστόσο, αμοιβαίο mod. άλατα διλιθίου πρωτοταγών νίτρο ενώσεων με αλκυλαλογονίδια, ανυδρίτες ή αλογονίδια καρβοξυλικών οξέων οδηγεί σε C-αλκυλίωση ή C-ακυλίωση προϊόντων, για παράδειγμα:
Υπάρχουν γνωστά παραδείγματα ιντραμόλης. C-αλκυλίωση, π.χ.
Οι πρωτογενείς και δευτερογενείς νιτροενώσεις αντιδρούν με αλειφατικές ενώσεις. αμίνες και CH 2 O με το σχηματισμό ρ-αμινο παραγώγων (διάλυμα Mannich). στο διάλυμα μπορείτε να χρησιμοποιήσετε προηγουμένως παρασκευασμένα παράγωγα μεθυλόλης νιτρο ενώσεων ή αμινο ενώσεων:

Το ενεργοποιητικό αποτέλεσμα της ομάδας NO 2 στο πυρηνόφιλο. Η υποκατάσταση (ιδιαίτερα στην ορθοθέση) χρησιμοποιείται ευρέως στην οργ. σύνθεση και βιομηχανία. Η αντίδραση προχωρά σύμφωνα με το σχήμα προσθήκης-εξάλειψης με ενδιάμεσο. σχηματισμός του συμπλέγματος s (σύμπλεγμα Meisenheimer). Σύμφωνα με αυτό το σχήμα, τα άτομα αλογόνου αντικαθίστανται εύκολα από πυρηνόφιλα:

Υπάρχουν γνωστά παραδείγματα υποκατάστασης από τον μηχανισμό ριζικών ανιόντων με σύλληψη ηλεκτρονίων σε αρωματικές ενώσεις. σύνδεση και απελευθέρωση ιόντων αλογονιδίου ή άλλων ομάδων, π.χ. αλκόξυ, αμινο, θειικό, ΝΟ - 2. Στην τελευταία περίπτωση, η αντίδραση είναι ευκολότερη, τόσο μεγαλύτερη είναι η απόκλιση της ομάδας ΝΟ 2 από την ομοεπίπεδη, για παράδειγμα: στο 2,3-δινιτροτολουόλιο αντικαθίσταται στη βάση. Ομάδα NO 2 στη θέση 2. Το άτομο Η σε αρωματικές νιτροενώσεις είναι επίσης ικανό να πυρηνόφιλο. υποκατάσταση-νιτροβενζόλιο όταν θερμαίνεται. με NaOH σχηματίζει ο-νιτροφαινόλη.
Η νίτρο ομάδα διευκολύνει τις αρωματικές ανακατατάξεις. συν. σύμφωνα με τον μηχανισμό της intramol. νουκλεόφ. αντικατάσταση ή μέσω του σταδίου σχηματισμού καρβανιόν (βλ. Αναδιάταξη χαμόγελου).
Η εισαγωγή μιας δεύτερης ομάδας NO 2 επιταχύνει το νουκλεόφιο. υποκατάστασηΝ ιτρο ενώσεις που υπάρχουν. βάσεις προστίθενται σε αλδεΰδες και κετόνες, δίνοντας νιτροαλκοόλες (βλέπε αντιδράσεις Henri), πρωτογενείς και δευτερογενείς νιτροενώσεις - σε ενώσεις που περιέχουν ενεργοποιητή. διπλός δεσμός (r-tion του Michael), για παράδειγμα:

Οι πρωτογενείς νιτροενώσεις μπορούν να εισέλθουν σε μια αντίδραση Michael με ένα δεύτερο μόριο μιας ακόρεστης ένωσης. αυτή η συνοικία με την τελευταία. έκστασησχηματισμός της ομάδας ΝΟ 2 χρησιμοποιείται για τη σύνθεση πολυλειτουργικών. αλιφατικός συνδέσεις. Ο συνδυασμός των διαλυμάτων Henri και Michael οδηγεί σε 1,3-δινιτρο ενώσεις, για παράδειγμα:
Κ απενεργοποιήθηκε Μόνο παράγωγα Hg των gem-di- ή trinitro ενώσεων, καθώς και IC(NO 2) 3 και C(NO 2) 4, προστίθενται στον διπλό δεσμό, με αποτέλεσμα το σχηματισμό προϊόντων C- ή O-αλκυλίωσης. Το τελευταίο μπορεί να εισέλθει σε μια αντίδραση κυκλο-προσθήκης με ένα δεύτερο μόριο ολεφίνης:

Οι νιτροολεφίνες εισέρχονται εύκολα σε διαλύματα προσθήκης: με νερό σε ελαφρώς όξινο ή ελαφρώς αλκαλικό περιβάλλον με το τελευταίο. με την οπισθοδρομική αντίδραση του Henri σχηματίζουν καρβονυλικές ενώσεις. και νιτροαλκάνια. με νιτροενώσεις που περιέχουν άτομο α-Η, πολυνιτροενώσεις. προσθέστε άλλα οξέα CH, όπως ακετυλακετόνη, ακετοξικούς και μηλονικούς εστέρες, αντιδραστήρια Grignard, καθώς και πυρηνόφιλα όπως OR - , NR - 2, κ.λπ., για παράδειγμα:

Οι νιτροολεφίνες μπορούν να δράσουν ως διενόφιλα ή διπολόφιλα στις διαδικασίες σύνθεσης διενίου και κυκλοπροσθήκης και τα 1,4-δινιτροδιένια ως συστατικά διενίου, για παράδειγμα:

Παραλαβή.Στη βιομηχανία, τα κατώτερα νιτροαλκάνια λαμβάνονται με νίτρωση σε υγρή φάση (μέθοδος Konovalov) ή σε φάση ατμού (μέθοδος Hess) ενός μείγματος αιθανίου, προπανίου και βουτανίου που απομονώνεται από φυσικό αέριο ή λαμβάνεται με διύλιση πετρελαίου (βλ. Νίτρωση). Υψηλότερες νιτροενώσεις λαμβάνονται επίσης χρησιμοποιώντας αυτή τη μέθοδο, για παράδειγμα. Το νιτροκυκλοεξάνιο είναι ένα ενδιάμεσο στην παραγωγή καπρολακτάμης.
Στο εργαστήριο, η νίτρωση των ενώσεων του αζώτου χρησιμοποιείται για τη λήψη νιτροαλκανίων. με ενεργοποιημένο ομάδα μεθυλενίου; μια βολική μέθοδος για τη σύνθεση πρωτογενών νιτροαλκανίων είναι η νίτρωση της 1,3-ινδανεδιόνης με την τελευταία. αλκαλική υδρόλυση α-νιτροκετόνης:

Οι αλειφατικές νιτροενώσεις λαμβάνουν επίσης αλληλεπίδραση. AgNO 2 με αλκυλαλογονίδια ή NaNO 2 με εστέρες α-αλογονοκαρβοξυλικών οξέων (βλέπε αντίδραση Meyer). Οι αλειφατικές νιτροενώσεις σχηματίζονται από την οξείδωση αμινών και οξιμών. Οξείδωση οξίμης - μια μέθοδος για την παραγωγή ενώσεων αίμη-δι- και αίμη-τρινιτρο, για παράδειγμα:
1. Νιτροενώσεις
1.2. Αντιδράσεις νιτροενώσεων
1. ΝΙΤΡΟΕΝΩΣΕΙΣ
Οι νιτροενώσεις είναι παράγωγα υδρογονάνθρακα στα οποία ένα ή περισσότερα άτομα υδρογόνου αντικαθίστανται από μια νίτρο ομάδα -NO 2 . Ανάλογα με τη ρίζα υδρογονάνθρακα στην οποία συνδέεται η νίτρο ομάδα, οι νιτροενώσεις χωρίζονται σε αρωματικές και αλειφατικές. Οι αλειφατικές ενώσεις διακρίνονται ως πρωτογενείς 1o, δευτεροταγείς 2o και τριτοταγείς 3o, ανάλογα με το αν μια νίτρο ομάδα συνδέεται με το άτομο άνθρακα 1o, 2o ή 3o.
Η νιτροομάδα –NO2 δεν πρέπει να συγχέεται με την ομάδα νιτρωδών –ΟΝΟ. Η νίτρο ομάδα έχει την ακόλουθη δομή:
Η παρουσία ενός συνολικού θετικού φορτίου στο άτομο του αζώτου προκαλεί ισχυρή επίδραση -I. Μαζί με το ισχυρό φαινόμενο -I, η νίτρο ομάδα έχει ένα ισχυρό φαινόμενο -M.
Πρώην. 1. Εξετάστε τη δομή της νίτρο ομάδας και την επίδρασή της στην κατεύθυνση και την ταχύτητα της αντίδρασης ηλεκτρόφιλης υποκατάστασης στον αρωματικό δακτύλιο.
1.1. Μέθοδοι λήψης νιτροενώσεων
Σχεδόν όλες οι μέθοδοι για την παραγωγή νιτροενώσεων έχουν ήδη συζητηθεί σε προηγούμενα κεφάλαια. Οι αρωματικές νίτρο ενώσεις λαμβάνονται συνήθως με άμεση νίτρωση αρενών και αρωματικών ετεροκυκλικών ενώσεων. Το νιτροκυκλοεξάνιο παράγεται βιομηχανικά με νίτρωση κυκλοεξανίου:
 (1)
(1)
Το νιτρομεθάνιο λαμβάνεται επίσης με τον ίδιο τρόπο, αλλά σε εργαστηριακές συνθήκες λαμβάνεται από χλωροοξικό οξύ ως αποτέλεσμα αντιδράσεων (2-5). Το βασικό στάδιο αυτών είναι η αντίδραση (3), η οποία λαμβάνει χώρα μέσω του μηχανισμού SN2.
Χλωροοξικό οξύ Χλωροοξικό νάτριο
Νιτροοξικό οξύ
Νιτρομεθάνιο
1.2. Αντιδράσεις νιτροενώσεων
1.2.1. Ταυτομερισμός αλειφατικών νίτρο ενώσεων
Λόγω των ισχυρών ιδιοτήτων έλξης ηλεκτρονίων της νίτρο ομάδας, τα άτομα α-υδρογόνου έχουν αυξημένη κινητικότητα και επομένως οι πρωτογενείς και δευτερογενείς νιτροενώσεις είναι CH-οξέα. Έτσι, το νιτρομεθάνιο είναι ένα αρκετά ισχυρό οξύ (pKa 10,2) και σε αλκαλικό περιβάλλον μετατρέπεται εύκολα σε σταθεροποιημένο σε συντονισμό ανιόν:
Νιτρομεθάνιο pKa 10.2 Ανιόν σταθεροποιημένο με συντονισμό
Άσκηση 2. Να γράψετε τις αντιδράσεις (α) νιτρομεθανίου και (β) νιτροκυκλοεξανίου με υδατικό διάλυμα NaOH.
1.2.2. Συμπύκνωση αλειφατικών νίτρο ενώσεων με αλδεΰδες και κετόνες
Μια νίτρο ομάδα μπορεί να εισαχθεί σε αλειφατικές ενώσεις με μια αντίδραση αλδόλης μεταξύ ενός ανιόντος νιτροαλκανίου και μιας αλδεΰδης ή κετόνης. Στα νιτροαλκάνια, τα άτομα α-υδρογόνου είναι ακόμη πιο κινητά από ό,τι στις αλδεΰδες και τις κετόνες, και επομένως μπορούν να εισέλθουν σε αντιδράσεις προσθήκης και συμπύκνωσης με αλδεΰδες και κετόνες, παρέχοντας τα άτομα α-υδρογόνου τους. Με τις αλειφατικές αλδεΰδες, συνήθως συμβαίνουν αντιδράσεις προσθήκης, και με τις αρωματικές αλδεΰδες, συμβαίνουν μόνο αντιδράσεις συμπύκνωσης.
Έτσι, το νιτρομεθάνιο προσθέτει στην κυκλοεξανόνη,
 (7)
(7)
1-Νιτρομεθυλοκυκλοεξανόλη
αλλά συμπυκνώνεται με βενζαλδεΰδη,
Η αντίδραση προσθήκης με φορμαλδεΰδη περιλαμβάνει και τα τρία άτομα υδρογόνου του νιτρομεθανίου για να σχηματιστεί 2-υδροξυμεθυλ-2-νιτρο-1,3-δινιτροπροπάνιο ή τριμεθυλολνιτρομεθάνιο.
Με συμπύκνωση νιτρομεθανίου με εξαμεθυλενοτετραμίνη λάβαμε 7-νιτρο-1,3,5-τριαζααδαμαντάνιο:
 (10)
(10)
Πρώην. 3. Γράψτε τις αντιδράσεις φορμαλδεΰδης (α) με νιτρομεθάνιο και (β) με νιτροκυκλοεξάνιο σε αλκαλικό μέσο.
1.2.3. Μείωση νιτροενώσεων
Η νίτρο ομάδα ανάγεται σε αμινομάδα με διάφορους αναγωγικούς παράγοντες (11.3.3). Η ανιλίνη παράγεται με υδρογόνωση του νιτροβενζολίου υπό πίεση παρουσία νικελίου Raney υπό βιομηχανικές συνθήκες.
 (11) (11 32)
(11) (11 32)
Σε εργαστηριακές συνθήκες, αντί για υδρογόνο, μπορεί να χρησιμοποιηθεί υδραζίνη, η οποία αποσυντίθεται παρουσία νικελίου Raney για να απελευθερώσει υδρογόνο.
 (12)
(12)
7-νιτρο-1,3,5-τριαζααδαμαντάνιο 7-αμινο-1,3,5-τριαζααδαμαντάνιο
Οι νιτροενώσεις ανάγεται με μέταλλα σε όξινο περιβάλλον που ακολουθείται από αλκαλοποίηση
 (13) (11 33)
(13) (11 33)
Ανάλογα με το pH του μέσου και τον αναγωγικό παράγοντα που χρησιμοποιείται, μπορούν να ληφθούν διαφορετικά προϊόντα. Σε ένα ουδέτερο και αλκαλικό περιβάλλον, η δράση των συμβατικών αναγωγικών παραγόντων προς τις νιτροενώσεις είναι μικρότερη από ό,τι σε ένα όξινο περιβάλλον. Χαρακτηριστικό παράδειγμα είναι η αναγωγή του νιτροβενζολίου με ψευδάργυρο. Σε περίσσεια υδροχλωρικού οξέος, ο ψευδάργυρος μειώνει το νιτροβενζόλιο σε ανιλίνη, ενώ σε ένα ρυθμιστικό διάλυμα χλωριούχου αμμωνίου ανάγεται σε φαινυλυδροξυλαμίνη:
 (14)
(14)
Σε όξινο περιβάλλον, οι αρυλυδροξυλαμίνες υφίστανται αναδιάταξη:
 (15)
(15)
Το p-Aminophenol χρησιμοποιείται ως προγραμματιστής στη φωτογραφία. Η φαινυλυδροξυλαμίνη μπορεί περαιτέρω να οξειδωθεί σε νιτροσοβενζόλιο:
 (16)
(16)
Νιτροσοβενζόλιο
Με αναγωγή του νιτροβενζολίου με χλωριούχο κασσίτερο (II), λαμβάνεται αζοβενζόλιο και με ψευδάργυρο σε αλκαλικό μέσο, λαμβάνεται υδραζοβενζόλιο.
 (17)
(17)
 (18)
(18)
Με την επεξεργασία του νιτροβενζολίου με ένα διάλυμα αλκαλίου σε μεθανόλη, λαμβάνεται αζοξυβενζόλιο και η μεθανόλη οξειδώνεται σε μυρμηκικό οξύ.
 (19)
(19)
Είναι γνωστές μέθοδοι ατελούς αναγωγής νιτροαλκανίων. Μία από τις βιομηχανικές μεθόδους για την παραγωγή νάιλον βασίζεται σε αυτό. Με τη νίτρωση του κυκλοεξανίου, λαμβάνεται νιτροκυκλοεξάνιο, το οποίο μετατρέπεται με αναγωγή σε οξίμη κυκλοεξανόνης και στη συνέχεια, χρησιμοποιώντας την αναδιάταξη Beckmann, σε καπρολακτάμη και πολυαμίδιο - το αρχικό υλικό για την παρασκευή ινών - νάιλον:

Η αναγωγή της νίτρο ομάδας προϊόντων προσθήκης αλδόλης (7) είναι ένας βολικός τρόπος για τη λήψη β-αμινοαλκοολών.
 (20)
(20)
1-Νιτρομεθυλοκυκλοεξανόλη 1-Αμινομεθυλοκυκλοεξανόλη
Η χρήση του υδρόθειου ως αναγωγικού παράγοντα καθιστά δυνατή την αναγωγή μιας από τις νιτροομάδες στα δινιτροαρένια:
 (11 34)
(11 34)
m-Δινιτροβενζόλιο m-Νιτροανιλίνη
 (21)
(21)
2,4-δινιτροανιλίνη 4-νιτρο-1,2-διαμινοβενζόλιο
Άσκηση 4. Γράψτε τις αντιδράσεις αναγωγής (α) m-δινιτροβενζολίου με κασσίτερο σε υδροχλωρικό οξύ, (β) m-δινιτροβενζολίου με υδρόθειο, (γ) π-νιτροτολουολίου με ψευδάργυρο σε ρυθμιστικό διάλυμα χλωριούχου αμμωνίου.
Άσκηση 5. Συμπληρώστε τις αντιδράσεις:
(ΕΝΑ)  (σι)
(σι) 
Στη συστηματική ονοματολογία, οι αμίνες ονομάζονται προσθέτοντας το πρόθεμα αμίνη στο όνομα του υδρογονάνθρακα. Με ορθολογική ονοματολογία θεωρούνται αλκύλιο ή αρυλαμίνες.
![]()
![]()
Μεθαναμίνη Αιθαναμίνη Ν-Μεθυλαιθαναμίνη Ν-Αιθυλαιθαναμίνη
(μεθυλαμίνη) (αιθυλαμίνη) (μεθυλαιθυλαμίνη) (διαιθυλαμίνη)
![]()
![]()
Ν,Ν-Διαιθυλαιθαναμίνη 2-Αμινοαιθανόλη 3-Αμινοπροπάνιο
τριαιθυλαμίνη) (αιθανολαμίνη) οξύ

Κυκλοεξαναμίνη Βενζολαμίνη Ν-Μεθυλοβενζολαμίνη 2-Μεθυλοβενζολαμίνη
(κυκλοεξυλαμίνη) (ανιλίνη) (Ν-μεθυλανιλίνη) (ο-τολουιδίνη)
Οι ετεροκυκλικές αμίνες ονομάζονται από τον αντίστοιχο υδρογονάνθρακα εισάγοντας το πρόθεμα aza-, diaza- ή triaza- για να δηλώσει τον αριθμό των ατόμων αζώτου.
1-Azacyclopeta- 1,2-Diazacyclopeta- 1,3-Diazacyclopeta-
2,4-διένιο 2,4-διένιο 2,4-διένιο
Η νίτρωση των αρωματικών ενώσεων είναι ο κύριος τρόπος λήψης νιτροενώσεων. Η διαδικασία της νίτρωσης ως ειδική περίπτωση ηλεκτροφιλικής υποκατάστασης στην αρωματική σειρά έχει ήδη εξεταστεί νωρίτερα. Επομένως, φαίνεται σκόπιμο να εστιάσουμε στο συνθετικό δυναμικό αυτής της αντίδρασης.
Το ίδιο το βενζόλιο νιτρώνεται αρκετά εύκολα και με καλά αποτελέσματα.
Κάτω από πιο σοβαρές συνθήκες, το νιτροβενζόλιο μπορεί επίσης να νιτρωθεί για να σχηματιστεί Μ-δινιτροβενζόλιο

Λόγω της επίδρασης απενεργοποίησης δύο νιτροομάδων, εισαγάγετε μια τρίτη ομάδα νίτρο Μ-Το δινιτροβενζόλιο μπορεί να ληφθεί μόνο με μεγάλη δυσκολία. Το 1,3,5-τρινιτροβενζόλιο ελήφθη σε 45% απόδοση ως αποτέλεσμα της νίτρωσης Μ-δινιτροβενζόλιο στους 100-110 o C και διάρκεια αντίδρασης 5 ημέρες.
Οι δυσκολίες στην απόκτηση τρινιτροβενζολίου με άμεση νίτρωση του βενζολίου οδήγησαν στην ανάπτυξη έμμεσων μεθόδων. Σύμφωνα με ένα από αυτά, το τρινιτροτολουόλιο, το οποίο είναι πιο προσιτό από το τρινιτροβενζόλιο, οξειδώνεται σε 2,4,6-τρινιτροβενζοϊκό οξύ, το οποίο αποκαρβοξυλιώνεται εύκολα όταν θερμαίνεται σε νερό.

Κατά τον ίδιο τρόπο, πρέπει να καταφεύγουμε σε έμμεσες μεθόδους όταν είναι απαραίτητο να ληφθεί 1,2-δινιτροβενζόλιο. Σε αυτή την περίπτωση, η ικανότητα της αμινομάδας να οξειδώνεται σε μια νίτρο ομάδα μέσα Ο-νιτροανιλίνη

Ακόμη και σε περιπτώσεις όπου η παρασκευή νιτροενώσεων με νίτρωση δεν θα πρέπει να συναντήσει ιδιαίτερες δυσκολίες, πρέπει να καταφύγουμε σε έμμεσες μεθόδους. Έτσι, δεν είναι δυνατόν να ληφθεί πικρικό οξύ με νίτρωση της φαινόλης, επειδή Με το νιτρικό οξύ, η φαινόλη δεν νιτρώνεται, αλλά οξειδώνεται. Επομένως, συνήθως χρησιμοποιείται το ακόλουθο σχήμα

Οι λεπτές αποχρώσεις αυτού του σχήματος είναι ότι λόγω της απενεργοποίησης του δακτυλίου από χλώριο και δύο ήδη υπάρχουσες νιτροομάδες, δεν είναι δυνατή η εισαγωγή μιας τρίτης νιτροομάδας σε αυτόν. Επομένως, το χλώριο στο δινιτροχλωροβενζόλιο αντικαθίσταται πρώτα από υδροξύλιο, στο οποίο συμβάλλουν οι νιτροομάδες (διμοριακή υποκατάσταση). Η δινιτροφαινόλη που προκύπτει δέχεται εύκολα μια άλλη νιτροομάδα χωρίς να οξειδώνεται σε αξιοσημείωτο βαθμό. Οι υπάρχουσες νιτροομάδες προστατεύουν τον δακτύλιο βενζολίου από την οξείδωση.
Ένας άλλος μη προφανής τρόπος λήψης πικρικού οξέος είναι η σουλφόνωση της φαινόλης σε 2,4-φαινολικό δισουλφονικό οξύ, ακολουθούμενη από νίτρωση της προκύπτουσας ένωσης. Σε αυτή την περίπτωση, ταυτόχρονα με τη νίτρωση, οι σουλφο ομάδες αντικαθίστανται από νιτροομάδες

Ένα από τα πιο σημαντικά αρωματικά νιτροπαράγωγα, το τρινιτροτολουόλιο, παράγεται στην τεχνολογία με νίτρωση τολουολίου, η οποία προχωρά σύμφωνα με το ακόλουθο σχήμα

Χημικές ιδιότητες
Οι αρωματικές νιτροενώσεις είναι ικανές να αντιδρούν τόσο με τη συμμετοχή του δακτυλίου βενζολίου όσο και της νιτροομάδας. Αυτά τα δομικά στοιχεία επηρεάζουν το ένα την αντιδραστικότητα του άλλου. Έτσι, υπό την επίδραση της νιτροομάδας, το νιτροβενζόλιο εισέρχεται απρόθυμα σε μια αντίδραση ηλεκτρόφιλης υποκατάστασης και ο νέος υποκαταστάτης δέχεται Μ-θέση. Η νίτρο ομάδα επηρεάζει όχι μόνο την αντιδραστικότητα του δακτυλίου βενζολίου, αλλά και τη συμπεριφορά γειτονικών λειτουργικών ομάδων σε χημικές αντιδράσεις.
Ας εξετάσουμε τις αντιδράσεις των αρωματικών νίτρο ενώσεων λόγω της νιτροομάδας.
16.2.1. Ανάκτηση.Μία από τις σημαντικότερες αντιδράσεις των νιτροενώσεων είναι η αναγωγή τους σε αρωματικές αμίνες, οι οποίες χρησιμοποιούνται ευρέως στην παραγωγή βαφών, φαρμάκων και φωτοχημικών.
Η δυνατότητα μετατροπής μιας νιτροομάδας σε μια αμινομάδα με την αναγωγή των νιτροενώσεων παρουσιάστηκε για πρώτη φορά από τη Ζινίνη το 1842 χρησιμοποιώντας το παράδειγμα της αντίδρασης νιτροβενζολίου με θειούχο αμμώνιο

Στη συνέχεια, η αναγωγή των αρωματικών νίτρο ενώσεων αποτέλεσε αντικείμενο εις βάθος μελέτης. Έχει διαπιστωθεί ότι στη γενική περίπτωση η αναγωγή είναι πολύπλοκη και προχωρά σε διάφορα στάδια με το σχηματισμό ενδιάμεσων προϊόντων. Οι αμίνες είναι μόνο το τελικό προϊόν της αντίδρασης. Το αποτέλεσμα της αποκατάστασης καθορίζεται από την ισχύ του αναγωγικού παράγοντα και το περιβάλλον pH. Κατά την ηλεκτροχημική αναγωγή, η σύνθεση των προϊόντων εξαρτάται από το δυναμικό των ηλεκτροδίων. Μεταβάλλοντας αυτούς τους παράγοντες, μπορείτε να καθυστερήσετε τη διαδικασία ανάκτησης σε ενδιάμεσα στάδια. Σε ουδέτερα και όξινα μέσα, η αναγωγή του νιτροβενζολίου προχωρά διαδοχικά μέσω του σχηματισμού νιτροσοβενζολίου και φαινυλυδροξυλαμίνης

Όταν η αναγωγή πραγματοποιείται σε αλκαλικό μέσο, το προκύπτον νιτροσοβενζόλιο και φαινυλυδροξυλαμίνη μπορούν να συμπυκνωθούν μεταξύ τους για να σχηματίσουν αζοξυβενζόλιο, στο οποίο τα άτομα αζώτου και οξυγόνου αλληλοσυνδέονται με έναν ημιπολικό δεσμό

Ο προτεινόμενος μηχανισμός συμπύκνωσης μοιάζει με τον μηχανισμό συμπύκνωσης αλδόλης
Η αναγωγή του αζοξυβενζολίου σε ανιλίνη συμβαίνει μέσω αζω- και υδραζοβενζολίων
Όλα τα ενδιάμεσα προϊόντα που αναφέρονται παραπάνω για την αναγωγή του νιτροβενζολίου σε ανιλίνη μπορούν να ληφθούν είτε απευθείας από το νιτροβενζόλιο είτε το ένα από το άλλο. Να μερικά παραδείγματα


16.2.2. Η επίδραση της νίτρο ομάδας στην αντιδραστικότητα άλλων λειτουργικών ομάδων.Στη μελέτη μας για τα αρωματικά παράγωγα αλογόνου, έχουμε ήδη αντιμετωπίσει μια περίπτωση όπου οι κατάλληλα τοποθετημένες νίτρο ομάδες επηρέασαν σημαντικά την πυρηνόφιλη υποκατάσταση του αλογόνου (διμοριακή υποκατάσταση του αρωματικά δεσμευμένου αλογόνου). Για παράδειγμα Ο- Και Π-δινιτροβενζόλια, βρέθηκε ότι η νίτρο ομάδα μπορεί να προάγει την πυρηνόφιλη υποκατάσταση όχι μόνο του αλογόνου, αλλά ακόμη και μιας άλλης νιτροομάδας

Ο μηχανισμός της διμοριακής αντικατάστασης μιας νιτροομάδας με μια ομάδα υδροξυλίου μπορεί να αναπαρασταθεί ως η ακόλουθη διεργασία δύο σταδίων

Το καρβανιόν που σχηματίζεται στο πρώτο στάδιο της υπό εξέταση αντίδρασης είναι σταθεροποιημένο σε συντονισμό λόγω της συμβολής της περιοριστικής δομής 1, στην οποία η νίτρο ομάδα αποσύρει ηλεκτρόνια ακριβώς από τον άνθρακα του δακτυλίου βενζολίου που έχει περίσσευμά τους.
Ένα χαρακτηριστικό της πυρηνόφιλης υποκατάστασης μιας νίτρο ομάδας υπό την επίδραση μιας άλλης νίτρο ομάδας είναι ότι η αντίδραση είναι πολύ ευαίσθητη στη θέση των νιτροομάδων σε σχέση μεταξύ τους. Είναι γνωστό ότι Μ-Το δινιτροβενζόλιο δεν αντιδρά με αλκοολικό διάλυμα αμμωνίας ακόμη και στους 250 o C.
Άλλα παραδείγματα νιτροομάδας που προάγει την υποκατάσταση, σε αυτή την περίπτωση το υδροξύλιο, είναι οι μετασχηματισμοί του πικρικού οξέος

16.2.3. Συμπλοκοποίηση με αρωματικούς υδρογονάνθρακες.Μια χαρακτηριστική ιδιότητα των αρωματικών νίτρο ενώσεων είναι η τάση τους να σχηματίζουν σύμπλοκα με αρωματικούς υδρογονάνθρακες. Οι δεσμοί σε τέτοια σύμπλοκα είναι ηλεκτροστατικής φύσης και προκύπτουν μεταξύ σωματιδίων που δότες ηλεκτρονίων και σωματιδίων δέκτη ηλεκτρονίων. Τα συμπλέγματα που εξετάζονται ονομάζονται π -συμπλέγματα ή συμπλέγματα μεταφοράς φορτίου.
π –Τα σύμπλοκα στις περισσότερες περιπτώσεις είναι κρυσταλλικές ουσίες με χαρακτηριστικά σημεία τήξης. Αν είναι απαραίτητο π -το σύμπλεγμα μπορεί να καταστραφεί με την απελευθέρωση υδρογονανθράκων. Χάρη στον συνδυασμό αυτών των ιδιοτήτων π - τα σύμπλοκα χρησιμοποιούνται για την απομόνωση, τον καθαρισμό και την ταυτοποίηση αρωματικών υδρογονανθράκων. Το πικρινικό οξύ χρησιμοποιείται ιδιαίτερα συχνά για σχηματισμό συμπλόκων, τα σύμπλοκα των οποίων λανθασμένα ονομάζονται πικράτες.
Κεφάλαιο 17
Αμίνες
Με βάση τον βαθμό υποκατάστασης των ατόμων υδρογόνου στην αμμωνία από αλκυλ και αρυλ υποκαταστάτες, διακρίνονται πρωτοταγείς, δευτεροταγείς και τριτοταγείς αμίνες. Ανάλογα με τη φύση των υποκαταστατών, οι αμίνες μπορεί να είναι λιπαρές-αρωματικές ή καθαρά αρωματικές.
Οι αρωματικές αμίνες ονομάζονται προσθέτοντας το επίθημα «αμίνη» στο όνομα των ομάδων που σχετίζονται με το άζωτο. Σε περίπλοκες περιπτώσεις, μια αμινομάδα με μικρότερο υποκαταστάτη χαρακτηρίζεται από το πρόθεμα «αμινο» (Ν-μεθυλαμινο-, Ν,Ν-διμεθυλαμινο), το οποίο προστίθεται στο όνομα του πιο πολύπλοκου υποκαταστάτη. Παρακάτω είναι οι πιο κοινές αμίνες και τα ονόματά τους.

Μέθοδοι παραλαβής
Έχουμε ήδη συναντήσει πολλές από τις μεθόδους παρασκευής αμινών κατά τη μελέτη των αλειφατικών αμινών. Κατά την εφαρμογή αυτών των μεθόδων στη σύνθεση αρωματικών αμινών, εμφανίζονται ορισμένες ιδιαιτερότητες, επομένως, χωρίς φόβο επανάληψης, θα τις εξετάσουμε.
17.1.1. Μείωση νιτροενώσεων.Η αναγωγή των νιτροενώσεων είναι η κύρια μέθοδος τόσο για την εργαστηριακή όσο και για τη βιομηχανική παραγωγή αμινών, η οποία μπορεί να πραγματοποιηθεί με διάφορους τρόπους. Αυτές περιλαμβάνουν καταλυτική υδρογόνωση, αναγωγή με ατομικό υδρογόνο και χημική αναγωγή.
Η καταλυτική αναγωγή πραγματοποιείται με μοριακό υδρογόνο παρουσία ενώσεων λεπτώς αλεσμένου νικελίου ή πλατίνας, συμπλόκου χαλκού στα στηρίγματα. Όταν επιλέγετε έναν καταλύτη και τις συνθήκες αναγωγής, πρέπει να λάβετε υπόψη ότι μπορούν επίσης να μειωθούν και άλλες λειτουργικές ομάδες. Επιπλέον, η καταλυτική αναγωγή των νίτρο ενώσεων πρέπει να πραγματοποιείται με κάποια προσοχή λόγω της ακραίας εξώθερμης φύσης της αντίδρασης.
Όταν το θειούχο αμμώνιο χρησιμοποιείται ως χημικός αναγωγικός παράγοντας, καθίσταται δυνατή η αναγωγή μόνο μιας από πολλές νιτροομάδες

17.1.2. Αμίνωση παραγώγων αλογόνου.Υπάρχουν γνωστές δυσκολίες που προκύπτουν κατά την αμίνωση των αρωματικών παραγώγων αλογόνου με τη χρήση του μηχανισμού «εξάλειψης-προσθήκης». Ωστόσο, όπως έχει ήδη αναφερθεί περισσότερες από μία φορές, οι υποκαταστάτες που αποσύρουν ηλεκτρόνια στον δακτύλιο βενζολίου, σωστά τοποθετημένοι, διευκολύνουν σημαντικά την υποκατάσταση αλογόνου σε αρυλαλογονίδια, κατευθύνοντας τη διαδικασία μέσω ενός διμοριακού μηχανισμού. Για σύγκριση, παρακάτω είναι οι συνθήκες για την αμίνωση του χλωροβενζολίου και του δινιτροχλωροβενζολίου

17.1.3. Ο Χόφμαν χωρίζει.Η διάσπαση Hoffmann των αμιδίων οξέος παράγει πρωτοταγείς αμίνες που περιέχουν έναν λιγότερο άνθρακα από τα αρχικά αμίδια

Η αντίδραση προχωρά με τη μετανάστευση του φαινυλίου από τον άνθρακα καρβονυλίου στο άτομο αζώτου (μετατόπιση 1,2-φαινυλίου) σύμφωνα με τον ακόλουθο προτεινόμενο μηχανισμό

17.1.4. Αλκυλίωση και αρυλίωση αμινών.Η αλκυλίωση πρωτοταγών και δευτεροταγών αρωματικών αμινών με αλογονοαλκύλια ή αλκοόλες παράγει δευτεροταγείς και τριτοταγείς λιπαρές αρωματικές αμίνες

Δυστυχώς, όταν οι πρωτοταγείς αμίνες συμμετέχουν στην αντίδραση, λαμβάνεται ένα μείγμα. Αυτό μπορεί να αποφευχθεί εάν η αρχική αμίνη προ-ακυλιωθεί και στη συνέχεια αλκυλιωθεί

Αυτή η μέθοδος προστασίας της αμινομάδας καθιστά δυνατή τη λήψη καθαρών δευτεροταγών αρωματικών αμινών, καθώς και τριτοταγών αμινών με διαφορετικές ρίζες υποκαταστάτη

Η αρυλίωση των αμινών καθιστά δυνατή τη λήψη καθαρών δευτεροταγών και τριτοταγών αρωματικών αμινών
Χημικές ιδιότητες
Οι αρωματικές αμίνες αντιδρούν τόσο με την αμινομάδα όσο και με τον δακτύλιο βενζολίου. Επιπλέον, κάθε λειτουργική ομάδα επηρεάζεται από μια άλλη ομάδα.
Αντιδράσεις στην αμινομάδα
Λόγω της παρουσίας μιας αμινομάδας, οι αρωματικές αμίνες υφίστανται πολυάριθμες αντιδράσεις. Μερικά από αυτά έχουν ήδη συζητηθεί: αλκυλίωση, ακυλίωση, αντίδραση με αλδεΰδες για σχηματισμό αζωμεθινών. Άλλες αντιδράσεις που θα δοθεί προσοχή είναι εύκολα προβλέψιμες, αλλά έχουν ορισμένα χαρακτηριστικά.
Βασικότητα
Η παρουσία ενός μόνο ζεύγους ηλεκτρονίων στο άτομο αζώτου, το οποίο μπορεί να παρουσιαστεί για να σχηματίσει δεσμό με ένα πρωτόνιο, παρέχει στις αρωματικές αμίνες βασικές ιδιότητες

Είναι ενδιαφέρον να συγκρίνουμε τη βασικότητα των αλειφατικών και των αρωματικών αμινών. Όπως έχει ήδη φανεί στη μελέτη των αλειφατικών αμινών, είναι βολικό να κρίνουμε τη βασικότητα των αμινών από τη σταθερά βασικότητας Κ μέσα

Ας συγκρίνουμε τις βασικές ιδιότητες της ανιλίνης, της μεθυλαμίνης και της αμμωνίας
Αμμωνία 1.7. 10 -5
Μεθυλαμίνη 4.4. 10 -4
Ανιλίνη 7.1. 10 -10
Από αυτά τα δεδομένα είναι σαφές ότι η εμφάνιση μιας μεθυλικής ομάδας που δίνει ηλεκτρόνια αυξάνει την πυκνότητα ηλεκτρονίων στο άτομο αζώτου και οδηγεί σε αυξημένη βασικότητα της μεθυλαμίνης σε σύγκριση με την αμμωνία. Ταυτόχρονα, η ομάδα φαινυλίου αποδυναμώνει τη βασικότητα της ανιλίνης περισσότερο από 10 5 φορές σε σύγκριση με την αμμωνία.
Η μείωση της βασικότητας της ανιλίνης σε σύγκριση με τις αλειφατικές αμίνες και την αμμωνία μπορεί να εξηγηθεί από τη σύζευξη του μοναδικού ζεύγους ηλεκτρονίων αζώτου με το εξάγωνο ηλεκτρονίων του δακτυλίου βενζολίου

Αυτό μειώνει την ικανότητα του μοναδικού ζεύγους ηλεκτρονίων να δέχεται ένα πρωτόνιο. Αυτή η τάση είναι ακόμη πιο έντονη στις αρωματικές αμίνες, οι οποίες περιέχουν υποκαταστάτες που αποσύρουν ηλεκτρόνια στον δακτύλιο βενζολίου.

Ετσι, Μ-Η νιτροανιλίνη ως βάση είναι 90 φορές πιο αδύναμη από την ανιλίνη.
Όπως θα ήταν αναμενόμενο, οι υποκαταστάτες που δότες ηλεκτρονίων στον δακτύλιο βενζολίου ενισχύουν τη βασικότητα των αρωματικών αμινών

Οι λιπαρές αρωματικές αμίνες, υπό την επίδραση της αλκυλομάδας, παρουσιάζουν μεγαλύτερη βασικότητα από την ανιλίνη και οι αμίνες με ομάδες απαγωγής ηλεκτρονίων στον δακτύλιο.