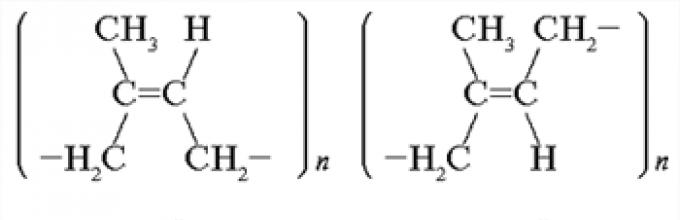Εξάρτηση των ιδιοτήτων των ουσιών από τη δομή των μορίων
Ένα μάθημα στα ανοιχτά μυαλά
Στόχοι. Εκπαιδευτικό – να εδραιώσει και να εμβαθύνει τις γνώσεις των μαθητών για τη θεωρία της χημικής δομής και τις βασικές αρχές της.
Εκπαιδευτικός– να προωθήσουν τη δημιουργία σχέσεων και σχέσεων αιτίου-αποτελέσματος.
Αναπτυξιακή– ανάπτυξη δεξιοτήτων σκέψης, ικανότητα μεταφοράς γνώσεων και δεξιοτήτων σε νέες καταστάσεις.
Εξοπλισμός και αντιδραστήρια.Ένα σετ μοντέλων με μπίλια και ραβδί. δείγματα φυσικού και συνθετικού καουτσούκ, διαιθυλαιθέρα, βουτανόλης, αιθανόλης, φαινόλης, λιθίου, νατρίου, διαλύματος λακκούβας, βρωμιούχου νερού, μυρμηκικού και οξικού οξέα.
Ρητό.«Κάθε ουσία - από την πιο απλή έως την πιο σύνθετη - έχει τρεις διαφορετικές αλλά αλληλένδετες πτυχές - ιδιότητα, σύνθεση, δομή»(V.M. Kedrov).
ΚΑΤΑ ΤΑ ΜΑΘΗΜΑΤΑ
Τι περιλαμβάνει η έννοια του «εθισμού»; (Μάθετε τις απόψεις των μαθητών).
Γράψτε τον ορισμό στον πίνακα: «Εθισμός είναι
1) η σχέση ενός φαινομένου με ένα άλλο ως συνέπεια μιας αιτίας.
2) υποταγή σε άλλους ελλείψει ανεξαρτησίας, ελευθερία» (λεξικό S.I. Ozhegov).
Θα προσδιορίσουμε μαζί τους στόχους του μαθήματος συντάσσοντας ένα διάγραμμα:
Μπλοκ παρακίνησης-προσανατολισμού
Διανοητική προθέρμανση
Προσδιορίστε την ορθότητα των παρακάτω δηλώσεων και υποστηρίξτε τις απαντήσεις σας με παραδείγματα.
Η θεωρία της χημικής δομής ανακαλύφθηκε από τον D.I. Mendeleev.
Απάντηση. A.M.Butlerov, 1861
Το σθένος του άνθρακα στις οργανικές ενώσεις μπορεί να είναι II και IV.
Απάντηση. Το σθένος του άνθρακα είναι πιο συχνά IV.
Τα άτομα που σχηματίζουν τα μόρια των οργανικών ουσιών συνδέονται τυχαία, χωρίς να λαμβάνεται υπόψη το σθένος.
Απάντηση. Τα άτομα στα μόρια συνδέονται σε μια συγκεκριμένη αλληλουχία ανάλογα με το σθένος τους.
Οι ιδιότητες των ουσιών δεν εξαρτώνται από τη δομή των μορίων.
Απάντηση. Ο Butlerov, στη θεωρία της χημικής δομής, υποστήριξε ότι οι ιδιότητες των οργανικών ενώσεων καθορίζονται από τη σύνθεση και τη δομή των μορίων τους.
Μονάδα λειτουργιών και εκτέλεσης
Παράγοντας χωρική δομή
Τι γνωρίζετε για τη χωρική δομή των μορίων των αλκανίων και των αλκενίων;
Απάντηση. Στα αλκάνια, σε κάθε άνθρακα υπάρχουν τέσσερα γειτονικά άτομα, τα οποία βρίσκονται στις κορυφές του τετραέδρου. Ο ίδιος ο άνθρακας βρίσκεται στο κέντρο του τετραέδρου. Τύπος υβριδισμού ατόμων άνθρακα – sp 3, γωνίες μεταξύ δεσμών (H–C–C, H–C–H, C–C–C) - 109°28". Η δομή της ανθρακικής αλυσίδας είναι ζιγκ-ζαγκ.
Στα αλκένια, δύο άτομα άνθρακα που συνδέονται με διπλό δεσμό και τέσσερα άτομα με απλούς δεσμούς βρίσκονται στο ίδιο επίπεδο. Τύπος ατομικού υβριδισμού – sp 2, γωνίες μεταξύ δεσμών (H–C=C, C–C=C) - 120°.
Θυμηθείτε τη διαφορά μεταξύ της χωρικής δομής των μορίων του φυσικού καουτσούκ και του συνθετικού καουτσούκ.
Απάντηση. Το φυσικό καουτσούκ, ένα γραμμικό πολυμερές ισοπρενίου, έχει τη δομή cis-1,4-πολυισοπρένιο. Το συνθετικό καουτσούκ μπορεί να έχει δομή έκσταση-1,4-πολυισοπρένιο.

Αυτά τα λάστιχα έχουν την ίδια ελαστικότητα;
Απάντηση. Η μορφή cis είναι πιο ελαστική από τη μορφή μετασχηματισμού. Τα μόρια του φυσικού καουτσούκ είναι μακρύτερα και πιο ελαστικά στριμμένα (πρώτα σε μια σπείρα και μετά σε μια μπάλα) από τα μόρια του συνθετικού καουτσούκ.
Το άμυλο (C 5 H 10 O 5) m είναι μια λευκή άμορφη σκόνη και η κυτταρίνη (C 5 H 10 O 5) n είναι μια ινώδης ουσία.
Ποιος είναι ο λόγος αυτής της διαφοράς;
Απάντηση. Το άμυλο είναι ένα πολυμερές -γλυκόζης, ενώ η κυτταρίνη είναι ένα πολυμερές -γλυκόζης.

Διαφέρουν οι χημικές ιδιότητες του αμύλου και της κυτταρίνης;
Απάντηση. Άμυλο + I 2 μπλε διάλυμα,
κυτταρίνη + νιτροκυτταρίνη HNO 3.
συμπέρασμα. Τόσο οι φυσικές όσο και οι χημικές ιδιότητες εξαρτώνται από τη χωρική δομή.
Συντελεστής χημικής δομής
Ποια είναι η κύρια ιδέα της θεωρίας της χημικής δομής;
Απάντηση. Η χημική δομή αντανακλά την εξάρτηση των ιδιοτήτων των ουσιών από τη σειρά σύνδεσης των ατόμων και την αλληλεπίδρασή τους.
Προσδιορίστε τι κοινό έχουν οι ουσίες:
Απάντηση. Χημική ένωση.
Συγκρίνετε τις φυσικές ιδιότητες αυτών των ουσιών. Που θεωρείτε ότι οφείλεται αυτή η διαφορά;
Με βάση την κατανομή της πυκνότητας ηλεκτρονίων ενός χημικού δεσμού, ποιο μόριο είναι πιο πολικό; Με τι συνδέεται αυτό;
Απάντηση. – ΟΗ δεσμός υδρογόνου.
Πείραμα επίδειξης

συμπέρασμα. Η αντιδραστικότητα μιας αλκοόλης καθορίζεται από την αμοιβαία επίδραση των ατόμων στο μόριο.
Παράγοντας ηλεκτρονική δομή
Ποια είναι η ουσία αμοιβαία επιρροήάτομα;
Απάντηση. Η αμοιβαία επιρροή συνίσταται στην αλληλεπίδραση ηλεκτρονικές δομέςάτομα, γεγονός που οδηγεί σε μετατόπιση της πυκνότητας ηλεκτρονίων των χημικών δεσμών.
Εργαστηριακές εργασίες
Δάσκαλος. Στα τραπέζια σας υπάρχουν σετ για εργαστηριακές εργασίες. Ολοκληρώστε την εργασία και αποδείξτε πειραματικά την εξάρτηση των ιδιοτήτων των ουσιών από την ηλεκτρονική δομή. Δουλέψτε σε ζευγάρια. Τηρείτε αυστηρά τους κανονισμούς ασφαλείας.
Επιλογή Ι. Διεξαγωγή έρευνας σχετικά με τις χημικές ιδιότητες της αιθανόλης και της φαινόλης. Να αποδείξουν την εξάρτησή τους αντιδραστικότητααπό ηλεκτρονική δομή. Χρησιμοποιήστε αντιδραστήρια - μέταλλο λιθίου και βρωμιούχο νερό. Καταγράψτε τις εξισώσεις για πιθανές αντιδράσεις. Δείξτε τη μετατόπιση της πυκνότητας ηλεκτρονίων ενός χημικού δεσμού στα μόρια.
Επιλογή II. Εξηγήστε την ουσία της αμοιβαίας επίδρασης της καρβοξυλικής ομάδας –COOH και του υποκαταστάτη στον άνθρακα καρβονυλίου στα μόρια καρβοξυλικά οξέα. Εξετάστε το παράδειγμα μυρμηκικού και οξικού οξέος. Χρησιμοποιήστε διάλυμα λιθίου και λιθίου. Καταγράψτε τις εξισώσεις αντίδρασης. Δείξτε τη μετατόπιση της πυκνότητας ηλεκτρονίων ενός χημικού δεσμού στα μόρια.
συμπέρασμα. Χημικές ιδιότητεςεξαρτώνται από την αμοιβαία επίδραση των ατόμων.


Τελικός έλεγχος γνώσης
Δάσκαλος. Ας συνοψίσουμε το μάθημά μας. Έχουμε επιβεβαιώσει ότι οι ιδιότητες των ουσιών εξαρτώνται από τη χωρική χημική και ηλεκτρονική δομή.
1. Γράψτε τους τύπους HCOOH, C 6 H 5 OH και C 4 H 9 COOH κατά σειρά αύξησης των όξινων ιδιοτήτων των ουσιών.
2. Τακτοποιήστε τους τύπους CH 3 COOH, C 3 H 7 COOH, CH 3 OH, ClCH 2 COOH σε φθίνουσα σειρά όξινες ιδιότητεςουσίες.
3. Ποια αλδεΰδη έχει:

πιο ενεργή ομάδα αλδεΰδης; Γιατί;
Αξιολογήστε την εργασία σας στην τάξη.
L.A.EREMINA,
καθηγήτρια χημείας στο σχολείο αρ.24
(Abakan, Khakassia)
Δοκιμή Α6 Ουσίες μοριακής και μη μοριακής δομής. Τύπος κρυσταλλικού πλέγματος. Εξάρτηση των ιδιοτήτων των ουσιών από τη σύνθεση και τη δομή τους. 1. Το κρυσταλλικό πλέγμα του χλωριούχου ασβεστίου είναι 1) ιοντικό 2) μοριακό 3) μεταλλικό 4) ατομικό 2. Η μοριακή δομή είναι 1) υδράργυρος 2) βρώμιο 3) υδροξείδιο του νατρίου 4) θειικό κάλιο 3. Το άτομο είναι δομικό σωματίδιο σε το κρυσταλλικό πλέγμα 1) μεθανίου 2) υδρογόνου 3) οξυγόνου 4) πυριτίου 4. Οι ουσίες που είναι σκληρές, πυρίμαχες και καλής διαλυτότητας στο νερό, κατά κανόνα, έχουν κρυσταλλικό πλέγμα: 1) μοριακό 2) ατομικό 3) ιονικό 4 ) μεταλλικό 5. Ένα μοριακό κρυσταλλικό πλέγμα έχει 1) HBr 2) K2O 3) BaO 4) KCl 6. Ουσίες με ατομικό κρυσταλλικό πλέγμα 1) πολύ σκληρό και πυρίμαχο 2) εύθραυστο και εύτηκτο 3) αγωγιμότητα ηλεκτρική ενέργειασε διαλύματα 4) αγώγουν ηλεκτρικό ρεύμα σε τήγματα. 7. Το μοριακό κρυσταλλικό πλέγμα έχει 1) Ca3P2 2) CO2 3) SO2 4) AlF3 8. Κάθε μία από τις ουσίες που βρίσκονται στη σειρά 1) νάτριο, χλωριούχο νάτριο, υδρίδιο του νατρίου 2) ασβέστιο, οξείδιο ασβεστίου, ανθρακικό ασβέστιο 3 έχει ιοντικό κρυσταλλικό πλέγμα ) βρωμιούχο νάτριο, θειικό κάλιο, χλωριούχος σίδηρος (II) 4) φωσφορικό μαγνήσιο, χλωριούχο κάλιο, οξείδιο του φωσφόρου (V) 9. Κρυσταλλικό πλέγμα γραφίτη 1) ιοντικό 2) υπομοριακό μέταλλο 10.3) σκληρότητα και ανθεκτικότητα , καλή διαλυτότητα στο νερό, κατά κανόνα, έχουν κρυσταλλικό πλέγμα 1) μοριακό 2) ιοντικό 3) ατομικό 4) μέταλλο 11. Το μοριακό πλέγμα κρυστάλλων έχει 1) πυρίτιο 2) μονοξείδιο του άνθρακα (IV) 3) διοξείδιο του πυριτίου 4) νιτρικό αμμώνιο 12. Το κρυσταλλικό πλέγμα των αλογόνων είναι 1) ατομικό 2) ιοντικό 3) μοριακό 4) μεταλλικό 13. Οι ουσίες με ατομικό κρυσταλλικό πλέγμα περιλαμβάνουν 1) νάτριο, φθόριο, οξείδιο του θείου (IV) 2) μόλυβδο, Νιτρικό οξύ, οξείδιο μαγνησίου 3) βόριο, διαμάντι, καρβίδιο του πυριτίου 4) χλωριούχο κάλιο, λευκός φώσφορος, ιώδιο 14. Η μοριακή δομή είναι 1) ψευδάργυρος 2) νιτρικό βάριο 3) υδροξείδιο του καλίου 4) υδροβρώμιο 15. Οι ουσίες είναι στερεές, ανθεκτικές, υψηλό σημείο τήξης, τα τήγματα του οποίου μεταφέρουν ηλεκτρικό ρεύμα, έχουν κρυσταλλικό πλέγμα 1) μεταλλικό 2) μοριακό 3) ατομικό 4) ιοντικό 16. Τα ιόντα είναι δομικά σωματίδια 1) οξυγόνου 2) νερού 3) μονοξειδίου του άνθρακα (IV) 4 ) χλωριούχο νάτριο 17. Έχουν μη μοριακή δομή όλα τα αμέταλλα της ομάδας 1) άνθρακας, βόριο, πυρίτιο 3) οξυγόνο, θείο, άζωτο 2) φθόριο, βρώμιο, ιώδιο 4) χλώριο, φώσφορος, σελήνιο 18. Κρυσταλλική δομή , παρόμοια με τη δομή του διαμαντιού, έχει 1) πυρίτιο 2) οξείδιο νατρίου 3) μονοξείδιο του άνθρακα (II) 4) λευκό φώσφορο P4 19. Ένα άτομο είναι ένα δομικό σωματίδιο στο κρυσταλλικό πλέγμα 1) μεθανίου 2) υδρογόνου 3) οξυγόνου 4) πυρίτιο 20. Το μοριακό κρυσταλλικό καθεμία από δύο ουσίες έχει ένα πλέγμα 1) γραφίτη και διαμάντι 2) πυρίτιο και ιώδιο 3) χλώριο και μονοξείδιο του άνθρακα (IV) 4) χλωριούχο βάριο και οξείδιο βαρίου 21. Κάθε μία από τις δύο ουσίες έχει έναν ατομικό κρύσταλλο πλέγμα 1) οξείδιο του πυριτίου (IV) και μονοξείδιο του άνθρακα (IV) 2) γραφίτης και πυρίτιο 3) χλωριούχο κάλιο και φθοριούχο νάτριο 4) χλώριο και ιώδιο 22. Η μοριακή δομή είναι 1) νάτριο 2) φρουκτόζη 3) νάτριο 4) φωσφορικό νάτριο οξείδιο 23. Το μοριακό κρυσταλλικό πλέγμα είναι χαρακτηριστικό καθεμιάς από τις ουσίες που βρίσκονται στη σειρά 1) χλωριούχο κάλιο, άζωτο, μεθάνιο 2) ιώδιο, διοξείδιο του άνθρακα, όζον 3) αλουμίνιο, βρώμιο, διαμάντι 4) υδρογόνο, θειικό μαγνήσιο II, σίδηρος ) οξείδιο 24. Το οξείδιο του πυριτίου είναι πυρίμαχο, αδιάλυτο στο νερό. Το κρυσταλλικό του πλέγμα είναι 1) ατομικό 2) μοριακό 3) ιοντικό 4) μεταλλικό 25. Ανάλογα με τη φύση των σωματιδίων που σχηματίζουν τον κρύσταλλο και τη φύση των δυνάμεων αλληλεπίδρασης μεταξύ τους, διακρίνονται τέσσερις τύποι κρυσταλλικών δικτυωμάτων: 1) ιοντικά, ατομικό, μοριακό και μεταλλικό 2) ιονικό, ομοιοπολικό, ατομικό και μοριακό 3) μεταλλικό, ομοιοπολικό, ατομικό και μοριακό 4) ιονικό, κυβικό, τριγωνικό και στρωματικό 26. Κρυσταλλικό πλέγμα πάγου: 1) ατομικό 2) μοριακό 3) ιονικό 4) μεταλλικό 27. Να αναφέρετε η ουσία που βρίσκεται σε στερεή κατάσταση έχει μοριακό κρυσταλλικό πλέγμα. 1) γραφίτης 2) νάτριο 3) υδροξείδιο του νατρίου 4) υδρογόνο 28. Αναφέρετε μια ουσία που σε στερεή κατάσταση έχει ατομικό κρυσταλλικό πλέγμα: 1) υδροχλώριο 2) χλώριο 3) οξείδιο του πυριτίου (IV) 4) οξείδιο του ασβεστίου 29. Για στερεά με μεταλλικό κρυσταλλικό πλέγμα χαρακτηρίζεται από υψηλή... 1) διαλυτότητα στο νερό 2) ηλεκτραρνητικότητα ατόμων 3) πτητότητα 4) ηλεκτρική αγωγιμότητα 30. Μια κρυσταλλική ουσία σχηματίζεται από σωματίδια Na+ και OH-. Σε ποιο τύπο κρυσταλλικού πλέγματος ανήκει αυτή η ουσία; 1) ατομική 2) μοριακή 3) ιοντική 4) μεταλλική 31. Κάθε μία από τις δύο ουσίες έχει μη μοριακή δομή: 1) S8 και O2 2) Fe και NaCl 3) CO και Mg 4) Na2CO3 και I2 32. Μια ουσία με μια μοριακή δομή είναι 1) όζον 2) οξείδιο του βαρίου 3) γραφίτης 4) θειούχο κάλιο 33. Το ατομικό κρυσταλλικό πλέγμα μιας απλής ουσίας: 1) διαμάντι 2) χαλκός 3) φθόριο 4) κασσίτερος 34. Η δήλωση ότι το δομικό σωματίδιο του μια δεδομένη ουσία είναι ένα μόριο ισχύει μόνο για 1) διαμάντι 2) επιτραπέζιο αλάτι 3) πυρίτιο 4) άζωτο 35. Το ιοντικό κρυσταλλικό πλέγμα έχει 1) νερό 2) φθοριούχο νάτριο 3) άργυρο 4) βρώμιο 36. Απλές ουσίες, που έχουν τον ίδιο τύπο κρυσταλλικού πλέγματος, σχηματίζονται από στοιχεία 1) μικρών περιόδων 3) δευτερευουσών υποομάδων 2) κύριων υποομάδων 4) μεγάλων περιόδων 37. Η κρυσταλλική δομή, παρόμοια με τη δομή του διαμαντιού, έχει: 1) πυρίτιο SiO2 2 ) οξείδιο του νατρίου Na2O 3) μονοξείδιο του άνθρακα (II) CO 4) λευκός φώσφορος P4 38. Η φωσφίνη PH3 είναι αέριο. Το κρυσταλλικό του πλέγμα είναι 1) ατομικό 2) μοριακό 3) ιοντικό 4) μεταλλικό 39. Οι κρύσταλλοι αποτελούνται από μόρια. 1) ζάχαρη 2) αλάτι 3) διαμάντι 4) ασήμι 40. Οι κρύσταλλοι 1) ζάχαρης 2) υδροξειδίου του νατρίου 3) διαμαντιού 4) αργύρου αποτελούνται από αντίθετα φορτισμένα ιόντα 41. Ποια σωματίδια σχηματίζουν έναν κρύσταλλο νιτρικού νατρίου; 1) Άτομα Na, N και O 3) Ιόντα Na+, NO3+ 5+ 22) Ιόντα Na, N, O 4) Μόρια NaNO3 42. Αξιολογήστε την ορθότητα των κρίσεων σχετικά με τη σχέση μεταξύ της δομής και των ιδιοτήτων μιας ουσίας. Α. Μεταξύ των ουσιών μοριακής δομής υπάρχουν αέριες, υγρές και στερεές υπό κανονικές συνθήκες. Β. Οι ουσίες με ατομικό κρυσταλλικό πλέγμα είναι στερεές υπό κανονικές συνθήκες. 1) μόνο το Α είναι αληθές 2) μόνο το Β είναι αληθές 3) και οι δύο κρίσεις είναι σωστές 4) και οι δύο κρίσεις είναι λανθασμένες 43. Αξιολογήστε την ορθότητα των κρίσεων σχετικά με τη σχέση μεταξύ της δομής και των ιδιοτήτων μιας ουσίας: Α. Εάν υπάρχει ισχυρός χημικός δεσμός μεταξύ των σωματιδίων σε έναν κρύσταλλο, τότε η ουσία είναι πυρίμαχη. Β. Όλα στερεάέχουν μη μοριακή δομή 1) μόνο το Α είναι αληθές 2) μόνο το Β είναι αληθές 3) και οι δύο κρίσεις είναι σωστές 4) και οι δύο κρίσεις είναι λανθασμένες 44. Ποιες από τις παρακάτω προτάσεις είναι αληθείς: Α. Ουσίες με μοριακό πλέγμα έχουν χαμηλές θερμοκρασίεςτήξη και χαμηλή ηλεκτρική αγωγιμότητα. Β. Οι ουσίες με ατομικό πλέγμα είναι πλαστικές και έχουν υψηλή ηλεκτρική αγωγιμότητα. 1) μόνο το Α είναι αληθές 2) μόνο το Β είναι αληθές 3) και οι δύο κρίσεις είναι σωστές 4) και οι δύο κρίσεις είναι λανθασμένες 45. Καθιερώστε μια αντιστοιχία μεταξύ μιας ουσίας και του τύπου του κρυσταλλικού πλέγματος της. ΟΥΣΙΑ ΤΥΠΟΣ ΚΡΥΣΤΑΛΛΙΚΟΥ πλέγματος 1) επιτραπέζιο αλάτι Α) μοριακό 2) άργυρος Β) ιοντικό 3) διοξείδιο του άνθρακα Γ) ατομικό 4) γραφίτης Δ) μέταλλο 5) γλυκόζη 46. Καθορίστε μια αντιστοιχία μεταξύ του τύπου του κρυσταλλικού πλέγματος και των ιδιοτήτων των ουσιών . ΤΥΠΟΣ ΚΡΥΣΤΑΛΛΙΚΩΝ ΙΔΙΟΤΗΤΕΣ ΔΙΚΤΥΜΑΤΙΚΩΝ ΟΥΣΙΩΝ Α) ιοντικό 1) στερεό, πυρίμαχο, δεν διαλύεται στο νερό Β) μεταλλικό 2) εύθραυστο, εύτηκτο, δεν άγει ηλεκτρικό ρεύμα Γ) ατομικό 3) πλαστικό, έχει διαφορετικά σημεία τήξης, άγει ηλεκτρικό ρεύμα Δ) μοριακό 4 ) στερεό, πυρίμαχο, διαλύεται καλά στο νερό 47. Αναφέρετε μια σειρά που χαρακτηρίζεται από μείωση του μήκους του χημικού δεσμού 1) SiCl4, MgCl2, AlCl3, NaCl 2) NaCl, MgCl2, SiCl4, AlCl3 3) NaCl , SiCl4, MgCl2, AlCl3 4) NaCl, MgCl2, AlCl3, SiCl4 48. Αξιολογήστε την ορθότητα των κρίσεων σχετικά με τη σχέση μεταξύ της δομής και των ιδιοτήτων μιας ουσίας. Α. Εάν υπάρχει ισχυρός χημικός δεσμός μεταξύ των σωματιδίων στον κρύσταλλο, τότε η ουσία εξατμίζεται εύκολα. Β. Όλα τα αέρια έχουν μοριακή δομή. 1) μόνο το Α είναι αληθές 2) μόνο το Β είναι αληθές 3) και οι δύο κρίσεις είναι σωστές 4) και οι δύο κρίσεις είναι λανθασμένες
Διάλεξη 7Εξάρτηση των ιδιοτήτων των ουσιών από αυτές
κτίρια. Χημικός δεσμός. Βασικός
είδη χημικών δεσμών.
Θέματα που καλύπτονται:
1. Επίπεδα οργάνωσης της ύλης. Ιεραρχία δομής.
2. Ουσίες μοριακής και μη μοριακής δομής.
3.
4. Λόγοι εμφάνισης χημικών δεσμών.
5. Ομοιοπολικός δεσμός: μηχανισμοί σχηματισμού, μέθοδοι
ατομική τροχιακή επικάλυψη, πολικότητα, διπολική ροπή
μόρια.
6. Ιωνικός δεσμός.
7. Σύγκριση πολικών ομοιοπολικών και ιοντικών δεσμών.
8. Σύγκριση ιδιοτήτων ουσιών με ομοιοπολικές πολικές και
ιοντικούς δεσμούς.
9. Μεταλλική σύνδεση.
10. Διαμοριακές αλληλεπιδράσεις. Ουσία (πάνω από 70 εκατομμύρια)
Τι πρέπει να γνωρίζετε για κάθε ουσία;
Φόρμουλα (από τι αποτελείται)
Δομή (πώς λειτουργεί)
Φυσικές ιδιότητες
Χημικές ιδιότητες
Μέθοδοι απόκτησης
(εργαστήριο και βιομηχανικό)
6. Πρακτική χρήση
1.
2.
3.
4.
5.Ιεραρχία της δομής της ύλης
Όλες οι ουσίες
αποτελείται από
άτομα, αλλά όχι
όλα είναι από
μόρια.
Ατομο
Μόριο
Για όλες τις ουσίες
Μόνο για ουσίες
μοριακός
κτίρια
Νανο επίπεδο
Για όλες τις ουσίες
Ογκομετρική (μακροεντολή)
επίπεδο
Για όλες τις ουσίες
Και τα 4 επίπεδα αποτελούν αντικείμενο μελέτης χημείας Μοριακές ουσίες
και μη μοριακή δομή Ουσίες
Μοριακός
κτίρια
Μη μοριακό
κτίρια
Αποτελείται από μόρια
Αποτελείται από άτομα
ή ιόντα
H2O, CO2, HNO3, C60,
σχεδόν όλα οργαν. ουσίες
Διαμάντι, γραφίτης, SiO2,
μέταλλα, άλατα
Ο τύπος αντανακλά
μοριακή σύνθεση
Η φόρμουλα αντικατοπτρίζει τη σύνθεση
μονάδα τύπου Ουσίες
Χλωριούχο νάτριο
Μονάδα τύπου NaCl Ουσίες
Πυρίτιο
Μονάδα τύπου SiO2
Το Ορυκτολογικό Μουσείο Fersman βρίσκεται κοντά στην είσοδο του κήπου Neskuchny.
Διεύθυνση: Μόσχα, Leninsky Prospekt, κτίριο 18, κτίριο 2. Ποικιλία χημικές δομές.
προωθητικό
C5H6
Κορόνεν
(υπερβενζόλιο)
C24H12
cavitand
C36H32O8 Ποικιλία χημικών δομών.
κατενάνη Ποικιλία χημικών δομών.
κατενάνη Ποικιλία χημικών δομών.
Λωρίδα Mobius Μόριο
Ένα μόριο είναι ένα σταθερό σύστημα που αποτελείται από πολλά
ατομικούς πυρήνεςκαι ηλεκτρόνια.
Τα άτομα συνδυάζονται σε μόρια σχηματίζοντας
χημικοί δεσμοί.
Σπίτι κινητήρια δύναμησχηματισμός μορίου από
άτομα – μείωση της συνολικής ενέργειας.
Τα μόρια έχουν γεωμετρικό σχήμα, χαρακτηρίζεται
αποστάσεις μεταξύ πυρήνων και γωνίες μεταξύ δεσμών. Κύρια κινητήρια δύναμη
σχηματισμός χημικού δεσμού
ανάμεσα σε σωματίδια ύλης -
μείωση της συνολικής ενέργειας
συστήματα. Κύριοι τύποι χημικών
συνδέσεις:
1.Ιωνικό
2.Ομοιοπολική
3.Μέταλλο
Βασική διαμοριακή
αλληλεπιδράσεις:
1.Δεσμοί υδρογόνου
2. Συνδέσεις Van der Waals Ιοντικός δεσμός
Αν ένας δεσμός σχηματίζεται από άτομα με έντονα διαφορετικά
τιμές ηλεκτραρνητικότητας (ΔOOE ≥ 1,7),
κοινό ζεύγος ηλεκτρονίων σχεδόν πλήρως
μετατοπίζεται προς πιο ηλεκτραρνητικά
άτομο.
Na Cl
ΟΕΟ 0,9 3,16
∆ 2,26
+Να
Ανιόν
:Clcation
Χημικός δεσμός μεταξύ ιόντων που εμφανίζεται
λόγω της ηλεκτροστατικής τους έλξης,
ονομάζεται ιοντικό. Ιοντικός δεσμός
Το δυναμικό Coulomb είναι σφαιρικό
συμμετρικά, κατευθυνόμενα προς όλες τις κατευθύνσεις,
επομένως ο ιονικός δεσμός είναι μη κατευθυντικός.
Coulomb δυναμικό δεν έχει
περιορισμούς στην ποσότητα
προστέθηκαν αντίθετα ιόντα -
εξ ου και ο ιονικός δεσμός
ακόρεστος. Ιοντικός δεσμός
Ενώσεις με τύπο ιοντικού δεσμού
στερεό, πολύ διαλυτό σε
πολικοί διαλύτες, έχουν υψηλή
σημεία τήξης και βρασμού. Ιοντικός δεσμός
Καμπύλη I: έλξη ιόντων αν
θα εκπροσωπούσαν
χρεώσεις πόντων.
Καμπύλη II: απώθηση πυρήνων σε
σε περίπτωση στενής γειτνίασης ιόντων.
Καμπύλη III: ελάχιστη ενέργεια E0 στο
αντιστοιχεί στην καμπύλη
κατάσταση ισορροπίας ιοντικών
ζευγάρια, στα οποία οι δυνάμεις
έλξη ηλεκτρονίων προς πυρήνες
αποζημιώνονται από δυνάμεις
απώθηση πυρήνων μεταξύ τους
απόσταση r0, Χημικός δεσμός σε μόρια
Οι χημικοί δεσμοί σε μόρια μπορούν να περιγραφούν με
θέσεις δύο μεθόδων:
- μέθοδος δεσμών σθένους, MBC
- μέθοδος μοριακής τροχιάς, MMO Μέθοδος δεσμού σθένους
Θεωρία Heitler-London
Βασικές διατάξεις της μεθόδου BC:
1. Ένας δεσμός σχηματίζεται από δύο ηλεκτρόνια με αντίθετα
περιστρέφεται και τα κυματικά κύματα επικαλύπτονται
συναρτήσεις και την πυκνότητα ηλεκτρονίων μεταξύ
πυρήνες.
2. Η σύνδεση είναι εντοπισμένη στην κατεύθυνση της μέγιστης
επικαλυπτόμενες Ψ-συναρτήσεις ηλεκτρονίων. Όσο πιο δυνατός
επικαλύπτονται, τόσο ισχυρότερος είναι ο δεσμός.
dsv - μήκος
διαβιβάσεις;
ESV - ενέργεια
διαβιβάσεις. Σχηματισμός μορίου υδρογόνου:
N· + ·N → N:N
Όταν δύο άτομα ενωθούν
προκύπτουν ελκτικές δυνάμεις και
αποστροφή:
1) έλξη: «ηλεκτρόνιο-πυρήνας»
γειτονικά άτομα.
2) απώθηση: «πυρήνας»,
«ηλεκτρόνιο-ηλεκτρόνιο» γειτονικό
άτομα. Σχηματισμός μορίου υδρογόνου:
Μοριακός
σύννεφο δύο ηλεκτρονίων,
έχοντας μέγιστο
πυκνότητα ηλεκτρονίων. Χημικός δεσμός που πραγματοποιείται από κοινού
Τα ζεύγη ηλεκτρονίων ονομάζονται ομοιοπολικά.
Ένα κοινό ζεύγος ηλεκτρονίων μπορεί να σχηματιστεί από δύο
τρόποι:
1) ως αποτέλεσμα της ένωσης δύο μη ζευγαρωμένων ηλεκτρονίων:
2) ως αποτέλεσμα της κοινωνικοποίησης του αδιαίρετου
ζεύγος ηλεκτρονίων ενός ατόμου (δότης) και κενό
τροχιακά άλλου (αποδέκτη).
Δύο μηχανισμοί για το σχηματισμό ομοιοπολικών δεσμών:
ανταλλαγή και δωρητής-αποδέκτης.
Η πυκνότητα επικοινωνίας εμφανίζεται κατά μήκος της γραμμής,
συνδέοντας τα κέντρα των ατόμων (πυρήνες), τότε αυτό
η επικάλυψη ονομάζεται σ-σύζευξη: Μέθοδοι επικάλυψης ατομικών τροχιακών με
σχηματισμός ομοιοπολικού δεσμού
Αν ο σχηματισμός μέγιστης ηλεκτρονικής
Η πυκνότητα του δεσμού εμφανίζεται και στις δύο πλευρές
γραμμή που συνδέει τα κέντρα των ατόμων (πυρήνες), τότε
μια τέτοια επικάλυψη ονομάζεται π-δεσμός: Πολικός και μη πολικός ομοιοπολικός δεσμός
1) Εάν ο δεσμός σχηματίζεται από πανομοιότυπα άτομα,
σύννεφο επικοινωνίας δύο ηλεκτρονίων κατανεμημένο σε
χώρο συμμετρικά μεταξύ των πυρήνων τους – τέτοιοι
ο δεσμός ονομάζεται μη πολικός: H2, Cl2, N2.
2) αν σχηματιστεί ο δεσμός διαφορετικά άτομα, σύννεφο επικοινωνίας
μετατοπίστηκε προς το πιο ηλεκτραρνητικό άτομο
- ένας τέτοιος δεσμός ονομάζεται πολικός: HCl, NH3, CO2. Πολικός ομοιοπολικός δεσμός
Διπολική στιγμή σύζευξης
δίπολο
Η+δCl-δ ή Η+0,18Cl-0,18
Όπου το ±δ είναι αποτελεσματικό
ατομικό φορτίο, κλάσμα
απόλυτη χρέωση
ηλεκτρόνιο.
+δ
-δ
Δεν πρέπει να συγχέεται με την κατάσταση οξείδωσης!
μεγάλο
Προϊόν ενεργού φορτίου και μήκους διπόλου
ονομάζεται ηλεκτρική ροπή του διπόλου: μ = δl
Αυτό είναι ένα διανυσματικό μέγεθος: κατευθυνόμενο από το θετικό
φορτίο σε αρνητικό. Πολικός ομοιοπολικός δεσμός
Διπολική ροπή ενός μορίου
Η διπολική ροπή ενός μορίου είναι ίση με το άθροισμα
διανύσματα διπολικών ροπών δεσμών, λαμβάνοντας υπόψη
μόνα ζεύγη ηλεκτρονίων.
Μονάδα διπολικής ροπής
είναι Debye: 1D = 3,3·10-30 C·m. Πολικός ομοιοπολικός δεσμός
Διπολική ροπή ενός μορίου
Στο γινόμενο μ = δl και οι δύο ποσότητες κατευθύνονται αντίθετα.
Επομένως, πρέπει να παρακολουθούμε προσεκτικά την αιτία
αλλαγές μ.
Για παράδειγμα,
CsF
CsCl
24
31
δ “χαμένος” l
CsI
HF
HCl
HBr
ΓΕΙΑ
37
5,73
3,24
2,97
1,14
αντίστροφα Πολικός ομοιοπολικός δεσμός
Διπολική ροπή ενός μορίου
Μπορεί ένα μόριο να είναι μη πολικό αν
Είναι όλες οι συνδέσεις σε αυτό πολικές;
Τα μόρια τύπου ΑΒ είναι πάντα πολικά.
Τα μόρια τύπου AB2 μπορεί να είναι τόσο πολικά όσο και
μη πολικό...
H2O
ΣΧΕΤΙΚΑ ΜΕ
Ν
CO2
μ>0
Ν
ΣΧΕΤΙΚΑ ΜΕ
ΜΕ
μ=0
ΣΧΕΤΙΚΑ ΜΕ Πολικός ομοιοπολικός δεσμός
Μόρια που αποτελούνται από τρία ή περισσότερα άτομα
(AB2, AB3, AB4, AB5, AB6) ,
μπορεί να είναι μη πολικές εάν είναι συμμετρικές.
Τι επηρεάζει η παρουσία διπολικής ροπής;
μόρια;
Υπάρχουν διαμοριακές αλληλεπιδράσεις, και
Κατά συνέπεια, η πυκνότητα της ουσίας αυξάνεται,
θερμοκρασία τήξης και θερμοκρασία βρασμού. Σύγκριση ιοντικών και ομοιοπολικών πολικών δεσμών
Γενικά: γενική εκπαίδευση
ζεύγος ηλεκτρονίων.
Διαφορά: πτυχίο
γενική μετατόπιση
ζεύγος ηλεκτρονίων
(πόλωση ομολόγων).
Ο ιοντικός δεσμός πρέπει να θεωρείται ως ακραίος
η περίπτωση ενός πολικού ομοιοπολικού δεσμού.
πολικούς δεσμούς
Ομοιοπολικός δεσμός: κορεσμένος και κατευθυνόμενος
Κορεσμός (μέγιστο σθένος) -
καθορίζεται από την ικανότητα ενός ατόμου να σχηματίζει
περιορισμένος αριθμός συνδέσεων (λαμβάνοντας υπόψη και τα δύο
μηχανισμοί σχηματισμού).
Η κατεύθυνση του δεσμού καθορίζεται από τη γωνία δεσμού, η οποία εξαρτάται από
τύπος υβριδισμού των τροχιακών του κεντρικού ατόμου.
Ιωνικός δεσμός: ακόρεστος και μη κατευθυντικός. Σύγκριση χαρακτηριστικών ιοντικών και ομοιοπολικών
πολικούς δεσμούς
Η κατεύθυνση του δεσμού καθορίζεται από τις γωνίες δεσμού.
Οι γωνίες δεσμών προσδιορίζονται πειραματικά ή
προβλέπονται με βάση τη θεωρία υβριδισμού
ατομικά τροχιακά του L. Paulling ή θεωρία
Gillespie.
Περισσότερες λεπτομέρειες για αυτό στα σεμινάρια.
ομοιοπολικούς δεσμούς
Ομοιοπολικούς δεσμούς
Ατομικοί κρύσταλλοι
Μεταξύ ατόμων
στον ίδιο τον κρύσταλλο
Υψηλή σκληρότητα
υψηλό tº λιώσει, tº βρασμό
κακή ζέστη και
ηλεκτρική αγωγιμότητα
Μοριακοί κρύσταλλοι
Μεταξύ ατόμων
σε ένα μόριο
Μέτρια απαλότητα
αρκετά χαμηλά
tº λιώσει, tº βράσει
κακή ζέστη και
Ηλεκτρική αγωγιμότητα
Αδιάλυτο στο νερό Σύγκριση ιδιοτήτων ουσιών με ιοντικά και
ομοιοπολικούς δεσμούς
μοριακός κρύσταλλος
Σημείο τήξεως 112,85 °C Σύγκριση ιδιοτήτων ουσιών με ιοντικά και
ομοιοπολικούς δεσμούς
Ατομικός ομοιοπολικός κρύσταλλος
Σημείο τήξεως ≈ 3700 °C Σύγκριση ιδιοτήτων ουσιών με ιοντικά και
ομοιοπολικούς δεσμούς
Ιωνικοί δεσμοί
μεταξύ ιόντων
σε κρύσταλλο
σκληρότητα και ευθραυστότητα
υψηλό σημείο τήξης
κακή θερμική και ηλεκτρική αγωγιμότητα
Διαλυτό στο νερό Σύγκριση ιδιοτήτων ουσιών με ιοντικά και
ομοιοπολικούς δεσμούς
Ιωνικός κρύσταλλος
Σημείο τήξεως ≈ 800 °C Μεταλλική σύνδεση
Ο μεταλλικός δεσμός πραγματοποιείται από ηλεκτρόνια,
που ανήκει σε όλα τα άτομα ταυτόχρονα.
Πυκνότητα ηλεκτρονίων
Το «αέριο ηλεκτρονίων» μετατοπίζεται.
Χαρακτηριστικό γνώρισμα
μεταλλική λάμψη
Πλαστική ύλη
Εύπλαστο
Υψηλή ζέστη και
ηλεκτρική αγωγιμότητα
Σημεία τήξης
πραγματικά διαφορετικό. Διαμοριακούς δεσμούς.
1. Δεσμός υδρογόνου
Έλξη μεταξύ του ατόμου υδρογόνου (+) του ενός
μόριο και το άτομο F, O, N (–) άλλου μορίου
φά
φά
H
H
H
H
φά
φά
Ο
H3C
H
φά
ντο
H
Πολυμερές
(HF)n
Ο
ντο
Ο
H
CH3
Dimer
οξικό οξύ
Ο
Οι δεσμοί υδρογόνου είναι αδύναμοι μεμονωμένα,
αλλά ισχυρά συλλογικά Διαμοριακούς δεσμούς.
2. Δεσμός υδρογόνου στο DNA Διαμοριακούς δεσμούς.
3. Δεσμοί υδρογόνου στο νερό
υγρό νερό
πάγος Διαμοριακούς δεσμούς.
4. Σχηματισμός δεσμών υδρογόνου σε
νερό
υγρό νερό
μεταμόρφωση
νερό σε πάγο Διαμοριακούς δεσμούς.
5. Συνδέσεις Van der Waals
Ακόμα κι αν δεν υπάρχουν δεσμοί υδρογόνου μεταξύ των μορίων,
τα μόρια πάντα έλκονται μεταξύ τους.
Η έλξη μεταξύ των μοριακών διπόλων ονομάζεται σύζευξη van der Waals.
Γ-δ-γ έλξηόσο πιο δυνατό τόσο περισσότερο:
1) πολικότητα? 2) μοριακό μέγεθος.
Παράδειγμα: μεθάνιο (CH4) – αέριο, βενζόλιο (C6H6) – υγρό
Ένα από τα πιο αδύναμα συνδέσεις v-d-v– μεταξύ μορίων
H2 (σ.τ. –259 oC, bp. –253 oC).
Η αλληλεπίδραση μεταξύ των μορίων είναι πολλές φορές πιο αδύναμη από τον δεσμό μεταξύ των ατόμων:
Ekow(Cl–Cl) = 244 kJ/mol, Evdv(Cl2–Cl2) = 25 kJ/mol
αλλά είναι ακριβώς αυτό που εξασφαλίζει την ύπαρξη της υγρής και στερεάς κατάστασης της ύλης Στη διάλεξη χρησιμοποιήθηκε υλικό από τον καθηγητή
Σχολή Χημείας, Κρατικό Πανεπιστήμιο της Μόσχας. Λομονόσοφ
Ερεμίν Βαντίμ Βλαντιμίροβιτς
Ευχαριστώ
για την προσοχή σας!
Το σύγχρονο δόγμα των οργανικών ιδιοτήτων είναι μια ανάπτυξη της ιδέας του A.M. Butlerov σχετικά με την εξάρτηση από τη δομή του. Η έκφραση της δομής δίνει μια ιδέα για ολόκληρη την ποικιλομορφία, αν και οι προβλέψεις δεν είναι συνέπεια αυστηρών μαθηματικών νόμων, αλλά είναι μόνο ποιοτικό χαρακτήρακαι αφήστε πολλά περισσότερα στο ταλέντο και τη διαίσθηση του πειραματιστή χημικού.
Τα χαρακτηριστικά των φυσικών ιδιοτήτων των ενώσεων εκφράζονται συχνά ως το άθροισμα πολλών όρων που σχετίζονται με τα αντίστοιχα στοιχεία που περιλαμβάνονται στη σύνθεση αυτής της σύνδεσης. Η χρήση τέτοιων κυκλώματα προσθέτωνΗ εύρεση οποιουδήποτε φυσικοχημικού χαρακτηριστικού μιας ένωσης από τον τύπο της δομής της ισοδυναμεί, επομένως, με την υπόθεση ότι το στοιχείο, όταν περιλαμβάνεται σε διάφορες ενώσεις, συνεισφέρει πάντα στο ίδιο μερίδιο αυτού του χαρακτηριστικού.
Στις απλούστερες περιπτώσεις, αυτή η υπόθεση αποδεικνύεται ότι είναι πολύ κοντά στην αλήθεια (για παράδειγμα, οι τιμές των μοριακών όγκων και
Διάλεξη 7 Εξάρτηση των ιδιοτήτων των ουσιών από τη δομή τους. Χημικός δεσμός. Κύριοι τύποι χημικών δεσμών. Θέματα που εξετάζονται: 1. Επίπεδα οργάνωσης της ύλης. Ιεραρχία δομής. 2. Ουσίες μοριακής και μη μοριακής δομής. 3. Ποικιλία χημικών δομών. 4. Λόγοι εμφάνισης χημικών δεσμών. 5. Ομοιοπολικός δεσμός: μηχανισμοί σχηματισμού, μέθοδοι επικάλυψης ατομικών τροχιακών, πολικότητα, διπολική ροπή του μορίου. 6. Ιωνικός δεσμός. 7. Σύγκριση πολικών ομοιοπολικών και ιοντικών δεσμών. 8. Σύγκριση ιδιοτήτων ουσιών με ομοιοπολικούς πολικούς και ιοντικούς δεσμούς. 9. Μεταλλική σύνδεση. 10. Διαμοριακές αλληλεπιδράσεις.
 Ουσία (πάνω από 70 εκατομμύρια) Τι πρέπει να γνωρίζετε για κάθε ουσία; 1. 2. 3. 4. 5. Τύπος (από τι αποτελείται) Δομή (πώς λειτουργεί) Φυσικές ιδιότητες Χημικές ιδιότητες Μέθοδοι παρασκευής (εργαστηριακή και βιομηχανική) 6. Πρακτική εφαρμογή
Ουσία (πάνω από 70 εκατομμύρια) Τι πρέπει να γνωρίζετε για κάθε ουσία; 1. 2. 3. 4. 5. Τύπος (από τι αποτελείται) Δομή (πώς λειτουργεί) Φυσικές ιδιότητες Χημικές ιδιότητες Μέθοδοι παρασκευής (εργαστηριακή και βιομηχανική) 6. Πρακτική εφαρμογή
 Ιεραρχία της δομής της ύλης Όλες οι ουσίες αποτελούνται από άτομα, αλλά δεν αποτελούν όλες από μόρια. Μόριο ατόμου Για όλες τις ουσίες Μόνο για ουσίες μοριακής δομής Νανο επίπεδο Για όλες τις ουσίες Ογκομετρικό (μακρο) επίπεδο Για όλες τις ουσίες Και τα 4 επίπεδα αποτελούν αντικείμενο μελέτης της χημείας
Ιεραρχία της δομής της ύλης Όλες οι ουσίες αποτελούνται από άτομα, αλλά δεν αποτελούν όλες από μόρια. Μόριο ατόμου Για όλες τις ουσίες Μόνο για ουσίες μοριακής δομής Νανο επίπεδο Για όλες τις ουσίες Ογκομετρικό (μακρο) επίπεδο Για όλες τις ουσίες Και τα 4 επίπεδα αποτελούν αντικείμενο μελέτης της χημείας

 Ουσίες Μοριακή δομήΜη μοριακή δομή Αποτελείται από μόρια Αποτελείται από άτομα ή ιόντα H 2 O, CO 2, HNO 3, C 60, σχεδόν όλα οργαν. ουσίες Διαμάντι, γραφίτης, Si. O 2, μέταλλα, άλατα Ο τύπος αντανακλά τη σύνθεση του μορίου Ο τύπος αντανακλά τη σύνθεση της μονάδας τύπου
Ουσίες Μοριακή δομήΜη μοριακή δομή Αποτελείται από μόρια Αποτελείται από άτομα ή ιόντα H 2 O, CO 2, HNO 3, C 60, σχεδόν όλα οργαν. ουσίες Διαμάντι, γραφίτης, Si. O 2, μέταλλα, άλατα Ο τύπος αντανακλά τη σύνθεση του μορίου Ο τύπος αντανακλά τη σύνθεση της μονάδας τύπου

 Ουσίες Διοξείδιο του πυριτίου Μονάδα τύπου Si. O 2 Το Ορυκτολογικό Μουσείο Fersman βρίσκεται κοντά στην είσοδο του κήπου Neskuchny. Διεύθυνση: Μόσχα, Leninsky Prospekt, κτίριο 18, κτίριο 2.
Ουσίες Διοξείδιο του πυριτίου Μονάδα τύπου Si. O 2 Το Ορυκτολογικό Μουσείο Fersman βρίσκεται κοντά στην είσοδο του κήπου Neskuchny. Διεύθυνση: Μόσχα, Leninsky Prospekt, κτίριο 18, κτίριο 2.
 Ποικιλία χημικών δομών. προπελάνιο C 5 H 6 κορονένιο (υπερβενζόλιο) C 24 H 12 cavitand C 36 H 32 O 8
Ποικιλία χημικών δομών. προπελάνιο C 5 H 6 κορονένιο (υπερβενζόλιο) C 24 H 12 cavitand C 36 H 32 O 8



 Ένα μόριο είναι ένα σταθερό σύστημα που αποτελείται από πολλούς ατομικούς πυρήνες και ηλεκτρόνια. Τα άτομα συνδυάζονται σε μόρια σχηματίζοντας χημικούς δεσμούς. Η κύρια κινητήρια δύναμη για το σχηματισμό ενός μορίου από άτομα είναι η μείωση της συνολικής ενέργειας. Τα μόρια έχουν γεωμετρικό σχήμα που χαρακτηρίζεται από τις αποστάσεις μεταξύ των πυρήνων και τις γωνίες μεταξύ των δεσμών.
Ένα μόριο είναι ένα σταθερό σύστημα που αποτελείται από πολλούς ατομικούς πυρήνες και ηλεκτρόνια. Τα άτομα συνδυάζονται σε μόρια σχηματίζοντας χημικούς δεσμούς. Η κύρια κινητήρια δύναμη για το σχηματισμό ενός μορίου από άτομα είναι η μείωση της συνολικής ενέργειας. Τα μόρια έχουν γεωμετρικό σχήμα που χαρακτηρίζεται από τις αποστάσεις μεταξύ των πυρήνων και τις γωνίες μεταξύ των δεσμών.

 Κύριοι τύποι χημικών δεσμών: 1. Ιωνικοί 2. Ομοιοπολικοί 3. Μεταλλικοί Βασικές διαμοριακές αλληλεπιδράσεις: 1. Δεσμοί υδρογόνου 2. Δεσμοί Van der Waals
Κύριοι τύποι χημικών δεσμών: 1. Ιωνικοί 2. Ομοιοπολικοί 3. Μεταλλικοί Βασικές διαμοριακές αλληλεπιδράσεις: 1. Δεσμοί υδρογόνου 2. Δεσμοί Van der Waals
 Ιωνικός δεσμός Εάν ένας δεσμός σχηματίζεται από άτομα με έντονα διαφορετικές τιμές ηλεκτραρνητικότητας (ΔOOE ≥ 1,7), το κοινό ζεύγος ηλεκτρονίων μετατοπίζεται σχεδόν πλήρως προς το πιο ηλεκτραρνητικό άτομο. Na Cl OEO 0,9 3,16 ∆ 2,26 +Na ανιόν: Cl. Κατιόν Ο χημικός δεσμός μεταξύ ιόντων που προκύπτει λόγω της ηλεκτροστατικής τους έλξης ονομάζεται ιονικός.
Ιωνικός δεσμός Εάν ένας δεσμός σχηματίζεται από άτομα με έντονα διαφορετικές τιμές ηλεκτραρνητικότητας (ΔOOE ≥ 1,7), το κοινό ζεύγος ηλεκτρονίων μετατοπίζεται σχεδόν πλήρως προς το πιο ηλεκτραρνητικό άτομο. Na Cl OEO 0,9 3,16 ∆ 2,26 +Na ανιόν: Cl. Κατιόν Ο χημικός δεσμός μεταξύ ιόντων που προκύπτει λόγω της ηλεκτροστατικής τους έλξης ονομάζεται ιονικός.
 Ιοντικός δεσμός Το δυναμικό Coulomb είναι σφαιρικά συμμετρικό, κατευθυνόμενο προς όλες τις κατευθύνσεις, επομένως ο ιοντικός δεσμός είναι μη κατευθυντικός. Το δυναμικό Coulomb δεν έχει περιορισμούς στον αριθμό των προστιθέμενων αντίθετων ιόντων - επομένως, ο ιοντικός δεσμός είναι ακόρεστος.
Ιοντικός δεσμός Το δυναμικό Coulomb είναι σφαιρικά συμμετρικό, κατευθυνόμενο προς όλες τις κατευθύνσεις, επομένως ο ιοντικός δεσμός είναι μη κατευθυντικός. Το δυναμικό Coulomb δεν έχει περιορισμούς στον αριθμό των προστιθέμενων αντίθετων ιόντων - επομένως, ο ιοντικός δεσμός είναι ακόρεστος.
 Ιωνικός δεσμός Οι ενώσεις με τον τύπο ιοντικού δεσμού είναι στερεές, πολύ διαλυτές σε πολικούς διαλύτες και έχουν υψηλά σημεία τήξης και βρασμού.
Ιωνικός δεσμός Οι ενώσεις με τον τύπο ιοντικού δεσμού είναι στερεές, πολύ διαλυτές σε πολικούς διαλύτες και έχουν υψηλά σημεία τήξης και βρασμού.
 Καμπύλη I ιοντικού δεσμού: έλξη ιόντων αν ήταν σημειακά φορτία. Καμπύλη II: απώθηση πυρήνων σε περίπτωση ισχυρής προσέγγισης ιόντων. Καμπύλη III: η ελάχιστη ενέργεια E 0 στην καμπύλη αντιστοιχεί στην κατάσταση ισορροπίας του ζεύγους ιόντων, στο οποίο οι δυνάμεις έλξης των ηλεκτρονίων στους πυρήνες αντισταθμίζονται από τις δυνάμεις απώθησης των πυρήνων μεταξύ τους σε απόσταση r 0,
Καμπύλη I ιοντικού δεσμού: έλξη ιόντων αν ήταν σημειακά φορτία. Καμπύλη II: απώθηση πυρήνων σε περίπτωση ισχυρής προσέγγισης ιόντων. Καμπύλη III: η ελάχιστη ενέργεια E 0 στην καμπύλη αντιστοιχεί στην κατάσταση ισορροπίας του ζεύγους ιόντων, στο οποίο οι δυνάμεις έλξης των ηλεκτρονίων στους πυρήνες αντισταθμίζονται από τις δυνάμεις απώθησης των πυρήνων μεταξύ τους σε απόσταση r 0,
 Χημικοί δεσμοί σε μόρια Οι χημικοί δεσμοί σε μόρια μπορούν να περιγραφούν από τη σκοπιά δύο μεθόδων: - η μέθοδος των δεσμών σθένους, MBC - η μέθοδος των μοριακών τροχιακών, MMO
Χημικοί δεσμοί σε μόρια Οι χημικοί δεσμοί σε μόρια μπορούν να περιγραφούν από τη σκοπιά δύο μεθόδων: - η μέθοδος των δεσμών σθένους, MBC - η μέθοδος των μοριακών τροχιακών, MMO
 Μέθοδος δεσμού σθένους Θεωρία Heitler-London Βασικές αρχές της μεθόδου BC: 1. Ένας δεσμός σχηματίζεται από δύο ηλεκτρόνια με αντίθετα σπιν, ενώ οι κυματικές συναρτήσεις επικαλύπτονται και η πυκνότητα ηλεκτρονίων μεταξύ των πυρήνων αυξάνεται. 2. Ο δεσμός εντοπίζεται στην κατεύθυνση της μέγιστης επικάλυψης των συναρτήσεων του ηλεκτρονίου Ψ. Όσο μεγαλύτερη είναι η επικάλυψη, τόσο ισχυρότερη είναι η σύνδεση.
Μέθοδος δεσμού σθένους Θεωρία Heitler-London Βασικές αρχές της μεθόδου BC: 1. Ένας δεσμός σχηματίζεται από δύο ηλεκτρόνια με αντίθετα σπιν, ενώ οι κυματικές συναρτήσεις επικαλύπτονται και η πυκνότητα ηλεκτρονίων μεταξύ των πυρήνων αυξάνεται. 2. Ο δεσμός εντοπίζεται στην κατεύθυνση της μέγιστης επικάλυψης των συναρτήσεων του ηλεκτρονίου Ψ. Όσο μεγαλύτερη είναι η επικάλυψη, τόσο ισχυρότερη είναι η σύνδεση.

 Σχηματισμός μορίου υδρογόνου: H· + ·H → H: H Όταν δύο άτομα ενώνονται, προκύπτουν δυνάμεις έλξης και απώθησης: 1) έλξη: «ηλεκτρόνιο-πυρήνας» γειτονικών ατόμων. 2) απώθηση: «πυρήνας-πυρήνας», «ηλεκτρόνιο-ηλεκτρόνιο» γειτονικών ατόμων.
Σχηματισμός μορίου υδρογόνου: H· + ·H → H: H Όταν δύο άτομα ενώνονται, προκύπτουν δυνάμεις έλξης και απώθησης: 1) έλξη: «ηλεκτρόνιο-πυρήνας» γειτονικών ατόμων. 2) απώθηση: «πυρήνας-πυρήνας», «ηλεκτρόνιο-ηλεκτρόνιο» γειτονικών ατόμων.

 Ένας χημικός δεσμός που πραγματοποιείται από κοινά ζεύγη ηλεκτρονίων ονομάζεται ομοιοπολικός. Ένα κοινό ζεύγος ηλεκτρονίων μπορεί να σχηματιστεί με δύο τρόπους: 1) ως αποτέλεσμα της ένωσης δύο μη ζευγαρωμένων ηλεκτρονίων: 2) ως αποτέλεσμα της κοινής χρήσης ενός μοναχικού ζεύγους ηλεκτρονίων ενός ατόμου (δότης) και ενός κενού τροχιακού ενός άλλου ( αποδέκτης). Δύο μηχανισμοί σχηματισμού ομοιοπολικού δεσμού: ανταλλαγή και δότης-δέκτης.
Ένας χημικός δεσμός που πραγματοποιείται από κοινά ζεύγη ηλεκτρονίων ονομάζεται ομοιοπολικός. Ένα κοινό ζεύγος ηλεκτρονίων μπορεί να σχηματιστεί με δύο τρόπους: 1) ως αποτέλεσμα της ένωσης δύο μη ζευγαρωμένων ηλεκτρονίων: 2) ως αποτέλεσμα της κοινής χρήσης ενός μοναχικού ζεύγους ηλεκτρονίων ενός ατόμου (δότης) και ενός κενού τροχιακού ενός άλλου ( αποδέκτης). Δύο μηχανισμοί σχηματισμού ομοιοπολικού δεσμού: ανταλλαγή και δότης-δέκτης.
 Μέθοδοι επικάλυψης ατομικών τροχιακών κατά το σχηματισμό ομοιοπολικού δεσμού Εάν ο σχηματισμός της μέγιστης πυκνότητας δεσμού ηλεκτρονίων συμβαίνει κατά μήκος της γραμμής που συνδέει τα κέντρα των ατόμων (πυρήνες), τότε μια τέτοια επικάλυψη ονομάζεται δεσμός σ:
Μέθοδοι επικάλυψης ατομικών τροχιακών κατά το σχηματισμό ομοιοπολικού δεσμού Εάν ο σχηματισμός της μέγιστης πυκνότητας δεσμού ηλεκτρονίων συμβαίνει κατά μήκος της γραμμής που συνδέει τα κέντρα των ατόμων (πυρήνες), τότε μια τέτοια επικάλυψη ονομάζεται δεσμός σ:
 Τρόποι επικάλυψης ατομικών τροχιακών κατά το σχηματισμό ομοιοπολικού δεσμού Εάν ο σχηματισμός της μέγιστης πυκνότητας δεσμού ηλεκτρονίων συμβαίνει και στις δύο πλευρές της γραμμής που συνδέει τα κέντρα των ατόμων (πυρήνες), τότε μια τέτοια επικάλυψη ονομάζεται δεσμός π:
Τρόποι επικάλυψης ατομικών τροχιακών κατά το σχηματισμό ομοιοπολικού δεσμού Εάν ο σχηματισμός της μέγιστης πυκνότητας δεσμού ηλεκτρονίων συμβαίνει και στις δύο πλευρές της γραμμής που συνδέει τα κέντρα των ατόμων (πυρήνες), τότε μια τέτοια επικάλυψη ονομάζεται δεσμός π:
 Πολικοί και μη πολικοί ομοιοπολικοί δεσμοί 1) Εάν ο δεσμός σχηματίζεται από πανομοιότυπα άτομα, το νέφος δεσμών δύο ηλεκτρονίων κατανέμεται στο χώρο συμμετρικά μεταξύ των πυρήνων τους - ένας τέτοιος δεσμός ονομάζεται μη πολικός: H 2, Cl 2, N 2. 2) εάν ο δεσμός σχηματίζεται από διαφορετικά άτομα, το σύννεφο δεσμών μετατοπίζεται προς την πλευρά του πιο ηλεκτραρνητικού ατόμου - ένας τέτοιος δεσμός ονομάζεται πολικός: HCl, NH 3, CO 2.
Πολικοί και μη πολικοί ομοιοπολικοί δεσμοί 1) Εάν ο δεσμός σχηματίζεται από πανομοιότυπα άτομα, το νέφος δεσμών δύο ηλεκτρονίων κατανέμεται στο χώρο συμμετρικά μεταξύ των πυρήνων τους - ένας τέτοιος δεσμός ονομάζεται μη πολικός: H 2, Cl 2, N 2. 2) εάν ο δεσμός σχηματίζεται από διαφορετικά άτομα, το σύννεφο δεσμών μετατοπίζεται προς την πλευρά του πιο ηλεκτραρνητικού ατόμου - ένας τέτοιος δεσμός ονομάζεται πολικός: HCl, NH 3, CO 2.
 Πολικός ομοιοπολικός δεσμός Διπολική ροπή δεσμού Δίπολο H+δCl-δ ή H+0, 18 Cl-0, 18 +δ -δ Όπου ±δ είναι το ενεργό φορτίο του ατόμου, το κλάσμα του απόλυτου φορτίου του ηλεκτρονίου. Δεν πρέπει να συγχέεται με την κατάσταση οξείδωσης! l Το γινόμενο του ενεργού φορτίου και του μήκους του διπόλου ονομάζεται ηλεκτρική ροπή του διπόλου: μ = δl Αυτό είναι ένα διανυσματικό μέγεθος: κατευθυνόμενο από το θετικό στο αρνητικό φορτίο.
Πολικός ομοιοπολικός δεσμός Διπολική ροπή δεσμού Δίπολο H+δCl-δ ή H+0, 18 Cl-0, 18 +δ -δ Όπου ±δ είναι το ενεργό φορτίο του ατόμου, το κλάσμα του απόλυτου φορτίου του ηλεκτρονίου. Δεν πρέπει να συγχέεται με την κατάσταση οξείδωσης! l Το γινόμενο του ενεργού φορτίου και του μήκους του διπόλου ονομάζεται ηλεκτρική ροπή του διπόλου: μ = δl Αυτό είναι ένα διανυσματικό μέγεθος: κατευθυνόμενο από το θετικό στο αρνητικό φορτίο.
 Πολικός ομοιοπολικός δεσμός Η διπολική ροπή ενός μορίου ισούται με το άθροισμα των διανυσμάτων των διπολικών ροπών του δεσμού, λαμβανομένων υπόψη των μοναχικών ζευγών ηλεκτρονίων. Η μονάδα διπολικής ροπής είναι Debye: 1 D = 3,3· 10 -30 C m.
Πολικός ομοιοπολικός δεσμός Η διπολική ροπή ενός μορίου ισούται με το άθροισμα των διανυσμάτων των διπολικών ροπών του δεσμού, λαμβανομένων υπόψη των μοναχικών ζευγών ηλεκτρονίων. Η μονάδα διπολικής ροπής είναι Debye: 1 D = 3,3· 10 -30 C m.
 Πολικός ομοιοπολικός δεσμός Διπολική ροπή μορίου Στο γινόμενο μ = δl και οι δύο ποσότητες κατευθύνονται αντίθετα. Ως εκ τούτου, είναι απαραίτητο να παρακολουθείται προσεκτικά ο λόγος της μεταβολής του μ. Για παράδειγμα, Cs. F Cs. Cl 24 31 δ «χαμένο» l Cs. I HF HCl HBr HI 37 5,73 3,24 2,97 1,14 αντίστροφα
Πολικός ομοιοπολικός δεσμός Διπολική ροπή μορίου Στο γινόμενο μ = δl και οι δύο ποσότητες κατευθύνονται αντίθετα. Ως εκ τούτου, είναι απαραίτητο να παρακολουθείται προσεκτικά ο λόγος της μεταβολής του μ. Για παράδειγμα, Cs. F Cs. Cl 24 31 δ «χαμένο» l Cs. I HF HCl HBr HI 37 5,73 3,24 2,97 1,14 αντίστροφα
 Πολικός ομοιοπολικός δεσμός Διπολική ροπή ενός μορίου Μπορεί ένα μόριο να είναι μη πολικό αν όλοι οι δεσμοί του είναι πολικοί; Τα μόρια τύπου ΑΒ είναι πάντα πολικά. Τα μόρια του τύπου AB 2 μπορεί να είναι τόσο πολικά όσο και μη πολικά. . . H 2 O O N CO 2 μ>0 H O C μ=0 O
Πολικός ομοιοπολικός δεσμός Διπολική ροπή ενός μορίου Μπορεί ένα μόριο να είναι μη πολικό αν όλοι οι δεσμοί του είναι πολικοί; Τα μόρια τύπου ΑΒ είναι πάντα πολικά. Τα μόρια του τύπου AB 2 μπορεί να είναι τόσο πολικά όσο και μη πολικά. . . H 2 O O N CO 2 μ>0 H O C μ=0 O
 Πολικός ομοιοπολικός δεσμός Τα μόρια που αποτελούνται από τρία ή περισσότερα άτομα (AB 2, AB 3, AB 4, AB 5, AB 6) μπορεί να είναι μη πολικά εάν είναι συμμετρικά. Τι επηρεάζεται από την παρουσία της διπολικής ροπής ενός μορίου; Υπάρχουν διαμοριακές αλληλεπιδράσεις και, κατά συνέπεια, αυξάνεται η πυκνότητα της ουσίας, το σημείο τήξης και το σημείο βρασμού.
Πολικός ομοιοπολικός δεσμός Τα μόρια που αποτελούνται από τρία ή περισσότερα άτομα (AB 2, AB 3, AB 4, AB 5, AB 6) μπορεί να είναι μη πολικά εάν είναι συμμετρικά. Τι επηρεάζεται από την παρουσία της διπολικής ροπής ενός μορίου; Υπάρχουν διαμοριακές αλληλεπιδράσεις και, κατά συνέπεια, αυξάνεται η πυκνότητα της ουσίας, το σημείο τήξης και το σημείο βρασμού.
 Σύγκριση ιοντικών και ομοιοπολικών πολικών δεσμών Γενικά: σχηματισμός κοινού ζεύγους ηλεκτρονίων. Διαφορά: ο βαθμός μετατόπισης του κοινού ζεύγους ηλεκτρονίων (πόλωση δεσμού). Ένας ιονικός δεσμός θα πρέπει να θεωρείται ως ακραία περίπτωση πολικού ομοιοπολικού δεσμού.
Σύγκριση ιοντικών και ομοιοπολικών πολικών δεσμών Γενικά: σχηματισμός κοινού ζεύγους ηλεκτρονίων. Διαφορά: ο βαθμός μετατόπισης του κοινού ζεύγους ηλεκτρονίων (πόλωση δεσμού). Ένας ιονικός δεσμός θα πρέπει να θεωρείται ως ακραία περίπτωση πολικού ομοιοπολικού δεσμού.
 Σύγκριση των χαρακτηριστικών των ιοντικών και ομοιοπολικών πολικών δεσμών Ομοιοπολικός δεσμός: κορεσμένος και κατευθυνόμενος Κορεσμός (μέγιστο σθένος) - καθορίζεται από την ικανότητα ενός ατόμου να σχηματίζει περιορισμένο αριθμό δεσμών (λαμβάνοντας υπόψη και τους δύο μηχανισμούς σχηματισμού). Η κατεύθυνση του δεσμού καθορίζεται από τη γωνία του δεσμού, η οποία εξαρτάται από τον τύπο υβριδισμού των τροχιακών του κεντρικού ατόμου. Ιωνικός δεσμός: ακόρεστος και μη κατευθυντικός.
Σύγκριση των χαρακτηριστικών των ιοντικών και ομοιοπολικών πολικών δεσμών Ομοιοπολικός δεσμός: κορεσμένος και κατευθυνόμενος Κορεσμός (μέγιστο σθένος) - καθορίζεται από την ικανότητα ενός ατόμου να σχηματίζει περιορισμένο αριθμό δεσμών (λαμβάνοντας υπόψη και τους δύο μηχανισμούς σχηματισμού). Η κατεύθυνση του δεσμού καθορίζεται από τη γωνία του δεσμού, η οποία εξαρτάται από τον τύπο υβριδισμού των τροχιακών του κεντρικού ατόμου. Ιωνικός δεσμός: ακόρεστος και μη κατευθυντικός.
 Σύγκριση των χαρακτηριστικών των ιοντικών και ομοιοπολικών πολικών δεσμών Η κατεύθυνση του δεσμού καθορίζεται από τις γωνίες του δεσμού. Οι γωνίες δεσμών προσδιορίζονται πειραματικά ή προβλέπονται με βάση τη θεωρία του υβριδισμού των ατομικών τροχιακών από τη θεωρία του L. Polling ή του Gillespie. Περισσότερες λεπτομέρειες για αυτό στα σεμινάρια.
Σύγκριση των χαρακτηριστικών των ιοντικών και ομοιοπολικών πολικών δεσμών Η κατεύθυνση του δεσμού καθορίζεται από τις γωνίες του δεσμού. Οι γωνίες δεσμών προσδιορίζονται πειραματικά ή προβλέπονται με βάση τη θεωρία του υβριδισμού των ατομικών τροχιακών από τη θεωρία του L. Polling ή του Gillespie. Περισσότερες λεπτομέρειες για αυτό στα σεμινάρια.
 Σύγκριση ιδιοτήτων ουσιών με ιοντικούς και ομοιοπολικούς δεσμούς Ομοιοπολικοί δεσμοί Ατομικοί κρύσταλλοι Μεταξύ ατόμων στον ίδιο τον κρύσταλλο Υψηλή σκληρότητα υψηλό σημείο τήξης, σημείο βρασμού φτωχή θερμική και ηλεκτρική αγωγιμότητα Μοριακοί κρύσταλλοι Μεταξύ ατόμων σε μόριο Μέτρια απαλότητα, αρκετά χαμηλό σημείο τήξης κακή θερμική και ηλεκτρική αγωγιμότητα Αδιάλυτο στο νερό
Σύγκριση ιδιοτήτων ουσιών με ιοντικούς και ομοιοπολικούς δεσμούς Ομοιοπολικοί δεσμοί Ατομικοί κρύσταλλοι Μεταξύ ατόμων στον ίδιο τον κρύσταλλο Υψηλή σκληρότητα υψηλό σημείο τήξης, σημείο βρασμού φτωχή θερμική και ηλεκτρική αγωγιμότητα Μοριακοί κρύσταλλοι Μεταξύ ατόμων σε μόριο Μέτρια απαλότητα, αρκετά χαμηλό σημείο τήξης κακή θερμική και ηλεκτρική αγωγιμότητα Αδιάλυτο στο νερό

 Σύγκριση ιδιοτήτων ουσιών με ιοντικούς και ομοιοπολικούς δεσμούς Ατομικός ομοιοπολικός κρύσταλλος Σημείο τήξης ≈ 3700 °C
Σύγκριση ιδιοτήτων ουσιών με ιοντικούς και ομοιοπολικούς δεσμούς Ατομικός ομοιοπολικός κρύσταλλος Σημείο τήξης ≈ 3700 °C
 Σύγκριση των ιδιοτήτων των ουσιών με ιοντικούς και ομοιοπολικούς δεσμούς Ιοντικοί δεσμοί μεταξύ ιόντων σε κρυσταλλική σκληρότητα και ευθραυστότητα υψηλό σημείο τήξης κακή θερμική και ηλεκτρική αγωγιμότητα Διαλυτό στο νερό
Σύγκριση των ιδιοτήτων των ουσιών με ιοντικούς και ομοιοπολικούς δεσμούς Ιοντικοί δεσμοί μεταξύ ιόντων σε κρυσταλλική σκληρότητα και ευθραυστότητα υψηλό σημείο τήξης κακή θερμική και ηλεκτρική αγωγιμότητα Διαλυτό στο νερό

 Ο μεταλλικός δεσμός πραγματοποιείται από ηλεκτρόνια που ανήκουν σε όλα τα άτομα ταυτόχρονα. Η πυκνότητα ηλεκτρονίων είναι μετατοπισμένη "αέριο ηλεκτρονίων". Χαρακτηριστική μεταλλική λάμψη Πλαστικότητα Ελατότητα Υψηλή θερμική και ηλεκτρική αγωγιμότητα Τα σημεία τήξης είναι πολύ διαφορετικά.
Ο μεταλλικός δεσμός πραγματοποιείται από ηλεκτρόνια που ανήκουν σε όλα τα άτομα ταυτόχρονα. Η πυκνότητα ηλεκτρονίων είναι μετατοπισμένη "αέριο ηλεκτρονίων". Χαρακτηριστική μεταλλική λάμψη Πλαστικότητα Ελατότητα Υψηλή θερμική και ηλεκτρική αγωγιμότητα Τα σημεία τήξης είναι πολύ διαφορετικά.
 Διαμοριακούς δεσμούς. 1. Δεσμός υδρογόνου Έλξη μεταξύ του ατόμου υδρογόνου (+) ενός μορίου και του ατόμου F, O, N (–) ενός άλλου μορίου Πολυμερές (HF)n Διμερές οξικού οξέος Οι δεσμοί υδρογόνου είναι αδύναμοι μεμονωμένα, αλλά ισχυροί συλλογικά
Διαμοριακούς δεσμούς. 1. Δεσμός υδρογόνου Έλξη μεταξύ του ατόμου υδρογόνου (+) ενός μορίου και του ατόμου F, O, N (–) ενός άλλου μορίου Πολυμερές (HF)n Διμερές οξικού οξέος Οι δεσμοί υδρογόνου είναι αδύναμοι μεμονωμένα, αλλά ισχυροί συλλογικά
 Διαμοριακούς δεσμούς. 5. Δεσμοί Van der Waals Ακόμα κι αν δεν υπάρχουν δεσμοί υδρογόνου μεταξύ των μορίων, τα μόρια πάντα έλκονται μεταξύ τους. Η έλξη μεταξύ των μοριακών διπόλων ονομάζεται σύζευξη van der Waals. Όσο ισχυρότερη είναι η έλξη: 1) πολικότητα. 2) μοριακό μέγεθος. Παράδειγμα: το μεθάνιο (CH 4) είναι αέριο, το βενζόλιο (C 6 H 6) είναι ένα υγρό. Ένα από τα πιο αδύναμος v-d-vδεσμούς - μεταξύ μορίων H 2 (σ.τ. - 259 ο. C, bp. - 253 ο. C). Η αλληλεπίδραση μεταξύ των μορίων είναι πολλές φορές πιο αδύναμη από τη σύνδεση μεταξύ των ατόμων: Ekov(Cl–Cl) = 244 kJ/mol, Evdv(Cl2–Cl2) = 25 kJ/mol, αλλά διασφαλίζει με ακρίβεια την ύπαρξη υγρών και στερεών καταστάσεων της ύλης
Διαμοριακούς δεσμούς. 5. Δεσμοί Van der Waals Ακόμα κι αν δεν υπάρχουν δεσμοί υδρογόνου μεταξύ των μορίων, τα μόρια πάντα έλκονται μεταξύ τους. Η έλξη μεταξύ των μοριακών διπόλων ονομάζεται σύζευξη van der Waals. Όσο ισχυρότερη είναι η έλξη: 1) πολικότητα. 2) μοριακό μέγεθος. Παράδειγμα: το μεθάνιο (CH 4) είναι αέριο, το βενζόλιο (C 6 H 6) είναι ένα υγρό. Ένα από τα πιο αδύναμος v-d-vδεσμούς - μεταξύ μορίων H 2 (σ.τ. - 259 ο. C, bp. - 253 ο. C). Η αλληλεπίδραση μεταξύ των μορίων είναι πολλές φορές πιο αδύναμη από τη σύνδεση μεταξύ των ατόμων: Ekov(Cl–Cl) = 244 kJ/mol, Evdv(Cl2–Cl2) = 25 kJ/mol, αλλά διασφαλίζει με ακρίβεια την ύπαρξη υγρών και στερεών καταστάσεων της ύλης
 Στη διάλεξη χρησιμοποιήθηκαν υλικά από τον καθηγητή της Χημικής Σχολής του Κρατικού Πανεπιστημίου της Μόσχας. Lomonosov Eremina Vadim Vladimirovich Σας ευχαριστούμε για την προσοχή σας!
Στη διάλεξη χρησιμοποιήθηκαν υλικά από τον καθηγητή της Χημικής Σχολής του Κρατικού Πανεπιστημίου της Μόσχας. Lomonosov Eremina Vadim Vladimirovich Σας ευχαριστούμε για την προσοχή σας!