Perkenalan
polarisasi pewarna pendaran fluoresensi
Masa hidup molekul yang tereksitasi secara elektronik adalah 10 -8 -10 -9 detik. Setelah itu, molekul kembali ke keadaan semula, mengeluarkan energi tambahan secara non-radiasi pada gerak vibrasi inti dan gerak translasi molekul tetangganya, yaitu pada gerak vibrasi inti dan gerak translasi molekul tetangganya. membuangnya dalam bentuk panas. Namun energi ini juga dapat dilepaskan dalam bentuk foton yang dipancarkan. Fenomena ini disebut pendaran. Tergantung pada metode eksitasi molekul - cahaya, energi listrik, reaksi kimia, pemanasan, dll. - membedakan antara foto, elektro, kemo, atau termoluminesensi. Kami lebih tertarik pada fotoluminesensi, yang biasa disebut fluoresensi.
Hukum fluoresensi
Spektrum fluoresensi adalah ketergantungan intensitas cahaya yang dipancarkan pada energi foton: SAYA fl =f(h) atau F(). Namun biasanya pada daerah tampak dan ultraviolet, ketergantungan intensitas cahaya fluoresen pada panjang gelombang diplot:
polarisasi pewarna pendaran fluoresensi
SAYA fl = f().
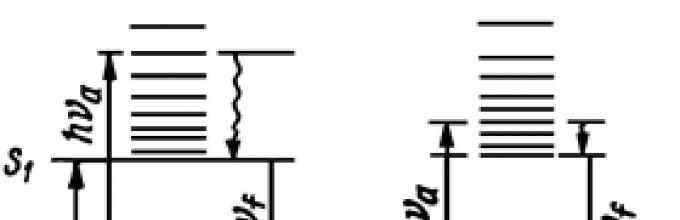
Oleh hukum Stokes, spektrum fluoresensi bergeser ke panjang gelombang yang lebih panjang dibandingkan dengan spektrum serapan. Pergeseran ini disebut pergeseran Stokes. Ini mencerminkan hilangnya sebagian energi eksitasi karena disipasi panas. Namun seringkali spektrum fluoresensi sebagian tumpang tindih dengan spektrum serapan cahaya (dan dengan spektrum eksitasi fluoresensi). Di wilayah tumpang tindih, yang disebut anti-Stokes (Gbr. 1), energi foton yang dipancarkan lebih besar daripada energi kuanta yang diserap. Dalam hal ini, energi tambahan diambil dari energi vibrasi molekul ketika, sebagai akibat dari radiasi, terjadi transisi ke sublevel vibrasi yang lebih rendah daripada sublevel tempat foton diserap (Gbr. 2).
Beras. 1.
aturan Kash menyatakan bahwa dalam larutan, transisi radiasi biasanya terjadi dari sublevel getaran yang lebih rendah dari tingkat tereksitasi singlet atau triplet. Hal ini terjadi karena selama masa keadaan tereksitasi 10 -8 -10 -9 s, semua transisi vibrasi-rotasi mempunyai waktu untuk terjadi (durasi tipikalnya adalah 10 -13 -10 -12 s). Kita dapat mengatakan bahwa pada saat foton dipancarkan, molekul tersebut “lupa” pada sublevel mana ia tereksitasi. Itu sebabnya spektrum fluoresensi tidak bergantung pada panjang gelombang cahaya yang menggairahkan.

Beras. 2. Skema transisi antara getaran elektronik selama fluoresensi Stokes (a) dan anti-Stokes (b), ketika, sebagai akibat dari transisi ke sublevel getaran yang lebih rendah, energi kuantum yang dipancarkan lebih tinggi daripada energi kuantum yang diserap. kuantum
Oleh aturan Levshin, spektrum fluoresensi yang diplot pada skala frekuensi (energi foton) adalah simetris cermin terhadap pita serapan gelombang panjang. Hal ini disebabkan oleh fakta bahwa jarak antara sublevel getaran dan probabilitas transisi ke sana untuk molekul dalam keadaan tereksitasi Alasannya adalah karena selama transisi elektronik orde 10 -15 s, posisi inti tidak mempunyai waktu untuk berubah, karena periode osilasinya yang khas adalah dua hingga tiga kali lipat lebih lama - sekitar 10 -13 -10 -12 s Oleh karena itu, menurut prinsip Franck-Condon, penyerapan dan emisi foton disebabkan oleh sublevel getaran yang sama.
Hasil kuantum fluoresensi adalah rasio jumlah kuanta yang dipancarkan dengan jumlah kuanta yang diserap:
= n fl /N mengasyikkan
Nilai 0< < 1, karena selain emisi foton, ada cara lain untuk memanfaatkan energi eksitasi: energi tersebut dapat ditransfer ke molekul lain, dikonsumsi dalam reaksi kimia, atau dihamburkan dalam bentuk panas.
Menurut hukum Vavilov, di wilayah Stokes, hasil kuantum fluoresensi molekul kompleks dalam larutan tidak bergantung pada panjang gelombang cahaya rangsang.
Intensitas fluoresensi larutan encer sebanding dengan konsentrasi fluorokrom. Memang, dalam larutan encer dengan kerapatan optik rendah D=kl < 0,05
SAYA fl =KI mengasyikkan =KI 0 (1-T) = K I 0 (1 -10 -D ) 2,3k I 0 D,
Di mana k- fraksi radiasi fluoresen yang masuk ke fotodetektor. Hal ini memungkinkan fluoresensi untuk menentukan jumlah fluorokrom dan perubahannya di bawah berbagai pengaruh. Untuk mengukur konsentrasi fluorokrom secara kuantitatif, gunakan kurva kalibrasi:
c = c std (SAYA fl /SAYA std ),
dimana indeks “std” mengacu pada larutan kalibrasi standar.
Konsep “luminescence” mencakup banyak fenomena berbeda. Ada beberapa sistem untuk klasifikasinya.

Dalam kimia analitik, fotoluminesensi molekuler paling sering digunakan. Tergantung pada sifat dasar dan keadaan tereksitasi molekul, ia dibagi menjadi fluoresensi dan pendar.
Karakteristik utama dan pola pendaran
Ciri-ciri utama pendaran adalah:
· spektrum eksitasi,
· spektrum emisi(spektrum pendaran),
· hasil kuantum dan energi,
· polarisasi, seumur hidup dll.
Spektrum eksitasi pendaran(fluoresensi, pendar) - ketergantungan intensitas cahaya yang dipancarkan dengan panjang gelombang tetap pada panjang gelombang atau karakteristik gelombang lain dari cahaya rangsang.
Dengan mengeksitasi molekul suatu zat dengan cahaya dengan panjang gelombang yang sesuai dengan lmaks spektrum eksitasi, fluoresensi dengan intensitas maksimum dapat diperoleh. Dalam larutan encer, spektrum eksitasi fluoresensi bertepatan dengan spektrum serapan zat.
Spektrum pendaran- ketergantungan intensitas cahaya yang dipancarkan pada panjang gelombangnya untuk panjang gelombang tetap dari cahaya rangsang.
Di meja Tabel 21.1 menunjukkan sifat utama yang melekat pada spektrum pendaran.
Sifat dasar spektrum pendaran
| Properti | Penjelasan |
| Spektrum pendaran tidak bergantung pada panjang gelombang cahaya yang menggairahkan (aturan M. Kasha) | Terlepas dari keadaan tereksitasi mana yang dimasuki molekul ketika foton diserap, emisi selalu terjadi selama transisi antara tingkat energi tereksitasi pertama dan tingkat energi dasar. |
| Biasanya spektrum pendaran secara keseluruhan dan maksimumnya selalu bergeser dibandingkan dengan spektrum serapan dan maksimumnya ke arah panjang gelombang yang lebih panjang (energi lebih rendah) - aturan Stokes-Lommel | Sebagian energi yang diserap hilang karena relaksasi getaran selama tumbukan dengan molekul lain; selain itu, pelarut menstabilkan keadaan tereksitasi dan mengurangi energinya. |
| Untuk banyak zat, spektrum serapan yang dinormalisasi (hanya pita panjang gelombang terpanjang) dan fluoresensi, yang digambarkan sebagai fungsi frekuensi atau bilangan gelombang, adalah simetris terhadap garis lurus yang tegak lurus terhadap sumbu absis melalui titik perpotongan spektrum ini ( Aturan V.L. Levshin) | Penyerapan (pita panjang gelombang terpanjang) dan emisi disebabkan oleh transisi yang sama (S 0 S 1 untuk fluoresensi) |
Hasil kuantum(sebutan V kv, Q, f) - perbandingan jumlah foton yang dipancarkan dengan jumlah foton yang diserap
Keluaran energi(V en) - perbandingan energi cahaya yang dipancarkan dengan energi cahaya yang diserap


Ada hubungan berikut antara Vkv dan Ven
Karena biasanya n digunakan< n погл, то В эн < В кв
Hasil kuantum pendaran tidak bergantung pada l exc hingga l tertentu, terletak di wilayah di mana spektrum serapan dan emisi tumpang tindih, setelah itu menurun tajam. Hasil energi bergantung pada l exc: mula-mula meningkat berbanding lurus ke l exc, maka dalam selang waktu tertentu nilainya tidak berubah, setelah itu nilainya menurun tajam ( hukum Vavilov).
Pengaruh berbagai faktor terhadap intensitas fluoresensi larutan
Pendaran dan, khususnya, fluoresensi lebih dipengaruhi oleh berbagai faktor daripada penyerapan cahaya. Intensitas fluoresensi tergantung pada:
· sifat materi;
· konsentrasi suatu zat dalam larutan;
· kondisi di mana zat fluoresen berada(suhu, pelarut, pH, keberadaan zat lain dalam larutan yang dapat mempengaruhi fluoresensi).
Sifat zat
Senyawa anorganik (dengan pengecualian beberapa senyawa uranium dan lantanida) biasanya tidak mampu berfluoresensi dalam larutan. Pada saat yang sama, terdapat cukup banyak zat fluoresen di antara senyawa organik.
Diperlukan(tetapi tidak cukup!) Kondisi fotoluminesensi adalah kemampuan suatu zat untuk menyerap radiasi elektromagnetik dalam rentang UV atau sinar tampak. Biasanya, zat dengan fluoresensi intens memiliki sistem ikatan terkonjugasi yang panjang. Zat fluoresen yang paling umum ditemukan di antara senyawa aromatik. Pengenalan substituen pemberi elektron ke dalam cincin benzena meningkatkan kemampuan zat untuk berfluoresensi. Misalnya, banyak fenol dan amina aromatik menunjukkan fluoresensi yang kuat. Pengenalan substituen penarik elektron, dengan beberapa pengecualian, mengurangi fluoresensi. Atom halogen berat(Br, I) meningkatkan laju konversi penyeberangan antarsistem dan, dengan demikian, mengurangi hasil kuantum fluoresensi. Namun, penambahan halogen berat meningkatkan kemampuan zat untuk berpendar. Kemampuan suatu zat untuk berfluoresensi dalam larutan meningkat seiring dengan kondensasi cincin aromatik dan peningkatan “kekakuan” molekul. Misalnya

Konsentrasi zat
Hubungan antara intensitas fluoresensi dan konsentrasi zat fluoresen dalam larutan lebih kompleks dibandingkan antara penyerapan cahaya dan konsentrasi. Hal ini disebabkan oleh fakta bahwa proses radiasi bersifat sekunder dan bergantung pada proses penyerapan cahaya sebelumnya.
Mari kita perhatikan kasus paling sederhana, ketika hanya ada satu zat fluoresen dalam larutan.
Dengan demikian:
Oleh karena itu, hubungan antara intensitas fluoresensi dan konsentrasi zat fluoresen tidak linier.
Fungsinya dapat diperluas menjadi deret Maclaurin
Jika produk (densitas optik larutan) kecil, maka
Dengan demikian, pada kepadatan optik rendah(di aku kecuali) ketergantungan intensitas fluoresensi pada konsentrasi dapat dianggap linier, yang digunakan dalam analisis kuantitatif. Pada nilai A yang lebih tinggi, ketergantungan intensitas fluoresensi pada konsentrasi menjadi lebih kompleks dan menyimpang dari linearitas. Pada A = 0,01, deviasi linearitas adalah 1%, 0,05 - 5%; 0,5 - sekitar 35% (Gbr. 21.4).

Beras. 21.4. Hubungan antara intensitas fluoresensi dan kepadatan optik larutan
1) dihitung dengan rumus sederhana I = KC; 2) nyata
Pengaruh kerapatan optik suatu larutan terhadap intensitas fluoresensi disebut “ efek filter internal" Efek ini disebabkan oleh dua alasan:
· penyerapan cahaya yang menarik, akibatnya partikel yang terletak jauh dari sumber radiasi akan menerima radiasi yang lebih sedikit;
· penyerapan hanya partikel materi radiasi, dipancarkan oleh partikel lain dari zat yang sama.
Pendaran adalah pancaran cahaya oleh bahan tertentu ketika suhunya relatif dingin. Berbeda dengan radiasi benda panas, seperti batu bara, besi cair, dan kawat yang dipanaskan oleh arus listrik. Emisi pendaran diamati:
- pada lampu neon dan lampu neon, televisi, radar dan layar fluoroskop;
- dalam zat organik seperti luminol atau luciferin pada kunang-kunang;
- pada beberapa pigmen yang digunakan dalam iklan luar ruang;
- dengan kilat dan cahaya utara.
Dalam semua fenomena ini, pancaran cahaya bukan dihasilkan dari pemanasan material di atas suhu ruangan, oleh karena itu disebut cahaya dingin. Nilai praktis bahan luminescent terletak pada kemampuannya mengubah bentuk energi tak terlihat menjadi
Sumber dan proses
Fenomena pendaran terjadi akibat penyerapan energi oleh suatu bahan, misalnya dari sumber radiasi ultraviolet atau sinar-x, berkas elektron, reaksi kimia, dan lain-lain. Hal ini menyebabkan atom-atom suatu zat menjadi tereksitasi. Karena tidak stabil, material kembali ke keadaan semula dan energi yang diserap dilepaskan dalam bentuk cahaya dan/atau panas. Hanya elektron terluar yang terlibat dalam proses tersebut. Efisiensi pendaran bergantung pada derajat konversi energi eksitasi menjadi cahaya. Jumlah bahan dengan efisiensi yang cukup untuk penggunaan praktis relatif sedikit.
Pendaran dan pijar
Eksitasi pendaran tidak berhubungan dengan eksitasi atom. Ketika bahan panas mulai bersinar akibat pijar, atom-atomnya berada dalam keadaan tereksitasi. Meskipun mereka sudah bergetar pada suhu kamar, ini cukup untuk menyebabkan radiasi terjadi di wilayah spektrum inframerah jauh. Dengan meningkatnya suhu, frekuensi radiasi elektromagnetik bergeser ke wilayah tampak. Di sisi lain, pada suhu yang sangat tinggi, seperti yang terjadi pada tabung kejut, tumbukan antar atom bisa begitu kuat sehingga elektron terpisah darinya dan bergabung kembali, sehingga memancarkan cahaya. Dalam hal ini, pendaran dan pijar menjadi tidak dapat dibedakan.
Pigmen dan pewarna bercahaya
Pigmen dan pewarna konvensional mempunyai warna karena mencerminkan bagian spektrum yang melengkapi bagian yang diserap. Sebagian kecil energi diubah menjadi panas, tetapi tidak terjadi radiasi yang nyata. Namun, jika pigmen luminescent menyerap cahaya matahari pada bagian spektrum tertentu, pigmen tersebut mungkin memancarkan foton yang berbeda dari foton yang dipantulkan. Hal ini terjadi sebagai akibat dari proses di dalam molekul pewarna atau pigmen yang melaluinya sinar ultraviolet dapat diubah menjadi cahaya tampak, seperti cahaya biru. Metode pendaran seperti itu digunakan dalam iklan luar ruang dan bubuk pencuci. Dalam kasus terakhir, “pencerah” tetap berada di dalam kain tidak hanya untuk memantulkan warna putih, tetapi juga untuk mengubah radiasi ultraviolet menjadi biru, mengimbangi warna kuning dan meningkatkan warna putih.

Penelitian awal
Meskipun petir, cahaya utara, dan cahaya redup kunang-kunang dan jamur selalu diketahui umat manusia, studi pertama tentang pendaran dimulai dengan bahan sintetis ketika Vincenzo Cascariolo, seorang alkemis dan pembuat sepatu dari Bologna, Italia, memanaskan campuran barium. sulfat (dalam bentuk barit, heavy spar) dengan batubara. Bedak tersebut, setelah didinginkan, mengeluarkan cahaya kebiruan di malam hari, dan Cascariolo mencatat bahwa hal ini dapat dipulihkan dengan memaparkan bedak tersebut di bawah sinar matahari. Zat tersebut dinamakan lapis solaris, atau batu matahari, karena para alkemis berharap dapat mengubah logam menjadi emas, yang dilambangkan dengan matahari. Pijaran cahaya tersebut membangkitkan minat banyak ilmuwan pada masa itu, yang memberi nama lain pada material tersebut, termasuk “fosfor”, yang berarti “pembawa cahaya”.
Saat ini, nama "fosfor" hanya digunakan untuk unsur kimianya, sedangkan bahan luminescent mikrokristalin disebut fosfor. "Fosfor" Cascariolo rupanya adalah barium sulfida. Fosfor pertama yang tersedia secara komersial (1870) adalah “cat Balmain” - larutan kalsium sulfida. Pada tahun 1866, fosfor stabil pertama dari seng sulfida dijelaskan - salah satu yang terpenting dalam teknologi modern.
Salah satu studi ilmiah pertama tentang pendaran yang terjadi pada kayu atau daging yang membusuk dan pada kunang-kunang dilakukan pada tahun 1672 oleh ilmuwan Inggris Robert Boyle, yang, meskipun tidak mengetahui asal usul biokimia cahaya ini, namun menetapkan beberapa sifat dasar bioluminescent. sistem:
- cahaya dingin;
- hal ini dapat ditekan dengan bahan kimia seperti alkohol, asam klorida dan amonia;
- radiasi memerlukan akses ke udara.
Pada tahun 1885-1887, diamati bahwa ekstrak kasar yang diperoleh dari kunang-kunang India Barat dan moluska folada menghasilkan cahaya jika dicampur.
Bahan chemiluminescent pertama yang efektif adalah senyawa sintetis non-biologis seperti luminol, yang ditemukan pada tahun 1928.

Kimia dan bioluminesensi
Sebagian besar energi yang dilepaskan dalam reaksi kimia, terutama reaksi oksidasi, berbentuk panas. Namun, dalam beberapa reaksi, sebagian digunakan untuk mengeksitasi elektron ke tingkat yang lebih tinggi, dan dalam molekul fluoresen sebelum terjadi chemiluminescence (CL). Penelitian menunjukkan bahwa CL adalah fenomena universal, meskipun intensitas pendarannya bisa sangat rendah sehingga diperlukan penggunaan detektor yang sensitif. Namun ada beberapa senyawa yang menunjukkan CL terang. Yang paling terkenal adalah luminol, yang bila dioksidasi dengan hidrogen peroksida dapat menghasilkan cahaya biru atau biru-hijau yang kuat. Zat CL kuat lainnya adalah lucigenin dan lofin. Meskipun CL-nya terang, tidak semuanya efektif dalam mengubah energi kimia menjadi cahaya, karena kurang dari 1% molekulnya memancarkan cahaya. Pada tahun 1960-an, ditemukan bahwa ester asam oksalat yang dioksidasi dalam pelarut anhidrat dengan adanya senyawa aromatik berfluoresensi tinggi memancarkan cahaya terang dengan efisiensi hingga 23%.
Bioluminesensi adalah jenis khusus CL yang dikatalisis oleh enzim. Hasil pendaran dari reaksi tersebut dapat mencapai 100%, yang berarti bahwa setiap molekul luciferin yang bereaksi masuk ke keadaan memancarkan. Semua reaksi bioluminesen yang dikenal saat ini dikatalisis oleh reaksi oksidasi yang terjadi dengan adanya udara.

Pendaran yang distimulasi secara termal
Termoluminesensi tidak berarti radiasi suhu, tetapi peningkatan radiasi cahaya dari bahan yang elektronnya tereksitasi oleh panas. Pendaran yang distimulasi secara termal diamati pada beberapa mineral dan terutama pada kristal fosfor setelah tereksitasi oleh cahaya.
Fotoluminesensi
Fotoluminesensi, yang dihasilkan oleh radiasi elektromagnetik yang terjadi pada suatu zat, dapat dihasilkan mulai dari cahaya tampak hingga ultraviolet hingga sinar-x dan sinar gamma. Dalam pendaran yang diinduksi foton, panjang gelombang cahaya yang dipancarkan biasanya sama dengan atau lebih besar dari panjang gelombang menarik (yaitu sama dengan atau lebih kecil dari energi). Perbedaan panjang gelombang ini disebabkan oleh konversi energi yang masuk menjadi getaran atom atau ion. Terkadang, ketika sinar laser terkena paparan yang intens, cahaya yang dipancarkan mungkin memiliki panjang gelombang yang lebih pendek.
Fakta bahwa PL dapat tereksitasi oleh radiasi ultraviolet ditemukan oleh fisikawan Jerman Johann Ritter pada tahun 1801. Dia memperhatikan bahwa fosfor bersinar terang di wilayah tak kasat mata di luar bagian spektrum ungu, dan dengan demikian menemukan radiasi UV. Konversi sinar UV menjadi cahaya tampak sangat penting secara praktis.
Pada tekanan tinggi frekuensinya meningkat. Spektrum tidak lagi terdiri dari satu garis spektral pada 254 nm, tetapi energi emisi didistribusikan melalui garis spektral yang sesuai dengan tingkat elektronik yang berbeda: 303, 313, 334, 366, 405, 436, 546 dan 578 nm. Lampu merkuri bertekanan tinggi digunakan untuk penerangan, karena 405-546 nm sama dengan cahaya tampak hijau kebiruan, dan ketika sebagian radiasi diubah menjadi cahaya merah menggunakan fosfor, hasilnya berwarna putih.
Ketika molekul gas tereksitasi, spektrum pendarannya menunjukkan pita lebar; tidak hanya elektron yang dinaikkan ke tingkat energi yang lebih tinggi, tetapi gerakan vibrasi dan rotasi atom secara keseluruhan juga tereksitasi secara bersamaan. Hal ini terjadi karena energi vibrasi dan rotasi molekul adalah 10 -2 dan 10 -4 energi transisi, yang bila dijumlahkan akan membentuk banyak panjang gelombang yang sedikit berbeda sehingga membentuk satu pita. Dalam molekul yang lebih besar terdapat beberapa pita yang tumpang tindih, satu untuk setiap jenis transisi. Emisi molekul dalam suatu larutan sebagian besar berbentuk pita, yang disebabkan oleh interaksi sejumlah besar molekul tereksitasi dengan molekul pelarut. Dalam molekul, seperti dalam atom, elektron terluar orbital molekul ikut serta dalam pendaran.
Fluoresensi dan pendar
Istilah-istilah ini dapat dibedakan tidak hanya berdasarkan durasi pendarnya, tetapi juga berdasarkan metode produksinya. Ketika sebuah elektron tereksitasi ke keadaan singlet dengan waktu tinggal 10 -8 s, yang kemudian dapat dengan mudah kembali ke keadaan dasar, zat tersebut memancarkan energinya dalam bentuk fluoresensi. Selama transisi, putaran tidak berubah. Keadaan dasar dan keadaan tereksitasi mempunyai keberagaman yang serupa.
Namun, sebuah elektron dapat dinaikkan ke tingkat energi yang lebih tinggi (disebut “keadaan triplet tereksitasi”) dengan membalikkan putarannya. Dalam mekanika kuantum, transisi dari keadaan triplet ke keadaan singlet dilarang, dan oleh karena itu, masa pakainya jauh lebih lama. Oleh karena itu, pendaran dalam hal ini memiliki durasi yang lebih lama: pendar diamati.