Molekul senyawa organik adalah kumpulan atom yang dihubungkan dalam urutan tertentu, biasanya melalui ikatan kovalen. Dalam hal ini, atom yang terikat dapat berbeda ukurannya keelektronegatifan. Kuantitas keelektronegatifan sangat menentukan karakteristik ikatan penting seperti polaritas dan kekuatan (energi pembentukan). Pada gilirannya, polaritas dan kekuatan ikatan dalam suatu molekul, sebagian besar, menentukan kemampuan molekul untuk masuk ke dalam reaksi kimia tertentu.
Keelektronegatifanatom karbon tergantung pada keadaan hibridisasinya. Hal ini disebabkan oleh bagiannya S- orbital dalam orbital hibrid: lebih kecil dari y sp 3 - dan lebih banyak lagi untuk sp 2 - dan sp -atom hibrida.
Semua atom yang membentuk suatu molekul saling berhubungan dan saling mempengaruhi. Pengaruh ini disalurkan terutama melalui sistem ikatan kovalen, menggunakan apa yang disebut efek elektronik.
Efek elektronik disebut pergeseran kerapatan elektron dalam suatu molekul di bawah pengaruh substituen./>
Atom-atom yang dihubungkan oleh ikatan polar membawa muatan parsial, dilambangkan dengan huruf Yunani delta ( D ). Atom "menarik" kerapatan elektronS-koneksi ke arahnya, memperoleh muatan negatif D -. Ketika mempertimbangkan sepasang atom yang dihubungkan oleh ikatan kovalen, atom yang lebih elektronegatif disebut akseptor elektron. Rekannya S -ikatan karenanya akan memiliki defisit kerapatan elektron dengan besaran yang sama, yaitu. sebagian positif mengenakan biaya D +, akan dipanggil donor elektron.
Pergeseran kerapatan elektron sepanjang rantaiS-koneksi disebut efek induktif dan ditunjuk SAYA.
Efek induktif ditransmisikan melalui rangkaian dengan redaman. Arah pergeseran kerapatan elektron semuaS-koneksi ditunjukkan dengan panah lurus.
Bergantung pada apakah kerapatan elektron menjauh dari atom karbon yang bersangkutan atau mendekatinya, efek induktif disebut negatif (- SAYA ) atau positif (+I). Tanda dan besarnya efek induktif ditentukan oleh perbedaan keelektronegatifan antara atom karbon yang bersangkutan dan gugus penyebabnya.
Substituen penarik elektron, mis. atom atau sekelompok atom yang menggeser kerapatan elektronS-ikatan dari atom karbon ke dirinya sendiri terlihat efek induktif negatif (- I-efek).
Elektrodonorsubstituen, yaitu sebuah atom atau sekelompok atom yang menggeser kerapatan elektron ke atom karbon menjauhi dirinya sendiri efek induktif positif(+I-efek).
Efek I ditunjukkan oleh radikal hidrokarbon alifatik, yaitu. radikal alkil (metil, etil, dll). Mayoritas kelompok fungsional menunjukkan - SAYA -efek: halogen, gugus amino, hidroksil, karbonil, gugus karboksil.
Efek induktif juga memanifestasikan dirinya ketika atom karbon yang terikat berbeda dalam keadaan hibridisasinya.
Ketika efek induktif gugus metil ditransfer ke ikatan rangkap, pengaruhnya pertama kali dialami oleh ikatan selulerP- koneksi.
Pengaruh substituen terhadap distribusi kerapatan elektron yang ditransmisikan melaluiP-koneksi disebut efek mesomerik (M). Efek mesomerik juga bisa bersifat negatif dan positif. DI DALAM rumus struktural ah digambarkan sebagai panah melengkung, dimulai dari pusat kerapatan elektron dan berakhir di tempat pergeseran kerapatan elektron.
Kehadiran pengaruh elektronik menyebabkan redistribusi kerapatan elektron dalam molekul dan munculnya muatan parsial pada atom individu. Ini menentukan reaktivitas molekul.
Menurut konsep modern, sifat dan mekanisme saling pengaruh atom ditentukan oleh sifat distribusi kerapatan elektron dalam molekul dan polarisasi ikatan kovalen.
Pencampuran elektronik dalam senyawa organik dibagi menjadi dua jenis: efek induktif - pencampuran kerapatan elektron sepanjang rantai ikatan dan efek mesomerik - perpindahan sepanjang sistem ikatan π.
Efek induktif. Mempertimbangkan jenis ikatan kimia, kami mencatat bahwa antara atom dengan keelektronegatifan yang sama, sepasang elektron dalam ikatan dimiliki secara merata oleh kedua partisipan dalam ikatan (kovalen ikatan non-polar). Misalnya, ikatan molekul metana dan butana bersifat non-polar, kerapatan elektron di dalamnya terdistribusi secara simetris dan molekul tidak memiliki momen dipol. Jika dalam molekul butana satu atom hidrogen digantikan oleh halogen - klor, maka kerapatan elektron ikatan kovalen C-Cl akan bercampur dengan atom klor yang lebih elektronegatif (ikatan kovalen polar):
Pasangan elektron pada ikatan a merupakan milik karbon dan klor, namun sedikit tercampur dengan klor, sehingga klor memperoleh muatan sebagian negatif (δ -), dan atom karbon pada ikatan C–Cl mempunyai muatan positif sebagian yang sama. muatan (δ +).
Penurunan kerapatan elektron pada C 1 mengarah pada fakta bahwa C 1, yang menunjukkan sifat akseptor, menggantikan elektron ikatan S dari atom karbon tetangga. Polarisasi ikatan C 2 –C 1 terjadi dan muatan positif parsial juga muncul pada C 2, yang selanjutnya menyebabkan polarisasi ikatan C 2 –C 3 dan munculnya muatan positif parsial pada C 3, dll. dalam hal ini, muatan positif pecahan pada atom karbon dalam rantai dari C 1 ke C berkurang: δ + > δ' + > δ'' + > δ''' +
Polarisasi satu ikatan karbon-halogen menyebabkan polarisasi molekul secara keseluruhan dan, akibatnya, munculnya momen dipol.
Efek induktif (induktif).– transfer pengaruh elektronik substituen sepanjang rantai ikatan σ, yang timbul karena perbedaan keelektronegatifan atom.
Efek induktif ditunjukkan dengan huruf SAYA, dan pergeseran kerapatan elektron digambarkan menggunakan panah di sepanjang ikatan σ sederhana, yang ujungnya menunjukkan arah pergeseran.
Berdasarkan arah pengaruh elektronik substituennya, positif +Saya dan negatif -SAYA efek induktif.
Efek induktif negatif ditunjukkan oleh substituen yang menarik elektron dari ikatan-o, misalnya: –NO 3 –C≡N, –COOH, –Hal, –OH,
Efek induktif negatif biasanya meningkat seiring dengan meningkatnya keelektronegatifan atom. Hal ini lebih menonjol untuk substituen dengan ikatan rangkap tiga, karena mengandung atom karbon hibridisasi sp yang lebih elektronegatif. Pada gilirannya, atom karbon dalam hibridisasi sp 3, karena kurang elektronegatif, menunjukkan + SAYA sehubungan dengan atom karbon dalam hibridisasi sp dan sp 2:
Efek induktif positif ditunjukkan oleh substituen yang menolak elektron ikatan oσ, paling sering adalah gugus alkil (Alk). Sifat pendonor elektron substituen alkil meningkat seiring dengan bertambahnya panjang rantai hidrokarbon (–C 4 H 9 > –CH 3) dan bertambahnya rangkaian radikal primer ke radikal tersier ((CH 3) 3 C– > (CH 3) 2 CH– > CH 3 CH 2 – > CH 3 –). Yang terakhir ini dijelaskan oleh fakta bahwa efek induktif meluruh di sepanjang rangkaian.
Meringkas hal di atas, mari kita membahas secara singkat sifat-sifat utama efek induktif;
1. Efek induktif hanya muncul jika molekul mengandung atom dengan keelektronegatifan berbeda.
2. Efek induktif hanya merambat melalui ikatan-o dalam satu arah.
3. Efek induktif dengan cepat meluruh di sepanjang rangkaian. Aksi maksimumnya adalah empat ikatan σ.
4. Bias induktif ditentukan oleh adanya momen dipol: μ≠0.
Efek mesomerik (efek konjugasi). Sebelum mempertimbangkan perpindahan pengaruh elektronik substituen melalui sistem ikatan π, mari kita definisikan konsep sistem terkonjugasi dan konjugasi.
Sistem terkonjugasi adalah sistem yang di dalamnya terdapat pergantian ikatan sederhana dan ganda, atau kedekatan atom yang memiliki orbital p kosong atau pasangan elektron bebas p. Sistem berpasangan tersedia dalam tipe sirkuit terbuka dan tertutup:
Masing-masing rantai ikatan terkonjugasi ini juga disebut rantai konjugasi (dari bahasa Latin - tumpang tindih, superimposisi). Mereka melibatkan konjugasi—tumpang tindih tambahan orbital π dan p yang memiliki sumbu simetri paralel (coplanar). Akibat konjugasi, terjadi redistribusi (delokalisasi) kerapatan elektron π dan terbentuknya sistem elektron π tunggal.
Tergantung pada jenis orbital yang tumpang tindih, beberapa jenis konjugasi dibedakan: konjugasi π,π (tumpang tindih dua orbital π), konjugasi p,π (tumpang tindih orbital p dan π):
Beras. 2.9. Sistem terkonjugasi 1,3 butadiena, vinil klorida dan kation alilik
Konjugasi adalah proses yang menguntungkan secara energi yang terjadi dengan pelepasan energi. Sistem terkonjugasi ditandai dengan peningkatan stabilitas termodinamika.
Setelah mendefinisikan konjugasi dan sistem terkonjugasi, mari kita perhatikan efek elektronik yang diamati ketika berbagai jenis substituen dimasukkan ke dalam sistem tersebut.
Efek konjugasi atau efek mesomerik(M) – proses transfer pengaruh elektronik substituen melalui sistem ikatan π terkonjugasi. Pencampuran kerapatan elektron dalam sistem terkonjugasi hanya dimungkinkan jika substituen pemberi atau penarik elektron dimasukkan ke dalam sistem.
Misalnya molekul benzena mempunyai konjugasi tetapi tidak memiliki substituen, sehingga tidak ada efek mesomerik. Gugus hidroksi pada molekul fenol merupakan bagian dari sistem terkonjugasi dan menunjukkan efek mesomerik, sedangkan pada molekul benzil alkohol, gugus –OH diisolasi dari sistem terkonjugasi melalui dua ikatan σ dan tidak menunjukkan efek mesomerik.
Efek mesomerik dilambangkan dengan huruf M, dan pergeseran kerapatan elektron dalam sistem terkonjugasi dilambangkan dengan panah melengkung. Menurut efek pengarah substituen, efek mesomerik dibagi menjadi positif (+M) dan negatif (–M).
Efek mesomerik positif ditunjukkan oleh substituen (atom atau gugus atom penyumbang elektron) yang menyediakan elektron ke sistem terkonjugasi, yaitu memiliki pasangan elektron bebas atau muatan negatif:
+M maksimum adalah untuk atom dengan muatan negatif. Substituen yang mengandung pasangan elektron bebas memiliki lebih banyak +M, semakin kecil keelektronegatifan atom yang mengandung pasangan elektron bebas dalam periode tersebut.
Efek mesomerik negatif dimanifestasikan oleh substituen yang menggeser kerapatan elektron sistem terkonjugasi ke dirinya sendiri:
Maksimum –M ditunjukkan oleh substituen yang membawa muatan positif. Pada gugus tak jenuh, efek –M meningkat seiring dengan meningkatnya perbedaan keelektronegatifan atom-atom yang berikatan ganda.
Mari kita lihat beberapa contoh efek mesomerik:
Efek mesomerik, dibandingkan dengan efek induktif, menyebabkan pergeseran kerapatan elektron yang lebih kuat dan praktis tidak melemah.
Manifestasi gabungan dari efek induktif dan mesomerik substituen
Efek mesomerik dan induktif dari satu substituen mungkin searah atau tidak. Misalnya, dalam molekul akrolein, gugus aldehida muncul -SAYA Dan -M, dan gugus hidroksil dalam molekul fenol memiliki -SAYA, Tetapi +M-memengaruhi,
Seperti dapat dilihat dari contoh di atas, dalam molekul fenol, pencampuran elektron yang berlawanan mengarah pada fakta bahwa kedua efek ini tampaknya “memadamkan” satu sama lain. Dan pada molekul akrolein, efek induktif dan mesomerik saling memperkuat. Efek mesomerik substituen biasanya lebih besar daripada efek induktif, karena ikatan l lebih mudah terpolarisasi dibandingkan ikatan σ.
Polarisasi yang disebabkan oleh efek mesomerik bersifat bolak-balik: di bawah pengaruh substituen, tidak hanya awan elektron π, tetapi juga awan ikatan σ akan bercampur. Fenomena ini diamati pada sistem dengan kopling sirkuit terbuka dan tertutup:
Meskipun pameran gugus amino -SAYA-efek, menyebabkan penurunan kerapatan elektron pada semua atom karbon pada siklus aromatik, tetapi karena +M-pengaruh sepasang elektron atom nitrogen yang lebih besar -SAYA secara umum, peningkatan kerapatan elektron diamati pada atom karbon cincin benzena, terutama pada posisi 2. 4. 6. Terjadi polarisasi bolak-balik.
Dalam molekul dengan rantai konjugasi terbuka, muatan parsial yang terkonsentrasi di ujung sistem terkonjugasi biasanya ditunjukkan:
Efek superkonjugasi (hiperkonjugasi). Seiring dengan konjugasi π,π- dan p,π, ada jenis konjugasi khusus - hiperkonjugasi (superkonjugasi) atau konjugasi σ,π.
Efek superkonjugasi– interaksi yang terjadi ketika awan elektron orbital o pada ikatan C–H tumpang tindih dengan orbital π pada ikatan rangkap. Jenis awan elektron yang tumpang tindih ini adalah konjugasi σ,π, yang terdapat pada rangkaian senyawa alifatik dan aromatik. Pencampuran elektron digambarkan menggunakan panah melengkung. Ikatan σ mana pun dari gugus metil propena dapat ikut serta dalam konjugasi σ,π.
Beras. 2.10. Diagram tumpang tindih orbital σ dari ikatan C–H dengan orbital π dari ikatan rangkap dalam molekul propena
Besarnya efek hiperkonjugasi semakin tinggi, semakin banyak atom hidrogen pada karbon yang berasosiasi dengan sistem tak jenuh. Konsep superkonjugasi menjelaskan peningkatan tersebut reaktivitas, mobilitas atom α-hidrogen dalam molekul aldehida, keton, asam dan turunannya. Superkonjugasi kadang-kadang disebut efek Nathan-Becker, diambil dari nama ilmuwan yang menemukannya.
ISOMERITAS SENYAWA ORGANIK. STRUKTUR SPASIAL MOLEKUL
Istilah isomerisme (dari bahasa Yunani isos - identik, meros - bagian) pertama kali diperkenalkan pada tahun 1830, ketika zat dengan komposisi kualitatif dan kuantitatif yang sama, tetapi dengan sifat fisik dan kimia yang berbeda, mulai dikenal.
Isomerisme adalah fenomena yang terdiri dari adanya senyawa-senyawa yang memiliki kesamaan Formula molekul, tetapi berbeda dalam urutan ikatan atom-atom dalam molekul atau susunan atom-atom dalam ruang, dan akibatnya berbeda dalam sifat fisika dan kimia.
Senyawa seperti ini disebut isomer. Ada dua jenis utama isomerisme - struktural (isomerisme struktural) dan spasial (stereoisomerisme).
Karya tersebut telah ditambahkan ke situs situs: 26-12-2015Memesan penulisan karya yang unik
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">bagian oleh kimia organik untuk mahasiswa Fakultas Ilmu Kesehatan Anak
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Kuliah 2
;font-family:"Times New Roman";text-decoration:underline" xml:lang="ru-RU" lang="ru-RU">Topik: Saling pengaruh atom dalam molekul senyawa organik
;teks-dekorasi:garis bawah" xml:lang="ru-RU" lang="ru-RU">Target:" xml:lang="ru-RU" lang="ru-RU">" xml:lang="ru-RU" lang="ru-RU">belajar struktur elektronik senyawa organik dan metode transmisi pengaruh timbal balik atom dalam molekulnya.
;font-family:"Times New Roman";text-decoration:underline" xml:lang="ru-RU" lang="ru-RU">Rencana:
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Efek induktif
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Jenis pemasangan.
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Aromatisitas senyawa organik
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Efek mesomerik (efek konjugasi)
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Efek induktif
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Molekul senyawa organik adalah kumpulan atom-atom yang dihubungkan dalam urutan tertentu melalui ikatan kovalen. Selain itu, atom-atom yang terikat mungkin berbeda dalam nilai keelektronegatifan (EO).
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> Keelektronegatifan;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> kemampuan suatu atom untuk menarik kerapatan elektron atom lain untuk mempengaruhi ikatan kimia.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Semakin besar nilai EO suatu unsur, semakin kuat daya tarik elektron ikatannya. Nilai EO. adalah didirikan oleh ahli kimia Amerika L. Pauling dan deret ini disebut skala Pauling.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">E. O. atom karbon bergantung pada keadaan hibridisasinya, karena atom karbon terletak pada jenis hibridisasi yang berbeda berbeda satu sama lain dalam E.O. dan ini tergantung pada proporsinya;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">s;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-awan dalam jenis hibridisasi ini. Misalnya, atom C berada dalam keadaan;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">sp;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">3;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-hibridisasi memiliki EO terendah sejak p-cloud menyumbang paling sedikit;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">s;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-clouds.Atom C di;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">sp;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">- hibridisasi.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Semua atom yang menyusun molekul saling berhubungan satu sama lain dan mengalami pengaruh timbal balik. Pengaruh ini ditransmisikan melalui ikatan kovalen menggunakan efek elektronik.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Salah satu sifat ikatan kovalen adalah mobilitas kerapatan elektron tertentu. Ia mampu bergeser ke arah atom dengan E, O yang lebih tinggi.
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Polaritas;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">ikatan kovalen adalah distribusi kerapatan elektron yang tidak merata antar atom yang terikat.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Keberadaan ikatan polar dalam suatu molekul mempengaruhi keadaan ikatan tetangganya. Hal ini dipengaruhi oleh polar ikatan, dan kerapatan elektronnya juga bergeser ke arah atom yang lebih EO, yaitu efek elektronik ditransfer.
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> Pergeseran kerapatan elektron sepanjang rantai ikatan ϭ disebut;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">efek induktif;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> dan ditunjuk;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">I;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Efek induktif ditransmisikan melalui rangkaian dengan redaman, karena ketika ikatan ϭ terbentuk, itu adalah dilepaskan sejumlah besar energi dan polarisasinya buruk dan oleh karena itu efek induktif lebih besar terwujud pada satu atau dua ikatan. Arah pergeseran kerapatan elektron semua ikatan ditunjukkan dengan panah lurus.→
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Misalnya: C;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">H;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">3;font-family:"Times New Roman";vertical-align:super" xml:lang="en-US" lang="en-US">δ;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">+< ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> →;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">CH;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman";vertical-align:super" xml:lang="en-US" lang="en-US">δ;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">+< ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> →;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">CH;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman";vertical-align:super" xml:lang="en-US" lang="en-US">δ;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">+< ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> →;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">Cl;font-family:"Times New Roman";vertical-align:super" xml:lang="en-US" lang="en-US">δ;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">-;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> E.O.S;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">l;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> > E.O.S
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">С;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">H;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">3;font-family:"Times New Roman";vertical-align:super" xml:lang="en-US" lang="en-US">δ;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">+< ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> →;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">CH;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman";vertical-align:super" xml:lang="en-US" lang="en-US">δ;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">+< ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> →;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">CH;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman";vertical-align:super" xml:lang="en-US" lang="en-US">δ;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">+< ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> →;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">OH;font-family:"Times New Roman";vertical-align:super" xml:lang="en-US" lang="en-US">δ;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">-;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">E.O. ON > E.O.S
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Sebuah atom atau sekelompok atom yang menggeser kerapatan elektron ikatan ϭ dari atom karbon ke dirinya sendiri adalah ditelepon;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">substituen penarik elektron;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">dan menunjukkan efek induktif negatif;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">(-;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">I;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-efek).
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Imi;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">adalah;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">halogen;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US"> (Cl, Br, I), OH;font-family:"Times New Roman";vertical-align:super" xml:lang="en-US" lang="en-US">-;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">, NH;font-family:"Times New Roman";vertical-align:sub" xml:lang="en-US" lang="en-US">2;font-family:"Times New Roman";vertical-align:super" xml:lang="en-US" lang="en-US">-;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">, COOH, COH, NO;font-family:"Times New Roman";vertical-align:sub" xml:lang="en-US" lang="en-US">2;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">, JADI;font-family:"Times New Roman";vertical-align:sub" xml:lang="en-US" lang="en-US">3;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">H dan lainnya.
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Sebuah atom atau sekelompok atom yang menyumbangkan kerapatan elektron disebut;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">substituen penyumbang elektron;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">dan menunjukkan efek induktif positif;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">(+;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">I;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-efek).
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">+;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">I;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-efek;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">menunjukkan radikal hidrokarbon alifatik, CH;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">3;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">, C;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Н;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">5;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> dll.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Efek induktif juga memanifestasikan dirinya dalam kasus ketika atom karbon yang terikat berbeda dalam keadaan hibridisasi. Untuk Misalnya, dalam molekul propena gugus CH;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">3;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> menunjukkan +;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">I;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-efek, karena atom karbon di dalamnya ada di;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">sp;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">3;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">- keadaan hibrid, dan atom karbon pada ikatan rangkap berada dalam keadaan;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">sp;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">- keadaan hibrid dan menunjukkan keelektronegatifan lebih besar, oleh karena itu menunjukkan -;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">I;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-efek dan merupakan akseptor elektron." xml:lang="ru-RU" lang="ru-RU">
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">propene-1
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Sistem terkonjugasi. Jenis konjugasi.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Faktor terpenting yang menentukan sifat kimia suatu molekul adalah distribusi kerapatan elektron di dalamnya. Sifat distribusi tergantung pada pengaruh timbal balik atom.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Sebelumnya telah ditunjukkan bahwa dalam molekul yang hanya memiliki ikatan ϭ, pengaruh timbal balik atom dalam kasus berbagai E, O. dilakukan melalui efek induktif. Dalam molekul yang merupakan sistem terkonjugasi, efek lain muncul;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">mesomerik,;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">atau;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> efek konjugasi.
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Pengaruh substituen yang ditransmisikan melalui sistem konjugasi ikatan π disebut;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">efek mesomerik (M).
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Sebelum berbicara tentang efek mesomerik, perlu dikaji masalah sistem terkonjugasi.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Konjugasi terjadi pada molekul banyak senyawa organik (alkadiena, hidrokarbon aromatik, asam karboksilat, urea, dll).
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Senyawa dengan susunan ikatan rangkap yang berselang-seling membentuk sistem terkonjugasi.
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Konjugasi;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">pembentukan awan elektron tunggal sebagai hasil interaksi partikel non-hibridisasi;font-family:"Times New Roman";vertical-align:sub" xml:lang="en-US" lang="en-US">z;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">- orbital dalam molekul dengan ikatan rangkap dan tunggal bergantian.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Senyawa terkonjugasi paling sederhana adalah butadiena-1,3. Keempat atom karbon dalam molekul butadiena-1 ,3 terletak mampu;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">sp;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">hibridisasi. Semua atom ini terletak pada bidang yang sama dan membentuk kerangka σ molekul (lihat angka).
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Orbital p yang tidak terhibridisasi dari setiap atom karbon terletak tegak lurus terhadap bidang ini dan sejajar satu sama lain. Hal ini menciptakan Tumpang tindih orbital-orbital ini terjadi tidak hanya antara atom C-1 dan C-2 dan C-3 dan C-4, tetapi juga sebagian antara atom C-2 dan C-3.;font-family:"Times New Roman";vertical-align:sub" xml:lang="en-US" lang="en-US">z;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-orbital, awan elektron π tunggal terbentuk, mis.;font-family:"Times New Roman";text-decoration:underline" xml:lang="ru-RU" lang="ru-RU">memasangkan;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> dua ikatan rangkap. Jenis konjugasi ini disebut;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">π, konjugasi π;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">, karena orbital ikatan π berinteraksi. Rantai konjugasi dapat mencakup jumlah yang besar obligasi ganda. Semakin lama, semakin besar delokalisasi elektron π dan semakin stabil molekulnya. Dalam sistem terkonjugasi, elektron π tidak lagi berada dalam ikatan tertentu; mereka;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">didelokalisasi;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">yaitu, mereka didistribusikan secara merata ke seluruh molekul. Delokalisasi elektron π dalam sistem terkonjugasi disertai dengan pelepasan energi, yang disebut;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">energi konjugasi.;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> Molekul seperti itu lebih stabil dibandingkan sistem dengan ikatan rangkap terisolasi. Hal ini dijelaskan oleh fakta bahwa energi molekul tersebut lebih rendah.Sebagai akibat dari delokalisasi elektron selama pembentukan sistem terkonjugasi, terjadi penyelarasan sebagian panjang ikatan: ikatan tunggal menjadi lebih pendek, dan ikatan rangkap menjadi lebih panjang.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Sistem konjugasi juga dapat mencakup heteroatom. Contoh sistem terkonjugasi π,π dengan heteroatom dalam rantai adalah senyawa karbonil tak jenuh α dan β, misalnya pada akrolein (propen-2-al) CH;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> = CH CH = O.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Rantai kopling mencakup tiga;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">sp;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">- atom karbon dan atom oksigen terhibridisasi, yang masing-masing menyumbangkan satu elektron p ke sistem π tunggal .
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">р,π-konjugasi.;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Dalam sistem terkonjugasi p,π, atom dengan pasangan elektron donor tunggal mengambil bagian dalam pembentukan konjugasi Dapat berupa: Cl, O, N,;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">S;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> dll. Senyawa tersebut antara lain halida, eter, asetamida, karbokation. Dalam molekul senyawa ini, konjugasi rangkap terjadi ikatan dengan orbital p suatu heteroatom.Ikatan tiga pusat yang terdelokalisasi terbentuk dengan tumpang tindih dua orbital p;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">sp;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">- atom karbon terhibridisasi dan satu orbital p dari heteroatom dengan sepasang elektron.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Pembentukan ikatan serupa dapat ditunjukkan pada gugus amino, yang merupakan fragmen struktural penting dari peptida dan protein Gugus Amida dari molekul asetamida mencakup dua heteroatom nitrogen dan oksigen.P, konjugasi π melibatkan elektron π dari ikatan rangkap terpolarisasi dari gugus karbonil dan pasangan elektron donor dari atom nitrogen.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> р, konjugasi π
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> Konjugasi juga dapat terjadi dalam sistem siklik. Ini terutama mencakup arena dan turunannya. Perwakilan paling sederhana adalah benzena Semua atom karbon dalam molekul benzena berada di;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">sp;font-family:"Times New Roman";vertical-align:super" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-hibridisasi. Enam;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">sp;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-awan hibrida membentuk kerangka benzena. Semua ikatan ϭ (C C dan CH) terletak pada bidang yang sama . Enam orbital p tak terhidridisasi terletak tegak lurus terhadap bidang molekul dan sejajar satu sama lain. Setiap orbital p dapat bertumpang tindih dengan dua orbital p yang berdekatan. Akibat tumpang tindih tersebut, timbullah sistem π tunggal yang terdelokalisasi, di mana kerapatan elektron tertinggi terletak di atas dan di bawah bidang kerangka ϭ dan mencakup semua atom karbon pada cincin. Kerapatan elektron π didistribusikan secara merata ke seluruh sistem siklik. Semua ikatan antar atom karbon memiliki panjang yang sama ( 0,139 nm), perantara antara panjang ikatan tunggal dan rangkap.
" xml:lang="ru-RU" lang="ru-RU">
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Aromatisitas
" xml:lang="ru-RU" lang="ru-RU">Konsep ini, yang mencakup berbagai sifat senyawa aromatik, diperkenalkan oleh fisikawan Jerman E. Hückel (1931).
" xml:lang="ru-RU" lang="ru-RU">Kondisi aromatisitas:
- " xml:lang="ru-RU" lang="ru-RU">loop tertutup datar
- " xml:lang="ru-RU" lang="ru-RU">semua atom C ada di dalamnya" xml:lang="en-US" lang="en-US">sp;penyelarasan vertikal:super" xml:lang="ru-RU" lang="ru-RU">2" xml:lang="ru-RU" lang="ru-RU"> hibridisasi
- " xml:lang="ru-RU" lang="ru-RU">sistem konjugasi tunggal dari semua atom dalam siklus terbentuk
- " xml:lang="ru-RU" lang="ru-RU">Aturan Hückel terpenuhi: “4" xml:lang="en-US" lang="en-US">n" xml:lang="ru-RU" lang="ru-RU">+2;font-family:"Simbol"" xml:lang="ru-RU" lang="ru-RU">" xml:lang="ru-RU" lang="ru-RU">-elektron, dimana" xml:lang="en-US" lang="en-US">n" xml:lang="ru-RU" lang="ru-RU"> = 1, 2, 3..." xml:lang="-tidak ada-" lang="-tidak ada-">" xml:lang="ru-RU" lang="ru-RU">”
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Perwakilan paling sederhana dari hidrokarbon aromatik adalah benzena. Ia memenuhi" xml:lang="ru-RU" lang="ru-RU">saya;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">dan keempat kondisi aromatisitas.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Aturan Hückel: 4;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">n;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">+2 = 6,;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">n;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> = 1.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Naftalena |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Naftalena senyawa aromatik ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Aturan Hückel: 4;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">n;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">+2 = 10,;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">n;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> = 2. |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Pir" xml:lang="ru-RU" lang="ru-RU">dan;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">din |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Heterosiklik aromatik piridin ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">с" xml:lang="ru-RU" lang="ru-RU">o;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">kesatuan. |
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Efek mesomerik
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Tidak seperti sistem tak terkonjugasi di mana pengaruh elektronik substituen ditransmisikan melalui ikatan ϭ (efek induktif) , dalam sistem terkonjugasi, elektron π dari ikatan kovalen terdelokalisasi memainkan peran utama dalam transmisi pengaruh elektronik. Efek yang diwujudkan dalam pergeseran kerapatan elektron dari sistem π yang terdelokalisasi (terkonjugasi) disebut efek konjugasi atau efek mesomerik .
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Efek mesomerik (+M, -M);font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> transfer pengaruh elektronik deputi melalui sistem terkait.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Dalam hal ini, substituen menjadi bagian dari sistem terkonjugasi. Ia dapat menimbulkan ikatan π (karbonil, karboksil, gugus nitro, gugus sulfo, dll.), pasangan elektron bebas dari heteroatom (halogen, amino, gugus hidroksil), kosong atau terisi dengan satu atau dua elektron orbital p. Dilambangkan dengan huruf M dan dari" xml:lang="ru-RU" lang="ru-RU">o;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">panah melengkung Efek mesomerik dapat berupa “+” atau “”.
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Substituen yang meningkatkan kerapatan elektron dalam sistem terkonjugasi menunjukkan efek mesomerik positif. Substituen tersebut mengandung atom dengan elektron bebas pasangan elektron atau muatan negatif dan mampu mentransfer elektronnya ke sistem konjugasi yang sama, yaitu;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">donor elektron. (ED);font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">. Mereka mengarahkan reaksi;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">S;font-family:"Times New Roman";vertical-align:sub" xml:lang="en-US" lang="en-US">E;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">di posisi 2,4,6 dan disebut;font-family:"Times New Roman";text-decoration:underline" xml:lang="ru-RU" lang="ru-RU">orientasi;font-family:"Times New Roman";text-decoration:underline" xml:lang="en-US" lang="en-US">I;font-family:"Times New Roman";text-decoration:underline" xml:lang="ru-RU" lang="ru-RU"> jenis
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">ED Contoh:
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Substituen yang menarik elektron dari sistem terkonjugasi menunjukkan M dan disebut;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">akseptor elektron (EA;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">). Ini adalah substituen yang memiliki dua" xml:lang="ru-RU" lang="ru-RU">th;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">koneksi baru
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">benzaldehida
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Tabel 1;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Efek elektronik substituen
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Deputi |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Orientan di C;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">6;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Н;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">5;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">R |
;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">I |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">M |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">A;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">lk;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> (;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">R;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-): CH;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">3;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-, C;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Н;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">5;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">-... |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Orientan ;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">I;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> urutkan: ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">kirim ED ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">alternatif ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">dalam orto- dan para- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">posisi" xml:lang="ru-RU" lang="ru-RU">е;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">nia |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">+ |
|
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Н;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">,;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">N;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Н;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">R;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">,;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">NR;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">2 |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">+ |
|
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Н, Н,;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">R |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">+ |
|
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Н;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">L |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">+ |
|
|
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Orientan ;font-family:"Times New Roman"" xml:lang="en-US" lang="en-US">II;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> jenis: langsung ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">з" xml:lang="ru-RU" lang="ru-RU">а;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">penggantian di meta- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">p" xml:lang="ru-RU" lang="ru-RU">o;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">posisi |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> |
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Bacaan yang disarankan
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Utama
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">1.;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Luzin A.P., Zurabyan S.E.,;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">N. A. Tyukavkina, Kimia organik (buku teks untuk mahasiswa lembaga farmasi dan kedokteran menengah), 2002. P.42 -46, 124-128.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Tambahan
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Egorov A.S., Shatskaya K.P.;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU"> Kimia. Tunjangan tutor bagi pelamar ke universitas
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Kuzmenko N.E., Eremin V.V., Popkov V.A.;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Awal Kimia M., 1998. P. 57-61.
- ;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Ryle S.A., Smith K., Ward R.;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">. Dasar-dasar kimia organik untuk mahasiswa spesialisasi biologi dan kedokteran M.: Mir, 1983.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">4. Ceramah oleh guru.
Beras. ;font-family:"Times New Roman"" xml:lang="-none-" lang="-none-">Pembentukan sistem terkonjugasi pada molekul 1,3-butadiena
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">SN;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">2;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">= CH O CH;font-family:"Times New Roman";vertical-align:sub" xml:lang="ru-RU" lang="ru-RU">3
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Vinil metil eter
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Kombinasi enam ikatan ϭ dengan satu sistem π disebut;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">koneksi aromatik.;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">Siklus enam atom karbon yang dihubungkan oleh ikatan aromatik disebut;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">cincin benzena;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">, atau;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">cincin benzena.
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">р, konjugasi π
;font-family:"Times New Roman"" xml:lang="ru-RU" lang="ru-RU">EA
BAB 2. IKATAN KIMIA DAN SALING MENGARUH ATOM DALAM SENYAWA ORGANIKBAB 2. IKATAN KIMIA DAN SALING MENGARUH ATOM DALAM SENYAWA ORGANIK
Sifat kimia senyawa organik ditentukan oleh jenis ikatan kimia, sifat atom yang terikat dan pengaruh timbal baliknya dalam molekul. Faktor-faktor ini, pada gilirannya, ditentukan oleh struktur elektronik atom dan interaksi orbital atomnya.
2.1. Struktur elektronik atom karbon
Bagian ruang atom yang peluangnya menemukan elektron paling besar disebut orbital atom (AO).
Dalam kimia, konsep orbital hibrid atom karbon dan unsur lainnya banyak digunakan. Konsep hibridisasi sebagai cara untuk menggambarkan penataan ulang orbital diperlukan ketika jumlah elektron tidak berpasangan dalam keadaan dasar suatu atom lebih kecil dari jumlah ikatan yang terbentuk. Contohnya adalah atom karbon, yang dalam semua senyawa memanifestasikan dirinya sebagai unsur tetravalen, tetapi sesuai dengan aturan pengisian orbital, tingkat elektron terluarnya dalam keadaan dasar 1s 2 2s 2 2p 2 hanya mengandung dua elektron yang tidak berpasangan (Gbr. 2). 2.1, A dan Lampiran 2-1). Dalam kasus ini, dipostulasikan bahwa orbital atom yang berbeda, dengan energi yang sama, dapat bercampur satu sama lain, membentuk orbital hibrid dengan bentuk dan energi yang sama.
Orbital hibridisasi, karena tumpang tindih yang lebih besar, membentuk ikatan yang lebih kuat dibandingkan orbital non-hibridisasi.
Bergantung pada jumlah orbital yang mengalami hibridisasi, atom karbon dapat berada di salah satu dari tiga keadaan
Beras. 2.1.Distribusi elektron pada orbital atom karbon dalam keadaan tereksitasi (a), (b) dan hibridisasi (c - sp3,g-sp2, D-sp)
hibridisasi (lihat Gambar 2.1, c-e). Jenis hibridisasi menentukan orientasi AO hibrid dalam ruang dan, akibatnya, geometri molekul, yaitu struktur spasialnya.
Struktur spasial molekul adalah pengaturan bersama atom dan gugus atom di ruang angkasa.
sp 3-Hibridisasi.Ketika empat AO eksternal dari atom karbon tereksitasi (lihat Gambar 2.1, b) - satu orbital 2s dan tiga 2p - dicampur, empat orbital hibrid sp 3 yang setara muncul. Mereka memiliki bentuk "delapan" tiga dimensi, yang salah satu bilahnya jauh lebih besar dari yang lain.
Setiap orbital hibrid diisi dengan satu elektron. Atom karbon dalam keadaan hibridisasi sp 3 memiliki konfigurasi elektronik 1s 2 2(sp 3) 4 (lihat Gambar 2.1, c). Keadaan hibridisasi ini merupakan karakteristik atom karbon dalam hidrokarbon jenuh (alkana) dan, karenanya, pada radikal alkil.
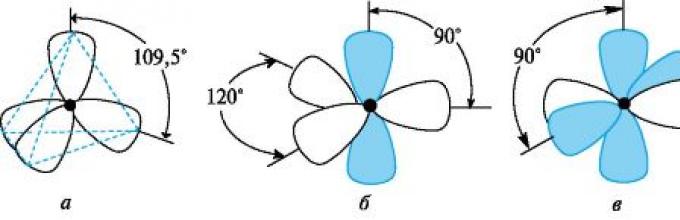
Karena saling tolak menolak, sp 3 -hibrida AO diarahkan dalam ruang menuju simpul segi empat, dan sudut antara keduanya adalah 109,5? (lokasi yang paling menguntungkan; Gambar 2.2, a).
Struktur spasial digambarkan menggunakan rumus stereokimia. Dalam rumus ini, atom karbon terhibridisasi sp 3 dan kedua ikatannya ditempatkan pada bidang gambar dan secara grafis ditunjukkan dengan garis beraturan. Garis tebal atau irisan tebal menunjukkan sambungan yang memanjang ke depan dari bidang gambar dan diarahkan ke pengamat; garis putus-putus atau irisan yang diarsir (..........) - sambungan yang memanjang dari pengamat di luar bidang gambar -

Beras. 2.2.Jenis hibridisasi atom karbon. Titik di tengah adalah inti atom (fraksi kecil orbital hibrid dihilangkan untuk menyederhanakan gambar; p-AO non-hibridisasi ditampilkan dalam warna)
nyonya (Gbr. 2.3, a). Atom karbon berada dalam keadaan sp 3-hibridisasi memiliki konfigurasi tetrahedral.
sp 2-Hibridisasi.Saat mencampur satu 2s- dan dua 2p-AO dari atom karbon tereksitasi, tiga atom setara terbentuk sp orbital 2-hibrida dan tetap 2p-AO yang tidak terhibridisasi. Atom karbon berada dalam keadaan sp Hibridisasi 2 memiliki konfigurasi elektronik 1s 2 2(sp 2) 3 2p 1 (lihat Gambar 2.1, d). Keadaan hibridisasi atom karbon ini khas untuk hidrokarbon tak jenuh (alkena), serta beberapa gugus fungsi, seperti karbonil dan karboksil.
sp 2 -Orbital terhibridisasi terletak pada bidang yang sama dengan sudut 120?, dan AO non-hibridisasi terletak pada bidang tegak lurus (lihat Gambar 2.2, b). Atom karbon berada dalam keadaan sp 2-hibridisasi memiliki konfigurasi trigonal. Atom karbon yang dihubungkan oleh ikatan rangkap berada pada bidang gambar, dan ikatan tunggalnya yang arahnya menuju dan menjauhi pengamat ditunjukkan seperti dijelaskan di atas (lihat Gambar 2.3, B).
sp-Hibridisasi.Ketika satu orbital 2s- dan satu 2p dari atom karbon tereksitasi dicampur, dua AO hibrid sp yang setara terbentuk, dan dua p-AO tetap tidak terhibridisasi. Atom karbon dalam keadaan hibridisasi sp memiliki konfigurasi elektronik

Beras. 2.3.Rumus stereokimia metana (a), etana (b) dan asetilena (c)
1s 2 2(sp 2) 2 2p 2 (lihat Gambar 2.1, d). Keadaan hibridisasi atom karbon ini terjadi pada senyawa yang memiliki ikatan rangkap tiga, misalnya pada alkuna dan nitril.
Orbital terhibridisasi sp terletak pada sudut 180°, dan dua AO non-hibridisasi terletak pada bidang yang saling tegak lurus (lihat Gambar 2.2, c). Atom karbon dalam keadaan hibridisasi sp memiliki konfigurasi linier misalnya, dalam molekul asetilena, keempat atom berada pada garis lurus yang sama (lihat Gambar 2.3, V).
Atom unsur organogenik lainnya mungkin juga berada dalam keadaan hibridisasi.
2.2. Ikatan kimia atom karbon
Ikatan kimia dalam senyawa organik terutama diwakili oleh ikatan kovalen.
Ikatan kovalen adalah ikatan kimia yang terbentuk sebagai hasil pembagian elektron antar atom yang terikat.
Elektron bersama ini menempati orbital molekul (MO). Biasanya, MO adalah orbital multisenter dan elektron yang mengisinya terdelokalisasi (tersebar). Jadi, MO, seperti AO, bisa kosong, diisi dengan satu elektron atau dua elektron dengan spin berlawanan*.
2.2.1. σ- Danπ -Koneksi
Ada dua jenis ikatan kovalen: ikatan σ (sigma) dan π (pi).
Ikatan σ adalah ikatan kovalen yang terbentuk ketika AO tumpang tindih sepanjang garis lurus (sumbu) yang menghubungkan inti dua atom yang terikat dengan tumpang tindih maksimum pada garis lurus tersebut.
Ikatan σ terjadi ketika AO mana pun, termasuk AO hibrida, tumpang tindih. Gambar 2.4 menunjukkan pembentukan ikatan antara atom karbon sebagai akibat dari tumpang tindih aksial ikatan hibrid sp 3 -AO dan C-H dengan tumpang tindih hibrid sp 3 -AO karbon dan s-AO hidrogen.
* Untuk lebih jelasnya lihat: Popkov V.A., Puzakov S.A. Kimia umum. - M.: GEOTAR-Media, 2007. - Bab 1.

Beras. 2.4.Pembentukan ikatan σ dalam etana melalui tumpang tindih aksial AO (fraksi kecil orbital hibrid dihilangkan dan ditampilkan dalam warna sp 3 -AO karbon, hitam - s-AO hidrogen)
Selain tumpang tindih aksial, jenis tumpang tindih lain juga mungkin terjadi - tumpang tindih lateral p-AO, yang mengarah pada pembentukan ikatan (Gbr. 2.5).
orbital atom p

Beras. 2.5.Pembentukan ikatan π dalam etilen melalui tumpang tindih lateral r-AO
Ikatan π adalah ikatan yang dibentuk oleh tumpang tindih lateral p-AO tak terhibridisasi dengan tumpang tindih maksimum pada kedua sisi garis lurus yang menghubungkan inti atom.
Ikatan rangkap yang terdapat pada senyawa organik merupakan gabungan ikatan σ- dan π: rangkap dua - satu σ- dan satu π-, rangkap tiga - satu ikatan σ- dan dua ikatan π.
Sifat-sifat ikatan kovalen dinyatakan melalui karakteristik seperti energi, panjang, polaritas, dan kemampuan polarisasi.
Energi komunikasiadalah energi yang dilepaskan ketika suatu ikatan terbentuk atau diperlukan untuk memisahkan dua atom yang terikat. Ini berfungsi sebagai ukuran kekuatan ikatan: semakin tinggi energinya, semakin kuat ikatannya (Tabel 2.1).
Panjang tautanadalah jarak antara pusat atom yang terikat. Ikatan rangkap lebih pendek dari ikatan tunggal, dan ikatan rangkap tiga lebih pendek dari ikatan rangkap (lihat Tabel 2.1). Ikatan antara atom karbon dalam keadaan hibridisasi yang berbeda memiliki pola yang sama -
Tabel 2.1.Ciri-ciri dasar ikatan kovalen

Ketika fraksi orbital s pada orbital hibrid bertambah, panjang ikatan berkurang. Misalnya pada rangkaian senyawa propana CH 3 CH 2 CH 3, propena CH 3 CH=CH 2, propuna CH 3 C=CH panjang ikatan CH 3 -C sama dengan 0,154; 0,150 dan 0,146nm.
Polaritas komunikasi karena distribusi kerapatan elektron yang tidak merata (polarisasi). Polaritas suatu molekul diukur dengan nilai momen dipolnya. Dari momen dipol suatu molekul, momen dipol ikatan individu dapat dihitung (lihat Tabel 2.1). Semakin besar momen dipol maka semakin polar ikatannya. Alasan polaritas ikatan adalah perbedaan keelektronegatifan atom-atom yang terikat.
Keelektronegatifan mencirikan kemampuan atom dalam molekul untuk menahan elektron valensi. Ketika keelektronegatifan suatu atom meningkat, derajat perpindahan elektron ikatan ke arahnya meningkat.
Berdasarkan nilai energi ikatan, ahli kimia Amerika L. Pauling (1901-1994) mengusulkan karakteristik kuantitatif elektronegativitas relatif atom (skala Pauling). Dalam skala (deret) ini, unsur-unsur organogen tipikal disusun menurut keelektronegatifan relatif (diberikan dua logam sebagai perbandingan) sebagai berikut:
Keelektronegatifan bukanlah suatu konstanta mutlak suatu unsur. Itu tergantung pada muatan efektif inti, jenis hibridisasi AO dan pengaruh substituen. Misalnya, keelektronegatifan atom karbon dalam keadaan hibridisasi sp 2 atau sp lebih tinggi daripada dalam keadaan hibridisasi sp 3, yang dikaitkan dengan peningkatan proporsi orbital s dalam orbital hibrid. Selama transisi atom dari sp 3 - ke sp 2 - dan selanjutnya ke sp-keadaan hibridisasi, luas orbital hibrid secara bertahap berkurang (terutama pada arah yang memberikan tumpang tindih terbesar selama pembentukan ikatan σ), yang berarti bahwa dalam urutan yang sama kerapatan elektron maksimum terletak semakin dekat ke inti. dari atom yang sesuai.
Dalam kasus ikatan kovalen non-polar atau praktis non-polar, perbedaan keelektronegatifan atom-atom yang terikat adalah nol atau mendekati nol. Ketika perbedaan keelektronegatifan meningkat, polaritas ikatan meningkat. Selisih hingga 0,4 dikatakan polar lemah, lebih dari 0,5 disebut ikatan kovalen polar kuat, dan lebih dari 2,0 disebut ikatan ionik. Ikatan kovalen polar rentan terhadap pembelahan heterolitik
(lihat 3.1.1).
Polarisasi ikatan dinyatakan dalam perpindahan elektron ikatan di bawah pengaruh eksternal Medan listrik, termasuk partikel lain yang bereaksi. Polarisabilitas ditentukan oleh mobilitas elektron. Elektron semakin mobile jika semakin jauh jaraknya dari inti atom. Dalam hal polarisasi, ikatan π jauh lebih unggul daripada ikatan σ, karena kerapatan elektron maksimum ikatan π terletak lebih jauh dari inti yang terikat. Polarisabilitas sangat menentukan reaktivitas molekul terhadap reagen polar.
2.2.2. Obligasi donor-akseptor
Tumpang tindih dua AO satu elektron bukanlah satu-satunya cara untuk membentuk ikatan kovalen. Ikatan kovalen dapat dibentuk melalui interaksi orbital dua elektron suatu atom (donor) dengan orbital kosong atom lain (akseptor). Donor adalah senyawa yang mengandung orbital dengan pasangan elektron bebas atau π-MO. Pembawa pasangan elektron bebas (n-elektron, dari bahasa Inggris. tidak terikat) adalah atom nitrogen, oksigen, halogen.
Pasangan elektron bebas berperan penting dalam manifestasi sifat kimia suatu senyawa. Secara khusus, mereka bertanggung jawab atas kemampuan senyawa untuk masuk ke dalam interaksi donor-akseptor.
Ikatan kovalen yang dibentuk oleh sepasang elektron dari salah satu mitra ikatan disebut donor-akseptor.

Hasilnya ikatan donor-akseptor hanya berbeda dalam metode pendidikannya; sifat-sifatnya identik dengan ikatan kovalen lainnya. Atom donor memperoleh muatan positif.
Ikatan donor-akseptor merupakan ciri senyawa kompleks.
2.2.3. Ikatan hidrogen
Atom hidrogen yang terikat pada unsur yang sangat elektronegatif (nitrogen, oksigen, fluor, dll.) mampu berinteraksi dengan pasangan elektron bebas dari atom lain yang cukup elektronegatif dari molekul yang sama atau lainnya. Akibatnya timbul ikatan hidrogen yang merupakan salah satu jenis ikatan donor.
ikatan akseptor. Secara grafis, ikatan hidrogen biasanya diwakili oleh tiga titik.
Energi ikatan hidrogen rendah (10-40 kJ/mol) dan terutama ditentukan oleh interaksi elektrostatik.
Ikatan hidrogen antarmolekul menentukan hubungan senyawa organik, seperti alkohol.

Ikatan hidrogen mempengaruhi sifat fisik (titik didih dan leleh, viskositas, karakteristik spektral) dan sifat kimia (asam basa) senyawa. Jadi, titik didih etanol adalah C 2 jam 5 OH (78,3°C) secara signifikan lebih tinggi dibandingkan dimetil eter CH 3 OCH 3 (-24°C), yang memiliki berat molekul sama dan tidak terikat melalui ikatan hidrogen.
Ikatan hidrogen juga bisa bersifat intramolekul. Ikatan dalam anion asam salisilat ini menyebabkan peningkatan keasamannya.
Ikatan hidrogen memainkan peran penting dalam pembentukan struktur spasial senyawa bermolekul tinggi - protein, polisakarida, asam nukleat.
2.3. Sistem konjugasi
Ikatan kovalen dapat terlokalisasi atau terdelokalisasi. Ikatan terlokalisasi adalah ikatan yang elektronnya terbagi antara dua inti atom yang terikat. Jika elektron ikatan digunakan bersama antara lebih dari dua inti, maka hal ini disebut ikatan terdelokalisasi.
Ikatan terdelokalisasi adalah ikatan kovalen yang orbital molekulnya menjangkau lebih dari dua atom.
Obligasi yang terdelokalisasi dalam banyak kasus adalah obligasi π. Mereka adalah karakteristik dari sistem berpasangan. Dalam sistem ini, terjadi jenis khusus pengaruh timbal balik atom—konjugasi.
Konjugasi (mesomerisme, dari bahasa Yunani. meso- rata-rata) adalah keselarasan ikatan dan muatan dalam molekul (partikel) nyata dibandingkan dengan struktur ideal, tetapi tidak ada.
Orbital p terdelokalisasi yang terlibat dalam konjugasi dapat berasal dari dua atau lebih ikatan π, atau ikatan π dan satu atom dengan orbital p. Sesuai dengan ini, perbedaan dibuat antara konjugasi π,π dan konjugasi ρ,π. Sistem konjugasi dapat terbuka atau tertutup dan tidak hanya mengandung atom karbon, tetapi juga heteroatom.
2.3.1. Sistem sirkuit terbuka
π,π -Memasangkan. Perwakilan paling sederhana dari sistem terkonjugasi π,π dengan rantai karbon adalah butadiena-1,3 (Gbr. 2.6, a). Atom karbon dan hidrogen dan, oleh karena itu, semua ikatan σ dalam molekulnya terletak pada bidang yang sama, membentuk kerangka datar. Atom karbon berada dalam keadaan hibridisasi sp2. P-AO yang tidak terhibridisasi dari setiap atom karbon terletak tegak lurus terhadap bidang kerangka dan sejajar satu sama lain, yang merupakan kondisi yang diperlukan untuk tumpang tindihnya. Tumpang tindih terjadi tidak hanya antara p-AO atom C-1 dan C-2, C-3 dan C-4, tetapi juga antara p-AO atom C-2 dan C-3, sehingga mengakibatkan terbentuknya satu π menutupi empat atom karbon -sistem, yaitu, ikatan kovalen terdelokalisasi muncul (lihat Gambar 2.6, b).

Beras. 2.6.Model orbital atom dari molekul 1,3 butadiena
Hal ini tercermin dari perubahan panjang ikatan dalam molekul. Panjang ikatan C-1-C-2 dan C-3-C-4 pada 1,3-butadiena sedikit bertambah, dan jarak antara C-2 dan C-3 diperpendek dibandingkan ikatan rangkap dan C-3 konvensional. obligasi tunggal. Dengan kata lain, proses delokalisasi elektron menyebabkan pemerataan panjang ikatan.
Hidrokarbon dengan jumlah yang besar ikatan rangkap terkonjugasi umum terjadi di dunia tumbuhan. Ini termasuk, misalnya, karoten, yang menentukan warna wortel, tomat, dll.
Sistem konjugasi terbuka juga dapat mencakup heteroatom. Contoh terbuka π, sistem terkonjugasi π dengan heteroatom dalam rantai Senyawa karbonil tak jenuh α,β dapat berfungsi. Misalnya gugus aldehida pada akrolein CH 2 =CH-CH=O adalah peserta dalam rantai konjugasi tiga atom karbon hibridisasi sp 2 dan satu atom oksigen. Masing-masing atom ini menyumbangkan satu elektron p ke sistem π tunggal.
pn-Memasangkan.Jenis konjugasi ini paling sering terjadi pada senyawa yang mengandung fragmen struktur -CH=CH-X, dengan X adalah heteroatom yang memiliki pasangan elektron bebas (terutama O atau N). Ini termasuk, misalnya, vinil eter, yang molekulnya terkonjugasi dengan ikatan rangkap R-orbital atom oksigen. Ikatan tiga pusat yang terdelokalisasi dibentuk dengan tumpang tindih dua atom karbon hibridisasi p-AO sp 2 dan satu R-AO dari heteroatom dengan sepasang n-elektron.

Pembentukan ikatan tiga pusat terdelokalisasi serupa terjadi pada gugus karboksil. Di sini, elektron π dari ikatan C=O dan n-elektron atom oksigen dari gugus OH berpartisipasi dalam konjugasi. Sistem terkonjugasi dengan ikatan dan muatan yang selaras mencakup spesies bermuatan negatif, seperti ion asetat.

Arah pergeseran kerapatan elektron ditunjukkan dengan panah melengkung.
Ada cara grafis lain untuk menampilkan hasil pemasangan. Jadi, struktur ion asetat (I) mengasumsikan bahwa muatan terdistribusi secara merata pada kedua atom oksigen (seperti yang ditunjukkan pada Gambar 2.7, dan ini benar).
Struktur (II) dan (III) digunakan dalam teori resonansi. Menurut teori ini, molekul atau partikel nyata digambarkan oleh sekumpulan struktur resonansi tertentu, yang berbeda satu sama lain hanya dalam distribusi elektron. Dalam sistem terkonjugasi, kontribusi utama terhadap hibrid resonansi dibuat oleh struktur dengan distribusi kerapatan elektron π yang berbeda (panah dua sisi yang menghubungkan struktur ini adalah simbol khusus teori resonansi).
Struktur pembatas (batas) sebenarnya tidak ada. Namun, sampai tingkat tertentu, mereka “berkontribusi” pada distribusi nyata kerapatan elektron dalam suatu molekul (partikel), yang direpresentasikan sebagai hibrida resonansi yang diperoleh dengan superposisi struktur pembatas.
Dalam sistem terkonjugasi ρ,π dengan rantai karbon, konjugasi dapat terjadi jika terdapat atom karbon dengan orbital p non-hibridisasi di sebelah ikatan π. Sistem tersebut dapat berupa partikel perantara - karbanion, karbokation, radikal bebas, misalnya, dengan struktur alilik. Gugus alilik radikal bebas memainkan peran penting dalam proses peroksidasi lipid.
Dalam anion alil CH 2 =CH-CH 2 sp 2 - atom karbon hibridisasi C-3 disuplai ke konjugat umum

Beras. 2.7.Peta kerapatan elektron gugus COONa dalam penisilin
sistem dua elektron, dalam radikal alilik CH 2 =CH-CH 2+ - satu, dan dalam karbokation alilik CH 2 =CH-CH 2+ tidak menyediakan apapun. Akibatnya, ketika p-AO dari tiga atom karbon terhibridisasi sp 2, terbentuk ikatan tiga pusat yang terdelokalisasi yang mengandung empat elektron (dalam karbanion), tiga (dalam radikal bebas) dan dua (dalam karbokation) elektron. , masing-masing.

Secara formal, atom C-3 pada kation alil membawa muatan positif, pada radikal alil membawa elektron tidak berpasangan, dan pada anion alil membawa muatan negatif. Faktanya, dalam sistem terkonjugasi seperti itu terjadi delokalisasi (penyebaran) kerapatan elektron, yang mengarah pada penyelarasan ikatan dan muatan. Atom C-1 dan C-3 dalam sistem ini setara. Misalnya, dalam kation alil, masing-masing kation membawa muatan positif+1/2 dan dihubungkan oleh ikatan satu setengah ke atom C-2.
Dengan demikian, konjugasi menghasilkan perbedaan yang signifikan dalam distribusi kerapatan elektron pada struktur nyata dibandingkan dengan struktur yang digambarkan oleh rumus struktur konvensional.
2.3.2. Sistem loop tertutup
Sistem terkonjugasi siklik sangat menarik sebagai kelompok senyawa dengan stabilitas termodinamika yang lebih tinggi dibandingkan dengan sistem terkonjugasi. sistem terbuka. Senyawa-senyawa ini juga mempunyai sifat-sifat khusus lainnya yang totalitasnya digabungkan konsep umum aromatisitas. Ini termasuk kemampuan senyawa tak jenuh formal tersebut
terlibat dalam reaksi substitusi daripada adisi, ketahanan terhadap zat pengoksidasi dan suhu.
Perwakilan khas dari sistem aromatik adalah arena dan turunannya. Keunikan struktur elektronik hidrokarbon aromatik termanifestasi dengan jelas dalam model orbital atom molekul benzena. Kerangka benzena dibentuk oleh enam atom karbon hibridisasi sp2. Semua ikatan σ (C-C dan C-H) terletak pada bidang yang sama. Enam p-AO yang tidak terhibridisasi terletak tegak lurus terhadap bidang molekul dan sejajar satu sama lain (Gbr. 2.8, a). Setiap R-AO bisa sama-sama tumpang tindih dengan dua tetangganya R-AO. Sebagai hasil dari tumpang tindih tersebut, muncul sistem π tunggal yang terdelokalisasi, kerapatan elektron tertinggi yang terletak di atas dan di bawah bidang kerangka σ dan mencakup semua atom karbon dalam siklus (lihat Gambar 2.8, b) . Kerapatan π-Elektron didistribusikan secara merata ke seluruh sistem siklik, yang ditunjukkan dengan lingkaran atau garis putus-putus di dalam siklus (lihat Gambar 2.8, c). Semua ikatan antar atom karbon pada cincin benzena mempunyai panjang yang sama (0,139 nm), berada di antara panjang ikatan tunggal dan rangkap.
Berdasarkan perhitungan mekanika kuantum, ditemukan bahwa untuk pembentukan molekul stabil seperti itu, sistem siklik datar harus mengandung (4n + 2) elektron π, di mana N= 1, 2, 3, dst. (Aturan Hückel, 1931). Dengan mempertimbangkan data ini, konsep “aromatisitas” dapat dikonkretkan.
Suatu senyawa dikatakan aromatik jika mempunyai cincin planar dan konjugatπ -sistem elektronik yang mencakup semua atom dalam siklus dan mengandung(4n+ 2) π-elektron.
Aturan Hückel berlaku untuk semua sistem kondensasi planar di mana tidak ada atom yang digunakan bersama lebih dari satu

Beras. 2.8.Model orbital atom molekul benzena (atom hidrogen dihilangkan; penjelasan dalam teks)
dua siklus. Senyawa dengan cincin benzena terkondensasi, seperti naftalena dan lain-lain, memenuhi kriteria aromatisitas.

Stabilitas sistem berpasangan. Pembentukan sistem terkonjugasi dan terutama sistem aromatik merupakan proses yang menguntungkan secara energetik, karena hal ini meningkatkan tingkat tumpang tindih orbital dan terjadi delokalisasi (penyebaran). R-elektron. Dalam hal ini, sistem terkonjugasi dan aromatik telah meningkatkan stabilitas termodinamika. Mereka mengandung lebih sedikit pasokan energi internal dan menempati tingkat energi yang lebih rendah dalam keadaan dasar dibandingkan dengan sistem non-konjugasi. Dari perbedaan antara level-level ini, seseorang dapat mengukur stabilitas termodinamika senyawa terkonjugasi, yaitu kestabilan termodinamika senyawa terkonjugasinya. energi konjugasi(energi delokalisasi). Untuk butadiena-1,3 ukurannya kecil dan berjumlah sekitar 15 kJ/mol. Dengan bertambahnya panjang rantai terkonjugasi, energi konjugasi dan stabilitas termodinamika senyawa meningkat. Energi konjugasi benzena jauh lebih tinggi yaitu 150 kJ/mol.
2.4. Efek elektronik substituen 2.4.1. Efek induktif
Ikatan σ polar dalam suatu molekul menyebabkan polarisasi ikatan σ di dekatnya dan menyebabkan munculnya muatan parsial pada atom tetangga*.
Substituen menyebabkan polarisasi tidak hanya pada substituennya sendiri, tetapi juga pada ikatan σ yang berdekatan. Jenis perpindahan pengaruh atom ini disebut efek induktif (/-efek).
Efek induktif adalah perpindahan pengaruh elektronik substituen akibat perpindahan elektron ikatan σ.
Karena lemahnya polarisasi ikatan σ, efek induktif memudar setelah tiga atau empat ikatan dalam rangkaian. Efeknya paling menonjol dalam kaitannya dengan atom karbon yang berdekatan dengan atom yang memiliki substituen. Arah efek induktif substituen dinilai secara kualitatif dengan membandingkannya dengan atom hidrogen, yang efek induktifnya dianggap nol. Secara grafis, hasil efek / diwakili oleh panah yang bertepatan dengan posisi garis valensi dan mengarah ke atom yang lebih elektronegatif.
/V\lebih kuat dari atom hidrogen, pamerannegatifefek induktif (-/- efek).
Substituen seperti ini umumnya mengurangi kerapatan elektron sistem; mereka disebut penarikan elektron. Ini termasuk sebagian besar gugus fungsi: OH, NH 2, COOH, TIDAK 2 dan gugus kationik, misalnya -NH 3+.
Substituen yang menggeser kerapatan elektron dibandingkan dengan atom hidrogenσ -ikatan terhadap atom karbon rantai, pameranpositifefek induktif (+/- efek).
Substituen seperti itu meningkatkan kerapatan elektron dalam rantai (atau cincin) dan disebut donor elektron. Ini termasuk gugus alkil yang terletak pada atom karbon terhibridisasi sp2, dan pusat anionik pada partikel bermuatan, misalnya -O -.
2.4.2. Efek mesomerik
Dalam sistem terkonjugasi, elektron π dari ikatan kovalen terdelokalisasi memainkan peran utama dalam transmisi pengaruh elektronik. Efek yang diwujudkan dalam pergeseran kerapatan elektron dari sistem π yang terdelokalisasi (terkonjugasi) disebut mesomerik (efek M), atau efek konjugasi.
Efek mesomerik adalah transfer pengaruh elektronik substituen melalui sistem terkonjugasi.
Dalam hal ini wakilnya sendiri merupakan peserta dalam sistem berpasangan. Ia dapat memasukkan ke dalam sistem konjugasi baik ikatan π (karbonil, gugus karboksil, dll.), atau pasangan elektron bebas heteroatom (gugus amino dan hidroksi), atau p-AO yang kosong atau berisi satu elektron.
Substituen yang meningkatkan kerapatan elektron dalam sistem terkonjugasi ditunjukkanpositifefek mesomerik (+M-efek).
Efek M ditunjukkan oleh substituen yang mencakup atom dengan pasangan elektron bebas (misalnya, gugus amino dalam molekul anilin) atau seluruh muatan negatif. Substituen ini mampu
untuk transfer sepasang elektron ke sistem konjugasi yang sama, yaitu mereka donor elektron.
Substituen yang menurunkan kerapatan elektron dalam sistem terkonjugasi ditunjukkannegatifefek mesomerik (efek -M-).
Efek M dalam sistem terkonjugasi disebabkan oleh atom oksigen atau nitrogen yang dihubungkan oleh ikatan rangkap dengan atom karbon, seperti yang ditunjukkan pada contoh asam akrilat dan benzaldehida. Kelompok seperti itu adalah penarikan elektron.


Pergeseran kerapatan elektron ditunjukkan dengan panah melengkung, yang awalnya menunjukkan elektron p atau π mana yang dipindahkan, dan ujungnya menunjukkan ikatan atau atom ke mana elektron tersebut dipindahkan. Efek mesomerik, berbeda dengan efek induktif, ditransmisikan melalui sistem ikatan terkonjugasi dalam jarak yang jauh lebih jauh.
Saat menilai pengaruh substituen terhadap distribusi kerapatan elektron dalam suatu molekul, perlu memperhitungkan efek yang dihasilkan dari efek induktif dan mesomerik (Tabel 2.2).
Tabel 2.2.Efek elektronik dari beberapa substituen

Efek elektronik substituen memungkinkan penilaian kualitatif distribusi kerapatan elektron dalam molekul yang tidak bereaksi dan memprediksi sifat-sifatnya.
Kimia organik- cabang kimia yang mempelajari senyawa karbon, struktur, sifat, dan interkonversinya.
Nama disiplin ilmu ini - "kimia organik" - muncul sejak lama. Alasannya terletak pada kenyataan bahwa sebagian besar senyawa karbon ditemukan oleh para peneliti di tahap awal pembentukan ilmu kimia, berasal dari tumbuhan atau hewan. Namun, sebagai pengecualian, senyawa karbon individu diklasifikasikan sebagai anorganik. Misalnya, karbon oksida dianggap sebagai zat anorganik. asam karbonat, karbonat, bikarbonat, hidrogen sianida dan beberapa lainnya.
Saat ini, hanya kurang dari 30 juta zat organik berbeda yang diketahui, dan daftar ini terus bertambah. Sejumlah besar senyawa organik terutama dikaitkan dengan sifat spesifik karbon berikut:
1) atom karbon dapat dihubungkan satu sama lain dalam rantai dengan panjang yang berubah-ubah;
2) tidak hanya hubungan berurutan (linier) atom karbon satu sama lain yang dimungkinkan, tetapi juga hubungan bercabang dan bahkan siklik;
3) mungkin jenis yang berbeda ikatan antar atom karbon yaitu tunggal, rangkap dua, dan rangkap tiga. Apalagi valensi karbon dalam senyawa organik selalu empat.
Selain itu, beragamnya senyawa organik juga difasilitasi oleh fakta bahwa atom karbon mampu membentuk ikatan dengan banyak atom lainnya. unsur kimia, misalnya hidrogen, oksigen, nitrogen, fosfor, belerang, halogen. Dalam hal ini, hidrogen, oksigen, dan nitrogen adalah yang paling umum.
Perlu dicatat bahwa untuk waktu yang cukup lama kimia organik mewakili “hutan gelap” bagi para ilmuwan. Untuk beberapa waktu, teori vitalisme bahkan populer dalam sains, yang menyatakan bahwa zat organik tidak dapat diperoleh “secara artifisial”, yaitu dengan menggunakan bahan organik. di luar materi hidup. Namun teori vitalisme tidak bertahan lama, karena ditemukan satu demi satu zat yang dapat disintesis di luar organisme hidup.
Para peneliti dibuat bingung oleh kenyataan bahwa banyak zat organik memiliki komposisi kualitatif dan kuantitatif yang sama, namun seringkali memiliki sifat fisik dan kimia yang sangat berbeda. Misalnya, dimetil eter dan etil alkohol memiliki komposisi unsur yang persis sama, tetapi dalam kondisi normal dimetil eter berbentuk gas, dan etil alkohol berbentuk cair. Selain itu, dimetil eter tidak bereaksi dengan natrium, tetapi etil alkohol bereaksi dengannya, melepaskan gas hidrogen.
Para peneliti abad ke-19 mengemukakan banyak asumsi mengenai bagaimana zat organik disusun. Asumsi yang sangat penting dikemukakan oleh ilmuwan Jerman F.A. Kekule, yang merupakan orang pertama yang mengungkapkan gagasan bahwa atom dari unsur kimia yang berbeda memiliki nilai valensi tertentu, dan atom karbon dalam senyawa organik bersifat tetravalen dan mampu bergabung satu sama lain untuk membentuk rantai. Belakangan, berdasarkan asumsi Kekule, ilmuwan Rusia Alexander Mikhailovich Butlerov mengembangkan teori tentang struktur senyawa organik, yang tidak kehilangan relevansinya di zaman kita. Mari kita perhatikan ketentuan utama teori ini:
1) semua atom dalam molekul zat organik terikat satu sama lain dalam urutan tertentu sesuai dengan valensinya. Atom karbon memiliki valensi konstan empat dan dapat membentuk rantai dengan struktur berbeda satu sama lain;
2) sifat fisik dan kimia suatu zat organik tidak hanya bergantung pada komposisi molekulnya, tetapi juga pada urutan atom-atom dalam molekul tersebut terhubung satu sama lain;
3) atom individu, serta kelompok atom dalam suatu molekul, saling mempengaruhi. Saling mempengaruhi ini tercermin pada sifat fisik dan kimia senyawa;
4) dengan mempelajari sifat fisika dan kimia suatu senyawa organik, dapat diketahui strukturnya. Kebalikannya juga benar - mengetahui struktur molekul suatu zat tertentu, Anda dapat memprediksi sifat-sifatnya.
Mirip dengan caranya hukum periodik D.I.Mendelev menjadi landasan ilmiah kimia anorganik, teori struktur zat organik A.M. Butlerov sebenarnya menjadi titik tolak perkembangan kimia organik sebagai ilmu pengetahuan. Perlu dicatat bahwa setelah teori struktur Butlerov tercipta, kimia organik mulai berkembang dengan sangat pesat.
Isomerisme dan homologi
Menurut posisi kedua teori Butlerov, sifat-sifat zat organik tidak hanya bergantung pada komposisi kualitatif dan kuantitatif molekul, tetapi juga pada urutan atom-atom dalam molekul tersebut terhubung satu sama lain.
Dalam hal ini, fenomena isomerisme tersebar luas pada zat organik.
Isomerisme adalah fenomena ketika zat yang berbeda memiliki komposisi molekul yang persis sama, yaitu. rumus molekul yang sama.
Seringkali, isomer sangat berbeda dalam sifat fisik dan kimianya. Misalnya:
Jenis isomerisme
Isomerisme struktural
a) Isomerisme kerangka karbon
b) Isomerisme posisi:
banyak koneksi
deputi:
kelompok fungsional:
c) Isomerisme antarkelas:
Isomerisme antar kelas terjadi ketika senyawa yang merupakan isomer termasuk dalam kelas yang berbeda senyawa organik.
Isomerisme spasial
Isomerisme spasial adalah fenomena ketika zat-zat berbeda dengan urutan ikatan atom yang sama satu sama lain berbeda satu sama lain dengan posisi atom atau kelompok atom yang tetap-berbeda dalam ruang.
Ada dua jenis isomerisme spasial - geometris dan optik. Tugas isomerisme optik tidak ditemukan pada Ujian Negara Terpadu, jadi kami hanya akan mempertimbangkan tugas geometris.
Jika molekul suatu senyawa mengandung ikatan rangkap C=C atau cincin, terkadang dalam kasus seperti itu fenomena geometri atau cis-trans-isomerisme.
Misalnya, jenis isomerisme ini dimungkinkan untuk butena-2. Artinya adalah bahwa ikatan rangkap antara atom karbon sebenarnya mempunyai struktur datar, dan substituen pada atom karbon ini dapat ditempatkan secara tetap di atas atau di bawah bidang ini:

Ketika substituen yang identik berada pada sisi bidang yang sama, mereka mengatakan demikian cis-isomer, dan bila berbeda - kesurupan-isomer.
Aktif dalam bentuk rumus struktur cis- Dan kesurupan-isomer (menggunakan butena-2 sebagai contoh) digambarkan sebagai berikut:
Perhatikan bahwa isomerisme geometri tidak mungkin terjadi jika setidaknya satu atom karbon pada ikatan rangkap memiliki dua substituen yang identik. Misalnya, cis-trans- isomerisme tidak mungkin terjadi pada propena:
 Propen tidak punya cis-trans-isomer, karena salah satu atom karbon pada ikatan rangkap memiliki dua “substituen” yang identik (atom hidrogen)
Propen tidak punya cis-trans-isomer, karena salah satu atom karbon pada ikatan rangkap memiliki dua “substituen” yang identik (atom hidrogen) Terlihat dari ilustrasi di atas, jika radikal metil dan atom hidrogen yang terletak pada atom karbon kedua ditukar, sisi yang berbeda pesawat, kita mendapatkan molekul yang sama yang baru saja kita lihat dari sisi lain.
Pengaruh atom dan gugus atom satu sama lain dalam molekul senyawa organik
Konsep struktur kimia sebagai rangkaian atom yang terhubung satu sama lain diperluas secara signifikan dengan munculnya teori elektronik. Dari sudut pandang teori ini, dimungkinkan untuk menjelaskan bagaimana atom dan kelompok atom dalam suatu molekul saling mempengaruhi.
Ada dua kemungkinan cara di mana satu bagian molekul mempengaruhi bagian lainnya:
1) Efek induktif
2) Efek mesomerik
Efek induktif
Untuk mendemonstrasikan fenomena ini, mari kita ambil contoh molekul 1-kloropropana (CH 3 CH 2 CH 2 Cl). Ikatan antara atom karbon dan klor bersifat polar karena klor memiliki keelektronegatifan yang jauh lebih tinggi dibandingkan karbon. Akibat pergeseran kerapatan elektron dari atom karbon ke atom klor, terbentuk muatan parsial positif (δ+) pada atom karbon, dan muatan parsial negatif (δ-) terbentuk pada atom klor:
Pergeseran kerapatan elektron dari satu atom ke atom lainnya sering kali ditandai dengan tanda panah yang mengarah ke atom yang lebih elektronegatif:
Namun, hal yang menarik adalah, selain pergeseran kerapatan elektron dari atom karbon pertama ke atom klor, juga terjadi pergeseran, namun dalam tingkat yang sedikit lebih kecil, dari atom karbon kedua ke atom karbon pertama. seperti dari yang ketiga ke yang kedua:
Pergeseran kerapatan elektron sepanjang rantai ikatan σ disebut efek induktif ( SAYA). Efek ini memudar seiring dengan jarak dari kelompok yang mempengaruhi dan praktis tidak muncul setelah ikatan 3 σ.
Dalam hal suatu atom atau sekelompok atom mempunyai keelektronegatifan lebih besar dibandingkan dengan atom karbon, substituen tersebut dikatakan mempunyai efek induktif negatif (- SAYA). Jadi, dalam contoh yang dibahas di atas, atom klor mempunyai efek induktif negatif. Selain klorin, substituen berikut juga memiliki efek induktif negatif:
–F, –Cl, –Br, –I, –OH, –NH 2 , –CN, –NO 2 , –COH, –COOH
Jika keelektronegatifan suatu atom atau sekelompok atom lebih kecil dari keelektronegatifan atom karbon, maka sebenarnya terjadi perpindahan kerapatan elektron dari substituen tersebut ke atom karbon. Dalam hal ini dikatakan bahwa substituen mempunyai efek induktif positif (+ SAYA) (adalah donor elektron).
Jadi, substituen dengan + SAYA-efeknya adalah radikal hidrokarbon jenuh. Pada saat yang sama, ekspresi + SAYA-efek meningkat dengan pemanjangan radikal hidrokarbon:
–CH 3 , –C 2 H 5 , –C 3 H 7 , –C 4 H 9
Perlu dicatat bahwa atom karbon yang terletak pada keadaan valensi berbeda juga memiliki keelektronegatifan yang berbeda. Atom karbon dalam keadaan terhibridisasi sp 2 memiliki keelektronegatifan yang lebih besar dibandingkan dengan atom karbon dalam keadaan terhibridisasi sp 2, yang selanjutnya lebih elektronegatif daripada atom karbon dalam keadaan terhibridisasi sp 3.
Efek mesomerik (M), atau efek konjugasi, adalah pengaruh substituen yang ditransmisikan melalui sistem ikatan π terkonjugasi.
Tanda efek mesomerik ditentukan menurut prinsip yang sama dengan tanda efek induktif. Jika suatu substituen meningkatkan kerapatan elektron dalam sistem terkonjugasi, ia mempunyai efek mesomerik positif (+ M) dan menyumbangkan elektron. Ikatan rangkap karbon-karbon dan substituen yang mengandung pasangan elektron bebas: -NH 2 , -OH, halogen memiliki efek mesomerik positif.
Efek mesomerik negatif (– M) mempunyai substituen yang menghilangkan kerapatan elektron dari sistem terkonjugasi, sedangkan kerapatan elektron dalam sistem menurun.
Kelompok berikut memiliki efek mesomerik negatif:
–NO 2 , –COOH, –SO 3 H, -COH, >C=O
Karena redistribusi kerapatan elektron akibat pengaruh mesomerik dan induktif, muatan positif atau negatif parsial muncul pada beberapa atom dalam molekul, yang mempengaruhi sifat kimia zat.
Secara grafis, efek mesomerik ditunjukkan dengan panah melengkung yang dimulai dari pusat kerapatan elektron dan berakhir di tempat pergeseran kerapatan elektron. Misalnya, dalam molekul vinil klorida, efek mesomerik terjadi ketika pasangan elektron bebas atom klor berpasangan dengan elektron ikatan π antara atom karbon. Jadi, sebagai akibatnya, muatan parsial positif muncul pada atom klor, dan awan elektron π yang bergerak, di bawah pengaruh pasangan elektron, bergeser ke arah atom karbon terluar, di mana muatan parsial negatif muncul sebagai hasilnya:
Jika suatu molekul mempunyai ikatan tunggal dan rangkap yang berselang-seling, maka molekul tersebut dikatakan mengandung sistem elektron π terkonjugasi. Properti yang menarik dari sistem seperti itu adalah bahwa efek mesomerik di dalamnya tidak memudar.