1. Sesuai dengan zat yang perlu diidentifikasi, reaksi kualitatif yang diketahui, reagen dan ciri identifikasi harus ditunjukkan.
Dalam kasus kita, kita dapat menggunakan reaksi berikut:
| Semua r-protein saya | Reaksi Biuret | Cu(OH) 2 ↓ baru diendapkan. | Cincin ungu |
| Protein dengan rasa. asam amino | Reaksi Xantoprotein | Kesimpulan HNO3, konsentrasi. larutan amonia, t° | Pewarnaan oranye |
| Protein dan semua asam amino | Reaksi ninhidrin | Ninhidrin dalam aseton, t° | Warna ungu (prolin – kuning) |
| Asam amino | Pendidikan senyawa kompleks | Cu(OH) 2 ↓ baru diendapkan. | Pewarnaan biru tua |
| Karbohidrat apa saja (mono-, di- dan polisakarida) | Reaksi Molish | Kesimpulan H 2 SO 4 , larutan α-naftol | Cincin ungu tua di perbatasan dua lapisan |
| Monosakarida dan disakarida (apa saja) | Pembentukan sakarat | Cu(OH) 2 ↓ baru diendapkan. | Pengenceran sedimen, warna biru bunga jagung |
| (mengurangi mono- dan disakarida) | Reaksi trommer dari “cermin tembaga” Reaksi “cermin perak” | Cu(OH) 2 , t° baru diendapkan. Ag 2 O, larutan amonia, t° | Endapan perak Cu 2 O berwarna merah bata pada dinding tabung reaksi |
2. Usulkan dalam bentuk diagram barisan yang paling efektif untuk menentukan senyawa-senyawa tersebut.
3. Tunjukkan prosedur reaksi, kondisi dan tulis persamaan reaksi yang menunjukkan ciri identifikasi karakteristik.
Sebagai uji pendahuluan untuk protein larut, Anda dapat menggunakan reagen yang menyebabkan denaturasi (pelipatan): termal atau kimia.
Saat memecahkan masalah ini, opsi analisis dimungkinkan.
Pilihan 1. Urutan identifikasi isi botol adalah sebagai berikut:
1. Kami melakukan tes pendahuluan untuk mengetahui keberadaan protein. Kami memanaskan sampel masing-masing dari 4 botol dalam nyala lampu alkohol. Dalam tabung reaksi dengan larutan protein, denaturasi diamati (protein menggumpal dan kehilangan kelarutannya). Dalam tabung reaksi dengan sampel zat lain, tidak ada perubahan yang diamati.
2. Kami mengidentifikasi protein menggunakan perbedaan komposisi asam aminonya. Kami melakukan reaksi xanthoprotein dengan sampel protein. Dalam tabung reaksi yang berisi larutan putih telur, endapan kuning yang mula-mula terbentuk larut dan muncul warna jingga, karena putih telur mengandung asam aromatik (tyr, fen, tri). Gelatin tidak mengandung asam amino aromatik, tes keberadaannya akan negatif.
3. Kami mengidentifikasi isi botol dengan glukosa dan asam amino menggunakan reaksi dengan ninhidrin. Warna ungu yang khas muncul pada tabung reaksi yang mengandung glisin.
4. Konfirmasikan adanya glukosa dalam sisa botol. Glukosa adalah monosakarida pereduksi, jadi untuk mengidentifikasinya Anda dapat menggunakan reaksi “cermin perak” (bila dipanaskan dalam penangas air, lapisan cermin perak yang khas muncul di dinding tabung reaksi) atau reaksi “cermin tembaga” (bila dipanaskan dalam nyala lampu alkohol, muncul endapan oksida khas berwarna tembaga (I) merah bata).
Pilihan 2.
1. Kita menentukan apakah suatu senyawa termasuk dalam kelompok protein menggunakan reaksi biuret dengan tembaga (II) hidroksida yang baru diendapkan. Cincin ungu yang khas muncul di tabung reaksi yang berisi sampel larutan protein. Dalam tabung reaksi dengan glukosa, pelarutan endapan biru tembaga (II) hidroksida dan munculnya warna biru bunga jagung karena pembentukan senyawa kompleks—sukrosa tembaga—juga diamati; dalam tabung reaksi dengan amino asam, warna biru tua muncul karena pembentukan senyawa kompleks—tembaga glisinat.
2. Konfirmasikan adanya glukosa. Kami memanaskan kedua tabung reaksi dalam nyala lampu alkohol. Dalam tabung reaksi dengan glukosa, terbentuk endapan tembaga (II) oksida berwarna merah bata, karena glukosa termasuk dalam kelompok monosakarida pereduksi.
3. Kami mengidentifikasi protein menggunakan perbedaan komposisi asam aminonya. Kami melakukan reaksi xantoprotein dengan sampel larutan protein baru (lihat versi 1).
Untuk mengidentifikasi asam amino dengan lebih akurat, Anda dapat mengambil sampel baru dan melakukan reaksi dengan larutan ninhidrin.
Pilihan lain yang berbeda dalam urutan reaksi dan reagen tidak dapat dikesampingkan.
Pedoman untuk guru
2. Soal-soal kimia untuk persiapan seminar harus diberikan kepada siswa paling lambat dua minggu sebelum pembelajaran.
4. Guru kimia memberikan motivasi pembelajaran, memperhatikan komposisi dan sifat protein. Seorang guru biologi menggeneralisasi dan memutakhirkan pengetahuan tentang struktur molekul protein, fungsi dan penerapannya.
5. Di akhir pembelajaran, guru mengevaluasi hasil pekerjaan siswa pada pembelajaran tersebut. Peralatan: film kode, proyektor overhead, layar, proyektor overhead, slide, bahan kimia, meja demonstrasi, meja.
Rencana pembelajaran (ditulis di papan tulis)
1. Komposisi dan struktur protein.
2. Sifat protein (denaturasi, renaturasi, hidrolisis, reaksi warna).
3. Fungsi protein dan sintesisnya di dalam sel.
4. Penerapan protein, sintesis peptida buatan.
Guru kimia. Hari ini kami mengadakan pelajaran yang tidak biasa - pelajaran ini mencakup masalah kimia dan biologi pada saat yang bersamaan. Tujuan pelajaran kita adalah untuk mensistematisasikan dan memperdalam pengetahuan tentang topik “Protein”. Kami memberikan perhatian khusus pada studi tentang protein, karena protein adalah yang utama bagian yang tidak terpisahkan dari semua kehidupan di Bumi. Ingat pernyataan F. Engels tentang apa itu kehidupan: “Di mana pun kita bertemu kehidupan, kita menemukan bahwa ia terkait dengan suatu jenis tubuh protein, dan di mana pun kita menemukan tubuh protein yang tidak sedang dalam proses penguraian, kita, tanpa kecuali. , menghadapi fenomena kehidupan. Hidup adalah cara keberadaan tubuh protein.” Tidak ada zat yang melakukan fungsi spesifik dan beragam dalam tubuh seperti protein.
Mari kita ingat senyawa apa yang disebut protein. ( Polimer alami yang monomernya adalah asam amino.)
Studi tentang proses manakah yang membantu membentuk struktur protein? ( Studi hidrolisis protein.)
Proses apa yang disebut hidrolisis?
Senyawa apa yang terbentuk selama hidrolisis protein?
Senyawa apa yang disebut asam amino?
Berapa banyak asam amino yang diketahui di alam?
Berapa banyak asam amino yang ditemukan dalam protein?
Seorang guru kimia mendemonstrasikan film kode.

Guru kimia. Perhatikan posisi gugus amino dalam asam amino. Sesuai dengan kedudukan gugus aminonya, asam amino penyusun protein disebut asam a-amino. Rumus umum dari salah satu asam amino ini dapat ditulis sebagai berikut:
Pada film kode Anda melihat dua asam amino, salah satunya mengandung dua gugus karboksil – COOH, yang lain – dua gugus amino – NH2. Asam seperti itu masing-masing disebut asam aminodikarboksilat atau diaminokarboksilat.
Dari mata kuliah kimia Anda mengetahui tentang isomer optik senyawa alam. Hampir semua protein hanya mengandung asam L-amino.
Asam amino adalah monomer protein. Mereka dapat terhubung satu sama lain melalui ikatan Amida (peptida), yang terbentuk ketika air dilepaskan - ini adalah reaksi kondensasi.
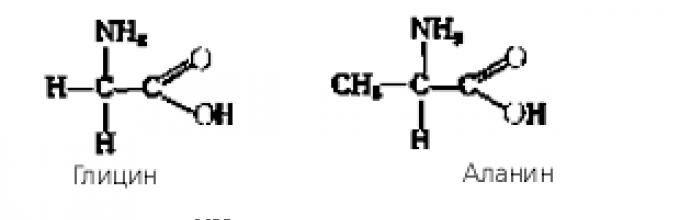
Mari kita buat persamaan reaksi antara asam amino glisin dan alanin.
(Siswa mengerjakan secara mandiri kemudian membandingkan hasilnya dengan tulisan di papan atau pita.)
Struktur yang dihasilkan disebut dipeptida. Polimer dari banyak asam amino disebut polipeptida.
Guru biologi. Mari kita terus mempelajari sifat-sifat protein, tetapi pertama-tama kita akan menjawab pertanyaan-pertanyaan berikut.
1. Bagaimana kita menjelaskan keanekaragaman protein yang ada di alam? ( Perbedaan komposisi asam amino dan perbedaan urutannya dalam rantai polipeptida.)
2. Apa tingkat pengorganisasian molekul protein? ( Primer – urutan asam amino; sekunder – A -spiral atau B - struktur bagian rantai terlipat; tersier - struktur spasial protein, terbentuk karena interaksi residu asam amino dari bagian rantai yang jauh: globula untuk protein globular, struktur berserabut untuk protein fibrilar; kuaterner - penyatuan dua atau lebih molekul protein yang terpisah.)
3. Jenis ikatan apa yang terjadi antara asam amino pada struktur primer? Apa nama lain dari hubungan ini? ( Ikatan kovalen. Ikatan Amida atau Peptida.)
4. Ikatan apa yang terutama menyediakan struktur sekunder molekul protein? ( Ikatan hidrogen, jembatan disulfhidril.)
5. Koneksi apa yang disediakan oleh struktur tersier? ( Ikatan hidrogen, interaksi hidrofobik dan ionik.)
6. Ikatan apa yang membentuk struktur kuaterner molekul protein? ( Interaksi elektrostatik, hidrofobik, dan ionik.)
7. Berikan contoh protein yang Anda ketahui memiliki struktur kuaterner. ( ATPase, hemoglobin.)
Sekarang mari kita selesaikan masalah berikut ( kondisi tugas diproyeksikan melalui overhead proyektor, ditampilkan slide dengan noda darah orang sehat dan pasien anemia sel sabit).
Penyakit anemia sel sabit disertai dengan penggantian residu asam amino asam glutamat pada rantai polipeptida molekul hemoglobin dengan residu valin. Fragmen rantai hemoglobin normal: – lem–lem–Lisa–. Fragmen rantai hemoglobin abnormal: – batang–lem–Lisa–
(lem- asam glutamat; Lisa– lisin; batang– valin). Gambarkan pecahan-pecahan ini sebagai rumus kimia.
Larutan.
Fragmen rantai hemoglobin normal:
Fragmen rantai hemoglobin abnormal:
Dari contoh di atas dapat disimpulkan bahwa struktur utama molekul protein dapat menentukan semua tingkat organisasi selanjutnya. Perubahan organisasi struktural suatu protein dapat mengganggu fungsinya, yang dalam beberapa kasus mengarah pada perkembangan patologi – penyakit.
Struktur protein menentukannya karakteristik fisikokimia, misalnya, kelarutan.
Seorang guru kimia mendemonstrasikan film kode.
Klasifikasi protein menurut kelarutannya

Guru kimia. Untuk mempertahankan aktivitas fungsionalnya, protein harus memiliki organisasi struktural alami (asli) di semua tingkatan.
Gangguan pada organisasi primer yang menyebabkan putusnya ikatan amino dengan penambahan molekul air disebut hidrolisis protein. Dengan hidrolisis sempurna, protein terurai menjadi asam amino penyusunnya.
Pelanggaran sekunder dan tersier struktur protein, yaitu hilangnya struktur aslinya disebut denaturasi protein.
Denaturasi protein disebabkan berbagai faktor: perubahan suhu yang signifikan, kenaikan dan penurunan pH lingkungan, paparan ion logam berat, dan lain-lain senyawa kimia, misalnya fenol.
Seorang guru kimia mendemonstrasikan eksperimen.
Pengalaman 1. Protein + panas -->
Pengalaman 2. Protein + fenol --> denaturasi (presipitasi).
Pengalaman 3. Protein + Pb atau CH 3 COOH --> denaturasi (presipitasi).
Pengalaman 4. Protein + CuSO4 --> denaturasi (presipitasi).
Guru biologi. Denaturasi terjadi sebagai akibat dari penghancuran hidrogen dan disulfida ikatan kovalen(tetapi bukan ikatan peptida, interaksi ionik dan hidrofobik), yang menjamin pembentukan dan pemeliharaan struktur sekunder dan tersier protein. Dalam hal ini, protein kehilangan sifat biologis bawaannya.
Reaksi yang digunakan untuk menentukan komposisi suatu zat disebut kualitatif.
Reaksi apa yang bersifat kualitatif terhadap protein?
Seorang guru kimia mendemonstrasikan percobaan berikut.
Pengalaman 1. Reaksi Xanthoprotein (nitrasi cincin benzena dari asam amino aromatik protein):
protein (didinginkan) + HNO 3 (konsentrasi) + panas --> warna kuning
Pengalaman 2. Reaksi Biuret (memungkinkan Anda menentukan jumlah ikatan peptida):
protein + CuSO 4
+ NaOH --> warna ungu (urea menghasilkan reaksi ini);
CuSO 4
+ NaOH --> Cu(OH) 2
+Tidak 2
JADI 4
;
protein + Cu(OH) 2
-> pewarna ungu.
Apakah mungkin untuk mengenali gliserol, protein, dan glukosa menggunakan satu reagen? Bisa! Reagen ini adalah tembaga hidroksida, yang memberikan warna berbeda pada larutan zat berikut:
a) gliserol + Cu(OH) 2
-> solusi biru cerah;
b) glukosa + Cu(OH) 2
+ pemanasan --> endapan merah;
c) protein + Cu(OH) 2
-> pewarna ungu.
Guru biologi. Sebutkan fungsi polipeptida yang anda ketahui. ( Konstruksi Polipeptida adalah bagian dari dinding sel jamur dan mikroorganisme dan terlibat dalam pembangunan membran. Rambut, kuku, dan cakar terbuat dari protein keratin. Protein kolagen adalah dasar dari tendon dan ligamen. Fungsi penting lainnya dari protein adalah enzimatik, katalitik.
Protein juga menyediakan semua jenis mobilitas biologis. Selain itu, protein melakukan fungsi transportasi, hormonal, atau pengatur, reseptor, hemostatik, toksigenik, pelindung dan energi.)
Definisi enzim. ( Enzim adalah protein yang memiliki aktivitas katalitik, yaitu. mempercepat reaksi.)
Semua enzim sangat spesifik terhadap substratnya dan, biasanya, hanya mengkatalisis satu reaksi yang sangat spesifik. Lihatlah representasi diagram struktur enzim. ( Seorang guru biologi mendemonstrasikan film kode dengan representasi skema suatu enzim.) Setiap enzim memiliki situs aktif di mana terjadi transformasi kimia substrat reaksi. Terkadang mungkin terdapat beberapa tempat pengikatan media. Struktur tempat pengikatan melengkapi struktur substrat, yaitu. mereka cocok satu sama lain “seperti kunci cocok dengan gembok.”
Kerja enzim dipengaruhi oleh banyak faktor: pH, suhu, ionik komposisi lingkungan hidup, kehadiran kecil molekul organik, yang berikatan dengan enzim atau merupakan bagian dari strukturnya dan disebut kofaktor (koenzim). Beberapa vitamin, seperti piridoksin (B 6
) dan cobalamin (B 12
).
Guru biologi mengenalkan siswa pada aplikasi praktis enzim.
Signifikansi klinis enzim
1. Penyakit akibat kekurangan enzim sudah banyak diketahui. Contoh: susu tidak dapat dicerna (tidak ada enzim laktase); hipovitaminosis (kekurangan vitamin) – kekurangan koenzim mengurangi aktivitas enzim (hipovitaminosis vitamin B1 menyebabkan penyakit beri-beri); fenilketonuria (disebabkan oleh pelanggaran konversi enzimatik asam amino fenilalanin menjadi tirosin).
2. Penentuan aktivitas enzim dalam cairan biologis sangat penting untuk mendiagnosis penyakit. Misalnya, virus hepatitis ditentukan oleh aktivitas enzim dalam plasma darah.
3. Enzim digunakan sebagai reagen dalam diagnosis penyakit tertentu.
4. Enzim digunakan untuk mengobati penyakit tertentu. Contoh beberapa obat berbasis enzim: pankreatin, festal, lidase.
Penggunaan enzim dalam industri
1.B Industri makanan enzim digunakan dalam pembuatan minuman ringan, keju, makanan kaleng, sosis, dan daging asap.
2. Dalam peternakan, enzim digunakan dalam pembuatan pakan.
3. Enzim digunakan dalam produksi bahan fotografi.
4. Enzim digunakan dalam pengolahan rami dan rami.
5. Enzim digunakan untuk melunakkan kulit pada industri kulit.
6. Enzim merupakan bagian dari bubuk pencuci.
Guru biologi. Mari kita lihat fungsi protein lainnya. Fungsi motorik dilakukan oleh protein kontraktil khusus, misalnya aktin dan miosin, yang merupakan bagian dari serat otot.
Fungsi penting lainnya dari protein adalah transportasi. Protein, misalnya, membawa ion kalium, asam amino, gula, dan senyawa lain melintasi membran sel ke dalam sel. Protein juga merupakan pembawa interstisial.
Dengan mengatur metabolisme di dalam sel dan antara sel dan jaringan di seluruh tubuh, protein menjalankan fungsi hormonal atau pengaturan. Misalnya, hormon insulin terlibat dalam pengaturan metabolisme protein dan lemak.
Pada permukaan membran sel terdapat reseptor protein yang secara selektif mengikat hormon dan mediator, sehingga menjalankan fungsi reseptor.
Fungsi homeostatis protein adalah membentuk bekuan darah saat menghentikan pendarahan.
Beberapa protein dan peptida yang dilepaskan oleh organisme, seperti patogen atau beberapa hewan beracun, bersifat racun bagi organisme hidup lainnya - inilah fungsi toksikogenik protein.
Fungsi pelindung protein sangat penting. Antibodi adalah protein yang diproduksi oleh sistem kekebalan tubuh ketika diserang oleh protein asing, bakteri, atau virus. Mereka mengidentifikasi “orang asing” dan berpartisipasi dalam kehancurannya.
Protein yang berfungsi sebagai cadangan energi misalnya kasein, protein utama dalam susu.
Jawab pertanyaan berikut.
2. Apa penyebab penolakan organ dan jaringan transplantasi pada pasien? ( Antibodi, yang melakukan fungsi perlindungan, mengenali protein asing dari organ yang ditransplantasikan dan menyebabkan reaksi penolakannya.)
3. Mengapa telur rebus tidak pernah menghasilkan ayam? ( Putih telur telah kehilangan struktur aslinya karena denaturasi panas.)
4. Mengapa berat daging dan ikan berkurang setelah dimasak? ( Selama perlakuan panas, terjadi denaturasi protein daging atau ikan. Protein menjadi praktis tidak larut dalam air dan melepaskan sebagian besar air yang dikandungnya, sementara berat daging berkurang 20–40%.)
5. Apa yang ditunjukkan dengan terbentuknya “serpihan” atau kekeruhan pada kaldu saat memasak daging? ( Jika daging direndam dalam air dingin dan dipanaskan, protein larut dari lapisan luar daging dipindahkan ke dalam air. Selama pemasakan, bahan-bahan tersebut mengalami perubahan sifat sehingga menghasilkan serpihan, busa yang mengapung di permukaan air, atau suspensi halus yang membuat larutan menjadi keruh..)
Semua molekul protein memiliki umur yang terbatas - mereka rusak seiring waktu. Oleh karena itu, protein terus diperbarui di dalam tubuh. Dalam hal ini, mari kita mengingat kembali dasar-dasar biosintesis protein. Jawab pertanyaan berikut.
1. Dimana terjadinya sintesis protein di dalam sel? ( Pada ribosom.)
2. Dalam hal apa organel seluler informasi tentang struktur utama protein disimpan. ( Dalam kromosom, pembawa informasi adalah DNA.)
3. Apa yang dimaksud dengan istilah “gen”? ( Urutan nukleotida yang mengkode sintesis satu protein.)
4. Tahapan utama biosintesis protein disebut? ( Transkripsi, siaran.)
5. Transkripsi terdiri dari apa? ( Ini adalah membaca informasi dari DNA dengan mensintesis RNA pembawa pesan yang melengkapi wilayah DNA yang sedang dibaca.)
6. Di bagian sel manakah transkripsi terjadi? ( Pada intinya.)
7. Terdiri dari apa siarannya? ( Ini adalah sintesis protein dari asam amino dalam urutan yang dicatat dalam mRNA; itu terjadi dengan partisipasi tRNA transpor yang mengantarkan asam amino yang sesuai ke ribosom.)
8. Di bagian sel manakah terjadi translasi? ( Di sitosol, di ribosom, di mitokondria.)
Biosintesis protein terjadi di dalam tubuh sepanjang hidup, paling intensif pada masa kanak-kanak. Intensitas sintesis protein dalam beberapa kasus dapat disesuaikan. Tindakan banyak antibiotik didasarkan pada penekanan sintesis protein, termasuk pada bakteri penyebab penyakit. Misalnya, antibiotik tetrasiklin mencegah tRNA berikatan dengan ribosom.
Mari dengarkan pesan singkat tentang sediaan protein yang digunakan dalam pengobatan modern.
Antihistamin
Laju kehidupan modern yang sibuk diiringi dengan meningkatnya jumlah penyakit, seperti serangan jantung, hipertensi, obesitas, dan segala macam alergi. Alergi adalah sensitivitas tubuh yang berlebihan terhadap iritasi eksternal tertentu. Semua penyakit ini ditandai dengan peningkatan kadar histamin dalam darah. Histamin adalah zat yang dibentuk oleh dekarboksilasi asam amino histidin. Antihistamin mengganggu reaksi ini dan kadar histamin menurun.
Interferon
Dalam proses evolusi, dalam memerangi virus, hewan telah mengembangkan mekanisme sintesis protein interferon pelindung. Program pembentukan interferon, seperti protein lainnya, dikodekan dalam DNA di inti sel dan diaktifkan setelah sel terinfeksi virus. Pendinginan, syok saraf, dan kekurangan vitamin dalam makanan menyebabkan penurunan kemampuan memproduksi interferon. Saat ini, sediaan interferon untuk keperluan medis dibuat dari leukosit darah donor atau penggunaan rekayasa genetika. Interferon digunakan untuk mencegah dan mengobati infeksi virus - influenza, herpes, serta neoplasma ganas.
Insulin
Insulin adalah protein yang terdiri dari 51 asam amino. Ini dilepaskan sebagai respons terhadap peningkatan kadar glukosa darah. Insulin mengontrol metabolisme karbohidrat dan menyebabkan efek berikut:
– meningkatkan laju konversi glukosa menjadi glikogen;
– percepatan transfer glukosa melalui membran sel di otot dan jaringan adiposa;
– peningkatan sintesis protein dan lipid;
– meningkatkan laju sintesis ATP, DNA dan RNA.
Insulin diperlukan untuk kehidupan karena merupakan satu-satunya hormon yang menurunkan konsentrasi glukosa dalam darah. Sekresi insulin yang tidak mencukupi menyebabkan gangguan metabolisme yang dikenal sebagai diabetes mellitus. Sediaan insulin diperoleh dari pankreas sapi atau melalui rekayasa genetika.
Guru kimia. Insulin adalah protein pertama yang struktur utamanya diuraikan. Butuh waktu hampir 10 tahun untuk menetapkan urutan asam amino dalam insulin. Saat ini, struktur primer dari sejumlah besar protein, termasuk struktur yang jauh lebih kompleks, telah diuraikan.
Sintesis zat protein pertama kali dilakukan dengan menggunakan contoh dua hormon hipofisis (vasopresin dan oksitosin).
Terakhir, guru memberikan nilai kepada siswa atas pekerjaannya di kelas kimia dan biologi.
Arti penting dari reaksi warna adalah memungkinkan untuk mendeteksi keberadaan protein dalam cairan biologis, larutan dan untuk menentukan komposisi asam amino dari berbagai protein alami. Reaksi-reaksi ini digunakan untuk penentuan kualitatif dan kuantitatif protein dan asam amino yang dikandungnya. Beberapa reaksi tidak hanya melekat pada protein, tetapi juga pada zat lain, misalnya fenol, seperti tirosin, memberikan warna merah jambu-merah dengan reagen Millon, sehingga melakukan satu reaksi saja tidak cukup untuk menentukan keberadaan suatu protein.
Ada dua jenis reaksi warna: 1) universal - biuret (untuk semua protein) dan ninhidrin (untuk semua A-asam amino dan protein); 2) spesifik - hanya untuk asam amino tertentu baik dalam molekul protein maupun dalam larutan asam amino individu, misalnya reaksi Foll (untuk asam amino yang mengandung sulfur yang terikat lemah), reaksi Millon (untuk tirosin), reaksi Sakaguchi ( untuk arginin), dll.
Saat melakukan reaksi warna untuk protein dan asam amino, Anda harus terlebih dahulu menyusun tabel berikut:
Reaksi warna terhadap protein (reaksi kualitatif)
Reaksi warna terhadap protein Percobaan 1. Reaksi Biuret.
Reaksi Biuret– kualitas untuk semuanya tanpa kecuali tupai, serta produk-produknya yang tidak lengkap hidrolisis, yang berisi setidaknya dua ikatan peptida.
Prinsip metode ini. Reaksi biuret disebabkan oleh adanya ikatan peptida (- CO – NH -) pada protein, yang dalam lingkungan basa membentuk garam tembaga berwarna merah-ungu dengan tembaga (II) sulfat kompleks. Reaksi biuret juga dihasilkan oleh beberapa zat non-protein, misalnya biuret(NH 2 -CO-NH-CO-NH 2), oksamida(NH 2 CO-CO-NH 2), seri asam amino (histidin, serin, treonin, asparagin).
Reaksi biuret dengan glisin
Urutan pekerjaan.
Larutan 10% dengan volume yang sama ditambahkan ke dalam 1 ml larutan protein uji 1%. natrium hidroksida(NaOH) alkali dan kemudian 2-3 tetes larutan 1%. tembaga sulfat(CuSO 4). larutan tembaga sulfat yang encer dan hampir tidak berwarna.
Jika reaksinya positif, muncul warna ungu dengan semburat merah atau biru.
Pengalaman 2.Reaksimenjadi “belerang yang terikat lemah”.
Prinsip metode ini. Ini adalah reaksi terhadap sistein dan sistin. Selama hidrolisis basa, “belerang yang terikat lemah” dalam sistein dan sistin cukup mudah terpecah, menghasilkan pembentukan hidrogen sulfida, yang bereaksi dengan alkali, menghasilkan natrium atau kalium sulfida. Ketika timbal(II) asetat ditambahkan, terbentuk endapan timbal(II) sulfida berwarna abu-abu kehitaman.
Urutan pekerjaan.
1 ml protein ayam murni dituangkan ke dalam tabung reaksi, ditambahkan 2 ml larutan natrium hidroksida 20%. Campuran direbus sampai matang (agar adonan tidak dibuang).
Dalam hal ini terjadi pelepasan amonia yang ditandai dengan warna biru kertas lakmus basah yang dibawa ke bukaan tabung reaksi (jangan menyentuh dinding). Sedikit endapan yang terbentuk larut pada saat mendidih, dan kemudian ditambahkan 0,5 ml larutan timbal(II) asetat. Endapan timbal(II) sulfida berwarna abu-abu kehitaman terlihat:


Kimia reaksi:

|
sedimen hitam |
1 ml dituangkan ke dalam tabung reaksi. tambahkan 2 ml protein ayam murni. larutan alkali pekat, masukkan beberapa boiler. Larutan natrium plumbite ditambahkan ke larutan panas - terbentuk warna kuning-coklat atau hitam. (Natrium plumbite dibuat sebagai berikut: larutan alkali ditambahkan tetes demi tetes ke dalam 1 ml timbal asetat sampai endapan timbal hidroksida yang awalnya membentuk endapan larut).
Jika molekul protein mengandung asam amino yang mengandung belerang (sistin, sistein), belerang secara bertahap dipecah dari asam amino ini dalam bentuk ion dalam keadaan oksidasi – 2, yang keberadaannya dideteksi oleh ion timbal, yang membentuk warna hitam. timbal sulfida yang tidak larut dengan ion belerang:
Pb(CH 3 COO) 2 + 2NaOH Pb(OH) 2 + 2 CH 3 COONa,
Pb(OH) 2 + 2NaOH Na 2 PbO 2 + H 2 O,
Na 2 S + Na 2 PbO 2 + 2H 2 O PbS + 4NaOH.
Percobaan 3. Reaksi xanthoprotein protein.
Prinsip metode ini. Reaksi ini digunakan untuk mendeteksi asam a-amino yang mengandung radikal aromatik. Tirosin, triptofan, fenilalanin, bila berinteraksi dengan asam nitrat pekat, membentuk turunan nitro yang berwarna kuning. Dalam lingkungan basa, turunan nitro dari asam a-amino ini menghasilkan garam berwarna oranye. Gelatin, misalnya, yang tidak mengandung asam amino aromatik, tidak memberikan uji xanthoprotein.
Urutan pekerjaan.
Ke dalam 1 ml larutan putih telur ayam 10% tambahkan 0,5 ml pekat asam sendawa. Akibat koagulasi protein, terbentuk endapan putih atau kekeruhan pada isi tabung reaksi. Saat dipanaskan, larutan dan endapan berubah menjadi kuning cerah. Dalam hal ini, endapan hampir larut seluruhnya akibat hidrolisis. Setelah dingin, tambahkan 1–2 ml larutan natrium hidroksida 20% (sampai larutan berubah warna menjadi oranye).
Mari kita perhatikan mekanisme reaksi xanthoprotein pada radikal tirosin:


Kimia reaksi:

Rancangan percobaan: menarik kesimpulan dan menulis persamaan reaksi.
Eksperimen 4. Reaksi Adamkiewicz (terhadap keberadaan triptofan dalam protein).
Prinsip metode ini. Protein yang mengandung triptofan memberikan warna merah-ungu dengan adanya asam glioksilat dan sulfat. Reaksi ini didasarkan pada kemampuan triptofan untuk berinteraksi dalam lingkungan asam dengan aldehida asam glioksilat (yang merupakan pengotor dalam asam asetat pekat) untuk membentuk produk kondensasi berwarna. Reaksi berlangsung menurut persamaan:

Gelatin tidak memberikan reaksi seperti itu, karena. itu tidak mengandung triptofan. Warna tersebut terjadi karena reaksi triptofan dengan asam glioksilat, yang selalu ada dalam asam asetat sebagai pengotor.
Reaksi yang sama terhadap triptofan dapat dilakukan dengan menggunakan asam asetat formaldehida 2,5% larutan H 2 SO 4 pekat. Aduk larutan dan setelah 2-3 menit. tambahkan 10 tetes natrium nitrit 5% sambil dikocok. Warna ungu pekat berkembang, yang menjadi dasarnya prinsip metode reaksi.
Urutan pekerjaan.
Tuang beberapa tetes protein murni ke dalam tabung reaksi dan tambahkan 2 ml. asam asetat glasial dan beberapa tetes asam glioksilat. Campuran dipanaskan sedikit sampai endapan yang terbentuk larut, didinginkan dan, dengan memiringkan tabung reaksi dengan kuat, H 2 SO 4 pekat dituangkan dengan hati-hati di sepanjang dinding agar kedua cairan tidak tercampur.
Setelah 5-10 menit, pembentukan cincin merah-ungu diamati pada antarmuka antara kedua lapisan.
Percobaan 5. Reaksi ninhidrin.
Prinsip metode ini. a-Asam amino bereaksi dengan ninhidrin membentuk kompleks biru-ungu (ungu Ruemann), yang intensitas warnanya sebanding dengan jumlah asam amino. Reaksi berlangsung sesuai dengan skema berikut:

Kimia reaksi :


Reaksi dengan ninhidrin digunakan untuk deteksi visual asam a-amino dalam kromatogram (di atas kertas, dalam lapisan tipis), serta untuk penentuan kolorimetri konsentrasi asam amino berdasarkan intensitas warna produk reaksi.
Produk reaksi ini mengandung radikal (R) dari asam amino asli, yang menyebabkan warna berbeda: biru, merah, dll. senyawa yang timbul dari reaksi asam amino dengan ninhidrin.
Saat ini, reaksi ninhidrin banyak digunakan baik untuk penemuan asam amino individu maupun untuk menentukan kuantitasnya.
Urutan pekerjaan.
1 ml larutan putih telur ayam encer 1-10% dan 1-2 ml larutan ninhidrin 1% dalam aseton dituangkan ke dalam tabung reaksi. Isi tabung reaksi dicampur dan dipanaskan secara hati-hati dalam penangas air selama 2-3 menit sampai muncul warna biru-ungu yang menunjukkan adanya protein. α -asam amino.
Rancangan percobaan: menarik kesimpulan dan menulis persamaan reaksi.
Eksperimen 6. Reaksi Sakaguchi.
Prinsip metode ini. Reaksi terhadap asam amino arginin ini didasarkan pada interaksi arginin dengan a-naftol dengan adanya zat pengoksidasi. Mekanismenya belum sepenuhnya dijelaskan. Tampaknya, reaksinya berlangsung menurut persamaan berikut:

Karena turunan kuinon imina (dalam hal ini, naftokuinon), di mana hidrogen dari gugus imino –NH– digantikan oleh radikal alkil atau aril, selalu berwarna kuning-merah, maka warnanya tampak oranye-merah. larutan selama reaksi Sakaguchi dijelaskan oleh munculnya turunan naftokuinon imina. Namun, kemungkinan pembentukan senyawa yang lebih kompleks akibat oksidasi lebih lanjut dari sisa gugus NH dari residu arginin dan cincin benzena a-naftol tidak dapat dikesampingkan:
Urutan pekerjaan.
menjadi 2ml. Tambahkan 2 ml larutan putih telur ayam encer 1%. 10% natrium hidroksida (NaOH) dan beberapa tetes larutan alkohol 0,2%. α -naftol. Isi tabung reaksi tercampur rata. Kemudian tambahkan 0,5 ml. natrium hipobromit (NaBrO) atau natrium hipoklorit (natrium hipoklorit - NaOCl), campur. Warna merah segera muncul, secara bertahap meningkat.
Segera tambahkan 1 ml larutan urea 40% untuk menstabilkan warna oranye-merah yang berkembang pesat.
Reaksi ini khas untuk senyawa yang mengandung residu guanidin
NH = C –NH 2 ,
dan menunjukkan adanya asam amino arginin dalam molekul protein:
NH = C –NH – (CH 2) 3 –CH –COOH
Rancangan percobaan: menarik kesimpulan dan menulis persamaan reaksi.
Pekerjaan laboratorium 15 “Tupai”
Asam amino disebut mengandung nitrogen senyawa organik, yang molekulnya mengandung gugus amino dan gugus karboksil.
Tergantung pada posisi relatif gugus karboksil dan amino dibedakan -, b-, g-, dll. asam amino. Misalnya,
Istilah "asam amino" paling sering digunakan untuk merujuk asam karboksilat, gugus aminonya berada pada posisi -, yaitu. untuk - asam amino. Rumus umum asam amino dapat direpresentasikan sebagai berikut:
Tergantung pada sifat radikal (R), asam amino dibagi menjadi alifatik, aromatik dan heterosiklik.
Asam amino bereaksi satu sama lain melalui reaksi polikondensasi, menghasilkan asam amino. Produk kondensasi tersebut disebut peptida. Ketika dua asam amino berinteraksi, dipeptida terbentuk:
Kelompok yang muncul -CO-NH- ditelepon ikatan peptida.
Ketika dipeptida berinteraksi dengan molekul asam amino baru, tripeptida diperoleh, dll.
Contoh asam amino paling sederhana
Tupai - ini mengandung nitrogen berat molekul tinggi bahan organik dengan komposisi yang kompleks dan struktur molekul. Mereka adalah polimer alami (polipeptida kompleks), yang molekulnya dibangun dari residu asam amino yang dihubungkan satu sama lain melalui ikatan amino (peptida).
Ini adalah polipeptida alami dengan nilai berat molekul tinggi (dari 5-10 ribu hingga 1 juta atau lebih). Mereka adalah bagian dari sel dan jaringan semua organisme hidup dan merupakan komponen utama makanan kita.
Protein mengandung karbon, hidrogen, oksigen dan nitrogen. Dalam jumlah yang jauh lebih kecil, komposisinya mungkin juga mencakup belerang, fosfor, dan unsur lainnya. Protein merupakan senyawa yang sangat tidak stabil sehingga sulit untuk mempelajari sifat fisik dan kimianya. Produk akhir dari pemecahan protein adalah
b- asam amino. Berat molekulnya sangat besar.
Semua proses kehidupan berhubungan dengan protein. Mereka menyediakan nutrisi, mengatur metabolisme, memainkan peran enzim - katalis metabolisme, meningkatkan transfer oksigen ke seluruh tubuh dan penyerapannya, memainkan peran penting dalam fungsi sistem saraf, adalah dasar mekanis kontraksi otot, berpartisipasi dalam transmisi informasi genetik dll.
Percobaan 1. Koagulasi protein bila dipanaskan.
Pelipatan protein, mis. denaturasi - proses hilangnya suatu protein konformasi alami (aslinya), biasanya disertai dengan hilangnya fungsi biologisnya. Ketika didenaturasi di bawah pengaruh faktor eksternal(suhu, tekanan mekanis, aksi reagen kimia dan sejumlah faktor lainnya) terjadi penghancuran struktur makromolekul protein sekunder, tersier dan kuaterner. Struktur primer, dan, akibatnya, komposisi kimia protein tidak berubah. Sedang berubah properti fisik: kelarutan, kemampuan hidrasi menurun, aktivitas biologis hilang. Bentuk makromolekul protein berubah dan terjadi pembesaran.
Untuk cara kerjanya, gunakan putih telur ayam yang dilarutkan dalam air (satu putih telur per 150 ml air).
Deskripsi pengalaman. Panaskan sedikit larutan protein di atas kompor hingga mendidih. Kekeruhan cairan diamati. Endapan yang dihasilkan tidak larut baik ketika didinginkan atau diencerkan dengan air, mis. reaksinya tidak dapat diubah.
Percobaan 2. Reaksi Xanthoprotein
Reaksi xanthoprotein menunjukkan adanya residu asam amino aromatik (fenilalanin, tirosin, triptofan) dalam protein. Bila terkena asam nitrat pekat, terjadi reaksi nitrasi inti aromatik dengan terbentuknya senyawa nitro berwarna kuning. Ketika terkena amonia, senyawa nitro terisomerisasi membentuk produk seperti garam yang berwarna pekat.
Deskripsi pengalaman. Tambahkan 5-6 tetes HNO3 pekat ke dalam 1 ml larutan protein sampai muncul endapan putih (atau kekeruhan dari protein yang menggumpal karena pengaruh asam). Bila dipanaskan, larutan dan endapan akan berubah warna menjadi kuning cerah (endapan hampir terhidrolisis dan larut seluruhnya).
Dinginkan campuran, tambahkan (dengan hati-hati, tanpa dikocok) kelebihan amonia berair pekat (atau alkali kaustik) setetes demi setetes sampai terjadi reaksi basa. Endapan asam albuminat yang keluar terlebih dahulu akan larut, dan cairan akan berubah warna menjadi jingga cerah.
Reaksi biuret menunjukkan adanya pengulangan gugus peptida -CO-NH- dalam protein. Hal ini dibuktikan dengan fakta bahwa protein memberikan warna ungu bila terkena sedikit larutan tembaga sulfat dengan adanya alkali. Warna tersebut disebabkan oleh pembentukan kompleks tembaga.
Percobaan 3. Reaksi Biuret
Deskripsi pengalaman. Masukkan 1 ml larutan putih telur, 1 ml larutan natrium hidroksida dan 1-2 tetes larutan tembaga (II) sulfat ke dalam tabung reaksi. Cairan akan berubah warna menjadi merah ungu (jika kandungan proteinnya rendah, tambahkan perlahan 0,5-1 ml larutan CuSO4 ke dalam larutan alkali; warna akan muncul pada batas lapisan). Persamaan reaksi:
CuSO4 + 2NaOH > Na2SO4 + Cu(OH)2v
2R - CH - COOH + Cu(OH)2 > (R- CH-COO)2Cu + 2H2O
Percobaan 4. Pengendapan protein dengan garam logam berat
Deskripsi pengalaman. Ambil dua tabung reaksi dan masukkan 1 ml larutan putih telur ke dalamnya dan perlahan sambil dikocok, setetes demi setetes, tambahkan larutan jenuh tembaga (II) sulfat ke dalam satu tabung reaksi, dan larutan timbal asetat 20% ke dalam tabung reaksi lainnya. . Endapan senyawa protein seperti garam yang sukar larut terbentuk. Pengalaman tersebut menggambarkan penggunaan protein sebagai penawar keracunan garam logam berat. Persamaan reaksi:
- 2R - CH - COOH + CuSO4 > (R- CH-COO)2Cu + H2SO4
- 2R-CH-COOH + (CH3COO)2Pb> (R-CH-COO)2Pb + CH3COOH
Eksperimen 4. Penemuan sulfur dalam protein
Deskripsi pengalaman. Sekitar 0,5 ml larutan timbal asetat dituangkan ke dalam tabung reaksi dan ditambahkan larutan kalium hidroksida sampai endapan timbal hidroksida larut. Sekitar 2-3 ml larutan protein dituangkan ke dalam tabung reaksi lain dan ditambahkan larutan plumbite dengan volume yang sama. Panaskan campuran hingga mendidih selama 2-3 menit. Munculnya warna gelap menunjukkan terbentuknya timbal sulfit. Tuliskan persamaan reaksinya.
1) Reaksi Biuret(untuk semua protein)
Protein + CuSO 4 + NaOH berwarna ungu cerah
CuSO 4 + 2NaOH Cu(OH) 2 + Na 2 SO 4
sedimen biru
C = O: Cu: O = C C = O: N
NHOHN:O=C
kompleks yang larut
ungu cerah
2) Reaksi Xantoprotein(untuk protein yang mengandung AA dengan radikal aromatik)
protein + sedimen HNO 3 (k). warna kuning
| || -- H 2 O | ||
N CH C─ + HONO 2 N CH C─
|
warna kuning
Jika Anda menambahkan larutan amonia pekat, warna oranye akan muncul karena pergeseran kerapatan elektron dalam nitrobenzena.
3) Reaksi sistein- reaksi terhadap residu AK yang mengandung S
Protein + NaOH + Pb(CH 3 COO) 2 PbS + protein
Warna hitam
| Pb + PbS
BIOKATALISIS
Satu dari fitur penting reaksi kimia yang terjadi pada organisme hidup adalah sifat katalitiknya. Sel hidup dapat diibaratkan sebagai reaktor katalitik mini. Perbedaan antara sel dan labu kimia adalah jika di dalam labu semua reaksi berlangsung secara independen (prinsip dasar independensi reaksi diterapkan), maka di dalam sel segala sesuatu terjadi saling berhubungan.
Hal ini tidak terjadi karena dilanggar hukum fisika atau apakah sel mematuhi hukum lain - tidak, hanya hukum yang berlaku pada materi hidup. Hanya saja dalam proses evolusi, alam menciptakan alat yang efektif untuk mengatur segalanya reaksi seluler, yang memungkinkan seluruh sel mengontrol rasio produk sehingga semua reaksi berfungsi optimal.
Jadi semuanya bio reaksi kimia- ini adalah reaksi katalis.
Katalis biologis disebut enzim atau enzim.
Pada prinsipnya, reaksi kimia yang sama terjadi di dalam sel seperti di dalam laboratorium kimia, namun pembatasan ketat diberlakukan pada kondisi reaksi di dalam sel, yaitu T = 37 ◦ C dan P = 1 atm.
Oleh karena itu, seringkali proses yang terjadi dalam satu tahap di laboratorium dilakukan dalam beberapa tahap di dalam sel hidup.
Inti dari reaksi katalitik, meskipun beragam, bermuara pada fakta bahwa bahan awal terbentuk dengan katalis koneksi perantara, yang relatif cepat berubah menjadi produk reaksi, meregenerasi katalis.
Terkadang zat antara dapat diisolasi dalam bentuk murni, tetapi biasanya zat tersebut terdiri dari molekul tidak stabil yang hanya dapat dideteksi menggunakan instrumen spektral yang sangat sensitif.
Proses yang melibatkan katalis bersifat siklik atau melingkar.

Ukuran aktivitas enzim - kecepatan(jumlah mol substrat yang mengalami perubahan dalam 1 menit per 1 mol enzim)
Jumlah putarannya bisa mencapai 10 8.
Seringkali, siklus beberapa katalis digabungkan menjadi satu, membentuk proses melingkar.

Zat S1 dan S2 diubah menjadi produk P1 dan P2. Selama transformasi ini, S1 pertama bereaksi dengan zat ketiga X dan katalis E1, membentuk produk antara M1, yang kemudian diubah oleh katalis E2 menjadi produk antara M2, dan seterusnya.
Efek percepatan katalis dikaitkan dengan penurunan energi aktivasi (ini adalah energi tambahan yang harus diberikan kepada satu mol suatu zat agar partikel-partikel zat tersebut menjadi reaktif dan mampu mengatasi penghalang energi dari katalis. reaksi).
Sifat utama enzim antara lain:
Efisiensi, yang terletak pada derajat percepatannya (percepatan 100 juta kali lipat).
Peningkatan spesifisitas substrat. Enzim membedakan substrat melalui pengenalan biologis (saling melengkapi).
Peningkatan spesifisitas reaksi yang dikatalisis. Kebanyakan enzim mempercepat satu jenis reaksi.
Peningkatan spesifisitas isomer optik (dapat mengenali isomer kidal dan isomer kanan).
Penyebab semuanya properti unik enzim - mereka struktur spasial. Biasanya ini adalah protein globular, ukurannya jauh lebih besar daripada substrat. Keadaan ini mengarah pada fakta bahwa dalam proses evolusi suatu pusat aktif terbentuk pada permukaan enzim, yang melengkapi substrat. Ini adalah gembok dan kunci.
Pusat aktif bersyarat dibagi menjadi: pengikatan dan katalitik.
Pusat pengikatan mengikat substrat dan secara optimal mengarahkannya ke gugus yang dikatalisis, sementara semua gugus aktif terkonsentrasi di pusat katalitik.
Jika hidrolisis (protein, lipid) diperlukan untuk melakukan reaksi, maka pusat yang dikatalisis dibentuk oleh radikal samping residu AA.
Dalam hal ini, enzim hanya terdiri dari rantai polipeptida. Namun, selain reaksi hidrolitik, ada juga reaksi lain: reaksi redoks, reaksi transfer gugus apa pun.
Dalam kasus ini, enzim mengandung bagian non-protein. Bagian ini adalah koenzim(faktor r, kelompok prostetik). Bagian protein memberikan efek pengikatan, dan koenzim memberikan efek katalitik. Bagian protein - apoenzim.
Apoenzim + koenzim ↔holoenzim