Asam sulfat
H2SO4, masa molar 98.082; tidak berwarna, berminyak, tidak berbau. Asam dibasa yang sangat kuat, pada 18°C p Ka 1 - 2.8, K 2 1.2 10 -2, hal A 2 1,92; panjang ikatan pada S=O 0,143 nm, S-OH 0,154 nm, sudut HOSOH 104°, OSO 119°; mendidih dengan dekomposisi, membentuk (98,3% H 2 SO 4 dan 1,7% H 2 O dengan titik didih 338,8°C; lihat juga Tabel 1). Asam sulfat, sesuai dengan kandungan H 2 SO 4 100%, mempunyai komposisi (%) : H 2 SO 4 99,5%, HSO 4 - 0,18%, H 3 SO 4 + 0,14%, H 3 O + 0,09%, H 2 S 2 O 7 0,04%, HS 2 O 7 0,05%. Bercampur dengan dan SO 3 dalam semua perbandingan. Dalam larutan air asam sulfat hampir seluruhnya terdisosiasi menjadi H+, HSO 4 - dan SO 4 2-. Bentuk H2SO4 N H 2 O, dimana N=1, 2, 3, 4 dan 6.5.
larutan SO 3 dalam asam sulfat disebut oleum; larutan tersebut membentuk dua senyawa H 2 SO 4 ·SO 3 dan H 2 SO 4 ·2SO 3. Oleum juga mengandung asam pirosulfat, diperoleh melalui reaksi: H 2 SO 4 +SO 3 =H 2 S 2 O 7.
Persiapan asam sulfat
Bahan baku untuk diperoleh asam sulfat melayani : S, logam sulfida, H 2 S, limbah pembangkit listrik tenaga panas, Fe, Ca sulfat, dll. Tahapan utama produksi asam sulfat: 1) bahan baku pembuatan SO 2; 2) SO 2 menjadi SO 3 (konversi); 3) JADI 3. Dalam industri, dua metode digunakan untuk memperolehnya asam sulfat, berbeda dalam metode oksidasi SO 2 - kontak menggunakan katalis padat (kontak) dan nitrous - dengan nitrogen oksida. Untuk mendapatkan asam sulfat Dengan metode kontak, pabrik modern menggunakan katalis vanadium, yang menggantikan oksida Pt dan Fe. V 2 O 5 murni mempunyai aktivitas katalitik yang lemah, yang meningkat tajam dengan adanya logam alkali, dan pengaruh terbesar diberikan oleh garam K. Peran pendorong logam alkali adalah karena pembentukan pirosulfonadat dengan titik leleh rendah (3K 2 S 2 O 7 V 2 O 5, 2 K 2 S 2 O 7 V 2 O 5 dan K 2 S 2 O 7 V 2 O 5, masing-masing terurai pada 315-330, 365-380 dan 400-405 °C). Komponen aktif dalam kondisi katalisis berada dalam keadaan cair.
Skema oksidasi SO 2 menjadi SO 3 dapat direpresentasikan sebagai berikut:
Pada tahap pertama tercapai keseimbangan, tahap kedua lambat dan menentukan kecepatan proses.
Produksi asam sulfat dari belerang dengan metode kontak ganda dan penyerapan ganda (Gbr. 1) terdiri dari tahapan sebagai berikut. Udara, setelah dibersihkan dari debu, disuplai melalui peniup gas ke menara pengering, di mana udara tersebut dikeringkan hingga 93-98%. asam sulfat hingga kadar air 0,01% volume. Udara kering memasuki tungku belerang setelah pemanasan awal di salah satu penukar panas unit kontak. Tungku membakar belerang yang disuplai melalui nozel: S + O 2 = SO 2 + 297.028 kJ. Gas yang mengandung 10-14% volume SO 2 didinginkan dalam boiler dan, setelah diencerkan dengan udara hingga kandungan SO 2 sebesar 9-10% volume pada 420°C, memasuki peralatan kontak untuk tahap konversi pertama, yang mana terjadi pada tiga lapisan katalis (SO 2 + V 2 O 2 = SO 3 + 96,296 kJ), setelah itu gas didinginkan dalam penukar panas. Kemudian gas yang mengandung 8,5-9,5% SO 3 pada suhu 200°C memasuki tahap penyerapan pertama ke dalam penyerap, diairi dan 98% asam sulfat: JADI 3 + H 2 O = H 2 JADI 4 + 130,56 kJ. Selanjutnya, gas mengalami pembersihan percikan asam sulfat, dipanaskan hingga 420°C dan memasuki tahap konversi kedua, yang terjadi pada dua lapisan katalis. Sebelum penyerapan tahap kedua, gas didinginkan dalam economizer dan disuplai ke penyerap tahap kedua, diairi dengan 98% asam sulfat, dan kemudian, setelah membersihkan percikannya, dilepaskan ke atmosfer.
1 - tungku belerang; 2 - ketel panas limbah; 3 - penghemat; 4 - menyalakan kotak api; 5, 6 - penukar panas tungku awal; 7 - perangkat kontak; 8 - penukar panas; 9 - penyerap oleum; 10 - menara pengering; 11 dan 12 - masing-masing peredam monohidrat pertama dan kedua; 13 - koleksi asam.
1 - pengumpan disk; 2 - oven; 3 - ketel panas limbah; 4 - siklon; 5 - alat pengendap listrik; 6 - menara cuci; 7 - pengendap elektrostatis basah; 8 - menara peniup; 9 - menara pengering; 10 - perangkap percikan; 11 - penyerap monohidrat pertama; 12 - penukar panas; 13 - perangkat kontak; 14 - penyerap oleum; 15 - penyerap monohidrat kedua; 16 - lemari es; 17 - koleksi.
1 - menara denitrasi; 2, 3 - menara produksi pertama dan kedua; 4 - menara oksidasi; 5, 6, 7 - menara penyerapan; 8 - pengendap listrik.
Produksi asam sulfat dari logam sulfida (Gbr. 2) jauh lebih rumit dan terdiri dari operasi berikut. FeS 2 dibakar dalam tungku fluidized bed menggunakan semburan udara: 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 + 13476 kJ. Gas pemanggangan dengan kandungan SO 2 13-14%, bersuhu 900°C, masuk ke boiler, kemudian didinginkan hingga 450°C. Penghapusan debu dilakukan dalam siklon dan alat pengendap listrik. Selanjutnya gas melewati dua menara cuci, diairi dengan 40% dan 10% asam sulfat. Dalam hal ini, gas akhirnya dibersihkan dari debu, fluor dan arsenik. Untuk pemurnian gas dari aerosol asam sulfat dihasilkan di menara cuci, disediakan dua tahap pengendap elektrostatis basah. Setelah dikeringkan di menara pengering, sebelum gas diencerkan hingga kadar 9% SO 2, gas disuplai ke tahap konversi pertama (3 lapisan katalis) melalui blower gas. Dalam penukar panas, gas dipanaskan hingga 420°C berkat panas gas yang berasal dari konversi tahap pertama. SO 2, teroksidasi sebesar 92-95% menjadi SO 3, memasuki tahap pertama penyerapan ke dalam oleum dan penyerap monohidrat, dimana ia dibebaskan dari SO 3. Selanjutnya gas yang mengandung SO 2 ~ 0,5% memasuki tahap konversi kedua, yang terjadi pada satu atau dua lapisan katalis. Gas dipanaskan terlebih dahulu di kelompok penukar panas lain hingga 420 °C berkat panas gas yang berasal dari katalisis tahap kedua. Setelah SO 3 dipisahkan pada tahap penyerapan kedua, gas tersebut dilepaskan ke atmosfer.
Derajat konversi SO 2 menjadi SO 3 dengan metode kontak sebesar 99,7%, derajat serapan SO 3 sebesar 99,97%. Produksi asam sulfat dilakukan dalam satu tahap katalisis, sedangkan derajat konversi SO 2 menjadi SO 3 tidak melebihi 98,5%. Sebelum dilepaskan ke atmosfer, gas dibersihkan dari sisa SO2 (lihat). Produktivitas instalasi modern 1500-3100 t/hari.
Inti dari metode nitrosa (Gbr. 3) adalah bahwa gas pemanggangan, setelah didinginkan dan dibersihkan dari debu, diolah dengan apa yang disebut nitrosa - asam sulfat, di mana nitrogen oksida dilarutkan. SO 2 diserap oleh nitrosa dan kemudian dioksidasi: SO 2 + N 2 O 3 + H 2 O = H 2 SO 4 + NO. NO yang dihasilkan sulit larut dalam nitrosa dan dilepaskan darinya, dan kemudian dioksidasi sebagian oleh oksigen dalam fase gas menjadi NO2. Campuran NO dan NO 2 diserap kembali asam sulfat dll. Nitrogen oksida tidak dikonsumsi dalam proses nitrogen dan dikembalikan ke siklus produksi karena penyerapannya yang tidak lengkap asam sulfat mereka sebagian terbawa oleh gas buang. Keuntungan metode nitrosa: kesederhanaan instrumentasi, biaya lebih rendah (10-15% lebih rendah dari kontak), kemungkinan daur ulang SO 2 100%.
Desain perangkat keras dari proses menara nitrosa sederhana: SO 2 diproses dalam 7-8 menara berlapis dengan kemasan keramik, salah satu menara (berongga) adalah volume oksidasi yang dapat disesuaikan. Menara ini memiliki pengumpul asam, lemari es, dan pompa yang menyuplai asam ke tangki bertekanan di atas menara. Kipas ekor dipasang di depan dua menara terakhir. Untuk pemurnian gas dari aerosol asam sulfat berfungsi sebagai pengendap listrik. Nitrogen oksida yang diperlukan untuk proses ini diperoleh dari HNO 3 . Untuk mengurangi emisi nitrogen oksida ke atmosfer dan 100% daur ulang SO 2, siklus pemrosesan SO 2 bebas nitrogen dipasang antara zona produksi dan penyerapan dalam kombinasi dengan metode air-asam untuk menangkap nitrogen oksida dalam-dalam. Kerugian dari metode nitrosa adalah kualitas produk yang rendah: konsentrasi asam sulfat 75%, adanya nitrogen oksida, Fe dan kotoran lainnya.
Untuk mengurangi kemungkinan kristalisasi asam sulfat standar untuk nilai komersial ditetapkan selama transportasi dan penyimpanan asam sulfat, konsentrasinya sesuai dengan suhu kristalisasi terendah. Isi asam sulfat dalam tingkat teknis (%): tower (nitrous) 75, kontak 92,5-98,0, oleum 104,5, oleum persentase tinggi 114,6, baterai 92-94. Asam sulfat disimpan dalam tangki baja dengan volume hingga 5000 m 3, total kapasitas gudang dirancang untuk hasil produksi sepuluh hari. Oleum dan asam sulfat diangkut dalam tangki kereta api baja. Terkonsentrasi dan baterai asam sulfat diangkut dalam tangki yang terbuat dari baja tahan asam. Tangki untuk mengangkut oleum ditutup dengan insulasi termal dan oleum dipanaskan sebelum diisi.
Mendefinisikan asam sulfat secara kolorimetri dan fotometri, berupa suspensi BaSO 4 - secara fototurbidimetri, serta dengan metode koulometri.
Penerapan asam sulfat
Asam sulfat digunakan dalam produksi pupuk mineral, sebagai elektrolit dalam baterai timbal, untuk produksi berbagai asam dan garam mineral, serat kimia, pewarna, zat pembentuk asap dan bahan peledak, dalam industri minyak, pengerjaan logam, tekstil, kulit dan lainnya. Ini digunakan dalam sintesis organik industri dalam reaksi dehidrasi (produksi dietil eter, ester), hidrasi (etanol dari etilen), sulfonasi (dan produk antara dalam produksi pewarna), alkilasi (produksi isooctane, polietilen glikol, kaprolaktam), dll. Konsumen terbesar asam sulfat- produksi pupuk mineral. Untuk 1 ton pupuk fosfor P 2 O 5 dikonsumsi 2,2-3,4 ton asam sulfat, dan untuk 1 t (NH 4) 2 SO 4 - 0,75 t asam sulfat. Oleh karena itu, mereka cenderung membangun pabrik asam sulfat bersamaan dengan pabrik produksi pupuk mineral. Produksi dunia asam sulfat pada tahun 1987 mencapai 152 juta ton.
Asam sulfat dan oleum adalah zat yang sangat agresif yang mempengaruhi saluran pernapasan, kulit, selaput lendir, menyebabkan kesulitan bernapas, batuk, dan seringkali radang tenggorokan, trakeitis, bronkitis, dll. Konsentrasi maksimum aerosol asam sulfat yang diperbolehkan di udara area kerja adalah 1,0 mg/m 3, di atmosfer 0,3 mg/m 3 (maksimum satu kali) dan 0,1 mg/m 3 (rata-rata harian). Konsentrasi uap yang luar biasa asam sulfat 0,008 mg/l (paparan 60 menit), mematikan 0,18 mg/l (60 menit). Kelas bahaya 2. Aerosol asam sulfat dapat terbentuk di atmosfer sebagai akibat emisi dari industri kimia dan metalurgi yang mengandung oksida S dan turun dalam bentuk hujan asam.
Penulis: Ensiklopedia Kimia N.S.ZefirovASAM SULFAT H 2 SO 4, berat molekul 98,082; tanpa warna cairan berminyak tidak berbau. Asam dibasa yang sangat kuat, pada 18°C pK a 1 - 2.8, K 2 1.2 10 -2, pK a 2 l.92; panjang ikatan dalam molekul S=O 0,143 nm, S-OH 0,154 nm, sudut HOSOH 104°, OSO 119°; mendidih dengan berbagai macam, membentuk campuran azeotropik (98,3% H 2 SO 4 dan 1,7% H 2 O dengan titik didih 338,8°C; lihat juga Tabel 1). ASAM SULFURAT, sesuai dengan kandungan 100% H 2 SO 4, memiliki komposisi (%): H 2 SO 4 99,5, 0,18, 0,14, H 3 O + 0,09, H 2 S 2 O 7 0,04, HS 2 O 7 0,05 . Dapat larut dengan air dan SO 3 dalam semua perbandingan. Dalam larutan air, ASAM SULFURAT hampir seluruhnya terdisosiasi menjadi H+, dan. Membentuk hidrat H 2 SO 4 nH 2 O, dimana n = 1, 2, 3, 4 dan 6.5.
Larutan SO 3 dalam ASAM SULFURAT disebut oleum; larutan tersebut membentuk dua senyawa H 2 SO 4 SO 3 dan H 2 SO 4 2SO 3. Oleum juga mengandung asam pirosulfat, diperoleh melalui reaksi: H 2 SO 4 + + SO 3 : H 2 S 2 O 7.


Titik didih larutan ASAM SULFURAT meningkat seiring dengan peningkatan konsentrasinya dan mencapai maksimum pada kandungan 98,3% H 2 SO 4 (Tabel 2). Titik didih oleum menurun seiring dengan meningkatnya kandungan SO3. Dengan meningkatnya konsentrasi larutan ASAM SULFURAT, tekanan uap total di atas larutan menurun dan mencapai minimum pada kandungan 98,3% H 2 SO 4. Dengan meningkatnya konsentrasi SO 3 dalam oleum, tekanan uap total di atasnya meningkat. Tekanan uap di atas larutan ASAM SULFURAT dan oleum dalam air dapat dihitung dengan persamaan: logp(Pa) = A - B/T+ 2,126, nilai koefisien A dan B bergantung pada konsentrasi ASAM SULFURAT. larutan ASAM SULFURAT terdiri dari campuran uap air, H 2 SO 4 dan SO 3, sedangkan komposisi uapnya berbeda dengan komposisi cairan pada semua konsentrasi ASAM SULFURAT, kecuali campuran azeotropik yang sesuai.
Dengan meningkatnya suhu, disosiasi H 2 SO 4 H 2 O + SO 3 - Q meningkat, persamaan ketergantungan suhu konstanta kesetimbangan lnК p = 14,74965 - 6,71464ln(298/T) - 8, 10161 10 4 T 2 -9643.04/T-9.4577 10 -3 T+2.19062 x 10 -6 T 2. Pada tekanan normal, derajat disosiasi adalah: 10 -5 (373 K), 2,5 (473 K), 27,1 (573 K), 69,1 (673 K). Massa jenis ASAM SULFURAT 100% dapat ditentukan dengan persamaan: d = 1,8517 - - 1,1 10 -3 t + 2 10 -6 t 2 g/cm 3 . Dengan meningkatnya konsentrasi larutan ASAM SULFURAT, kapasitas panasnya menurun dan mencapai minimum untuk ASAM SULFURAT 100%; kapasitas panas oleum meningkat dengan meningkatnya kandungan SO3.
Dengan meningkatnya konsentrasi dan penurunan suhu, konduktivitas termal l menurun: l = 0,518 + 0,0016t - (0,25 + + t/1293) C/100, di mana C adalah konsentrasi ASAM SULFURAT, dalam%. Maks. Viskositas oleum H 2 SO 4 SO 3 menurun seiring dengan meningkatnya suhu. Listrik ketahanan ASAM SULFURAT minimal pada konsentrasi 30 dan 92% H 2 SO 4 dan maksimal pada konsentrasi 84 dan 99,8% H 2 SO 4. Untuk oleum min. r pada konsentrasi 10% SO 3 . Dengan meningkatnya suhu, ASAM SULFURAT meningkat. Dielektrik permeabilitas 100% ASAM SULFURAT k.101 (298,15 K), 122 (281,15 K); krioskopik konstanta 6.12, ebulioskopik. konstanta 5,33; koefisien difusi uap ASAM SULFURAT di udara berubah seiring suhu; D = 1,67 · 10 -5 T 3/2 cm 2 /s.
ASAM SULFURAT merupakan oksidator yang cukup kuat, terutama bila dipanaskan; mengoksidasi HI dan sebagian HBr menjadi halogen bebas, karbon menjadi CO 2, S menjadi SO 2, mengoksidasi banyak logam (Cu, Hg, dll.). Dalam hal ini, ASAM SULFURAT direduksi menjadi SO 2, dan zat pereduksi paling kuat direduksi menjadi S dan H 2 S. Conc. H 2 SO 4 tereduksi sebagian oleh H 2, sehingga tidak dapat digunakan untuk pengeringan. Razb. Interaksi H 2 SO 4 dengan semua logam yang ditemukan di seri elektrokimia tegangan di sebelah kiri hidrogen, dengan pelepasan H 2. Mengoksidasi. sifat-sifat H 2 SO 4 encer tidak seperti biasanya. ASAM SULFURAT menghasilkan dua rangkaian garam: sulfat sedang dan hidrosulfat asam (lihat sulfat anorganik), serta eter (lihat sulfat organik). Asam peroxomonosulfuric (Caro acid) H 2 SO 5 dan peroxodisulfuric H 2 S 2 O 8 telah diketahui (lihat Sulfur).
Kuitansi. Bahan baku pembuatan asam sulfat adalah : S, logam sulfida, H 2 S, gas sisa pembangkit listrik tenaga panas, sulfat Fe, Ca, dll. tahapan memperoleh ASAM SULFURAT: 1) penyangraian bahan baku untuk menghasilkan SO 2; 2) oksidasi SO 2 menjadi SO 3 (konversi); 3) penyerapan SO3. Dalam industri, dua metode digunakan untuk produksi ASAM SULFURAT, yang berbeda adalah metode oksidasi SO 2 - kontak menggunakan katalis padat (kontak) dan nitrous - dengan nitrogen oksida. Untuk memperoleh asam sulfat dengan metode kontak, pabrik modern menggunakan katalis vanadium, yang menggantikan oksida Pt dan Fe. V 2 O 5 murni memiliki aktivitas katalitik yang lemah, yang meningkat tajam dengan adanya garam logam alkali, dengan garam K yang memiliki pengaruh paling besar.Peran promosi logam alkali disebabkan oleh pembentukan pirosulfonadat dengan titik leleh rendah (3K 2 S 2 O 7 V 2 O 5, 2K 2 S 2 O 7 V 2 O 5 dan K 2 S 2 O 7 V 2 O 5, masing-masing terurai pada 315-330, 365-380 dan 400-405 ° C). Komponen aktif dalam kondisi katalisis berada dalam keadaan cair.
Skema oksidasi SO 2 menjadi SO 3 dapat direpresentasikan sebagai berikut:
Pada tahap pertama tercapai keseimbangan, tahap kedua lambat dan menentukan kecepatan proses.
Produksi ASAM SULFURAT dari belerang dengan metode kontak ganda dan serapan ganda (Gbr. 1) terdiri dari tahapan sebagai berikut. Udara, setelah dibersihkan dari debu, disuplai oleh gas blower ke menara pengering, kemudian dikeringkan dengan ASAM SULFURAT 93-98% hingga kadar air 0,01% volume. Udara kering memasuki tungku belerang setelah pemanasan awal. pemanasan di salah satu penukar panas unit kontak. Tungku membakar belerang yang disuplai melalui nozel: S + O 2 : SO 2 + + 297.028 kJ. Gas yang mengandung 10-14% volume SO 2 didinginkan dalam boiler dan, setelah diencerkan dengan udara hingga kandungan SO 2 9-10% volume pada 420 ° C, memasuki peralatan kontak untuk tahap konversi pertama, yang terjadi pada tiga lapisan katalis (SO 2 + V 2 O 2 :: SO 3 + 96,296 kJ), setelah itu gas didinginkan dalam penukar panas. Kemudian gas yang mengandung 8,5-9,5% SO 3 pada suhu 200 °C memasuki tahap penyerapan pertama ke dalam penyerap yang diairi dengan oleum dan ASAM SULFURAT 98%: SO 3 + H 2 O : H 2 SO 4 + + 130,56 kJ. Selanjutnya gas dimurnikan dari percikan ASAM SULFURAT, dipanaskan hingga 420 °C dan memasuki konversi tahap kedua yang terjadi pada dua lapisan katalis. Sebelum penyerapan tahap kedua, gas didinginkan di dalam economizer dan disuplai ke penyerap tahap kedua, diairi dengan ASAM SULFURAT 98%, dan kemudian, setelah dibersihkan dari percikan, dilepaskan ke atmosfer. 
Beras. 1. Skema produksi asam sulfat dari belerang: tungku 1-belerang; ketel 2 pemulihan; 3 - penghemat; kotak api 4-mulai; 5, 6 - penukar panas tungku awal; perangkat 7-pin; 8 penukar panas; penyerap 9-oleum; menara 10 pengering; 11 dan 12 masing-masing adalah penyerap monohidrat pertama dan kedua; pengumpul 13 asam.

Gambar.2. Skema produksi asam sulfat dari pirit: pengumpan 1 pelat; 2 oven; ketel 3 pemulihan; 4-siklon; 5-pengendap listrik; 6 menara cuci; presipitator elektrostatik 7-basah; menara 8 knalpot; menara 9 pengering; perangkap 10 percikan; penyerap monohidrat 11 pertama; 12-wiki pertukaran panas; 13 - perangkat kontak; penyerap 14-oleum; Penyerap monohidrat 15 detik; 16-lemari es; 17 koleksi.

Beras. 3. Skema produksi asam sulfat dengan metode nitrosa: 1 - denitrat. menara; 2, 3 - produk pertama dan kedua. menara; 4-oksida. menara; 5, 6, 7-menyerap. menara; 8 - pengendap listrik.
Produksi ASAM SULFURAT dari logam sulfida (Gbr. 2) jauh lebih rumit dan terdiri dari operasi berikut. FeS 2 dibakar dalam tungku fluidized bed menggunakan semburan udara: 4FeS 2 + 11O 2: 2Fe 2 O 3 + 8SO 2 + 13476 kJ. Gas pemanggangan dengan kandungan SO 2 13-14%, bersuhu 900 °C, masuk ke boiler, kemudian didinginkan hingga 450 °C. Penghapusan debu dilakukan dalam siklon dan alat pengendap listrik. Selanjutnya gas melewati dua menara pencuci, diairi dengan ASAM SULFURAT 40% dan 10%, pada saat yang sama gas akhirnya dibersihkan dari debu, fluor dan arsenik. Untuk memurnikan gas dari aerosol ASAM SULFURAT yang terbentuk di menara pencuci, disediakan dua tahap pengendap elektrostatis basah. Setelah dikeringkan di menara pengering, sebelum gas diencerkan hingga kadar 9% SO 2, gas disuplai ke tahap konversi pertama (3 lapisan katalis) melalui blower gas. Dalam penukar panas, gas dipanaskan hingga 420 °C berkat panas gas yang berasal dari konversi tahap pertama. SO 2, teroksidasi sebesar 92-95% menjadi SO 3, memasuki tahap pertama penyerapan ke dalam oleum dan penyerap monohidrat, dimana ia dibebaskan dari SO 3. Selanjutnya, gas yang mengandung SO 2 ~ 0,5% memasuki tahap konversi kedua, yang berlangsung pada satu atau dua lapisan katalis. Gas dipanaskan terlebih dahulu di kelompok penukar panas lain hingga 420 °C karena panas gas yang berasal dari katalisis tahap kedua. Setelah SO 3 dipisahkan pada tahap penyerapan kedua, gas tersebut dilepaskan ke atmosfer.
Derajat konversi SO 2 menjadi SO 3 dengan metode kontak sebesar 99,7%, derajat serapan SO 3 sebesar 99,97%. Produksi ASAM SULFURAT dilakukan dalam satu tahap katalisis, dan derajat konversi SO 2 menjadi SO 3 tidak melebihi 98,5%. Sebelum dilepaskan ke atmosfer, gas tersebut dimurnikan dari sisa SO2 (lihat Pemurnian gas). Produktivitas instalasi modern 1500-3100 t/hari.
Inti dari metode nitrosa (Gbr. 3) adalah bahwa gas pemanggangan, setelah didinginkan dan dibersihkan dari debu, diolah dengan apa yang disebut nitrose-C. ke., di sol mana. nitrogen oksida. SO 2 diserap oleh nitrosa kemudian dioksidasi: SO 2 + N 2 O 3 + H 2 O : H 2 SO 4 + NO. NO yang dihasilkan sulit larut dalam nitrosa dan dilepaskan darinya, dan kemudian dioksidasi sebagian oleh oksigen dalam fase gas menjadi NO2. Campuran NO dan NO 2 diserap kembali oleh ASAM SULFURAT. dll. Nitrogen oksida tidak dikonsumsi dalam proses nitrogen dan dikembalikan ke produksi. siklusnya, karena penyerapannya yang tidak sempurna oleh ASAM SULFURAT, sebagiannya terbawa oleh gas buang. Keuntungan metode nitrosa: kesederhanaan instrumentasi, biaya lebih rendah (10-15% lebih rendah dari kontak), kemungkinan daur ulang SO 2 100%.
Desain perangkat keras dari proses menara nitrosa sederhana: SO 2 diproses dalam 7-8 menara berlapis keramik. nozzle, salah satu menara (berongga) adalah oksidator yang dapat disesuaikan. volume. Menara ini memiliki pengumpul asam, lemari es, dan pompa yang menyuplai asam ke tangki bertekanan di atas menara. Kipas ekor dipasang di depan dua menara terakhir. Alat pengendap listrik digunakan untuk memurnikan gas dari ASAM SULFURAT aerosol. Nitrogen oksida yang diperlukan untuk proses ini diperoleh dari HNO 3 . Untuk mengurangi emisi nitrogen oksida ke atmosfer dan 100% daur ulang SO 2, siklus pemrosesan SO 2 bebas nitrogen dipasang antara zona produksi dan penyerapan dalam kombinasi dengan metode air-asam untuk menangkap nitrogen oksida dalam-dalam. Kerugian dari metode nitrous adalah rendahnya kualitas produk: konsentrasi ASAM SULFURAT 75%, adanya nitrogen oksida, Fe dan pengotor lainnya.
Untuk mengurangi kemungkinan kristalisasi ASAM SULFURAT selama pengangkutan dan penyimpanan, standar telah ditetapkan untuk ASAM SULFURAT kualitas komersial, yang konsentrasinya sesuai dengan suhu kristalisasi terendah. Isi ASAM SULFURAT di bidang teknologi. nilai (%): tower (nitrous) 75, kontak 92,5-98,0, oleum 104,5, oleum persentase tinggi 114,6, baterai 92-94. ASAM SULFURAT disimpan dalam tangki baja dengan volume hingga 5000 m 3, total kapasitas gudang dirancang untuk produksi sepuluh hari. Oleum dan ASAM SULFURAT diangkut dalam tangki kereta api baja. Kesimpulan dan baterai ASAM SULFURAT diangkut dalam tangki yang terbuat dari baja tahan asam. Tangki untuk mengangkut oleum ditutup dengan insulasi termal dan oleum dipanaskan sebelum diisi.
ASAM SULFURAT ditentukan secara kolorimetri dan fotometrik, berupa suspensi BaSO 4 - secara fototurbidimetri, serta secara koulometri. metode.
Aplikasi. ASAM SULFURAT digunakan dalam produksi pupuk mineral, sebagai elektrolit dalam baterai timbal, untuk produksi berbagai asam dan garam mineral, serat kimia, pewarna, zat pembentuk asap dan bahan peledak, dalam minyak, pengerjaan logam, tekstil, kulit dan industri lainnya. Ini digunakan dalam industri. sintesis organik dalam reaksi dehidrasi (produksi dietil eter, ester), hidrasi (etanol dari etilen), sulfonasi (sintetis. deterjen dan produk antara dalam produksi pewarna), alkilasi (produksi isooctane, polietilen glikol, kapro-laktam), dll. Konsumen ASAM SULFURAT terbesar adalah produksi pupuk mineral. Untuk 1 t pupuk fosfor P 2 O 5 dikonsumsi 2,2-3,4 t ASAM SULFURAT, dan untuk 1 t (NH 4) 2 SO 4 -0,75 t ASAM SULFURAT dikonsumsi, sehingga cenderung membentuk asam sulfat. tanaman yang dikombinasikan dengan pabrik produksi pupuk mineral. Produksi ASAM SULFURAT dunia pada tahun 1987 mencapai 152 juta ton.
ASAM SULFURAT dan oleum merupakan zat yang sangat agresif yang mempengaruhi saluran pernapasan, kulit, selaput lendir, menyebabkan kesulitan bernapas, batuk, sering radang tenggorokan, trakeitis, bronkitis, dll. MPC aerosol ASAM SULFURAT di udara area kerja 1, 0 mg/ m3, di atm. udara 0,3 mg/m 3 (maks. satu kali) dan 0,1 mg/m 3 (rata-rata harian). Konsentrasi uap ASAM SULFURAT yang merusak adalah 0,008 mg/l (paparan 60 menit), mematikan 0,18 mg/l (60 menit). Kelas bahaya 2. ASAM SULFURAT Aerosol dapat terbentuk di atmosfer sebagai akibat emisi bahan kimia dan metalurgi. industri yang mengandung oksida S dan turun dalam bentuk hujan asam.
Literatur: Buku Pegangan Asam Sulfat, ed. K.M. Malina, edisi ke-2, M., 1971; Amelin A.G., Teknologi asam sulfat, edisi ke-2, M., 1983; Vasiliev B.T., Otvagina M.I., Teknologi asam sulfat, M., 1985. Yu.V. Filatov.
Ensiklopedia kimia. Jilid 4 >>
DEFINISI
Anhidrat asam sulfat adalah cairan kental dan berat yang mudah larut dengan air dalam perbandingan berapa pun: interaksi ini ditandai dengan efek eksotermik yang sangat besar (~880 kJ/mol pada pengenceran tak terhingga) dan dapat menyebabkan titik didih yang eksplosif dan percikan campuran jika air dimasukkan ke dalam air. ditambahkan ke asam; Inilah sebabnya mengapa sangat penting untuk selalu membalikkan urutan dalam menyiapkan larutan dan menambahkan asam ke dalam air, secara perlahan dan sambil diaduk.
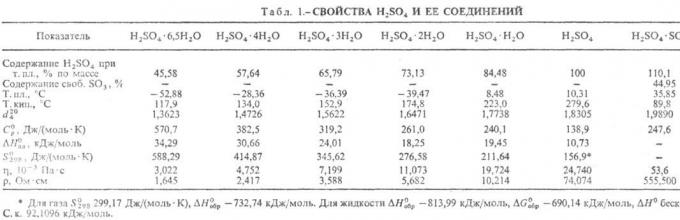
Beberapa sifat fisik asam sulfat diberikan dalam tabel.
H 2 SO 4 anhidrat adalah senyawa luar biasa dengan konstanta dielektrik yang luar biasa tinggi dan konduktivitas listrik yang sangat tinggi, yang disebabkan oleh autodisosiasi ionik (autoprotolisis) senyawa tersebut, serta mekanisme konduksi relai dengan transfer proton, yang menjamin aliran arus listrik melalui cairan kental dengan jumlah yang besar ikatan hidrogen.
Tabel 1. Properti fisik asam sulfat.
Persiapan asam sulfat
Asam sulfat adalah bahan kimia industri terpenting dan asam termurah yang diproduksi dalam volume besar di seluruh dunia.
Asam sulfat pekat (“minyak vitriol”) pertama kali diperoleh dengan memanaskan “vitriol hijau” FeSO 4 × nH 2 O dan dikonsumsi dalam jumlah besar untuk menghasilkan Na 2 SO 4 dan NaCl.
DI DALAM proses modern Untuk menghasilkan asam sulfat, digunakan katalis yang terdiri dari vanadium(V) oksida dengan penambahan kalium sulfat pada pembawa silikon dioksida atau kieselguhr. Sulfur dioksida SO2 dihasilkan dengan membakar belerang murni atau dengan memanggang bijih sulfida (terutama pirit atau bijih Cu, Ni dan Zn) dalam proses ekstraksi logam-logam ini.SO2 kemudian dioksidasi menjadi trioksida, dan kemudian asam sulfat diperoleh dengan melarutkan dalam air:
S + O 2 → SO 2 (ΔH 0 - 297 kJ/mol);
SO 2 + ½ O 2 → SO 3 (ΔH 0 - 9,8 kJ/mol);
SO 3 + H 2 O → H 2 SO 4 (ΔH 0 - 130 kJ/mol).
Sifat kimia asam sulfat
Asam sulfat merupakan asam dibasa kuat. Pada langkah pertama, dalam larutan dengan konsentrasi rendah, ia terdisosiasi hampir seluruhnya:
H 2 JADI 4 ↔H + + HSO 4 - .
Disosiasi tahap kedua
HSO 4 — ↔H + + SO 4 2-
terjadi pada tingkat yang lebih rendah. Konstanta disosiasi asam sulfat tahap kedua, dinyatakan dalam aktivitas ion, K 2 = 10 -2.
Sebagai asam dibasa, asam sulfat membentuk dua rangkaian garam: sedang dan asam. Garam rata-rata asam sulfat disebut sulfat, dan garam asam disebut hidrosulfat.
Asam sulfat dengan rakus menyerap uap air dan oleh karena itu sering digunakan untuk mengeringkan gas. Kemampuan menyerap air juga menjelaskan terjadinya hangus pada banyak tanaman bahan organik, terutama yang termasuk golongan karbohidrat (serat, gula, dll), bila terkena asam sulfat pekat. Asam sulfat menghilangkan hidrogen dan oksigen dari karbohidrat, yang membentuk air, dan karbon dilepaskan dalam bentuk batu bara.
Asam sulfat pekat, terutama yang panas, merupakan zat pengoksidasi yang kuat. Ia mengoksidasi HI dan HBr (tetapi bukan HCl) menjadi halogen bebas, batubara menjadi CO2, belerang menjadi SO2. Reaksi-reaksi ini dinyatakan dengan persamaan:
8HI + H 2 SO 4 = 4I 2 + H 2 S + 4H 2 O;
2HBr + H 2 SO 4 = Br 2 + SO 2 + 2H 2 O;
C + 2H 2 JADI 4 = CO 2 + 2SO 2 + 2H 2 O;
S + 2H 2 JADI 4 = 3JADI 2 + 2H 2 O.
Interaksi asam sulfat dengan logam terjadi berbeda-beda tergantung konsentrasinya. Asam sulfat encer teroksidasi dengan ion hidrogennya. Oleh karena itu, ia hanya berinteraksi dengan logam-logam yang rangkaian tegangannya hanya sampai hidrogen, misalnya:
Zn + H 2 JADI 4 = ZnSO 4 + H 2.
Namun, timbal tidak larut dalam asam encer, karena garam PbSO 4 yang dihasilkan tidak larut.
Asam sulfat pekat merupakan oksidator karena belerang (VI). Ini mengoksidasi logam dalam rentang tegangan hingga dan termasuk perak. Produk reduksinya dapat bervariasi tergantung pada aktivitas logam dan kondisi (konsentrasi asam, suhu). Saat berinteraksi dengan si kecil logam aktif, misalnya dengan tembaga, asam direduksi menjadi SO 2:
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O.
Ketika berinteraksi dengan logam yang lebih aktif, produk reduksinya dapat berupa dioksida dan sulfur bebas serta hidrogen sulfida. Misalnya, ketika berinteraksi dengan seng, reaksi berikut dapat terjadi:
Zn + 2H 2 JADI 4 = ZnSO 4 + JADI 2 + 2H 2 O;
3Zn + 4H 2 SO 4 = 3ZnSO 4 + S↓ + 4H 2 O;
4Zn + 5H 2 SO 4 = 4ZnSO 4 + H 2 S + 4H 2 O.
Penerapan asam sulfat
Penggunaan asam sulfat bervariasi dari satu negara ke negara lain dan dari dekade ke dekade. Misalnya saja di Amerika saat ini wilayah utama konsumsi H 2 SO 4 - produksi pupuk (70%), diikuti oleh produksi kimia, metalurgi, penyulingan minyak (~5% di setiap area). Di Inggris, distribusi konsumsi menurut industri berbeda: hanya 30% H2SO4 yang dihasilkan digunakan dalam produksi pupuk, namun 18% digunakan untuk cat, pigmen dan produk setengah jadi dari produksi pewarna, 16% untuk produksi kimia, 12 % untuk produksi sabun dan deterjen, 10 % untuk produksi serat alami dan buatan dan 2,5% digunakan dalam metalurgi.
Contoh pemecahan masalah
CONTOH 1
| Latihan | Tentukan massa asam sulfat yang dapat diperoleh dari satu ton pirit jika rendemen sulfur (IV) oksida pada reaksi pemanggangan adalah 90%, dan sulfur (VI) oksida pada oksidasi katalitik sulfur (IV) adalah 95% dari teoritis. |
| Larutan | Mari kita tuliskan persamaan reaksi pembakaran pirit: 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2. Mari kita hitung jumlah zat pirit: n(FeS 2) = m(FeS 2) / M(FeS 2); M(FeS 2) = Ar(Fe) + 2×Ar(S) = 56 + 2×32 = 120g/mol; n(FeS 2) = 1000 kg / 120 = 8,33 kmol. Karena dalam persamaan reaksi koefisien sulfur dioksida dua kali lebih besar dari koefisien FeS 2, maka secara teoritis jumlah zat sulfur oksida (IV) yang mungkin adalah: teori n(SO 2) = 2 ×n(FeS 2) = 2 ×8,33 = 16,66 kmol. Dan jumlah mol sulfur oksida (IV) yang diperoleh secara praktis adalah: n(SO 2) praktek = η × n(SO 2) teori = 0,9 × 16,66 = 15 kmol. Mari kita tulis persamaan reaksi oksidasi belerang oksida (IV) menjadi belerang oksida (VI): 2SO 2 + O 2 = 2SO 3. Jumlah sulfur oksida (VI) yang mungkin secara teoritis sama dengan: n(SO 3) teori = n(SO 2) praktek = 15 kmol. Dan jumlah mol sulfur oksida (VI) yang diperoleh secara praktis adalah: n(SO 3) praktek = η × n(SO 3) teori = 0,5 × 15 = 14,25 kmol. Mari kita tulis persamaan reaksi produksi asam sulfat: JADI 3 + H 2 O = H 2 JADI 4. Mari kita cari jumlah asam sulfat: n(H 2 SO 4) = n(SO 3) praktik = 14,25 kmol. Hasil reaksinya adalah 100%. Massa asam sulfat sama dengan: m(H 2 JADI 4) = n(H 2 JADI 4) × M(H 2 JADI 4); M(H 2 SO 4) = 2×Ar(H) + Ar(S) + 4×Ar(O) = 2×1 + 32 + 4×16 = 98 g/mol; m(H 2 SO 4) = 14,25 × 98 = 1397kg. |
| Menjawab | Massa asam sulfat adalah 1397 kg |
Sifat asam sulfat
Asam sulfat anhidrat (monohidrat) adalah cairan berminyak berat yang bercampur dengan air dalam berbagai perbandingan untuk dilepaskan jumlah besar panas. Massa jenis pada 0 °C adalah 1,85 g/cm3. Mendidih pada suhu 296 °C dan membeku pada suhu -10 °C. Asam sulfat disebut tidak hanya monohidrat, tetapi juga larutan berair itu (), serta larutan belerang trioksida dalam monohidrat (), disebut oleum. Oleum “berasap” di udara karena desorpsi darinya. Asam sulfat murni tidak berwarna, sedangkan asam sulfat teknis berwarna gelap karena pengotor.
Sifat fisik asam sulfat, seperti massa jenis, suhu kristalisasi, titik didih, bergantung pada komposisinya. Pada Gambar. Gambar 1 menunjukkan diagram kristalisasi sistem. Maksimum di dalamnya sesuai dengan komposisi senyawa atau adanya minimum dijelaskan oleh fakta bahwa suhu kristalisasi campuran dua zat lebih rendah daripada suhu kristalisasi masing-masing zat.
Beras. 1
Asam sulfat 100% anhidrat memiliki suhu kristalisasi yang relatif tinggi yaitu 10,7 °C. Untuk mengurangi kemungkinan pembekuan produk komersial selama pengangkutan dan penyimpanan, konsentrasi asam sulfat teknis dipilih sedemikian rupa sehingga mempunyai cukup suhu rendah kristalisasi. Industri ini memproduksi tiga jenis asam sulfat komersial.
Asam sulfat sangat aktif. Ia melarutkan oksida logam dan sebagian besar logam murni; pada suhu tinggi, ia menggantikan semua asam lain dari garam. Asam sulfat sangat mudah bereaksi dengan air karena kemampuannya membentuk hidrat. Ia mengambil air dari asam lain, dari kristal hidrat garam dan bahkan turunan oksigen dari hidrokarbon, yang tidak mengandung air, tetapi hidrogen dan oksigen dalam kombinasi H:O = 2. kayu dan jaringan tumbuhan dan hewan lain yang mengandung selulosa, pati dan gula dihancurkan dalam asam sulfat pekat; air berikatan dengan asam dan hanya karbon terdispersi halus yang tersisa dari jaringan. Dalam asam encer, selulosa dan pati terurai membentuk gula. Jika asam sulfat pekat bersentuhan dengan kulit manusia, dapat menyebabkan luka bakar.
Aktivitas asam sulfat yang tinggi, dikombinasikan dengan biaya produksi yang relatif rendah, menentukan skala penerapannya yang sangat besar dan sangat beragam (Gbr. 2). Sulit untuk menemukan industri di mana asam sulfat atau produk berbahannya tidak dikonsumsi dalam jumlah yang bervariasi.

Beras. 2
Konsumen asam sulfat terbesar adalah produksi pupuk mineral: superfosfat, amonium sulfat, dll. Banyak asam (misalnya, fosfat, asetat, klorida) dan garam sebagian besar diproduksi menggunakan asam sulfat. Asam sulfat banyak digunakan dalam produksi logam non-besi dan langka. Dalam industri pengerjaan logam, asam sulfat atau garamnya digunakan untuk pengawetan produk baja sebelum pengecatan, pelapisan timah, pelapisan nikel, pelapisan krom, dll. Asam sulfat dalam jumlah besar dihabiskan untuk pemurnian produk minyak bumi. Produksi sejumlah pewarna (untuk kain), pernis dan cat (untuk bangunan dan mesin), bahan obat dan beberapa plastik juga melibatkan penggunaan asam sulfat. Menggunakan asam sulfat, etil dan alkohol lainnya, beberapa ester, deterjen sintetis, dan sejumlah pestisida untuk pengendalian hama diproduksi. Pertanian dan gulma. Larutan encer asam sulfat dan garamnya digunakan dalam produksi rayon, dalam industri tekstil untuk mengolah serat atau kain sebelum pewarnaan, serta dalam industri ringan lainnya. DI DALAM Industri makanan asam sulfat digunakan dalam produksi pati, molase dan sejumlah produk lainnya. Transportasi menggunakan baterai asam sulfat timbal. Asam sulfat digunakan untuk mengeringkan gas dan memekatkan asam. Terakhir, asam sulfat digunakan dalam proses nitrasi dan produksi sebagian besar bahan peledak.