Ahli botani Skotlandia Robert Brown (kadang-kadang nama belakangnya ditranskripsikan menjadi Brown) semasa hidupnya, sebagai ahli tanaman terbaik, menerima gelar “Pangeran Ahli Botani”. Dia membuat banyak penemuan menakjubkan. Pada tahun 1805, setelah ekspedisi empat tahun ke Australia, ia membawa ke Inggris sekitar 4.000 spesies tumbuhan Australia yang tidak diketahui para ilmuwan dan menghabiskan waktu bertahun-tahun untuk mempelajarinya. Tanaman yang dijelaskan dibawa dari Indonesia dan Afrika Tengah. Ia mempelajari fisiologi tumbuhan dan untuk pertama kalinya menjelaskan secara rinci inti sel tumbuhan. Akademi Ilmu Pengetahuan St. Petersburg mengangkatnya menjadi anggota kehormatan. Namun nama ilmuwan tersebut kini dikenal luas bukan karena karya-karyanya tersebut.
Pada tahun 1827 Brown melakukan penelitian terhadap serbuk sari tanaman. Dia sangat tertarik pada bagaimana serbuk sari berperan dalam proses pembuahan. Suatu kali dia melihat di bawah mikroskop sel serbuk sari dari tanaman Amerika Utara. Clarkia pulchella(Clarkia cantik) butiran sitoplasma memanjang tersuspensi dalam air. Tiba-tiba Brown melihat butiran padat terkecil, yang hampir tidak terlihat dalam setetes air, terus-menerus bergetar dan berpindah dari satu tempat ke tempat lain. Ia menemukan bahwa gerakan-gerakan ini, dalam kata-katanya, “tidak berhubungan dengan aliran dalam cairan atau dengan penguapan bertahap, namun melekat pada partikel itu sendiri.”
Pengamatan Brown dikonfirmasi oleh ilmuwan lain. Partikel terkecil berperilaku seolah-olah mereka hidup, dan “tarian” partikel tersebut dipercepat dengan meningkatnya suhu dan penurunan ukuran partikel dan jelas melambat ketika air diganti dengan media yang lebih kental. Fenomena menakjubkan ini tidak pernah berhenti: fenomena ini dapat diamati selama yang diinginkan. Pada mulanya Brown bahkan mengira bahwa makhluk hidup sebenarnya masuk ke dalam bidang mikroskop, apalagi serbuk sari merupakan sel reproduksi jantan pada tumbuhan, namun ada juga partikel dari tumbuhan mati, bahkan yang dikeringkan seratus tahun sebelumnya di herbarium. Kemudian Brown bertanya-tanya apakah ini adalah “molekul dasar makhluk hidup”, yang dibicarakan oleh naturalis Prancis terkenal Georges Buffon (1707–1788), penulis buku 36 jilid. Sejarah alam. Asumsi ini hilang ketika Brown mulai mengamati benda-benda yang tampaknya tidak bernyawa; mula-mula berupa partikel batu bara yang sangat kecil, serta jelaga dan debu dari udara London, kemudian digiling halus zat anorganik: kaca, banyak mineral berbeda. “Molekul-molekul aktif” ada di mana-mana: “Dalam setiap mineral,” tulis Brown, “yang telah berhasil saya hancurkan sedemikian rupa sehingga dapat tersuspensi dalam air untuk beberapa waktu, saya telah menemukan, dalam jumlah yang lebih besar atau lebih kecil, molekul-molekul ini ."
Harus dikatakan bahwa Brown tidak memiliki mikroskop terbaru apa pun. Dalam artikelnya, dia secara khusus menekankan bahwa dia memiliki lensa bikonveks biasa, yang dia gunakan selama beberapa tahun. Dan dia melanjutkan dengan mengatakan: “Sepanjang keseluruhan penelitian saya terus menggunakan lensa yang sama dengan yang saya gunakan untuk memulai penelitian ini, untuk memberikan kredibilitas yang lebih besar terhadap pernyataan saya dan membuatnya dapat diakses semaksimal mungkin oleh pengamatan biasa.”
Sekarang, untuk mengulangi pengamatan Brown, cukup memiliki mikroskop yang tidak terlalu kuat dan menggunakannya untuk memeriksa asap di dalam kotak yang menghitam, diterangi melalui lubang samping dengan seberkas cahaya yang kuat. Dalam gas, fenomena ini memanifestasikan dirinya jauh lebih jelas daripada dalam cairan: potongan-potongan kecil abu atau jelaga (tergantung pada sumber asapnya) terlihat, menghamburkan cahaya, dan terus-menerus melompat maju mundur.
Seperti yang sering terjadi dalam sains, bertahun-tahun kemudian para sejarawan menemukan bahwa pada tahun 1670, penemu mikroskop, orang Belanda Antonie Leeuwenhoek, rupanya mengamati fenomena serupa, namun kelangkaan dan ketidaksempurnaan mikroskop, keadaan embrio ilmu molekuler pada saat itu. tidak menarik perhatian pada pengamatan Leeuwenhoek, oleh karena itu penemuan tersebut dikaitkan dengan Brown, yang merupakan orang pertama yang mempelajari dan menjelaskannya secara rinci.
Gerak Brown dan teori atom-molekul.
Fenomena yang diamati oleh Brown dengan cepat diketahui secara luas. Dia sendiri menunjukkan eksperimennya kepada banyak rekannya (Brown mencantumkan dua lusin nama). Tapi jelaskan fenomena misterius, yang disebut “gerakan Brown”, tidak mungkin dilakukan baik oleh Brown sendiri maupun oleh banyak ilmuwan lain selama bertahun-tahun. Pergerakan partikel benar-benar acak: sketsa posisinya dibuat momen yang berbeda waktu (misalnya setiap menit) sekilas tidak memberikan kemungkinan untuk menemukan pola apa pun dalam gerakan-gerakan tersebut.
Penjelasan tentang gerak Brown (sebutan untuk fenomena ini) dengan pergerakan molekul tak kasat mata baru diberikan pada kuartal terakhir abad ke-19, namun tidak serta merta diterima oleh semua ilmuwan. Pada tahun 1863, seorang guru geometri deskriptif dari Karlsruhe (Jerman), Ludwig Christian Wiener (1826–1896), mengemukakan bahwa fenomena tersebut berhubungan dengan gerakan osilasi atom yang tidak terlihat. Ini adalah penjelasan pertama, meskipun sangat jauh dari modern, mengenai gerak Brown berdasarkan sifat-sifat atom dan molekul itu sendiri. Penting bagi Wiener untuk melihat peluang menggunakan fenomena ini untuk menembus rahasia struktur materi. Dia adalah orang pertama yang mencoba mengukur kecepatan pergerakan partikel Brown dan ketergantungannya pada ukurannya. Anehnya, pada tahun 1921 Laporan dari Akademi Ilmu Pengetahuan Nasional AS Sebuah karya diterbitkan tentang gerakan Brown dari Wiener lain - Norbert, pendiri sibernetika yang terkenal.
Ide-ide LK Wiener diterima dan dikembangkan oleh sejumlah ilmuwan - Sigmund Exner di Austria (dan 33 tahun kemudian - putranya Felix), Giovanni Cantoni di Italia, Karl Wilhelm Negeli di Jerman, Louis Georges Gouy di Prancis, tiga pendeta Belgia - Jesuit Carbonelli, Delso dan Tirion dan lain-lain. Di antara para ilmuwan ini adalah fisikawan dan kimiawan Inggris terkenal William Ramsay. Lambat laun menjadi jelas bahwa butiran materi terkecil dihantam dari semua sisi oleh partikel yang lebih kecil lagi, yang tidak lagi terlihat melalui mikroskop - seperti halnya gelombang yang mengguncang perahu yang jauh tidak terlihat dari pantai, sedangkan pergerakan perahu tidak terlihat. sendiri terlihat cukup jelas. Sebagaimana mereka tulis dalam salah satu pasal tahun 1877, “...hukum angka besar sekarang tidak mereduksi efek tumbukan menjadi tekanan seragam rata-rata, resultannya tidak lagi sama dengan nol, namun akan terus berubah arah dan besarnya.”
Secara kualitatif, gambaran tersebut cukup masuk akal dan bahkan visual. Kira-kira sama dengan cara ranting atau serangga kecil bergerak ketika didorong (atau ditarik) ke dalam sisi yang berbeda banyak semut. Partikel-partikel yang lebih kecil ini sebenarnya ada dalam perbendaharaan kata para ilmuwan, namun belum ada yang pernah melihatnya. Mereka disebut molekul; Diterjemahkan dari bahasa Latin, kata ini berarti “massa kecil.” Hebatnya, penjelasan inilah yang diberikan terhadap fenomena serupa oleh filsuf Romawi Titus Lucretius Carus (c. 99–55 SM) dalam puisinya yang terkenal. Tentang sifat sesuatu. Di dalamnya, ia menyebut partikel terkecil yang tidak terlihat oleh mata sebagai “prinsip dasar” benda.
Prinsip-prinsip segala sesuatu mula-mula bergerak sendiri,
Mengikuti mereka adalah tubuh dari kombinasi terkecilnya,
Seolah-olah dekat dengan prinsip-prinsip utama,
Tersembunyi dari mereka, menerima kejutan, mereka mulai berusaha,
Dirinya bergerak, lalu mendorong tubuh yang lebih besar.
Jadi, dimulai dari awal, gerakannya sedikit demi sedikit
Itu menyentuh perasaan kita dan menjadi terlihat juga
Kepada kami dan pada setitik debu yang bergerak di bawah sinar matahari,
Meskipun getaran yang ditimbulkannya tidak terlihat...
Selanjutnya, ternyata Lucretius salah: tidak mungkin mengamati gerak Brown dengan mata telanjang, dan partikel debu pada sinar matahari yang menembus ke dalam kamar gelap, “menari” karena gerakan pusaran udara. Namun secara lahiriah kedua fenomena tersebut memiliki beberapa kesamaan. Dan baru pada abad ke-19. Menjadi jelas bagi banyak ilmuwan bahwa pergerakan partikel Brown disebabkan oleh dampak acak dari molekul medium. Molekul yang bergerak bertabrakan dengan partikel debu dan partikel padat lainnya yang ada di dalam air. Semakin tinggi suhunya, semakin cepat pergerakannya. Jika setitik debu berukuran besar, misalnya berukuran 0,1 mm (diameternya sejuta kali lebih besar dari molekul air), maka banyak dampak simultan dari semua sisi yang saling seimbang dan praktis tidak terjadi. “merasakan” mereka – kurang lebih sama dengan sepotong kayu seukuran piring tidak akan “merasakan” usaha banyak semut yang akan menarik atau mendorongnya ke arah yang berbeda. Jika partikel debu berukuran relatif kecil, ia akan bergerak ke satu arah atau lainnya karena pengaruh molekul di sekitarnya.
Partikel Brown memiliki ukuran sekitar 0,1–1 m, yaitu. dari seperseribu hingga sepersepuluh ribu milimeter, itulah sebabnya Brown dapat membedakan pergerakan mereka karena dia melihat butiran sitoplasma kecil, dan bukan serbuk sari itu sendiri (yang sering kali salah ditulis). Masalahnya adalah sel serbuk sari terlalu besar. Jadi, pada serbuk sari rumput padang rumput yang terbawa angin dan menyebabkan penyakit alergi pada manusia (hay Fever), ukuran selnya biasanya berkisar antara 20 - 50 mikron, yaitu. mereka terlalu besar untuk mengamati gerak Brown. Penting juga untuk dicatat bahwa pergerakan individu partikel Brown sangat sering terjadi dan dalam jarak yang sangat pendek, sehingga tidak mungkin untuk melihatnya, tetapi di bawah mikroskop, pergerakan yang terjadi selama periode waktu tertentu dapat terlihat.
Tampaknya fakta keberadaan gerak Brown terbukti dengan jelas struktur molekul Namun, penting bahkan pada awal abad ke-20. Ada ilmuwan, termasuk fisikawan dan kimia, yang tidak percaya akan keberadaan molekul. Teori atom-molekul hanya secara perlahan dan sulit mendapat pengakuan. Oleh karena itu, ahli kimia organik terkemuka Perancis Marcelin Berthelot (1827–1907) menulis: “Konsep molekul, dari sudut pandang pengetahuan kita, tidak pasti, sedangkan konsep lain – atom – murni hipotetis.” Ahli kimia Prancis terkenal A. Saint-Clair Deville (1818–1881) berbicara lebih jelas lagi: “Saya tidak menerima hukum Avogadro, baik atom, maupun molekul, karena saya menolak untuk mempercayai apa yang tidak dapat saya lihat atau amati. ” Dan ahli kimia fisika Jerman Wilhelm Ostwald (1853–1932), penerima Hadiah Nobel, salah satu pendiri kimia fisik, pada awal abad ke-20. dengan tegas menyangkal keberadaan atom. Dia berhasil menulis buku teks kimia tiga jilid yang tidak pernah menyebutkan kata “atom”. Berbicara pada tanggal 19 April 1904 dengan laporan besar di Royal Institution kepada anggota Inggris Masyarakat Kimia, Ostwald mencoba membuktikan bahwa atom tidak ada, dan “apa yang kita sebut materi hanyalah kumpulan energi yang dikumpulkan di suatu tempat tertentu.”
Namun para fisikawan yang menerima teori molekuler pun tidak dapat mempercayai hal tersebut dengan cara yang sederhana Validitas teori atom-molekul terbukti, sehingga berbagai alasan alternatif dikemukakan untuk menjelaskan fenomena tersebut. Dan hal ini sesuai dengan semangat sains: sampai penyebab suatu fenomena teridentifikasi secara jelas, dimungkinkan (dan bahkan perlu) untuk mengasumsikan berbagai hipotesis, yang jika memungkinkan, harus diuji secara eksperimental atau teoritis. Jadi, pada tahun 1905 Kamus Ensiklopedis Brockhaus dan Efron menerbitkan artikel pendek oleh profesor fisika St. Petersburg N.A. Gezehus, guru dari akademisi terkenal A.F. Ioffe. Gesehus menulis bahwa, menurut beberapa ilmuwan, gerak Brown disebabkan oleh “sinar cahaya atau panas yang melewati cairan,” dan bermuara pada “aliran sederhana di dalam cairan yang tidak ada hubungannya dengan pergerakan molekul,” dan aliran ini dapat disebabkan oleh “penguapan, difusi, dan alasan lainnya”. Lagi pula, telah diketahui bahwa pergerakan partikel debu di udara yang sangat mirip justru disebabkan oleh aliran pusaran. Namun penjelasan yang diberikan oleh Gesehus dapat dengan mudah dibantah secara eksperimental: jika Anda melihat dua partikel Brown yang letaknya sangat berdekatan melalui mikroskop yang kuat, pergerakannya akan menjadi sepenuhnya independen. Jika pergerakan ini disebabkan oleh aliran apa pun dalam cairan, maka partikel-partikel di sekitarnya akan bergerak bersamaan.
Teori gerak Brown.
Pada awal abad ke-20. sebagian besar ilmuwan memahami sifat molekuler gerak Brown. Namun semua penjelasan masih bersifat kualitatif; tidak ada teori kuantitatif yang dapat bertahan verifikasi eksperimental. Selain itu, Anda sendiri hasil percobaan tidak jelas: pemandangan fantastis dari partikel-partikel yang bergerak tanpa henti menghipnotis para peneliti, dan mereka tidak tahu persis karakteristik fenomena apa yang perlu diukur.
Meskipun tampak tidak teratur sepenuhnya, pergerakan acak partikel Brown masih dapat dijelaskan melalui hubungan matematis. Untuk pertama kalinya, penjelasan mendalam tentang gerak Brown diberikan pada tahun 1904 oleh fisikawan Polandia Marian Smoluchowski (1872–1917), yang pada tahun-tahun itu bekerja di Universitas Lviv. Pada saat yang sama, teori fenomena ini dikembangkan oleh Albert Einstein (1879–1955), seorang ahli kelas 2 yang saat itu kurang dikenal di Kantor Paten kota Bern di Swiss. Artikelnya yang diterbitkan pada Mei 1905 di jurnal Jerman Annalen der Physik diberi judul Tentang gerak partikel yang tersuspensi dalam suatu fluida dalam keadaan diam, diperlukan oleh teori kinetik molekuler tentang panas. Dengan nama tersebut, Einstein ingin menunjukkan bahwa teori kinetik molekuler tentang struktur materi tentu menyiratkan adanya gerak acak partikel padat terkecil dalam cairan.
Sangat mengherankan bahwa di awal artikel ini, Einstein menulis bahwa dia akrab dengan fenomena itu sendiri, meskipun secara dangkal: “Ada kemungkinan bahwa gerakan yang dimaksud identik dengan apa yang disebut gerakan molekul Brown, tetapi data yang tersedia bagi saya mengenai pendapat terakhir ini sangat tidak akurat sehingga saya tidak dapat merumuskan pendapat yang pasti.” Dan beberapa dekade kemudian, di akhir hidupnya, Einstein menulis sesuatu yang berbeda dalam memoarnya - bahwa dia sama sekali tidak mengetahui tentang gerak Brown dan sebenarnya “menemukan kembali” secara teoritis: “Tidak mengetahui bahwa pengamatan terhadap “gerakan Brown” telah lama dilakukan. diketahui, saya menemukan bahwa teori atom mengarah pada adanya gerak yang dapat diamati dari partikel-partikel tersuspensi mikroskopis." Meskipun demikian, artikel teoretis Einstein diakhiri dengan seruan langsung kepada para peneliti untuk menguji kesimpulannya secara eksperimental: "Jika ada peneliti yang dapat segera menjawab pertanyaan yang diajukan di sini pertanyaan!" – dia mengakhiri artikelnya dengan seruan yang tidak biasa.
Jawaban atas seruan penuh semangat Einstein tidak lama lagi akan datang.
Menurut teori Smoluchowski-Einstein, nilai rata-rata perpindahan kuadrat partikel Brown ( S 2) untuk waktu T berbanding lurus dengan suhu T dan berbanding terbalik dengan viskositas cairan h, ukuran partikel R dan konstanta Avogadro
N A: S 2 = 2RTt/6 jam rN A,
Di mana R– konstanta gas. Jadi, jika dalam 1 menit sebuah partikel dengan diameter 1 μm bergerak sebesar 10 μm, maka dalam 9 menit - sebesar 10 = 30 μm, dalam 25 menit - sebesar 10 = 50 μm, dst. Dalam kondisi serupa, sebuah partikel dengan diameter 0,25 μm dalam periode waktu yang sama (1, 9, dan 25 menit) akan bergerak masing-masing sebesar 20, 60, dan 100 μm, karena = 2. Rumus di atas harus mencakup Konstanta Avogadro, yang dengan demikian, dapat ditentukan dengan pengukuran kuantitatif pergerakan partikel Brown, yang dilakukan oleh fisikawan Perancis Jean Baptiste Perrin (1870–1942).
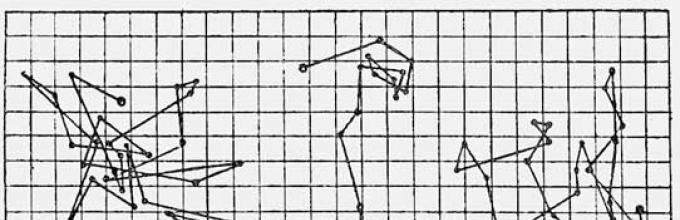
Pada tahun 1908, Perrin memulai pengamatan kuantitatif terhadap gerak partikel Brown di bawah mikroskop. Dia menggunakan ultramikroskop, ditemukan pada tahun 1902, yang memungkinkan untuk mendeteksi partikel terkecil dengan menghamburkan cahaya ke partikel tersebut dari iluminator samping yang kuat. Perrin memperoleh bola-bola kecil berbentuk hampir bulat dan berukuran kira-kira sama dari permen karet, getah kental beberapa pohon tropis (juga digunakan sebagai cat air kuning). Manik-manik kecil ini disuspensikan dalam gliserol yang mengandung 12% air; cairan kental mencegah munculnya aliran internal di dalamnya yang akan mengaburkan gambar. Berbekal stopwatch, Perrin mencatat dan kemudian membuat sketsa (tentu saja, dalam skala yang sangat besar) pada selembar kertas grafik posisi partikel secara berkala, misalnya setiap setengah menit. Dengan menghubungkan titik-titik yang dihasilkan dengan garis lurus, ia memperoleh lintasan yang rumit, beberapa di antaranya ditunjukkan pada gambar (diambil dari buku Perrin atom, diterbitkan pada tahun 1920 di Paris). Pergerakan partikel yang kacau dan tidak teratur mengarah pada fakta bahwa mereka bergerak cukup lambat di ruang angkasa: jumlah segmennya jauh lebih besar daripada perpindahan partikel dari titik pertama ke titik terakhir.

Posisi berturut-turut setiap 30 detik dari tiga partikel Brown - bola karet dengan ukuran sekitar 1 mikron. Satu sel setara dengan jarak 3 µm. Jika Perrin dapat menentukan posisi partikel Brown bukan setelah 30, tetapi setelah 3 detik, maka garis lurus antara setiap titik yang berdekatan akan berubah menjadi garis putus-putus zigzag kompleks yang sama, hanya saja dalam skala yang lebih kecil.
Dengan menggunakan rumus teori dan hasilnya, Perrin memperoleh nilai bilangan Avogadro yang cukup akurat saat itu: 6,8 . 10 23 . Perrin juga menggunakan mikroskop untuk mempelajari distribusi vertikal partikel Brown ( cm. HUKUM AVOGADRO) dan menunjukkan bahwa, meskipun ada pengaruh gravitasi, mereka tetap tersuspensi dalam larutan. Perrin juga memiliki yang lain pekerjaan penting. Pada tahun 1895 ia membuktikan bahwa sinar katoda bersifat negatif muatan listrik(elektron), pada tahun 1901 ia pertama kali mengusulkan model atom planet. Pada tahun 1926 ia dianugerahi Hadiah Nobel Fisika.
Hasil yang diperoleh Perrin membenarkan kesimpulan teoritis Einstein. Hal itu memberikan kesan yang kuat. Seperti yang ditulis fisikawan Amerika A. Pais bertahun-tahun kemudian, “Anda tidak pernah berhenti terkesima dengan hasil yang diperoleh dengan cara sederhana ini: cukup dengan menyiapkan suspensi bola, yang ukurannya lebih besar dibandingkan dengan ukurannya. molekul sederhana, ambil stopwatch dan mikroskop, dan Anda dapat menentukan konstanta Avogadro!” Orang mungkin juga terkejut: deskripsi eksperimen baru tentang gerak Brown masih muncul di jurnal ilmiah (Nature, Science, Journal of Chemical Education) dari waktu ke waktu! Setelah hasil Perrin dipublikasikan, Ostwald, mantan penentang atomisme, mengakui bahwa “kebetulan gerak Brown dengan persyaratan hipotesis kinetik... kini memberikan hak kepada ilmuwan yang paling berhati-hati untuk berbicara tentang bukti eksperimental teori atom. materi. Dengan demikian, teori atom telah diangkat ke peringkat teori ilmiah yang mempunyai landasan kuat.” Hal serupa juga disampaikan oleh matematikawan dan fisikawan Prancis Henri Poincaré: “Penentuan jumlah atom yang brilian oleh Perrin melengkapi kejayaan atomisme... Atom para ahli kimia kini telah menjadi kenyataan.”
Gerak Brown dan difusi.
Pergerakan partikel Brown sangat mirip dengan pergerakan molekul individu akibat gerakan termalnya. Gerakan ini disebut difusi. Bahkan sebelum karya Smoluchowski dan Einstein, hukum gerak molekul telah ditetapkan dalam kasus paling sederhana yaitu wujud gas. Ternyata molekul-molekul dalam gas bergerak sangat cepat - secepat peluru, namun tidak dapat terbang jauh, karena sangat sering bertabrakan dengan molekul lain. Misalnya, molekul oksigen dan nitrogen di udara, yang bergerak dengan kecepatan rata-rata sekitar 500 m/s, mengalami lebih dari satu miliar tumbukan setiap detik. Oleh karena itu, jalur molekul, jika memungkinkan untuk diikuti, akan menjadi garis putus-putus yang kompleks. Partikel Brown juga menggambarkan lintasan serupa jika posisinya dicatat pada interval waktu tertentu. Baik difusi maupun gerak Brown merupakan konsekuensi dari gerak termal molekul yang kacau dan oleh karena itu dijelaskan dengan persamaan ketergantungan matematika. Bedanya, molekul-molekul dalam gas bergerak lurus hingga bertabrakan dengan molekul lain, setelah itu berubah arah. Partikel Brown, tidak seperti molekul, tidak melakukan “penerbangan bebas”, tetapi sangat sering mengalami “kegugupan” kecil dan tidak beraturan, akibatnya partikel tersebut bergeser secara kacau ke satu arah atau yang lain. Perhitungan telah menunjukkan bahwa untuk partikel berukuran 0,1 µm, satu pergerakan terjadi dalam tiga per miliar detik pada jarak hanya 0,5 nm (1 nm = 0,001 µm). Seperti yang dikatakan dengan tepat oleh seorang penulis, hal ini mengingatkan kita pada memindahkan kaleng bir kosong ke dalam lapangan tempat banyak orang berkumpul.
Difusi jauh lebih mudah untuk diamati daripada gerak Brown, karena tidak memerlukan mikroskop: pergerakan yang diamati bukan dari partikel individu, tetapi dari massanya yang sangat besar, Anda hanya perlu memastikan bahwa difusi tidak ditumpangkan oleh konveksi - pencampuran materi sebagai a akibat aliran pusaran (aliran seperti itu mudah dilihat dengan menempatkan setetes larutan berwarna, seperti tinta, ke dalam segelas air panas).
Difusi mudah diamati pada gel kental. Gel semacam itu dapat dibuat, misalnya, dalam toples penisilin dengan menyiapkan larutan gelatin 4–5% di dalamnya. Agar-agar terlebih dahulu harus membengkak selama beberapa jam, kemudian larut seluruhnya sambil diaduk dengan menurunkan toples ke dalam air panas. Setelah pendinginan, diperoleh gel yang tidak mengalir dalam bentuk massa transparan dan agak keruh. Jika, dengan menggunakan pinset tajam, Anda dengan hati-hati memasukkan kristal kecil kalium permanganat (“kalium permanganat”) ke tengah massa ini, kristal tersebut akan tetap menggantung di tempatnya tertinggal, karena gel mencegahnya jatuh. Dalam beberapa menit, bola berwarna ungu akan mulai tumbuh di sekitar kristal; seiring waktu, bola itu menjadi semakin besar hingga dinding toples mengubah bentuknya. Hasil yang sama dapat diperoleh dengan menggunakan kristal tembaga sulfat, hanya dalam hal ini bola tidak akan berubah menjadi ungu, tetapi biru.
Jelas mengapa berbentuk bola: MnO 4 – ion yang terbentuk ketika kristal larut, masuk ke dalam larutan (gel sebagian besar terdiri dari air) dan, sebagai hasil difusi, bergerak secara merata ke segala arah, sementara gravitasi hampir tidak berpengaruh pada bola. tingkat difusi. Difusi dalam cairan sangat lambat: dibutuhkan waktu berjam-jam agar bola tumbuh beberapa sentimeter. Dalam gas, difusi jauh lebih cepat, namun tetap saja, jika udara tidak tercampur, bau parfum atau amonia akan menyebar ke seluruh ruangan selama berjam-jam.
Teori gerak Brown: jalan acak.
Teori Smoluchowski – Einstein menjelaskan hukum difusi dan gerak Brown. Kita dapat mempertimbangkan pola-pola ini dengan menggunakan contoh difusi. Jika kecepatan molekulnya adalah kamu, lalu, bergerak dalam garis lurus, dalam waktu T akan menempuh jarak L = keluar, namun akibat tumbukan dengan molekul lain, molekul tersebut tidak bergerak lurus, melainkan terus menerus berubah arah geraknya. Jika memungkinkan untuk membuat sketsa jalur suatu molekul, pada dasarnya tidak ada bedanya dengan gambar yang diperoleh Perrin. Dari gambar-gambar ini jelas bahwa akibat gerak kacau, molekul berpindah sejauh tertentu S, secara signifikan kurang dari L. Besaran-besaran ini dihubungkan oleh relasi S= , dimana l adalah jarak yang ditempuh molekul dari satu tumbukan ke tumbukan lainnya, jalur bebas rata-rata. Pengukuran telah menunjukkan bahwa untuk molekul udara pada tekanan atmosfer normal l ~ 0,1 μm, yang berarti bahwa pada kecepatan 500 m/s molekul nitrogen atau oksigen akan menempuh jarak dalam 10.000 detik (kurang dari tiga jam) L= 5000 km, dan akan bergeser dari posisi semula hanya sebesar S= 0,7 m (70 cm), itulah sebabnya zat bergerak sangat lambat akibat difusi, bahkan dalam gas.
Jalur suatu molekul akibat difusi (atau jalur partikel Brown) disebut jalur acak. Fisikawan cerdas menafsirkan ulang ungkapan ini sebagai jalan pemabuk - “jalan seorang pemabuk.” Memang benar, pergerakan sebuah partikel dari satu posisi ke posisi lain (atau jalur sebuah molekul yang mengalami banyak tumbukan) menyerupai pergerakan orang mabuk. Terlebih lagi, analogi ini juga memungkinkan seseorang untuk menyimpulkan secara sederhana persamaan dasar dari proses tersebut berdasarkan pada contoh gerak satu dimensi, yang mudah untuk digeneralisasikan menjadi tiga dimensi.
Misalkan seorang pelaut yang mabuk keluar dari sebuah kedai pada larut malam dan berjalan menyusuri jalan. Setelah menempuh jalan menuju lentera terdekat, dia beristirahat dan pergi... lebih jauh, ke lentera berikutnya, atau kembali, ke kedai - lagi pula, dia tidak ingat dari mana dia berasal. Pertanyaannya adalah, akankah dia meninggalkan zucchini, atau akankah dia hanya berkeliaran di sekitarnya, lalu menjauh, lalu mendekatinya? (Versi lain dari soal ini menyatakan bahwa ada selokan kotor di kedua ujung jalan, tempat lampu jalan berakhir, dan menanyakan apakah pelaut dapat menghindari jatuh ke salah satu selokan tersebut.) Secara intuitif, sepertinya jawaban kedua benar. Namun hal tersebut tidak benar: ternyata sang pelaut lambat laun akan bergerak semakin menjauh dari titik nol, meski jauh lebih lambat dibandingkan jika ia berjalan hanya dalam satu arah. Berikut cara membuktikannya.
Setelah pertama kali melewati lampu terdekat (ke kanan atau ke kiri), pelaut akan berada di kejauhan S 1 = ± l dari titik awal. Karena kita hanya tertarik pada jaraknya dari titik ini, tapi bukan arahnya, kita akan menghilangkan tandanya dengan mengkuadratkan persamaan ini: S 1 2 = l 2. Setelah beberapa waktu, pelaut sudah selesai N"berkeliaran", akan berada di kejauhan
s n= dari awal. Dan setelah berjalan lagi (satu arah) menuju lentera terdekat, dari kejauhan s n+1 = s n± l, atau, dengan menggunakan kuadrat perpindahan, S 2 N+1 = S 2 N± 2 s n l + l 2. Jika pelaut mengulangi gerakan ini berkali-kali (dari N sebelum N+ 1), maka sebagai hasil rata-rata (lulus dengan probabilitas yang sama N langkah ke kanan atau ke kiri), suku ± 2 s n Aku akan membatalkan, jadi 2 N+1 = s2 N+ l 2> (tanda kurung siku menunjukkan nilai rata-rata) L = 3600 m = 3,6 km, sedangkan perpindahan dari titik nol dalam waktu yang sama hanya akan sama dengan S= = 190 m Dalam tiga jam akan berlalu L= 10,8 km, dan akan bergeser S= 330 m, dst.
Bekerja kamu l dalam rumus yang dihasilkan dapat dibandingkan dengan koefisien difusi, yang seperti ditunjukkan oleh fisikawan dan matematikawan Irlandia George Gabriel Stokes (1819–1903), bergantung pada ukuran partikel dan viskositas medium. Berdasarkan pertimbangan serupa, Einstein menurunkan persamaannya.
Teori gerak Brown dalam kehidupan nyata.
Teori jalan acak mempunyai penerapan praktis yang penting. Mereka mengatakan bahwa jika tidak ada landmark (matahari, bintang, kebisingan jalan raya, atau kereta api dll.) seseorang mengembara di hutan, melintasi ladang di tengah badai salju atau dalam kabut tebal berputar-putar, sepanjang waktu kembali ke tempat asalnya. Faktanya, ia tidak berjalan berputar-putar, tetapi kira-kira sama dengan cara molekul atau partikel Brown bergerak. Dia bisa kembali ke tempat asalnya, tapi hanya secara kebetulan. Tapi dia melintasi jalannya berkali-kali. Mereka juga mengatakan bahwa orang-orang yang membeku dalam badai salju ditemukan “beberapa kilometer” dari perumahan atau jalan terdekat, namun kenyataannya orang tersebut tidak memiliki kesempatan untuk berjalan sejauh kilometer tersebut, dan inilah alasannya.
Untuk menghitung seberapa besar pergeseran seseorang akibat berjalan secara acak, Anda perlu mengetahui nilai l, yaitu. jarak yang dapat ditempuh seseorang dalam garis lurus tanpa adanya penanda. Nilai tersebut diukur oleh Doktor Ilmu Geologi dan Mineralogi B.S. Gorobets dengan bantuan mahasiswa relawan. Dia, tentu saja, tidak meninggalkan mereka di hutan lebat atau di lapangan yang tertutup salju, semuanya lebih sederhana - siswa ditempatkan di tengah-tengah stadion yang kosong, ditutup matanya dan diminta berjalan ke ujung lapangan sepak bola di keheningan total (untuk mengecualikan orientasi berdasarkan suara). Ternyata rata-rata siswa tersebut berjalan lurus hanya sekitar 20 meter (penyimpangan dari garis lurus ideal tidak melebihi 5°), kemudian mulai semakin menyimpang dari arah semula. Pada akhirnya, dia berhenti, jauh dari mencapai tepian.
Biarkan sekarang pria berjalan(atau lebih tepatnya mengembara) di dalam hutan dengan kecepatan 2 kilometer per jam (untuk jalan sangat lambat, tetapi untuk hutan lebat sangat cepat), maka jika nilai l adalah 20 meter, maka dalam sebuah jam itu akan menempuh jarak 2 km, tetapi hanya akan bergeser sejauh 200 m, dalam dua jam - sekitar 280 m, dalam tiga jam - 350 m, dalam 4 jam - 400 m, dll. Dan bergerak dalam garis lurus dengan kecepatan seperti itu, seseorang akan berjalan sejauh 8 kilometer dalam 4 jam, jadi dalam instruksi Sesuai dengan tindakan pencegahan keselamatan untuk kerja lapangan, terdapat aturan berikut: jika landmark hilang, Anda harus tetap di tempat, mendirikan tempat berlindung dan menunggu sampai akhir cuaca buruk (matahari mungkin muncul) atau untuk bantuan. Di hutan, penanda - pohon atau semak - akan membantu Anda bergerak dalam garis lurus, dan setiap kali Anda harus tetap berpegang pada dua penanda tersebut - satu di depan, yang lain di belakang. Tapi, tentu saja, yang terbaik adalah membawa kompas...
Ilya Leenson
Literatur:
Mario Liozzi. Sejarah fisika. M., Mir, 1970
Kerker M. Gerakan Brown dan Realitas Molekuler Sebelum tahun 1900. Jurnal Pendidikan Kimia, 1974, vol. 51, No.12
Leenson I.A. Reaksi kimia
. M., Astrel, 2002
Hari ini kita akan melihat lebih dekat topik penting- mari kita definisikan gerak Brown dari potongan-potongan kecil materi dalam cairan atau gas.
Peta dan koordinat
Beberapa anak sekolah, yang tersiksa oleh pelajaran yang membosankan, tidak mengerti mengapa belajar fisika. Sementara itu, ilmu pengetahuan inilah yang memungkinkan ditemukannya Amerika!
Mari kita mulai dari jauh. Peradaban kuno di Mediterania, dalam arti tertentu, beruntung: mereka berkembang di tepi perairan pedalaman yang tertutup. Laut Mediterania Disebut demikian karena di semua sisinya dikelilingi oleh daratan. Dan para pengelana zaman dahulu dapat melakukan perjalanan cukup jauh dengan ekspedisi mereka tanpa melupakan pantai. Garis besar daratan membantu navigasi. Dan peta pertama dibuat secara deskriptif, bukan geografis. Berkat pelayaran yang relatif singkat ini, orang Yunani, Fenisia, dan Mesir menjadi sangat ahli dalam membuat kapal. Dan jika terdapat peralatan terbaik, di situ terdapat keinginan untuk melampaui batas dunia Anda.
Oleh karena itu, suatu hari kekuatan Eropa memutuskan untuk memasuki lautan. Saat berlayar melintasi hamparan tak berujung antar benua, para pelaut hanya melihat air selama berbulan-bulan, dan entah bagaimana mereka harus menemukan jalan. Penemuan jam tangan yang akurat dan kompas berkualitas tinggi membantu menentukan koordinat seseorang.
Jam dan kompas

Penemuan kronometer genggam kecil sangat membantu para pelaut. Untuk menentukan secara pasti di mana mereka berada, mereka memerlukan alat sederhana yang mengukur ketinggian matahari di atas cakrawala, dan mengetahui kapan tepatnya tengah hari. Dan berkat kompas, kapten kapal tahu kemana tujuan mereka. Baik jam maupun sifat jarum magnet dipelajari dan diciptakan oleh fisikawan. Berkat ini, seluruh dunia terbuka untuk orang Eropa.
Benua baru adalah terra incognita, daratan yang belum dijelajahi. Tanaman aneh tumbuh di sana dan hewan aneh ditemukan.
Tumbuhan dan Fisika

Semua naturalis di dunia beradab bergegas mempelajari sistem ekologi baru yang aneh ini. Dan tentu saja, mereka berusaha mengambil manfaat darinya.
Robert Brown adalah seorang ahli botani Inggris. Ia melakukan perjalanan ke Australia dan Tasmania, mengumpulkan koleksi tanaman di sana. Sudah berada di rumahnya di Inggris, dia bekerja keras dalam mendeskripsikan dan mengklasifikasikan materi yang dibawa. Dan ilmuwan ini sangat teliti. Suatu hari, saat mengamati pergerakan serbuk sari pada getah tanaman, dia memperhatikan: partikel-partikel kecil terus-menerus membuat gerakan zigzag yang kacau. Inilah definisi gerak Brown unsur-unsur kecil dalam gas dan cairan. Berkat penemuannya, ahli botani menakjubkan ini menuliskan namanya dalam sejarah fisika!
Coklat dan Lengket
Dalam sains Eropa, merupakan kebiasaan untuk menamai suatu efek atau fenomena dengan nama orang yang menemukannya. Namun seringkali hal ini terjadi secara tidak sengaja. Namun orang yang mendeskripsikan, mengungkapkan pentingnya atau mengeksplorasi lebih detail hukum fisika, muncul dalam bayang-bayang. Hal ini terjadi pada orang Prancis Louis Georges Gouy. Dialah yang memberikan definisi gerak Brown (kelas 7 pasti tidak mendengarnya ketika mempelajari topik fisika ini).
Penelitian Gouy dan sifat gerak Brown

Eksperimen Perancis Louis Georges Gouy mengamati pergerakan tersebut jenis yang berbeda partikel dalam beberapa cairan, termasuk larutan. Ilmu pengetahuan pada masa itu sudah mampu menentukan secara akurat ukuran partikel materi hingga sepersepuluh mikrometer. Saat mempelajari apa itu gerak Brown (Gouy-lah yang memberikan definisi fenomena ini dalam fisika), ilmuwan menyadari: intensitas pergerakan partikel meningkat jika ditempatkan dalam media yang kurang kental. Sebagai seorang eksperimen berspektrum luas, ia memaparkan suspensi pada cahaya dan medan elektromagnetik dengan kekuatan yang berbeda-beda. Ilmuwan menemukan bahwa faktor-faktor ini sama sekali tidak mempengaruhi lompatan partikel zigzag yang kacau. Gouy dengan jelas menunjukkan apa yang dibuktikan oleh gerak Brown: pergerakan termal molekul cairan atau gas.
Tim dan massa
Sekarang mari kita uraikan lebih detail mekanisme lompatan zigzag potongan-potongan kecil materi dalam zat cair.
Zat apa pun terdiri dari atom atau molekul. Unsur-unsur dunia ini sangat kecil; tidak ada mikroskop optik yang dapat melihatnya. Dalam cairan mereka berosilasi dan bergerak sepanjang waktu. Ketika partikel apa pun yang terlihat memasuki suatu larutan, massanya ribuan kali lebih besar dari satu atom. gerak Brown molekul cair terjadi secara kacau. Namun bagaimanapun juga, semua atom atau molekul adalah suatu kolektif, saling terhubung satu sama lain, seperti manusia yang bergandengan tangan. Oleh karena itu, kadang-kadang terjadi bahwa atom-atom cairan di satu sisi partikel bergerak sedemikian rupa sehingga “menekan” partikel tersebut, sementara lingkungan yang kurang padat tercipta di sisi lain partikel. Oleh karena itu, partikel debu bergerak dalam ruang larutan. Di tempat lain, pergerakan kolektif molekul fluida secara acak mempengaruhi sisi lain dari komponen yang lebih masif. Inilah tepatnya bagaimana gerak partikel Brown terjadi.
Waktu dan Einstein

Jika suatu zat mempunyai suhu bukan nol, atom-atomnya mengalami getaran termal. Oleh karena itu, bahkan dalam cairan yang sangat dingin atau sangat dingin, gerak Brown tetap ada. Lompatan kacau partikel-partikel kecil yang tersuspensi ini tidak pernah berhenti.
Albert Einstein mungkin adalah ilmuwan paling terkenal di abad kedua puluh. Siapa pun yang setidaknya tertarik pada fisika mengetahui rumus E = mc 2. Juga, banyak orang dapat mengingat efek foto yang diberikan padanya Penghargaan Nobel, dan tentang teori relativitas khusus. Namun hanya sedikit orang yang mengetahui bahwa Einstein mengembangkan rumus gerak Brown.
Berdasarkan teori kinetik molekuler, ilmuwan memperoleh koefisien difusi partikel tersuspensi dalam cairan. Dan ini terjadi pada tahun 1905. Rumusnya terlihat seperti ini:
D = (R * T) / (6 * N A * a * π * ξ),
di mana D adalah koefisien yang diinginkan, R adalah konstanta gas universal, T adalah suhu absolut (dinyatakan dalam Kelvin), N A adalah konstanta Avogadro (setara dengan satu mol suatu zat, atau sekitar 10 23 molekul), a adalah perkiraan rata-rata radius partikel, ξ adalah viskositas dinamis suatu cairan atau larutan.
Dan sudah pada tahun 1908, fisikawan Perancis Jean Perrin dan murid-muridnya secara eksperimental membuktikan kebenaran perhitungan Einstein.
Satu partikel di bidang prajurit
Di atas kami menggambarkan pengaruh kolektif lingkungan terhadap banyak partikel. Tetapi bahkan satu unsur asing dalam suatu cairan dapat menimbulkan beberapa pola dan ketergantungan. Misalnya, jika Anda mengamati partikel Brown dalam waktu lama, Anda dapat merekam semua pergerakannya. Dan dari kekacauan ini akan muncul sistem yang harmonis. Pergerakan rata-rata partikel Brown dalam satu arah sebanding dengan waktu.
Dalam percobaan pada partikel dalam cairan, besaran berikut dimurnikan:
- Konstanta Boltzmann;
- nomor Avogadro.
Di samping itu gerak linier, juga ditandai dengan rotasi yang kacau. Dan perpindahan sudut rata-rata juga sebanding dengan waktu pengamatan.
Ukuran dan bentuk

Setelah pertimbangan seperti itu, pertanyaan logis mungkin muncul: mengapa efek ini tidak terlihat pada benda besar? Karena ketika luas suatu benda yang direndam dalam cairan lebih besar dari nilai tertentu, maka semua “dorongan” kolektif acak molekul-molekul ini berubah menjadi tekanan konstan, saat tekanan tersebut dirata-ratakan. Dan Jenderal Archimedes sudah bertindak pada tubuh itu. Jadi, sepotong besar besi tenggelam, dan debu logam mengapung di air.
Ukuran partikel, sebagai contoh fluktuasi molekul cair, tidak boleh melebihi 5 mikrometer. Sedangkan untuk objek berukuran besar, efek ini tidak akan terlihat.
Apa itu gerak Brown?
Sekarang Anda akan mengetahui bukti paling nyata dari gerakan termal molekul (posisi utama kedua dari teori kinetik molekul). Pastikan untuk mencoba melihat melalui mikroskop dan melihat bagaimana partikel Brown bergerak.
Sebelumnya, Anda telah mempelajari apa itu difusi, yaitu mencampurkan gas, cairan dan padatan setelah kontak langsung mereka. Fenomena ini dapat dijelaskan dengan adanya pergerakan acak molekul dan penetrasi molekul suatu zat ke dalam ruang antar molekul zat lain. Hal ini dapat menjelaskan, misalnya, fakta bahwa volume campuran air dan alkohol lebih kecil dibandingkan volume komponen penyusunnya. Namun bukti paling nyata dari pergerakan molekul dapat diperoleh dengan mengamati melalui mikroskop partikel terkecil dari setiap zat padat yang tersuspensi dalam air. Partikel-partikel ini mengalami gerak acak yang disebut Brown.
Ini adalah pergerakan termal partikel yang tersuspensi dalam cairan (atau gas).
Pengamatan gerak Brown
Ahli botani Inggris R. Brown (1773-1858) pertama kali mengamati fenomena ini pada tahun 1827, memeriksa spora lumut yang tersuspensi dalam air melalui mikroskop. Kemudian dia mengamati partikel kecil lainnya, termasuk pecahan batu dari piramida Mesir. Saat ini, untuk mengamati gerak Brown, mereka menggunakan partikel cat gum gum yang tidak larut dalam air. Partikel-partikel ini bergerak secara acak. Hal yang paling menakjubkan dan tidak biasa bagi kami adalah gerakan ini tidak pernah berhenti. Kita terbiasa dengan kenyataan bahwa benda yang bergerak cepat atau lambat akan berhenti. Brown awalnya mengira spora lumut tersebut menunjukkan tanda-tanda kehidupan.
gerakan termal, dan tidak bisa berhenti. Ketika suhu meningkat, intensitasnya meningkat. Gambar 8.3 menunjukkan diagram pergerakan partikel Brown. Posisi partikel, yang ditandai dengan titik, ditentukan secara berkala selama 30 detik. Titik-titik ini dihubungkan oleh garis lurus. Kenyataannya, lintasan partikel jauh lebih kompleks.Gerak Brown juga dapat diamati pada gas. Hal ini disebabkan oleh partikel debu atau asap yang tersuspensi di udara.
Fisikawan Jerman R. Pohl (1884-1976) dengan penuh warna menggambarkan gerak Brown: “Hanya sedikit fenomena yang mampu memikat pengamat seperti halnya gerak Brown. Di sini pengamat diperbolehkan melihat ke balik layar dari apa yang terjadi di alam. Itu terbuka di hadapannya dunia baru- hiruk pikuk sejumlah besar partikel tanpa henti. Partikel terkecil dengan cepat terbang melalui bidang pandang mikroskop, hampir seketika mengubah arah gerakannya. Partikel yang lebih besar bergerak lebih lambat, tetapi mereka juga terus-menerus mengubah arah pergerakannya. Partikel besar praktis hancur di tempatnya. Tonjolannya dengan jelas menunjukkan perputaran partikel di sekitar porosnya, yang secara konstan mengubah arah di ruang angkasa. Tidak ada jejak sistem atau ketertiban di mana pun. Dominasi peluang buta - itulah kesan yang kuat dan luar biasa dari gambar ini terhadap pengamatnya.”
Saat ini konsepnya gerak Brown digunakan lebih banyak dalam arti luas. Misalnya gerak Brown adalah getaran jarum-jarum alat ukur sensitif yang terjadi akibat adanya pergerakan termal atom-atom bagian alat dan lingkungan.
Penjelasan gerak Brown
Gerak Brown hanya dapat dijelaskan berdasarkan teori kinetika molekuler. Alasan terjadinya gerak Brown pada suatu partikel adalah karena tumbukan molekul-molekul cairan pada partikel tersebut tidak saling meniadakan. Gambar 8.4 secara skematis menunjukkan posisi satu partikel Brown dan molekul yang paling dekat dengannya. Ketika molekul bergerak secara acak, impuls yang diteruskannya ke partikel Brown, misalnya ke kiri dan ke kanan, tidak sama. Oleh karena itu, gaya tekanan yang dihasilkan molekul cair pada partikel Brown adalah bukan nol. Gaya ini menyebabkan perubahan gerak partikel.

Tekanan rata-rata memiliki nilai tertentu baik dalam gas maupun cairan. Namun selalu ada penyimpangan acak kecil dari rata-rata ini. Semakin kecil luas permukaan benda, semakin nyata perubahan relatif gaya tekanan yang bekerja daerah tertentu. Jadi, misalnya, jika suatu area mempunyai ukuran orde beberapa diameter molekul, maka gaya tekanan yang bekerja padanya berubah secara tiba-tiba dari nol ke nilai tertentu ketika molekul mengenai area tersebut.
Teori kinetik molekuler gerak Brown diciptakan pada tahun 1905 oleh A. Einstein (1879-1955).
Konstruksi teori gerak Brown dan konfirmasi eksperimentalnya oleh fisikawan Perancis J. Perrin akhirnya melengkapi kemenangan teori kinetik molekuler.
Eksperimen Perrin
Ide percobaan Perrin adalah sebagai berikut. Diketahui bahwa konsentrasi molekul gas di atmosfer menurun seiring dengan ketinggian. Jika tidak ada gerakan termal, maka semua molekul akan jatuh ke bumi dan atmosfer akan hilang. Namun, jika tidak ada gaya tarik ke Bumi, maka akibat gerakan termal molekul-molekul tersebut akan meninggalkan Bumi, karena gas mampu mengembang tanpa batas. Sebagai hasil dari aksi faktor-faktor yang berlawanan ini, terjadi distribusi tinggi molekul tertentu, seperti disebutkan di atas, yaitu konsentrasi molekul menurun cukup cepat seiring dengan ketinggian. Apalagi dari lebih banyak massa molekul, semakin cepat konsentrasinya menurun seiring dengan ketinggian.
Partikel Brown berpartisipasi dalam gerakan termal. Karena interaksinya sangat kecil, kumpulan partikel-partikel ini dalam gas atau cairan dapat dianggap sebagai gas ideal dengan molekul yang sangat berat. Akibatnya, konsentrasi partikel Brown dalam gas atau cairan di medan gravitasi bumi akan berkurang menurut hukum yang sama dengan konsentrasi molekul gas. Hukum ini diketahui.
Perrin, menggunakan mikroskop pembesaran tinggi dengan kedalaman bidang dangkal (shallow depth of field), mengamati partikel Brown dalam lapisan cairan yang sangat tipis. Dengan menghitung konsentrasi partikel pada ketinggian berbeda, ia menemukan bahwa konsentrasi ini berkurang seiring ketinggian menurut hukum yang sama dengan konsentrasi molekul gas. Bedanya, karena massa partikel Brown yang besar, maka penyusutannya terjadi dengan sangat cepat.
Selain itu, menghitung partikel Brown pada ketinggian berbeda memungkinkan Perrin menentukan konstanta Avogadro menggunakan metode yang benar-benar baru. Nilai konstanta ini bertepatan dengan nilai yang diketahui.
Semua fakta ini menunjukkan kebenaran teori gerak Brown dan, oleh karena itu, partikel Brown berpartisipasi dalam gerak termal molekul.
Anda telah melihat dengan jelas adanya gerakan termal; melihat gerakan kacau terjadi. Molekul bergerak lebih acak dibandingkan partikel Brown.
Inti dari fenomena tersebut
Sekarang mari kita coba memahami inti dari fenomena gerak Brown. Dan ini terjadi karena semua zat cair dan gas mutlak terdiri dari atom atau molekul. Tapi kita juga tahu bahwa partikel-partikel kecil ini, yang terus menerus bergerak kacau, terus-menerus mendorong partikel Brown dari arah yang berbeda.
Namun yang menarik adalah para ilmuwan telah membuktikan bahwa partikel lebih banyak ukuran besar, yang melebihi 5 mikron tetap tidak bergerak dan hampir tidak berpartisipasi dalam gerak Brown, yang tidak dapat dikatakan tentang partikel yang lebih kecil. Partikel dengan ukuran kurang dari 3 mikron mampu bergerak secara translasi, melakukan rotasi atau menulis lintasan yang kompleks.
Ketika sebuah benda besar dibenamkan ke dalam lingkungan, guncangan yang terjadi dalam jumlah yang sangat besar seolah-olah akan mencapai level rata-rata dan mempertahankan tekanan konstan. Dalam hal ini, teori Archimedes ikut berperan, karena benda besar yang dikelilingi oleh lingkungan di semua sisi menyeimbangkan tekanan dan gaya angkat yang tersisa memungkinkan benda tersebut mengapung atau tenggelam.
Tetapi jika benda memiliki dimensi seperti partikel Brown, yang sama sekali tidak terlihat, maka penyimpangan tekanan menjadi nyata, yang berkontribusi pada terciptanya gaya acak yang menyebabkan getaran partikel-partikel tersebut. Dapat disimpulkan bahwa partikel Brown pada medium berada dalam keadaan tersuspensi, berbeda dengan partikel besar yang tenggelam atau mengapung.
Arti Gerak Brown
Mari kita coba mencari tahu apakah gerak Brown mempunyai arti penting dalam lingkungan alam:
Pertama, gerak Brown memainkan peranan penting dalam nutrisi tanaman dari tanah;
Kedua, dalam tubuh manusia dan hewan, penyerapan nutrisi terjadi melalui dinding organ pencernaan akibat gerak Brown;
Ketiga, dalam pelaksanaan pernafasan kulit;
Dan yang terakhir, gerak Brown juga penting dalam propagasi zat berbahaya di udara dan di air.
Pekerjaan rumah
Bacalah pertanyaan dengan cermat dan berikan jawaban tertulis:
1. Ingat apa yang disebut difusi?
2. Apa hubungan antara difusi dan gerak termal molekul?
3. Mendefinisikan gerak Brown.
4. Apakah menurut Anda gerak Brown bersifat termal, dan jelaskan jawaban Anda?
5. Apakah sifat gerak Brown akan berubah jika dipanaskan? Jika berubah, bagaimana tepatnya?
6. Alat apa yang digunakan untuk mempelajari gerak Brown?
7. Apakah pola gerak Brown berubah seiring dengan meningkatnya suhu dan bagaimana tepatnya?
8. Apakah akan terjadi perubahan gerak Brown jika emulsi air diganti dengan gliserol?
G.Ya.Myakishev, B.B.Bukhovtsev, N.N.Sotsky, Fisika kelas 10
Semasa hidupnya, ahli botani Skotlandia Robert Brown, sebagai ahli tanaman terbaik, menerima gelar “Pangeran Ahli Botani”. Dia membuat banyak penemuan menakjubkan. Pada tahun 1805, setelah ekspedisi empat tahun ke Australia, ia membawa ke Inggris sekitar 4.000 spesies tumbuhan Australia yang tidak diketahui para ilmuwan dan menghabiskan waktu bertahun-tahun untuk mempelajarinya. Tanaman yang dijelaskan dibawa dari Indonesia dan Afrika Tengah. Ia mempelajari fisiologi tumbuhan dan untuk pertama kalinya menjelaskan secara rinci inti sel tumbuhan. Namun nama ilmuwan tersebut kini dikenal luas bukan karena karya-karyanya tersebut.
Pada tahun 1827 Brown melakukan penelitian terhadap serbuk sari tanaman. Dia sangat tertarik pada bagaimana serbuk sari berperan dalam proses pembuahan. Suatu ketika, di bawah mikroskop, ia memeriksa butiran sitoplasma memanjang yang tersuspensi dalam air dari sel serbuk sari tanaman Clarkia pulchella di Amerika Utara. Tiba-tiba Brown melihat butiran padat terkecil, yang hampir tidak terlihat dalam setetes air, terus-menerus bergetar dan berpindah dari satu tempat ke tempat lain. Ia menemukan bahwa gerakan-gerakan ini, dalam kata-katanya, “tidak berhubungan dengan aliran dalam cairan atau dengan penguapan bertahap, namun melekat pada partikel itu sendiri.”
Pengamatan Brown dikonfirmasi oleh ilmuwan lain. Partikel terkecil berperilaku seolah-olah mereka hidup, dan “tarian” partikel tersebut dipercepat dengan meningkatnya suhu dan penurunan ukuran partikel dan jelas melambat ketika air diganti dengan media yang lebih kental. Fenomena menakjubkan ini tidak pernah berhenti: fenomena ini dapat diamati selama yang diinginkan. Pada mulanya Brown bahkan mengira bahwa makhluk hidup sebenarnya masuk ke dalam bidang mikroskop, apalagi serbuk sari merupakan sel reproduksi jantan pada tumbuhan, namun ada juga partikel dari tumbuhan mati, bahkan yang dikeringkan seratus tahun sebelumnya di herbarium. Kemudian Brown bertanya-tanya apakah ini adalah “molekul dasar makhluk hidup” yang dibicarakan oleh naturalis Prancis terkenal Georges Buffon (1707-1788), penulis 36 volume Natural History. Asumsi ini hilang ketika Brown mulai mengamati benda-benda yang tampaknya tidak bernyawa; mula-mula berupa partikel batu bara yang sangat kecil, serta jelaga dan debu dari udara London, kemudian zat anorganik yang digiling halus: kaca, berbagai mineral. “Molekul aktif” ada dimana-mana: “Dalam setiap mineral,” tulis Brown, “yang telah berhasil saya giling menjadi debu sedemikian rupa sehingga dapat tersuspensi dalam air untuk beberapa waktu, saya temukan, dalam jumlah yang lebih besar atau lebih kecil, molekul-molekul ini."
Selama kurang lebih 30 tahun, penemuan Brown tidak menarik minat para fisikawan. Fenomena baru tidak diberikan sangat penting, percaya bahwa hal itu disebabkan oleh gemetarnya sediaan, atau serupa dengan pergerakan partikel debu, yang diamati di atmosfer ketika seberkas cahaya menimpanya, dan yang, seperti diketahui, disebabkan oleh pergerakan udara. Namun jika pergerakan partikel Brown disebabkan oleh aliran apa pun dalam cairan, maka partikel tetangga tersebut akan bergerak bersamaan, yang bertentangan dengan data pengamatan.
Penjelasan tentang gerak Brown (sebutan untuk fenomena ini) dengan pergerakan molekul tak kasat mata baru diberikan pada kuartal terakhir abad ke-19, namun tidak serta merta diterima oleh semua ilmuwan. Pada tahun 1863, seorang guru geometri deskriptif dari Karlsruhe (Jerman), Ludwig Christian Wiener (1826-1896), mengemukakan bahwa fenomena tersebut dikaitkan dengan gerakan osilasi atom tak kasat mata. Penting bagi Wiener untuk melihat peluang menggunakan fenomena ini untuk menembus rahasia struktur materi. Dia adalah orang pertama yang mencoba mengukur kecepatan pergerakan partikel Brown dan ketergantungannya pada ukurannya. Namun kesimpulan Wiener menjadi rumit dengan diperkenalkannya konsep "atom eter" selain atom materi. Pada tahun 1876, William Ramsay, dan pada tahun 1877, pendeta Jesuit Belgia Carbonel, Delso dan Thirion, dan terakhir, pada tahun 1888, Guy, dengan jelas menunjukkan sifat termal gerak Brown [5].
“Pada area yang luas,” tulis Delso dan Carbonelle, “dampak molekul, yang merupakan penyebab tekanan, tidak menyebabkan guncangan pada benda yang tersuspensi, karena keduanya menciptakan tekanan yang seragam pada benda ke segala arah. . Tetapi jika luasnya tidak cukup untuk mengkompensasi ketidakrataan tersebut, maka perlu memperhitungkan ketimpangan tekanan dan perubahannya yang terus menerus dari titik ke titik. Hukum bilangan besar tidak lagi mereduksi pengaruh tumbukan menjadi tekanan seragam rata-rata; resultannya tidak lagi sama dengan nol, namun akan terus berubah arah dan besarnya.”
Jika penjelasan tersebut diterima, maka fenomena gerak termal zat cair yang didalilkan oleh teori kinetik dapat dikatakan terbukti ad oculos (secara visual). Sebagaimana mungkin, tanpa membedakan jarak gelombang di laut, untuk menjelaskan goyangan perahu di cakrawala oleh gelombang, demikian pula, tanpa melihat pergerakan molekul, seseorang dapat menilainya dari pergerakan partikel yang tersuspensi. dalam cairan.
Penjelasan gerak Brown ini penting tidak hanya sebagai konfirmasi teori kinetik, namun juga membawa konsekuensi teoretis yang penting. Menurut hukum kekekalan energi, perubahan kecepatan partikel tersuspensi harus disertai dengan perubahan suhu di sekitar partikel tersebut: suhu ini meningkat jika kecepatan partikel menurun, dan menurun jika kecepatannya partikelnya semakin besar. Jadi, kesetimbangan termal suatu zat cair merupakan kesetimbangan statistik.
Pengamatan yang lebih signifikan dilakukan pada tahun 1888 oleh Guy: Gerak Brown, sebenarnya, tidak mematuhi hukum kedua termodinamika. Faktanya, ketika sebuah partikel tersuspensi naik secara spontan dalam suatu cairan, sebagian panas di sekitarnya secara spontan berubah menjadi pekerjaan mekanis, yang dilarang oleh hukum kedua termodinamika. Namun, pengamatan menunjukkan bahwa pengangkatan suatu partikel lebih jarang terjadi, semakin berat partikel tersebut. Untuk partikel materi berukuran normal, kemungkinan kenaikan tersebut praktis nol.
Dengan demikian, hukum kedua termodinamika menjadi hukum probabilitas dan bukan hukum keharusan. Tidak ada pengalaman sebelumnya yang mendukung interpretasi statistik ini. Menyangkal keberadaan molekul saja sudah cukup, seperti yang dilakukan, misalnya, oleh aliran energi, yang berkembang di bawah kepemimpinan Mach dan Ostwald, agar hukum kedua termodinamika menjadi hukum keharusan. Namun setelah ditemukannya gerak Brown, interpretasi yang ketat terhadap hukum kedua menjadi tidak mungkin: terdapat pengalaman nyata yang menunjukkan bahwa hukum kedua termodinamika terus-menerus dilanggar di alam, bahwa mesin gerak abadi Jenis kedua tidak hanya tidak dikecualikan, tetapi terus-menerus terjadi tepat di depan mata kita.
Oleh karena itu, pada akhir abad yang lalu, studi tentang gerak Brown memperoleh signifikansi teoretis yang sangat besar dan menarik perhatian banyak fisikawan teoretis, dan khususnya Einstein.
« Fisika - kelas 10"
Ingat fenomena difusi dari mata pelajaran fisika sekolah dasar.
Bagaimana fenomena ini dapat dijelaskan?
Sebelumnya, Anda telah mempelajari apa itu difusi, yaitu penetrasi molekul suatu zat ke dalam ruang antarmolekul zat lain. Fenomena ini ditentukan oleh pergerakan acak molekul. Hal ini dapat menjelaskan, misalnya, fakta bahwa volume campuran air dan alkohol lebih kecil dibandingkan volume komponen penyusunnya.
Namun bukti paling nyata dari pergerakan molekul dapat diperoleh dengan mengamati melalui mikroskop partikel terkecil dari zat apa pun yang tersuspensi dalam air. padat. Partikel-partikel ini mengalami gerak acak yang disebut Brown.
gerak Brown adalah pergerakan termal partikel yang tersuspensi dalam cairan (atau gas).
Pengamatan gerak Brown.
Ahli botani Inggris R. Brown (1773-1858) pertama kali mengamati fenomena ini pada tahun 1827, memeriksa spora lumut yang tersuspensi dalam air melalui mikroskop.
Kemudian dia mengamati partikel kecil lainnya, termasuk pecahan batu dari piramida Mesir. Saat ini, untuk mengamati gerak Brown, mereka menggunakan partikel cat gum gum yang tidak larut dalam air. Partikel-partikel ini bergerak secara acak. Hal yang paling menakjubkan dan tidak biasa bagi kami adalah gerakan ini tidak pernah berhenti. Kita terbiasa dengan kenyataan bahwa benda yang bergerak cepat atau lambat akan berhenti. Brown awalnya mengira spora lumut tersebut menunjukkan tanda-tanda kehidupan.
Gerak Brown merupakan gerak termal dan tidak dapat berhenti. Ketika suhu meningkat, intensitasnya meningkat.
Gambar 8.3 menunjukkan lintasan partikel Brown. Posisi partikel, yang ditandai dengan titik, ditentukan secara berkala selama 30 detik. Titik-titik ini dihubungkan oleh garis lurus. Kenyataannya, lintasan partikel jauh lebih kompleks.
Penjelasan gerak Brown.
Gerak Brown hanya dapat dijelaskan berdasarkan teori kinetika molekuler.
“Hanya sedikit fenomena yang dapat memikat pengamat seperti gerak Brown. Di sini pengamat diperbolehkan melihat ke balik layar dari apa yang terjadi di alam. Dunia baru terbuka di hadapannya - hiruk pikuk sejumlah besar partikel tanpa henti. Partikel terkecil dengan cepat terbang melalui bidang pandang mikroskop, hampir seketika mengubah arah gerakannya. Partikel yang lebih besar bergerak lebih lambat, tetapi mereka juga terus-menerus mengubah arah pergerakannya. Partikel besar praktis hancur di tempatnya. Tonjolannya dengan jelas menunjukkan perputaran partikel di sekitar porosnya, yang secara konstan mengubah arah di ruang angkasa. Tidak ada jejak sistem atau ketertiban di mana pun. Dominasi peluang buta - itulah kesan yang kuat dan luar biasa dari gambar ini terhadap pengamatnya.” R.Paul (1884-1976).
Alasan terjadinya gerak Brown pada suatu partikel adalah karena tumbukan molekul-molekul cairan pada partikel tersebut tidak saling meniadakan.

Gambar 8.4 secara skematis menunjukkan posisi satu partikel Brown dan molekul yang paling dekat dengannya.
Ketika molekul bergerak secara acak, impuls yang diteruskannya ke partikel Brown, misalnya ke kiri dan ke kanan, tidak sama. Oleh karena itu, gaya tekanan yang dihasilkan molekul cair pada partikel Brown adalah bukan nol. Gaya ini menyebabkan perubahan gerak partikel.
Teori kinetik molekuler gerak Brown diciptakan pada tahun 1905 oleh A. Einstein (1879-1955). Konstruksi teori gerak Brown dan konfirmasi eksperimentalnya oleh fisikawan Perancis J. Perrin akhirnya melengkapi kemenangan teori kinetik molekuler. Pada tahun 1926, J. Perrin menerima Hadiah Nobel atas studinya tentang struktur materi.
Eksperimen Perrin.
Ide percobaan Perrin adalah sebagai berikut. Diketahui bahwa konsentrasi molekul gas di atmosfer menurun seiring dengan ketinggian. Jika tidak ada gerakan termal, maka semua molekul akan jatuh ke bumi dan atmosfer akan hilang. Namun, jika tidak ada gaya tarik ke Bumi, maka akibat gerakan termal molekul-molekul tersebut akan meninggalkan Bumi, karena gas mampu mengembang tanpa batas. Sebagai hasil dari aksi faktor-faktor yang berlawanan ini, terjadi distribusi tinggi molekul tertentu, yaitu konsentrasi molekul menurun cukup cepat seiring dengan ketinggian. Selain itu, semakin besar massa molekul, semakin cepat konsentrasinya menurun seiring dengan ketinggian.
Partikel Brown berpartisipasi dalam gerakan termal. Karena interaksinya dapat diabaikan, kumpulan partikel-partikel ini dalam gas atau cairan dapat dianggap sebagai gas ideal dengan molekul yang sangat berat. Akibatnya, konsentrasi partikel Brown dalam gas atau cairan di medan gravitasi bumi akan berkurang menurut hukum yang sama dengan konsentrasi molekul gas. Hukum ini diketahui.
Perrin, menggunakan mikroskop pembesaran tinggi dengan kedalaman bidang dangkal (shallow depth of field), mengamati partikel Brown dalam lapisan cairan yang sangat tipis. Dengan menghitung konsentrasi partikel pada ketinggian berbeda, ia menemukan bahwa konsentrasi ini berkurang seiring ketinggian menurut hukum yang sama dengan konsentrasi molekul gas. Bedanya, karena massa partikel Brown yang besar, maka penyusutannya terjadi dengan sangat cepat.
Semua fakta ini menunjukkan kebenaran teori gerak Brown dan bahwa partikel Brown berpartisipasi dalam gerak termal molekul.
Menghitung partikel Brown pada ketinggian berbeda memungkinkan Perrin menentukan konstanta Avogadro menggunakan metode yang benar-benar baru. Nilai konstanta ini bertepatan dengan nilai yang diketahui sebelumnya.