UNIVERSITAS NEGERI BELARUSIA
DEPARTEMEN BIOLOGI
Departemen Fisiologi Tumbuhan dan Biokimia
FISIOLOGI
SAYUR-MAYUR
SEL
untuk latihan laboratorium bengkel
"Fisiologi Tumbuhan"
untuk siswa Fakultas Biologi
V. M. Yurin, A. P. Kudryashov, T. I. Ditchenko, O. V. Molchan, I. I. Smolich Direkomendasikan oleh Dewan Akademik Fakultas Biologi 16 Juni 2009, Protokol No. Calon Peninjau Ilmu Biologi, Associate Professor M. A Fisiologi sel Tanaman Jus: metode. Rekomendasi penelitian laboratorium workshop Fisiologi Tumbuhan untuk mahasiswa F Fakultas Biologi / V. M. Yurin [et al.].
- Minsk: BSU, 2009 .-- 28 hal.
Manual ini merupakan elemen integral dari kompleks pendidikan dan metodologi untuk disiplin "Fisiologi Tumbuhan" dan mencakup pekerjaan laboratorium di bagian "Fisiologi Sel Tumbuhan".
Dirancang untuk mahasiswa Fakultas Biologi, belajar di spesialisasi "Biologi" dan "Bioekologi".
UDC 581. LBC 28. © BSU,
DARI PENULIS
Rekomendasi metodologis untuk studi laboratorium merupakan bagian integral dari kursus "Fisiologi Tumbuhan". Tujuan publikasi adalah untuk mengaktifkan karya mandiri siswa, dengan mempertimbangkan fakta bahwa proses pembelajaran individu harus efektif. Lokakarya pada kursus "Fisiologi Tumbuhan" dirancang untuk mengkonsolidasikan materi teoretis, memperoleh keterampilan praktis dan membiasakan diri dengan metode utama untuk meneliti proses fisiologis tanaman. Siswa ditawari tugas merinci materi faktual yang harus mereka kuasai sendiri.Ini akan memungkinkan Anda untuk menggunakan waktu kelas Anda lebih efisien.
1. SEL TANAMAN SEBAGAI
SISTEM OSMOTIK
Sistem osmotik adalah sistem yang terdiri dari dua larutan zat dengan konsentrasi berbeda, atau larutan dan pelarut, dipisahkan oleh membran semipermeabel. Membran semipermeabel yang ideal adalah permeabel terhadap molekul pelarut dan impermeabel terhadap molekul zat terlarut. Dalam semua sistem biologis, pelarutnya adalah air. Perbedaan komposisi dan konsentrasi zat di kedua sisi membran semi-permeabel adalah penyebab osmosis - difusi terarah molekul air melalui membran semi-permeabel.Jika kita abstrak dari struktur rinci sel tumbuhan dan mempertimbangkannya dari sudut pandang model osmotik, maka dapat dikatakan bahwa sel tumbuhan adalah sistem osmotik yang hidup.
Membran plasma bersifat semi-permeabel, dan sitoplasma serta tonoplast bertindak sebagai satu kesatuan. Di luar membran semipermeabel adalah dinding sel, yang permeabel dengan baik terhadap air dan zat terlarut di dalamnya dan tidak mengganggu pergerakan air. Peran utama ruang osmotik sel dimainkan oleh vakuola, yang diisi dengan larutan berair dari berbagai zat aktif osmotik - gula, asam organik, garam, pigmen yang larut dalam air (antosianin, dll.). Namun, ini adalah konsep sel yang agak disederhanakan sebagai sistem osmotik, karena setiap organel sitoplasma yang dikelilingi oleh membran juga merupakan sel osmotik. Akibatnya, gerakan osmotik air juga terjadi antara organel individu dan sitosol.
MODEL SEL TANAMAN
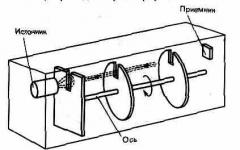
Kata pengantar. Karakteristik fisikokimia yang unik dari biomembran memastikan aliran air dan penciptaan tekanan hidrostatik tinggi (turgor) dalam sel tumbuhan, pelestarian distribusi anisotropik zat antara sel dan lingkungannya, penyerapan selektif dan pelepasan zat, dan sejumlah fungsi lainnya.Hipotesis keberadaan membran plasma pada permukaan sel diajukan pada paruh kedua abad ke-19. Pembuktian ilmiah hipotesis (konsep) ini diberikan oleh W. Pfeffer berdasarkan penjelasan tentang fenomena plasmolisis dan deplasmolisis. Menurut Pfeffer, membran ini memiliki sifat "semi-permeabilitas", yaitu permeabel terhadap air dan impermeabel terhadap zat terlarut dalam air. Pada tahun-tahun berikutnya, penelitian dilakukan yang memungkinkan tidak hanya untuk membuktikan keberadaan struktur seperti itu pada permukaan sel, tetapi juga untuk mempelajari beberapa sifat struktur ini yang tidak terlihat dalam mikroskop optik. Namun, sampai paruh kedua abad kedua puluh. biomembran tetap hanya struktur hipotetis dari sel hidup. Oleh karena itu, para peneliti telah menciptakan model sel ("sel buatan") untuk menunjukkan sifat-sifat tertentu dari membran plasma dan menjelaskan keteraturan fungsi mekanisme yang terkait dengan membran plasma.
Dalam periode waktu yang berbeda, sistem model muncul - "sel buatan" oleh Pfeffer, Traube, Jacobs, dll. Dua model pertama di atas menunjukkan fenomena osmosis, yang ketiga - keteraturan transfer elektrolit lemah melalui biomembran . Saat melakukan pekerjaan laboratorium, diusulkan untuk membuat model sistem "kandang buatan" menurut Traub dan Jacobs (dalam modifikasi).
Selama pembentukan model "sel buatan" Pfeffer dan Traube, pada antarmuka antara larutan garam darah kuning dan tembaga sulfat, terbentuk massa amorf tembaga biru-besi yang tidak larut dalam air, yang memiliki sifat osmotik yang hampir ideal - permeabilitas terhadap air dan impermeabilitas terhadap zat terlarut. Karena membran yang terbuat dari tembaga ferrosianida memisahkan dua larutan, arah dan besarnya aliran air yang melaluinya akan ditentukan oleh perbedaan potensial kimia molekul air pada sisi yang berlawanan dari membran. Jika membran seperti itu memisahkan dua larutan dari zat yang sama, maka potensial kimia molekul air akan lebih tinggi dalam larutan yang lebih encer, dan air akan bergerak dari sisi larutan dengan konsentrasi lebih rendah. Saat menentukan arah pergerakan air dalam sistem yang mengandung: zat yang berbeda di kedua sisi membran, tingkat disosiasi zat, valensi dan permeabilitas membran untuk ion harus diperhitungkan. Untuk menyederhanakan pembahasan percobaan untuk memperoleh "sel buatan" menurut Traube, kami berasumsi bahwa membran tembaga besi-biru-ferro benar-benar kedap terhadap zat terlarut, tingkat disosiasi garam darah kuning dan tembaga sulfat dalam larutan adalah sama. Dalam hal ini, untuk membandingkan nilai potensial kimia molekul air, seseorang dapat menggunakan konsentrasi normal garam-garam ini.
Keteraturan utama proses difusi zat dengan polaritas berbeda melalui membran plasma ditetapkan pada paruh pertama abad ke-20. Menurut penelitian Collander dan Barlund, koefisien permeabilitas membran terhadap zat apa pun dapat diprediksi dari berat molekul yang terakhir dan koefisien distribusi kesetimbangan (kр) antara air dan minyak nabati:
di mana CM dan SV adalah konsentrasi zat yang telah ditetapkan dalam sistem pelarut yang bersentuhan satu sama lain - minyak dan air - dalam keadaan setimbang. Untuk sebagian besar zat yang berdifusi melalui membran plasma, ada proporsionalitas langsung antara produk Pi M i dan kp (Pi adalah koefisien permeabilitas membran terhadap zat i; Mi adalah berat molekul zat i).
Koefisien kр dalam hal ini bertindak sebagai ukuran kuantitatif tingkat hidrofobisitas: lebih banyak zat hidrofobik terakumulasi dalam minyak dan dicirikan oleh nilai k yang besar, hidrofilik, sebaliknya, terakumulasi dalam fase air, bagi mereka nilainya dari k lebih kecil. Sesuai dengan hal tersebut, senyawa non-polar seharusnya lebih mudah menembus ke dalam sel akibat proses difusi melalui lapisan lipid membran daripada yang polar. Derajat hidrofobisitas ditentukan oleh struktur molekul zat. Namun, indikator hidrofobisitas suatu zat sangat bergantung pada derajat ionisasi molekulnya dalam larutan. Pada gilirannya, derajat ionisasi banyak senyawa organik dan bahan organik(elektrolit lemah) ditentukan oleh nilai pH larutan.
"Sel buatan" Jacobs mensimulasikan permeabilitas selektif membran plasma sel tumbuhan dalam kaitannya dengan molekul elektrolit lemah yang netral secara elektrik. di dalamnya desain asli"Sel buatan" Jacobs menggunakan lipatan kulit katak sebagai analog dari plasmalemma. Dalam karya yang diusulkan, film yang terbuat dari bahan hidrofobik (polimer) digunakan sebagai model plasmalemma. Ini dilakukan tidak hanya karena alasan kemanusiaan - film polimer lebih jelas mensimulasikan sifat fisikokimia lipid bilayer membran plasma.
Menjadi basa lemah, amonium ada dalam larutan berair dalam bentuk NH3 dan NH4 +, rasio konsentrasi yang tergantung pada pH medium dan untuk larutan encer ditentukan oleh konstanta disosiasi pKa, yang pada 25 ° C adalah sama dengan 9,25:
di mana dan adalah konsentrasi molekul amonia dan ion amonium, masing-masing.
Jika hanya molekul amonia yang tidak bermuatan yang dapat menembus membran, maka mudah untuk menunjukkan bahwa konsentrasi ion amonium pada sisi membran yang berbeda dalam kesetimbangan akan bergantung pada pH larutan yang bersentuhan dengan membran. Untuk mendemonstrasikan transfer amonia melintasi membran, "kandang buatan" Jacobs menggunakan kemampuannya untuk menggeser pH.
Tujuan kerja. Dapatkan "sel buatan" dengan metode Traube dan Jacobs dan amati fenomena osmosis - pergerakan air melalui membran semipermeabel di sepanjang gradien potensial osmotik.
Bahan dan peralatan: 1,0 N larutan garam darah kuning, tembaga sulfat, amonium klorida, natrium hidroksida dan asam klorida, larutan alkohol 1% berwarna merah netral, kertas indikator universal, pecahan tabung kaca meleleh dari ujungnya, film polimer, benang , tabung reaksi , 3 gelas dengan kapasitas 150-200 ml, stopwatch.
1. Mendapatkan Traube "sel buatan". Siapkan larutan 1,0 N garam darah kuning (K4Fe (CN) 6), larutan 0,5 N dan 1, N tembaga sulfat (CuSO45 H2O) dengan cara pengenceran. Ambil dua tabung reaksi. Tuang 0,5 N ke dalam satu, dan larutan tembaga sulfat 1,0 N ke yang lain. Pipet dengan hati-hati di sepanjang sisi tabung, masukkan garam darah kuning 1,0 N ke dalam setiap tabung. Pada permukaan kontak larutan tembaga sulfat dan garam darah kuning, membran tembaga biru-besi terbentuk:
Endapan amorf tembaga ferrosianida memiliki sifat osmotik yang hampir ideal, oleh karena itu, dengan perbedaan nilai potensial kimia molekul H2O, aliran air harus diamati, yang mengarah pada perubahan volume "sel buatan. ". Perlu dicatat bahwa membran tembaga biru-besi memiliki elastisitas yang rendah. Oleh karena itu, ketika volume "sel buatan" meningkat, membran pecah.
Latihan. Amati perilaku "sel buatan" dalam larutan tembaga sulfat 0,5 N dan 1,0 N. Gambar "sel buatan"
dan menggambarkan dinamika perubahan bentuknya.
2. Memperoleh "sel buatan" oleh Jacobs. Siapkan dengan pengenceran 200 ml larutan amonium klorida 0,5 N dan 100 ml larutan natrium hidroksida 0,5 N. Tuang larutan natrium hidroksida ke dalam gelas, dan bagi larutan amonium klorida menjadi dua bagian yang sama dan tuangkan ke dalam gelas dengan kapasitas 150-200 ml. Dengan menggunakan kertas indikator dan larutan 1,0 N asam klorida dan natrium hidroksida, bawa keasaman larutan dalam gelas pertama menjadi pH 9,0, dan pada gelas kedua menjadi pH 7,0.
Ambil 3 Fragmen TABUNG KACA. Di ujung yang meleleh masing-masing, letakkan selembar film plastik dan ikat dengan hati-hati dengan benang. Tambahkan 5-10 tetes larutan merah netral ke dalam 50 ml air dan sedikit asamkan medium dengan 1-2 tetes asam klorida.
Isi larutan indikator yang ditunjukkan ke "sel buatan" Jacobs (fragmen tabung kaca dengan membran). Tempatkan "sel buatan" Jacobs dalam gelas dengan larutan natrium hidroksida dan amonium klorida sedemikian rupa sehingga media ini bersentuhan dengan membran polimer.
Amonia mampu berdifusi melalui fase hidrofobik membran polimer. Dan karena konsentrasinya di dalam "sel buatan" dapat diabaikan, molekul NH3 ditransfer dari larutan ke dalam "sel" dan menyebabkan alkalisasi isi tabung gelas, yang ditandai dengan hilangnya warna merah-merah pada tabung gelas. konten "intraseluler".
Latihan. Tentukan waktu yang diperlukan untuk menghilangnya warna merah indikator pada masing-masing varian percobaan.
1. Mengapa konsentrasi garam meningkat pada permukaan "sel buatan" dalam larutan tembaga sulfat 0,5 N?
2. Mengapa "sel buatan" membengkak dalam larutan 0,5 N tembaga sulfat, tetapi permukaannya stabil dalam larutan 1,0 N?
3. Faktor apa yang menentukan derajat disosiasi asam lemah dan basa lemah?
4. Mengapa warna merah netral tidak hilang ketika "kandang buatan" ditempatkan dalam larutan natrium hidroksida?
5. Mengapa, ketika "sel buatan" ditempatkan dalam larutan netral amonium klorida, terjadi pergeseran pH konten "intraseluler" ke nilai basa lemah?
6. Apa itu osmosis?
7. Larutan apa yang disebut hipo-, iso- dan hipertonik?
FENOMENA PLASMOLISIS DAN DEPLASMOLISIS
SEL TANAMAN
Kata pengantar. Proses keluarnya air dari sel tumbuhan dan masuknya air ke dalam sel melalui membran semipermeabel dapat ditelusuri dengan mengamati fenomena plasmolisis dan deplasmolisis. Ketika sel ditempatkan dalam larutan yang hipertonik sehubungan dengan jus sel, plasmolisis terjadi - pemisahan protoplas dari dinding sel karena penurunan volumenya karena pelepasan air dari sel ke dalam larutan eksternal . Selama plasmolisis, bentuk protoplas berubah. Awalnya, protoplas tertinggal di belakang dinding sel hanya di beberapa tempat, paling sering di sudut-sudut. Plasmolisis bentuk ini disebut sudut. Dengan peningkatan durasi inkubasi sel tanaman dalam larutan hipertonik, bentuk plasmolisis berikut diamati - plasmolisis cekung. Ini ditandai dengan pelestarian kontak protoplas dengan dinding sel di tempat yang terpisah, di mana permukaan protoplas yang terpisah memperoleh bentuk cekung. Secara bertahap, protoplas terlepas dari dinding sel di seluruh permukaan dan mengambil bentuk bulat. Plasmolisis ini disebut cembung.Setelah mengganti larutan eksternal dengan air murni, yang terakhir mulai mengalir ke dalam sel. Pada saat yang sama, volume protoplas meningkat dan terjadi deplasmolisis. Setelah selesai, protoplas kembali mengisi seluruh volume sel.
Tujuan kerja. Buktikan berdasarkan fenomena plasmolisis dan deplasmolisis bahwa sel tumbuhan adalah sistem osmotik.
Bahan dan peralatan: mikroskop, slide dan kaca penutup, silet pengaman, jarum bedah, pinset, larutan sukrosa 1 M, kertas saring, umbi bawang.
Pada sisi cembung permukaan sisik bawang, sel-selnya berwarna ungu karena adanya antosianin dalam vakuola, epidermis dihilangkan dengan jarum bedah, ditempatkan di setetes air pada slide kaca, ditutup dengan kaca penutup dan diperiksa di bawah mikroskop. Kemudian ganti air dengan larutan sukrosa 1 M. Untuk melakukan ini, setetes besar larutan dioleskan ke slide kaca di sebelah kaca penutup dan air disedot dengan selembar kertas saring, oleskan di sisi lain kaca penutup. Ulangi teknik ini 2-3 kali hingga air benar-benar tergantikan dengan larutan. Obat diperiksa di bawah mikroskop. Keterlambatan bertahap protoplas dari dinding sel terdeteksi, pertama di sudut, dan kemudian di sepanjang seluruh permukaan dinding. Akhirnya, protoplas benar-benar terlepas dari dinding sel dan mengambil bentuk bulat.
Kemudian, dengan cara yang dijelaskan di atas, ganti larutan sukrosa 1 M dengan air. Air memasuki sel, yang mengarah pada peningkatan volume protoplas, yang secara bertahap kembali ke posisi sebelumnya. Sangkar dikembalikan ke keadaan semula.
Latihan. Buat sketsa bentuk plasmolisis yang diamati, serta tahapan deplasmolisis. Merumuskan kesimpulan.
1. Ciri-ciri struktural sel tumbuhan apa yang memberinya sifat-sifat sistem osmotik?
2. Apa itu plasmolisis? Jelaskan bentuk utama dari plasmolisis.
3. Apa itu deplasmolisis? Dalam kondisi apa itu diamati?
PENENTUAN TEKANAN OSMOTIK
PLASMOLITIK JUS SEL
METODE
Kata pengantar. Ketika dua larutan yang mengandung jumlah zat terlarut yang berbeda bersentuhan, karena gerakan termal yang melekat pada molekul, difusi timbal balik terjadi, yang mengarah pada pemerataan konsentrasi zat terlarut di seluruh volume, yang setara dengan situasi pencampuran cairan. Jika larutan ini dipisahkan oleh membran semipermeabel yang menjebak molekul zat terlarut, maka hanya molekul pelarut (air) yang akan melewati batas kontak larutan. Selain itu, ada aliran air searah melalui membran (osmosis). Tekanan yang harus diberikan pada salah satu larutan dalam sistem untuk mencegah masuknya pelarut ke dalamnya disebut tekanan osmotik. Besarnya tekanan osmotik suatu larutan berbanding lurus dengan konsentrasi dan suhu mutlaknya. Van't Hoff menemukan bahwa tekanan osmotik larutan encer mematuhi hukum gas dan dapat dihitung dengan rumus:di mana R adalah konstanta gas (0,0821); T adalah suhu mutlak (273 ° C + t ° C) larutan; C adalah konsentrasi zat terlarut dalam mol; i - koefisien isotonik.
Nilai koefisien isotonik ditentukan oleh kekhasan proses pembubaran zat. Untuk non-elektrolit (misalnya, untuk sukrosa) i sama dengan 1. Untuk larutan elektrolit, nilai i tergantung pada jumlah ion ke dalam molekul yang terurai dan pada tingkat disosiasi. Nilai i untuk larutan NaCl diberikan dalam tabel.
Nilai koefisien isotonik larutan natrium klorida Konsentrasi NaCl nilai i Nilai tekanan osmotik getah sel menyatakan kemampuan sel tumbuhan untuk "menyerap" air dan menunjukkan kemungkinan pertumbuhan tanaman pada tanah dengan kekuatan menahan air yang berbeda . Pada saat yang sama, peningkatan tekanan osmotik getah sel selama kekeringan merupakan kriteria untuk dehidrasi tanaman dan kebutuhan untuk penyiramannya.
Metode plasmolitik untuk menentukan tekanan osmotik isi sel didasarkan pada kenyataan bahwa tekanan osmotik larutan, yang menyebabkan pergerakan air melalui membran, dapat dibuat oleh berbagai zat (osmolitik). Oleh karena itu, untuk menentukan tekanan osmotik jus sel, pengetahuan tentang komposisi kualitatif dan konsentrasi zat individu tidak diperlukan, tetapi konsentrasi zat apa pun dalam larutan eksternal harus ditemukan, di mana tidak akan ada pergerakan air melaluinya. plasmalemma tanpa adanya turgor dan plasmolisis. Untuk ini, bagian dari jaringan yang diteliti direndam dalam serangkaian larutan dengan konsentrasi yang diketahui, dan kemudian diperiksa di bawah mikroskop. Berasal dari fakta bahwa hanya larutan hipertonik yang dapat menyebabkan plasmolisis, mereka menemukan yang terlemah di antara mereka, di mana hanya plasmolisis awal yang ditemukan dalam sel individu. Larutan yang lebih encer setelahnya tidak akan memplasmolisis sel.
Akibatnya, konsentrasi larutan isotonik untuk sel-sel ini akan sama (dengan margin kesalahan yang diketahui) dengan rata-rata aritmatika antara konsentrasi larutan tetangga.
Untuk kenyamanan, pekerjaan dilakukan dengan jaringan, yang sel-selnya mengandung antosianin dalam getah sel: epidermis sisik bawang biru, epidermis bawah daun tradescantia. Sebagai plasmolitik, larutan sukrosa atau NaCl digunakan.
Bahan dan peralatan: mikroskop, slide dan kaca penutup, silet pengaman, jarum bedah, larutan NaCl 1 M dan sukrosa 1 M, daun Tradescantia atau umbi bawang merah.
Dengan menggunakan larutan sukrosa atau NaCl 1 M, buat dengan mengencerkan 5 ml larutan sesuai tabel.
Setelah larutan tercampur rata, tuangkan ke dalam botol kaca atau cawan lebur, di mana 2-3 bagian jaringan yang diperiksa ditempatkan selama 30 menit.
Dalam hal ini, perlu untuk memastikan bahwa irisan tidak mengapung di permukaan, tetapi direndam dalam cairan (jika irisan mengapung, itu harus "tenggelam" dengan jarum bedah). Tutup wadah dengan penutup atau kaca slide untuk mencegah penguapan.
Setelah waktu inkubasi yang ditentukan telah berlalu, periksa bagian di bawah mikroskop dalam setetes larutan yang sesuai (bukan dalam air!) Dalam urutan yang sama di mana mereka direndam dalam larutan. Batang kaca atau pipet, yang dengannya larutan dioleskan pada slide kaca, harus dibilas secara menyeluruh dengan air suling setelah setiap larutan dan dibersihkan dengan tisu atau kertas saring.
Latihan. Tentukan adanya plasmolisis pada jaringan yang diperiksa dan derajatnya. Tingkat plasmolisis dinyatakan dalam istilah "kuat", "lemah", "awal", "tidak adanya plasmolisis". Masukkan hasilnya ke dalam tabel.
Derajat plasmolisis Konsentrasi isotonik, M Tekanan osmotik getah sel dalam atm dan kPa Atur konsentrasi isotonik natrium klorida, yaitu kandungan NaCl yang menciptakan tekanan osmotik yang serupa dengan getah sel dalam jaringan yang diteliti. Hitung tekanan osmotik menggunakan persamaan (1). Menggunakan faktor 101,3, hitung tekanan osmotik dalam kPa.
1. Apa itu tekanan osmotik?
2. Bagaimana cara menghitung nilai tekanan osmotik?
3. Apa yang bergantung pada nilai koefisien isotonik?
4. Kriteria proses manakah yang merupakan peningkatan tekanan osmotik getah sel?
2. SIFAT MEMBRAN SEL
Sifat terpenting membran sel adalah permeabilitas selektif. Membran sitoplasma luar, memisahkan sel dari lingkungan, mengontrol pengangkutan zat antara sel dan ruang bebas. Membran intraseluler, karena permeabilitas selektif yang melekat, menyediakan fungsi kompartementalisasi, yang memungkinkan sel dan organel untuk mempertahankan enzim dan metabolit yang diperlukan dalam volume kecil, menciptakan lingkungan mikro fisikokimia yang heterogen, dan melakukan berbagai reaksi biokimia yang kadang-kadang berlawanan arah. sisi membran yang berbeda.Permeabilitas membran sel untuk berbagai zat dapat menjadi kriteria untuk kelangsungan hidup sel. Permeabilitas selektif membran dipertahankan selama sel tetap hidup.
STUDI IZIN PEMILIHAN
PLASMALEM DARI SEL TUMBUHAN
Kata pengantar. Dimungkinkan untuk membandingkan permeabilitas membran plasma untuk berbagai zat berdasarkan pengamatan sederhana yang mencirikan durasi pengawetan plasmolisis dalam sel tumbuhan dalam larutan hipertonik zat yang diteliti. Dalam kasus permeabilitas plasmalemma yang cukup rendah untuk zat terlarut atau sama sekali tidak ada kemampuan molekulnya untuk berdifusi secara bebas ke dalam sel tanaman, plasmolisis persisten akan terjadi, di mana sel-sel yang diplasmolisis dapat tetap dalam keadaan tidak berubah selama beberapa waktu. lama. Namun, jika molekul zat terlarut melewati membran, tetapi lebih lambat daripada molekul air, maka plasmolisis yang telah dimulai bersifat sementara dan segera menghilang. Sebagai hasil penetrasi bertahap zat terlarut ke dalam sel, air akan mengalir dari larutan eksternal sepanjang gradien konsentrasi, yang pada akhirnya akan menyebabkan sel bertransisi ke keadaan deplasmolisis.Tujuan kerja. Bandingkan permeabilitas membran sel untuk berbagai zat berdasarkan pengamatan plasmolisis persisten dan transien.
Bahan dan peralatan: mikroskop, slide dan kaca penutup, silet pengaman, jarum bedah, pinset, larutan sukrosa 1 M, larutan karbamid 1 M, larutan gliserin 1 M, kertas saring, umbi bawang.
Setetes larutan diteteskan ke tiga objek: 1 M larutan sukrosa ke satu, 1 M larutan karbamid ke yang lain, dan 1 M larutan gliserin ke yang ketiga. Sebuah fragmen dari epidermis bawang merah berwarna ditempatkan di setiap tetes, ditutup dengan kaca penutup dan diperiksa di bawah mikroskop. Temukan area di mana sel-sel yang mengalami plasmolisis terlihat jelas. Waktu timbulnya plasmolisis - awal pengamatan dicatat. Preparat didiamkan selama 10-30 menit, kemudian diperiksa kembali di bawah mikroskop. Plasmolisis persisten diamati dalam larutan sukrosa, dan plasmolisis sementara dalam larutan karbamid dan gliserin. Alasan deplasmolisis dalam dua larutan terakhir adalah permeabilitas plasmalemma untuk molekul urea dan gliserol.
Latihan. Melakukan studi tentang karakteristik plasmolisis sel tumbuhan dalam larutan berbagai zat. Catat hasil pengamatan dalam tabel, catat derajat plasmolisis setiap 10 menit setelah dimulainya pengamatan. Berdasarkan analisis hasil percobaan, ungkapkan perbedaan durasi pelestarian keadaan plasmolisis yang disebabkan oleh berbagai osmolitik, dan buat kesimpulan tentang permeabilitas relatif plasmalemma untuk zat yang diteliti.
Zat terlarut Catatan: +++ - plasmolisis kuat, ++ - plasmolisis sedang, + - plasmolisis lemah.
1. Berapa permeabilitas selektif membran sel?
2. Zat apa yang lebih mudah menembus membran sel?
3. Bagaimana sifat permeabilitas selektif dapat digunakan untuk menentukan kelangsungan hidup sel tumbuhan?
MEMPELAJARI DIFUSI NETRAL
MERAH MELALUI PLASMALEMMA
SEL TANAMAN
Kata pengantar. Membran plasma mengisolasi isi intraseluler dari lingkungan eksternal. Pertukaran zat antara isi intraseluler dan lingkungan sekitar sel terjadi dengan transportasi mereka melalui membran. Lapisan ganda lipid adalah penghalang untuk pergerakan zat. Sebagian besar zat fisiologis eksogen yang signifikan memasuki sel sebagai akibat dari berfungsinya sistem transpor pasif dan aktif pada plasmalemma. Namun, difusi pasif sederhana melalui lapisan ganda lipid, yang merupakan fase hidrofobik, juga dimungkinkan.Keteraturan utama difusi zat melalui lapisan ganda lipid ditetapkan pada akhir abad ke-19 - awal abad ke-20, yaitu, pada saat biomembran hanya tinggal struktur hipotetis sel. Fakta bahwa zat hidrofobik menembus ke dalam sel lebih baik daripada zat hidrofilik, yang menjadi dasar asumsi para peneliti tentang keberadaan lipid dalam membran.
Proses difusi zat melalui membran mematuhi hukum pertama Fick, ekspresi matematis yang dalam kaitannya dengan membran dijelaskan oleh rumus:
di mana Pi adalah koefisien permeabilitas membran untuk zat i; CIII dan CiI adalah konsentrasi zat i di kedua sisi membran.
Asam dan basa lemah dicirikan oleh fakta bahwa derajat ionisasi molekulnya dalam larutan encer bergantung pada pH (lihat Pekerjaan laboratorium 1, rumus (2)). Artinya derajat disosiasi molekul elektrolit lemah pada kisaran nilai pH yang secara numerik sama dengan pKa adalah 50%. Dengan penurunan pH satu unit, lebih dari 90% molekul basa lemah akan terionisasi, dan dengan peningkatan pH dengan nilai yang sama, kurang dari 10%.
Kembali pada paruh pertama abad kedua puluh, ditunjukkan bahwa molekul elektrolit lemah yang tidak terionisasi secara elektrik netral menembus cukup baik melalui membran plasma ke dalam sel tumbuhan, sedangkan untuk ion yang sesuai, membran ternyata praktis kedap air. Misalnya, koefisien permeabilitas plasmalemma untuk amonia dan ion amonium berbeda lebih dari 100 kali lipat. Dengan demikian, pergeseran nilai pH hanya 1-2 satuan. menyebabkan perubahan lebih dari 10 kali lipat dalam konsentrasi bentuk molekul zat yang diangkut melalui membran.
Di antara elektrolit lemah, indikator asam-basa sangat menarik, karena molekul zat ini dicirikan oleh perubahan sifat optiknya saat ionisasi. Selain itu, karena karakteristik warna larutan senyawa ini, cukup mudah untuk menentukan kandungannya secara kolorimetri. Merah netral (NK) adalah basa lemah. Molekul NA terionisasi (pada pH 6,8 ke bawah) mewarnai larutan dengan warna merah pekat. Dengan peningkatan pH dari 6,8 menjadi 8,0, perubahan warna secara bertahap menjadi kuning pucat terjadi karena penurunan derajat disosiasi molekul NA. Dalam larutan basa, molekul NA yang tidak terinfeksi secara elektrik mendominasi melalui lapisan ganda lipid membran plasma, sedangkan dalam larutan asam, ion NA yang permeabelnya buruk terhadap membran mendominasi.
Molekul NK yang memasuki sel melalui plasmalemma juga dapat berdifusi melalui membran sel lain, namun, menembus ke dalam vakuola (kompartemen asam sel tumbuhan), molekul NK terionisasi, menodai isi vakuola menjadi merah tua. Dalam hal ini, ion NC "tertutup" di ruang vakuola, yaitu, mereka cenderung menumpuk.
Tujuan kerja. Untuk mempelajari keteraturan difusi merah netral melalui membran plasma sel tumbuhan Bahan dan peralatan: gunting, larutan berair-alkohol merah netral, larutan desinormal natrium hidroksida dan asam klorida, kertas indikator universal, cawan Petri, mikroskop, stopwatch , budidaya alga Nitella flexilis.
Tambahkan 5 tetes larutan merah netral ke dalam 100 ml air.
Tuang larutan ini secara merata ke dalam 4 cawan Petri. Pengontrolan keasaman isi cawan petri dengan kertas indikator universal menggunakan larutan HCl dan NaOH, atur indeks keasaman cawan petri pertama menjadi pH 9,0, cawan kedua hingga pH 8,0, dan cawan ketiga hingga pH 7,0, pada cawan petri. keempat hingga pH 5.0. Beri label pada cawan Petri.
Pisahkan 8-12 sel ruas ganggang dengan hati-hati dari thallus Nitella flexilis dengan gunting. Memeriksa ruas di bawah mikroskop, pastikan bahwa sel-sel yang disiapkan asli: sel-sel utuh yang hidup mempertahankan barisan kloroplas yang terletak sejajar dengan garis cahaya, di samping itu, ada pergerakan sitoplasma yang intens - cyclosis.
Tempatkan 2-3 sel ruas ganggang di cawan Petri.
Mulai stopwatch.
Latihan. Tentukan waktu yang diperlukan untuk pewarnaan sel alga pada setiap varian percobaan. Untuk melakukan ini, setelah 5 menit, bandingkan sel-sel ruas ganggang dari masing-masing varian sesuai dengan intensitas warna. Ulangi operasi setelah 10, 20, 30 menit. Masukkan hasil observasi ke dalam tabel. Buatlah kesimpulan tentang bentuk basa lemah yang dapat terdifusi melalui membran.
Nilai PH medium Catatan: +++ - warna intens, ++ - warna sedang, + - warna lemah, - tidak ada warna.
1. Faktor apa yang menentukan derajat disosiasi asam lemah dan basa lemah?
2. Mengapa biomembran lebih permeabel terhadap bentuk elektrolit lemah yang tidak terdisosiasi?
3. Dalam kondisi apa akumulasi elektrolit lemah dalam sel dicatat?
PERUBAHAN PERMEABILITAS TONOPLAST
DAN PLASMAEMMAS UNTUK BETHATIANIN BAWAH
TINDAKAN SECARA FISIK DAN KIMIA
FAKTOR
Kata pengantar. Permeabilitas selektif membran sel berubah di bawah pengaruh berbagai faktor. Dimungkinkan untuk menentukan pengaruh zat atau kondisi apa pun pada permeabilitas membran dengan mengukur pelepasan berbagai metabolit dari sel.Betacyanin, pigmen dalam bit, adalah molekul yang relatif besar dan sangat larut dalam air yang ditemukan dalam getah sel.
Untuk masuk ke lingkungan eksternal, molekul betacyanin harus melewati tonoplast, matriks sitoplasma utama dan plasmalemma. Tonoplas sel hidup tidak dapat ditembus oleh molekul pigmen ini. Difusi betasianin dari vakuola ke dalam media dapat berlangsung agak cepat di bawah aksi berbagai faktor atau agen yang menyebabkan peningkatan permeabilitas membran. Dengan mengukur kerapatan optik media inkubasi setelah periode waktu tertentu, dimungkinkan untuk menilai tingkat pengaruh satu faktor atau lainnya pada permeabilitas membran.
Tujuan kerja. Tentukan efek suhu, serta asam dan alkohol pada permeabilitas membran sel untuk betasianin dengan melepaskannya ke dalam larutan eksternal.
Bahan dan peralatan: air suling, larutan asam asetat 30%, larutan etanol 50%, kertas saring, tabung reaksi, rak tabung reaksi, penangas air, spektrofotometer atau fotokolorimeter, sayuran akar bit.
Setelah menghilangkan jaringan integumen, tanaman akar bit dipotong menjadi kubus (sisi kubus adalah 5 mm) dan dicuci dengan air selama 5-10 menit untuk menghilangkan pigmen yang dilepaskan dari sel yang rusak.
Kemudian mereka ditempatkan satu per satu di masing-masing 4 tabung reaksi, di mana 5 ml berbagai media dituangkan sesuai dengan skema eksperimental: air suling (2 tabung reaksi), larutan asam asetat dan etanol.
Tabung reaksi pertama dengan air suling didiamkan, dan isi tabung kedua dipanaskan dalam penangas air selama 2-3 menit. Setelah 30 menit, semua tabung dikocok dengan kuat, kubus bit dikeluarkan, dan intensitas warna larutan ditentukan pada fotokolorimeter dengan filter lampu hijau atau spektrofotometer = 535 nm.
Kerapatan optik larutan, Intensitas pewarnaan, Tugas varian eksperimen. Lakukan penelitian Anda. Masukkan hasil pengukuran kerapatan optik pada tabel. Tentukan perbedaan permeabilitas tonoplast dan plasmalemma untuk betacyanin dalam sel akar bit yang terpapar berbagai faktor, dan buat kesimpulan tentang alasan perbedaan ini.
1. Apa pentingnya permeabilitas selektif membran sel?
2. Apa yang menentukan permeabilitas selektif membran sel tumbuhan?
3. SIFAT-SIFAT SITOPLASMA
Volume utama sitoplasma yang mengisi ruang antar organel sel disebut sitosol. Bagian air dalam sitosol adalah sekitar 90%. Hampir semua biomolekul dasar terkandung dalam bentuk terlarut dalam sitosol. Larutan sejati membentuk ion dan molekul kecil (garam dari logam alkali dan alkali tanah, gula, asam amino, asam lemak, nukleotida, dan gas terlarut). Molekul besar seperti protein membentuk larutan koloid. Larutan koloid dapat berupa sol (tidak kental) dan gel (kental). Intensitas sebagian besar proses intraseluler tergantung pada viskositas sitosol.Sifat terpenting dari sitoplasma adalah gerakan aktifnya.
Ini adalah ciri khas sel tumbuhan hidup, indikator aktivitas proses vitalnya. Pergerakan sitoplasma menyediakan transportasi zat intraseluler dan interseluler, pergerakan organel di dalam sel, memainkan peran penting dalam reaksi iritabilitas. Implementasinya melibatkan elemen sitoskeleton - mikrofilamen dan mikrotubulus. Sumber energi untuk gerakan ini adalah ATP. Pergerakan sitoplasma (siklosis) adalah salah satu indikator yang paling sensitif dari viabilitas sel. Banyak pengaruh bahkan kecil berhenti atau, sebaliknya, mempercepatnya.
PENGARUH ION KALIUM DAN KALSIUM TERHADAP
VISKOSITAS SITOPLAS SEL TANAMAN
Kata pengantar. Kation individu dapat secara signifikan mengubah viskositas sitoplasma. Ditemukan bahwa ion kalium berkontribusi pada peningkatan kadar air dan penurunan viskositas. Viskositas sitoplasma yang lebih rendah mendukung aliran proses sintetik, pengangkutan zat intraseluler, tetapi menurunkan ketahanan sel tumbuhan terhadap kondisi eksternal yang tidak menguntungkan. Tidak seperti kalium, kalsium meningkatkan viskositas sitoplasma. Dengan viskositas sitosol yang lebih tinggi, proses fisiologis lebih lambat, yang meningkatkan ketahanan sel terhadap kondisi lingkungan yang tidak menguntungkan.Perubahan viskositas sitoplasma di bawah aksi ion kalium dan kalsium dapat dinilai dengan bentuk plasmolisis dalam sel dalam larutan hipertonik garamnya. Dengan inkubasi sel tanaman yang berkepanjangan dalam larutan yang mengandung ion kalium, plasmolisis tutup diamati. Dalam hal ini, ion kalium melewati plasmalemma ke dalam sitoplasma, tetapi secara perlahan menembus tonoplast ke dalam vakuola. Sebagai hasil dari pembengkakan sitoplasma, protoplas mengambil bentuk cembung, hanya terpisah dari bagian melintang dinding sel, dari sisi di mana pembentukan apa yang disebut "tutup" diamati. Peningkatan viskositas sitoplasma yang disebabkan oleh kalsium mudah dideteksi dengan mengamati perubahan bentuk protoplas plasmolisis: jika plasmolitik mengandung kalsium, maka plasmolisis cekung sering berubah menjadi bentuk kejang.
Tujuan kerja. Untuk mempelajari sifat pengaruh ion kalium dan kalsium terhadap viskositas sitoplasma sel tumbuhan berdasarkan pengamatan cap dan plasmolisis kejang.
Bahan dan peralatan: mikroskop, kaca objek dan kaca film penutup, silet pengaman, jarum bedah, pinset, larutan KNO3 1 M, larutan Ca (NO3) 2 M, kertas saring, umbi bawang.
Setetes larutan kalium nitrat 1 M diterapkan pada satu kaca objek, dan larutan kalsium nitrat 1 M pada kaca objek lainnya. Sepotong epidermis bawang, dikeluarkan dari permukaan cekung sisik bawang yang sama, ditempatkan di kedua tetes, ditutup dengan penutup. Setelah 30 menit, preparat diperiksa di bawah mikroskop dalam larutan di mana mereka berada. Fenomena plasmolisis diamati. Dalam beberapa sel epidermis, disimpan dalam larutan KNO3, dari sisi dinding melintang sel, sitoplasma membentuk "tutup", yang penampilannya disebabkan oleh peningkatan hidrasi sitosol di bawah pengaruh dari ion kalium. Ion kalsium, sebaliknya, meningkatkan viskositas sitoplasma, meningkatkan adhesi ke dinding sel, dan protoplas mengambil bentuk tidak beraturan, karakteristik plasmolisis kejang.
Latihan. Gambarkan bentuk-bentuk plasmolisis yang diamati. Ungkapkan ketergantungan bentuk plasmolisis pada viskositas sitoplasma dengan adanya ion kalium dan kalsium.
1. Bagaimana ion kalium dan kalsium mempengaruhi viskositas sitoplasma?
2. Dalam kondisi apa plasmolisis kejang diamati?
3. Apa alasan terbentuknya "tutup" akibat inkubasi sel dalam larutan KNO3?
PENGAMATAN GERAK SITOPLASM
SEL TUMBUHAN DAN PENGUKURANNYA
KECEPATAN
Kata pengantar. Yang paling nyaman untuk mengamati pergerakan sitoplasma adalah sel tanaman besar dengan vakuola besar (sel ruas ganggang chara, ganggang hijau siphon laut, sel daun tanaman air Elodea, Vallisneria, dll.). Ada beberapa jenis gerakan sitoplasma. Gerakan osilasi adalah yang paling luas. Ini dianggap paling tidak teratur, karena beberapa partikel diam, yang lain meluncur ke pinggiran, dan yang lain ke pusat sel. Gerakannya tidak stabil, acak. Pergerakan sirkulasi adalah karakteristik sel yang memiliki tali sitoplasma melintasi vakuola pusat. Arah dan kecepatan pergerakan partikel yang terletak di dalam atau di permukaan lapisan sitoplasma, serta di lapisan sitoplasma, tidak konstan. Selama gerakan rotasi, sitoplasma hanya bergerak di pinggiran sel dan bergerak seperti sabuk penggerak. Pergerakan jenis ini, berbeda dengan sirkulasi, memiliki karakter yang kurang lebih konstan dan teratur, oleh karena itu nyaman untuk studi kuantitatif. Selain di atas, gerakan sitoplasma juga dibedakan, misalnya, tercurah dan antar-jemput. Jenis gerakan berbeda satu sama lain secara kondisional dan dalam sel yang sama dapat berpindah dari satu ke yang lain.Pergerakan sitoplasma dapat dicirikan dengan menentukan kecepatannya, yang tidak hanya bergantung pada kekuatan pendorong, tetapi juga pada viskositas sitoplasma. Kecepatan pergerakan sitoplasma dapat diukur di bawah mikroskop dengan mengamati pergerakan partikelnya.
Tujuan kerja. Kenali jenis gerakan rotasi sitoplasma dan ukur kecepatannya di berbagai objek tanaman.
Bahan dan peralatan: mikroskop, slide dan slide penutup, pisau cukur pengaman, jarum bedah, larutan air kolam buatan, daun Vallisneria, sel internodal nitella.
Sepotong kecil dipotong dari bilah daun Vallisneria dengan pisau cukur yang tajam, mencoba melukai daun sesedikit mungkin, letakkan di setetes air pada slide kaca dan periksa di bawah mikroskop, pertama pada rendah, kemudian pada perbesaran tinggi . Memotong dari lembaran tidak dianjurkan, karena sel-selnya terluka parah, dan gerakan di dalamnya berhenti. Pergerakan sitoplasma mudah diamati dengan pergerakan semua kloroplas dalam satu arah di sepanjang dinding sel. Gerakan ini disebut rotasi.
Untuk mengamati siklosis dalam sel nitella, sel yang telah disiapkan sebelumnya ditempatkan di ruang khusus, yang diisi dengan larutan air kolam buatan. Semua alga charo juga menunjukkan jenis gerakan sitoplasmik rotasi, tetapi kloroplas dalam sel-sel ini tidak bergerak. Langsung ke membran selulosa, mereka memiliki lapisan sitoplasma padat dan tidak bergerak yang disebut ektoplasma. Pada lapisan ini, kromatofora tetap, yang membentuk satu lapisan baris memanjang teratur yang berdekatan. Antara vakuola dan lapisan ektoplasma terdapat lapisan seluler cair internal sitoplasma, yang disebut endoplasma. Pergerakan intensifnya dapat diamati dengan pergerakan organel yang lebih kecil dari kloroplas - inklusi kecil tidak berwarna yang tersuspensi dalam sitoplasma.
Untuk menentukan kecepatan gerak sitoplasma, digunakan stopwatch dan penggaris okuler yang ditempatkan di lensa okuler mikroskop. Stopwatch digunakan untuk menghitung waktu selama kloroplas atau partikel bergerak lainnya melewati jarak antara dua divisi yang dipilih dari penggaris lensa mata. Pengukuran seperti itu di sel yang sama dilakukan 3-5 kali. Untuk menghitung kecepatan gerakan sitoplasma, ukur nilai pembagian penggaris lensa mata. Untuk ini, objek mikrometer ditempatkan di atas panggung mikroskop, yang diperiksa dalam mikrometer lensa mata. Tujuan yang dipilih ditetapkan pada pembagian objek mikrometer dan jumlah pembagian objek mikrometer dihitung. Harga divisi mikrometer lensa mata dihitung dengan rumus di mana N adalah harga divisi mikrometer lensa mata; 10 mikron - pembagian skala objek mikrometer; b adalah jumlah divisi mikrometer lensa mata yang sesuai dengan (a) divisi objek mikrometer.
Kecepatan partikel adalah rasio jarak dalam mikrometer dengan jumlah detik selama partikel yang bergerak menempuh jarak ini (μm / s).
Latihan. Melakukan penentuan nilai kecepatan gerak sitoplasma dalam sel tumbuhan air. Masukkan hasil pengukuran ke dalam tabel. Buat gambar skema sel-sel objek yang sedang dipertimbangkan dan dengan panah menunjukkan arah pergerakan sitoplasma, bandingkan sifat dan kecepatan cyclosis.
Benda Jenis Jarak bergerak Waktu tempuh partikel, s Kecepatan putaran, 1. Apa yang dimaksud dengan sitosol?
2. Bagaimana bentuk plasmolisis bergantung pada kekentalan sitoplasma sel tumbuhan?
3. Apa itu? signifikansi biologis pergerakan sitoplasma?
4. Apa jenis utama gerakan sitoplasma?
5. Apa yang menentukan kecepatan gerak sitoplasma?
Dari penulis ………………………………………………………….1. SEL TANAMAN SEBAGAI OSMOTIK
SISTEM………………………………………………………….Pekerjaan laboratorium Model sel tumbuhan …………………………………… ... Kerja laboratorium Fenomena plasmolisis dan deplasmolisis sel tumbuhan .. ……. Kerja laboratorium Penentuan tekanan osmotik sari sel dengan metode plasmolitik …………………………………. ……………. 2. SIFAT-SIFAT MEMBRAN SELULER ………… .. ………… ..
Pekerjaan laboratorium Studi permeabilitas selektif plasmalemma sel tumbuhan ………………………. ……………………………… .. Pekerjaan laboratorium Studi difusi merah netral melalui membran plasma Pekerjaan laboratorium Perubahan permeabilitas tonoplast dan plasmalemma untuk betasianin di bawah aksi faktor fisik dan kimia ... 3. SIFAT-SIFAT SITOplasma ……………………………… ... Pekerjaan laboratorium Pengaruh ion kalium dan kalsium pada viskositas sitoplasma sel tumbuhan ……………………………… .. ……………………. Pekerjaan laboratorium Mengamati pergerakan sitoplasma sel tumbuhan dan mengukur kecepatannya ……………………………………………….
FISIOLOGI SEL TUMBUHAN
bengkel "Fisiologi Tumbuhan"untuk mahasiswa Fakultas Biologi Bertanggung jawab atas rilis A. P. Kudryashov Ditandatangani untuk dicetak 31. 08. 2009. Format 6084/16. Kertas offset.
Headset kali. KONV. mencetak l. 1.63. Uch.-ed. l. 1.62. Sirkulasi 50 eksemplar. Zach.
Universitas Negeri Belarusia 220030, Minsk, Independence Avenue, 4.
Dicetak dari tata letak asli pelanggan pada peralatan penyalinan dan penggandaan dari Universitas Negeri Belarusia.
Karya serupa:
"Kementerian ZDRAVOOHRANENIYAIYA RUSIA Lembaga Pendidikan Anggaran Negara Pendidikan Profesi Tinggi Universitas Kedokteran Negeri Irkutsk (Universitas Kedokteran ISMU Kementerian Kesehatan Rusia) kursus fisioterapi dan kedokteran olahraga disiplin akademik terapi fisik dan pedoman pemantauan medis untuk siswa kerja kelas dari spesialisasi: 060103 (040200) - Pediatri ( PED), 5 mata kuliah TOPIK PELAJARAN: Terapi latihan dalam sistem rehabilitasi medik. DASAR…”
UNIVERSITAS Departemen Keselamatan Hidup, Anatomi dan Fisiologi FISIOLOGI (FISIOLOGI MANUSIA DAN HEWAN) Kompleks pendidikan-metodis Untuk siswa yang terdaftar dalam spesialisasi 020201 Biologi Gorno-Altaisk RIO Universitas Negeri Gorno-Altai 2008 Diterbitkan berdasarkan keputusan dewan metodologis Negara Bagian Gorno-Altai ... "
“Pengulas: Doktor Ilmu Biologi, Profesor Panov Valery Petrovich - Akademi Pertanian Moskow; Doktor Ilmu Pertanian, Profesor Nikolay Vasilievich Gruzdev - Kepala. Departemen Ilmu Peternakan Swasta, PFUR. Blokhin GI dkk.K64 Cynology. Buku teks untuk universitas / G. I. Blokhin, M. Yu. Gladkikh, A. A. Ivanov, B. R. Ovsischer, M. V. Sidorova - M .: OOO Publishing House Scriptorium 2000, 2001. - 432 hal. dengan lumpur. Manual tersebut mencakup informasi tentang anatomi, fisiologi, pemberian makan, pemeliharaan, pembiakan, dan genetika anjing .... "
"KAZAN FEDERAL (PRIVOLGA) UNIVERSITY Fakultas Biologi dan Ilmu Tanah Jurusan Fisiologi Manusia dan Hewan PRAKTEK PADA METODE FISIK DAN KIMIA DALAM BIOLOGI Alat bantu ajar Yakovleva OV, Sitdikova GF, Yakovlev Kazan-2010 1 Diterbitkan oleh keputusan dewan metodologi pendidikan Fakultas Biologi dan Ilmu Tanah KF (P) Lokakarya metode fisik dan kimia ... "
“Bulletin akuisisi baru (November 2008) 1. ILMU SOSIAL 1.1. Filsafat. Psikologi. Logika 1. Yu9ya7 Bogomolova, NN Psikologi sosial komunikasi massa: buku teks. PoB 74 sobie untuk universitas / N.N.Bogomolova. - M.: Aspect Press, 2008 .-- 191 hal. a - 1; h / zo - 1; 2. Yuya7 Pengantar filsafat: buku teks. manual untuk universitas / I. T. Frolov [dan lainnya]. - Ke-4 Dalam edisi ke-24, Pdt. dan tambahkan. - M.: Revolusi budaya, 2007 .-- 623 hal. uh / b - 1; 3. Yu Goldobina, L.A. Masyarakat sebagai makhluk khusus: ... "
UNIVERSITAS NEGERI BELARUSIA FAKULTAS BIOLOGI Departemen Botani DASAR-DASAR BOTANIK Instruksi metodis untuk studi laboratorium untuk mahasiswa tahun pertama departemen spesialisasi 1-31 01 02 Biokimia; 1-31 01 03 Mikrobiologi MINSK 2013 UDC 581.4 (077) LBC 28.56 r.y73 O-75 Komposisi: T. A. Sautkina, V. D. Poliksenova, A. K. Khramtsov , VN Tikhomirov, MA Dzhus Direkomendasikan oleh Dewan Fakultas Biologi Negara Belarusia Universitas pada 27 Februari 2013 ... "
UNIVERSITAS NEGERI BELARUSIAN FAKULTAS BIOLOGI Departemen Fisiologi Manusia dan Hewan PENGEMBANGAN VERTEBRAT TINGGI: BURUNG Instruksi metodis untuk kursus Biologi pengembangan individu untuk mahasiswa Fakultas Biologi, spesialisasi 1-31 01 01 Biologi MINSK 2007 UDC 286,06 RB 17,70 Maslova, AV Sidorov Direkomendasikan oleh Dewan Akademik Fakultas Biologi 7 Desember 2007, Protokol No. 5 Calon Pengulas Ilmu Biologi, Associate Professor C .... "
"Lembaga pendidikan anggaran negara pendidikan profesional tinggi Universitas Kedokteran Negeri Irkutsk Kementerian Kesehatan Federasi Rusia Sistem kardiovaskular: fitur anatomi dan fisiologis, metode penelitian dan semiotika lesi utama. Panduan belajar Irkutsk ISMU 2012 1 UDC BBK 57.319я73 32 Direkomendasikan oleh FMS fakultas pediatrik GBOU VPO ISMU dari Kementerian Kesehatan Rusia sebagai ... "PERKEMBANGAN KESEHATAN DAN SOSIAL FEDERASI RUSIA (GBOU VPO VOLGGMU KEMENTERIAN KESEHATAN DAN PEMBANGUNAN SOSIAL RUSIA) Disetujui _ Kepala. Departemen Fisiologi Patologis, Doktor Ilmu Kedokteran, Profesor L.N. PENGEMBANGAN METODOLOGI Rogova bagi mahasiswa dalam menyelenggarakan kelas praktik dalam disiplin Patofisiologi, patofisiologi kepala dan leher dalam spesialisasi ... "
"Badan Federal untuk Pendidikan Institusi Pendidikan Negeri Pendidikan Profesi Tinggi UNIVERSITAS NEGERI GORNO-ALTAI Departemen Keselamatan, Anatomi dan Fisiologi Kehidupan MANUSIA Kompleks pendidikan-metodis Untuk siswa yang terdaftar dalam spesialisasi 020201 Biologi Gorno-Altaysk RIO Dewan Negara Gorno-Altai 2009 Gorno-Altai Universitas Negeri UDC 611; 591,4 LBC Penulis ... "
"Universitas Kedokteran Negeri Donetsk. M. Gorky Departemen Kimia Obat PETUNJUK METODOLOGI untuk pelatihan praktis dalam kimia obat untuk mahasiswa tahun pertama Fakultas Kedokteran Internasional. Donetsk - 2011 1 Instruksi metodis disiapkan oleh: kepala. Departemen, Associate Professor Rozhdestvensky E.Yu. Associate Professor Sidun M.S., Art. guru Pavlenko V.I., asisten departemen Ignatieva V.V., Boytsova V.E., Busurina Z.A., Streletskaya L.P., Sidorenko L.M. Pedoman metodis disetujui untuk ... "
«UNIVERSITAS MEDIS NEGARA IRKUTSK Departemen kebersihan dan kebersihan komunal anak-anak dan remaja PERSYARATAN HIGIENIS UNTUK ALAS KAKI D E T S K O Y (manual pendidikan-metodis untuk mahasiswa fakultas pediatrik) Irkutsk, 2010 Persyaratan higienis untuk sepatu anak-anak: Manual pendidikan / metodologi .G., Popov IP, Makarova LI - Irkutsk: Penerbitan ISMU, 2010. Manual pelatihan disiapkan di bawah kepemimpinan redaksi. Departemen Profesor Ignatieva L.P. staf departemen ... "
UNIVERSITAS NEGERI BELARUSIAN FAKULTAS BIOLOGI Jurusan Fisiologi Manusia dan Hewan PENGEMBANGAN AMPHIBI Petunjuk metodologis untuk mata kuliah Biologi perkembangan individu untuk mahasiswa Fakultas Biologi, spesialisasi 1-31 01 01 Biologi MINSK 2007 UDC 611.06 BBK 28.706 P 17 Penulis-penyusun V. Sidorov Direkomendasikan oleh Dewan Akademik Fakultas Biologi 10 April 2007, Protokol No. 7 Calon Pengulas Ilmu Biologi, Associate Professor SV Glushen ... "
"Penyediaan proses pendidikan dengan perpustakaan lain dan sumber informasi dan sarana untuk memastikan proses pendidikan yang diperlukan untuk pelaksanaan yang dinyatakan untuk lisensi Program edukasi Spesialisasi Penulis, nama, tempat penerbitan, penerbit, tahun Nomor Jumlah edisi eksemplar yang mempelajari disiplin Ilmu Kedokteran Umum 060101 Kebidanan. untuk siswa sayang. universitas Saveliev, Obstetri 537 432 Shalina, Sichinava, Panina, Kurtser. - M.: GEOTAR-Media, 2009 ... "
“Cabang Pyatigorsk dari Lembaga Pendidikan Anggaran Negara Pendidikan Profesi Tinggi Universitas Kedokteran Negeri Volgograd dari Kementerian Kesehatan Federasi Rusia DEPARTEMEN KIMIA BIOLOGI DAN MIKROBIOLOGI Ye.G. MIKROBIOLOGI UMUM DORKIN. BAGIAN 2 FISIOLOGI MIKROORGANISME Instruksi metodis untuk pekerjaan mandiri (ekstrakurikuler) siswa tahun pertama (pendidikan penuh waktu) dalam disiplin 2.B.11 - MIKROBIOLOGI Pyatigorsk 2013 1 UDC ... "
"BADAN FEDERAL PENDIDIKAN LEMBAGA PENDIDIKAN PROFESIONAL TINGGI UNIVERSITAS NEGERI VORONEZH A.T. Eprintsev, V.N. Popov, D.N. IDENTIFIKASI DAN PENELITIAN EKSPRESI GEN Fedorin Panduan studi untuk universitas Pusat Penerbitan dan Percetakan Universitas Negeri Voronezh 2008 Disetujui oleh Dewan Ilmiah dan Metodologi Fakultas Biologi dan Ilmu Tanah pada 14 Februari 2008, Protokol No. Pengulas Doktor Biologi .. . "
"LEMBAGA PENDIDIKAN NEGARA PENDIDIKAN TINGGI Universitas Kedokteran Negeri Kursk, Kementerian Kesehatan Federasi Rusia Fakultas Farmasi Kimia Biologi, panduan belajar mandiri tentang kimia biologi untuk mahasiswa Fakultas Farmasi, Pembelajaran Jarak Jauh KURSK - 2005 UDC: 54:57 (072) BBK: 24:28 YA7 Diterbitkan berdasarkan keputusan redaksi KSMU. Pedoman belajar mandiri kimia biologi ... "
ANGGARAN NEGARA LEMBAGA PENDIDIKAN PROFESIONAL TINGGI VOLGOGRAD UNIVERSITAS MEDIS NEGARA KEMENTERIAN KESEHATAN DAN KEBIJAKAN SOSIAL FEDERASI RUSIA FEDERASI FEDERASI RUSIA FEDERASI FEDERASI RUSIA FEDERASI RUSIA Departemen Fisiologi Patologis, Doktor Ilmu Kedokteran, Profesor L. N. Rogova PENGEMBANGAN METODOLOGI untuk siswa dalam melakukan kelas praktis dalam disiplin Patofisiologi, patofisiologi kepala dan leher dalam spesialisasi ... "
«1 2 NI Fedyukovich ANATOMI DAN FISIOLOGI MANUSIA Disetujui oleh Kementerian Pendidikan Federasi Rusia sebagai buku teks untuk siswa sekolah kedokteran yang belajar dalam spesialisasi 0406 Keperawatan Edisi kedua Rostov-on-Don Phoenix 2003 BBK 28.8я723 Ф32 3 Fedyukovich N.I F 32 Anatomi dan Fisiologi Manusia: Buku Ajar. Ed. 2. - Rostov n / a: penerbit: Phoenix, 2003 .-- 416 hal. Tutorial mencakup masalah normal, anatomi dan fisiologi manusia, dengan mempertimbangkan ... "
Pendahuluan 2
1.Fakta kunci tentang struktur membran sel 3
2. Konsep umum permeabilitas 4
3. Transportasi molekul melintasi membran 4
3.1. Difusi 5
3.2 Persamaan Fick 6
3.3 Transportasi pasif 7
3.3.1 Perbedaan antara difusi terfasilitasi dan sederhana 8
4. Hukum Darcy 8
5. Transpor aktif 9
6. Struktur dan fungsi saluran ion 11
Kesimpulan 15
Referensi 17
PENGANTAR
Transpor membran adalah transpor zat melalui membran sel ke dalam sel atau dari sel, dilakukan dengan menggunakan berbagai mekanisme - difusi sederhana, difusi terfasilitasi dan transpor aktif.
Sifat terpenting dari membran biologis adalah kemampuannya untuk melewatkan berbagai zat ke dalam dan ke luar sel. Memiliki sangat penting untuk pengaturan diri dan pemeliharaan komposisi sel yang konstan. Fungsi membran sel ini dilakukan karena permeabilitas selektif, mis. kemampuan untuk melewatkan beberapa zat dan tidak melewati yang lain. Molekul nonpolar dengan berat molekul rendah (oksigen, nitrogen, benzena) paling mudah melewati lapisan ganda lipid. Molekul polar kecil seperti karbon dioksida, oksida nitrat, air, dan urea menembus lapisan ganda lipid agak cepat. Etanol dan gliserol, serta steroid dan hormon tiroid, melewati lapisan ganda lipid dengan kecepatan yang nyata. Untuk molekul polar yang lebih besar (glukosa, asam amino), serta untuk ion, lapisan ganda lipid praktis kedap air, karena bagian dalamnya bersifat hidrofobik. Jadi, untuk air, koefisien permeabilitas (cm / s) sekitar 10-2, untuk gliserin - 10-5, untuk glukosa - 10-7, dan untuk ion monovalen - kurang dari 10-10.
Perpindahan molekul dan ion polar besar disebabkan oleh protein saluran atau protein pembawa. Jadi, di membran sel ada saluran untuk ion natrium, kalium dan klorin, di membran banyak sel ada saluran air aquaporin, serta protein pembawa untuk glukosa, berbagai kelompok asam amino dan banyak ion. Aktif dan transportasi pasif.
Membran membentuk struktur sel dan menjalankan fungsinya. Disfungsi sel dan membran intraseluler mendasari kerusakan sel yang ireversibel dan, sebagai akibatnya, perkembangan penyakit parah pada sistem kardiovaskular, saraf, endokrin.
1. Fakta dasar tentang struktur membran sel.
Membran sel meliputi plasmolemma, karyolemma, membran mitokondria, EPS, aparatus Golgi, lisosom, peroksisom. Fitur umum dari semua membran sel adalah bahwa mereka adalah lapisan tipis (6-10 nm) yang bersifat lipoprotein (lipid dalam kompleks dengan protein). Komponen kimia utama membran sel adalah lipid (40%) dan protein (60%); selain itu, karbohidrat (5-10%) ditemukan di banyak membran.
Membran plasma mengelilingi setiap sel, menentukan ukurannya dan memastikan bahwa perbedaan antara isi sel dan lingkungan eksternal dipertahankan. Membran berfungsi sebagai filter yang sangat selektif dan bertanggung jawab untuk transpor aktif zat, yaitu masuknya nutrisi ke dalam sel dan pembuangan produk limbah berbahaya di luar. Akhirnya, membran bertanggung jawab atas persepsi sinyal eksternal, memungkinkan sel untuk merespons perubahan eksternal. Semua membran biologis adalah kumpulan molekul lipid dan protein yang disatukan oleh interaksi non-kovalen.
Dasar dari setiap membran molekul dibentuk oleh molekul lipid yang membentuk bilayer. Lipid termasuk kelompok besar zat organik dengan kelarutan air yang buruk (hidrofobisitas) dan kelarutan yang baik dalam pelarut organik dan lemak (lipofilisitas). Komposisi lipid dalam membran yang berbeda tidak sama. Misalnya, membran plasma, berbeda dengan membran retikulum endoplasma dan mitokondria, diperkaya dengan kolesterol. Perwakilan khas lipid yang ditemukan dalam membran sel adalah fosfolipid (gliserofosfatida), sfingomielin dan, dari lipid steroid, kolesterol.
Ciri lipid adalah pemisahan molekulnya menjadi dua bagian yang berbeda secara fungsional: hidrofobik, non-polar, tanpa muatan ("ekor"), yang terdiri dari asam lemak, dan "kepala" kutub yang bermuatan hidrofilik. Hal ini menentukan kemampuan lipid untuk secara spontan membentuk struktur membran bilayer (bilipid) dengan ketebalan 5-7 nm.
Eksperimen pertama yang mengkonfirmasi hal ini dilakukan pada tahun 1925.
Pembentukan bilayer adalah sifat khusus dari molekul lipid dan diwujudkan bahkan di luar sel. Sifat paling penting dari lapisan ganda: kemampuan untuk merakit sendiri - fluiditas - asimetri.
2. Konsep umum permeabilitas.
Karakterisasi membran, dinding pembuluh darah dan sel epitel, yang mencerminkan kemampuan untuk melakukan bahan kimia; membedakan antara aktif (transpor aktif zat) dan pasif P. (fagositosis
3. Transportasi molekul melintasi membran.
Karena bagian dalam lapisan lipid bersifat hidrofobik, lapisan ini merupakan penghalang yang hampir tidak dapat ditembus oleh sebagian besar molekul polar. Karena adanya penghalang ini, kebocoran isi sel dicegah, namun karena ini, sel dipaksa untuk membuat mekanisme khusus untuk pengangkutan zat yang larut dalam air melalui membran. Pemindahan molekul kecil yang larut dalam air dilakukan dengan menggunakan protein transpor khusus. Ini adalah protein transmembran khusus, yang masing-masing bertanggung jawab untuk pengangkutan molekul tertentu atau kelompok molekul terkait.
Di dalam sel, ada juga mekanisme transfer makromolekul (protein) dan bahkan partikel besar melalui membran. Proses penyerapan makromolekul oleh sel disebut endositosis. Secara umum, mekanisme jalannya adalah sebagai berikut: area lokal membran plasma berinvaginasi dan menutup, membentuk vesikel endositik, kemudian partikel yang diserap biasanya memasuki lisosom dan mengalami degradasi.
3.1 Difusi (Latin difusio - menyebar, menyebar, hamburan) - proses perpindahan materi atau energi dari area konsentrasi tinggi ke area konsentrasi rendah (melawan gradien konsentrasi). Contoh difusi yang paling terkenal adalah pencampuran gas atau cairan (jika tinta dijatuhkan ke dalam air, cairan akan menjadi berwarna seragam setelah beberapa saat). Contoh lain terkait dengan benda padat: jika salah satu ujung batang dipanaskan atau bermuatan listrik, panas (atau, karenanya, arus listrik) menyebar dari bagian panas (bermuatan) ke bagian dingin (tidak bermuatan). Dalam kasus batang logam, difusi termal berkembang pesat dan arus mengalir hampir seketika. Jika batang terbuat dari bahan sintetis, difusi termal lambat dan difusi partikel bermuatan listrik sangat lambat. Difusi molekul umumnya lebih lambat. Misalnya, jika gula batu diturunkan ke dasar segelas air dan air tidak diaduk, maka beberapa minggu akan berlalu sebelum larutan menjadi homogen. Difusi dari satu padat ke yang lain terjadi bahkan lebih lambat. Misalnya, jika tembaga dilapisi dengan emas, maka difusi emas menjadi tembaga akan terjadi, tetapi dalam kondisi normal (suhu kamar dan tekanan atmosfer), lapisan pembawa emas akan mencapai ketebalan beberapa mikrometer hanya setelah beberapa ribu tahun.
Semua jenis difusi mematuhi hukum yang sama. Laju difusi sebanding dengan luas penampang sampel, serta perbedaan konsentrasi, suhu, atau muatan (dalam hal nilai parameter ini relatif kecil). Dengan demikian, panas akan menyebar empat kali lebih cepat melalui batang dengan diameter dua sentimeter daripada melalui batang dengan diameter satu sentimeter. Panas ini akan menyebar lebih cepat jika perbedaan suhu per sentimeter adalah 10 ° C, bukan 5 ° C. Laju difusi juga sebanding dengan parameter yang mencirikan bahan tertentu. Dalam kasus difusi termal, parameter ini disebut konduktivitas termal, dalam kasus aliran muatan listrik - konduktivitas listrik. Jumlah materi yang berdifusi selama waktu tertentu dan jarak yang ditempuh oleh materi yang berdifusi sebanding dengan akar kuadrat dari waktu difusi.
Difusi adalah proses pada tingkat molekuler dan ditentukan oleh sifat acak dari pergerakan molekul individu. Oleh karena itu, laju difusi sebanding dengan kecepatan molekul rata-rata. Dalam kasus gas, kecepatan rata-rata molekul kecil lebih tinggi, yaitu berbanding terbalik dengan akar kuadrat dari massa molekul dan meningkat dengan meningkatnya suhu. Proses difusi dalam padatan pada suhu tinggi sering digunakan dalam praktik. Misalnya, beberapa jenis tabung sinar katoda (CRT) menggunakan torium logam yang disebarkan melalui tungsten logam pada 2000 ° C.
3.2 persamaan Fick
Dalam kebanyakan kasus praktis, alih-alih potensial kimia, konsentrasi C digunakan. Penggantian langsung dengan C menjadi tidak benar dalam kasus konsentrasi tinggi, karena potensial kimia terkait dengan konsentrasi menurut hukum logaritmik. Jika Anda tidak mempertimbangkan kasus seperti itu, maka rumus di atas dapat diganti dengan yang berikut:
yang menunjukkan bahwa kerapatan fluks zat J sebanding dengan koefisien difusi D dan gradien konsentrasi. Persamaan ini mengungkapkan hukum pertama Fick (Adolf Fick adalah seorang ahli fisiologi Jerman yang menetapkan hukum difusi pada tahun 1855). Hukum kedua Fick menghubungkan perubahan spasial dan temporal dalam konsentrasi (persamaan difusi):
Koefisien difusi D bergantung pada suhu. Dalam beberapa kasus, dalam kisaran suhu yang luas, ketergantungan ini adalah persamaan Arrhenius.
Proses difusi sangat penting di alam:
Nutrisi, respirasi hewan dan tumbuhan;
Penetrasi oksigen dari darah ke jaringan manusia.
3.3 Transportasi pasif
Transpor pasif adalah perpindahan zat dari tempat yang potensial elektrokimianya tinggi ke tempat yang potensial elektrokimianya lebih rendah.
Dalam percobaan dengan lapisan ganda lipid buatan, ditemukan bahwa semakin kecil molekul dan semakin sedikit ikatan hidrogen yang terbentuk, semakin cepat ia berdifusi melalui membran. Jadi, semakin kecil molekul dan semakin larut dalam lemak (hidrofobik atau non-polar), semakin cepat ia akan menembus membran. Difusi zat melalui lapisan ganda lipid disebabkan oleh gradien konsentrasi dalam membran. Melalui pori-pori lipid dan protein, molekul zat yang tidak larut dalam lemak dan ion terhidrasi yang larut dalam air (dikelilingi oleh molekul air) menembus membran. Molekul non-polar kecil mudah larut dan berdifusi dengan cepat. Molekul polar yang tidak bermuatan pada ukuran kecil juga dapat larut dan berdifusi.
Adalah penting bahwa air dengan sangat cepat menembus lapisan ganda lipid, meskipun faktanya relatif tidak larut dalam lemak. Ini disebabkan oleh fakta bahwa molekulnya kecil dan netral secara listrik.
Osmosis adalah pergerakan dominan molekul air melalui membran semipermeabel (impermeabel terhadap zat terlarut dan permeabel terhadap air) dari tempat dengan konsentrasi zat terlarut lebih rendah ke tempat dengan konsentrasi lebih tinggi. Osmosis pada dasarnya adalah difusi sederhana air dari tempat-tempat dengan konsentrasi air yang lebih tinggi ke tempat-tempat dengan konsentrasi air yang lebih rendah. Osmosis memainkan peran penting dalam banyak fenomena biologis. Fenomena osmosis menyebabkan hemolisis eritrosit dalam larutan hipotonik.
Jadi, membran dapat melewatkan air dan molekul non-polar melalui difusi sederhana.
3.3.1 Perbedaan antara difusi terfasilitasi dan sederhana:
1) transfer zat dengan partisipasi pembawa terjadi lebih cepat;
2) difusi terfasilitasi memiliki sifat kejenuhan: dengan peningkatan konsentrasi di satu sisi membran, kerapatan fluks zat hanya meningkat hingga batas tertentu, ketika semua molekul pembawa sudah terisi;
3) dengan difusi terfasilitasi, ada persaingan antara zat yang ditransfer dalam kasus di mana zat yang berbeda ditransfer oleh pembawa; pada saat yang sama, beberapa zat ditoleransi lebih baik daripada yang lain, dan penambahan beberapa zat mempersulit pengangkutan zat lain; jadi dari gula glukosa lebih baik ditoleransi daripada fruktosa, fruktosa lebih baik dari xilosa, dan xilosa lebih baik dari arabinosa dan. dll .;
4) ada zat yang menghalangi difusi terfasilitasi - mereka membentuk kompleks yang kuat dengan molekul pembawa, misalnya, phloridzin menghambat pengangkutan gula melintasi membran biologis.
4 hukum Darcy
Hukum Darcy (Henri Darcy, 1856) - hukum filtrasi cairan dan gas dalam media berpori. Diperoleh secara eksperimental. Menyatakan ketergantungan laju filtrasi fluida pada gradien tekanan:
dimana: - laju filtrasi, K - koefisien filtrasi, - gradien tekanan. Hukum Darcy dikaitkan dengan beberapa sistem pengukuran. Sebuah media dengan permeabilitas 1 Darcy (D) memungkinkan 1 cm³ / s cairan atau gas dengan viskositas 1 cn (mPa · s) mengalir di bawah gradien tekanan 1 atm / cm, bekerja pada area seluas 1 cm². 1 millidarcy (mD) sama dengan 0,001 Darcy.
Dalam satuan SI, 1 Darcy setara dengan 9,869233 × 10-13m² atau 0,9869233 m². Konversi ini biasanya diperkirakan sebagai 1 m². Perlu dicatat bahwa angka ini, kebalikan dari 1,013250, adalah faktor konversi dari atmosfer ke batangan.
Transportasi melintasi lapisan ganda lipid (difusi sederhana) dan transportasi dengan partisipasi protein membran
5. Transpor aktif
Protein pembawa lainnya (kadang-kadang disebut protein pompa) mengangkut zat melintasi membran dengan pengeluaran energi, yang biasanya disuplai selama hidrolisis ATP. Jenis transpor ini dilakukan melawan gradien konsentrasi zat yang dibawa dan disebut transpor aktif.
Symport, antiport dan uniport
Transpor zat melalui membran juga berbeda dalam arah pergerakannya dan jumlah zat yang dibawa oleh pembawa ini:
1) Uniport - pengangkutan satu zat dalam satu arah tergantung pada gradien
2) Symport - pengangkutan dua zat dalam satu arah melalui satu pembawa.
3) Antiport - pergerakan dua zat dalam arah yang berbeda melalui satu pembawa.
Uniport mengimplementasikan, misalnya, saluran natrium yang bergantung pada tegangan melalui mana ion natrium bergerak ke dalam sel selama pembangkitan potensial aksi.
Gejala dilakukan oleh transporter glukosa yang terletak di sisi luar (menghadap ke lumen usus) sel epitel usus. Protein ini secara bersamaan menangkap molekul glukosa dan ion natrium dan, mengubah konformasi, mentransfer kedua zat ke dalam sel. Dalam hal ini, energi gradien elektrokimia digunakan, yang, pada gilirannya, dibuat karena hidrolisis ATP dengan natrium-kalium ATP-ase.
Antiport dilakukan, misalnya, oleh natrium-kalium ATPase (atau ATPase yang bergantung pada natrium). Ini mentransfer ion kalium ke dalam sel. dan dari sel - ion natrium.
Kerja natrium-kalium ATPase sebagai contoh antiport dan transpor aktif
Awalnya, pembawa ini menempelkan tiga ion Na + ke sisi dalam membran. Ion-ion ini mengubah konformasi pusat aktif ATPase. Setelah aktivasi tersebut, ATPase mampu menghidrolisis satu molekul ATP, dan ion fosfat difiksasi pada permukaan pembawa dari sisi dalam membran.
Energi yang dilepaskan digunakan untuk mengubah konformasi ATPase, setelah itu tiga ion Na + dan satu ion (fosfat) muncul di sisi luar membran. Di sini, ion Na + dipisahkan dan digantikan oleh dua ion K +. Kemudian konformasi pembawa berubah menjadi yang asli, dan ion K + muncul di sisi dalam membran. Di sini ion K + dipisahkan, dan pembawa kembali siap untuk bekerja.
Secara lebih ringkas, aksi ATPase dapat digambarkan sebagai berikut:
1) Ia "mengambil" tiga ion Na + dari dalam sel, kemudian memecah molekul ATP dan menempelkan fosfat ke dirinya sendiri
2) "Mengeluarkan" ion Na + dan menambahkan dua ion K + dari lingkungan luar.
3) Melepaskan fosfat, melemparkan dua ion K + ke dalam sel
Akibatnya, konsentrasi tinggi ion Na + dibuat di lingkungan ekstraseluler, dan konsentrasi tinggi K + dibuat di dalam sel. Kerja Na +, K + - ATPase tidak hanya menciptakan perbedaan konsentrasi, tetapi juga perbedaan muatan (bekerja seperti pompa elektrogenik). Muatan positif dibuat di bagian luar membran, dan muatan negatif di bagian dalam.
6. Struktur dan fungsi saluran ion.
Model membran tereksitasi mengasumsikan transpor diatur ion kalium dan natrium melintasi membran. Namun, transisi langsung ion melalui lapisan ganda lipid sangat sulit; oleh karena itu, kerapatan fluks ion akan sangat rendah jika ion melewati langsung fase lipid membran. Hal ini dan sejumlah pertimbangan lainnya memberikan alasan untuk percaya bahwa membran harus mengandung beberapa struktur khusus - ion penghantar.
Struktur seperti itu telah ditemukan dan diberi nama saluran ion. Saluran tersebut diisolasi dari berbagai objek: membran plasma sel, membran postsinaptik sel otot, dan objek lainnya. Saluran ion antibiotik juga dikenal.
Sifat dasar saluran ion:
1) selektivitas;
2) independensi karya saluran individu;
3) sifat konduktivitas yang diskrit;
4) ketergantungan parameter saluran pada potensial membran.
Mari kita pertimbangkan mereka secara berurutan.
1. Selektivitas adalah kemampuan saluran ion untuk secara selektif mentransmisikan ion dari satu jenis apa pun.
Bahkan dalam percobaan pertama pada akson cumi-cumi, ditemukan bahwa ion natrium dan kalium memiliki efek yang berbeda pada potensial membran. Ion kalium mengubah potensial istirahat, dan ion natrium mengubah potensial aksi.
Pengukuran telah menunjukkan bahwa saluran ion benar-benar selektif terhadap kation (saluran selektif kation) atau anion (saluran selektif anion). Pada saat yang sama, berbagai kation dari berbagai unsur kimia, tetapi konduktivitas membran untuk ion minor, dan karenanya arus yang melaluinya, akan jauh lebih rendah, misalnya, untuk saluran natrium, arus kalium yang melaluinya akan menjadi 20 kali lebih sedikit. Kemampuan saluran ion untuk mentransmisikan ion yang berbeda disebut selektivitas relatif dan dicirikan oleh rangkaian selektivitas - rasio konduktivitas saluran untuk ion berbeda yang diambil pada konsentrasi yang sama.
2. Independensi karya saluran individu. Aliran arus melalui saluran ion tunggal tidak tergantung pada apakah arus mengalir melalui saluran lain. Misalnya, saluran kalium dapat dihidupkan atau dimatikan, tetapi arus yang melalui saluran natrium tidak berubah. Pengaruh saluran satu sama lain terjadi secara tidak langsung: perubahan permeabilitas saluran apa pun (misalnya, natrium) mengubah potensial membran, dan itu sudah mempengaruhi konduktivitas saluran ion lainnya.
3. Karakter diskrit konduktivitas saluran ion. Saluran ionik adalah kompleks subunit protein yang menembus membran. Di tengahnya ada tabung tempat ion dapat lewat.
Jumlah saluran ion per 1 m permukaan membran ditentukan menggunakan penghambat saluran natrium berlabel radioaktif, tetrodotoxin. Diketahui bahwa satu molekul TTX hanya mengikat satu saluran. Kemudian pengukuran radioaktivitas sampel dengan luas yang diketahui memungkinkan untuk menunjukkan bahwa ada sekitar 500 saluran natrium pada 1 m akson cumi-cumi. Ini pertama kali ditemukan pada tahun 1962 dalam studi konduktivitas membran lipid bilayer (BLM) ketika jumlah mikro zat tertentu yang menginduksi eksitasi ditambahkan ke larutan yang mencuci membran. Tegangan konstan diterapkan ke BLM dan arus dicatat. Rekaman arus dalam waktu berbentuk lompatan antara dua keadaan konduksi.
Hasil percobaan yang dilakukan pada berbagai saluran ion menunjukkan bahwa konduktivitas saluran ion bersifat diskrit dan dapat dalam dua keadaan: terbuka atau tertutup. Lonjakan arus disebabkan oleh pembukaan 2 atau 3 saluran secara bersamaan. Transisi antara keadaan saluran ion terjadi pada waktu yang acak dan mematuhi hukum statistik. Tidak dapat dikatakan bahwa saluran ion ini akan terbuka tepat pada saat ini. Seseorang hanya dapat membuat pernyataan tentang kemungkinan pembukaan saluran dalam interval waktu tertentu.
Saluran ionik menggambarkan masa hidup karakteristik keadaan terbuka dan tertutup.
4. Ketergantungan parameter saluran pada potensial membran. Saluran ion serat saraf sensitif terhadap potensial membran, misalnya saluran natrium dan kalium akson cumi-cumi. Ini dimanifestasikan dalam kenyataan bahwa setelah timbulnya depolarisasi membran, arus yang sesuai mulai berubah dengan satu atau lain kinetika. Dalam bahasa "saluran ion", proses ini terjadi sebagai berikut. Saluran selektif ion memiliki apa yang disebut
"Sensor" adalah elemen tertentu dari desainnya yang peka terhadap aksi medan listrik (lihat gambar). Ketika potensial membran berubah, besarnya gaya yang bekerja padanya berubah, akibatnya, bagian dari saluran ion ini bergerak dan mengubah kemungkinan membuka atau menutup "gerbang" - semacam peredam yang bertindak sesuai dengan "semua atau tidak ada" hukum.
Struktur saluran ion
Saluran selektif ion terdiri dari bagian berikut dari bagian protein yang direndam dalam bilayer yang memiliki struktur subunit; filter selektif yang dibentuk oleh atom oksigen bermuatan negatif, yang ditempatkan secara kaku pada jarak tertentu satu sama lain dan memungkinkan ion dengan diameter tertentu saja untuk melewatinya; bagian gerbang.
"Gerbang" saluran ion dikendalikan oleh potensial membran dan dapat tertutup (garis putus-putus) atau terbuka (garis padat). Posisi normal gerbang saluran natrium tertutup. Di bawah pengaruh medan listrik, kemungkinan keadaan terbuka meningkat, gerbang terbuka dan aliran ion terhidrasi dapat melewati filter selektif.
Jika ion "cocok" dengan diameter, maka ia melepaskan cangkang hidrasi dan tergelincir ke sisi lain dari saluran ion. Jika diameter ion terlalu besar, seperti tetraetilamonium, ion tersebut tidak dapat melewati filter dan tidak dapat melewati membran. Sebaliknya, jika ion terlalu kecil, maka ia mengalami kesulitan dalam filter selektif, kali ini terkait dengan kesulitan melepaskan cangkang hidrasinya. Untuk ion yang "cocok", air yang dibuang diganti dengan ikatan dengan atom oksigen yang terletak di filter, untuk ion yang "tidak cocok", korespondensi steriknya lebih buruk. Oleh karena itu, lebih sulit baginya untuk melewati filter dan konduktivitas saluran lebih rendah baginya.
Pemblokir saluran ion tidak dapat melewatinya, terjebak dalam filter, atau, jika ini adalah molekul besar seperti TTX, mereka secara sterik sesuai dengan setiap pintu masuk ke saluran. Karena penghambat membawa muatan positif, bagian bermuatannya ditarik ke dalam saluran ke filter selektif sebagai kation biasa, dan makromolekul menyumbatnya.
Dengan demikian, perubahan sifat listrik biomembran yang dapat dieksitasi dilakukan menggunakan saluran ion. Ini adalah makromolekul protein yang menembus lapisan ganda lipid, yang bisa dalam beberapa keadaan terpisah. Sifat saluran selektif untuk ion kalium, natrium, dan kalsium dapat bergantung secara berbeda pada potensial membran, yang menentukan dinamika potensial aksi dalam membran, serta perbedaan potensial tersebut dalam membran sel yang berbeda.
Kesimpulan
Setiap molekul dapat melewati lapisan ganda lipid, tetapi laju difusi pasif zat, mis. Transisi suatu zat dari daerah dengan konsentrasi yang lebih tinggi ke daerah dengan konsentrasi yang lebih rendah bisa sangat berbeda. Untuk beberapa molekul, ini membutuhkan waktu yang lama sehingga kita dapat membicarakan impermeabilitas praktisnya terhadap lapisan ganda lipid dari membran. Laju difusi zat melalui membran terutama bergantung pada ukuran molekul dan kelarutan relatifnya dalam lemak.
Molekul non-polar kecil seperti O2, steroid, hormon tiroid, dan asam lemak melewati paling mudah dengan difusi sederhana melalui membran lipid. Molekul polar kecil yang tidak bermuatan - CO2, NH3, H2O, etanol, urea - juga berdifusi dengan kecepatan yang cukup tinggi. Difusi gliserol jauh lebih lambat, dan glukosa praktis tidak dapat melewati membran sendiri. Untuk semua molekul bermuatan, berapa pun ukurannya, membran lipid bersifat impermeabel.
Pengangkutan molekul-molekul tersebut dimungkinkan karena adanya dalam membran baik protein yang membentuk saluran (pori-pori) di lapisan lipid yang diisi dengan air, di mana zat dengan ukuran tertentu dapat melewati difusi sederhana, atau protein pembawa spesifik yang berinteraksi secara selektif. dengan ligan tertentu, memfasilitasi transfer mereka melalui membran (difusi difasilitasi).
Selain transpor pasif zat, ada protein dalam sel yang secara aktif memompa zat tertentu yang dilarutkan dalam air melawan gradiennya, mis. dari konsentrasi yang lebih rendah ke yang lebih besar. Proses ini, yang disebut transpor aktif, selalu dilakukan dengan bantuan protein pembawa dan terjadi dengan pengeluaran energi.
Bagian luar saluran relatif dapat diakses untuk studi; studi bagian dalam menghadirkan kesulitan yang signifikan. P. G. Kostyuk mengembangkan metode dialisis intraseluler, yang memungkinkan seseorang untuk mempelajari fungsi struktur input dan output saluran ion tanpa menggunakan mikroelektroda. Ternyata bagian saluran ion yang membuka ke ruang ekstraseluler berbeda sifat fungsionalnya dengan bagian saluran yang menghadap ke lingkungan intraseluler.
Ini adalah saluran ion yang menyediakan dua sifat penting dari membran: selektivitas dan konduktivitas.
Selektivitas, atau selektivitas, saluran disediakan oleh struktur protein khusus. Sebagian besar saluran dikontrol secara elektrik, yaitu kemampuannya untuk menghantarkan ion tergantung pada nilai potensial membran. Saluran bersifat heterogen dalam karakteristik fungsionalnya, terutama untuk struktur protein yang terletak di pintu masuk saluran dan di pintu keluarnya (yang disebut mekanisme gerbang).
persamaan Fick
Tanda “-” menunjukkan bahwa kerapatan total fluks zat selama difusi searah dengan penurunan kerapatan, D adalah koefisien difusi. Rumus tersebut menunjukkan bahwa kerapatan fluks zat J sebanding dengan koefisien difusi D dan gradien konsentrasi. Persamaan ini mengungkapkan hukum pertama Fick (Adolf Fick adalah seorang ahli fisiologi Jerman yang menetapkan hukum difusi pada tahun 1855).
Saluran selektif ion terdiri dari bagian berikut dari bagian protein yang direndam dalam bilayer yang memiliki struktur subunit; filter selektif yang dibentuk oleh atom oksigen bermuatan negatif, yang ditempatkan secara kaku pada jarak tertentu satu sama lain dan memungkinkan ion dengan diameter tertentu saja untuk melewatinya; bagian gerbang. Ini adalah saluran ion yang menyediakan dua sifat penting dari membran: selektivitas dan konduktivitas. Saluran kalsium memainkan peran penting dalam sel-sel jantung.
Bibliografi
2. Yu.I. Afanasyev, NA Yurina, EF Kotovsky dan lainnya.Histologi. M.
4. Fillippovich Yu.B. Dasar-dasar Biokimia. M., SMA, 1985 Difusi
5. Basniev KS, Kochina NI, hidromekanik Bawah Tanah Maksimov MV. // L.: Nedra, 1993, hal. 41-43
6. Gennis R. Biomembran. Struktur dan fungsi molekul. M., Mir, 1997
Tujuan pekerjaan: menunjukkan bahwa membran sel memiliki permeabilitas selektif. Mendemonstrasikan peran membran dalam proses fagositosis dan pinositosis.
Peralatan: mikroskop, kaca penutup dan slide, pisau bedah, jarum bedah, gelas untuk air dan larutan, kertas saring, pipet, tinta. Budaya ciliates, amuba, daun elodea. Larutan NaCl atau KCl, larutan CaCl atau MgCl, larutan albumin 2%, larutan NaCl 10%, air suling.
Kemajuan:
Tempatkan ciliates dalam larutan lemah NaCl atau KCl. Siapkan slide mikroskop. Penyusutan sel dapat terlihat, menunjukkan permeabilitas dinding sel. Dalam hal ini, air dari sel dilepaskan ke lingkungan. Pindahkan sel ke setetes air suling atau tarik larutan dari bawah kaca penutup menggunakan kertas saring dan ganti dengan air suling. Amati bagaimana sel-sel membengkak karena masuknya air ke dalamnya.
Tempatkan ciliates dalam larutan CaCl atau MgCl konsentrasi rendah (sama seperti larutan sebelumnya). Ciliata terus hidup, tidak ada deformasi yang diamati. Ion Ca dan Mg menurunkan permeabilitas membran sel, berbeda dengan ion Na dan K. Tidak ada pergerakan air melalui cangkang.
Tempatkan amuba dalam setetes larutan albumin 2% (putih telur ayam). Siapkan slide mikroskop. Setelah beberapa saat, gelembung, tonjolan, tubulus mulai terbentuk di permukaan amuba. Seseorang mendapat kesan bahwa permukaan amuba "mendidih". Hal ini disertai dengan gerakan cairan yang intens pada permukaan membran. Gelembung cair dikelilingi oleh tonjolan sitoplasma. Yang kemudian tutup. Vesikel pinositik terkadang muncul tiba-tiba, yang menunjukkan penangkapan cepat tetesan cairan bersama dengan zat yang larut di dalamnya.
Tempatkan amuba dalam larutan gula. Tidak ada pinositosis. Pinositosis hanya disebabkan oleh zat yang menurunkan tegangan permukaan membran sel, misalnya asam amino, beberapa garam. Ke dalam setetes cairan yang mengandung amuba, tambahkan sedikit maskara yang ditumbuk halus. Siapkan slide mikroskop Anda. Setelah beberapa saat, amuba mulai bergerak perlahan menuju butiran bangkai, melepaskan pseudopodia. Butir-butir bangkai menempel pada permukaan pseudopodia, kemudian perlahan-lahan mengelilinginya dan setelah beberapa saat terbenam di dalam sitoplasma. Amati fenomena fagositosis pada amuba di bawah mikroskop.
Dalam sitoplasma sel elodea, banyak benda hijau bulat-oval terlihat - ini adalah kloroplas. Periksa sel-sel di dekat urat daun. Mereka dapat mendeteksi pergerakan sitoplasma dan plastida di sepanjang dinding. Jika gerakan tidak terlihat, hangatkan obat di bawah lampu listrik.
Buat sketsa semua yang Anda lihat di slide mikro. Diskusikan proses yang Anda lihat dalam kelompok, coba jelaskan.
Identifikasi kerja laboratorium aromorfosis dan adaptasi idioadaptasi pada tumbuhan dan hewan
Tujuan pekerjaan: tunjukkan dengan contoh spesifik asal usul kelompok sistematis besar dengan aromorfosis, kenali contoh kemungkinan adaptasi idio-organisme (degenerasi), ungkap pengaruh aktivitas manusia pada arah utama evolusi organik
Peralatan: herbarium tanaman (lumut, pisang raja, tumbuhan runjung, angiospermae), tanaman berduri, tumpukan (duri unta, pinggul mawar), gambar paruh dan kaki burung, hewan dengan pewarnaan pelindung (penutup), ikan pari.
Kemajuan:
Dengan menganalisis fitur utama spora, gymnospermae dan angiospermae, untuk memahami aromorfosis tanaman
Tentukan adaptasi idioadaptasi oleh duri tanaman dan serabut kelenjar
Tangani contoh adaptasi idioadaptasi: struktur paruh dan kaki burung yang hidup di berbagai kondisi lingkungan
Mengidentifikasi penyebab idioadaptasi pada struktur ikan pari
SEKSI 2
LATIHAN LABORATORIUM
Pekerjaan laboratorium No. 1
Perbandingan permeabilitas membran sel hidup dan sel mati
Latihan: mengidentifikasi perbedaan permeabilitas membran sel hidup dan sel mati dan menarik kesimpulan tentang alasan perbedaan ini.
Bahan dan peralatan: tabung reaksi, rak tabung reaksi, pisau bedah, lampu spiritus atau kompor gas, larutan asam asetat 30%, sayuran akar bit.
Prosedur pelaksanaan
1. Setelah menghilangkan jaringan integumen, tanaman akar bit dipotong menjadi kubus (sisi kubus 5 mm) dan dicuci bersih dengan air untuk menghilangkan pigmen yang dilepaskan dari sel yang rusak.
2. Satu buah bit dicelupkan ke dalam tiga tabung reaksi. 5 ml air dituangkan ke dalam yang pertama dan kedua, 5 ml larutan asam asetat 30% dituangkan ke dalam yang ketiga. Tabung pertama dipertahankan untuk kontrol. Isi yang kedua direbus selama 2-3 menit.
3. Vakuola sel tanaman akar bit mengandung betacyanin, pigmen yang memberi warna pada jaringan sayuran akar. Tonoplas sel hidup tidak dapat ditembus oleh molekul pigmen ini. Setelah kematian sel, tonoplast kehilangan sifat semipermeabilitasnya, menjadi permeabel, molekul pigmen meninggalkan sel dan mewarnai air.
Dalam tabung kedua dan ketiga, di mana sel-sel dibunuh dengan cara direbus atau asam, airnya diwarnai, tetapi di tabung pertama tetap tidak ternoda.
4. Catat hasil observasi.
Pekerjaan laboratorium No. 2
Turgor, plasmolisis dan deplasmolisis
Latihan: mempelajari di bawah mikroskop fenomena turgor, plasmolisis dan deplasmolisis dalam sel-sel epidermis bawang biru.
Bahan dan peralatan: mikroskop, aksesoris bedah, lampu spiritus, bawang biru, akar bit, larutan gula 30%, larutan kalium nitrat 5-8%.
Prosedur pelaksanaan
1. Buat potongan datar dari kulit ari bawang bombay, taruh di atas kaca objek dengan setetes air.
2. Tutup tetesan dengan kaca penutup dan amati sel dalam keadaan turgor di bawah mikroskop.
3. Ambil setetes larutan gula 30% dan letakkan di samping kaca penutup.
4. Menyentuh ujung kaca penutup yang berlawanan dengan kertas saring, ganti air dalam sediaan dengan larutan gula.
5. Amati kembali di bawah mikroskop. Jika plasmolisis belum terlihat, ulangi penggantian air dengan larutan gula.
Plasmolisis pada sel hidup epidermis akan terlihat jelas di bawah mikroskop.
6. Lakukan percobaan dengan urutan terbalik, yaitu mengembalikan air lagi dan mengamati fenomena deplasmolisis.
7. Sketsa sel dalam keadaan turgor, plasmolisis dan deplasmolisis.
8. Untuk membuktikan bahwa plasmolisis dan deplasmolisis hanya terjadi pada sel hidup, lakukan eksperimen semacam itu secara paralel. Salah satu irisan kulit ari bawang bombay, ditempatkan dalam setetes air, tahan di atas nyala lampu alkohol untuk membunuh sel-selnya. Kemudian oleskan larutan gula dan lihat apakah terjadi plasmolisis.
Pengalaman yang dijelaskan memungkinkan seseorang untuk berkenalan tidak hanya dengan proses turgor, plasmolisis dan deplasmolisis, tetapi juga dengan proses masuknya zat ke dalam sel (dalam hal ini, molekul gula dari larutan).
Saat mempelajari fenomena plasmolisis dan deplasmolisis dalam sel akar bit meja, prosedurnya sama, tetapi alih-alih larutan gula, lebih baik menggunakan larutan kalium nitrat 5%.
Pekerjaan laboratorium No.3
Penentuan transpirasi dengan metode gravimetri
Latihan: menentukan jumlah air yang diuapkan oleh tanaman selama periode waktu tertentu, dengan metode gravimetri.
Bahan dan peralatan: timbangan, timbangan, gunting, piring, dudukan, tanaman hidup.
Prosedur pelaksanaan
1. Letakkan tabung-U pada dudukan dan tuangkan air ke dalamnya. Potong satu daun dari tanaman (atau cabang kecil dengan dua daun) dan gunakan sumbat kapas untuk memperkuatnya di satu lutut (sumbat kapas tidak boleh menyentuh air, jika tidak air akan menguap melaluinya). Tutup lutut lainnya dengan sumbat karet atau plastik (jika tidak ada tabung seperti itu, Anda dapat mengambil tabung reaksi sederhana dan mengisi permukaan air dengan minyak sayur sehingga tidak ada penguapan).
2. Timbang instrumen dan pada saat yang sama crystallizer kecil diisi dengan air. Tempatkan perangkat dan crystallizer di jendela.
3. Timbang kembali dalam 1-2 jam. Massa berkurang dalam kedua kasus, karena air menguap.
Pekerjaan laboratorium No. 4
Mengamati pergerakan stomata
Latihan: mengamati pergerakan stomata, menjelaskan alasan pergerakan stomata, membuat sketsa stomata dalam air dan larutan 5 dan
20%-
gliserin.
Tujuan pekerjaan: mengamati pergerakan stomata dalam air dan larutan gliserin.
Bahan dan peralatan: larutan gliserol (5 dan 20%), larutan sukrosa 1M, mikroskop, slide dan kaca penutup, jarum bedah, kertas saring, cangkir, daun tanaman apa saja.
Prosedur pelaksanaan
1. Siapkan beberapa iris epidermis bawah daun dan tempatkan selama 2 jam dalam larutan gliserin 5%. Gliserin menembus vakuola sel penjaga, menurunkan potensi airnya dan, oleh karena itu, meningkatkan kemampuannya untuk menyedot air. Bagian ditempatkan pada slide kaca dalam larutan yang sama, keadaan sel dicatat dan dibuat sketsa.
2. Ganti gliserin dengan air, tarik keluar dari bawah kaca dengan kertas saring. Dalam hal ini, pembukaan celah stomata diamati. Sketsa persiapannya.
3. Ganti air dengan osmotik kuat - larutan gliserin 20% atau larutan sukrosa 1M. Penutupan stomata diamati.
4. Menarik kesimpulan.
Pekerjaan laboratorium No. 5
Produk fotosintesis
Latihan: mempelajari proses pembentukan pati primer pada daun.
Bahan dan peralatan: lampu spiritus, penangas air, gunting, kompor listrik, lampu pijar 200-300 W, piring, tanaman hidup (labu, buncis, pelargonium, primrose, dll.), etil alkohol, larutan yodium dalam kalium iodida.
Prosedur pelaksanaan
1. Dengan menggunakan uji pati, buktikan bahwa pati terbentuk dalam proses fotosintesis.
Tanaman yang disiram dengan baik harus ditempatkan di tempat gelap selama 2-3 hari. Selama waktu ini, akan ada aliran keluar asimilat dari daun. Pati baru tidak dapat terbentuk dalam gelap.
Untuk mendapatkan kontras dari proses fotosintesis, bagian daun harus digelapkan. Untuk melakukan ini, Anda dapat menggunakan foto-negatif atau dua layar buram yang identik, menempelkannya di bagian atas dan bawah. Pola pada layar (kliping) bisa sangat berbeda.
Sebuah lampu pijar 200-300 W diletakkan pada jarak 0,5 m dari lembaran. Setelah satu atau dua jam, lembaran harus diproses seperti yang ditunjukkan di atas. Lebih mudah melakukan ini di piring datar. Pada saat yang sama, selembar diproses, yang tetap gelap sepanjang waktu.
Bagian yang terkena cahaya berubah menjadi biru, sedangkan sisanya berwarna kuning.
Di musim panas, Anda dapat mengubah pengalaman - tutup beberapa daun di pabrik, letakkan kantong kertas buram hitam dengan potongan yang sesuai; setelah dua - tiga hari, di penghujung hari yang cerah, potong daunnya, rebus terlebih dahulu dalam air, lalu ubah warnanya dengan alkohol dan obati dengan larutan yodium dalam kalium iodida. Area daun yang diarsir akan menjadi terang, dan area yang diterangi akan menjadi hitam.
Pada beberapa tanaman (misalnya, pada bawang merah), produk utama fotosintesis bukanlah pati, tetapi gula, sehingga uji pati tidak berlaku untuk mereka.
2. Catat hasil pengamatan.
Pekerjaan laboratorium No. 6
Memperoleh ekstrak alkohol pigmen dari daun
dan perpisahan mereka
Latihan: dapatkan ekstrak alkohol pigmen, pisahkan dan kenali sifat dasar pigmen.
Bahan dan peralatan: gunting, lesung dengan alu, rak dengan tabung reaksi, piring, lampu spiritus, penangas air, daun segar atau kering (jelatang, aspidistra, ivy atau tanaman lainnya), etil alkohol, bensin, larutan NaOH (atau KOH) 20%, kapur kering , pasir.
Prosedur pelaksanaan
1. Tempatkan daun kering yang dihaluskan dengan gunting dalam cobek bersih, tambahkan sedikit kapur untuk menetralkan asam dalam sel nira. Giling massa secara menyeluruh dengan alu, tambahkan etil alkohol (100 cm 3), lalu saring larutan.
Ekstrak klorofil yang dihasilkan memiliki fluoresensi: berwarna hijau dalam cahaya yang ditransmisikan, dan merah ceri dalam cahaya yang dipantulkan.
2. Pisahkan pigmen menggunakan metode Kraus.
Untuk melakukan ini, tuangkan 2-3 cm 3 ekstrak ke dalam tabung reaksi dan tambahkan satu setengah volume bensin dan 2-3 tetes air; maka Anda perlu mengocok tabung reaksi dan menunggu sampai dua lapisan terlihat jelas - bensin di bagian atas, alkohol di bagian bawah. Jika pemisahan tidak terjadi, tambahkan lebih banyak bensin dan kocok tabung lagi.
Jika kekeruhan muncul, tambahkan sedikit alkohol.
Karena bensin tidak larut dalam alkohol, itu berakhir di atas. Warna hijau pada lapisan atas menunjukkan bahwa klorofil telah masuk ke dalam bensin. Selain itu, karoten juga larut dalam bensin. Di bawah, dalam alkohol, xantofil tetap. Lapisan bawah berwarna kuning.
Setelah menyelesaikan solusi, dua lapisan terbentuk. Sebagai hasil dari saponifikasi klorofil, alkohol terpecah dan garam natrium klorofilin terbentuk, yang, tidak seperti klorofil, tidak larut dalam bensin.
Untuk saponifikasi yang lebih baik, tabung reaksi dengan penambahan NaOH dapat ditempatkan dalam penangas air mendidih dan dikeluarkan segera setelah larutan mendidih. Setelah itu, bensin dituangkan. Karoten dan xantofil (warnanya akan kuning) akan masuk ke lapisan bensin (atas), dan garam natrium asam klorofil akan masuk ke lapisan alkohol.
Pekerjaan laboratorium No. 7
Deteksi respirasi tanaman
Latihan: untuk membuktikan bahwa CO 2 dilepaskan selama respirasi tanaman, untuk membuat sketsa perangkat yang membantu mendeteksi respirasi dengan pelepasan CO 2, untuk membuat keterangan pada gambar.
Bahan dan peralatan: 2 toples kaca dengan kapasitas 300-400 ml, 2 tabung karet dengan lubang untuk corong dan tabung, 2 corong, 2 tabung kaca melengkung berbentuk huruf "U" panjang 18-20 cm dan diameter 4-5 mm , 2 tabung reaksi, gelas kimia, larutan Ba (OH) 2, biji gandum, bunga matahari, jagung, kacang polong, dll yang berkecambah.
Prosedur pelaksanaan
1. Tuang 50-60 g biji yang berkecambah ke dalam stoples kaca, tutup rapat dengan gabus, di mana corong dan tabung kaca melengkung dimasukkan, dan biarkan selama 1-1,5 jam. respirasi benih, karbon dioksida akan menumpuk di toples. Ini lebih berat daripada udara, oleh karena itu terkonsentrasi di bagian bawah kaleng dan tidak memasuki atmosfer melalui corong atau tabung.
2. Secara bersamaan ambil toples kontrol tanpa biji, tutup juga dengan sumbat karet dengan corong dan tabung gelas dan letakkan di sebelah toples pertama.
3. Ujung tabung gelas yang bebas dicelupkan ke dalam dua tabung reaksi dengan air barit. Air secara bertahap dituangkan ke dalam kedua stoples melalui corong. Air menggantikan udara yang diperkaya dengan CO2 dari kaleng, yang masuk ke tabung reaksi dengan larutan Ba(OH)2. Akibatnya, air barit menjadi keruh.
4. Bandingkan derajat kekeruhan Ba(OH)2 pada kedua tabung.
Pekerjaan laboratorium No. 8
Penentuan intensitas pernapasan dalam cangkir Conway
Latihan: untuk melakukan percobaan dan menghitung laju respirasi objek yang diteliti, tergantung pada varian percobaan.
Bahan dan peralatan: Cangkir Conway, petroleum jelly, buret, dudukan, kertas saring, gunting, timbangan, timbangan, reagen: 0,1 n Ba (OH) 2; 0.1N HCl, phenolphthalein, setiap bibit dan tanaman dewasa atau organnya.
Prosedur pelaksanaan
1. Piring Conway dikalibrasi sebelum eksperimen; mereka harus memiliki volume yang sama untuk varian kontrol dan eksperimen. Setiap varian percobaan dilakukan dalam tiga kali pengulangan.
2. Sebuah sampel bahan tanaman seberat 0,5-1,0 g ditempatkan di lingkaran luar cangkir Conway. 1 atau 2 ml 0,1 n Ba (OH) 2 dituangkan ke dalam silinder bagian dalam. Cawan ditutup dengan ground-in tutupnya (sehingga kontur transparan dari bagian tipis cangkir muncul) dan letakkan di tempat gelap selama 20 - 40 menit (untuk mengecualikan fotosintesis dalam jaringan tanaman hijau). Selama pemaparan, karbon dioksida yang terakumulasi dalam volume cangkir Conway bereaksi dengan barium hidroksida:
CO2 + Ba(OH)2 = BaCO3 + H2O.
Kelebihan Ba(OH)2 dititrasi dengan HCl 0,1N untuk fenolftalein sampai warna merah muda hilang.
3. Bersamaan dengan percobaan, masukkan cawan kontrol Conway (tanpa bagian yang ditimbang). Volume yang sama dari larutan 0,1 N Ba (OH) 2 dituangkan ke dalamnya, ditutup dengan penutup tanah dan dibiarkan di sebelah cangkir uji. Barium hidroksida dalam cangkir ini bereaksi dengan karbon dioksida, yang awalnya volumenya sebagai bagian dari udara. Kelebihan barit dititrasi.
4. Berdasarkan perbedaan volume larutan asam klorida yang digunakan untuk mentitrasi kelebihan Ba(OH)2 dalam gelas kontrol dan percobaan, laju respirasi dihitung (I. d.):
Mg 2 / (g jam),
di mana V HC1k - volume 0,1 n HC1, yang digunakan untuk mentitrasi kelebihan Ba (OH) 2 dalam cawan kontrol; V HC1on - volume 0,1 N HC1, yang digunakan untuk mentitrasi kelebihan Ba (OH) 2 dalam cawan uji; R- berat sampel, g;
t adalah waktu, h; 2.2 adalah faktor konversi HC1 menjadi CO 2 (1 ml 0,1 n HC1 atau Ba (OH) 2 setara dengan 2,2 mg CO 2).
Pekerjaan laboratorium No. 9
Nilai berbagai elemen untuk tanaman
Latihan: mempelajari pentingnya berbagai unsur mineral untuk pertumbuhan jamur aspergillus.
Bahan dan peralatan: timbangan, termostat, sumbat kapas, filter, lima labu 100 cm 3, tabung reaksi, pipet, dua gelas, corong, garam mineral, sukrosa, asam organik (sitrat), kultur jamur Aspergillus yang ditanam pada potongan kentang atau roti selama 3 4 hari.
Prosedur pelaksanaan
1. Tumbuhkan jamur pada campuran nutrisi.
Ditemukan bahwa aspergillus membuat persyaratan yang sama untuk kondisi nutrisi mineral seperti tanaman tingkat tinggi. Dari unsur mineral, jamur tidak hanya membutuhkan kalsium. Campuran nutrisi disiapkan dalam labu 100 cm 3 dan dibuat sesuai dengan skema tertentu (Tabel 1).
Penomoran labu sesuai dengan penomoran varian percobaan. Hasil percobaan dicatat di bawah ini.
Tabel 1
Formula nutrisi
Zat | Konsentrasi | Jumlah zat (ml) dalam labu |
||||
#1 - Campuran Lengkap | No. 2 - tanpa N | No. 3 - tanpa P | No. 4 - tanpa K | No. 5 - tanpa mineral |
||
Sukrosa asam lemon | ||||||
hasil Massa miselium, g | ||||||
Asam sitrat ditambahkan untuk menciptakan lingkungan asam yang menguntungkan bagi Aspergillus, tetapi menghambat perkembangan mikroorganisme lainnya.
2. Tuang air steril ke dalam tabung reaksi atau labu dan tempatkan miselium jamur yang diambil dengan loop steril ke dalamnya, aduk isinya dengan memutar di antara jari atau telapak tangan.
Tambahkan suspensi yang dihasilkan dengan pipet steril ke dalam semua labu.
Tutup termos dengan sumbat kapas dan masukkan ke dalam termostat pada suhu 30-35 ° . Pengamatan harus dilakukan dalam seminggu.
Inti dari percobaan ini terletak pada kenyataan bahwa dengan menentukan massa miselium jamur yang ditanam pada berbagai campuran nutrisi, seseorang dapat mengetahui kebutuhannya akan elemen individu.
3. Lakukan penimbangan, untuk itu ambil dua gelas bersih, satu corong, dan beberapa filter kertas yang identik. Timbang satu gelas kimia (no. 1) dengan corong dan saring dan catat beratnya. Kemudian masukkan corong ke dalam gelas lain (No. 2), pindahkan miselium jamur dari labu pertama ke saringan, bilas dengan air dan, setelah air merintih, pindahkan corong kembali ke gelas No. 1. Timbang lagi. Jelas hasilnya akan lebih besar, karena miselium jamur telah ditambahkan.
Panduan belajar... - balashov: Nikolaev, 2007 .-- 48 hal. ISBN 978-5-94035-300-3 B pendidikan-metodismanual cara dijelaskan... fisiologitanaman: buku teks. uang saku/ ed. V.B.Ivanova. - Akademi, 2001 .-- 144 hal. Zanina, M.A. Fisiologitanaman: metode belajar. uang saku ...
Kompleks pelatihan dan metodologi
... pendidikan-metodis kompleks balashov... 'merasa', fisiologi dari bahasa yunani... pelatihan subgaya dalam pendidikan sastra untuk pendidikan metodismanual... dan tanaman dan... 2005 memiliki ...
TEORI DAN PRAKTEK Pidato ILMIAH Kursus khusus untuk spesialisasi non-kemanusiaan universitas Kompleks pendidikan-metodis Balashov - 2008
Kompleks pelatihan dan metodologi... pendidikan-metodis kompleks balashov... 'merasa', fisiologi dari bahasa yunani... pelatihan subgaya dalam pendidikan sastra untuk pendidikan berbagai jenis lembaga, buku referensi, metodismanual... dan tanaman dan... 2005 G.). Kami belum pernah melakukan ini sebelumnya sehingga memiliki ...
Kompleks pendidikan-metodis (219)
Panduan belajarDana ( tanaman, koleksi... oleh merekapendidikan ... fisiologi... G.Yu. Teknologi sekolah yang menjanjikan: pendidikan-metodisuang saku/ G.Yu. Ksenzov. - M.: ... 288 S. 6. balashov, M. Game didaktik ... - No. 22. - 2005 ... Pedagogi: buku teks. uang saku/ ed. NS. ...
1. Membran sel, jenisnya. Sifat membran. Fungsi membran.
Studi morfologi dan fisiologis telah menunjukkan bahwa membran sel memainkan peran penting dalam fungsi sel.
Struktur membran: inti, kompleks Golgi, EPS, dll.
Selaput adalah struktur tipis dengan ketebalan 7 nm. Menurut komposisi kimianya, membran mengandung 25% protein, 25% fosfolipid, 13% kolesterol, 4% lipid, 3% karbohidrat.
Secara struktural dasar membran adalah lapisan ganda fosfolipid. Fitur molekul fosfolipid adalah bahwa mereka memiliki bagian hidrofilik dan hidrofobik dalam komposisinya. Bagian hidrofilik mengandung gugus polar (gugus fosfat dalam fosfolipid dan gugus hidroksida dalam kolesterol). Bagian hidrofilik diarahkan ke permukaan. A hidrofobik (ekor gemuk)) diarahkan ke pusat membran.
Molekul ini memiliki dua ekor berlemak, dan rantai hidrokarbon ini dapat berada dalam dua konfigurasi. Memanjang - konfigurasi trans(silinder 0,48 nm). Tipe kedua adalah konfigurasi gauche-trans-gauche. Dalam hal ini, dua ekor gemuk menyimpang dan luasnya meningkat menjadi 0,58 nm.
Molekul lipid dalam kondisi normal memiliki bentuk kristal cair. Dan dalam keadaan ini mereka memiliki mobilitas. Selain itu, mereka berdua bisa bergerak di dalam lapisan mereka dan berbalik. Dengan penurunan suhu, transisi dari keadaan cair membran menjadi seperti jeli terjadi, dan ini mengurangi mobilitas molekul.
Ketika molekul lipid bergerak, mikrostrip terbentuk, yang disebut raja, di mana zat dapat ditangkap. Lapisan lipid dalam membran adalah penghalang untuk zat yang larut dalam air, tetapi memungkinkan zat yang larut dalam lemak untuk melewatinya.
Selain lipid, membran juga mengandung molekul protein. Ini terutama glikoprotein.
Protein integral melewati kedua lapisan... Lainnya protein sebagian terbenam di lapisan luar atau dalam. Mereka disebut protein perifer..
Model membran ini disebut model kristal cair... Secara fungsional, molekul protein melakukan fungsi struktural, transportasi, enzimatik. Selain itu, mereka membentuk saluran ion dengan diameter 0,35 hingga 0,8 nm, di mana ion dapat lewat. Saluran memiliki spesialisasinya sendiri. Protein integral terlibat dalam transpor aktif dan difusi terfasilitasi.
Protein perifer di sisi dalam membran dicirikan oleh fungsi enzimatik. Di sisi dalam - fungsi antigenik (antibodi) dan reseptor.
rantai karbon dapat menempel pada molekul protein, dan kemudian terbentuk glikoprotein... Atau lipid, maka mereka disebut glikolipid.
Fungsi utama membran sel menjadi:
1. Fungsi penghalang
2. Perpindahan zat secara pasif dan aktif.
3. Fungsi metabolisme (karena adanya sistem enzim di dalamnya)
4. Membran terlibat dalam penciptaan potensial listrik dalam keadaan istirahat, dan ketika tereksitasi - arus aksi.
5. Fungsi reseptor.
6. Imunologis (berhubungan dengan adanya antigen dan produksi antibodi).
7. Memberikan interaksi antar sel dan penghambatan kontak.
Ketika sel-sel homogen bersentuhan, pembelahan sel terhambat. Fungsi ini hilang pada sel kanker. Selain itu, sel kanker tidak hanya bersentuhan dengan sel mereka sendiri, tetapi juga dengan sel lain, menginfeksi mereka.
Fungsi permeabilitas membran. Mengangkut.
Transportasi zat melintasi membran bisa pasif dan aktif.
Perpindahan pasif zat melalui membran melewati tanpa konsumsi energi dengan adanya gradien (perbedaan konsentrasi zat, perbedaan gradien elektrokimia, dengan adanya gradien tekanan dan gradien osmotik). Dalam hal ini, transpor pasif dilakukan dengan menggunakan:
Difusi.
Penyaringan. Ini dilakukan dengan adanya perbedaan tekanan hidrostatik.
Osmosa. Selama osmosis, pergerakan pelarut terjadi. Artinya, air dari larutan murni akan masuk ke larutan dengan konsentrasi yang lebih tinggi.
Dalam semua kasus ini tidak ada biaya energi... Zat melewati pori-pori di membran.
Ada pori-pori dengan konduktivitas lambat di membran, tetapi tidak banyak pori-pori seperti itu di membran. Sebagian besar saluran dalam membran juga memiliki mekanisme gerbang dalam strukturnya, yang menutup saluran. Saluran-saluran ini dapat dikontrol dengan dua cara: untuk menanggapi perubahan muatan (saluran yang dapat dieksitasi atau diberi tegangan). Dalam kasus lain, gerbang di kanal terbuka ketika bahan kimia (yang dapat dirangsang secara kimia atau bergantung pada ligan) dipasang.
Transfer aktif zat melintasi membran dikaitkan dengan transfer zat melawan gradien.
Untuk transpor aktif, protein integral digunakan yang memiliki fungsi enzimatik. ATP digunakan sebagai energi. Protein integral memiliki mekanisme khusus (protein) yang diaktifkan baik dengan peningkatan konsentrasi zat di luar sel, atau dengan penurunan di dalam.
Arus istirahat.
Potensi membran. Di luar, membran bermuatan positif, dan di dalam, negatif. 70-80mV.
Arus gangguan adalah perbedaan muatan antara yang tidak rusak dan yang rusak... Yang rusak bermuatan negatif, relatif utuh.
Arus metabolisme adalah perbedaan potensial karena intensitas proses metabolisme yang tidak sama.
Asal usul potensial membran dijelaskan dalam istilah: teori ion membran, yang memperhitungkan permeabilitas membran yang tidak sama untuk ion dan komposisi ion yang berbeda dalam cairan intraseluler dan interseluler. Ditemukan bahwa baik cairan intraseluler dan interseluler memiliki jumlah ion positif dan negatif yang sama, tetapi komposisinya berbeda. Cairan eksternal: Na +, Cl - Cairan internal: K +, A - (anion organik)
Saat istirahat, membran permeabel terhadap ion dengan cara yang berbeda. Kalium memiliki permeabilitas tertinggi, diikuti oleh natrium dan klorin. Membran tidak permeabel terhadap anion organik.
Karena peningkatan permeabilitas terhadap ion kalium, mereka meninggalkan sel. Akibatnya, org menumpuk di dalamnya. anion. Akibatnya, perbedaan potensial (potensial difusi kalium) dibuat, yang berlangsung selama itu bisa keluar.
Potensi kalium yang dihitung adalah -90 mV. Dan potensi praktisnya adalah -70 mV. Ini menunjukkan bahwa ada ion lain yang terlibat dalam pengembangan kapasitas.
Untuk menahan potensi dalam membran, sel harus bekerja, karena pergerakan ion kalium dari sel, dan natrium ke dalam sel, akan menyebabkan pelanggaran persamaan tanda. Membran terpolarisasi. Di luar, muatannya akan positif, dan di luarnya akan negatif.
Keadaan muatan listrik membran.
Reverse atau overshoot - ubah tanda muatan. Kembali ke muatan awal - repolarisasi.
Arus eksitasi.
Ketika iritasi bekerja pada membran, kegembiraan jangka pendek terjadi. Proses eksitasi bersifat lokal dan menyebar di sepanjang membran, dan kemudian terdepolarisasi. Saat eksitasi bergerak, bagian baru dari membran terdepolarisasi, dll. Arus aksi adalah arus dua fasa.
Di setiap fase arus aksi, respons lokal dapat dibedakan, yang digantikan oleh potensial puncak, dan potensial jejak negatif dan positif mengikuti potensi puncak. Terjadi dengan aksi iritasi. Untuk menjelaskan tindakan saat ini, diusulkan teori membran-monik(Hodge, Huxley, Katz). Mereka menunjukkan bahwa potensial aksi lebih besar dari potensial istirahat... Ketika iritan bekerja pada membran, muatan dipindahkan ke membran (depolarisasi parsial) dan ini menyebabkan saluran natrium terbuka. Natrium menembus ke dalam sel, secara bertahap mengurangi muatan pada membran, tetapi potensial aksi tidak muncul dengan aksi apa pun, tetapi hanya pada nilai kritis (berubah 20-30 mV) - depolarisasi kritis. Pada saat yang sama, hampir semua saluran natrium dibuka, dan dalam hal ini, natrium mulai meluncur ke dalam sel. Depolarisasi lengkap terjadi. Prosesnya tidak berhenti di situ, tetapi terus masuk ke sel dan mengisi daya hingga +40. Pada puncak potensial puncak, gerbang menutup h. Pada nilai potensial membran ini, gerbang kalium terbuka. Dan karena Ka + lebih besar di dalam, maka Ka + mulai meninggalkan sel, dan muatan akan mulai kembali ke nilai aslinya. Ini berjalan cepat pada awalnya dan kemudian melambat. Fenomena ini disebut potensial ekor negatif. Kemudian muatan dikembalikan ke nilai awal, dan setelah itu potensi jejak positif dicatat, yang ditandai dengan peningkatan permeabilitas terhadap kalium. Keadaan hiperpolarisasi membran (potensial jejak positif) muncul Pergerakan ion pasif. Dalam satu eksitasi, 20.000 ion natrium masuk ke dalam sel, dan 20.000 ion kalium meninggalkan sel.
Mekanisme pemompaan diperlukan untuk mengembalikan konsentrasi. 3 ion natrium positif dibawa masuk, dan 2 ion kalium keluar dengan transpor aktif.
Rangsangan membran berubah, dan karenanya potensial aksi. Selama respons lokal, terjadi peningkatan gairah secara bertahap. Selama respons puncak, gairah menghilang.
Dengan potensi jejak negatif, rangsangan akan meningkat lagi, karena membran kembali terdepolarisasi sebagian. Pada fase potensial cahaya positif, terjadi penurunan eksitabilitas. Dalam kondisi ini, rangsangan menurun.
Kecepatan proses rangsang - labilitas. Ukuran labilitas adalah jumlah eksitasi per satuan waktu... Serabut saraf bereproduksi dari 500 hingga 1000 impuls per detik. Kain yang berbeda memiliki labilitas yang berbeda.
2. Reseptor, klasifikasinya: berdasarkan lokalisasi (membran, inti), mekanisme perkembangan proses (ion- dan metabotropik), berdasarkan kecepatan penerimaan sinyal (cepat, lambat), berdasarkan jenis zat yang menerima.
Penerimaan sinyal oleh sel dari pembawa pesan primer disediakan oleh protein reseptor khusus yang pembawa pesan utamanya adalah ligan. Untuk memastikan fungsi reseptor, molekul protein harus memenuhi sejumlah persyaratan:
- memiliki selektivitas yang tinggi untuk ligan;
- kinetika pengikatan ligan harus digambarkan oleh kurva dengan saturasi yang sesuai dengan keadaan kerja penuh semua molekul reseptor, yang jumlahnya terbatas pada membran;
- reseptor harus memiliki spesifisitas jaringan, yang mencerminkan ada atau tidak adanya fungsi-fungsi ini dalam sel-sel organ target;
- pengikatan ligan dan efek selulernya (fisiologis) harus reversibel, dan parameter afinitas harus sesuai dengan konsentrasi fisiologis ligan.
Reseptor seluler diklasifikasikan ke dalam kelas berikut:
- selaput
- reseptor tirosin kinase
- Reseptor berpasangan G-protein
- saluran ion
- sitoplasma
- nuklir
Reseptor membran mengenali molekul pemberi sinyal besar (misalnya, insulin) atau hidrofilik (misalnya, adrenalin) yang tidak dapat secara mandiri memasuki sel. Molekul pensinyalan hidrofobik kecil (misalnya, triiodothyronine, hormon steroid, CO, NO) dapat berdifusi ke dalam sel. Reseptor untuk hormon tersebut biasanya adalah protein sitoplasma atau inti yang larut. Setelah ligan berikatan dengan reseptor, informasi tentang peristiwa ini ditransmisikan lebih jauh di sepanjang rantai dan mengarah pada pembentukan respons seluler primer dan sekunder.
Dua kelas utama reseptor membran adalah reseptor metabotropik dan reseptor ionotropik.
Reseptor ionotropik adalah saluran membran yang dibuka atau ditutup oleh ikatan ligan. Arus ionik yang dihasilkan menyebabkan perubahan perbedaan potensial transmembran dan, sebagai akibatnya, dalam rangsangan sel, dan juga mengubah konsentrasi ion intraseluler, yang dapat menyebabkan aktivasi sekunder sistem mediator intraseluler. Salah satu reseptor ionotropik yang paling banyak dipelajari adalah reseptor n-kolinergik.
Struktur G-protein, terdiri dari tiga jenis unit (heterotrimerik) - t / i (biru), (merah) dan (hijau)
Reseptor metabotropik berhubungan dengan sistem pembawa pesan intraseluler. Perubahan konformasi mereka saat mengikat ligan mengarah pada peluncuran kaskade reaksi biokimia, dan, pada akhirnya, perubahan keadaan fungsional sel. Jenis utama reseptor membran:
Reseptor yang terkait dengan protein G heterotrimerik (misalnya reseptor vasopresin).
Reseptor dengan aktivitas tirosin kinase intrinsik (misalnya, reseptor insulin atau reseptor faktor pertumbuhan epidermal).
Reseptor yang terkait dengan protein G adalah protein transmembran dengan 7 domain transmembran, N-terminus ekstraseluler dan C-terminus intraseluler. Situs pengikatan ligan terletak pada loop ekstraseluler, domain pengikatan protein G berada di dekat terminal-C di sitoplasma.
Aktivasi reseptor mengarah pada fakta bahwa subunit -nya berdisosiasi dari kompleks subunit dan dengan demikian diaktifkan. Setelah itu, ia mengaktifkan atau, sebaliknya, menonaktifkan enzim yang menghasilkan utusan sekunder.
Reseptor dengan aktivitas tirosin kinase memfosforilasi protein intraseluler berikutnya, sering juga protein kinase, dan dengan demikian mengirimkan sinyal ke dalam sel. Secara struktural, ini adalah protein transmembran dengan satu domain membran. Sebagai aturan, mereka adalah homodimer, subunit yang dihubungkan oleh jembatan disulfida.
3. Reseptor ionotropik, reseptor metabotropik dan varietasnya. Sistem mediator sekunder aksi reseptor metabotropik (cAMP, cGMP, inositol-3-fosfat, diasilgliserol, ion Ca ++).
Reseptor untuk neurotransmitter terletak di membran neuron atau sel target (sel otot atau kelenjar). Lokalisasi mereka bisa pada membran postsinaptik dan presinaptik. Yang disebut autoreseptor sering terletak di membran prasinaps, yang mengatur pelepasan neurotransmitter yang sama dari terminal prasinaps. Namun ada juga heteroautoreseptor yang juga mengatur pelepasan suatu mediator, tetapi pada reseptor ini pelepasan salah satu mediator diatur oleh mediator atau neuromodulator yang lain.
Kebanyakan reseptor adalah protein oligomer terikat membran yang mengikat ligan (neurotransmitter) dengan afinitas tinggi dan selektivitas tinggi. Sebagai hasil dari interaksi ini, kaskade perubahan intraseluler dipicu. Reseptor dicirikan oleh afinitas ligan, kuantitas, saturasi, dan kapasitas disosiasi kompleks reseptor-ligan. Beberapa reseptor memiliki isoform yang berbeda dalam afinitasnya terhadap ligan tertentu. Isoform ini dapat ditemukan di jaringan yang sama.
Ligan adalah zat yang secara selektif berinteraksi dengan reseptor tertentu. Jika zat farmakologis mengaktifkan reseptor ini, itu adalah agonis untuk itu, dan jika mengurangi aktivitasnya, maka itu adalah antagonis.
Pengikatan ligan ke reseptor menyebabkan perubahan konformasi reseptor, akibatnya saluran ion dibuka atau kaskade reaksi yang mengarah pada perubahan metabolisme dipicu.
Ada reseptor ionotropik dan metabotropik.
Reseptor ionotropik. Karena pembentukan potensial postsinaptik, saluran ion yang sesuai dibuka baik segera di bawah aksi mediator, atau melalui aktivasi protein-G. Dalam hal ini, reseptor itu sendiri membentuk saluran ion, atau terkait dengannya. Setelah pengikatan ligan dan aktivasi reseptor, saluran dibuka untuk ion yang sesuai. Akibatnya, potensial postsinaptik terbentuk pada membran. Reseptor ionotropik merupakan jalur transmisi sinyal yang cepat dan pembentukan PSP tanpa mengubah proses metabolisme di dalam sel.
Reseptor Metabotropik. Ini adalah jalur transmisi sinyal yang lebih kompleks. Dalam hal ini, setelah pengikatan ligan ke reseptor, kaskade fosforilasi-defosforilasi diaktifkan. Ini dilakukan baik secara langsung atau melalui mediator sekunder, misalnya, melalui tirosin kinase, atau melalui cAMP, atau cGMP, atau inositol trifosfat, atau diasilgliserol, atau dengan meningkatkan kalsium intraseluler, yang menghasilkan aktivasi protein kinase. Fosforilasi paling sering melibatkan aktivasi protein kinase yang bergantung pada cAMP atau diasilgliserol. Efek ini berkembang lebih lambat dan bertahan lebih lama.
Afinitas reseptor untuk neurotransmiter yang sesuai dapat berubah dengan cara yang sama seperti untuk hormon, misalnya, karena perubahan alosterik pada reseptor atau mekanisme lainnya. Oleh karena itu, reseptor sekarang disebut sebagai struktur yang mobile dan mudah berubah. Sebagai bagian dari membran, protein reseptor dapat berinteraksi dengan protein membran lainnya (yang disebut internalisasi reseptor). Neuromodulator, seperti neurotransmiter, dapat memengaruhi jumlah dan sensitivitas reseptor. Kehadiran jangka panjang neurotransmitter atau neuromodulator dalam jumlah besar dapat mengurangi sensitivitasnya (regulasi ke bawah), dan kekurangan ligan dapat meningkatkan sensitivitasnya (regulasi ke atas).
4. Saluran ionik, strukturnya. Klasifikasi saluran ion saluran natrium dan kalium.
Struktur dan fungsi saluran ion. Ion Na +, K +, Ca 2+, Cl - menembus ke dalam sel dan keluar melalui saluran khusus yang diisi dengan cairan. Ukuran saluran agak kecil (diameter 0,5-0,7 nm). Perhitungan menunjukkan bahwa total area saluran menempati bagian yang tidak signifikan dari permukaan membran sel.
Fungsi saluran ion dipelajari dengan berbagai cara. Yang paling umum adalah metode penjepit tegangan (gbr. 2.2). Inti dari metode ini terletak pada kenyataan bahwa dengan bantuan sistem elektronik khusus selama percobaan, potensial membran diubah dan diperbaiki pada tingkat tertentu. Dalam hal ini, nilai arus ionik yang mengalir melalui membran diukur. Jika beda potensial konstan, maka, sesuai dengan hukum Ohm, nilai arus sebanding dengan konduktivitas saluran ion. Menanggapi depolarisasi bertahap, saluran tertentu dibuka, ion yang sesuai memasuki sel sepanjang gradien elektrokimia, yaitu, arus ionik muncul, yang mendepolarisasi sel. Perubahan ini dicatat dengan menggunakan penguat kontrol dan arus listrik dilewatkan melalui membran, sama besarnya, tetapi berlawanan arah dengan arus ion membran. Dalam hal ini, beda potensial transmembran tidak berubah. Penggunaan gabungan dari metode penjepitan potensial dan penghambat saluran ion spesifik telah menyebabkan terbukanya berbagai jenis saluran ion dalam membran sel.
Saat ini, banyak jenis saluran untuk berbagai ion telah dibuat (Tabel 2.1). Beberapa di antaranya sangat spesifik, yang kedua, selain ion utama, dapat melewati ion lain.
Studi tentang fungsi masing-masing saluran dimungkinkan dengan metode "penjepit jalur" potensial lokal; Nasi. 2.3, A). Mikroelektroda kaca (mikropipet) diisi dengan garam, ditekan ke permukaan membran, dan sedikit vakum dibuat. Dalam hal ini, bagian dari membran tersedot ke dalam mikroelektroda. Jika saluran ion muncul di zona hisap, aktivitas saluran tunggal direkam. Sistem stimulasi dan registrasi aktivitas saluran sedikit berbeda dari sistem fiksasi tegangan.
Tabel 2.1. Saluran ion dan arus ion terpenting dari sel yang dapat dieksitasi
|
Jenis saluran |
Fungsi |
Pemblokir saluran |
|
|
Kalium (sendiri) |
Mengistirahatkan generasi potensial |
I K + (bocor) |
|
|
Sodium |
Generasi potensial aksi |
||
|
Kalsium |
Generasi Potensial Lambat |
D-600, verapamil |
|
|
Kalium (pembetulan tertunda) |
Memastikan repolarisasi |
I K + (penundaan) |
|
|
Kalium kalsium diaktifkan |
Batasan depolarisasi karena arus Ca 2+ |
Catatan. TEH - tetraetilamonium; TTX - tetrodotoksin.
Bagian luar saluran relatif dapat diakses untuk studi; studi bagian dalam menghadirkan kesulitan yang signifikan. P. G. Kostyuk mengembangkan metode dialisis intraseluler, yang memungkinkan untuk mempelajari fungsi struktur input dan output saluran ion tanpa menggunakan mikroelektroda. Ternyata bagian saluran ion yang membuka ke ruang ekstraseluler berbeda sifat fungsionalnya dengan bagian saluran yang menghadap ke lingkungan intraseluler.
Ini adalah saluran ion yang menyediakan dua sifat penting dari membran: selektivitas dan konduktivitas.
Selektivitas, atau selektivitas, saluran disediakan oleh struktur protein khusus. Sebagian besar saluran dikontrol secara elektrik, yaitu kemampuannya untuk menghantarkan ion tergantung pada nilai potensial membran. Saluran bersifat heterogen dalam karakteristik fungsionalnya, terutama untuk struktur protein yang terletak di pintu masuk saluran dan di pintu keluarnya (yang disebut mekanisme gerbang).
5. Konsep rangsangan. Parameter rangsangan sistem neuromuskular: ambang iritasi (rheobase), waktu yang berguna (chronaxia). Ketergantungan kekuatan iritasi pada waktu kerjanya (kurva Goorweg-Weiss). sifat tahan api.
Sifat dpt dirangsang- kemampuan sel untuk merespon rangsangan dengan pembentukan AP dan reaksi spesifik.
1) fase respons lokal - depolarisasi parsial membran (masuknya Na + ke dalam sel). Jika Anda mengoleskan iritasi kecil, maka jawabannya lebih kuat.
Depolarisasi lokal adalah fase peninggian.
2) fase refraktori absolut - sifat jaringan yang dapat dirangsang untuk tidak membentuk PD untuk stimulus apa pun dengan kekuatan apa pun
3) fase refraktori relatif.
4) fase repolarisasi lambat - iritasi - lagi-lagi respons yang kuat
5) fase hiperpolarisasi - rangsangan kurang (subnormal), stimulus harus besar.
labilitas fungsional- penilaian rangsangan jaringan melalui jumlah AP maksimum yang mungkin per unit waktu.
Hukum eksitasi:
1) hukum kekuatan - kekuatan stimulus harus ambang batas atau di atas ambang batas (nilai minimum gaya yang menyebabkan kegembiraan). Semakin kuat stimulus, semakin kuat kegembiraan - hanya untuk asosiasi jaringan (batang saraf, otot, dengan pengecualian SMC).
2) hukum waktu - stimulus kerja panjang harus cukup untuk timbulnya kegembiraan.
Hubungan antara gaya dan waktu berbanding terbalik antara waktu minimum dan gaya minimum. Gaya minimum - rheobase - adalah gaya yang menyebabkan kegembiraan dan tidak bergantung pada durasi. Waktu minimum adalah waktu yang baik. Kronaxia adalah rangsangan dari jaringan tertentu, waktu di mana gairah terjadi sama dengan dua rheobase.
Semakin besar kekuatannya, semakin besar responsnya terhadap nilai tertentu.
Faktor-faktor yang membuat MSP:
1) perbedaan konsentrasi natrium dan kalium
2) permeabilitas yang berbeda terhadap natrium dan kalium
3) kerja pompa Na-K (3 Na+ dihilangkan, 2 K+ dikembalikan).
Hubungan antara kekuatan stimulus dan durasi dampaknya, yang diperlukan untuk munculnya respons minimal dari struktur hidup, dapat ditelusuri dengan sangat baik pada apa yang disebut kurva gaya-waktu (kurva Goorweg-Weiss-Lapik) .
Dari analisis kurva dapat disimpulkan bahwa, tidak peduli seberapa besar kekuatan stimulus, jika durasi kerjanya tidak mencukupi, tidak akan ada respons (menunjuk ke kiri cabang menaik hiperbola). Fenomena serupa diamati dengan aksi stimulus subthreshold yang berkepanjangan. Arus minimum (atau tegangan) yang dapat menimbulkan eksitasi disebut Lapik rheobase (bagian dari ordinat OA). Interval waktu terkecil di mana arus yang sama kuatnya dengan rheobase berlipat ganda menyebabkan eksitasi dalam jaringan disebut chronaxy (segmen absis OF), yang merupakan indikator durasi ambang stimulasi. Kronaxia diukur dalam (seperseribu detik). Dengan besarnya chronaxia, seseorang dapat menilai tingkat permulaan eksitasi di jaringan: semakin sedikit chronaxia, semakin cepat eksitasi muncul. Kronaxia saraf manusia dan serat otot sama dengan seperseribu dan sepuluh ribu detik, dan kronaksia dari apa yang disebut jaringan lambat, misalnya, serat otot perut katak, sama dengan seperseratus detik.
Penentuan kronaxia jaringan yang dapat dirangsang telah tersebar luas tidak hanya dalam eksperimen, tetapi juga dalam fisiologi olahraga, di klinik. Secara khusus, dengan mengukur kronaksia otot, ahli saraf dapat menentukan adanya kerusakan saraf motorik. Perlu dicatat bahwa stimulus bisa cukup kuat, memiliki durasi ambang batas, tetapi tingkat peningkatan waktu yang rendah ke nilai ambang; eksitasi dalam hal ini tidak muncul. Adaptasi jaringan yang tereksitasi terhadap stimulus yang tumbuh lambat disebut akomodasi. Akomodasi disebabkan oleh fakta bahwa selama peningkatan kekuatan stimulus dalam jaringan, perubahan aktif memiliki waktu untuk berkembang, meningkatkan ambang iritasi dan mencegah perkembangan eksitasi. Dengan demikian, tingkat peningkatan stimulasi dalam waktu, atau gradien stimulasi, sangat penting untuk timbulnya gairah.
Hukum gradien iritasi. Reaksi makhluk hidup terhadap suatu rangsangan bergantung pada gradien stimulasi, yaitu pada urgensi atau kecuraman pertumbuhan stimulus dalam waktu: semakin tinggi gradien stimulasi, semakin kuat (sampai batas tertentu) responsnya. formasi yang bersemangat.
Akibatnya, hukum iritasi mencerminkan hubungan kompleks antara stimulus dan struktur yang dapat dirangsang selama interaksi mereka. Agar eksitasi terjadi, stimulus harus memiliki kekuatan ambang batas, memiliki durasi ambang batas, dan memiliki tingkat peningkatan waktu tertentu.
6. Pompa ion (ATP-ase):K+- tidak+ -putih,Ca2+ (plasmolemma dan retikulum sarkoplasma),H+- K+ -penukar.
Menurut konsep modern, membran biologis memiliki pompa ion yang beroperasi dengan mengorbankan energi bebas hidrolisis ATP - sistem khusus protein integral (mengangkut ATPase).
Saat ini, ada tiga jenis pompa ion elektrogenik yang secara aktif mentransfer ion melintasi membran (Gbr. 13).
Pemindahan ion oleh transpor ATPase terjadi karena konjugasi proses transfer dengan reaksi kimia, karena energi metabolisme sel.
Selama kerja K + -Na + -ATPase, karena energi yang dilepaskan selama hidrolisis setiap molekul ATP, dua ion kalium dipindahkan ke dalam sel, dan pada saat yang sama tiga ion natrium dipompa keluar dari sel. Dengan demikian, terjadi peningkatan konsentrasi ion kalium dalam sel dan penurunan konsentrasi natrium dalam sel dibandingkan dengan media antar sel, yang sangat penting secara fisiologis.
Tanda-tanda "pompa bio":
1. Gerakan melawan gradien potensial elektrokimia.
2. Aliran materi berhubungan dengan hidrolisis ATP (atau sumber energi lainnya).
3. asimetri kendaraan pengangkut.
4. Pompa in vitro mampu menghidrolisis ATP hanya dengan adanya ion-ion yang dibawanya secara in vivo.
5. Ketika pompa dibangun ke dalam lingkungan buatan, ia mampu mempertahankan selektivitas.
Mekanisme molekuler dari ATPase ionik tidak sepenuhnya dipahami. Namun demikian, tahapan utama dari proses enzimatik yang kompleks ini dapat dilacak. Dalam kasus K + -Na + -ATPase, ada tujuh tahap transfer ion yang terkait dengan hidrolisis ATP.
Diagram menunjukkan bahwa tahapan kunci dari enzim adalah:
1) pembentukan kompleks enzim dengan ATP pada permukaan bagian dalam membran (reaksi ini diaktifkan oleh ion magnesium);
2) mengikat oleh kompleks tiga ion natrium;
3) fosforilasi enzim dengan pembentukan adenosin difosfat;
4) flip-flop (flip-flop) enzim di dalam membran;
5) reaksi pertukaran ion natrium dengan kalium, yang terjadi pada permukaan luar membran;
6) membalik balik kompleks enzim dengan transfer ion kalium ke dalam sel;
7) kembalinya enzim ke keadaan semula dengan pelepasan ion kalium dan fosfat anorganik (P).
Jadi, selama satu siklus penuh, tiga ion natrium dilepaskan dari sel, sitoplasma diperkaya dengan dua ion kalium, dan satu molekul ATP dihidrolisis.
7. Potensial membran, besaran dan asal.
Banyak teori telah diajukan untuk menjelaskan asal usul biopotensial. Teori membran yang diajukan oleh peneliti Jerman Bernstein (1902, 1912) paling lengkap dibuktikan secara eksperimental. Pada periode modern, teori ini telah dimodifikasi dan dikembangkan secara eksperimental oleh Hodgkin, Huxley, Katz (1949-1952).
Ditemukan bahwa dasar dari fenomena bioelektrik adalah distribusi ion yang tidak merata (asimetri) dalam sitoplasma sel dan lingkungannya. Dengan demikian, protoplasma sel saraf dan otot mengandung ion kalium 30-50 kali lebih banyak, ion natrium 8-10 kali lebih sedikit, dan ion klorin 50 kali lebih sedikit daripada cairan ekstraseluler. Selain itu, komposisi sitoplasma sel termasuk anion organik (senyawa molekul besar yang membawa muatan negatif), yang tidak ada di lingkungan ekstraseluler.
Pendukung teori membran percaya bahwa alasan utama asimetri ionik adalah adanya membran sel dengan sifat-sifat tertentu.
Membran sel adalah lapisan sitoplasma yang dipadatkan, dengan ketebalan sekitar 10 nm (100 A). Penggunaan metode penelitian mikroskopis elektron memungkinkan untuk menentukan struktur halus membran (Gbr. 55). Membran sel terdiri dari lapisan ganda molekul fosfolipid, yang ditutupi dari dalam dengan lapisan molekul protein, dan dari luar dengan lapisan molekul karbohidrat kompleks - mukopolisakarida. Membran memiliki saluran khusus - "pori-pori" di mana air dan ion menembus ke dalam sel. Diasumsikan bahwa ada saluran khusus untuk setiap ion. Dalam hal ini, permeabilitas membran untuk ion tertentu akan tergantung pada ukuran pori dan diameter ion itu sendiri.
Dalam keadaan istirahat fisiologis relatif, membran mengalami peningkatan permeabilitas untuk ion kalium, sedangkan permeabilitasnya untuk ion natrium berkurang tajam.
Dengan demikian, kekhasan permeabilitas membran sel, serta ukuran ion itu sendiri, adalah salah satu alasan asimetri distribusi ion di kedua sisi membran sel. Asimetri ionik adalah salah satu alasan utama munculnya potensi istirahat, sedangkan peran utama adalah distribusi ion kalium yang tidak merata.
Hodgkin melakukan eksperimen klasik pada serat saraf raksasa cumi-cumi. Konsentrasi ion kalium di dalam serat dan di cairan sekitarnya disamakan - potensi istirahat menghilang. Jika serat diisi dengan larutan garam buatan yang komposisinya mirip dengan cairan intraseluler, perbedaan potensial terbentuk antara sisi dalam dan luar membran, kira-kira sama dengan potensial istirahat serat normal (50-80 mV).
Mekanisme pembentukan potensial aksi jauh lebih rumit. Peran utama dalam terjadinya arus aksi adalah milik ion natrium. Di bawah aksi stimulus kekuatan ambang, permeabilitas membran sel untuk ion natrium meningkat 500 kali dan melebihi permeabilitas ion kalium sebesar 10-20 kali. Dalam hal ini, natrium bergegas ke dalam sel seperti longsoran salju, yang menyebabkan pengisian ulang membran sel. Permukaan luar bermuatan negatif terhadap bagian dalam. Terjadi depolarisasi membran sel, disertai dengan pembalikan potensial membran. Pembalikan potensial membran dipahami sebagai jumlah milivolt (mV) dimana potensial aksi melebihi potensial istirahat. Pemulihan tingkat awal potensial membran (repolarisasi) dilakukan karena penurunan tajam permeabilitas natrium (inaktivasi) dan transfer aktif ion natrium dari sitoplasma sel ke lingkungan.
Bukti untuk hipotesis natrium tentang potensial aksi juga diperoleh oleh Hodgkin. Memang, jika potensial aksi bersifat natrium, maka dengan memvariasikan konsentrasi ion natrium, nilai potensial aksi dapat diubah. Ternyata ketika 2/3 air laut, yang merupakan lingkungan normal untuk akson cumi-cumi raksasa, diganti dengan larutan dekstrosa isotonik, yaitu ketika konsentrasi natrium di lingkungan berubah 2/3, potensial aksi berkurang setengahnya. .
Dengan demikian, munculnya biopotensi adalah fungsi dari membran biologis dengan permeabilitas selektif. Besarnya potensial istirahat dan potensial aksi ditentukan oleh asimetri ionik dalam sistem lingkungan sel.
8. Fenomena listrik di jaringan saraf dan otot pada kegembiraan. Potensial aksi, besarnya, fase dan durasinya. Rasio fase potensial aksi dengan fase rangsangan.
Kami telah menunjukkan di atas bahwa konduksi eksitasi pada serabut saraf dan otot dilakukan dengan bantuan impuls listrik yang merambat di sepanjang membran permukaan. Transmisi eksitasi dari saraf ke otot didasarkan pada mekanisme yang berbeda. Ini dilakukan sebagai hasil dari pelepasan ujung saraf yang sangat aktif senyawa kimia- mediator impuls saraf. Pada sinapsis otot rangka, mediator ini adalah asetilkolin (ACh).
Ada tiga elemen struktural utama dalam sinaps neuromuskular - membran prasinaps pada saraf membran pascasinaps pada otot, di antara mereka - celah sinaptik ... Bentuk sinapsis dapat bervariasi. Saat istirahat, ACh terkandung dalam apa yang disebut vesikel sinaptik di dalam pelat ujung serat saraf. Sitoplasma serat dengan vesikel sinaptik yang mengambang di dalamnya dipisahkan dari celah sinaptik oleh membran prasinaps. Dengan depolarisasi membran prasinaptik, muatan dan permeabilitasnya berubah, gelembung mendekati membran dan mengalir ke celah sinaptik, yang lebarnya mencapai 200-1000 angstrom. Mediator mulai berdifusi melalui celah ke membran postsinaptik.
Membran postsinaptik tidak bersifat elektrogenik, tetapi memiliki sensitivitas tinggi terhadap mediator karena adanya apa yang disebut reseptor kolinergik - gugus biokimia yang mampu bereaksi selektif dengan ACh. Yang terakhir mencapai membran postsinaptik dalam 0,2-0,5 msec. (disebut "penundaan sinaptik") dan, berinteraksi dengan reseptor kolinergik, menyebabkan perubahan permeabilitas membran untuk Na, yang menyebabkan depolarisasi membran postsinaptik dan pembentukan gelombang depolarisasi di atasnya, yang disebut potensial postsinaptik rangsang, (EPSP), yang nilainya melebihi EK bagian elektrogenik yang berdekatan dari membran serat otot. Akibatnya, PD (potensial aksi) muncul di dalamnya, yang menyebar ke seluruh permukaan serat otot, kemudian menyebabkannya berkontraksi, memulai proses yang disebut. antarmuka elektromekanis (Kapling). Mediator di celah sinaptik dan pada membran pascasinaps bekerja untuk waktu yang sangat singkat, karena mediator tersebut dihancurkan oleh enzim kolinesterase, yang mempersiapkan sinaps untuk persepsi bagian baru dari mediator. Juga ditunjukkan bahwa bagian dari ACh yang tidak bereaksi dapat kembali ke serabut saraf.
Dengan ritme stimulasi yang sangat sering, potensi postsinaptik dapat disimpulkan, karena kolinesterase tidak memiliki waktu untuk sepenuhnya memecah ACh yang dilepaskan di ujung saraf. Sebagai hasil penjumlahan ini, membran postsinaptik menjadi semakin terdepolarisasi. Dalam hal ini, area elektrogenik yang berdekatan dari serat otot mengalami keadaan tertekan, mirip dengan yang berkembang dengan aksi katoda DC yang berkepanjangan. (depresi katodik Verigo).
Eksitasi dalam jaringan memanifestasikan dirinya dalam penampilan fungsi spesifik untuknya (konduksi eksitasi oleh jaringan saraf, kontraksi otot, sekresi kelenjar) dan reaksi nonspesifik (generasi potensial aksi, perubahan metabolisme).
Arus aksi (AP dan EPP) adalah arus listrik yang terjadi di saraf, otot, dan beberapa sel tumbuhan antara daerah istirahat yang tereksitasi dan sekitarnya. Hal ini disebabkan oleh perubahan permeabilitas ionik membran dan potensi yang berkembang di daerah tereksitasi. Memainkan peran penting dalam propagasi potensial aksi di sepanjang sel (serat). Potensial aksi adalah pergeseran potensial membran yang terjadi pada jaringan di bawah aksi stimulus ambang dan supra ambang, yang disertai dengan pengisian kembali membran sel.
Di bawah aksi stimulus ambang atau suprathreshold, permeabilitas membran sel untuk ion berubah ke berbagai tingkat. Untuk ion Na, meningkat 400-500 kali, dan gradien bertambah cepat, untuk ion K, 10-15 kali, dan gradien berkembang lambat. Akibatnya, pergerakan ion Na terjadi di dalam sel, ion K keluar dari sel, yang mengarah pada pengisian ulang membran sel. Permukaan luar membran membawa muatan negatif, permukaan bagian dalam positif. Pengukuran yang akurat menunjukkan bahwa amplitudo potensial aksi 30-50 mV lebih tinggi dari nilai potensial istirahat.
Tahapan PD. PD terdiri dari 2 fase:
1. Fase depolarisasi. Sesuai dengan perubahan cepat dalam potensial membran (depolarisasi membran) sekitar 110 mV. Potensial membran berubah dari tingkat istirahat (sekitar -70mV) ke nilai yang mendekati potensial keseimbangan - potensi di mana arus masuk mengambil nilai nol (ENa + (sekitar 40mV)).
2. Fase repolarisasi. Potensial membran kembali mencapai tingkat istirahat (membran repolarisasi), setelah itu terjadi hiperpolarisasi ke nilai sekitar 10 mV lebih kecil (lebih negatif) daripada potensial istirahat, yaitu. sekitar -80mV.
Durasi potensial aksi di serabut saraf dan otot rangka bervariasi dalam 0,1 - 5 msec., Sedangkan fase repolarisasi selalu lebih lama dari fase depolarisasi.
Rasio fase potensial aksi dan rangsangan. Tingkat eksitabilitas sel tergantung pada fase PD. Pada fase respon lokal, eksitabilitas meningkat. Fase rangsangan ini disebut augmentasi laten. Pada fase repolarisasi AP, ketika semua saluran natrium terbuka dan ion natrium masuk ke dalam sel seperti longsoran salju, bahkan tidak ada stimulus super kuat yang dapat merangsang proses ini. Oleh karena itu, fase depolarisasi sesuai dengan fase refraktori absolut. Selama fase repolarisasi, semakin banyak saluran natrium yang tertutup. Namun, mereka dapat dibuka kembali di bawah aksi stimulus suprathreshold. Ini sesuai dengan fase refraktori relatif. Selama jejak depolarisasi, MP berada pada tingkat kritis; oleh karena itu, bahkan rangsangan di bawah ambang batas dapat menyebabkan eksitasi sel. Akibatnya, pada saat ini, kegembiraannya meningkat. Fase ini disebut fase eksitabilitas supernormal. Pada saat hiperpolarisasi jejak, MF berada di atas level awal. Dia berada dalam fase rangsangan subnormal.
9. Struktur otot rangka dan persarafannya. Satuan bermotor. Sifat fisiologis otot, karakteristiknya pada bayi baru lahir.
Klasifikasi morfo-fungsional otot:
1. Bergaris-garis
a) kerangka - sel berinti banyak, lurik melintang, inti lebih dekat ke sarkolema. Berat 40%.
b) jantung - sel mononuklear dengan lurik melintang, nukleus di tengah. Berat 0,5%.
2. Halus - sel mononuklear, tidak memiliki lurik silang. Mereka adalah anggota badan lain. Massa totalnya adalah 5-10%.
Sifat umum otot.
1) Kegembiraan. PP = - 90mV. Amplitudo PD = 120 mV - tanda pembalikan +30 mV.
2) Konduktivitas - kemampuan untuk melakukan PD melintasi membran sel (3-5 m / s). Menyediakan pengiriman PD ke tabung-T dan dari mereka ke tabung-L yang melepaskan kalsium.
3) Kontraktilitas - kemampuan untuk memperpendek atau mengembangkan ketegangan saat bersemangat.
4) Elastisitas - kemampuan untuk kembali ke panjang semula.
Fungsi otot rangka:
1. Gerakan tubuh di luar angkasa
2. Memindahkan bagian tubuh relatif satu sama lain
3. Menjaga postur tubuh
4. Generasi panas
5. Pergerakan darah dan getah bening (kerja dinamis)
6. Partisipasi dalam ventilasi paru-paru
7. Perlindungan organ dalam
8. Faktor anti-stres
Tingkat organisasi otot rangka:
Seluruh otot dikelilingi oleh epimisium, pembuluh darah dan saraf mendekatinya. Bundel otot individu ditutupi dengan perimisium. Seikat sel (serat otot atau simplas) - ditutupi dengan endomisium. Sel mengandung miofibril dari miofilamen, protein utamanya adalah aktin, miosin, tropomiosin, troponin, kalsium ATP-ase, kreatin fosfokinase, protein struktural.
Di otot, motorik (motorik, unit neuromotor) dibedakan - ini adalah asosiasi fungsional neuron motorik, akson dan serat ototnya dipersarafi oleh akson ini. Serat otot ini dapat ditemukan di berbagai area (bundel) otot.
Motor unit (ME) adalah unit fungsional otot rangka. ME termasuk - neuron motorik dan sekelompok serat otot yang dipersarafi olehnya.
Jenis serat otot:
1) serat phasic lambat dari tipe oksidatif
2) serat fasik cepat dari tipe oksidatif (tipe 2a)
3) serat fasik cepat dari tipe glikolitik (tipe 2b)
4) serat tonik
Mekanisme kontraksi otot.
A) serat otot tunggal
B) seluruh otot
Otot rangka memiliki sifat-sifat penting berikut:
1) rangsangan - kemampuan untuk merespons aksi iritasi dengan mengubah konduktivitas ionik dan potensial membran. Dalam kondisi alami, iritan ini adalah mediator asetilkolin.
2) konduktivitas - kemampuan untuk melakukan potensial aksi di sepanjang dan ke dalam serat otot di sepanjang sistem-T;
3) kontraktilitas - kemampuan untuk mempersingkat atau mengembangkan ketegangan saat bersemangat;
4) elastisitas - kemampuan untuk mengembangkan ketegangan saat diregangkan.
10. Cara kontraksi otot: isotonik dan isometrik. Kekuatan otot mutlak. Perubahan terkait usia dalam kekuatan otot.
Kemampuan kontraktil otot rangka dicirikan oleh kekuatan kontraksi yang dikembangkan otot (biasanya diperkirakan). kekuatan keseluruhan, yang dapat dikembangkan otot, dan mutlak, yaitu gaya per 1 cm 2 penampang) panjang pemendekan, tingkat ketegangan serat otot, kecepatan pemendekan dan perkembangan ketegangan, kecepatan relaksasi. Karena parameter ini sangat ditentukan oleh panjang awal serat otot dan beban pada otot, studi tentang kemampuan kontraktil otot dilakukan dalam berbagai mode.
Stimulasi serabut otot dengan ambang tunggal atau stimulus suprathreshold menyebabkan kontraksi tunggal, yang terdiri dari beberapa periode (Gbr. 2.23). Yang pertama - periode latensi adalah jumlah waktu tunda yang disebabkan oleh eksitasi membran serat otot, penyebaran AP di sepanjang sistem-T ke dalam serat, pembentukan inositol trifosfat, peningkatan konsentrasi kalsium intraseluler dan aktivasi jembatan silang. Untuk otot sartorius katak, periode latensi sekitar 2 ms.
Yang kedua adalah periode pemendekan, atau pengembangan ketegangan. Dalam kasus pemendekan serat otot gratis, mereka berbicara tentang kontraksi isotonik, di mana tegangan praktis tidak berubah, tetapi hanya panjang serat otot yang berubah. Jika serat otot tetap di kedua sisi dan tidak dapat dipersingkat dengan bebas, maka mereka berbicara tentang kontraksi isometrik Sebenarnya, dengan cara kontraksi ini, panjang serat otot tidak berubah, sedangkan ukuran sarkomer berubah karena pergeseran filamen aktin dan miosin relatif satu sama lain. Dalam hal ini, tegangan yang dihasilkan ditransfer ke elemen elastis yang terletak di dalam serat. Sifat elastis dimiliki oleh jembatan transversal filamen miosin, filamen aktin, pelat Z, retikulum sarkoplasma yang terletak secara longitudinal dan sarkolema serat otot.
Dalam percobaan pada otot yang terisolasi, peregangan elemen jaringan ikat otot dan tendon terungkap, di mana ketegangan yang dikembangkan oleh jembatan transversal ditransmisikan.
Dalam tubuh manusia, dalam bentuk yang terisolasi, kontraksi isotonik atau isometrik tidak terjadi. Sebagai aturan, perkembangan ketegangan disertai dengan pemendekan panjang otot - pengurangan mode auksotonik
Yang ketiga adalah periode relaksasi, ketika konsentrasi ion Ca2+ menurun dan kepala miosin terlepas dari filamen aktin.
Dipercaya bahwa untuk satu serat otot, tegangan yang dihasilkan oleh sarkomer mana pun sama dengan tegangan pada sarkomer lainnya. Karena sarkomer terhubung secara seri, kecepatan kontraksi serat otot sebanding dengan jumlah sarkomernya. Jadi, dengan kontraksi tunggal, kecepatan pemendekan serat otot panjang lebih tinggi daripada yang lebih pendek. Jumlah usaha yang dikembangkan oleh serat otot sebanding dengan jumlah miofibril dalam serat. Selama pelatihan otot, jumlah miofibril meningkat, yang merupakan substrat morfologis untuk meningkatkan kekuatan kontraksi otot. Pada saat yang sama, jumlah mitokondria meningkat, yang meningkatkan daya tahan serat otot selama aktivitas fisik.
Dalam otot yang terisolasi, besarnya dan kecepatan kontraksi tunggal ditentukan oleh sejumlah faktor tambahan. Besarnya kontraksi tunggal terutama akan ditentukan oleh jumlah unit motorik yang terlibat dalam kontraksi. Karena otot terdiri dari serat otot dengan tingkat rangsangan yang berbeda, ada hubungan yang pasti antara besarnya stimulus dan respons. Peningkatan kekuatan kontraksi dimungkinkan hingga batas tertentu, setelah itu amplitudo kontraksi tetap tidak berubah dengan peningkatan amplitudo stimulus. Dalam hal ini, semua serat otot yang membentuk otot ikut serta dalam kontraksi.
Pentingnya partisipasi semua serat otot dalam kontraksi ditunjukkan ketika mempelajari ketergantungan tingkat pemendekan pada besarnya beban.
Ketika stimulus kedua diterapkan selama periode pemendekan atau pengembangan ketegangan otot, dua kontraksi berturut-turut dijumlahkan dan respons yang dihasilkan dalam amplitudo menjadi jauh lebih tinggi daripada dengan stimulus tunggal; jika serat otot atau otot dirangsang dengan frekuensi sedemikian rupa sehingga rangsangan berulang akan jatuh pada periode pemendekan, atau pengembangan ketegangan, maka penjumlahan lengkap dari kontraksi tunggal terjadi dan berkembang tetanus halus (Gbr. 2.25, B). Tetanus adalah kontraksi otot yang kuat dan berkepanjangan. Diyakini bahwa fenomena ini didasarkan pada peningkatan konsentrasi kalsium di dalam sel, yang memungkinkan reaksi interaksi antara aktin dan miosin dan pembentukan kekuatan otot oleh jembatan transversal untuk waktu yang cukup lama. Dengan penurunan frekuensi stimulasi, ada kemungkinan bahwa stimulus berulang diterapkan selama periode relaksasi. Dalam hal ini, penjumlahan kontraksi otot juga akan terjadi, namun, akan ada depresi khas pada kurva kontraksi otot (Gbr. 2.25, D) - penjumlahan tidak lengkap, atau dentate tetanus.
Dengan tetanus, penjumlahan kontraksi otot terjadi, sedangkan PD serat otot tidak disimpulkan.
Dalam kondisi alami, kontraksi tunggal otot rangka tidak terjadi. Penambahan terjadi, atau superposisi, kontraksi unit neuromotor individu. Dalam hal ini, kekuatan kontraksi dapat meningkat baik karena perubahan jumlah unit motorik yang berpartisipasi dalam kontraksi, dan karena perubahan frekuensi impuls neuron motorik. Dalam kasus peningkatan frekuensi impuls, penjumlahan kontraksi unit motorik individu akan diamati.
Salah satu alasan peningkatan kekuatan kontraksi in vivo adalah frekuensi impuls yang dihasilkan oleh neuron motorik. Alasan kedua untuk ini adalah peningkatan jumlah motoneuron yang tereksitasi dan sinkronisasi frekuensi eksitasinya. Peningkatan jumlah neuron motorik sesuai dengan peningkatan jumlah unit motorik yang terlibat dalam kontraksi, dan peningkatan tingkat sinkronisasi eksitasinya berkontribusi pada peningkatan amplitudo dengan superposisi kontraksi maksimum yang dikembangkan oleh masing-masing motor. satuan secara terpisah.
Kekuatan kontraksi otot rangka yang terisolasi, semua hal lain dianggap sama, tergantung pada panjang awal otot. Peregangan otot yang sedang menyebabkan kekuatan yang dikembangkannya meningkat dibandingkan dengan kekuatan yang dikembangkan oleh otot yang tidak diregangkan. Ada penjumlahan ketegangan pasif, karena adanya komponen elastis otot, dan kontraksi aktif. Kekuatan kontraksi maksimum dicapai ketika ukuran sarkomer adalah 2-2,2 mikron (Gbr. 2.26). Peningkatan panjang sarkomer menyebabkan penurunan kekuatan kontraksi, karena area saling tumpang tindih filamen aktin dan miosin berkurang. Dengan panjang sarkomer 2,9 mikron, otot dapat mengembangkan kekuatan sebesar hanya 50% dari kekuatan maksimum yang mungkin.
Dalam kondisi alami, kekuatan kontraksi otot rangka ketika diregangkan, misalnya, selama pijatan, meningkat karena kerja eferen gamma.
Kekuatan otot absolut adalah rasio kekuatan maksimum otot dengan diameter fisiologisnya, mis. beban maksimum yang diangkat otot, dibagi dengan luas total semua serat otot. Kekuatan kontraksi tidak tetap konstan sepanjang hidup. Akibat aktivitas yang berkepanjangan, kinerja otot rangka menurun. Fenomena ini disebut kelelahan. Pada saat yang sama, kekuatan kontraksi menurun, periode laten kontraksi dan periode relaksasi meningkat.
11. Kontraksi otot tunggal, fase-fasenya. Fase perubahan rangsangan otot. Fitur kontraksi tunggal pada bayi baru lahir.
Iritasi pada otot atau saraf motorik yang mempersarafinya dengan satu stimulus menyebabkan kontraksi tunggal pada otot. Ini membedakan antara dua fase utama: fase kontraksi dan fase relaksasi. Kontraksi serat otot sudah dimulai selama cabang menaik dari AP. Durasi kontraksi di setiap titik serat otot puluhan kali lebih lama dari durasi AP. Oleh karena itu, tiba saatnya ketika PD telah melewati seluruh serat dan berakhir, sementara gelombang kontraksi telah menutupi seluruh serat dan terus memendek. Ini sesuai dengan momen pemendekan maksimum atau ketegangan serat otot.
Kontraksi masing-masing serat otot individu dengan kontraksi tunggal mematuhi hukum " semua atau tidak Ini berarti bahwa kontraksi yang terjadi baik selama stimulasi threshold dan overthreshold memiliki amplitudo maksimum. Besarnya kontraksi tunggal seluruh otot tergantung pada kekuatan iritasi. Dengan stimulasi ambang, kontraksinya hampir tidak terlihat, tetapi dengan peningkatan kekuatan stimulasi, itu meningkat. sampai mencapai ketinggian tertentu, setelah itu tetap tidak berubah (kontraksi maksimum). Hal ini disebabkan oleh fakta bahwa rangsangan serat otot individu tidak sama, dan oleh karena itu hanya sebagian dari mereka bersemangat dengan iritasi lemah.Pada kontraksi maksimum, mereka semua bersemangat.Kecepatan gelombang kontraksi otot bertepatan dengan kecepatan propagasi AP Dalam bisep brachii itu sama dengan 3,5-5,0 m / detik.
Kontraksi tunggal - satu pengurangan iritasi... Di dalamnya, periode laten, fase kontraksi dan fase relaksasi dibedakan. Pada saat periode laten, fase refrocter terjadi. Tapi sudah di awal fase pemendekan, itu dipulihkan.
12. Jumlah kontraksi otot. Kontraksi tetanik.
Jika, dalam percobaan, serat otot individu atau seluruh otot ditindaklanjuti oleh dua rangsangan tunggal kuat yang berurutan dengan cepat, maka kontraksi yang dihasilkan akan memiliki amplitudo yang lebih besar daripada kontraksi tunggal maksimum. Efek kontraktil yang disebabkan oleh rangsangan pertama dan kedua tampaknya bertambah. Fenomena ini disebut penjumlahan singkatan. Untuk munculnya penjumlahan, perlu bahwa interval antara rangsangan memiliki durasi tertentu - itu harus lebih lama dari periode refraktori, tetapi lebih pendek dari seluruh durasi kontraksi tunggal, sehingga stimulasi kedua bekerja pada otot sebelumnya. punya waktu untuk bersantai. Dalam hal ini, dua kasus dimungkinkan. Jika stimulus kedua datang ketika otot sudah mulai rileks, pada kurva miografi, puncak kontraksi kedua akan dipisahkan dari yang pertama oleh suatu depresi. Jika stimulus kedua bekerja ketika kontraksi pertama belum mencapai puncaknya, maka kontraksi kedua, seolah-olah, bergabung dengan yang pertama, bersama-sama membentuk satu puncak yang diringkas. Dengan penjumlahan penuh dan tidak lengkap, PD tidak dijumlahkan. Kontraksi kumulatif ini sebagai respons terhadap rangsangan ritmis disebut tetanus. Tergantung pada frekuensi iritasi, itu bergerigi dan halus.
Alasan penjumlahan kontraksi pada tetanus terletak pada akumulasi ion Ca ++ di ruang interfibrillar hingga konsentrasi 5 * 106 mM / L. Setelah mencapai nilai ini, akumulasi Ca++ lebih lanjut tidak menyebabkan peningkatan amplitudo tetanus.
Setelah penghentian stimulasi tetanik, serat pada awalnya tidak sepenuhnya rileks, dan panjang aslinya dipulihkan hanya setelah waktu tertentu berlalu. Fenomena ini disebut kontraktur post-tetanik atau residual. Hal ini terkait dengan itu. bahwa dibutuhkan lebih banyak waktu untuk mengeluarkan semua Ca ++ dari ruang interfibrilar, yang sampai di sana dengan rangsangan berirama dan tidak punya waktu untuk sepenuhnya masuk ke dalam tangki retikulum sarkoplasma dengan pengoperasian pompa Ca.
Jika setelah mencapai tetanus halus, frekuensi iritasi semakin meningkat, maka otot pada frekuensi tertentu tiba-tiba mulai rileks. Fenomena ini disebut pesimis . Itu terjadi ketika setiap impuls berikutnya jatuh ke dalam refraktori dari yang sebelumnya.
13. Ultrastruktur miofibril. Protein kontraktil (aktin, miosin). Protein pengatur (troponin, tropomiosin) dalam komposisi protofibril tipis. Teori kontraksi otot.
Miofibril adalah aparatus kontraktil serat otot. Pada serat otot lurik, miofibril dibagi menjadi bagian (cakram) yang berselang-seling secara teratur dengan sifat optik yang berbeda. Beberapa daerah ini bersifat anisotropik, yaitu memiliki birefringence. Dalam cahaya normal, mereka tampak gelap, dan dalam cahaya terpolarisasi, mereka tampak transparan dalam arah memanjang dan buram dalam arah melintang. Daerah lain isotropik dan tampak transparan di bawah cahaya normal. Daerah anisotropik dilambangkan dengan huruf A, isotropik - SAYA. Di tengah disk A ada strip cahaya H, dan di tengah disk saya ada garis gelap Z, yang merupakan membran transversal tipis melalui pori-pori yang dilewati miofibril. Karena adanya struktur pendukung seperti itu, disk paralel dari masing-masing miofibril dalam satu serat tidak bergerak relatif satu sama lain selama kontraksi.
Ditemukan bahwa masing-masing miofibril memiliki diameter sekitar 1 mikron dan terdiri dari rata-rata 2.500 protofibril, yang merupakan molekul terpolimerisasi memanjang dengan protein miosin dan aktin. Filamen miosin (protofibril) dua kali lebih tebal dari filamen aktin. Diameternya sekitar 100 angstrom. Dalam keadaan istirahat serat otot, filamen terletak di miofibril sedemikian rupa sehingga filamen aktin panjang yang tipis memasuki ujungnya ke dalam ruang antara filamen miosin tebal dan pendek. Di bagian seperti itu, setiap utas tebal dikelilingi oleh 6 utas tipis. Karena itu, cakram I hanya terdiri dari filamen aktin, dan cakram A juga terdiri dari filamen miosin. Strip cahaya H mewakili zona bebas dari filamen aktin selama periode istirahat. Membran Z, melewati bagian tengah piringan I, menyatukan filamen aktin.
Banyak jembatan melintang pada miosin juga merupakan komponen penting dari struktur ultramikroskopik miofibril. Pada gilirannya, filamen aktin memiliki apa yang disebut pusat aktif, yang diam tertutup, seperti selubung, dengan protein khusus - troponin dan tropomiosin. Kontraksi didasarkan pada proses geser filamen aktin relatif terhadap filamen miosin. Geser ini disebabkan oleh kerja yang disebut. "peralatan kimia", mis. siklus perubahan yang terjadi secara berkala dalam keadaan jembatan melintang dan interaksinya dengan pusat aktif pada aktin. Ion ATP dan Ca+ memainkan peran penting dalam proses ini.
Ketika serat otot berkontraksi, filamen aktin dan miosin tidak memendek, tetapi mulai bergeser satu sama lain: filamen aktin meluncur di antara filamen miosin, akibatnya panjang cakram I memendek, dan cakram A mempertahankannya. ukuran, saling mendekat. Strip H hampir menghilang, karena ujung-ujung aktin bersentuhan dan bahkan melewati satu sama lain.
14. Hubungan eksitasi dan kontraksi (electromechanical coupling) pada serat otot. Peran ion kalsium. Fungsi retikulum sarkoplasma.
Dalam otot rangka, in vivo, inisiator kontraksi otot adalah potensial aksi yang menyebar selama eksitasi sepanjang membran permukaan serat otot.
Jika ujung mikroelektroda diterapkan pada permukaan serat otot di daerah membran Z, maka ketika stimulus listrik yang sangat lemah diterapkan yang menyebabkan depolarisasi, disk I di kedua sisi tempat iritasi akan mulai memendek. . dalam hal ini, eksitasi menyebar jauh ke dalam serat, di sepanjang membran Z. Iritasi bagian lain dari membran tidak menyebabkan efek seperti itu. Dari sini dapat disimpulkan bahwa depolarisasi membran permukaan di wilayah disk I selama propagasi AP adalah mekanisme pemicu proses kontraktil.
Penelitian lebih lanjut telah menunjukkan bahwa hubungan antara yang penting antara depolarisasi membran dan permulaan kontraksi otot adalah penetrasi ion CA ++ bebas ke dalam ruang interfibrilar. Saat istirahat, sebagian besar Ca ++ dalam serat otot disimpan dalam retikulum sarkoplasma.
Dalam mekanisme kontraksi otot, peran khusus dimainkan oleh bagian retikulum itu, yang terlokalisasi di wilayah membran Z. Secara mikroskopis elektron, yang disebut. triad (sistem-T), yang masing-masing terdiri dari tabung melintang tipis, terletak di pusat di wilayah membran Z, berjalan melintasi serat, dan dua tangki lateral retikulum sarkoplasma, yang mengandung Ca ++ terikat. Perambatan PD di sepanjang membran permukaan dibawa jauh ke dalam serat di sepanjang tubulus transversal dari triad. Kemudian eksitasi ditransmisikan ke tangki, mendepolarisasi membran mereka dan menjadi permeabel terhadap CA ++.
Telah dibuktikan secara eksperimental bahwa ada konsentrasi kritis tertentu dari ion Ca ++ bebas, di mana kontraksi miofibril dimulai. Itu sama dengan 0,2-1,5 * 10 6 ion per serat. Peningkatan konsentrasi Ca++ hingga 5*10 6 sudah menyebabkan reduksi yang maksimal.
Permulaan kontraksi otot terbatas pada sepertiga pertama dari lutut PD asendens, ketika nilainya mencapai sekitar 50 mV. Dipercaya bahwa pada besarnya depolarisasi inilah konsentrasi Ca ++ menjadi ambang batas untuk terjadinya interaksi antara aktin dan miosin.
Proses pelepasan Ca++ berhenti setelah puncak AP berakhir. Namun demikian, reduksi terus berkembang sampai mekanisme tersebut berperan, memastikan kembalinya Ca++ ke sisterna retikulum. Mekanisme ini disebut "pompa kalsium". Untuk melakukan pekerjaannya, energi yang diperoleh dari pemecahan ATP digunakan.
Di ruang interfibrilar, Ca ++ berinteraksi dengan protein yang menutup pusat aktif filamen aktin - troponin dan tropomiosin, memberikan kesempatan untuk reaksi jembatan silang filamen miosin dan aktin.
Dengan demikian, urutan kejadian yang mengarah pada kontraksi dan kemudian relaksasi serat otot saat ini digambarkan sebagai berikut:
15. Kelelahan selama kerja otot. Penyebab kelelahan. Konsep rekreasi aktif.
Kelelahan adalah penurunan sementara kinerja sel, organ atau seluruh organisme, yang terjadi sebagai akibat dari pekerjaan dan menghilang setelah istirahat.
Jika otot yang terisolasi, yang menahan beban kecil, teriritasi untuk waktu yang lama dengan rangsangan listrik berirama, maka amplitudo kontraksinya secara bertahap berkurang hingga mencapai nol. Sebuah kurva kelelahan dicatat. Seiring dengan perubahan amplitudo kontraksi selama kelelahan, periode laten kontraksi meningkat, periode relaksasi otot diperpanjang, dan ambang iritasi meningkat, mis. eksitabilitasnya menurun. Semua perubahan ini tidak terjadi segera setelah mulai bekerja, ada periode tertentu di mana terjadi peningkatan amplitudo kontraksi dan sedikit peningkatan rangsangan otot. Pada saat yang sama, itu menjadi mudah diperluas. Dalam kasus seperti itu, mereka mengatakan bahwa otot "bekerja", mis. beradaptasi untuk bekerja dalam ritme dan kekuatan iritasi tertentu. Setelah periode workability, periode workability stabil dimulai. Dengan iritasi berkepanjangan lebih lanjut, serat otot kelelahan.
Penurunan kinerja otot yang diisolasi dari tubuh selama iritasi berkepanjangan disebabkan oleh dua alasan utama. Yang pertama adalah bahwa selama kontraksi, produk metabolisme (asam fosfat, pengikat Ca ++, asam laktat, dll.) menumpuk di otot, yang memiliki efek depresi pada kinerja otot. Beberapa dari produk ini, serta ion Ca, berdifusi dari serat ke luar ke dalam ruang periseluler dan memiliki efek menekan kemampuan membran tereksitasi untuk menghasilkan AP. Jadi, jika otot yang terisolasi, ditempatkan dalam volume kecil cairan Ringer, dibawa ke kelelahan total, maka cukup dengan mengubah larutan yang mencucinya untuk memulihkan kontraksi otot.
Alasan lain untuk pengembangan kelelahan pada otot yang terisolasi adalah penipisan cadangan energi secara bertahap di dalamnya. Dengan kerja yang berkepanjangan, kandungan glikogen dalam otot menurun tajam, akibatnya proses resintesis ATP dan CF, yang diperlukan untuk pelaksanaan kontraksi, terganggu.
Perlu dicatat bahwa di bawah kondisi alami keberadaan tubuh, kelelahan peralatan motorik selama kerja yang berkepanjangan berkembang dengan cara yang sama sekali berbeda daripada dalam percobaan dengan otot yang terisolasi. Ini tidak hanya disebabkan oleh fakta bahwa di dalam tubuh otot terus disuplai dengan darah, dan, oleh karena itu, menerima nutrisi yang diperlukan dengannya dan dibebaskan dari produk metabolisme. Perbedaan utama adalah bahwa di dalam tubuh, impuls rangsang datang ke otot dari saraf. Sinaps neuromuskular menjadi lelah jauh lebih awal daripada serat otot, karena penipisan yang cepat dari akumulasi cadangan neurotransmiter. Hal ini menyebabkan blokade transmisi eksitasi dari saraf ke otot, yang melindungi otot dari kelelahan yang disebabkan oleh pekerjaan yang berkepanjangan. Di seluruh organisme, pusat saraf (kontak saraf-saraf) menjadi lelah lebih awal selama bekerja.
Peran sistem saraf dalam kelelahan seluruh organisme dibuktikan dengan studi kelelahan dalam hipnosis (kettlebell-basket), pembentukan pengaruh "istirahat aktif" pada kelelahan, peran sistem saraf simpatik (Orbeli- fenomena Ginetsinsky), dll.
Ergografi digunakan untuk mempelajari kelelahan otot pada manusia. Bentuk kurva kelelahan dan jumlah pekerjaan yang dilakukan sangat bervariasi dari orang ke orang dan bahkan dari subjek yang sama dalam kondisi yang berbeda.
16. Ciri fisiologis otot polos. Nada plastik otot polos.
Sifat penting dari otot polos adalah ukurannya yang besar plastik , itu. kemampuan untuk mempertahankan panjang yang diberikan oleh ekstensi tanpa mengubah tegangan. Otot rangka, di sisi lain, segera memendek setelah diturunkan. Otot polos tetap teregang sampai, di bawah pengaruh iritasi apa pun, kontraksi aktifnya terjadi. Sifat plastisitas sangat penting untuk aktivitas normal organ berongga - berkat itu, tekanan di dalam organ berongga berubah relatif sedikit dengan tingkat pengisian yang berbeda.
Ada berbagai jenis otot polos. Di dinding sebagian besar organ berongga terdapat serat otot sepanjang 50-200 mikron dan diameter 4-8 mikron, yang sangat berdekatan satu sama lain, dan oleh karena itu, ketika memeriksanya di bawah mikroskop, tampaknya mereka secara morfologis merupakan satu. utuh. Pemeriksaan mikroskopis elektron menunjukkan, bagaimanapun, bahwa mereka dipisahkan satu sama lain oleh celah antar sel, yang lebarnya bisa 600-1500 angstrom. Meskipun demikian, otot polos berfungsi secara keseluruhan. Hal ini dinyatakan dalam fakta bahwa AP dan gelombang lambat depolarisasi bebas merambat dari satu serat ke serat lainnya.
Pada beberapa otot polos, misalnya, pada otot siliaris mata, atau otot iris, serabut-serabut tersebut terletak secara terpisah, dan masing-masing memiliki persarafannya sendiri. Pada sebagian besar otot polos, serabut saraf motorik terletak hanya pada sejumlah kecil serabut.
Potensi istirahat serat otot polos, yang otomatis, menunjukkan fluktuasi kecil yang konstan. Nilainya dengan timbal intraseluler sama dengan 30-70 mV. Potensi istirahat serat otot polos non-otomatis stabil dan sama dengan 60-70 mV. Dalam kedua kasus, nilainya kurang dari potensi istirahat otot rangka. Hal ini disebabkan oleh fakta bahwa membran serat otot polos saat istirahat dicirikan oleh permeabilitas yang relatif tinggi terhadap ion Na. Potensial aksi di otot polos juga sedikit lebih rendah daripada di otot rangka. Kelebihan di atas potensial istirahat tidak lebih dari 10-20 mV.
Mekanisme ionik inisiasi PD pada otot polos agak berbeda dari pada otot rangka. Ditemukan bahwa depolarisasi regeneratif membran, yang mendasari potensial aksi di sejumlah otot polos, dikaitkan dengan peningkatan permeabilitas membran untuk ion Ca ++, daripada Na +.
Banyak otot polos dicirikan oleh aktivitas spontan dan otomatis. Hal ini ditandai dengan penurunan potensial membran istirahat yang lambat, yang, ketika tingkat tertentu tercapai, disertai dengan terjadinya PD.
Pada serabut saraf dan otot rangka, eksitasi menyebar melalui arus listrik lokal yang timbul antara bagian membran sel yang terdepolarisasi dan bagian istirahat yang berdekatan. Mekanisme yang sama melekat pada otot polos. Namun, tidak seperti pada otot rangka, pada otot polos, potensial aksi yang timbul pada satu serat dapat merambat ke serat yang berdekatan. Hal ini disebabkan oleh fakta bahwa di dalam membran sel otot polos di area kontak dengan sel-sel tetangga terdapat area dengan resistansi yang relatif rendah, di mana loop arus yang muncul dalam satu serat dengan mudah diteruskan ke serat yang berdekatan, menyebabkan depolarisasi membran mereka. Dalam hal ini, otot polos mirip dengan otot jantung. Satu-satunya perbedaan adalah bahwa seluruh otot tereksitasi dari satu sel di jantung, dan pada otot polos AP, yang muncul di satu area, menyebar darinya hanya ke jarak tertentu, yang bergantung pada kekuatan stimulus yang diberikan.
Ciri penting lain dari otot polos adalah bahwa AP yang menyebar terjadi ke bawah hanya jika stimulus yang diberikan secara bersamaan merangsang sejumlah minimum sel otot. "Zona kritis" ini memiliki diameter sekitar 100 mikron, yang setara dengan 20-30 sel paralel. Laju konduksi eksitasi di berbagai otot polos berkisar antara 2 hingga 15 cm/detik. itu. secara signifikan lebih sedikit daripada di otot rangka.
Seperti halnya pada otot rangka, pada potensial aksi halus memiliki nilai awal untuk permulaan proses kontraktil. Hubungan antara gairah dan kontraksi di sini juga dilakukan dengan bantuan Ca++. Namun, dalam serat otot polos, retikulum sarkoplasma diekspresikan dengan buruk, oleh karena itu, peran utama dalam mekanisme kontraksi diberikan kepada ion Ca ++ yang menembus ke dalam serat otot selama pembentukan AP.
Dengan kekuatan stimulasi tunggal yang besar, kontraksi otot polos dapat terjadi. Periode laten kontraksinya jauh lebih lama daripada periode laten, mencapai 0,25-1 detik. Durasi kontraksi itu sendiri juga lama - hingga 1 menit. Relaksasi berlangsung sangat lambat setelah kontraksi. Gelombang kontraksi menyebar di sepanjang otot polos dengan kecepatan yang sama dengan gelombang eksitasi (2-15 cm / detik). Tetapi kelambatan aktivitas kontraktil ini dikombinasikan dengan kekuatan kontraksi yang besar dari otot polos. Jadi, otot perut burung mampu mengangkat 2 kg per 1 sq. Mm. penampangnya.
Karena lambatnya kontraksi, otot polos, bahkan dengan rangsangan ritmik yang jarang (10-12 per menit), dengan mudah masuk ke dalam keadaan kontraksi persisten yang berkepanjangan, mengingatkan pada tetanus otot rangka. Namun, biaya energi yang terkait dengan pengurangan ini sangat rendah.
Kemampuan untuk mengotomatisasi otot polos melekat pada serat ototnya dan diatur oleh elemen saraf yang terletak di dinding organ otot polos. Sifat otomatisasi miogenik dibuktikan dengan eksperimen pada potongan otot dinding usus, yang dibebaskan dari elemen saraf. Otot polos bereaksi terhadap semua pengaruh eksternal dengan mengubah frekuensi ritme spontan, yang menghasilkan kontraksi atau relaksasi otot. Efek iritasi otot polos usus tergantung pada rasio antara frekuensi stimulasi dan frekuensi alami ritme spontan: dengan nada rendah - AP spontan yang jarang - stimulasi yang diterapkan meningkatkan nada, dengan nada tinggi sebagai respons terhadap iritasi, relaksasi terjadi, karena peningkatan impuls yang berlebihan mengarah pada fakta bahwa setiap impuls berikutnya jatuh ke fase refraktori dari yang sebelumnya.
17. Struktur dan fungsi serabut saraf. Mekanisme eksitasi
serabut saraf bebas mielin dan mielin. Pentingnya intersepsi Ranvier.
Fungsi utama akson adalah untuk menghantarkan impuls yang timbul di neuron. Akson dapat ditutupi dengan selubung mielin (serat mielin) atau tanpa selubung mielin (serat bebas mielin). Serat mielin lebih sering terjadi pada saraf motorik, serat bebas mielin mendominasi di sistem saraf otonom (otonom).
Serabut saraf bermielin terpisah terdiri dari silinder aksial yang dilapisi selubung mielin yang dibentuk oleh sel Schwann. Silinder aksial memiliki membran dan aksoplasma. Selubung mielin adalah produk dari aktivitas sel Schwann dan terdiri dari 80% lipid dengan resistensi ohmik tinggi dan 20% protein.
Selubung mielin tidak menutupi silinder aksial dengan penutup kontinu, tetapi terputus, meninggalkan area terbuka silinder aksial, yang disebut intersepsi nodal (intersepsi Ranvier). Panjang bagian antara intersepsi ini berbeda dan tergantung pada ketebalan serat saraf: semakin tebal, semakin panjang jarak antara intersepsi (Gbr. 2.17).
Serabut saraf bebas mielin hanya ditutupi oleh selubung Schwann.
Konduksi eksitasi pada serat bebas mielin berbeda dari pada serat mielin karena struktur membran yang berbeda. Dalam serat bebas mielin, rangsangan secara bertahap menutupi bagian yang berdekatan dari membran silinder aksial dan menyebar ke ujung akson. Kecepatan rambat eksitasi sepanjang serat ditentukan oleh diameternya.
Dalam serabut saraf bebas mielin, di mana proses metabolisme tidak memberikan kompensasi yang cepat untuk pengeluaran energi untuk eksitasi, penyebaran eksitasi ini berlanjut dengan pelemahan bertahap - dengan penurunan. Konduksi eksitasi yang menurun adalah karakteristik dari sistem saraf yang terorganisir rendah.
Pada hewan tingkat tinggi, terutama karena adanya selubung mielin dan kesempurnaan metabolisme dalam serat saraf, eksitasi berlalu tanpa redaman, tanpa penurunan. Ini difasilitasi oleh adanya muatan yang sama di seluruh membran dan pemulihannya yang cepat setelah lewatnya eksitasi.
Dalam serat mielin, eksitasi hanya mencakup area intersepsi nodal, yaitu, melewati area yang ditutupi mielin. Konduksi eksitasi sepanjang serat ini disebut yg berdansa (berselang). Dalam intersepsi nodal, jumlah saluran natrium mencapai 12.000 per 1 m, yang secara signifikan lebih banyak daripada di bagian lain dari serat. Akibatnya, intersepsi nodal adalah yang paling bersemangat dan memberikan tingkat konduksi eksitasi yang tinggi. Waktu konduksi eksitasi sepanjang serat mielin berbanding terbalik dengan panjang antara intersepsi.
Konduksi eksitasi sepanjang serabut saraf tidak terganggu untuk waktu yang lama (berjam-jam). Ini menunjukkan kelelahan yang rendah dari serat saraf. Dipercayai bahwa serat saraf relatif tidak kenal lelah karena fakta bahwa proses resintesis energi di dalamnya berlangsung dengan kecepatan yang cukup tinggi dan berhasil memulihkan pemborosan energi yang terjadi selama perjalanan kegembiraan.
Pada saat kegembiraan, energi serat saraf dihabiskan untuk pengoperasian pompa natrium-kalium. Terutama pengeluaran energi yang besar terjadi pada intersepsi Ranvier karena kepadatan tinggi saluran natrium-kalium di sini.
J. Erlanger dan H. Gasser (1937) adalah orang pertama yang mengklasifikasikan serabut saraf ps dari kecepatan eksitasi. Perbedaan kecepatan konduksi eksitasi di sepanjang serabut saraf campuran adalah saat menggunakan elektroda ekstraseluler. Potensi serat melakukan eksitasi pada kecepatan yang tidak sama dicatat secara terpisah (Gbr. 2.18).
Tergantung pada kecepatan eksitasi, serabut saraf dibagi menjadi tiga jenis: A, B, C. Pada gilirannya, serat tipe A dibagi menjadi empat kelompok: A α , A β , A γ , A δ . Kecepatan konduksi tertinggi (hingga 120 m / s) dimiliki oleh serat kelompok A α , yang terdiri dari serat dengan diameter 12-22 mikron. Serat lain memiliki diameter yang lebih kecil dan, karenanya, konduksi eksitasi melaluinya terjadi pada kecepatan yang lebih rendah (Tabel 2.4).
Batang saraf dibentuk oleh sejumlah besar serat, tetapi kegembiraan yang terjadi di sepanjang masing-masing serat tidak ditransmisikan ke serat yang berdekatan. Fitur konduksi eksitasi di sepanjang saraf ini disebut hukum konduksi terisolasi dari eksitasi pada serat saraf yang terpisah. Kemungkinan perilaku seperti itu sangat penting secara fisiologis, karena memberikan, misalnya, isolasi kontraksi setiap unit neuromotorik.
Kemampuan serat saraf untuk melakukan eksitasi dalam isolasi adalah karena adanya selubung, serta fakta bahwa resistensi cairan yang mengisi ruang interfiber jauh lebih rendah daripada resistensi membran serat. Oleh karena itu, arus yang meninggalkan serat tereksitasi didorong dalam cairan dan menjadi lemah untuk mengeksitasi serat tetangga. Kondisi yang diperlukan untuk konduksi eksitasi di saraf bukan hanya kontinuitas anatomisnya, tetapi juga integritas fisiologisnya. Dalam setiap konduktor logam, arus listrik akan mengalir selama konduktor mempertahankan kontinuitas fisik. Untuk saraf "konduktor" kondisi ini tidak cukup: serat saraf juga harus menjaga integritas fisiologis. Jika sifat-sifat membran serat dilanggar (perban, blokade dengan novocaine, amonia, dll.), konduksi eksitasi di sepanjang serat berhenti. Karakteristik properti lain dari konduksi eksitasi sepanjang serat saraf adalah kemampuan untuk melakukan secara bilateral. Menerapkan iritasi antara dua elektroda timbal pada permukaan serat akan menghasilkan potensi listrik di bawah masing-masing.
Tabel- Kecepatan konduksi eksitasi di sepanjang serabut saraf
|
Kelompok serat |
Diameter serat, m |
Kecepatan konduksi, m / s |
18. Hukum konduksi eksitasi sepanjang saraf. Klasifikasi serabut saraf. Kecepatan konduksi eksitasi di sepanjang serabut saraf, karakteristik usianya.
19. Struktur sinaps neuromuskular. Mekanisme transmisi eksitasi dari saraf ke otot.Potensi pelat ujung, sifat-sifatnya.
Sinapsis adalah kontak yang membentuk neuron sebagai formasi independen. Sinaps adalah struktur kompleks dan terdiri dari bagian prasinaps (ujung akson yang mengirimkan sinyal), celah sinaptik, dan bagian postsinaptik (struktur sel penerima).
Sinapsis neuromuskular memberikan konduksi eksitasi dari serat saraf ke otot satu berkat mediator asetilkolin, yang, ketika ujung saraf tereksitasi, masuk ke celah sinaptik dan bekerja pada pelat ujung serat otot.
Di terminal prasinaps, asetilkolin terbentuk dan terakumulasi dalam bentuk gelembung. Ketika tereksitasi oleh impuls listrik yang berjalan di sepanjang akson, bagian prasinaps sinaps, membrannya menjadi permeabel terhadap asetilkolin.
Permeabilitas ini dimungkinkan karena fakta bahwa sebagai akibat dari depolarisasi membran prasinaps, saluran kalsiumnya terbuka. Ion Ca2+ memasuki bagian prasinaps sinaps dari celah sinaptik. Asetilkolin dilepaskan dan memasuki celah sinaptik. Di sini ia berinteraksi dengan reseptornya di membran postsinaptik milik serat otot. Reseptor, ketika tereksitasi, membuka saluran protein yang dibangun ke dalam lapisan lipid membran. Melalui saluran terbuka, ion Na + menembus ke dalam sel otot, yang menyebabkan depolarisasi membran sel otot, menghasilkan perkembangan yang disebut potensial pelat akhir (EPP). Karena potensial ini biasanya selalu di atas ambang batas, hal itu menyebabkan potensial aksi yang menyebar di sepanjang serat otot dan menyebabkan kontraksi. Potensi pelat ujung pendek, karena asetilkolin, pertama, dengan cepat terlepas dari reseptor, dan kedua, AChE dihidrolisis.
Sinaps neuromuskular mentransmisikan eksitasi dalam satu arah: dari ujung saraf ke membran postsinaptik serat otot, yang disebabkan oleh adanya hubungan kimia dalam mekanisme transmisi neuromuskular.
Laju konduksi eksitasi melalui sinaps jauh lebih sedikit daripada di sepanjang serabut saraf, karena waktu dihabiskan di sini untuk aktivasi membran prasinaps, lewatnya kalsium melaluinya, pelepasan asetilkolin ke dalam celah sinaptik, depolarisasi membran postsinaptik, dan perkembangan EPP.