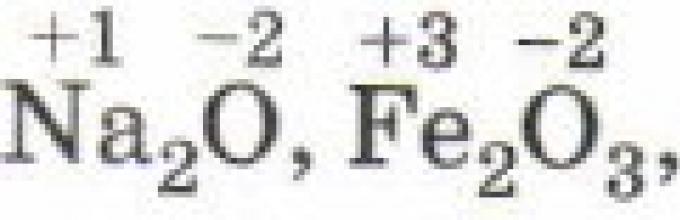Untuk mengkarakterisasi keadaan unsur-unsur dalam senyawa, konsep bilangan oksidasi diperkenalkan.
DEFINISI
Banyaknya elektron yang berpindah dari suatu atom suatu unsur atau ke atom suatu unsur dalam suatu senyawa disebut keadaan oksidasi.
Bilangan oksidasi positif menunjukkan jumlah elektron yang berpindah dari suatu atom, dan bilangan oksidasi negatif menunjukkan jumlah elektron yang berpindah ke atom tertentu.
Dari definisi ini dapat disimpulkan bahwa dalam senyawa dengan ikatan non-polar, bilangan oksidasi unsur-unsurnya adalah nol. Contoh senyawa tersebut adalah molekul yang terdiri dari atom identik (N 2, H 2, Cl 2).
Bilangan oksidasi logam dalam keadaan unsur adalah nol, karena distribusi kerapatan elektron di dalamnya seragam.
Dalam senyawa ionik sederhana, bilangan oksidasi unsur-unsur penyusunnya sama dengan muatan listrik, karena selama pembentukan senyawa ini terjadi perpindahan elektron yang hampir sempurna dari satu atom ke atom lainnya: Na +1 I -1, Mg +2 Cl -1 2, Al +3 F -1 3, Zr +4 Br - 1 4.
Saat menentukan bilangan oksidasi unsur-unsur dalam senyawa dengan ikatan kovalen polar, nilai elektronegativitasnya dibandingkan. Karena selama pembentukan ikatan kimia, elektron dipindahkan ke atom unsur yang lebih elektronegatif, unsur yang lebih elektronegatif memiliki bilangan oksidasi negatif dalam senyawa.
Keadaan oksidasi terendah
Untuk unsur-unsur yang menunjukkan bilangan oksidasi berbeda dalam senyawanya, terdapat konsep bilangan oksidasi tertinggi (positif maksimum) dan terendah (negatif minimum). Keadaan oksidasi terendah unsur kimia biasanya secara numerik sama dengan selisih antara nomor golongan dalam Tabel Periodik DI Mendeleev, tempat unsur kimianya berada, dan angka 8. Misalnya, nitrogen termasuk dalam golongan VA, yang berarti bilangan oksidasi terendahnya adalah (-3): V-VIII = - 3; belerang termasuk golongan VIA yang berarti bilangan oksidasi terendahnya adalah (-2): VI-VIII = -2, dst.
Contoh pemecahan masalah
CONTOH 1
DEFINISI
Keadaan oksidasi adalah penilaian kuantitatif keadaan atom suatu unsur kimia dalam suatu senyawa, berdasarkan elektronegativitasnya.
Dia menerima hal positif dan nilai-nilai negatif. Untuk menunjukkan bilangan oksidasi suatu unsur dalam suatu senyawa, Anda perlu menempatkan angka Arab dengan tanda yang sesuai (“+” atau “-”) di atas simbolnya.
Perlu diingat bahwa bilangan oksidasi adalah besaran yang tidak memiliki arti fisis, karena tidak mencerminkan muatan atom yang sebenarnya. Namun konsep ini sangat banyak digunakan dalam kimia.
Tabel bilangan oksidasi unsur kimia
Bilangan oksidasi positif maksimum dan negatif minimum dapat ditentukan dengan menggunakan Tabel Periodik D.I. Mendeleev. Jumlahnya sama dengan jumlah golongan di mana unsur tersebut berada dan selisih antara nilai bilangan oksidasi “tertinggi” dan angka 8.
Jika kita mempertimbangkan senyawa kimia lebih khusus lagi, pada zat dengan ikatan non-polar bilangan oksidasi unsur-unsurnya adalah nol (N 2, H 2, Cl 2).
Bilangan oksidasi logam dalam keadaan unsur adalah nol, karena distribusi kerapatan elektron di dalamnya seragam.
Dalam senyawa ionik sederhana, bilangan oksidasi unsur-unsur penyusunnya sama dengan muatan listrik, karena selama pembentukan senyawa ini terjadi transisi elektron yang hampir sempurna dari satu atom ke atom lainnya: Na +1 I -1, Mg +2 Cl -1 2, Al +3 F - 1 3 , Zr +4 Br -1 4 .
Saat menentukan bilangan oksidasi unsur-unsur dalam senyawa dengan ikatan kovalen polar, nilai elektronegativitasnya dibandingkan. Karena selama pembentukan ikatan kimia, elektron dipindahkan ke atom unsur yang lebih elektronegatif, unsur yang lebih elektronegatif memiliki bilangan oksidasi negatif dalam senyawa.
Ada unsur yang hanya mempunyai satu bilangan oksidasi (fluor, logam golongan IA dan IIA, dll.). Fluor, ditandai dengan nilai tertinggi keelektronegatifan, dalam senyawa selalu mempunyai bilangan oksidasi negatif yang konstan (-1).
Unsur alkali dan alkali tanah, yang mempunyai nilai keelektronegatifan yang relatif rendah, selalu mempunyai bilangan oksidasi positif masing-masing sebesar (+1) dan (+2).
Namun, ada juga unsur kimia yang mempunyai beberapa bilangan oksidasi (belerang - (-2), 0, (+2), (+4), (+6), dll.).
Untuk memudahkan mengingat berapa banyak dan apa bilangan oksidasi yang merupakan ciri suatu unsur kimia tertentu, gunakan tabel bilangan oksidasi suatu unsur kimia, yang tampilannya seperti ini:
|
Nomor seri |
Rusia / Inggris Nama |
Simbol kimia |
Keadaan oksidasi |
|
Hidrogen |
|||
|
Helium |
|||
|
Litium |
|||
|
Berilium |
|||
|
(-1), 0, (+1), (+2), (+3) |
|||
|
Karbon |
(-4), (-3), (-2), (-1), 0, (+2), (+4) |
||
|
Nitrogen / Nitrogen |
(-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
||
|
Oksigen |
(-2), (-1), 0, (+1), (+2) |
||
|
Fluor |
|||
|
Natrium/Natrium |
|||
|
Magnesium/Magnesium |
|||
|
Aluminium |
|||
|
Silikon |
(-4), 0, (+2), (+4) |
||
|
Fosfor / Fosfor |
(-3), 0, (+3), (+5) |
||
|
Belerang/Belerang |
(-2), 0, (+4), (+6) |
||
|
Klorin |
(-1), 0, (+1), (+3), (+5), (+7), jarang (+2) dan (+4) |
||
|
Argon / Argon |
|||
|
Kalium / Kalium |
|||
|
Kalsium |
|||
|
Skandium / Skandium |
|||
|
titanium |
(+2), (+3), (+4) |
||
|
Vanadium |
(+2), (+3), (+4), (+5) |
||
|
Krom / Kromium |
(+2), (+3), (+6) |
||
|
Mangan / Mangan |
(+2), (+3), (+4), (+6), (+7) |
||
|
Besi |
(+2), (+3), jarang (+4) dan (+6) |
||
|
Kobalt |
(+2), (+3), jarang (+4) |
||
|
Nikel |
(+2), jarang (+1), (+3) dan (+4) |
||
|
Tembaga |
+1, +2, jarang (+3) |
||
|
galium |
(+3), jarang (+2) |
||
|
Germanium / Germanium |
(-4), (+2), (+4) |
||
|
Arsenik/Arsenik |
(-3), (+3), (+5), jarang (+2) |
||
|
Selenium |
(-2), (+4), (+6), jarang (+2) |
||
|
Brom |
(-1), (+1), (+5), jarang (+3), (+4) |
||
|
Kripton / Kripton |
|||
|
Rubidium / Rubidium |
|||
|
Strontium / Strontium |
|||
|
Itrium / Itrium |
|||
|
Zirkonium / Zirkonium |
(+4), jarang (+2) dan (+3) |
||
|
Niobium / Niobium |
(+3), (+5), jarang (+2) dan (+4) |
||
|
Molibdenum |
(+3), (+6), jarang (+2), (+3) dan (+5) |
||
|
teknesium / teknesium |
|||
|
Rutenium / Rutenium |
(+3), (+4), (+8), jarang (+2), (+6) dan (+7) |
||
|
Rhodium |
(+4), jarang (+2), (+3) dan (+6) |
||
|
Paladium |
(+2), (+4), jarang (+6) |
||
|
Perak |
(+1), jarang (+2) dan (+3) |
||
|
Kadmium |
(+2), jarang (+1) |
||
|
India |
(+3), jarang (+1) dan (+2) |
||
|
Timah/Timah |
(+2), (+4) |
||
|
Antimon / Antimon |
(-3), (+3), (+5), jarang (+4) |
||
|
Telurium / Telurium |
(-2), (+4), (+6), jarang (+2) |
||
|
(-1), (+1), (+5), (+7), jarang (+3), (+4) |
|||
|
Xenon / Xenon |
|||
|
sesium |
|||
|
Barium / Barium |
|||
|
Lantanum / Lantanum |
|||
|
Cerium |
(+3), (+4) |
||
|
Praseodymium / Praseodymium |
|||
|
Neodimium / Neodimium |
(+3), (+4) |
||
|
Prometium / Prometium |
|||
|
Samarium / Samarium |
(+3), jarang (+2) |
||
|
Europium |
(+3), jarang (+2) |
||
|
Gadolinium / Gadolinium |
|||
|
Terbium / Terbium |
(+3), (+4) |
||
|
Disprosium / Disprosium |
|||
|
Holmium |
|||
|
Erbium |
|||
|
Thulium |
(+3), jarang (+2) |
||
|
Ytterbium / Ytterbium |
(+3), jarang (+2) |
||
|
Lutetium / Lutetium |
|||
|
Hafnium / Hafnium |
|||
|
Tantalum / Tantalum |
(+5), jarang (+3), (+4) |
||
|
Tungsten/Tungsten |
(+6), jarang (+2), (+3), (+4) dan (+5) |
||
|
Renium / Renium |
(+2), (+4), (+6), (+7), jarang (-1), (+1), (+3), (+5) |
||
|
Osmium / Osmium |
(+3), (+4), (+6), (+8), jarang (+2) |
||
|
Iridium/Iridium |
(+3), (+4), (+6), jarang (+1) dan (+2) |
||
|
Platinum |
(+2), (+4), (+6), jarang (+1) dan (+3) |
||
|
Emas |
(+1), (+3), jarang (+2) |
||
|
Air raksa |
(+1), (+2) |
||
|
Talium / Talium |
(+1), (+3), jarang (+2) |
||
|
Memimpin/Memimpin |
(+2), (+4) |
||
|
Bismut |
(+3), jarang (+3), (+2), (+4) dan (+5) |
||
|
Polonium |
(+2), (+4), jarang (-2) dan (+6) |
||
|
Astatin |
|||
|
Radon / Radon |
|||
|
Fransium |
|||
|
Radium |
|||
|
Aktinium |
|||
|
Torium |
|||
|
Proaktinium / Protaktinium |
|||
|
Uranium / Uranium |
(+3), (+4), (+6), jarang (+2) dan (+5) |
Contoh pemecahan masalah
CONTOH 1
- Bilangan oksidasi fosfor dalam fosfin adalah (-3), dan dalam asam ortofosfat - (+5). Perubahan bilangan oksidasi fosfor: +3 → +5, mis. pilihan jawaban pertama.
- Bilangan oksidasi suatu unsur kimia dalam zat sederhana adalah nol. Bilangan oksidasi fosfor dalam oksida dengan komposisi P 2 O 5 adalah (+5). Perubahan bilangan oksidasi fosfor: 0 → +5, mis. pilihan jawaban ketiga.
- Bilangan oksidasi fosfor dalam komposisi asam HPO 3 adalah (+5), dan H 3 PO 2 adalah (+1). Perubahan bilangan oksidasi fosfor: +5 → +1, mis. pilihan jawaban kelima.
CONTOH 2
| Latihan | Bilangan oksidasi (-3) karbon dalam senyawa tersebut adalah: a) CH 3 Cl; b) C 2 H 2; c) HCOOH; d) C 2 H 6. |
| Larutan | Untuk memberikan jawaban yang benar atas pertanyaan yang diajukan, kita akan menentukan bilangan oksidasi karbon pada setiap senyawa yang diajukan secara bergantian. a) bilangan oksidasi hidrogen adalah (+1), dan bilangan oksidasi klor adalah (-1). Mari kita ambil bilangan oksidasi karbon sebagai “x”: x + 3×1 + (-1) =0; Jawabannya salah. b) bilangan oksidasi hidrogen adalah (+1). Mari kita ambil bilangan oksidasi karbon sebagai “y”: 2×kamu + 2×1 = 0; Jawabannya salah. c) bilangan oksidasi hidrogen adalah (+1), dan oksigen adalah (-2). Mari kita ambil bilangan oksidasi karbon sebagai “z”: 1 + z + (-2) +1 = 0: Jawabannya salah. d) bilangan oksidasi hidrogen adalah (+1). Mari kita ambil bilangan oksidasi karbon sebagai “a”: 2×a + 6×1 = 0; Jawaban yang benar. |
| Menjawab | Opsi (d) |
Saat mempelajari ikatan kimia polar ionik dan kovalen, Anda sudah familiar dengannya zat kompleks, terdiri dari dua unsur kimia. Zat semacam itu disebut biner (dari bahasa Latin bi - dua) atau dua unsur.
Mari kita mengingat kembali senyawa biner khas yang kita kutip sebagai contoh untuk mempertimbangkan mekanisme pembentukan ikatan kimia polar ionik dan kovalen: NaCl - natrium klorida dan HCl - hidrogen klorida.
Dalam kasus pertama, ikatannya bersifat ionik: atom natrium mentransfer elektron terluarnya ke atom klor dan berubah menjadi ion bermuatan +1, dan atom klor menerima elektron dan berubah menjadi ion bermuatan - 1. Secara skematis proses pengubahan atom menjadi ion dapat digambarkan sebagai berikut:
Dalam molekul hidrogen klorida HC1, ikatan kimia terbentuk karena pasangan elektron eksternal yang tidak berpasangan dan pembentukan pasangan elektron yang sama dari atom hidrogen dan klor:
Lebih tepat membayangkan pembentukan ikatan kovalen dalam molekul hidrogen klorida sebagai tumpang tindih awan s satu elektron atom hidrogen dengan awan p satu elektron atom klor:
Pada interaksi kimia pasangan elektron bersama bergeser ke arah atom klor yang lebih elektronegatif: , yaitu, elektron tidak akan berpindah seluruhnya dari atom hidrogen ke atom klor, tetapi sebagian, sehingga menentukan muatan parsial atom 5 (lihat § 12): . Jika kita membayangkan bahwa dalam molekul hidrogen klorida HCl, serta dalam natrium klorida NaCl, elektron telah berpindah seluruhnya dari atom hidrogen ke atom klor, maka mereka akan menerima muatan +1 dan -1: . Muatan konvensional seperti itu disebut bilangan oksidasi. Ketika mendefinisikan konsep ini, secara konvensional diasumsikan bahwa dalam senyawa kovalen polar, elektron ikatan ditransfer sepenuhnya ke atom yang lebih elektronegatif, dan oleh karena itu senyawa tersebut hanya terdiri dari ion bermuatan positif dan negatif.
Bilangan oksidasi dapat mempunyai nilai negatif, positif atau nol, yang biasanya ditempatkan di atas simbol unsur di atas, misalnya:
Atom-atom yang telah menerima elektron dari atom lain atau yang pasangan elektronnya dipindahkan, yaitu atom dari unsur yang lebih elektronegatif, memiliki bilangan oksidasi negatif. Fluor selalu memiliki bilangan oksidasi -1 di semua senyawa. Oksigen, unsur kedua setelah fluor dalam hal keelektronegatifan, hampir selalu memiliki bilangan oksidasi -2, kecuali senyawa dengan fluor, misalnya:
![]()
Bilangan oksidasi positif diberikan kepada atom-atom yang menyumbangkan elektronnya ke atom lain atau dari mana pasangan elektron yang sama diambil, yaitu atom dari unsur yang kurang elektronegatif. Logam dalam senyawa selalu mempunyai bilangan oksidasi positif. Untuk logam dari subkelompok utama: golongan I (golongan IA) pada semua senyawa bilangan oksidasinya +1, golongan II (golongan IIA) adalah +2, golongan III (golongan IIIA) adalah +3, contoh:
![]()
![]()
tetapi dalam senyawa dengan logam, hidrogen memiliki bilangan oksidasi -1:
![]()
Atom dalam molekul mempunyai bilangan oksidasi nol zat sederhana dan atom dalam keadaan bebas, misalnya:
Dekat dengan konsep “bilangan oksidasi” adalah konsep “valensi”, yang sudah Anda kenal ketika mempertimbangkan kovalen ikatan kimia. Namun, ini bukanlah hal yang sama.
Konsep “valensi” berlaku untuk zat yang memiliki struktur molekul. Mayoritas bahan organik, yang akan Anda kenali di kelas 10, memiliki struktur persis seperti ini. Di mata pelajaran sekolah dasar, Anda mempelajari kimia anorganik, yang pokok bahasannya adalah zat-zat yang berstruktur molekul dan non-molekul, misalnya ionik. Oleh karena itu, lebih baik menggunakan konsep “keadaan oksidasi”.
Apa perbedaan antara valensi dan bilangan oksidasi?
Seringkali bilangan valensi dan oksidasi sama secara numerik, tetapi valensi tidak mempunyai tanda muatan, tetapi bilangan oksidasi mempunyai tanda muatan. Misalnya, hidrogen monovalen memiliki bilangan oksidasi berikut: berbagai zat Oh:
![]()
Tampaknya fluor monovalen, unsur paling elektronegatif, seharusnya memiliki bilangan oksidasi dan nilai valensi yang sama persis. Bagaimanapun, atomnya hanya mampu membentuk satu atom tunggal Ikatan kovalen, karena ia kekurangan satu elektron untuk melengkapi lapisan elektron terluar. Namun, ada perbedaan juga di sini:
Valensi dan bilangan oksidasi akan semakin berbeda jika keduanya tidak bertepatan secara numerik. Misalnya:
Dalam senyawa, bilangan oksidasi total selalu nol. Mengetahui hal ini dan bilangan oksidasi salah satu unsur, Anda dapat mencari bilangan oksidasi unsur lain menggunakan rumus, misalnya senyawa biner. Jadi, mari kita cari bilangan oksidasi klorin dalam senyawa C1 2 O 7.
Mari kita nyatakan bilangan oksidasi oksigen: . Oleh karena itu, tujuh atom oksigen akan mempunyai muatan negatif total (-2) × 7 = -14. Maka muatan total dua atom klor akan sama dengan +14, dan satu atom klor: (+14) : 2 = +7. Oleh karena itu, bilangan oksidasi klorin adalah .
Demikian pula, dengan mengetahui bilangan oksidasi suatu unsur, Anda dapat membuat rumus suatu senyawa, misalnya aluminium karbida (senyawa aluminium dan karbon).
Sangat mudah untuk melihat bahwa Anda bekerja dengan cara yang sama dengan konsep “valensi” ketika Anda menurunkan rumus senyawa kovalen atau menentukan valensi suatu unsur dari rumus senyawanya.
Nama-nama senyawa biner dibentuk dari dua kata – nama unsur kimia penyusunnya. Kata pertama menunjukkan bagian elektronegatif senyawa - bukan logam; nama Latinnya dengan akhiran -id selalu muncul di kasus nominatif. Kata kedua menunjukkan bagian elektropositif - unsur logam atau kurang elektronegatif; namanya selalu muncul di kasus genitif:
Misalnya: NaCl - natrium klorida, MgS - magnesium sulfida, KH - kalium hidrida, CaO - kalsium oksida. Apabila suatu unsur elektropositif mempunyai bilangan oksidasi yang berbeda, maka hal ini tercermin pada namanya, yang menunjukkan bilangan oksidasi tersebut dengan angka romawi yang diletakkan di akhir namanya, contoh: - besi (II) oksida (baca “besi oksida dua”), - besi (III) oksida (baca “besi oksida tiga”).
Jika suatu senyawa terdiri dari dua unsur bukan logam, maka akhiran -id ditambahkan pada nama unsur yang lebih elektronegatif, dan komponen kedua ditempatkan setelahnya dalam kasus genitif. Contoh : - oksigen fluorida (II), - sulfur oksida (IV) dan - sulfur oksida (VI).
Dalam beberapa kasus, jumlah atom suatu unsur ditunjukkan menggunakan nama angka dalam bahasa Yunani - mono, di, tri, tetra, penta, hexa, dll. Misalnya: - karbon monoksida, atau karbon oksida (II), - karbon dioksida, atau karbon oksida (IV), - timbal tetraklorida, atau timbal (IV) klorida.
Untuk ahli kimia negara lain saling memahami, perlu diciptakan kesatuan terminologi dan nomenklatur zat. Prinsip tata nama kimia pertama kali dikembangkan oleh ahli kimia Perancis A. Lavoisier, A. Fourcroix, L. Guiton de Mervo dan C. Berthollet pada tahun 1785. Saat ini, Persatuan Internasional Kimia Murni dan Terapan (IUPAC) mengoordinasikan kegiatan ilmuwan dari berbagai negara dan mengeluarkan rekomendasi tentang tata nama zat dan terminologi yang digunakan dalam kimia.
Kata kunci dan frase
- Senyawa biner, atau dua unsur.
- Keadaan oksidasi.
- Tata nama kimia.
- Penentuan bilangan oksidasi unsur menggunakan rumus.
- Menyusun rumus senyawa biner menurut bilangan oksidasi unsur.
Bekerja dengan komputer
- Lihat aplikasi elektronik. Pelajari materi pelajaran dan selesaikan tugas yang diberikan.
- Temukan alamat email di Internet yang dapat berfungsi sebagai sumber tambahan yang mengungkap isi kata kunci dan frasa dalam paragraf. Tawarkan bantuan Anda kepada guru dalam mempersiapkan pelajaran baru - buatlah laporan tentang kata dan frasa kunci pada paragraf berikutnya.
Pertanyaan dan tugas
- Tuliskan rumus nitrogen oksida (II), (V), (I), (III), (IV).
- Sebutkan nama senyawa biner yang rumusnya adalah: a) C1 2 0 7, C1 2 O, C1O 2; b) FeCl 2, FeCl 3; c) MnS, MnO 2, MnF 4, MnO, MnCl 4; r) Cu 2 O, Mg 2 Si, SiCl 4, Na 3 N, FeS.
- Temukan di buku referensi dan kamus semua kemungkinan nama zat dengan rumus: a) CO 2 dan CO; b) JADI 2 dan JADI 3. Jelaskan etimologinya. Berikan dua nama zat tersebut menurut nomenklatur internasional sesuai dengan aturan yang ditetapkan dalam paragraf.
- Apa nama lain yang dapat diberikan untuk amonia H 3 N?
- Temukan volume yang mereka miliki di n. kamu. 17 g hidrogen sulfida.
- Berapa banyak molekul yang ada dalam volume ini?
- Hitung massa 33,6 m3 metana CH 2 di udara. kamu. dan tentukan jumlah molekulnya yang terkandung dalam volume ini.
- Tentukan bilangan oksidasi karbon dan tuliskan rumus struktur zat berikut, mengetahui bahwa ada karbon di dalamnya senyawa organik selalu tetravalen: metana CH 4, karbon tetraklorida CC1 4, etana C 2 H 4, asetilena C 2 H 2.
Bilangan oksidasi adalah muatan bersyarat atom-atom suatu unsur kimia dalam suatu senyawa, dihitung dari asumsi bahwa semua ikatan mempunyai tipe ion. Bilangan oksidasi dapat bernilai positif, negatif, atau nol, oleh karena itu jumlah aljabar bilangan oksidasi unsur-unsur dalam suatu molekul, dengan memperhitungkan jumlah atomnya, sama dengan 0, dan dalam suatu ion - muatan ionnya. .
Daftar bilangan oksidasi ini menunjukkan semua bilangan oksidasi yang diketahui dari unsur-unsur kimia dalam tabel periodik. Daftar ini didasarkan pada tabel Greenwood dengan semua tambahan. Garis yang disorot berwarna mengandung gas inert yang bilangan oksidasinya nol.
| 1 | −1 | H | +1 | ||||||||||
| 2 | Dia | ||||||||||||
| 3 | Li | +1 | |||||||||||
| 4 | -3 | Menjadi | +1 | +2 | |||||||||
| 5 | −1 | B | +1 | +2 | +3 | ||||||||
| 6 | −4 | −3 | −2 | −1 | C | +1 | +2 | +3 | +4 | ||||
| 7 | −3 | −2 | −1 | N | +1 | +2 | +3 | +4 | +5 | ||||
| 8 | −2 | −1 | HAI | +1 | +2 | ||||||||
| 9 | −1 | F | +1 | ||||||||||
| 10 | Tidak | ||||||||||||
| 11 | −1 | Tidak | +1 | ||||||||||
| 12 | mg | +1 | +2 | ||||||||||
| 13 | Al | +3 | |||||||||||
| 14 | −4 | −3 | −2 | −1 | Ya | +1 | +2 | +3 | +4 | ||||
| 15 | −3 | −2 | −1 | P | +1 | +2 | +3 | +4 | +5 | ||||
| 16 | −2 | −1 | S | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 17 | −1 | Kl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| 18 | Ar | ||||||||||||
| 19 | K | +1 | |||||||||||
| 20 | Ca | +2 | |||||||||||
| 21 | Sc | +1 | +2 | +3 | |||||||||
| 22 | −1 | Ti | +2 | +3 | +4 | ||||||||
| 23 | −1 | V | +1 | +2 | +3 | +4 | +5 | ||||||
| 24 | −2 | −1 | Kr | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 25 | −3 | −2 | −1 | M N | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||
| 26 | −2 | −1 | Fe | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 27 | −1 | Bersama | +1 | +2 | +3 | +4 | +5 | ||||||
| 28 | −1 | Tidak | +1 | +2 | +3 | +4 | |||||||
| 29 | Cu | +1 | +2 | +3 | +4 | ||||||||
| 30 | Zn | +2 | |||||||||||
| 31 | Ga | +1 | +2 | +3 | |||||||||
| 32 | −4 | Ge | +1 | +2 | +3 | +4 | |||||||
| 33 | −3 | Sebagai | +2 | +3 | +5 | ||||||||
| 34 | −2 | Ya | +2 | +4 | +6 | ||||||||
| 35 | −1 | Sdr | +1 | +3 | +4 | +5 | +7 | ||||||
| 36 | Kr | +2 | |||||||||||
| 37 | Rb | +1 | |||||||||||
| 38 | Sr | +2 | |||||||||||
| 39 | Y | +1 | +2 | +3 | |||||||||
| 40 | Zr | +1 | +2 | +3 | +4 | ||||||||
| 41 | −1 | Catatan | +2 | +3 | +4 | +5 | |||||||
| 42 | −2 | −1 | Mo | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 43 | −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| 44 | −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |||
| 45 | −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| 46 | Pd | +2 | +4 | ||||||||||
| 47 | Agustus | +1 | +2 | +3 | |||||||||
| 48 | CD | +2 | |||||||||||
| 49 | Di dalam | +1 | +2 | +3 | |||||||||
| 50 | −4 | sn | +2 | +4 | |||||||||
| 51 | −3 | Sb | +3 | +5 | |||||||||
| 52 | −2 | Te | +2 | +4 | +5 | +6 | |||||||
| 53 | −1 | SAYA | +1 | +3 | +5 | +7 | |||||||
| 54 | Xe | +2 | +4 | +6 | +8 | ||||||||
| 55 | Cs | +1 | |||||||||||
| 56 | Ba | +2 | |||||||||||
| 57 | La | +2 | +3 | ||||||||||
| 58 | Ce | +2 | +3 | +4 | |||||||||
| 59 | PR | +2 | +3 | +4 | |||||||||
| 60 | Tidak | +2 | +3 | ||||||||||
| 61 | Pm | +3 | |||||||||||
| 62 | Sm | +2 | +3 | ||||||||||
| 63 | Uni Eropa | +2 | +3 | ||||||||||
| 64 | Tuhan | +1 | +2 | +3 | |||||||||
| 65 | Tb | +1 | +3 | +4 | |||||||||
| 66 | Mati | +2 | +3 | ||||||||||
| 67 | Ho | +3 | |||||||||||
| 68 | Eh | +3 | |||||||||||
| 69 | Tm | +2 | +3 | ||||||||||
| 70 | Yb | +2 | +3 | ||||||||||
| 71 | Lu | +3 | |||||||||||
| 72 | HF | +2 | +3 | +4 | |||||||||
| 73 | −1 | Ta | +2 | +3 | +4 | +5 | |||||||
| 74 | −2 | −1 | W | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 75 | −3 | −1 | Ulang | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| 76 | −2 | −1 | Os | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||
| 77 | −3 | −1 | Ir | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 78 | Pt | +2 | +4 | +5 | +6 | ||||||||
| 79 | −1 | Au | +1 | +2 | +3 | +5 | |||||||
| 80 | HG | +1 | +2 | +4 | |||||||||
| 81 | Tl | +1 | +3 | ||||||||||
| 82 | −4 | hal | +2 | +4 | |||||||||
| 83 | −3 | Dua | +3 | +5 | |||||||||
| 84 | −2 | Po | +2 | +4 | +6 | ||||||||
| 85 | −1 | Pada | +1 | +3 | +5 | ||||||||
| 86 | Rn | +2 | +4 | +6 | |||||||||
| 87 | Pdt | +1 | |||||||||||
| 88 | Ra | +2 | |||||||||||
| 89 | Ac | +3 | |||||||||||
| 90 | Th | +2 | +3 | +4 | |||||||||
| 91 | Pa | +3 | +4 | +5 | |||||||||
| 92 | kamu | +3 | +4 | +5 | +6 | ||||||||
| 93 | Np | +3 | +4 | +5 | +6 | +7 | |||||||
| 94 | Pu | +3 | +4 | +5 | +6 | +7 | |||||||
| 95 | Saya | +2 | +3 | +4 | +5 | +6 | |||||||
| 96 | Cm | +3 | +4 | ||||||||||
| 97 | Bk | +3 | +4 | ||||||||||
| 98 | Lih | +2 | +3 | +4 | |||||||||
| 99 | Ya | +2 | +3 | ||||||||||
| 100 | FM | +2 | +3 | ||||||||||
| 101 | MD | +2 | +3 | ||||||||||
| 102 | TIDAK | +2 | +3 | ||||||||||
| 103 | Lr | +3 | |||||||||||
| 104 | Rf | +4 | |||||||||||
| 105 | Db | +5 | |||||||||||
| 106 | Sg | +6 | |||||||||||
| 107 | Bh | +7 | |||||||||||
| 108 | Hs | +8 |
Bilangan oksidasi tertinggi suatu unsur sesuai dengan nomor golongannya tabel periodik, dimana unsur ini berada (pengecualian adalah: Au+3 (golongan I), Cu+2 (II), dari golongan VIII bilangan oksidasi +8 hanya dapat ditemukan pada osmium Os dan rutenium Ru.
Keadaan oksidasi logam dalam senyawa
Bilangan oksidasi logam dalam senyawa selalu positif, tetapi jika kita berbicara tentang nonlogam, maka bilangan oksidasinya bergantung pada atom mana unsur tersebut terikat:
- jika dengan atom nonlogam, maka bilangan oksidasinya bisa positif atau negatif. Itu tergantung pada keelektronegatifan atom unsur;
- jika dengan atom logam, maka bilangan oksidasinya negatif.
Bilangan oksidasi negatif bukan logam
Bilangan oksidasi negatif tertinggi dari nonlogam dapat ditentukan dengan mengurangkan 8 bilangan golongan dimana unsur kimia tersebut berada, yaitu. bilangan oksidasi positif tertinggi sama dengan jumlah elektron pada lapisan terluar, yang sesuai dengan nomor golongannya.
Harap dicatat bahwa bilangan oksidasi zat sederhana adalah 0, terlepas dari apakah itu logam atau non-logam.
Sumber:
- Kayu Hijau, Norman N.; Earnshaw, A. Kimia Unsur - edisi ke-2. - Oxford: Butterworth-Heinemann, 1997
- Senyawa Magnesium(I) Stabil Hijau dengan Ikatan Mg-Mg / Jones C.; Stasch A.. - Majalah Sains, 2007. - Desember (edisi 318 (No. 5857)
- Majalah Sains, 1970. - Jil. 3929. - No.168. - Hal.362.
- Jurnal Masyarakat Kimia, Komunikasi Kimia, 1975. - hlm.760b-761.
- Irving Langmuir Susunan elektron dalam atom dan molekul. - Majalah J.Am kimia. Soc., 1919. - Edisi. 41.
Dalam proses kimia Pemeran utama atom dan molekul bermain, sifat-sifatnya menentukan hasilnya reaksi kimia. Salah satu karakteristik penting suatu atom adalah bilangan oksidasi, yang menyederhanakan metode penghitungan transfer elektron dalam suatu partikel. Bagaimana cara menentukan bilangan oksidasi atau muatan formal suatu partikel dan aturan apa yang perlu Anda ketahui untuk ini?
Definisi
Setiap reaksi kimia disebabkan oleh interaksi atom-atom zat yang berbeda. Proses reaksi dan hasilnya bergantung pada karakteristik partikel terkecil.
Istilah oksidasi (oksidasi) dalam kimia berarti suatu reaksi di mana sekelompok atom atau salah satu atom tersebut kehilangan atau memperoleh elektron; dalam hal perolehan, reaksi tersebut disebut “reduksi”.
Bilangan oksidasi adalah besaran yang diukur secara kuantitatif dan mencirikan elektron yang terdistribusi ulang selama suatu reaksi. Itu. Selama proses oksidasi, elektron dalam suatu atom berkurang atau bertambah, didistribusikan kembali di antara partikel-partikel lain yang berinteraksi, dan tingkat oksidasi menunjukkan dengan tepat bagaimana mereka ditata ulang. Konsep ini berkaitan erat dengan keelektronegatifan partikel - kemampuannya untuk menarik dan menolak ion bebas.
Penentuan tingkat oksidasi bergantung pada karakteristik dan sifat suatu zat tertentu, sehingga prosedur perhitungannya tidak dapat disebut mudah atau rumit, tetapi hasilnya membantu mencatat proses reaksi redoks secara kondisional. Perlu dipahami bahwa hasil perhitungan yang dihasilkan merupakan hasil memperhitungkan perpindahan elektron dan tidak mempunyai arti fisis, serta bukan merupakan muatan inti sebenarnya.
Penting untuk diketahui! Kimia anorganik sering menggunakan istilah valensi daripada bilangan oksidasi unsur, hal ini tidak salah, namun perlu diingat bahwa konsep kedua lebih universal.
Konsep dan aturan penghitungan pergerakan elektron menjadi dasar klasifikasi zat kimia(tata nama), deskripsi sifat-sifatnya dan penyusunan rumus komunikasi. Namun paling sering konsep ini digunakan untuk mendeskripsikan dan menangani reaksi redoks.
Aturan untuk menentukan keadaan oksidasi
Bagaimana cara mengetahui bilangan oksidasi? Saat menangani reaksi redoks, penting untuk diketahui bahwa muatan formal suatu partikel akan selalu sama dengan nilai elektron, yang dinyatakan dalam nilai numerik. Ciri ini disebabkan oleh asumsi bahwa pasangan elektron yang membentuk suatu ikatan selalu bergeser seluruhnya ke arah partikel yang lebih negatif. Harus dipahami apa yang sedang kita bicarakan ikatan ionik, dan dalam kasus reaksi di elektron akan dibagi rata antara partikel yang identik.
Bilangan oksidasi dapat mempunyai nilai positif dan negatif. Masalahnya adalah bahwa selama reaksi, atom harus menjadi netral, dan untuk itu perlu menambahkan sejumlah elektron ke ion, jika positif, atau menghilangkannya jika negatif. Untuk menunjukkan konsep ini, ketika menulis suatu rumus, biasanya dituliskan angka arab dengan tanda yang sesuai di atas penunjukan unsur. Misalnya, atau dll.
Anda harus tahu bahwa muatan formal logam akan selalu positif, dan dalam banyak kasus, Anda dapat menggunakan tabel periodik untuk menentukannya. Ada beberapa ciri yang harus diperhatikan untuk menentukan indikator dengan benar.

Derajat oksidasi:
Dengan mengingat ciri-ciri ini, akan sangat mudah untuk menentukan bilangan oksidasi suatu unsur, terlepas dari kompleksitas dan jumlah tingkat atomnya.
Video yang bermanfaat: menentukan bilangan oksidasi
Tabel periodik Mendeleev berisi hampir semua informasi yang diperlukan untuk bekerja dengan unsur kimia. Misalnya, anak sekolah hanya menggunakannya untuk menggambarkan reaksi kimia. Jadi, untuk menentukan nilai maksimum bilangan oksidasi positif dan negatif, Anda perlu memeriksa penunjukan unsur kimia dalam tabel:
- Positif maksimum adalah banyaknya golongan dimana unsur tersebut berada.
- Bilangan oksidasi negatif maksimum adalah selisih antara batas positif maksimum dan bilangan 8.
Jadi, cukup dengan mengetahui batas ekstrim muatan formal suatu unsur tertentu. Tindakan ini dapat dilakukan dengan menggunakan perhitungan berdasarkan tabel periodik.
Penting untuk diketahui! Satu unsur dapat secara bersamaan memiliki beberapa laju oksidasi yang berbeda.
Ada dua metode utama untuk menentukan tingkat oksidasi, contohnya disajikan di bawah ini. Yang pertama adalah metode yang membutuhkan pengetahuan dan kemampuan menerapkan hukum-hukum kimia. Bagaimana cara mengatur bilangan oksidasi menggunakan metode ini?

Aturan untuk menentukan bilangan oksidasi
Untuk melakukan ini, Anda perlu:
- Tentukan apakah suatu zat merupakan unsur dan apakah zat tersebut berada di luar ikatan. Jika demikian, maka bilangan oksidasinya akan menjadi 0, apapun komposisi zatnya (atom individu atau senyawa atom bertingkat).
- Tentukan apakah zat tersebut terdiri dari ion. Jika demikian, maka bilangan oksidasinya akan sama dengan muatannya.
- Jika zat yang dimaksud adalah logam, maka lihatlah indikator zat lain pada rumus dan hitung pembacaan logam menggunakan operasi aritmatika.
- Jika seluruh senyawa mempunyai satu muatan (pada dasarnya itu adalah jumlah semua partikel unsur yang diwakili), maka cukup menentukan indikator zat sederhana, kemudian kurangi dari total dan dapatkan data logamnya.
- Jika hubungannya netral, maka jumlah totalnya harus nol.
Sebagai contoh, pertimbangkan penggabungan dengan ion aluminium yang muatan bersihnya nol. Aturan kimia menegaskan fakta bahwa ion Cl memiliki bilangan oksidasi -1, dan dalam hal ini ada tiga ion dalam senyawa. Artinya ion Al harus +3 agar seluruh senyawa menjadi netral.
Metode ini sangat baik, karena kebenaran larutan selalu dapat diperiksa dengan menjumlahkan semua tingkat oksidasi.
Metode kedua dapat digunakan tanpa mengetahui hukum kimia:
- Temukan data partikel yang tidak memiliki aturan ketat dan jumlah pasti elektronnya tidak diketahui (hal ini dapat dilakukan dengan pengecualian).
- Cari tahu indikator semua partikel lainnya dan kemudian temukan partikel yang diinginkan dari jumlah totalnya dengan pengurangan.
Mari kita perhatikan cara kedua dengan menggunakan contoh zat Na2SO4, dimana atom belerang S tidak ditentukan, hanya diketahui berbeda dari nol.
Untuk mengetahui persamaan semua bilangan oksidasi:
- Temukan elemen yang diketahui, dengan mengingat aturan dan pengecualian tradisional.
- Ion Na = +1, dan setiap oksigen = -2.
- Kalikan jumlah partikel setiap zat dengan elektronnya untuk mendapatkan bilangan oksidasi semua atom kecuali satu.
- Na2SO4 mengandung 2 natrium dan 4 oksigen; jika dikalikan diperoleh: 2 X +1 = 2 adalah bilangan oksidasi seluruh partikel natrium dan 4 X -2 = -8 - oksigen.
- Tambahkan hasil yang diperoleh 2+(-8) =-6 - ini adalah muatan total senyawa tanpa partikel belerang.
- Nyatakan notasi kimia sebagai persamaan: jumlah data yang diketahui + bilangan yang tidak diketahui = muatan total.
- Na2SO4 direpresentasikan sebagai berikut: -6 + S = 0, S = 0 + 6, S = 6.
Jadi, untuk menggunakan cara kedua, cukup mengetahui hukum aritmatika sederhana.