Tupai- berat molekul tinggi senyawa organik, terdiri dari residu asam α-amino.
DI DALAM komposisi protein termasuk karbon, hidrogen, nitrogen, oksigen, belerang. Beberapa protein membentuk kompleks dengan molekul lain yang mengandung fosfor, besi, seng, dan tembaga.
Protein memiliki berat molekul besar: albumin telur - 36.000, hemoglobin - 152.000, miosin - 500.000 Sebagai perbandingan: berat molekul alkohol adalah 46, asam asetat- 60, benzena - 78.
Komposisi asam amino protein
Tupai- polimer non-periodik, yang monomernya adalah asam α-amino. Biasanya, 20 jenis asam α-amino disebut monomer protein, meskipun lebih dari 170 di antaranya ditemukan di sel dan jaringan.
Tergantung pada apakah asam amino dapat disintesis dalam tubuh manusia dan hewan lain, ada: asam amino nonesensial- dapat disintesis; asam amino esensial- tidak dapat disintesis. Asam amino esensial harus masuk ke dalam tubuh dengan makanan. Tumbuhan mensintesis semua jenis asam amino.
Tergantung pada komposisi asam aminonya, protein adalah: lengkap- mengandung seluruh rangkaian asam amino; cacat- beberapa asam amino hilang dalam komposisinya. Jika protein hanya terdiri dari asam amino, maka disebut sederhana. Jika protein mengandung, selain asam amino, komponen non-asam amino (gugus prostetik), maka disebut kompleks. Gugus prostetik dapat diwakili oleh logam (metaloprotein), karbohidrat (glikoprotein), lipid (lipoprotein), asam nukleat (nukleoprotein).
Semua mengandung asam amino: 1) gugus karboksil (-COOH), 2) gugus amino (-NH 2), 3) radikal atau gugus R (sisa molekul). Struktur radikal jenis yang berbeda asam amino - beragam. Tergantung pada jumlah gugus amino dan gugus karboksil yang termasuk dalam asam amino, mereka dibedakan: asam amino netral memiliki satu gugus karboksil dan satu gugus amino; asam amino basa memiliki lebih dari satu gugus amino; asam amino yang bersifat asam mempunyai lebih dari satu gugus karboksil.
Asam amino adalah senyawa amfoter , karena dalam larutan mereka dapat bertindak sebagai asam dan basa. DI DALAM larutan berair asam amino ada dalam bentuk ionik yang berbeda.
Ikatan peptida
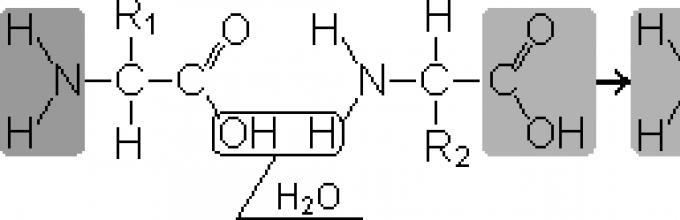
Peptida- zat organik yang terdiri dari residu asam amino yang dihubungkan oleh ikatan peptida.
Pembentukan peptida terjadi sebagai akibat dari reaksi kondensasi asam amino. Ketika gugus amino dari satu asam amino berinteraksi dengan gugus karboksil asam amino lainnya, terjadi ikatan kovalen nitrogen-karbon di antara keduanya, yang disebut peptida. Tergantung pada jumlah residu asam amino yang termasuk dalam peptida, ada dipeptida, tripeptida, tetrapeptida dll. Pembentukan ikatan peptida dapat terjadi berkali-kali. Hal ini mengarah pada pembentukan polipeptida. Di salah satu ujung peptida terdapat gugus amino bebas (disebut ujung-N), dan di ujung lainnya terdapat gugus karboksil bebas (disebut ujung-C).

Organisasi spasial molekul protein
Kinerja fungsi spesifik tertentu oleh protein bergantung pada konfigurasi spasial molekulnya; selain itu, secara energetik tidak menguntungkan bagi sel untuk menyimpan protein dalam bentuk terbuka, dalam bentuk rantai, oleh karena itu rantai polipeptida mengalami pelipatan, memperoleh a struktur tiga dimensi tertentu, atau konformasi. Ada 4 level organisasi spasial protein.
Struktur primer tupai- urutan susunan residu asam amino pada rantai polipeptida penyusun molekul protein. Ikatan antar asam amino merupakan ikatan peptida.

Jika suatu molekul protein hanya terdiri dari 10 residu asam amino, maka jumlahnya secara teoritis pilihan yang memungkinkan molekul protein berbeda dalam urutan pergantian asam amino - 10 20. Memiliki 20 asam amino, Anda dapat membuat kombinasi yang lebih beragam. Sekitar sepuluh ribu protein berbeda telah ditemukan di dalam tubuh manusia, yang berbeda satu sama lain dan dari protein organisme lain.
Struktur utama molekul proteinlah yang menentukan sifat molekul protein dan konfigurasi spasialnya. Penggantian hanya satu asam amino dengan asam amino lain dalam rantai polipeptida menyebabkan perubahan sifat dan fungsi protein. Misalnya, mengganti asam amino glutamat keenam dalam subunit β hemoglobin dengan valin menyebabkan fakta bahwa molekul hemoglobin secara keseluruhan tidak dapat menjalankan fungsi utamanya - transportasi oksigen; Dalam kasus seperti itu, orang tersebut terserang penyakit yang disebut anemia sel sabit.
Struktur sekunder- pelipatan rantai polipeptida yang teratur menjadi spiral (terlihat seperti pegas yang memanjang). Putaran heliks tersebut diperkuat oleh ikatan hidrogen yang timbul antara gugus karboksil dan gugus amino. Hampir semua gugus CO dan NH berperan dalam pembentukan ikatan hidrogen. Mereka lebih lemah dari peptida, namun, diulang berkali-kali, memberikan stabilitas dan kekakuan pada konfigurasi ini. Pada tingkat struktur sekunder terdapat protein: fibroin (sutra, jaring laba-laba), keratin (rambut, kuku), kolagen (tendon).



Struktur tersier- pengepakan rantai polipeptida menjadi butiran-butiran yang dihasilkan dari kejadian tersebut ikatan kimia(hidrogen, ionik, disulfida) dan pembentukan interaksi hidrofobik antara radikal residu asam amino. Peran utama dalam pembentukan struktur tersier dimainkan oleh interaksi hidrofilik-hidrofobik. Dalam larutan berair, radikal hidrofobik cenderung bersembunyi dari air, berkelompok di dalam globul, sedangkan radikal hidrofilik, akibat hidrasi (interaksi dengan dipol air), cenderung muncul di permukaan molekul. Pada beberapa protein, struktur tersier distabilkan oleh ikatan kovalen disulfida yang terbentuk antara atom belerang dari dua residu sistein. Pada tingkat struktur tersier terdapat enzim, antibodi, dan beberapa hormon.

Struktur Kuarter karakteristik protein kompleks yang molekulnya dibentuk oleh dua atau lebih butiran. Subunit ditahan dalam molekul melalui interaksi ionik, hidrofobik, dan elektrostatik. Kadang-kadang, selama pembentukan struktur kuaterner, ikatan disulfida terjadi antar subunit. Protein yang paling banyak dipelajari dengan struktur kuaterner adalah hemoglobin. Ini dibentuk oleh dua subunit α (141 residu asam amino) dan dua subunit β (146 residu asam amino). Terkait dengan setiap subunit adalah molekul heme yang mengandung besi.
Jika karena alasan tertentu konformasi spasial protein menyimpang dari normal, protein tersebut tidak dapat menjalankan fungsinya. Misalnya, penyebab “penyakit sapi gila” (ensefalopati spongiform) adalah konformasi abnormal prion, protein permukaan sel saraf.
Sifat-sifat protein
Komposisi asam amino dan struktur molekul protein menentukannya properti. Protein menggabungkan sifat basa dan asam, ditentukan oleh radikal asam amino: semakin asam asam amino dalam suatu protein, semakin besar sifat asamnya. Kemampuan menyumbang dan menambah H+ ditentukan sifat penyangga protein; Salah satu buffer yang paling kuat adalah hemoglobin dalam sel darah merah, yang menjaga pH darah pada tingkat yang konstan. Ada protein larut (fibrinogen), dan ada protein tidak larut yang menjalankan fungsi mekanis (fibroin, keratin, kolagen). Ada protein yang aktif secara kimia (enzim), ada protein yang tidak aktif secara kimia yang tahan terhadap berbagai kondisi lingkungan, dan ada pula yang sangat tidak stabil.
Faktor eksternal (panas, radiasi ultraviolet, logam berat dan garamnya, perubahan pH, radiasi, dehidrasi)
dapat menyebabkan terganggunya organisasi struktural molekul protein. Proses hilangnya konformasi tiga dimensi yang melekat pada molekul protein tertentu disebut denaturasi. Penyebab terjadinya denaturasi adalah putusnya ikatan yang menstabilkan struktur protein tertentu. Pada awalnya, ikatan yang paling lemah akan putus, dan seiring dengan semakin ketatnya kondisi, maka ikatan yang lebih kuat pun akan putus. Oleh karena itu, pertama-tama struktur kuaterner, kemudian struktur tersier dan sekunder hilang. Perubahan konfigurasi spasial menyebabkan perubahan sifat protein dan, sebagai akibatnya, protein tidak dapat menjalankan fungsi biologis bawaannya. Jika denaturasi tidak disertai dengan kerusakan struktur primer, maka hal itu mungkin terjadi dapat dibalik, dalam hal ini, terjadi pemulihan sendiri karakteristik konformasi protein. Misalnya, protein reseptor membran mengalami denaturasi seperti itu. Proses pemulihan struktur protein setelah denaturasi disebut renaturasi. Jika pemulihan konfigurasi spasial protein tidak mungkin dilakukan, maka disebut denaturasi tidak dapat diubah.
Fungsi protein
| Fungsi | Contoh dan penjelasannya |
|---|---|
| Konstruksi | Protein terlibat dalam pembentukan struktur seluler dan ekstraseluler: mereka adalah bagian dari membran sel (lipoprotein, glikoprotein), rambut (keratin), tendon (kolagen), dll. |
| Mengangkut | Protein darah hemoglobin mengikat oksigen dan mengangkutnya dari paru-paru ke seluruh jaringan dan organ, dan darinya mentransfer karbon dioksida ke paru-paru; Komposisi membran sel mencakup protein khusus yang memastikan transfer zat dan ion tertentu secara aktif dan selektif dari sel ke lingkungan luar dan sebaliknya. |
| Peraturan | Hormon protein berperan dalam pengaturan proses metabolisme. Misalnya, hormon insulin mengatur kadar glukosa darah, meningkatkan sintesis glikogen, dan meningkatkan pembentukan lemak dari karbohidrat. |
| Protektif | Menanggapi penetrasi protein asing atau mikroorganisme (antigen) ke dalam tubuh, protein khusus terbentuk - antibodi yang mampu mengikat dan menetralisirnya. Fibrin, terbentuk dari fibrinogen, membantu menghentikan pendarahan. |
| Motor | Protein kontraktil aktin dan miosin memberikan kontraksi otot pada hewan multiseluler. |
| Sinyal | Di dalam membran permukaan sel terdapat molekul protein yang mampu mengubah struktur tersiernya sebagai respons terhadap faktor lingkungan, sehingga menerima sinyal dari lingkungan luar dan mengirimkan perintah ke sel. |
| Penyimpanan | Di dalam tubuh hewan, protein biasanya tidak disimpan, kecuali albumin telur dan kasein susu. Namun berkat protein, beberapa zat dapat disimpan di dalam tubuh; misalnya, selama pemecahan hemoglobin, zat besi tidak dikeluarkan dari tubuh, tetapi disimpan, membentuk kompleks dengan protein feritin. |
| Energi | Ketika 1 g protein dipecah menjadi produk akhir, 17,6 kJ dilepaskan. Pertama, protein terurai menjadi asam amino, dan kemudian menjadi produk akhir - air, karbon dioksida, dan amonia. Namun, protein digunakan sebagai sumber energi hanya jika sumber lain (karbohidrat dan lemak) telah habis. |
| Katalis | Salah satu fungsi terpenting protein. Disediakan oleh protein - enzim yang mempercepat reaksi biokimia yang terjadi di dalam sel. Misalnya, ribulosa bifosfat karboksilase mengkatalisis fiksasi CO2 selama fotosintesis. |
Enzim
Enzim, atau enzim, adalah kelas protein khusus yang merupakan katalis biologis. Berkat enzim, reaksi biokimia terjadi dengan kecepatan luar biasa. Laju reaksi enzimatik puluhan ribu kali (dan terkadang jutaan) lebih tinggi daripada laju reaksi yang melibatkan katalis anorganik. Zat yang menjadi tempat kerja enzim disebut substrat.
Enzim adalah protein globular, fitur struktural enzim dapat dibagi menjadi dua kelompok: sederhana dan kompleks. Enzim sederhana adalah protein sederhana, yaitu hanya terdiri dari asam amino. Enzim kompleks adalah protein kompleks, mis. Selain bagian protein, mereka mengandung kelompok yang bersifat non-protein - kofaktor. Beberapa enzim menggunakan vitamin sebagai kofaktor. Molekul enzim mengandung bagian khusus yang disebut pusat aktif. Pusat aktif- bagian kecil dari enzim (dari tiga hingga dua belas residu asam amino), di mana terjadi pengikatan substrat atau substrat untuk membentuk kompleks enzim-substrat. Setelah reaksi selesai, kompleks enzim-substrat terurai menjadi enzim dan produk reaksi. Beberapa enzim memiliki (kecuali aktif) pusat alosterik- area di mana pengatur kecepatan enzim dipasang ( enzim alosterik).

Reaksi katalisis enzimatik dicirikan oleh: 1) efisiensi tinggi, 2) selektivitas dan arah kerja yang ketat, 3) spesifisitas substrat, 4) regulasi yang halus dan tepat. Spesifisitas substrat dan reaksi katalisis enzimatik dijelaskan oleh hipotesis E. Fischer (1890) dan D. Koshland (1959).
E. Fisher (hipotesis kunci-kunci) menyarankan bahwa konfigurasi spasial dari situs aktif enzim dan substrat harus sesuai satu sama lain. Substrat dibandingkan dengan “kunci”, enzim dengan “gembok”.
D. Koshland (hipotesis sarung tangan) menyarankan bahwa korespondensi spasial antara struktur substrat dan pusat aktif enzim tercipta hanya pada saat interaksinya satu sama lain. Hipotesis ini disebut juga hipotesis korespondensi yang diinduksi.
Laju reaksi enzimatik bergantung pada: 1) suhu, 2) konsentrasi enzim, 3) konsentrasi substrat, 4) pH. Perlu ditekankan bahwa karena enzim adalah protein, aktivitasnya paling tinggi secara fisiologis kondisi normal.
Kebanyakan enzim hanya dapat bekerja pada suhu antara 0 dan 40°C. Dalam batas ini, laju reaksi meningkat kira-kira 2 kali lipat setiap kenaikan suhu 10 °C. Pada suhu di atas 40°C, protein mengalami denaturasi dan aktivitas enzim menurun. Pada suhu mendekati titik beku, enzim menjadi tidak aktif.
Dengan bertambahnya jumlah substrat, laju reaksi enzimatik meningkat hingga jumlah molekul substrat sama dengan jumlah molekul enzim. Dengan peningkatan lebih lanjut dalam jumlah substrat, kecepatannya tidak akan meningkat, karena pusat aktif enzim sudah jenuh. Peningkatan konsentrasi enzim menyebabkan peningkatan aktivitas katalitik, karena lebih banyak molekul substrat yang mengalami transformasi per satuan waktu.

Untuk setiap enzim, terdapat nilai pH optimal yang menunjukkan aktivitas maksimum (pepsin - 2.0, amilase ludah - 6.8, lipase pankreas - 9.0). Pada nilai pH yang lebih tinggi atau lebih rendah, aktivitas enzim menurun. Dengan perubahan pH yang tiba-tiba, enzim mengalami denaturasi.
Kecepatan kerja enzim alosterik diatur oleh zat yang menempel pada pusat alosterik. Jika zat tersebut mempercepat suatu reaksi maka disebut aktivator, jika mereka melambat - penghambat.
Klasifikasi enzim
Menurut jenis transformasi kimia yang dikatalisisnya, enzim dibagi menjadi 6 kelas:
- oksireduktase(transfer atom hidrogen, oksigen atau elektron dari satu zat ke zat lain - dehidrogenase),
- transferase(pemindahan gugus metil, asil, fosfat atau amino dari satu zat ke zat lain - transaminase),
- hidrolase(reaksi hidrolisis di mana dua produk terbentuk dari substrat - amilase, lipase),
- liase(penambahan non-hidrolitik pada substrat atau pelepasan sekelompok atom darinya, dalam hal ini ikatan C-C, C-N, C-O, C-S dapat diputus - dekarboksilase),
- isomerase(penataan ulang intramolekul - isomerase),
- ligase(hubungan dua molekul sebagai akibat dari pembentukan koneksi C-C, C-N, C-O, C-S - sintetase).
Kelas pada gilirannya dibagi lagi menjadi subkelas dan subsubkelas. Pada saat ini klasifikasi internasional Setiap enzim memiliki kode tertentu, terdiri dari empat angka yang dipisahkan oleh titik. Angka pertama adalah kelas, angka kedua adalah subkelas, angka ketiga adalah subkelas, dan angka keempat adalah nomor seri enzim pada subkelas ini, misalnya kode arginase adalah 3.5.3.1.
Pergi ke kuliah nomor 2"Struktur dan fungsi karbohidrat dan lipid"
Pergi ke kuliah nomor 4“Struktur dan fungsi asam nukleat ATP"
Deskripsi Singkat:
Fragmen buku teks: Kimia biologi dengan latihan dan tugas: buku teks / ed. Anggota yang sesuai RAMS S.E. Severina. M.: GEOTAR-Media, 2011. - 624 hal.: sakit. MODUL 1: STRUKTUR, SIFAT DAN FUNGSI PROTEIN
MODUL 1: STRUKTUR, SIFAT DAN FUNGSI PROTEIN
Struktur modul | Tema |
Unit modular 1 | 1.1. Organisasi struktural protein. Tahapan pembentukan konformasi protein asli 1.2. Dasar-dasar fungsi protein. Obat sebagai ligan mempengaruhi fungsi protein 1.3. Denaturasi protein dan kemungkinan renativasi spontannya |
Unit modular 2 | 1.4. Ciri-ciri struktur dan fungsi protein oligomer pada contoh hemoglobin 1.5. Pemeliharaan konformasi protein asli dalam kondisi seluler 1.6. Berbagai protein. Keluarga protein menggunakan contoh imunoglobulin 1.7. Sifat fisikokimia protein dan metode pemisahannya |
Unit modular 1 ORGANISASI STRUKTUR PROTEIN MONOMER DAN DASAR FUNGSINYA
Tujuan pembelajaran Mampu:
1. Menggunakan pengetahuan tentang ciri-ciri struktural protein dan ketergantungan fungsi protein pada strukturnya untuk memahami mekanisme perkembangan proteinopati herediter dan didapat.
2. Menjelaskan mekanisme kerja terapeutik beberapa obat sebagai ligan yang berinteraksi dengan protein dan mengubah aktivitasnya.
3. Menggunakan pengetahuan tentang struktur dan labilitas konformasi protein untuk memahami ketidakstabilan struktural dan fungsionalnya serta kecenderungan denaturasinya dalam kondisi yang berubah.
4. Menjelaskan kegunaan bahan denaturasi sebagai alat untuk mensterilkan bahan dan instrumen kesehatan, serta sebagai antiseptik.
Tahu:
1. Tingkat organisasi struktural protein.
2. Pentingnya struktur primer protein, yang menentukan keanekaragaman struktural dan fungsionalnya.
3. Mekanisme pembentukan pusat aktif pada protein dan interaksi spesifiknya dengan ligan yang mendasari berfungsinya protein.
4. Contoh pengaruh ligan eksogen (obat, toksin, racun) terhadap konformasi dan aktivitas fungsional protein.
5. Penyebab dan akibat denaturasi protein, faktor penyebab denaturasi.
6. Contoh penggunaan faktor denaturasi dalam pengobatan sebagai antiseptik dan alat sterilisasi alat kesehatan.
TOPIK 1.1. ORGANISASI STRUKTUR PROTEIN. TAHAP PEMBENTUKAN ASLI
KONFORMASI PROTEIN
Tupai - ini adalah heteropolimer molekul (yaitu terdiri dari berbagai monomer). Monomer protein adalah 20 jenis asam α-amino yang dihubungkan satu sama lain melalui ikatan peptida.
Himpunan dan urutan kombinasi asam amino dalam suatu protein ditentukan oleh struktur gen yang sesuai dalam DNA individu. Setiap protein, sesuai dengan struktur spesifiknya, menjalankan fungsinya masing-masing. Himpunan protein suatu organisme tertentu ( proteom) menentukan karakteristik fenotipiknya, serta adanya penyakit keturunan atau kecenderungan perkembangannya.
1. Asam amino penyusun protein. Ikatan peptida.
Protein adalah heteropolimer yang dibangun dari monomer - 20 asam α-amino.
Rumus umum asam amino disajikan di bawah ini.

Asam amino berbeda dalam struktur, ukuran, dan sifat fisikokimia radikal yang terikat pada atom karbon α. Gugus fungsi asam amino menentukan karakteristik sifat-sifat asam α-amino yang berbeda. Radikal yang terdapat pada asam α-amino dapat dibagi menjadi beberapa kelompok:
prolin, Berbeda dengan 19 monomer protein lainnya, prolin bukanlah asam amino, melainkan asam imino; radikal dalam prolin berasosiasi dengan atom karbon α dan gugus imino.

Asam amino bervariasi dalam kelarutan dalam air. Hal ini disebabkan kemampuan radikal berinteraksi dengan air (hidrat).
KE hidrofilik termasuk radikal yang mengandung anionik, kationik dan polar tidak bermuatan kelompok fungsional.
KE hidrofobik termasuk radikal yang mengandung gugus metil, rantai atau cincin alifatik.
2. Ikatan peptida menghubungkan asam amino membentuk peptida. Selama sintesis peptida, gugus α-karboksil dari satu asam amino berinteraksi dengan gugus α-amino dari asam amino lain untuk membentuk ikatan peptida:
Protein adalah polipeptida, mis. polimer linier asam α-amino yang dihubungkan oleh ikatan peptida (Gbr. 1.1.)
 Beras. 1.1. Istilah yang digunakan untuk menggambarkan struktur peptida
Beras. 1.1. Istilah yang digunakan untuk menggambarkan struktur peptida
Monomer asam amino yang menyusun polipeptida disebut residu asam amino. Rantai kelompok yang berulang - NH-CH-CO- formulir tulang punggung peptida. Residu asam amino yang mempunyai gugus α-amino bebas disebut terminal-N, dan yang mempunyai gugus α-karboksil bebas disebut terminal-C. Peptida ditulis dan dibaca dari N-terminus ke C-terminus.
Ikatan peptida yang dibentuk oleh gugus imino prolin berbeda dari ikatan peptida lainnya: atom nitrogen pada gugus peptida kekurangan hidrogen,
sebaliknya, terdapat ikatan dengan radikal, akibatnya salah satu sisi cincin termasuk dalam tulang punggung peptida:

Peptida berbeda dalam komposisi asam amino, jumlah asam amino dan urutan ikatan asam amino, misalnya Ser-Ala-Glu-Gis dan His-Glu-Ala-Ser adalah dua peptida yang berbeda.
Ikatan peptida sangat kuat, dan hidrolisis kimia non-enzimatiknya memerlukan kondisi yang ketat: protein yang dianalisis dihidrolisis dalam konsentrasi asam hidroklorik pada suhu sekitar 110° selama 24 jam. Di sel hidup ikatan peptida dapat terkoyak oleh enzim proteolitik, ditelepon protease atau hidrolase peptida.
3. Struktur primer protein. Residu asam amino dalam rantai peptida protein yang berbeda tidak bergantian secara acak, tetapi tersusun dalam urutan tertentu. Urutan linier atau urutan pergantian residu asam amino dalam rantai polipeptida disebut struktur utama protein.
Struktur utama setiap protein individu dikodekan dalam molekul DNA (di wilayah yang disebut gen) dan diwujudkan selama transkripsi (menyalin informasi ke mRNA) dan translasi (sintesis struktur primer protein). Akibatnya, struktur utama protein seseorang adalah informasi yang diturunkan secara turun-temurun dari orang tua ke anak-anak, yang menentukan ciri-ciri struktural protein suatu organisme tertentu, yang menjadi sandaran fungsi protein yang ada (Gbr. 1.2.).
 Beras. 1.2. Hubungan antara genotipe dan konformasi protein yang disintesis dalam tubuh individu
Beras. 1.2. Hubungan antara genotipe dan konformasi protein yang disintesis dalam tubuh individu
Masing-masing dari sekitar 100.000 protein individu dalam tubuh manusia miliki unik struktur primer. Molekul dari jenis protein yang sama (misalnya albumin) memiliki pergantian residu asam amino yang sama, yang membedakan albumin dari protein individu lainnya.
Urutan residu asam amino dalam rantai peptida dapat dianggap sebagai bentuk pencatatan informasi. Informasi ini menentukan susunan spasial rantai peptida linier menjadi struktur tiga dimensi yang lebih kompak yang disebut konformasi tupai. Proses pembentukan konformasi protein yang aktif secara fungsional disebut Melipat
4. Konformasi protein. Rotasi bebas pada tulang punggung peptida dimungkinkan antara atom nitrogen dari gugus peptida dan atom karbon α yang berdekatan, serta antara atom karbon α dan karbon dari gugus karbonil. Karena interaksi gugus fungsi residu asam amino, struktur primer protein dapat memperoleh struktur spasial yang lebih kompleks. Dalam protein globular, ada dua tingkat utama pelipatan konformasi rantai peptida: sekunder Dan struktur tersier.
Struktur sekunder protein adalah struktur spasial yang terbentuk sebagai hasil pembentukan ikatan hidrogen antara gugus fungsi -C=O dan -NH- dari tulang punggung peptida. Dalam hal ini, rantai peptida dapat memperoleh dua jenis struktur teratur: α-heliks Dan struktur β.
DI DALAM α-heliks ikatan hidrogen terbentuk antara atom oksigen dari gugus karbonil dan hidrogen dari nitrogen amino dari asam amino ke-4 darinya; rantai samping residu asam amino
terletak di sepanjang pinggiran spiral, tanpa berpartisipasi dalam pembentukan struktur sekunder (Gbr. 1.3.).
Radikal curah, atau radikal yang membawa muatan yang sama, mencegah pembentukan α-helix. Residu prolin, yang memiliki struktur cincin, memutus α-heliks, karena kurangnya hidrogen pada atom nitrogen dalam rantai peptida, tidak mungkin terbentuk ikatan hidrogen. Ikatan antara nitrogen dan atom karbon α merupakan bagian dari cincin prolin, sehingga tulang punggung peptida menjadi bengkok pada titik ini.
β-Struktur terbentuk antara daerah linier tulang punggung peptida dari satu rantai polipeptida, sehingga membentuk struktur terlipat. Rantai polipeptida atau bagiannya dapat terbentuk paralel atau struktur β antiparalel. Dalam kasus pertama, ujung N dan C dari rantai peptida yang berinteraksi bertepatan, dan pada kasus kedua, keduanya memiliki arah yang berlawanan (Gbr. 1.4).
Beras. 1.3. Struktur sekunder protein adalah α-heliks
 Beras. 1.4. Struktur lembaran β paralel dan antiparalel
Beras. 1.4. Struktur lembaran β paralel dan antiparalel
Struktur β ditunjukkan dengan panah lebar: A - Struktur β Antiparalel. B - Struktur lembaran β paralel
Pada beberapa protein, struktur β dapat terbentuk karena pembentukan ikatan hidrogen antara atom-atom tulang punggung peptida dari rantai polipeptida yang berbeda.
Juga ditemukan dalam protein daerah dengan sekunder tidak beraturan struktur, yang meliputi tikungan, putaran, dan putaran tulang punggung polipeptida. Mereka sering terletak di tempat di mana arah rantai peptida berubah, misalnya, ketika struktur lembaran β paralel terbentuk.
Berdasarkan keberadaan heliks α dan struktur β, protein globular dapat dibagi menjadi empat kategori.
Beras. 1.5. Struktur sekunder mioglobin (A) dan rantai β hemoglobin (B), mengandung delapan heliks α
 Beras. 1.6. Struktur sekunder domain triosefosfat isomerase dan piruvat kinase
Beras. 1.6. Struktur sekunder domain triosefosfat isomerase dan piruvat kinase
 Beras. 1.7. Struktur sekunder dari domain konstan imunoglobulin (A) dan enzim superoksida dismutase (B)
Beras. 1.7. Struktur sekunder dari domain konstan imunoglobulin (A) dan enzim superoksida dismutase (B)
DI DALAM kategori keempat termasuk protein yang mengandung sejumlah kecil struktur sekunder biasa. Protein ini termasuk protein kecil yang kaya sistein atau metalloprotein.
Struktur tersier protein- jenis konformasi yang terbentuk karena interaksi antara radikal asam amino, yang dapat ditempatkan pada jarak yang cukup jauh satu sama lain dalam rantai peptida. Kebanyakan protein membentuk struktur spasial menyerupai globule (protein globular).
Karena radikal asam amino hidrofobik cenderung bergabung melalui apa yang disebut interaksi hidrofobik dan gaya van der Waals antarmolekul, inti hidrofobik padat terbentuk di dalam globul protein. Radikal terionisasi hidrofilik dan non-terionisasi terutama terletak di permukaan protein dan menentukan kelarutannya dalam air.
 Beras. 1.8. Jenis ikatan yang timbul antara radikal asam amino selama pembentukan struktur tersier suatu protein
Beras. 1.8. Jenis ikatan yang timbul antara radikal asam amino selama pembentukan struktur tersier suatu protein
1 - ikatan ionik- terjadi antara gugus fungsi yang bermuatan positif dan negatif;
2 - ikatan hidrogen- terjadi antara gugus hidrofilik tak bermuatan dan gugus hidrofilik lainnya;
3 - interaksi hidrofobik- timbul di antara radikal hidrofobik;
4 - ikatan disulfida- terbentuk karena oksidasi gugus SH residu sistein dan interaksinya satu sama lain
Residu asam amino hidrofilik yang terletak di dalam inti hidrofobik dapat berinteraksi satu sama lain menggunakan ionik Dan ikatan hidrogen(Gbr. 1.8).
Ikatan ionik dan hidrogen, serta interaksi hidrofobik, lemah: energinya tidak jauh lebih tinggi daripada energi gerak termal molekul pada suhu kamar. Konformasi protein dipertahankan dengan pembentukan banyak ikatan lemah. Karena atom-atom yang membentuk protein terus bergerak, beberapa ikatan lemah dapat diputus dan membentuk ikatan lain, yang menyebabkan sedikit pergerakan pada masing-masing bagian rantai polipeptida. Sifat protein untuk mengubah konformasi sebagai akibat putusnya sebagian dan pembentukan ikatan lemah lainnya disebut labilitas konformasi.
Tubuh manusia mempunyai sistem yang mendukung homeostatis- konsistensi lingkungan internal dalam batas tertentu yang dapat diterima untuk kesehatan tubuh. Dalam kondisi homeostatis, perubahan kecil pada konformasi tidak mengganggu keseluruhan struktur dan fungsi protein. Konformasi protein yang aktif secara fungsional disebut konformasi asli. Perubahan lingkungan internal (misalnya konsentrasi glukosa, ion Ca, proton, dll) menyebabkan perubahan konformasi dan terganggunya fungsi protein.
Struktur tersier beberapa protein menjadi stabil ikatan disulfida, terbentuk karena interaksi gugus -SH dari dua residu
 Beras. 1.9. Pembentukan ikatan disulfida dalam molekul protein
Beras. 1.9. Pembentukan ikatan disulfida dalam molekul protein
sistein (Gbr. 1.9). Kebanyakan protein intraseluler tidak memiliki ikatan kovalen disulfida pada struktur tersiernya. Kehadiran mereka merupakan karakteristik protein yang disekresikan oleh sel, yang menjamin stabilitasnya yang lebih besar dalam kondisi ekstraseluler. Dengan demikian, ikatan disulfida terdapat dalam molekul insulin dan imunoglobulin.
Insulin- hormon protein yang disintesis di sel pankreas dan disekresikan ke dalam darah sebagai respons terhadap peningkatan konsentrasi glukosa dalam darah. Dalam struktur insulin, terdapat dua ikatan disulfida yang menghubungkan rantai polipeptida A dan B, dan satu ikatan disulfida dalam rantai A (Gbr. 1.10).
 Beras. 1.10. Ikatan disulfida dalam struktur insulin
Beras. 1.10. Ikatan disulfida dalam struktur insulin
5. Struktur protein supersekunder. Pada protein dengan struktur dan fungsi primer yang berbeda, terkadang terdeteksi kombinasi serupa dan posisi relatif struktur sekunder, yang disebut struktur supersekunder. Ia menempati posisi perantara antara struktur sekunder dan tersier, karena merupakan kombinasi spesifik elemen struktur sekunder dalam pembentukan struktur tersier protein. Struktur supersekunder memiliki nama spesifik, seperti “α-helix-turn-a-helix”, “leucine ritsleting”, “jari seng”, dll. Struktur supersekunder tersebut merupakan karakteristik protein pengikat DNA.
"Ritsleting leusin." Jenis struktur supersekunder ini digunakan untuk menggabungkan dua protein menjadi satu. Pada permukaan protein yang berinteraksi terdapat daerah heliks α yang mengandung setidaknya empat residu leusin. Residu leusin dalam α-heliks terletak terpisah enam asam amino. Karena setiap putaran α-heliks mengandung 3,6 residu asam amino, radikal leusin terletak di permukaan setiap putaran kedua. Residu leusin dari α-heliks suatu protein dapat berinteraksi dengan residu leusin dari protein lain (interaksi hidrofobik), menghubungkan keduanya (Gbr. 1.11.). Banyak protein pengikat DNA berfungsi dalam kompleks oligomer di mana masing-masing subunit dihubungkan satu sama lain melalui “ritsleting leusin”.
 Beras. 1.11. "Ritsleting leusin" antara daerah heliks α dari dua protein
Beras. 1.11. "Ritsleting leusin" antara daerah heliks α dari dua protein
Contoh protein tersebut adalah histon. sejarah- protein inti, yang mengandung sejumlah besar asam amino bermuatan positif - arginin dan lisin (hingga 80%). Molekul histon digabungkan menjadi kompleks oligomer yang mengandung delapan monomer menggunakan “ritsleting leusin”, meskipun molekul-molekul ini memiliki muatan homonim yang signifikan.
"jari seng"- varian struktur supersekunder, karakteristik protein pengikat DNA, berbentuk fragmen memanjang pada permukaan protein dan mengandung sekitar 20 residu asam amino (Gbr. 1.12). Bentuk “jari terentang” didukung oleh atom seng yang terikat pada empat radikal asam amino - dua residu sistein dan dua residu histidin. Dalam beberapa kasus, selain residu histidin, terdapat residu sistein. Dua residu sistein yang letaknya berdekatan dipisahkan dari dua residu Gisili lainnya melalui rangkaian Cys yang terdiri dari sekitar 12 residu asam amino. Wilayah protein ini membentuk α-heliks, yang radikalnya dapat secara spesifik berikatan dengan wilayah pengatur alur utama DNA. Kekhususan pengikatan individu
 Beras. 1.12. Struktur utama wilayah protein pengikat DNA yang membentuk struktur “jari seng” (huruf menunjukkan asam amino yang menyusun struktur ini)
Beras. 1.12. Struktur utama wilayah protein pengikat DNA yang membentuk struktur “jari seng” (huruf menunjukkan asam amino yang menyusun struktur ini)
Protein pengikat DNA pengatur bergantung pada urutan residu asam amino yang terletak di daerah jari seng. Struktur tersebut mengandung, khususnya, reseptor hormon steroid yang terlibat dalam regulasi transkripsi (membaca informasi dari DNA ke RNA).
TOPIK 1.2. DASAR FUNGSI PROTEIN. OBAT SEBAGAI LIGAND YANG MEMPENGARUHI FUNGSI PROTEIN
1. Pusat aktif protein dan interaksinya dengan ligan. Selama pembentukan struktur tersier, suatu daerah terbentuk pada permukaan protein yang aktif secara fungsional, biasanya dalam suatu ceruk, dibentuk oleh radikal asam amino yang berjauhan satu sama lain dalam struktur primer. Wilayah ini, yang memiliki struktur unik untuk protein tertentu dan mampu berinteraksi secara spesifik dengan molekul tertentu atau kelompok molekul serupa, disebut situs pengikatan protein-ligan atau situs aktif. Ligan adalah molekul yang berinteraksi dengan protein.
Spesifisitas tinggi Interaksi protein dengan ligan dijamin oleh struktur pusat aktif yang saling melengkapi dengan struktur ligan.
Komplementaritas- ini adalah korespondensi spasial dan kimia dari permukaan yang berinteraksi. Pusat aktif tidak hanya harus sesuai secara spasial dengan ligan yang termasuk di dalamnya, tetapi juga ikatan (interaksi ionik, hidrogen, dan hidrofobik) harus terbentuk antara gugus fungsi radikal yang termasuk dalam pusat aktif dan ligan yang menahan ligan. di pusat aktif (Gbr. 1.13 ).
 Beras. 1.13. Interaksi komplementer protein dengan ligan
Beras. 1.13. Interaksi komplementer protein dengan ligan
Beberapa ligan, ketika melekat pada pusat aktif suatu protein, memainkan peran tambahan dalam fungsi protein. Ligan seperti itu disebut kofaktor, dan protein yang mengandung bagian non-protein disebut protein kompleks(berlawanan dengan protein sederhana, hanya terdiri dari bagian protein). Bagian bukan protein yang terikat kuat pada protein disebut kelompok prostetik. Misalnya, mioglobin, hemoglobin, dan sitokrom mengandung gugus prostetik, heme, yang mengandung ion besi, terikat kuat pada pusat aktif. Protein kompleks yang mengandung heme disebut hemoprotein.
Ketika ligan tertentu melekat pada protein, fungsi protein ini terwujud. Jadi, albumin, protein terpenting dalam plasma darah, menunjukkan fungsi transpornya dengan menempelkan ligan hidrofobik, seperti asam lemak, bilirubin, obat-obatan tertentu, dll. ke pusat aktif (Gbr. 1.14)
Ligan yang berinteraksi dengan struktur tiga dimensi rantai peptida tidak hanya berupa molekul organik dan anorganik dengan berat molekul rendah, tetapi juga makromolekul:
DNA (contoh protein pengikat DNA dibahas di atas);
Polisakarida;
 Beras. 1.14. Hubungan antara genotipe dan fenotipe
Beras. 1.14. Hubungan antara genotipe dan fenotipe
Struktur primer unik protein manusia, yang dikodekan dalam molekul DNA, diwujudkan dalam sel dalam bentuk konformasi unik, struktur pusat aktif, dan fungsi protein.
Dalam kasus ini, protein mengenali wilayah tertentu dari ligan yang sepadan dan saling melengkapi dengan tempat pengikatan. Jadi, pada permukaan hepatosit terdapat protein reseptor hormon insulin, yang juga memiliki struktur protein. Interaksi insulin dengan reseptor menyebabkan perubahan konformasi dan aktivasi sistem sinyal, yang menyebabkan penyimpanan nutrisi di hepatosit setelah makan.
Dengan demikian, Fungsi protein didasarkan pada interaksi spesifik pusat aktif protein dengan ligan.
2. Struktur domain dan perannya dalam fungsi protein. Rantai polipeptida panjang dari protein globular sering kali terlipat menjadi beberapa daerah yang kompak dan relatif independen. Mereka memiliki struktur tersier independen, mengingatkan pada struktur protein globular, dan disebut domain. Karena struktur domain protein, struktur tersiernya lebih mudah dibentuk.
Dalam protein domain, situs pengikatan ligan sering kali terletak di antara domain. Jadi, trypsin adalah enzim proteolitik yang diproduksi oleh bagian eksokrin pankreas dan diperlukan untuk pencernaan protein makanan. Ia memiliki struktur dua domain, dan pusat pengikatan trypsin dengan ligannya - protein makanan - terletak di alur antara dua domain. Di pusat aktif, kondisi yang diperlukan untuk pengikatan efektif bagian tertentu dari protein makanan dan hidrolisis ikatan peptidanya tercipta.
Domain yang berbeda dalam suatu protein dapat berpindah relatif satu sama lain ketika pusat aktif berinteraksi dengan ligan (Gbr. 1.15).
Heksokinase- enzim yang mengkatalisis fosforilasi glukosa menggunakan ATP. Situs aktif enzim terletak pada celah antara dua domain. Ketika heksokinase berikatan dengan glukosa, domain di sekitarnya menutup dan substrat menjadi terperangkap, tempat terjadinya fosforilasi (lihat Gambar 1.15).
 Beras. 1.15. Pengikatan domain heksokinase ke glukosa
Beras. 1.15. Pengikatan domain heksokinase ke glukosa
Pada beberapa protein, domain menjalankan fungsi independen dengan mengikat berbagai ligan. Protein semacam itu disebut multifungsi.
3. Obat adalah ligan yang mempengaruhi fungsi protein. Interaksi protein dengan ligan bersifat spesifik. Namun, karena labilitas konformasi protein dan pusat aktifnya, zat lain dapat dipilih yang juga dapat berinteraksi dengan protein di pusat aktif atau bagian lain dari molekul.
Suatu zat yang strukturnya mirip dengan ligan alami disebut analog struktural ligan atau ligan non-alami. Ia juga berinteraksi dengan protein di situs aktif. Analog struktural ligan dapat meningkatkan fungsi protein (agonis), dan menguranginya (antagonis). Ligan dan analog strukturalnya bersaing satu sama lain untuk berikatan dengan protein di tempat yang sama. Zat yang demikian disebut modulator kompetitif(pengatur) fungsi protein. Banyak obat bertindak sebagai penghambat protein. Beberapa di antaranya diperoleh dengan modifikasi kimia ligan alami. Penghambat fungsi protein dapat berupa obat dan racun.
Atropin adalah penghambat kompetitif reseptor M-kolinergik. Asetilkolin adalah neurotransmitter untuk transmisi impuls saraf melalui sinapsis kolinergik. Untuk melakukan eksitasi, dilepaskan di celah sinaptik asetilkolin harus berinteraksi dengan protein reseptor membran postsinaptik. Ditemukan dua jenis reseptor kolinergik:
reseptor M selain asetilkolin, ia secara selektif berinteraksi dengan muscarine (toksin lalat agaric). M - reseptor kolinergik terdapat pada otot polos dan, ketika berinteraksi dengan asetilkolin, menyebabkan kontraksinya;
reseptor H khusus mengikat nikotin. Reseptor N-kolinergik ditemukan di sinapsis otot rangka lurik.
Penghambat spesifik Reseptor M-kolinergik adalah atropin. Hal ini ditemukan di tanaman belladonna dan henbane.
 Atropin memiliki gugus fungsi yang mirip strukturnya dengan asetilkolin dan susunan spasialnya, oleh karena itu atropin merupakan penghambat kompetitif reseptor M-kolinergik. Mengingat pengikatan asetilkolin dengan reseptor M-kolinergik menyebabkan kontraksi otot polos, maka atropin digunakan sebagai obat yang meredakan kejangnya. (antispasmodik). Oleh karena itu, diketahui penggunaan atropin untuk mengendurkan otot mata saat melihat fundus, serta untuk meredakan kejang pada kolik gastrointestinal. Reseptor M-kolinergik juga terdapat di pusat sistem saraf(SSP), oleh karena itu atropin dosis besar dapat menyebabkan reaksi yang tidak diinginkan dari sistem saraf pusat: agitasi motorik dan mental, halusinasi, kejang.
Atropin memiliki gugus fungsi yang mirip strukturnya dengan asetilkolin dan susunan spasialnya, oleh karena itu atropin merupakan penghambat kompetitif reseptor M-kolinergik. Mengingat pengikatan asetilkolin dengan reseptor M-kolinergik menyebabkan kontraksi otot polos, maka atropin digunakan sebagai obat yang meredakan kejangnya. (antispasmodik). Oleh karena itu, diketahui penggunaan atropin untuk mengendurkan otot mata saat melihat fundus, serta untuk meredakan kejang pada kolik gastrointestinal. Reseptor M-kolinergik juga terdapat di pusat sistem saraf(SSP), oleh karena itu atropin dosis besar dapat menyebabkan reaksi yang tidak diinginkan dari sistem saraf pusat: agitasi motorik dan mental, halusinasi, kejang.
Ditilin adalah agonis kompetitif reseptor H-kolinergik, menghambat fungsi sinapsis neuromuskular.
 Sinapsis neuromuskular otot rangka mengandung reseptor H-kolinergik. Interaksi mereka dengan asetilkolin menyebabkan kontraksi otot. Selama beberapa operasi bedah, serta dalam pemeriksaan endoskopi, obat-obatan digunakan yang menyebabkan relaksasi otot rangka (relaksan otot). Ini termasuk dithiline, yang merupakan analog struktural asetilkolin. Ia menempel pada reseptor H-kolinergik, tetapi tidak seperti asetilkolin, ia dihancurkan dengan sangat lambat oleh enzim asetilkolinesterase. Akibat pembukaan saluran ion yang berkepanjangan dan depolarisasi membran yang terus-menerus, konduksi impuls saraf terganggu dan terjadi relaksasi otot. Awalnya, sifat-sifat ini ditemukan dalam racun curare, itulah sebabnya obat tersebut disebut seperti curare.
Sinapsis neuromuskular otot rangka mengandung reseptor H-kolinergik. Interaksi mereka dengan asetilkolin menyebabkan kontraksi otot. Selama beberapa operasi bedah, serta dalam pemeriksaan endoskopi, obat-obatan digunakan yang menyebabkan relaksasi otot rangka (relaksan otot). Ini termasuk dithiline, yang merupakan analog struktural asetilkolin. Ia menempel pada reseptor H-kolinergik, tetapi tidak seperti asetilkolin, ia dihancurkan dengan sangat lambat oleh enzim asetilkolinesterase. Akibat pembukaan saluran ion yang berkepanjangan dan depolarisasi membran yang terus-menerus, konduksi impuls saraf terganggu dan terjadi relaksasi otot. Awalnya, sifat-sifat ini ditemukan dalam racun curare, itulah sebabnya obat tersebut disebut seperti curare.
TOPIK 1.3. DENATURASI PROTEIN DAN KEMUNGKINAN RENATIVASI SPONTANNYA
1. Karena konformasi asli protein dipertahankan karena interaksi yang lemah, perubahan komposisi dan sifat lingkungan sekitar protein, paparan reagen kimia dan faktor fisik menyebabkan perubahan konformasi (sifat labilitas konformasi). Celah jumlah besar ikatan menyebabkan penghancuran konformasi asli dan denaturasi protein.
Denaturasi protein- ini adalah penghancuran konformasi aslinya di bawah pengaruh zat denaturasi, yang disebabkan oleh putusnya ikatan lemah yang menstabilkan struktur spasial protein. Denaturasi disertai dengan rusaknya struktur tiga dimensi unik dan pusat aktif protein serta hilangnya aktivitas biologisnya (Gbr. 1.16).
Semua molekul terdenaturasi dari satu protein memperoleh konformasi acak yang berbeda dari molekul lain dari protein yang sama. Radikal asam amino yang membentuk pusat aktif ternyata berjauhan secara spasial satu sama lain, yaitu. situs pengikatan spesifik protein dengan ligan dihancurkan. Selama denaturasi, struktur utama protein tetap tidak berubah.
Penerapan agen denaturasi dalam penelitian biologi dan kedokteran. DI DALAM penelitian biokimia Sebelum menentukan senyawa dengan berat molekul rendah dalam bahan biologis, protein biasanya dihilangkan terlebih dahulu dari larutan. Asam trikloroasetat (TCA) paling sering digunakan untuk tujuan ini. Setelah menambahkan TCA ke dalam larutan, protein yang terdenaturasi mengendap dan mudah dihilangkan dengan penyaringan (Tabel 1.1.)
Dalam pengobatan, bahan pendenaturasi sering digunakan untuk mensterilkan peralatan dan bahan medis dalam autoklaf (bahan pendenaturasi adalah suhu tinggi) dan sebagai antiseptik (alkohol, fenol, kloramin) untuk merawat permukaan terkontaminasi yang mengandung mikroflora patogen.
2. Reaktivasi protein secara spontan- bukti determinisme struktur primer, konformasi dan fungsi protein. Protein individu adalah produk dari satu gen yang memiliki urutan asam amino yang identik dan memperoleh konformasi yang sama di dalam sel. Kesimpulan mendasar bahwa struktur primer suatu protein sudah berisi informasi tentang konformasi dan fungsinya dibuat berdasarkan kemampuan beberapa protein (khususnya, ribonuklease dan mioglobin) untuk melakukan reaktifasi secara spontan - mengembalikan konformasi aslinya setelah denaturasi.
Pembentukan struktur protein spasial dilakukan dengan metode self-assembly - suatu proses spontan di mana rantai polipeptida, yang memiliki struktur primer unik, cenderung mengadopsi konformasi dengan energi bebas terendah dalam larutan. Kemampuan untuk mengaktifkan kembali protein yang mempertahankan struktur primernya setelah denaturasi dijelaskan dalam percobaan dengan enzim ribonuklease.
Ribonuklease adalah enzim yang memecah ikatan antara nukleotida individu dalam molekul RNA. Protein globular ini mempunyai satu rantai polipeptida, struktur tersiernya distabilkan oleh banyak ikatan lemah dan empat ikatan disulfida.
Perlakuan ribonuklease dengan urea, yang memutus ikatan hidrogen dalam molekul, dan zat pereduksi, yang memutus ikatan disulfida, menyebabkan denaturasi enzim dan hilangnya aktivitasnya.
Penghapusan agen denaturasi melalui dialisis mengarah pada pemulihan konformasi dan fungsi protein, yaitu untuk kelahiran kembali. (Gbr. 1.17).
 Beras. 1.17. Denaturasi dan renativasi ribonuklease
Beras. 1.17. Denaturasi dan renativasi ribonuklease
A - konformasi asli ribonuklease, dalam struktur tersiernya terdapat empat ikatan disulfida; B - molekul ribonuklease terdenaturasi;
B - molekul ribonuklease yang diaktifkan kembali dengan struktur dan fungsi yang dipulihkan
1. Isi tabel 1.2.
Tabel 1.2. Klasifikasi asam amino menurut polaritas radikalnya
2. Tuliskan rumus tetrapeptida:
Asp - Pro - Fen - Liz
a) menyoroti gugus berulang dalam peptida yang membentuk tulang punggung peptida dan gugus variabel yang diwakili oleh radikal asam amino;
b) memberi label pada ujung N dan C;
c) menyorot ikatan peptida;
d) tulis peptida lain yang terdiri dari asam amino yang sama;
e) menghitung jumlah kemungkinan varian tetrapeptida dengan komposisi asam amino yang serupa.
3. Jelaskan peran struktur primer protein dengan menggunakan contoh analisis komparatif dua hormon peptida neurohipofisis mamalia yang serupa secara struktural dan dekat secara evolusioner - oksitosin dan vasopresin (Tabel 1.3).
Tabel 1.3. Struktur dan fungsi oksitosin dan vasopresin
 Untuk ini:
Untuk ini:
a) membandingkan komposisi dan urutan asam amino dari dua peptida;
b) menemukan kesamaan struktur utama kedua peptida dan kesamaan tindakan biologisnya;
c) menemukan perbedaan struktur dua peptida dan perbedaan fungsinya;
d) menarik kesimpulan tentang pengaruh struktur primer peptida terhadap fungsinya.
4. Jelaskan tahapan utama pembentukan konformasi protein globular (sekunder, struktur tersier, konsep struktur supersekunder). Tunjukkan jenis ikatan yang terlibat dalam pembentukan struktur protein. Radikal asam amino manakah yang dapat berpartisipasi dalam pembentukan interaksi hidrofobik, ionik, ikatan hidrogen.
Berikan contoh.
5. Definisikan konsep "labilitas konformasi protein", tunjukkan alasan keberadaan dan signifikansinya.
6. Perluas arti dari frasa berikut: “Fungsi protein didasarkan pada interaksi spesifiknya dengan ligan”, dengan menggunakan istilah dan penjelasan maknanya: konformasi protein, pusat aktif, ligan, saling melengkapi, fungsi protein.
7. Dengan menggunakan satu contoh, jelaskan apa itu domain dan apa perannya dalam fungsi protein.
TUGAS PENGENDALIAN DIRI
1. Cocok.
Gugus fungsi dalam radikal asam amino:
A. Gugus karboksil B. Gugus hidroksil C Gugus guanidin D. Gugus tiol E. Gugus amino
2. Pilihlah jawaban yang benar.
Asam amino dengan radikal tak bermuatan polar adalah:
A. Cis B. Asn
B. Glu G. Tiga
3. Pilihlah jawaban yang benar.
Radikal asam amino:
A. Memberikan kekhususan struktur primer B. Berpartisipasi dalam pembentukan struktur tersier
B. Terletak di permukaan protein, mempengaruhi kelarutannya D. Membentuk pusat aktif
D. Berpartisipasi dalam pembentukan ikatan peptida
4. Pilihlah jawaban yang benar.
Interaksi hidrofobik dapat terbentuk antara radikal asam amino:
A. Tre Lay B. Pro Tiga
B. Bertemu Ile G. Tir Ala D. Val Fen
5. Pilihlah jawaban yang benar.
Ikatan ionik dapat terbentuk antara radikal asam amino:
A. Gln Asp B. Apr Liz
B.Liz Glu G.Gis Asp D.Asn Apr
6. Pilihlah jawaban yang benar.
Ikatan hidrogen dapat terbentuk antara radikal asam amino:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. Cocok.
Jenis ikatan yang terlibat dalam pembentukan struktur protein:
A. Struktur primer B. Struktur sekunder
B. Struktur tersier
D. Struktur Supersekunder E. Konformasi.
1. Ikatan hidrogen antar atom tulang punggung peptida
2. Lemahnya ikatan antar gugus fungsi radikal asam amino
3. Ikatan antara gugus α-amino dan α-karboksil asam amino
8. Pilihlah jawaban yang benar. Tripsin:
A. Enzim proteolitik B. Berisi dua domain
B. Menghidrolisis pati
D. Situs aktif terletak di antara domain. D. Terdiri dari dua rantai polipeptida.
9. Pilihlah jawaban yang benar. Atropin:
A.Neurotransmitter
B. Analog struktural asetilkolin
B. Berinteraksi dengan reseptor H-kolinergik
D. Memperkuat konduksi impuls saraf melalui sinapsis kolinergik
D. Penghambat kompetitif reseptor M-kolinergik
10. Pilihlah pernyataan yang benar. Dalam protein:
A. Struktur primer berisi informasi tentang struktur situs aktifnya
B. Pusat aktif terbentuk pada tingkat struktur primer
B. Konformasinya ditetapkan secara kaku oleh ikatan kovalen
D. Situs aktif dapat berinteraksi dengan sekelompok ligan serupa
karena labilitas konformasi protein D. Perubahan lingkungan, dapat mempengaruhi afinitas aktif
pusat ke ligan
1.1-B, 2-G, 3-B.
3.A,B,C,D.
7. 1-B, 2-D, 3-A.
8.A,B,C,D.
SYARAT DAN KONSEP DASAR
1. Protein, polipeptida, asam amino
2. Struktur protein primer, sekunder, tersier
3. Konformasi, konformasi protein asli
4. Ikatan kovalen dan lemah pada protein
5. Labilitas konformasi
6. Situs aktif protein
7. Ligan
8. Pelipatan protein
9. Analog struktur ligan
10. Protein domain
11. Protein sederhana dan kompleks
12. Denaturasi protein, zat pendenaturasi
13. Reaktivasi protein
Menyelesaikan masalah
“Organisasi struktural protein dan dasar fungsinya”
1. Fungsi utama protein - hemoglobin A (HbA) adalah pengangkutan oksigen ke jaringan. Dalam populasi manusia, berbagai bentuk protein ini diketahui mengalami perubahan sifat dan fungsi - yang disebut hemoglobin abnormal. Misalnya, hemoglobin S, yang ditemukan dalam sel darah merah pasien dengan penyakit sel sabit (HbS), diketahui memiliki kelarutan yang rendah dalam kondisi tekanan parsial oksigen yang rendah (seperti halnya pada darah vena). Hal ini mengarah pada pembentukan agregat protein ini. Protein kehilangan fungsinya, mengendap, dan sel darah merah bertambah bentuknya tidak beraturan(beberapa di antaranya berbentuk sabit) dan dihancurkan lebih cepat dari biasanya di limpa. Akibatnya, anemia sel sabit berkembang.
Satu-satunya perbedaan dalam struktur primer HbA ditemukan di wilayah N-terminal rantai β hemoglobin. Bandingkan daerah N-terminal dari untai β dan tunjukkan bagaimana perubahan struktur primer protein mempengaruhi sifat dan fungsinya.
 Untuk ini:
Untuk ini:
a) tuliskan rumus asam amino yang membedakan HbA dan bandingkan sifat asam amino tersebut (polaritas, muatan).
b) menarik kesimpulan tentang penyebab penurunan kelarutan dan terganggunya pengangkutan oksigen ke jaringan.
2. Gambar tersebut menunjukkan diagram struktur protein yang mempunyai pusat pengikatan dengan ligan (pusat aktif). Jelaskan mengapa protein bersifat selektif dalam pemilihan ligannya. Untuk ini:
a) ingat apa itu pusat aktif suatu protein dan perhatikan struktur pusat aktif protein yang ditunjukkan pada gambar;
b) tuliskan rumus radikal asam amino yang menyusun pusat aktif;
c) menggambar ligan yang secara spesifik dapat berinteraksi dengan situs aktif protein. Tunjukkan gugus fungsi yang dapat membentuk ikatan dengan radikal asam amino yang membentuk pusat aktif;
d) menunjukkan jenis ikatan yang timbul antara ligan dan radikal asam amino pusat aktif;
e) menjelaskan kekhususan interaksi protein-ligan berdasarkan apa.
 3.
Gambar tersebut menunjukkan situs aktif protein dan beberapa ligan.
3.
Gambar tersebut menunjukkan situs aktif protein dan beberapa ligan.
Tentukan ligan mana yang paling mungkin berinteraksi dengan situs aktif protein dan alasannya.
 Jenis ikatan apa yang timbul selama pembentukan kompleks protein-ligan?
Jenis ikatan apa yang timbul selama pembentukan kompleks protein-ligan?
4. Analog struktural ligan protein alami dapat digunakan sebagai obat untuk memodifikasi aktivitas protein.
Asetilkolin adalah mediator transmisi eksitasi pada sinapsis neuromuskular. Ketika asetilkolin berinteraksi dengan protein - reseptor membran postsinaptik otot rangka, saluran ion terbuka dan terjadi kontraksi otot. Ditilin adalah obat yang digunakan dalam beberapa operasi untuk mengendurkan otot, karena mengganggu transmisi impuls saraf melalui sinapsis neuromuskular. Jelaskan mekanisme kerja ditilin sebagai pelemas otot. Untuk ini:
a) tuliskan rumus asetilkolin dan ditilin serta bandingkan strukturnya;
b) menjelaskan mekanisme efek relaksasi ditilin.
5. Pada beberapa penyakit, suhu tubuh penderita meningkat, yang dianggap sebagai reaksi perlindungan tubuh. Namun suhu tinggi merusak protein tubuh. Jelaskan mengapa pada suhu di atas 40 °C fungsi protein terganggu dan timbul ancaman bagi kehidupan manusia. Untuk melakukan ini, ingatlah:
1) Struktur protein dan ikatan yang menjaga strukturnya dalam konformasi asli;
2) Bagaimana struktur dan fungsi protein berubah seiring dengan meningkatnya suhu?;
3) Apa itu homeostatis dan mengapa penting untuk menjaga kesehatan manusia.
Unit modular 2 PROTEIN OLIGOMERICK SEBAGAI TARGET PENGARUH REGULASI. KEANEKARAGAMAN STRUKTURAL DAN FUNGSIONAL PROTEIN. METODE PEMISAHAN DAN PEMURNIKAN PROTEIN
Tujuan pembelajaran Mampu:
1. Menggunakan pengetahuan tentang ciri-ciri struktur dan fungsi protein oligomer untuk memahami mekanisme adaptif pengaturan fungsinya.
2. Jelaskan peran pendamping dalam sintesis dan pemeliharaan konformasi protein dalam kondisi seluler.
3. Menjelaskan keragaman manifestasi kehidupan melalui keragaman struktur dan fungsi protein yang disintesis dalam tubuh.
4. Menganalisis hubungan antara struktur protein dan fungsinya menggunakan contoh perbandingan hemoprotein terkait - mioglobin dan hemoglobin, serta perwakilan dari lima kelas protein dari keluarga imunoglobulin.
5. Menerapkan pengetahuan tentang kekhasan sifat fisik dan kimia protein untuk memilih metode pemurniannya dari protein dan pengotor lain.
6. Menafsirkan hasil kuantitatif dan komposisi berkualitas protein plasma darah untuk memastikan atau memperjelas diagnosis klinis.
Tahu:
1. Ciri-ciri struktur protein oligomer dan mekanisme adaptif untuk mengatur fungsinya menggunakan contoh hemoglobin.
2. Struktur dan fungsi pendamping dan pentingnya menjaga konformasi asli protein dalam kondisi seluler.
3. Prinsip penggabungan protein ke dalam famili berdasarkan kesamaan konformasi dan fungsinya dengan menggunakan contoh imunoglobulin.
4. Cara pemisahan protein berdasarkan ciri-ciri sifat fisikokimianya.
5. Elektroforesis plasma darah sebagai metode untuk menilai komposisi protein secara kualitatif dan kuantitatif.
TOPIK 1.4. FITUR STRUKTUR DAN FUNGSI PROTEIN OLIGOMER MENGGUNAKAN CONTOH HEMOGLOBIN
1. Banyak protein mengandung beberapa rantai polipeptida. Protein seperti ini disebut oligomer, dan rantai individu - protomer. Protomer dalam protein oligomer dihubungkan oleh banyak ikatan non-kovalen lemah (hidrofobik, ionik, hidrogen). Interaksi
protomer dilakukan berkat komplementaritas permukaan kontak mereka.
Jumlah protomer dalam protein oligomer dapat sangat bervariasi: hemoglobin mengandung 4 protomer, enzim aspartat aminotransferase memiliki 12 protomer, dan protein virus mosaik tembakau mengandung 2.120 protomer yang dihubungkan melalui ikatan non-kovalen. Akibatnya, protein oligomer dapat memiliki berat molekul yang sangat tinggi.
Interaksi satu protomer dengan protomer lainnya dapat dianggap sebagai kasus spesial interaksi protein-ligan, karena setiap protomer berfungsi sebagai ligan untuk protomer lainnya. Jumlah dan cara bergabungnya protomer dalam suatu protein disebut struktur protein kuaterner.
Protein dapat mengandung protomer dengan struktur yang sama atau berbeda, misalnya homodimer adalah protein yang mengandung dua protomer identik, dan heterodimer adalah protein yang mengandung dua protomer berbeda.
Jika protein mengandung protomer yang berbeda, maka pusat pengikatan dengan ligan berbeda yang strukturnya berbeda dapat terbentuk pada protein tersebut. Ketika ligan berikatan dengan situs aktif, fungsi protein ini terwujud. Pusat yang terletak pada protomer berbeda disebut alosterik (berbeda dengan protomer aktif). Menghubungi ligan atau efektor alosterik, ia melakukan fungsi pengaturan (Gbr. 1.18). Interaksi pusat alosterik dengan efektor menyebabkan perubahan konformasi pada struktur seluruh protein oligomer karena labilitas konformasinya. Hal ini mempengaruhi afinitas situs aktif untuk ligan tertentu dan mengatur fungsi protein tersebut. Perubahan konformasi dan fungsi semua protomer selama interaksi protein oligomer dengan setidaknya satu ligan disebut perubahan konformasi kooperatif. Efektor yang meningkatkan fungsi protein disebut aktivator, dan efektor yang menghambat fungsinya - penghambat.
Jadi, protein oligomer, serta protein dengan struktur domain, memiliki sifat baru dibandingkan dengan protein monomer - kemampuan untuk mengatur fungsi secara alosterik (regulasi dengan menempelkan ligan berbeda ke protein). Hal ini dapat dilihat dengan membandingkan struktur dan fungsi dua protein kompleks yang berkaitan erat, mioglobin dan hemoglobin.
 Beras. 1.18. Skema struktur protein dimer
Beras. 1.18. Skema struktur protein dimer
2. Pembentukan struktur spasial dan fungsi mioglobin.
Mioglobin (Mb) adalah protein yang terdapat pada otot merah, yang fungsi utamanya adalah menciptakan cadangan O2 yang diperlukan untuk kerja otot yang intens. Mb adalah protein kompleks yang mengandung bagian protein - apoMb dan bagian non-protein - heme. Struktur utama apoMB menentukan konformasi globular kompaknya dan struktur pusat aktif, tempat melekatnya bagian non-protein mioglobin, heme. Oksigen yang berasal dari darah ke otot berikatan dengan heme Fe+2 di mioglobin. Mb merupakan protein monomer yang memiliki afinitas sangat tinggi terhadap O 2, sehingga pelepasan oksigen oleh mioglobin hanya terjadi selama kerja otot yang intens, ketika tekanan parsial O 2 menurun tajam.
Pembentukan konformasi Mv. Di otot merah, pada ribosom, selama translasi, struktur utama MB disintesis, diwakili oleh urutan spesifik 153 residu asam amino. Struktur sekunder Mb mengandung delapan heliks α, yang disebut dengan huruf Latin dari A sampai H, di antaranya terdapat daerah non-heliks. Struktur tersier Mb berbentuk globul kompak, di dalam ceruknya terdapat pusat aktif antara heliks F dan E (Gbr. 1.19).
 Beras. 1.19. Struktur mioglobin
Beras. 1.19. Struktur mioglobin
3. Ciri-ciri struktur dan fungsi pusat aktif MV. Pusat aktif Mb dibentuk terutama oleh radikal asam amino hidrofobik, yang berjarak jauh satu sama lain dalam struktur primer (misalnya, Tri 3 9 dan Fen 138) Ligan yang sukar larut dalam air - heme dan O 2 - menempel pada pusat aktif. Heme adalah ligan spesifik apoMB (Gbr. 1.20), yang dasarnya terdiri dari empat cincin pirol yang dihubungkan oleh jembatan metenil; di tengahnya terdapat atom Fe+ 2 yang terhubung ke atom nitrogen pada cincin pirol melalui empat ikatan koordinasi. Di pusat aktif Mb, selain radikal asam amino hidrofobik, juga terdapat residu dua asam amino dengan radikal hidrofilik - Gis E 7(Gis 64) dan GIS F 8(93 miliknya) (Gbr. 1.21).
 Beras. 1.20. Struktur heme - bagian non-protein dari mioglobin dan hemoglobin
Beras. 1.20. Struktur heme - bagian non-protein dari mioglobin dan hemoglobin
 Beras. 1.21. Lokasi heme dan O2 di situs aktif apomioglobin dan protomer hemoglobin
Beras. 1.21. Lokasi heme dan O2 di situs aktif apomioglobin dan protomer hemoglobin
Heme terikat secara kovalen ke F8-Nya melalui atom besi. O 2 menempel pada besi di sisi lain bidang heme. E 7-nya diperlukan untuk orientasi O 2 yang benar dan memfasilitasi penambahan oksigen ke Fe + 2 heme
GIS F 8 membentuk ikatan koordinasi dengan Fe+ 2 dan mengikat heme dengan kuat di pusat aktif. Gis E 7 diperlukan untuk orientasi yang benar di pusat aktif ligan lain - O 2 selama interaksinya dengan Fe + 2 heme. Lingkungan mikro heme menciptakan kondisi pengikatan O2 ke Fe+2 yang kuat namun reversibel dan mencegah air memasuki situs aktif hidrofobik, yang dapat menyebabkan oksidasi menjadi Fe+3.
Struktur monomer Mb dan pusat aktifnya menentukan tingginya afinitas protein terhadap O2.
4. Struktur oligomer Hb dan pengaturan afinitas Hb terhadap ligan O2. Hemoglobin manusia- keluarga protein, seperti mioglobin, yang berhubungan dengan protein kompleks (hemoprotein). Mereka memiliki struktur tetramerik dan mengandung dua rantai α, tetapi berbeda dalam struktur dua rantai polipeptida lainnya (rantai 2α-, 2x). Struktur rantai polipeptida kedua menentukan ciri-ciri fungsi bentuk Hb ini. Sekitar 98% hemoglobin dalam sel darah merah orang dewasa adalah hemoglobin A(rantai 2α-, 2p).
Selama perkembangan janin, ada dua jenis utama hemoglobin yang berfungsi: Hb embrionik(2α, 2ε), yang ditemukan pada tahap awal perkembangan janin, dan hemoglobin F (janin)- (2α, 2γ), yang menggantikan hemoglobin janin awal pada bulan keenam perkembangan intrauterin dan hanya setelah lahir digantikan oleh Hb A.
HB A adalah protein terkait mioglobin (MB) yang ditemukan pada sel darah merah manusia dewasa. Struktur masing-masing protomernya mirip dengan mioglobin. Struktur sekunder dan tersier dari protomer mioglobin dan hemoglobin sangat mirip, meskipun faktanya dalam struktur primer rantai polipeptidanya hanya 24 residu asam amino yang identik (struktur sekunder protomer hemoglobin, seperti mioglobin, mengandung delapan heliks α, ditunjuk dengan huruf latin dari A sampai H , dan struktur tersiernya berbentuk bola kompak). Namun berbeda dengan mioglobin, hemoglobin memiliki struktur oligomer, terdiri dari empat rantai polipeptida yang dihubungkan melalui ikatan non-kovalen (Gambar 1.22).
Setiap protomer Hb dikaitkan dengan bagian non-protein - heme dan protomer tetangganya. Hubungan bagian protein Hb dengan heme mirip dengan mioglobin: pada pusat aktif protein, bagian hidrofobik heme dikelilingi oleh radikal asam amino hidrofobik kecuali His F 8 dan His E 7, yang terletak di kedua sisi bidang heme dan memainkan peran serupa dalam fungsi protein dan pengikatannya dengan oksigen (lihat struktur mioglobin).
 Beras. 1.22. Struktur oligomer hemoglobin
Beras. 1.22. Struktur oligomer hemoglobin
Di samping itu, Gis E 7 melakukan hal yang penting peran tambahan dalam berfungsinya Nv. Heme bebas memiliki afinitas 25.000 kali lebih tinggi terhadap CO dibandingkan O2. CO terbentuk dalam jumlah kecil di dalam tubuh dan, mengingat afinitasnya yang tinggi terhadap heme, CO dapat mengganggu pengangkutan O2 yang diperlukan untuk kehidupan sel. Namun, dalam komposisi hemoglobin, afinitas heme terhadap karbon monoksida melebihi afinitas terhadap O 2 hanya 200 kali lipat karena adanya His E 7 di pusat aktif. Sisa asam amino ini menciptakan kondisi optimal untuk pengikatan heme ke O2 dan melemahkan interaksi heme dengan CO.
5. Fungsi utama HB adalah mengangkut O2 dari paru-paru ke jaringan. Berbeda dengan mioglobin monomer, yang memiliki afinitas sangat tinggi terhadap O2 dan berfungsi menyimpan oksigen di otot merah, struktur oligomer hemoglobin menyediakan:
1) cepat saturasi HB dengan oksigen di paru-paru;
2) kemampuan HB melepaskan oksigen dalam jaringan pada tekanan parsial O 2 yang relatif tinggi (20-40 mm Hg);
3) kemungkinan mengatur afinitas Hb terhadap O2.
6. Perubahan kooperatif dalam konformasi protomer hemoglobin mempercepat pengikatan O2 di paru-paru dan pelepasannya ke jaringan. Di paru-paru, tekanan parsial O2 yang tinggi mendorong pengikatannya dengan Hb di situs aktif empat protomer (2α dan 2β). Pusat aktif setiap protomer, seperti pada mioglobin, terletak di antara dua heliks α (F dan E) dalam kantong hidrofobik. Ini mengandung bagian non-protein - heme, melekat pada bagian protein melalui banyak interaksi hidrofobik lemah dan satu ikatan kuat antara Fe 2 + heme dan His F 8 (lihat Gambar 1.21).
Dalam deoksihemoglobin, karena ikatan dengan F 8 His, atom Fe 2 + menonjol dari bidang heme menuju histidin. Pengikatan O 2 ke Fe 2 + terjadi di sisi lain heme di wilayah His E 7 menggunakan ikatan koordinasi bebas tunggal. E 7 miliknya memberikan kondisi optimal untuk pengikatan O 2 ke besi heme.
Penambahan O2 pada atom Fe+2 dari salah satu protomer menyebabkan pergerakannya ke bidang heme, diikuti oleh residu histidin yang terkait dengannya.
 Beras. 1.23. Perubahan konformasi protomer hemoglobin bila dikombinasikan dengan O2
Beras. 1.23. Perubahan konformasi protomer hemoglobin bila dikombinasikan dengan O2
Hal ini menyebabkan perubahan konformasi semua rantai polipeptida karena labilitas konformasinya. Mengubah konformasi rantai lain memfasilitasi interaksinya dengan molekul O2 berikutnya.
Molekul O2 keempat menempel pada hemoglobin 300 kali lebih mudah dibandingkan molekul pertama (Gbr. 1.24).
 Beras. 1.24. Perubahan kooperatif dalam konformasi protomer hemoglobin selama interaksinya dengan O2
Beras. 1.24. Perubahan kooperatif dalam konformasi protomer hemoglobin selama interaksinya dengan O2
Dalam jaringan, setiap molekul O2 berikutnya lebih mudah dibelah daripada molekul sebelumnya, juga karena perubahan kooperatif dalam konformasi protomer.
7. CO 2 dan H+ terbentuk selama katabolisme bahan organik, mengurangi afinitas hemoglobin terhadap O2 sebanding dengan konsentrasinya. Energi yang dibutuhkan untuk fungsi sel diproduksi terutama di mitokondria selama oksidasi zat organik menggunakan O2 yang dikirim dari paru-paru melalui hemoglobin. Sebagai hasil oksidasi zat organik, produk akhir penguraiannya terbentuk: CO 2 dan K 2 O, yang jumlahnya sebanding dengan intensitas proses oksidasi yang sedang berlangsung.
CO 2 berdifusi dari sel ke dalam darah dan menembus ke dalam sel darah merah, di mana, di bawah aksi enzim karbanhidrase, ia diubah menjadi asam karbonat. Asam lemah ini terdisosiasi menjadi proton dan ion bikarbonat.
H+ mampu bergabung dengan radikal-radikalnya 14 6 dalam rantai α- dan β hemoglobin, mis. di daerah yang jauh dari heme. Protonasi hemoglobin mengurangi afinitasnya terhadap O2, mendorong pembuangan O2 dari oksiHb, pembentukan deoksiHb, dan meningkatkan suplai oksigen ke jaringan sebanding dengan jumlah proton yang terbentuk (Gbr. 1.25).
Peningkatan jumlah oksigen yang dilepaskan tergantung pada peningkatan konsentrasi H+ dalam sel darah merah disebut efek Bohr (dinamai menurut ahli fisiologi Denmark Christian Bohr, yang pertama kali menemukan efek ini).
Di paru-paru, tekanan parsial oksigen yang tinggi mendorong pengikatannya dengan deoksiHb, yang mengurangi afinitas protein terhadap H+. Proton yang dilepaskan di bawah pengaruh asam karbonat bereaksi dengan bikarbonat membentuk CO 2 dan H 2 O

 Beras. 1.25. Ketergantungan afinitas Hb terhadap O 2 pada konsentrasi CO 2 dan proton (efek Bohr):
Beras. 1.25. Ketergantungan afinitas Hb terhadap O 2 pada konsentrasi CO 2 dan proton (efek Bohr):
A- pengaruh konsentrasi CO 2 dan H+ terhadap pelepasan O 2 dari kompleks dengan HB (efek Bohr); B- oksigenasi deoksihemoglobin di paru-paru, pembentukan dan pelepasan CO2.
CO 2 yang dihasilkan memasuki ruang alveolar dan dikeluarkan bersama udara yang dihembuskan. Dengan demikian, jumlah oksigen yang dilepaskan oleh hemoglobin dalam jaringan diatur oleh produk katabolisme zat organik: semakin intens pemecahan zat, misalnya selama latihan fisik, semakin tinggi konsentrasi CO 2 dan H + serta semakin banyak oksigen. jaringan menerima sebagai akibat dari penurunan afinitas Hb terhadap O2.
8. Regulasi alosterik afinitas Hb terhadap O2 oleh ligan - 2,3-bifosfogliserat. Dalam eritrosit, ligan alosterik hemoglobin, 2,3-bifosfogliserat (2,3-BPG), disintesis dari produk oksidasi glukosa - 1,3-bifosfogliserat. Dalam kondisi normal, konsentrasi 2,3-BPG tinggi dan sebanding dengan konsentrasi Hb. 2,3-BPG memiliki muatan negatif kuat -5.
 Bifosfogliserat di kapiler jaringan, berikatan dengan deoksihemoglobin, meningkatkan pelepasan oksigen ke jaringan, mengurangi afinitas Hb terhadap O2.
Bifosfogliserat di kapiler jaringan, berikatan dengan deoksihemoglobin, meningkatkan pelepasan oksigen ke jaringan, mengurangi afinitas Hb terhadap O2.
Di tengah molekul hemoglobin tetramerik terdapat rongga. Ini dibentuk oleh residu asam amino dari keempat protomer (lihat Gambar 1.22). Di kapiler jaringan, protonasi Hb (efek Bohr) menyebabkan putusnya ikatan antara besi heme dan O2. Dalam sebuah molekul
deoksihemoglobin dibandingkan dengan oksihemoglobin ada tambahan ikatan ionik, menghubungkan protomer, akibatnya dimensi rongga pusat meningkat dibandingkan dengan oksihemoglobin. Rongga sentral merupakan tempat melekatnya 2,3-BPG pada hemoglobin. Karena perbedaan ukuran rongga tengah, 2,3-BPG hanya dapat menempel pada deoksihemoglobin.
2,3-BPG berinteraksi dengan hemoglobin di tempat yang jauh dari pusat aktif protein dan termasuk dalam alosterik ligan (pengaturan), dan rongga tengah Hb adalah pusat alosterik. 2,3-BPG memiliki muatan negatif yang kuat dan berinteraksi dengan lima gugus bermuatan positif dari dua rantai β Hb: gugus N-terminal α-amino dari Val dan radikal Lys 82 His 143 (Gbr. 1.26).
 Beras. 1.26. BPG di rongga tengah deoksihemoglobin
Beras. 1.26. BPG di rongga tengah deoksihemoglobin
BPG berikatan dengan tiga gugus bermuatan positif pada setiap untai β.
Dalam kapiler jaringan, deoksihemoglobin yang dihasilkan berinteraksi dengan 2,3-BPG dan ikatan ionik terbentuk antara radikal rantai β bermuatan positif dan ligan bermuatan negatif, yang mengubah konformasi protein dan mengurangi afinitas Hb terhadap O2. . Penurunan afinitas Hb terhadap O 2 mendorong pelepasan O 2 yang lebih efisien ke dalam jaringan.
Di paru-paru, pada tekanan parsial tinggi, oksigen berinteraksi dengan Hb, bergabung dengan besi heme; dalam hal ini, konformasi protein berubah, rongga pusat berkurang dan 2,3-BPG dipindahkan dari pusat alosterik
Dengan demikian, protein oligomer memiliki sifat baru dibandingkan dengan protein monomer. Perlekatan ligan di situs
berjauhan secara spasial satu sama lain (alosterik), dapat menyebabkan perubahan konformasi pada seluruh molekul protein. Akibat interaksi dengan ligan pengatur, terjadi perubahan konformasi dan adaptasi fungsi molekul protein terhadap perubahan lingkungan.
TOPIK 1.5. PEMELIHARAAN KONFORMASI ASLI PROTEIN DALAM KONDISI SEL
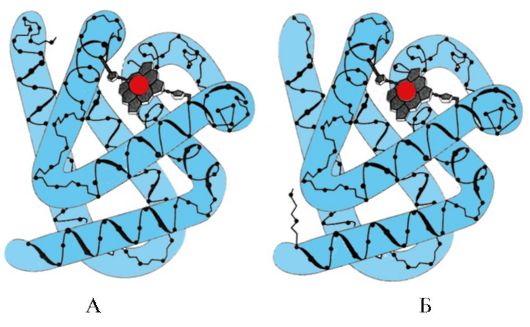
Dalam sel, selama sintesis rantai polipeptida, pengangkutannya melalui membran ke bagian sel yang sesuai, selama proses pelipatan (pembentukan konformasi asli) dan selama perakitan protein oligomer, serta selama fungsinya, zat antara , konformasi yang rawan agregasi dan tidak stabil muncul dalam struktur protein. Radikal hidrofobik, biasanya tersembunyi di dalam molekul protein dalam konformasi asli, muncul di permukaan dalam konformasi tidak stabil dan cenderung bergabung dengan kelompok protein lain yang sulit larut dalam air. Protein khusus telah ditemukan dalam sel semua organisme yang diketahui yang memastikan pelipatan protein sel yang optimal, menstabilkan konformasi aslinya selama berfungsi dan, yang paling penting, mempertahankan struktur dan fungsi protein intraseluler ketika homeostasis terganggu. Protein-protein ini disebut "pendamping" yang berarti "pengasuh" dalam bahasa Perancis.
1. Pendamping molekuler dan perannya dalam mencegah denaturasi protein.
Pendamping (CH) diklasifikasikan menurut massa subunitnya. Pendamping dengan berat molekul tinggi memiliki massa 60 hingga 110 kDa. Diantaranya, tiga kelas yang paling banyak dipelajari: Sh-60, Sh-70 dan Sh-90. Setiap kelas mencakup keluarga protein terkait. Jadi, Sh-70 mencakup protein dengan berat molekul 66 hingga 78 kDa. Pendamping dengan berat molekul rendah memiliki berat molekul 40 hingga 15 kDa.
Di antara para pendamping ada pokok protein, sintesis basalnya yang tinggi tidak bergantung pada efek stres pada sel-sel tubuh, dan dapat diinduksi, sintesisnya lemah dalam kondisi normal, tetapi meningkat tajam di bawah tekanan. Pendamping yang dapat diinduksi juga disebut “protein kejutan panas” karena pertama kali ditemukan dalam sel yang terkena suhu tinggi. Dalam sel, karena konsentrasi protein yang tinggi, reaktivasi spontan protein yang terdenaturasi sebagian menjadi sulit. Sh-70 dapat mencegah timbulnya denaturasi dan membantu mengembalikan konformasi asli protein. Pendamping molekuler-70- kelas protein yang sangat terkonservasi yang ditemukan di semua bagian sel: sitoplasma, nukleus, retikulum endoplasma, mitokondria. Pada ujung karboksil rantai polipeptida tunggal Ш-70 terdapat daerah berupa alur yang mampu berinteraksi dengan peptida yang panjangnya
dari 7 hingga 9 residu asam amino yang diperkaya dengan radikal hidrofobik. Daerah seperti itu pada protein globular terdapat kira-kira setiap 16 asam amino. Sh-70 mampu melindungi protein dari inaktivasi suhu dan memulihkan konformasi serta aktivitas protein yang terdenaturasi sebagian.
2. Peran pendamping dalam pelipatan protein. Selama sintesis protein di ribosom, daerah terminal-N dari polipeptida disintesis sebelum terminal-C. Untuk membentuk konformasi asli, diperlukan rangkaian asam amino lengkap dari protein. Dalam proses sintesis protein, pendamping-70 karena struktur pusat aktifnya mampu menutup area polipeptida yang rentan agregasi, diperkaya dengan radikal asam amino hidrofobik hingga sintesis selesai (Gambar 1.27, A ).
 Beras. 1.27. Partisipasi pendamping dalam pelipatan protein
Beras. 1.27. Partisipasi pendamping dalam pelipatan protein
A - partisipasi pendamping-70 dalam pencegahan interaksi hidrofobik antara bagian polipeptida yang disintesis; B - pembentukan konformasi asli protein di kompleks pendamping
Banyak protein bermolekul tinggi yang memiliki konformasi kompleks, seperti struktur domain, terlipat dalam ruang khusus yang dibentuk oleh Sh-60. Sh-60 berfungsi sebagai kompleks oligomer yang terdiri dari 14 subunit. Mereka membentuk dua cincin berongga, yang masing-masing terdiri dari tujuh subunit, cincin ini terhubung satu sama lain. Setiap subunit Sh-60 terdiri dari tiga domain: apikal (apikal), diperkaya dengan radikal hidrofobik yang menghadap rongga cincin, perantara dan khatulistiwa (Gbr. 1.28).
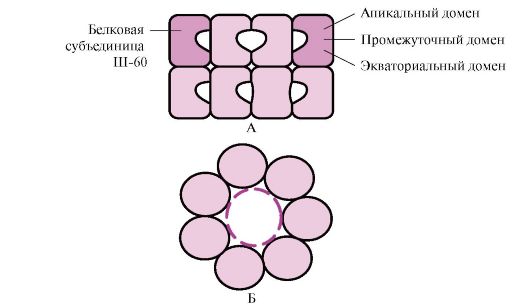 Beras. 1.28. Struktur kompleks pendamping terdiri dari 14 Ш-60
Beras. 1.28. Struktur kompleks pendamping terdiri dari 14 Ш-60
A - tampak samping; B - tampilan atas
Protein yang disintesis, yang memiliki unsur-unsur pada permukaan yang merupakan karakteristik molekul yang tidak terlipat, khususnya radikal hidrofobik, memasuki rongga cincin pendamping. Dalam lingkungan spesifik rongga-rongga ini, kemungkinan konformasi dicari sampai satu-satunya konformasi yang paling disukai secara energetik ditemukan (Gbr. 1.27, B). Pembentukan konformasi dan pelepasan protein disertai dengan Hidrolisis ATP di wilayah khatulistiwa. Biasanya, pelipatan yang bergantung pada pendamping membutuhkan banyak energi.
Selain berpartisipasi dalam pembentukan struktur tiga dimensi protein dan renativasi protein yang terdenaturasi sebagian, pendamping juga diperlukan untuk terjadinya proses mendasar seperti perakitan protein oligomer, pengenalan dan pengangkutan protein terdenaturasi ke dalam lisosom, pengangkutan protein melintasi membran, dan partisipasi dalam pengaturan aktivitas kompleks protein.
TOPIK 1.6. VARIETAS PROTEIN. KELUARGA PROTEIN: CONTOH IMUNOGLOBULIN
1. Protein memainkan peran penting dalam kehidupan sel individu dan segalanya organisme multiseluler, dan fungsinya ternyata sangat beragam. Hal ini ditentukan oleh karakteristik struktur primer dan konformasi protein, struktur unik pusat aktif dan kemampuan mengikat ligan tertentu.
Hanya sebagian kecil dari semua kemungkinan varian rantai peptida yang dapat mengadopsi struktur spasial yang stabil; mayoritas
diantaranya dapat mengambil banyak konformasi dengan energi Gibbs yang kira-kira sama, tetapi dengan sifat yang berbeda. Struktur primer dari sebagian besar protein yang diketahui dipilih evolusi biologis, memberikan stabilitas luar biasa dari salah satu konformasi, yang menentukan kekhasan fungsi protein ini.
2. Keluarga protein. Dalam spesies biologis yang sama, substitusi residu asam amino dapat menyebabkan munculnya protein berbeda yang menjalankan fungsi terkait dan memiliki urutan homolog asam amino. Protein terkait tersebut mempunyai konformasi yang sangat mirip: jumlah dan posisi relatif heliks α dan/atau struktur β, dan sebagian besar putaran dan lengkungan rantai polipeptida serupa atau identik. Protein dengan daerah rantai polipeptida homolog, konformasi serupa dan fungsi terkait diklasifikasikan ke dalam keluarga protein. Contoh keluarga protein: proteinase serin, keluarga imunoglobulin, keluarga mioglobin.
Proteinase serin- keluarga protein yang menjalankan fungsi enzim proteolitik. Ini termasuk enzim pencernaan - chymotrypsin, trypsin, elastase dan banyak faktor pembekuan darah. Protein ini memiliki asam amino yang identik pada 40% posisinya dan konformasi yang sangat mirip (Gbr. 1.29).

Beras. 1.29. Struktur spasial elastase (A) dan kimotripsin (B)
Beberapa substitusi asam amino telah menyebabkan perubahan spesifisitas substrat protein ini dan munculnya keragaman fungsional dalam famili tersebut.
3. Keluarga imunoglobulin. Dalam berfungsinya sistem kekebalan tubuh, protein dari superfamili imunoglobulin memainkan peran besar, yang mencakup tiga keluarga protein:
Antibodi (imunoglobulin);
Reseptor limfosit T;
Protein dari kompleks histokompatibilitas utama - MHC kelas 1 dan 2 (Kompleks Histokompatibilitas Utama).
Semua protein ini memiliki struktur domain, terdiri dari domain mirip imun yang homolog dan melakukan fungsi serupa: mereka berinteraksi dengan struktur asing, baik yang terlarut dalam darah, getah bening atau cairan antar sel (antibodi), atau terletak di permukaan sel (milik atau luar negeri).
4. Antibodi- protein spesifik yang diproduksi oleh limfosit B sebagai respons terhadap masuknya struktur asing ke dalam tubuh, disebut antigen.
Fitur struktur antibodi
Molekul antibodi paling sederhana terdiri dari empat rantai polipeptida: dua rantai ringan identik - L, mengandung sekitar 220 asam amino, dan dua rantai berat identik - H, terdiri dari 440-700 asam amino. Keempat rantai dalam molekul antibodi dihubungkan oleh banyak ikatan non-kovalen dan empat ikatan disulfida (Gbr. 1.30).
Rantai ringan antibodi terdiri dari dua domain: domain variabel (VL), yang terletak di wilayah terminal-N rantai polipeptida, dan domain konstan (CL), yang terletak di terminal-C. Rantai berat biasanya memiliki empat domain: satu variabel (VH), terletak di ujung N, dan tiga domain konstan (CH1, CH2, CH3) (lihat Gambar 1.30). Setiap domain imunoglobulin memiliki superstruktur lembaran β di mana dua residu sistein dihubungkan oleh ikatan disulfida.
Di antara dua domain konstan CH1 dan CH2 terdapat daerah yang mengandung jumlah yang besar residu prolin, yang mencegah pembentukan struktur sekunder dan interaksi rantai H yang berdekatan di segmen ini. Daerah engsel ini memberikan fleksibilitas molekul antibodi. Di antara domain variabel rantai berat dan ringan terdapat dua situs pengikatan antigen yang identik (situs aktif untuk mengikat antigen), oleh karena itu antibodi semacam itu sering disebut bivalen. Tidak seluruh rangkaian asam amino dari daerah variabel kedua rantai terlibat dalam pengikatan antigen ke antibodi, tetapi hanya 20-30 asam amino yang terletak di daerah hipervariabel dari setiap rantai. Wilayah inilah yang menentukan kemampuan unik setiap jenis antibodi untuk berinteraksi dengan antigen komplementer terkait.
Antibodi adalah salah satu garis pertahanan tubuh terhadap serangan organisme asing. Fungsinya dapat dibagi menjadi dua tahap: tahap pertama adalah pengenalan dan pengikatan antigen pada permukaan organisme asing, yang dimungkinkan karena adanya situs pengikatan antigen dalam struktur antibodi; tahap kedua adalah permulaan proses inaktivasi dan penghancuran antigen. Spesifisitas tahap kedua bergantung pada kelas antibodi. Ada lima kelas rantai berat, berbeda satu sama lain dalam struktur domain konstan: α, δ, ε, γ dan μ, yang menurutnya lima kelas imunoglobulin dibedakan: A, D, E, G dan M.
Ciri-ciri struktural rantai berat memberikan daerah engsel dan daerah terminal-C rantai berat suatu karakteristik konformasi dari setiap kelas. Setelah antigen berikatan dengan antibodi, perubahan konformasi dalam domain konstan menentukan jalur penghilangan antigen.
 Beras. 1. 30. Struktur domain IgG
Beras. 1. 30. Struktur domain IgG
Imunoglobulin M
Imunoglobulin M memiliki dua bentuk.
Bentuk monomer- Antibodi kelas 1 yang diproduksi oleh pengembangan limfosit B. Selanjutnya, banyak sel B beralih untuk memproduksi antibodi kelas lain, tetapi dengan tempat pengikatan antigen yang sama. IgM tertanam dalam membran dan bertindak sebagai reseptor pengenalan antigen. Integrasi IgM ke dalam membran sel dimungkinkan karena adanya 25 residu asam amino hidrofobik di bagian ekor.
Bentuk sekretori IgM mengandung lima subunit monomer yang dihubungkan satu sama lain melalui ikatan disulfida dan rantai J polipeptida tambahan (Gbr. 1.31). Rantai berat monomer bentuk ini tidak mengandung ekor hidrofobik. Pentamer memiliki 10 situs pengikatan antigen sehingga efektif dalam mengenali dan menghilangkan antigen yang pertama kali masuk ke dalam tubuh. Bentuk sekretori IgM adalah kelas antibodi utama yang disekresikan ke dalam darah selama respon imun primer. Pengikatan IgM ke antigen mengubah konformasi IgM dan menginduksi pengikatannya pada komponen protein pertama dari sistem komplemen (sistem komplemen adalah sekumpulan protein yang terlibat dalam penghancuran antigen) dan aktivasi sistem ini. Jika antigen terletak pada permukaan suatu mikroorganisme, sistem komplemen menyebabkan pelanggaran integritas membran sel dan kematian sel bakteri.
Imunoglobulin G
Secara kuantitatif, kelas imunoglobulin ini mendominasi dalam darah (75% dari seluruh Ig). IgG - monomer, kelas utama antibodi yang disekresikan ke dalam darah selama respon imun sekunder. Setelah interaksi IgG dengan antigen permukaan mikroorganisme, kompleks antigen-antibodi mampu mengikat dan mengaktifkan protein sistem komplemen atau dapat berinteraksi dengan reseptor spesifik makrofag dan neutrofil. Interaksi dengan fagosit mengarah
 Beras. 1.31. Struktur bentuk sekretori IgM
Beras. 1.31. Struktur bentuk sekretori IgM
untuk penyerapan kompleks antigen-antibodi dan penghancurannya dalam fagosom sel. IgG adalah satu-satunya kelas antibodi yang mampu menembus penghalang plasenta dan memberikan perlindungan intrauterin pada janin dari infeksi.
Imunoglobulin A
Kelas utama antibodi terdapat dalam sekret (susu, air liur, sekret saluran pernafasan dan saluran usus). IgA disekresi terutama dalam bentuk dimer, di mana monomer dihubungkan satu sama lain melalui rantai J tambahan (Gbr. 1.32).
IgA tidak berinteraksi dengan sistem komplemen dan sel fagosit, tetapi dengan mengikat mikroorganisme, antibodi mencegah perlekatan mereka pada sel epitel dan penetrasi ke dalam tubuh.
Imunoglobulin E
Imunoglobulin E diwakili oleh monomer yang mengandung rantai ε berat, seperti rantai μ imunoglobulin M, satu variabel dan empat domain konstan. Setelah disekresi, IgE berikatan dengannya
 Beras. 1.32. Struktur IgA
Beras. 1.32. Struktur IgA
Daerah terminal-C dengan reseptor yang sesuai pada permukaan sel mast dan basofil. Akibatnya, mereka menjadi reseptor antigen pada permukaan sel tersebut (Gbr. 1.33).
 Beras. 1.33. Interaksi IgE dengan antigen pada permukaan sel mast
Beras. 1.33. Interaksi IgE dengan antigen pada permukaan sel mast
Setelah antigen berikatan dengan situs pengikatan antigen IgE yang sesuai, sel menerima sinyal untuk mensekresi secara biologis zat aktif(histamin, serotonin), yang sebagian besar bertanggung jawab atas perkembangan reaksi inflamasi dan manifestasi reaksi alergi seperti asma, urtikaria, demam.
Imunoglobulin D
Imunoglobulin D ditemukan dalam jumlah yang sangat kecil dalam serum; mereka adalah monomer. Rantai δ berat memiliki satu domain variabel dan tiga domain konstan. IgD bertindak sebagai reseptor untuk limfosit B; fungsi lainnya masih belum diketahui. Interaksi antigen spesifik dengan reseptor pada permukaan limfosit B (IgD) menyebabkan transmisi sinyal-sinyal ini ke dalam sel dan aktivasi mekanisme yang memastikan proliferasi klon limfosit tertentu.
TOPIK 1.7. SIFAT FISIK DAN KIMIA PROTEIN SERTA METODE PEMISAHANNYA
1. Protein individu berbeda dalam sifat fisik dan kimia:
Bentuk molekul;
Berat molekul;
Muatan total, yang besarnya bergantung pada perbandingan gugus asam amino anionik dan kationik;
Rasio radikal asam amino polar dan nonpolar pada permukaan molekul;
Tingkat resistensi terhadap berbagai agen denaturasi.
2. Kelarutan protein tergantung tentang sifat-sifat protein yang disebutkan di atas, serta tentang komposisi media di mana protein dilarutkan (nilai pH, komposisi garam, suhu, keberadaan zat organik lain yang dapat berinteraksi dengan protein). Besarnya muatan molekul protein merupakan salah satu faktor yang mempengaruhi kelarutannya. Ketika muatan pada titik isoelektrik hilang, protein lebih mudah berkumpul dan mengendap. Hal ini terutama terjadi pada protein terdenaturasi, di mana radikal asam amino hidrofobik muncul di permukaan.
Pada permukaan molekul protein terdapat radikal asam amino bermuatan positif dan negatif. Jumlah gugus ini, dan muatan total protein, bergantung pada pH medium, yaitu. perbandingan konsentrasi gugus H+ - dan OH -. Dalam lingkungan asam Peningkatan konsentrasi H+ menyebabkan penekanan disosiasi gugus karboksil -COO - + H+ > - COOH dan penurunan muatan negatif protein. Dalam lingkungan basa, pengikatan kelebihan OH - oleh proton yang terbentuk selama disosiasi gugus amino -NH 3 + + OH - - NH 2 + H 2 O dengan pembentukan air, menyebabkan penurunan muatan positif protein . Nilai pH dimana suatu protein mempunyai muatan bersih nol disebut titik isoelektrik (IEP). Dalam IET, jumlah gugus bermuatan positif dan negatif adalah sama, yaitu. protein berada dalam keadaan isoelektrik.
3. Pemisahan protein individu. Ciri-ciri struktur dan fungsi tubuh bergantung pada kumpulan protein yang disintesis di dalamnya. Mempelajari struktur dan sifat protein tidak mungkin dilakukan tanpa isolasinya dari sel dan pemurnian dari protein lain dan molekul organik. Tahapan isolasi dan pemurnian protein individu:
Penghancuran sel jaringan yang sedang dipelajari dan memperoleh homogenat.
Pemisahan homogenat menjadi pecahan dengan sentrifugasi, memperoleh fraksi nuklir, mitokondria, sitosol atau lainnya yang mengandung protein yang diinginkan.
Denaturasi termal selektif- pemanasan jangka pendek larutan protein, di mana beberapa pengotor protein yang terdenaturasi dapat dihilangkan (jika protein relatif stabil terhadap panas).
Mengasinkan. Protein yang berbeda mengendap pada konsentrasi garam yang berbeda dalam larutan. Dengan meningkatkan konsentrasi garam secara bertahap, dimungkinkan untuk memperoleh sejumlah fraksi terpisah dengan kandungan dominan protein terisolasi di salah satunya. Amonium sulfat paling sering digunakan untuk fraksinasi protein. Protein dengan kelarutan paling kecil akan mengendap pada konsentrasi garam rendah.
Filtrasi gel- metode menyaring molekul melalui butiran Sephadex yang membengkak (rantai polisakarida tiga dimensi dari dekstran yang memiliki pori-pori). Kecepatan protein melewati kolom yang diisi dengan Sephadex akan bergantung pada berat molekulnya: semakin kecil massa molekul protein, semakin mudah mereka menembus ke dalam butiran dan bertahan di sana lebih lama daripada lebih banyak massa, semakin cepat mereka terelusi dari kolom.
Ultrasentrifugasi- metode yang melibatkan penempatan protein dalam tabung sentrifus ke dalam rotor ultrasentrifugasi. Ketika rotor berputar, laju sedimentasi protein sebanding dengan berat molekulnya: fraksi protein yang lebih berat terletak lebih dekat ke dasar tabung reaksi, fraksi protein yang lebih ringan terletak lebih dekat ke permukaan.
Elektroforesis- metode yang didasarkan pada perbedaan kecepatan pergerakan protein dalam medan listrik. Nilai ini sebanding dengan muatan protein. Elektroforesis protein dilakukan di atas kertas (dalam hal ini kecepatan pergerakan protein hanya sebanding dengan muatannya) atau dalam gel poliakrilamida dengan ukuran pori tertentu (kecepatan pergerakan protein sebanding dengan muatan dan berat molekulnya) .
Kromatografi pertukaran ion- metode fraksinasi berdasarkan pengikatan gugus protein terionisasi dengan gugus resin penukar ion yang bermuatan berlawanan (bahan polimer tidak larut). Kekuatan pengikatan protein pada resin sebanding dengan muatan protein. Protein yang teradsorpsi pada polimer penukar ion dapat tersapu dengan meningkatnya konsentrasi larutan NaCl; semakin rendah muatan protein, semakin rendah konsentrasi NaCl yang diperlukan untuk menghilangkan protein yang terikat pada gugus ionik resin.
Kromatografi afinitas- metode paling spesifik untuk mengisolasi protein individu.Ligan suatu protein terikat secara kovalen pada polimer inert. Ketika larutan protein dilewatkan melalui kolom dengan polimer, hanya protein spesifik untuk ligan tertentu yang teradsorpsi pada kolom karena pengikatan komplementer protein ke ligan.
Dialisis- metode yang digunakan untuk menghilangkan senyawa dengan berat molekul rendah dari larutan protein yang diisolasi. Metode ini didasarkan pada ketidakmampuan protein untuk melewati membran semipermeabel, tidak seperti zat dengan berat molekul rendah. Ini digunakan untuk memurnikan protein dari pengotor dengan berat molekul rendah, misalnya garam setelah penggaraman.
TUGAS KERJA EKSTRAKURIKULER
1. Isi tabelnya. 1.4.
Tabel 1.4. Analisis perbandingan struktur dan fungsi protein terkait - mioglobin dan hemoglobin
a) mengingat struktur pusat aktif Mb dan Hb. Apa peran radikal asam amino hidrofobik dalam pembentukan pusat aktif protein ini? Jelaskan struktur pusat aktif Mb dan Hb serta mekanisme perlekatan ligan padanya. Apa peran residu His F 8 dan His E 7 dalam berfungsinya pusat aktif Mv iHv?
b) sifat baru apa yang dimiliki protein oligomer, hemoglobin, yang berkerabat dekat dengan mioglobin monomer? Jelaskan peran perubahan kooperatif dalam konformasi protomer dalam molekul hemoglobin, pengaruh CO2 dan konsentrasi proton terhadap afinitas hemoglobin terhadap oksigen, serta peran 2,3-BPG dalam regulasi alosterik fungsi Hb .
2. Ciri-ciri pendamping molekuler, dengan memperhatikan hubungan antara struktur dan fungsinya.
3. Protein apa yang dikelompokkan ke dalam keluarga? Dengan menggunakan contoh keluarga imunoglobulin, identifikasi ciri-ciri struktural serupa dan fungsi terkait dari protein keluarga ini.
4. Protein individu yang dimurnikan seringkali diperlukan untuk tujuan biokimia dan pengobatan. Jelaskan yang mana sifat fisik dan kimia protein didasarkan pada metode yang digunakan untuk pemisahan dan pemurniannya.
TUGAS PENGENDALIAN DIRI
1. Pilihlah jawaban yang benar.
Fungsi hemoglobin:
A. Pengangkutan O2 dari paru ke jaringan B. Pengangkutan H+ dari jaringan ke paru
B. Mempertahankan pH darah yang konstan D. Transportasi CO 2 dari paru-paru ke jaringan
D. Transportasi CO 2 dari jaringan ke paru-paru
2. Pilihlah jawaban yang benar. Liganα -protomer Hb adalah: A.Heme
B.Oksigen
B.CO G.2,3-BPG
D. β-Protomer
3. Pilihlah jawaban yang benar.
Hemoglobin berbeda dengan mioglobin:
A. Memiliki struktur kuaterner
B. Struktur sekunder hanya diwakili oleh heliks α
B. Milik protein kompleks
D. Berinteraksi dengan ligan alosterik D. Terikat secara kovalen dengan heme
4. Pilihlah jawaban yang benar.
Afinitas Hb terhadap O2 menurun:
A. Ketika satu molekul O 2 ditambahkan B. Ketika satu molekul O 2 dihilangkan
B. Saat berinteraksi dengan 2,3-BPG
D. Bila dilekatkan pada protomer H + D. Bila konsentrasi 2,3-BPG menurun
5. Cocok.
Tipe HB mempunyai ciri-ciri :
A. Dalam bentuk deoksi membentuk agregat fibrilar B. Berisi dua rantai α- dan dua rantai δ
B. Bentuk Hb yang dominan pada eritrosit dewasa D. Mengandung heme dengan Fe+3 pada pusat aktifnya
D. Berisi dua rantai α- dan dua γ 1. HbA 2.
6. Cocok.
Ligan Hb:
A. Berikatan dengan Hb di pusat alosterik
B. Memiliki afinitas yang sangat tinggi terhadap situs aktif Hb
B. Dengan bergabung, meningkatkan afinitas Hb terhadap O 2 G. Mengoksidasi Fe+ 2 menjadi Fe+ 3
D.Bentuk Ikatan kovalen dengan gisF8
7. Pilihlah jawaban yang benar.
Pendamping:
A. Protein terdapat di seluruh bagian sel
B. Sintesis meningkat di bawah tekanan
B. Berpartisipasi dalam hidrolisis protein terdenaturasi
D. Berpartisipasi dalam mempertahankan konformasi asli protein
D. Mereka menciptakan organel di mana konformasi protein terbentuk.
8. Cocokkan. Imunoglobulin:
A. Bentuk sekretorinya adalah pentamerik.
B. Kelas Ig yang menembus sawar plasenta
B.Ig - reseptor sel mast
D. Kelas utama Ig hadir dalam sekresi sel epitel. D. Reseptor limfosit B, aktivasi yang memastikan proliferasi sel
9. Pilihlah jawaban yang benar.
Imunoglobulin E:
A. Diproduksi oleh makrofag B. Memiliki rantai ε yang berat.
B. Tertanam dalam membran limfosit T
D. Bertindak sebagai reseptor antigen membran pada sel mast dan basofil
D. Bertanggung jawab atas reaksi alergi
10. Pilihlah jawaban yang benar.
Metode pemisahan protein didasarkan pada perbedaan berat molekulnya:
A. Filtrasi gel
B. Ultrasentrifugasi
B. Elektroforesis gel poliakrilamida D. Kromatografi penukar ion
D. Kromatografi afinitas
11. Pilih jawaban yang benar.
Metode pemisahan protein didasarkan pada perbedaan kelarutannya dalam air:
A. Filtrasi gel B. Pengasinan
B. Kromatografi penukar ion D. Kromatografi afinitas
D. Elektroforesis dalam gel poliakrilamida
STANDAR JAWABAN TERHADAP “TUGAS PENGENDALIAN DIRI”
1.A,B,C,D
2.A,B,C,D
5. 1-B, 2-A, 3-G
6. 1-B, 2-B, 3-A
7.A,B,D,D
8. 1-G; 2-B, 3-B
SYARAT DAN KONSEP DASAR
1. Protein oligomer, protomer, struktur protein kuaterner
2. Perubahan kooperatif dalam konformasi protomer
3. Efek Bohr
4. Regulasi alosterik fungsi protein, pusat alosterik dan efektor alosterik
5. Pendamping molekuler, protein kejutan panas
6. Keluarga protein (serin protease, imunoglobulin)
7. Hubungan IgM-, G-, E-, A-struktur-fungsi
8. Muatan total protein, titik isoelektrik protein
9. Elektroforesis
10. Pengasinan
11. Filtrasi gel
12. Kromatografi pertukaran ion
13. Ultrasentrifugasi
14. Kromatografi afinitas
15. Elektroforesis protein plasma darah
TUGAS UNTUK PEKERJAAN KELAS
1. Bandingkan ketergantungan derajat kejenuhan hemoglobin (Hb) dan mioglobin (Mb) dengan oksigen terhadap tekanan parsialnya dalam jaringan
 Beras. 1.34. Ketergantungan saturasi Mv danNHoksigen dari tekanan parsialnya
Beras. 1.34. Ketergantungan saturasi Mv danNHoksigen dari tekanan parsialnya
Harap dicatat bahwa bentuk kurva saturasi oksigen protein berbeda: untuk mioglobin - hiperbola, untuk hemoglobin - bentuk sigmoid.
1. bandingkan nilai tekanan parsial oksigen dimana Mb dan Hb jenuh dengan O 2 sebesar 50%. Manakah dari protein berikut yang memiliki afinitas lebih tinggi terhadap O2?
2. Ciri-ciri struktural Mb apa yang menentukan afinitasnya yang tinggi terhadap O 2?
3. Ciri struktural HB apa yang memungkinkannya melepaskan O2 di kapiler jaringan istirahat (dengan tekanan parsial O2 yang relatif tinggi) dan secara tajam meningkatkan pelepasan ini pada otot yang bekerja? Sifat protein oligomer apa yang memberikan efek ini?
4. Hitung berapa jumlah O2 (dalam%) hemoglobin teroksigenasi yang diberikan kepada otot istirahat dan bekerja?
5. menarik kesimpulan tentang hubungan antara struktur suatu protein dan fungsinya.
2. Jumlah oksigen yang dilepaskan oleh hemoglobin di kapiler tergantung pada intensitas proses katabolik di jaringan (efek Bohr). Bagaimana perubahan metabolisme jaringan mengatur afinitas Hb terhadap O2? Pengaruh CO 2 dan H+ terhadap afinitas Hb terhadap O 2
 1. jelaskan efek Bohr.
1. jelaskan efek Bohr.
2. ke arah mana proses yang ditunjukkan pada diagram berlangsung:
a) di kapiler paru-paru;
b) di kapiler jaringan?
3. Apa arti fisiologis dari efek Bohr?
4. Mengapa interaksi Hb dengan H+ pada lokasi yang jauh dari heme mengubah afinitas protein terhadap O 2?
3. Afinitas Hb terhadap O2 bergantung pada konsentrasi ligannya - 2,3-bifosfogliserat, yang merupakan pengatur alosterik afinitas Hb terhadap O2. Mengapa interaksi ligan pada lokasi yang jauh dari situs aktif mempengaruhi fungsi protein? Bagaimana 2,3-BPG mengatur afinitas Hb terhadap O2? Untuk mengatasi masalah tersebut, jawablah pertanyaan berikut:
1. di mana dan dari apa 2,3-bifosfogliserat (2,3-BPG) disintesis? Tulis rumusnya, tunjukkan muatan molekul ini.
2. Bentuk hemoglobin (oksi atau deoksi) manakah yang berinteraksi dengan BPG dan mengapa? Di bagian molekul Hb manakah interaksi terjadi?
3. ke arah manakah proses yang ditunjukkan pada diagram terjadi?
a) di kapiler jaringan;
b) di kapiler paru-paru?
4. dimana konsentrasi kompleks harus lebih tinggi
Nv-2,3-BFG:
a) di kapiler otot saat istirahat,
b) di kapiler otot yang bekerja (asalkan konsentrasi BPG yang sama dalam eritrosit)?
5. Bagaimana afinitas HB terhadap oksigen berubah ketika seseorang beradaptasi dengan kondisi dataran tinggi, jika konsentrasi BPG dalam eritrosit meningkat? Apa signifikansi fisiologis dari fenomena ini?
4. Penghancuran 2,3-BPG selama penyimpanan darah yang diawetkan mengganggu fungsi HB. Bagaimana afinitas HB terhadap O 2 berubah dalam darah yang diawetkan jika konsentrasi 2,3-BPG dalam eritrosit dapat menurun dari 8 menjadi 0,5 mmol/l. Apakah mungkin untuk mentransfusikan darah tersebut ke pasien yang sakit parah jika konsentrasi 2,3-BPG pulih tidak lebih awal dari setelah tiga hari? Apakah mungkin mengembalikan fungsi sel darah merah dengan menambahkan 2,3-BPG ke dalam darah?
5. Ingat struktur molekul imunoglobulin paling sederhana. Apa peran imunoglobulin dalam sistem kekebalan? Mengapa Ig sering disebut bivalen? Bagaimana hubungan struktur Ig dengan fungsinya? (Jelaskan dengan menggunakan contoh kelas imunoglobulin.)
Sifat fisikokimia protein dan metode pemisahannya.
6. Bagaimana muatan bersih suatu protein mempengaruhi kelarutannya?
a) tentukan muatan total peptida pada pH 7
Ala-Glu-Tre-Pro-Asp-Liz-Cis
b) bagaimana muatan peptida ini berubah pada pH >7, pH<7, рН <<7?
c) berapa titik isoelektrik suatu protein (IEP) dan di lingkungan manakah letaknya?
IET dari peptida ini?
d) pada nilai pH berapa kelarutan peptida ini paling kecil akan diamati.
7. Mengapa susu asam, tidak seperti susu segar, “mengental” ketika direbus (yaitu, kasein protein susu mengendap)? Dalam susu segar, molekul kasein mempunyai muatan negatif.
8. Filtrasi gel digunakan untuk memisahkan protein individu. Campuran yang mengandung protein A, B, C dengan berat molekul masing-masing sebesar 160.000, 80.000 dan 60.000, dianalisis dengan filtrasi gel (Gbr. 1.35). Butiran gel yang membengkak dapat ditembus oleh protein dengan berat molekul kurang dari 70.000 Prinsip apa yang mendasari metode pemisahan ini? Grafik manakah yang mencerminkan hasil fraksinasi dengan benar? Tunjukkan urutan pelepasan protein A, B, dan C dari kolom.
 Beras. 1.35. Menggunakan Filtrasi Gel untuk Pemisahan Protein
Beras. 1.35. Menggunakan Filtrasi Gel untuk Pemisahan Protein
9. Pada Gambar. 1.36, A menunjukkan diagram elektroforesis di atas kertas protein serum darah orang sehat. Jumlah relatif fraksi protein yang diperoleh dengan metode ini adalah: albumin 54-58%, α 1 -globulin 6-7%, α 2 -globulin 8-9%, β-globulin 13%, γ-globulin 11-12% .
 Beras. 1.36 Elektroforesis pada kertas protein plasma darah orang sehat (A) dan pasien (B)
Beras. 1.36 Elektroforesis pada kertas protein plasma darah orang sehat (A) dan pasien (B)
I - γ-globulin; II - β-globulin; AKU AKU AKU -α 2 -globulin; IV -α 2 -globulin; V - albumin
Banyak penyakit disertai dengan perubahan kuantitatif komposisi protein serum (disproteinemia). Sifat perubahan ini diperhitungkan saat membuat diagnosis dan menilai tingkat keparahan dan stadium penyakit.
1. Mengapa protein dianggap polimer?
Menjawab. Protein adalah polimer, yaitu molekul yang dibangun seperti rantai dari unit monomer berulang, atau subunit, yang terdiri dari asam amino yang dihubungkan dalam urutan tertentu melalui ikatan peptida. Mereka adalah komponen dasar dan penting dari semua organisme.
Ada protein sederhana (protein) dan protein kompleks (protein). Protein adalah protein yang molekulnya hanya mengandung komponen protein. Ketika mereka terhidrolisis sempurna, asam amino terbentuk.
Proteid adalah protein kompleks yang molekulnya berbeda secara signifikan dari molekul protein karena selain komponen protein itu sendiri, protein tersebut juga mengandung komponen dengan berat molekul rendah yang bersifat non-protein.
2. Apa fungsi protein yang anda ketahui?
Menjawab. Protein melakukan fungsi berikut: konstruksi, energi, katalitik, pelindung, transportasi, kontraktil, sinyal dan lain-lain.
Pertanyaan setelah § 11
1. Zat apa yang disebut protein?
Menjawab. Protein, atau protein, adalah polimer biologis yang monomernya adalah asam amino. Semua asam amino memiliki gugus amino (-NH2) dan gugus karboksil (-COOH) dan berbeda dalam struktur dan sifat radikal. Asam amino dihubungkan satu sama lain melalui ikatan peptida, itulah sebabnya protein disebut juga polipeptida.
Menjawab. Molekul protein dapat mengambil bentuk spasial yang berbeda - konformasi, yang mewakili empat tingkat organisasinya. Urutan linier asam amino dalam rantai polipeptida mewakili struktur utama suatu protein. Ini unik untuk protein apa pun dan menentukan bentuk, sifat, dan fungsinya.
3. Bagaimana struktur protein sekunder, tersier, dan kuaterner terbentuk?
Menjawab. Struktur sekunder suatu protein dibentuk oleh pembentukan ikatan hidrogen antara gugus -CO- dan -NH-. Dalam hal ini, rantai polipeptida dipelintir menjadi spiral. Heliks dapat memperoleh konfigurasi globul, karena berbagai ikatan muncul antara radikal asam amino dalam heliks. Globula adalah struktur tersier suatu protein. Jika beberapa butiran bergabung menjadi satu kompleks kompleks, maka timbullah struktur kuaterner. Misalnya, hemoglobin dalam darah manusia dibentuk oleh empat gumpalan.
4. Apa yang dimaksud dengan denaturasi protein?
Menjawab. Pelanggaran terhadap struktur alami suatu protein disebut denaturasi. Di bawah pengaruh sejumlah faktor (kimia, radioaktif, suhu, dll.), struktur protein kuaterner, tersier, dan sekunder dapat dihancurkan. Jika pengaruh faktor tersebut berhenti, protein dapat memulihkan strukturnya. Jika pengaruh faktor tersebut meningkat, struktur utama protein - rantai polipeptida - juga hancur. Ini adalah proses yang tidak dapat diubah - protein tidak dapat memulihkan strukturnya
5. Atas dasar apa protein dibedakan menjadi sederhana dan kompleks?
Menjawab. Protein sederhana hanya terdiri dari asam amino. Protein kompleks dapat mencakup zat organik lainnya: karbohidrat (kemudian disebut glikoprotein), lemak (lipoprotein), asam nukleat (nukleoprotein).
6. Apa fungsi protein yang anda ketahui?
Menjawab. Fungsi konstruksi (plastik). Protein merupakan komponen struktural membran biologis dan organel sel, serta merupakan bagian dari struktur pendukung tubuh, rambut, kuku, dan pembuluh darah. Fungsi enzimatik. Protein berfungsi sebagai enzim, yaitu katalis biologis yang mempercepat laju reaksi biokimia puluhan dan ratusan juta kali lipat. Contohnya adalah amilase, yang memecah pati menjadi monosakarida. Fungsi kontraktil (motorik). Hal ini dilakukan oleh protein kontraktil khusus yang memastikan pergerakan sel dan struktur intraseluler. Berkat mereka, kromosom bergerak selama pembelahan sel, dan flagela serta silia menggerakkan sel protozoa. Sifat kontraktil protein aktin dan miosin mendasari fungsi otot. Fungsi transportasi. Protein terlibat dalam pengangkutan molekul dan ion di dalam tubuh (hemoglobin membawa oksigen dari paru-paru ke organ dan jaringan, albumin serum terlibat dalam pengangkutan asam lemak). Fungsi pelindung. Ini terdiri dari melindungi tubuh dari kerusakan dan invasi protein dan bakteri asing. Protein antibodi yang diproduksi oleh limfosit menciptakan pertahanan tubuh terhadap infeksi asing; trombin dan fibrin terlibat dalam pembentukan bekuan darah, sehingga membantu tubuh menghindari kehilangan banyak darah. Fungsi regulasi. Hal ini dilakukan oleh protein hormon. Mereka berpartisipasi dalam pengaturan aktivitas sel dan semua proses vital tubuh. Dengan demikian, insulin mengatur kadar gula darah dan mempertahankannya pada tingkat tertentu. Fungsi sinyal. Protein yang tertanam dalam membran sel mampu mengubah strukturnya sebagai respons terhadap iritasi. Dengan demikian, sinyal ditransmisikan dari lingkungan luar ke dalam sel. Fungsi energi. Hal ini sangat jarang diwujudkan oleh protein. Dengan pemecahan lengkap 1 g protein, 17,6 kJ energi dapat dilepaskan. Namun, protein merupakan senyawa yang sangat berharga bagi tubuh. Oleh karena itu, pemecahan protein biasanya terjadi menjadi asam amino, yang darinya rantai polipeptida baru dibangun. Protein hormon mengatur aktivitas sel dan seluruh proses kehidupan tubuh. Jadi, dalam tubuh manusia, somatotropin terlibat dalam pengaturan pertumbuhan tubuh, insulin menjaga kadar glukosa darah pada tingkat yang konstan.
7. Apa peran hormon protein?
Menjawab. Fungsi pengaturan melekat pada protein hormon (regulator). Mereka mengatur berbagai proses fisiologis. Misalnya, hormon yang paling terkenal adalah insulin, yang mengatur kadar glukosa darah. Ketika insulin dalam tubuh tidak mencukupi, maka timbullah penyakit yang disebut diabetes melitus.
8. Apa fungsi protein enzim?
Menjawab. Enzim adalah katalis biologis, yaitu mempercepat reaksi kimia ratusan juta kali lipat. Enzim mempunyai kekhususan yang ketat terhadap zat yang bereaksi. Setiap reaksi dikatalisis oleh enzimnya sendiri.
9. Mengapa protein jarang digunakan sebagai sumber energi?
Menjawab. Monomer protein asam amino adalah bahan mentah yang berharga untuk pembangunan molekul protein baru. Oleh karena itu, pemecahan lengkap polipeptida menjadi zat anorganik jarang terjadi. Akibatnya, fungsi energik, yang terdiri dari pelepasan energi setelah penguraian total, jarang dilakukan oleh protein.
Putih telur adalah protein yang khas. Cari tahu apa yang akan terjadi jika terkena air, alkohol, aseton, asam, alkali, minyak sayur, suhu tinggi, dll.
Menjawab. Akibat pengaruh suhu tinggi pada putih telur, akan terjadi denaturasi protein. Ketika terkena alkohol, aseton, asam atau basa, hal yang kira-kira sama terjadi: protein menggumpal. Ini adalah proses di mana struktur tersier dan kuaterner suatu protein terganggu karena putusnya ikatan hidrogen dan ionik.
Dalam air dan minyak sayur, protein mempertahankan strukturnya.
Giling umbi kentang mentah hingga menjadi bubur. Ambil tiga tabung reaksi dan masukkan sedikit kentang cincang ke dalamnya.
Tempatkan tabung reaksi pertama di dalam freezer lemari es, tabung reaksi kedua di rak paling bawah lemari es, dan tabung reaksi ketiga di dalam toples berisi air hangat (t = 40 °C). Setelah 30 menit, keluarkan tabung reaksi dan masukkan sedikit hidrogen peroksida ke dalam masing-masing tabung reaksi. Amati apa yang terjadi pada setiap tabung reaksi. Jelaskan hasil Anda
Menjawab. Eksperimen ini menggambarkan aktivitas enzim katalase dalam sel hidup pada hidrogen peroksida. Sebagai hasil dari reaksi, oksigen dilepaskan. Dinamika pelepasan gelembung dapat digunakan untuk menilai aktivitas enzim.
Pengalaman memungkinkan kami mencatat hasil berikut:
Aktivitas katalase bergantung pada suhu:
1. Tabung reaksi 1: tidak ada gelembung karena pada suhu rendah sel kentang akan hancur.
2. Tabung reaksi 2 : terdapat gelembung sedikit – karena aktivitas enzim pada suhu rendah rendah.
3. Tabung reaksi 3: banyak gelembung, suhu optimal, katalase sangat aktif.
Masukkan beberapa tetes air ke dalam tabung reaksi pertama yang berisi kentang, beberapa tetes asam (cuka meja) ke dalam tabung reaksi kedua, dan alkali ke dalam tabung ketiga.
Amati apa yang terjadi pada setiap tabung reaksi. Jelaskan hasil Anda. Menarik kesimpulan.
Menjawab. Ketika air ditambahkan, tidak terjadi apa-apa, ketika asam ditambahkan, terjadi penggelapan, ketika alkali ditambahkan, terjadi “busa” - hidrolisis basa.
Seperti yang Anda ketahui, protein adalah dasar asal usul kehidupan di planet kita. Namun tetesan coacervate, yang terdiri dari molekul peptida,lah yang menjadi dasar asal usul makhluk hidup. Hal ini tidak diragukan lagi, karena analisis komposisi internal setiap perwakilan biomassa menunjukkan bahwa zat-zat ini ada dalam segala hal: tumbuhan, hewan, mikroorganisme, jamur, virus. Selain itu, mereka sangat beragam dan bersifat makromolekul.
Struktur ini memiliki empat nama, semuanya sinonim:
- protein;
- protein;
- polipeptida;
- peptida.
Molekul protein
Jumlah mereka sungguh tidak terhitung banyaknya. Selain itu, semua molekul protein dapat dibagi menjadi dua kelompok besar:
- sederhana - hanya terdiri dari rangkaian asam amino yang dihubungkan oleh ikatan peptida;
- kompleks - struktur dan struktur protein dicirikan oleh kelompok protolitik (prostetik) tambahan, yang juga disebut kofaktor.
Pada saat yang sama, molekul kompleks juga memiliki klasifikasinya sendiri.
Gradasi peptida kompleks
- Glikoprotein merupakan senyawa yang berkerabat dekat antara protein dan karbohidrat. Kelompok prostetik mukopolisakarida dijalin ke dalam struktur molekul.
- Lipoprotein adalah senyawa kompleks protein dan lipid.
- Metaloprotein - ion logam (besi, mangan, tembaga, dan lainnya) bertindak sebagai gugus prostetik.
- Nukleoprotein adalah penghubung antara protein dan asam nukleat (DNA, RNA).
- Fosfoprotein - konformasi protein dan residu asam ortofosfat.
- Kromoprotein sangat mirip dengan metaloprotein, namun unsur yang termasuk dalam kelompok prostetik adalah kompleks berwarna utuh (merah - hemoglobin, hijau - klorofil, dan sebagainya).
Pada setiap kelompok yang dipertimbangkan, struktur dan sifat protein berbeda-beda. Fungsi yang mereka lakukan juga bervariasi tergantung pada jenis molekulnya.

Struktur kimia protein
Dari sudut pandang ini, protein adalah rantai residu asam amino yang panjang dan masif yang dihubungkan satu sama lain melalui ikatan spesifik yang disebut ikatan peptida. Cabang yang disebut radikal memanjang dari struktur samping asam. Struktur molekul ini ditemukan oleh E. Fischer pada awal abad ke-21.
Belakangan, protein, struktur dan fungsi protein dipelajari lebih detail. Jelas terlihat bahwa hanya ada 20 asam amino yang membentuk struktur peptida, tetapi asam amino tersebut dapat digabungkan dengan berbagai cara. Oleh karena itu keragaman struktur polipeptida. Selain itu, dalam proses kehidupan dan menjalankan fungsinya, protein mampu mengalami sejumlah transformasi kimia. Akibatnya, strukturnya berubah, dan jenis koneksi yang benar-benar baru muncul.
Untuk memutus ikatan peptida, yaitu mengganggu protein dan struktur rantai, kondisi yang sangat ketat harus dipilih (suhu tinggi, asam atau basa, katalis). Hal ini disebabkan tingginya kekuatan pada molekulnya, yaitu pada gugus peptida.

Deteksi struktur protein di laboratorium dilakukan dengan menggunakan reaksi biuret - paparan polipeptida (II) yang baru diendapkan. Kompleks gugus peptida dan ion tembaga memberikan warna ungu cerah.
Ada empat organisasi struktural utama, yang masing-masing memiliki ciri struktural proteinnya sendiri.
Tingkat organisasi: struktur utama
Seperti disebutkan di atas, peptida adalah rangkaian residu asam amino dengan atau tanpa inklusi, koenzim. Jadi, yang utama adalah struktur molekul yang alami, alami, benar-benar asam amino yang dihubungkan oleh ikatan peptida, dan tidak lebih. Artinya, polipeptida dengan struktur linier. Selain itu, ciri struktural protein jenis ini adalah kombinasi asam tersebut sangat menentukan fungsi molekul protein. Berkat kehadiran fitur-fitur ini, dimungkinkan tidak hanya untuk mengidentifikasi suatu peptida, tetapi juga untuk memprediksi sifat dan peran peptida yang benar-benar baru dan belum ditemukan. Contoh peptida dengan struktur primer alami adalah insulin, pepsin, kimotripsin dan lain-lain.

Konformasi sekunder
Struktur dan sifat protein dalam kategori ini agak berbeda. Struktur seperti itu dapat terbentuk pada awalnya secara alami atau ketika struktur primer terkena hidrolisis yang parah, suhu atau kondisi lainnya.
Konformasi ini memiliki tiga jenis:
- Belokan halus, teratur, stereoregular, dibangun dari residu asam amino, yang berputar di sekitar sumbu utama sambungan. Mereka disatukan hanya oleh oksigen yang timbul antara oksigen dari satu kelompok peptida dan hidrogen dari kelompok lainnya. Selain itu, strukturnya dianggap benar karena putarannya diulang secara merata setiap 4 mata rantai. Struktur seperti itu dapat berupa kidal atau kidal. Namun pada sebagian besar protein yang diketahui, isomer dekstrorotatori mendominasi. Konformasi seperti ini biasanya disebut struktur alfa.
- Komposisi dan struktur protein jenis berikutnya berbeda dari yang sebelumnya karena ikatan hidrogen terbentuk bukan antara residu yang berdekatan dengan salah satu sisi molekul, tetapi antara residu yang berjauhan, dan pada jarak yang cukup jauh. Oleh karena itu, seluruh strukturnya berbentuk beberapa rantai polipeptida bergelombang seperti ular. Ada satu karakteristik yang harus ditunjukkan oleh suatu protein. Struktur asam amino pada cabang harus sesingkat mungkin, seperti glisin atau alanin misalnya. Jenis konformasi sekunder ini disebut lembaran beta karena kemampuannya bersatu membentuk struktur umum.
- Biologi mengacu pada jenis struktur protein ketiga sebagai fragmen yang kompleks, tersebar secara heterogen, tidak teratur yang tidak memiliki stereoregularitas dan mampu mengubah struktur di bawah pengaruh kondisi eksternal.
Tidak ada contoh protein yang secara alami memiliki struktur sekunder yang telah diidentifikasi.

Pendidikan Tinggi
Ini adalah konformasi yang agak rumit yang disebut “globul”. Apa proteinnya? Strukturnya didasarkan pada struktur sekunder, namun, jenis interaksi baru antara atom-atom gugus ditambahkan, dan seluruh molekul tampak terlipat, sehingga berfokus pada fakta bahwa gugus hidrofilik diarahkan ke dalam globul, dan gugus hidrofobik diarahkan ke dalam globul, dan hidrofobik yang ke luar.
Hal ini menjelaskan muatan molekul protein dalam larutan koloid air. Jenis interaksi apa yang ada di sini?
- Ikatan hidrogen - tetap tidak berubah antara bagian yang sama seperti pada struktur sekunder.
- interaksi - terjadi ketika polipeptida dilarutkan dalam air.
- Daya tarik ionik terbentuk antara kelompok residu asam amino (radikal) yang bermuatan berbeda.
- Interaksi kovalen - dapat terbentuk antara situs asam tertentu - molekul sistein, atau lebih tepatnya, ekornya.
Dengan demikian, komposisi dan struktur protein dengan struktur tersier dapat digambarkan sebagai rantai polipeptida yang terlipat menjadi butiran-butiran yang mempertahankan dan menstabilkan konformasinya karena berbagai jenis interaksi kimia. Contoh peptida tersebut: fosfogliserat kenase, tRNA, alpha-keratin, silk fibroin dan lain-lain.
Struktur Kuarter
Ini adalah salah satu gumpalan paling kompleks yang dibentuk oleh protein. Struktur dan fungsi protein jenis ini sangat beragam dan spesifik.
Konformasi apa ini? Ini adalah beberapa (dalam beberapa kasus lusinan) rantai polipeptida besar dan kecil yang terbentuk secara independen satu sama lain. Tapi kemudian, karena interaksi yang sama yang kita pertimbangkan untuk struktur tersier, semua peptida ini berputar dan terjalin satu sama lain. Dengan cara ini, diperoleh butiran konformasi kompleks, yang mungkin mengandung atom logam, gugus lipid, dan karbohidrat. Contoh protein tersebut: DNA polimerase, selubung protein virus tembakau, hemoglobin dan lain-lain.

Semua struktur peptida yang kami periksa memiliki metode identifikasi sendiri di laboratorium, berdasarkan kemampuan modern menggunakan kromatografi, sentrifugasi, mikroskop elektron dan optik, serta teknologi komputer tinggi.
Fungsi dilakukan
Struktur dan fungsi protein berkorelasi erat satu sama lain. Artinya, setiap peptida memainkan peran tertentu, unik dan spesifik. Ada juga yang mampu melakukan beberapa operasi penting sekaligus dalam satu sel hidup. Namun, fungsi utama molekul protein dalam organisme hidup dapat diungkapkan dalam bentuk umum:
- Memberikan gerakan. Organisme bersel tunggal, atau organel, atau beberapa jenis sel mampu bergerak, berkontraksi, dan bergerak. Hal ini dipastikan oleh protein yang membentuk struktur alat motoriknya: silia, flagela, dan membran sitoplasma. Jika kita berbicara tentang sel yang tidak mampu bergerak, maka protein dapat berkontribusi pada kontraksinya (miosin otot).
- Fungsi nutrisi atau cadangan. Ini adalah akumulasi molekul protein dalam telur, embrio dan benih tanaman untuk selanjutnya mengisi kembali nutrisi yang hilang. Ketika dipecah, peptida menghasilkan asam amino dan zat aktif biologis yang diperlukan untuk perkembangan normal organisme hidup.
- Fungsi energi. Selain karbohidrat, protein juga bisa memberi kekuatan pada tubuh. Pemecahan 1 g peptida melepaskan 17,6 kJ energi berguna dalam bentuk asam adenosin trifosfat (ATP), yang digunakan untuk proses vital.
- Pemberian sinyal terdiri dari pemantauan cermat terhadap proses yang sedang berlangsung dan transmisi sinyal dari sel ke jaringan, dari jaringan ke organ, dari jaringan ke sistem, dan seterusnya. Contoh tipikalnya adalah insulin, yang secara ketat mengatur jumlah glukosa dalam darah.
- Fungsi reseptor. Hal ini dilakukan dengan mengubah konformasi peptida pada satu sisi membran dan melibatkan ujung lainnya dalam restrukturisasi. Pada saat yang sama, sinyal dan informasi yang diperlukan dikirimkan. Paling sering, protein tersebut tertanam dalam membran sitoplasma sel dan melakukan kontrol ketat terhadap semua zat yang melewatinya. Mereka juga memberikan informasi tentang perubahan kimia dan fisik di lingkungan.
- Fungsi transportasi peptida. Hal ini dilakukan oleh protein saluran dan protein transporter. Perannya jelas – mengangkut molekul yang diperlukan ke tempat dengan konsentrasi rendah dari bagian dengan konsentrasi tinggi. Contoh tipikalnya adalah pengangkutan oksigen dan karbon dioksida melalui organ dan jaringan oleh protein hemoglobin. Mereka juga melakukan pengiriman senyawa dengan berat molekul rendah melalui membran sel ke bagian dalam.
- Fungsi struktural. Salah satu fungsi terpenting yang dilakukan oleh protein. Struktur semua sel dan organelnya dijamin oleh peptida. Mereka, seperti bingkai, mengatur bentuk dan struktur. Selain itu, mereka mendukungnya dan memodifikasinya jika perlu. Oleh karena itu, untuk pertumbuhan dan perkembangan, semua makhluk hidup memerlukan protein dalam makanannya. Peptida tersebut antara lain elastin, tubulin, kolagen, aktin, keratin dan lain-lain.
- Fungsi katalitik. Hal ini dilakukan oleh enzim. Banyak dan beragam, mereka mempercepat semua reaksi kimia dan biokimia dalam tubuh. Tanpa partisipasi mereka, apel biasa di perut dapat dicerna hanya dalam dua hari, kemungkinan besar akan membusuk dalam prosesnya. Di bawah pengaruh katalase, peroksidase dan enzim lainnya, proses ini berlangsung dalam dua jam. Secara umum, berkat peran protein inilah anabolisme dan katabolisme dilakukan, yaitu plastik dan

Peran protektif
Ada beberapa jenis ancaman yang dirancang oleh protein untuk melindungi tubuh.
Pertama, reagen traumatis, gas, molekul, zat dari berbagai spektrum aksi. Peptida dapat berinteraksi secara kimia dengan mereka, mengubahnya menjadi bentuk yang tidak berbahaya atau sekadar menetralkannya.
Kedua, ancaman fisik dari luka - jika protein fibrinogen tidak diubah menjadi fibrin di lokasi cedera pada waktunya, maka darah tidak akan menggumpal, yang berarti tidak akan terjadi penyumbatan. Sebaliknya, Anda memerlukan peptida plasmin, yang mampu melarutkan bekuan darah dan mengembalikan patensi pembuluh darah.
Ketiga, ancaman terhadap imunitas. Struktur dan pentingnya protein yang membentuk pertahanan kekebalan sangatlah penting. Antibodi, imunoglobulin, interferon - semua ini adalah elemen penting dan signifikan dari sistem limfatik dan kekebalan tubuh manusia. Setiap partikel asing, molekul berbahaya, bagian sel yang mati atau seluruh struktur harus segera diperiksa oleh senyawa peptida. Itulah sebabnya seseorang dapat secara mandiri, tanpa bantuan obat-obatan, melindungi dirinya setiap hari dari infeksi dan virus sederhana.
Properti fisik
Struktur protein sel sangat spesifik dan bergantung pada fungsi yang dilakukan. Tetapi sifat fisik semua peptida serupa dan bermuara pada karakteristik berikut.
- Berat molekulnya mencapai 1.000.000 Dalton.
- Sistem koloid terbentuk dalam larutan air. Di sana struktur memperoleh muatan yang bervariasi tergantung pada keasaman lingkungan.
- Ketika terkena kondisi yang keras (iradiasi, asam atau alkali, suhu, dll.), mereka dapat berpindah ke tingkat konformasi lain, yaitu denaturasi. Proses ini tidak dapat diubah pada 90% kasus. Namun, ada juga pergeseran sebaliknya - renaturasi.
Ini adalah sifat utama dari ciri fisik peptida.
Ini adalah senyawa organik bermolekul tinggi, biopolimer, dibangun dari 20 jenis residu asam L-?-amino yang dihubungkan dalam urutan tertentu menjadi rantai panjang. Berat molekul protein bervariasi dari 5 ribu hingga 1 juta. Nama “putih” pertama kali diberikan pada zat telur burung, yang menggumpal bila dipanaskan menjadi massa putih yang tidak larut. Istilah ini kemudian diperluas ke zat lain dengan sifat serupa yang diisolasi dari hewan dan tumbuhan.
Beras. 1. Biopolimer yang paling kompleks adalah protein. Makromolekulnya terdiri dari monomer, yaitu asam amino. Setiap asam amino memiliki dua gugus fungsi: gugus karboksil dan gugus amino. Keragaman protein tercipta dari kombinasi 20 asam amino yang berbeda.
Protein mendominasi seluruh senyawa lain yang ada dalam organisme hidup, biasanya menyumbang lebih dari setengah berat keringnya. Diasumsikan bahwa terdapat beberapa miliar protein individu di alam (misalnya, lebih dari 3 ribu protein berbeda terdapat pada bakteri E. coli saja).
Protein memainkan peran penting dalam proses kehidupan organisme apa pun. Protein termasuk enzim, yang dengannya semua transformasi kimia terjadi di dalam sel (metabolisme); mereka mengendalikan tindakan gen; dengan partisipasi mereka, aksi hormon diwujudkan, transportasi transmembran dilakukan, termasuk pembangkitan impuls saraf. Mereka adalah bagian integral dari sistem kekebalan (imunoglobulin) dan sistem koagulasi, membentuk dasar tulang dan jaringan ikat, dan terlibat dalam transformasi dan pemanfaatan energi.
Sejarah penelitian protein
Upaya pertama untuk mengisolasi protein dilakukan pada abad ke-18. Pada awal abad ke-19, karya pertama tentang studi kimia protein muncul. Ilmuwan Perancis Joseph Louis Gay-Lussac dan Louis Jacques Thénard mencoba menetapkan komposisi unsur protein dari berbagai sumber, yang menandai dimulainya studi analitis sistematis, yang menghasilkan kesimpulan bahwa semua protein serupa dalam kumpulan unsur yang termasuk dalam komposisi mereka. Pada tahun 1836, ahli kimia Belanda G.J. Mulder mengajukan teori pertama tentang struktur zat protein, yang menyatakan bahwa semua protein memiliki radikal hipotetis tertentu (C 40 H 62 N 10 O 12), yang terkait dalam berbagai proporsi dengan atom belerang dan fosfor. Dia menyebut "protein" radikal ini (dari bahasa Yunani protein - pertama, utama). Teori Mulder berkontribusi pada peningkatan minat dalam studi protein dan peningkatan metode kimia protein. Teknik untuk mengisolasi protein melalui ekstraksi dengan larutan garam netral dikembangkan, dan protein diperoleh dalam bentuk kristal untuk pertama kalinya (beberapa protein nabati). Untuk menganalisis protein, mereka mulai menggunakan pencernaan awal dengan asam dan basa.
Pada saat yang sama, semakin banyak perhatian mulai diberikan pada studi fungsi protein. Jens Jakob Berzelius adalah orang pertama yang menyatakan pada tahun 1835 bahwa mereka memainkan peran biokatalis. Segera, enzim proteolitik ditemukan - pepsin (T. Schwann, 1836) dan trypsin (L. Corvisart, 1856), yang menarik perhatian pada fisiologi pencernaan dan analisis produk yang terbentuk selama pemecahan nutrisi. Studi lebih lanjut tentang struktur protein dan kerja sintesis kimia peptida menghasilkan munculnya hipotesis peptida, yang menyatakan bahwa semua protein dibangun dari asam amino. Pada akhir abad ke-19, sebagian besar asam amino penyusun protein dipelajari.
Pada awal abad ke-20, ahli kimia Jerman Emil Hermann Fischer adalah orang pertama yang menggunakan metode kimia organik untuk mempelajari protein dan membuktikan bahwa protein terdiri dari asam β-amino yang dihubungkan satu sama lain melalui ikatan amino (peptida). Kemudian, berkat penggunaan metode analisis fisikokimia, massa molekul banyak protein ditentukan, bentuk bola protein globular ditetapkan, analisis difraksi sinar-X asam amino dan peptida dilakukan, dan metode analisis kromatografi dilakukan. dikembangkan (lihat kromatografi).
Hormon protein pertama diisolasi (Frederick Grant Banting, John James Rickard McLeod, 1922), keberadaan gamma globulin dalam antibodi terbukti, dan fungsi enzimatik dari protein otot miosin dijelaskan (Vladimir Aleksandrovich Engelhardt, M. N. Lyubimova, 1939) . Untuk pertama kalinya, enzim diperoleh dalam bentuk kristal - urease (J.B. Saliner, 1926), pepsin (J.H. Nortron, 1929), lisozim (E.P. Abraham, Robert Robinson, 1937).

Beras. 2. Skema struktur tiga dimensi enzim lisozim. Lingkaran - asam amino; untaian - ikatan peptida; persegi panjang yang diarsir adalah ikatan disulfida. Bagian rantai polipeptida yang berbentuk spiral dan memanjang terlihat.
Pada tahun 1950-an, organisasi tiga tingkat molekul protein terbukti - adanya struktur primer, sekunder dan tersier; menciptakan penganalisis asam amino otomatis (Stanford Moore, William Howard Stein, 1950). Pada tahun 60an, upaya dilakukan untuk mensintesis protein secara kimia (insulin, ribonuklease). Metode analisis difraksi sinar-X telah ditingkatkan secara signifikan; sebuah perangkat telah dibuat - sequencer (P. Edman, G. Begg, 1967), yang memungkinkan untuk menentukan urutan asam amino dalam rantai polipeptida. Konsekuensinya adalah terbentuknya struktur beberapa ratus protein dari berbagai sumber. Diantaranya adalah enzim proteolitik (pepsin, trypsin, chymotrypsin, subtilisin, karboksipeptidase), mioglobin, hemoglobin, sitokrom, lisozim, imunoglobulin, histon, neurotoksin, protein selubung virus, hormon protein-peptida. Akibatnya, muncul prasyarat untuk memecahkan masalah mendesak di bidang enzimologi, imunologi, endokrinologi, dan bidang kimia biologi lainnya.
Pada akhir abad ke-20, kemajuan signifikan dicapai dalam mempelajari peran protein dalam sintesis matriks biopolimer, memahami mekanisme kerjanya dalam berbagai proses kehidupan organisme, dan membangun hubungan antara struktur dan fungsinya. Peningkatan metode penelitian dan munculnya metode baru untuk memisahkan protein dan peptida sangatlah penting.
Perkembangan metode yang efektif untuk menganalisis urutan nukleotida dalam asam nukleat telah memungkinkan untuk menyederhanakan dan mempercepat penentuan urutan asam amino dalam protein secara signifikan. Hal ini ternyata dimungkinkan karena urutan asam amino dalam suatu protein ditentukan oleh urutan nukleotida pada gen yang mengkode protein tersebut (fragmen). Oleh karena itu, dengan mengetahui susunan nukleotida dalam gen ini dan kode genetiknya, seseorang dapat secara akurat memprediksi urutan asam amino dalam rantai polipeptida suatu protein. Seiring dengan kemajuan dalam analisis struktur protein, hasil signifikan telah dicapai dalam studi organisasi spasialnya, mekanisme pembentukan dan kerja kompleks supramolekul, termasuk ribosom dan organel seluler lainnya, kromatin, virus, dll.
Struktur protein
Hampir semua protein dibangun dari 20 asam α-amino yang termasuk dalam seri L, dan sama di hampir semua organisme. Asam amino dalam protein dihubungkan satu sama lain melalui ikatan peptida -CO-NH-, yang dibentuk oleh gugus karboksil dan -amino dari residu asam amino yang berdekatan: dua asam amino membentuk dipeptida di mana karboksil terminal (-COOH) dan gugus amino (H 2 N-) tetap bebas, sehingga asam amino baru dapat ditambahkan untuk membentuk rantai polipeptida.
Bagian rantai tempat terminal grup H 2 N berada disebut terminal-N, dan bagian yang berlawanan disebut terminal-C. Banyaknya variasi protein ditentukan oleh urutan susunannya dan jumlah residu asam amino yang dikandungnya. Meskipun tidak ada perbedaan yang jelas, rantai pendek biasanya disebut peptida atau oligopeptida (dari oligo...), dan polipeptida (protein) biasanya dipahami sebagai rantai yang terdiri dari 50 atau lebih. Protein yang paling umum adalah yang mengandung 100-400 residu asam amino, namun ada juga yang molekulnya dibentuk oleh 1000 residu atau lebih. Protein dapat terdiri dari beberapa rantai polipeptida. Dalam protein tersebut, setiap rantai polipeptida disebut subunit.
Struktur spasial protein

Beras. 3. Protein pada semua organisme terdiri dari 20 jenis asam amino. Setiap protein dicirikan oleh bermacam-macam dan rasio kuantitatif asam amino tertentu. Dalam molekul protein, asam amino dihubungkan satu sama lain melalui ikatan peptida (- CO - NH -) dalam urutan linier, sehingga disebut struktur primer protein. Baris teratas - asam amino bebas dengan gugus samping R1, R2, R3; intinya - asam amino dihubungkan oleh ikatan peptida.
Rantai polipeptida mampu secara spontan membentuk dan mempertahankan struktur spasial khusus. Berdasarkan bentuk molekul proteinnya, protein dibedakan menjadi fibrilar dan globular. Dalam protein globular, satu atau lebih rantai polipeptida dilipat menjadi struktur bola kompak, atau globule. Biasanya protein ini sangat larut dalam air. Ini mencakup hampir semua enzim, protein pengangkut darah dan banyak protein penyimpanan. Protein fibrilar adalah molekul seperti benang yang disatukan melalui ikatan silang dan membentuk serat panjang atau struktur berlapis. Mereka memiliki kekuatan mekanik yang tinggi, tidak larut dalam air dan terutama melakukan fungsi struktural dan pelindung. Perwakilan khas dari protein tersebut adalah keratin rambut dan wol, fibroin sutra, dan kolagen tendon.
Urutan asam amino yang terikat secara kovalen dalam rantai polipeptida disebut urutan asam amino, atau struktur primer protein. Struktur utama setiap protein, yang dikodekan oleh gen yang sesuai, adalah konstan dan membawa semua informasi yang diperlukan untuk pembentukan struktur tingkat yang lebih tinggi. Potensi jumlah protein yang dapat dibentuk dari 20 asam amino praktis tidak terbatas.
Sebagai hasil interaksi gugus samping residu asam amino, masing-masing bagian rantai polipeptida yang relatif kecil mengalami satu atau beberapa konformasi (jenis lipatan), yang dikenal sebagai struktur sekunder protein. Elemen yang paling khas adalah struktur α-heliks dan β yang berulang secara berkala. Struktur sekundernya sangat stabil. Karena hal ini sangat ditentukan oleh urutan asam amino dari wilayah protein yang sesuai, maka menjadi mungkin untuk memprediksinya dengan tingkat probabilitas tertentu. Istilah “?-helix” diperkenalkan oleh ahli biokimia, fisikawan, dan kimia Amerika Linus Carl Pauling, yang menggambarkan susunan rantai polipeptida dalam protein?-keratin dalam bentuk heliks tangan kanan (?-helix can dibandingkan dengan kabel telepon). Untuk setiap putaran heliks dalam protein terdapat 3,6 residu asam amino. Artinya gugus -C=O dari satu ikatan peptida membentuk ikatan hidrogen dengan gugus -NH dari ikatan peptida lain, empat residu asam amino jauh dari yang pertama. Rata-rata, setiap daerah heliks α mencakup hingga 15 asam amino, yang setara dengan 3-4 putaran heliks. Namun pada setiap protein, panjang heliks bisa sangat berbeda dari nilai ini. Pada penampang melintang, α-heliks berbentuk cakram, dengan rantai samping asam amino mengarah ke luar.
Struktur, atau? -lapisan terlipat, dapat dibentuk oleh beberapa bagian rantai polipeptida. Bagian-bagian ini diregangkan dan diletakkan sejajar satu sama lain, dihubungkan satu sama lain melalui ikatan hidrogen yang terjadi antara ikatan peptida. Mereka dapat berorientasi pada arah yang sama atau berlawanan (arah pergerakan sepanjang rantai polipeptida biasanya dianggap dari ujung N ke ujung C). Dalam kasus pertama, lapisan terlipat disebut paralel, dalam kasus kedua - antiparalel. Yang terakhir ini terbentuk ketika rantai peptida berbelok tajam ke belakang, membentuk tikungan (?-tikungan). Apakah rantai samping asam amino berorientasi tegak lurus terhadap bidang? -lapisan.
Konten relatif? -bagian spiral dan? -struktur dapat sangat bervariasi di antara protein yang berbeda. Ada protein dengan dominasi α-heliks (sekitar 75% asam amino dalam mioglobin dan hemoglobin), dan jenis utama pelipatan rantai di banyak protein fibrilar (termasuk fibroin sutra, β-keratin) adalah α-heliks. -struktur. Daerah rantai polipeptida yang tidak dapat diklasifikasikan ke dalam konformasi apa pun yang dijelaskan di atas disebut loop penghubung. Strukturnya ditentukan terutama oleh interaksi antara rantai samping asam amino, dan dalam molekul protein apa pun ia cocok dengan cara yang ditentukan secara ketat.
Struktur tersier disebut struktur spasial protein globular. Namun seringkali konsep ini mengacu pada metode pelipatan rantai polipeptida dalam ruang, karakteristik setiap protein tertentu. Struktur tersier dibentuk oleh rantai polipeptida suatu protein secara spontan, tampaknya, sepanjang jalur koagulasi tertentu dengan pembentukan awal elemen struktur sekunder. Jika stabilitas struktur sekunder disebabkan oleh ikatan hidrogen, maka struktur tersier ditentukan oleh beragam sistem interaksi non-kovalen: hidrogen, ionik, interaksi antarmolekul, serta kontak hidrofobik antara rantai samping amino non-polar. residu asam.
Pada beberapa protein, struktur tersier selanjutnya distabilkan dengan pembentukan ikatan disulfida (ikatan -S-S-) antara residu sistein. Biasanya, di dalam globul protein terdapat rantai samping asam amino hidrofobik yang dirangkai menjadi inti (transfernya di dalam globul protein menguntungkan secara termodinamika), dan di pinggirannya terdapat residu hidrofilik dan beberapa residu hidrofobik. Globula protein dikelilingi oleh beberapa ratus molekul air hidrasi, yang diperlukan untuk stabilitas molekul protein dan sering kali terlibat dalam fungsinya. Struktur tersier bersifat mobile, masing-masing bagiannya dapat bergeser, yang mengarah pada transisi konformasi yang memainkan peran penting dalam interaksi protein dengan molekul lain.
Struktur tersier merupakan dasar sifat fungsional suatu protein. Ini menentukan pembentukan ansambel gugus fungsi dalam protein - pusat aktif dan zona pengikatan, memberi mereka geometri yang diperlukan, memungkinkan terciptanya lingkungan internal, yang merupakan prasyarat untuk terjadinya banyak reaksi, dan memastikan interaksi dengan protein lain. .
Struktur tersier protein jelas sesuai dengan struktur primernya; mungkin ada kode stereokimia yang belum diuraikan yang menentukan sifat pelipatan protein. Namun, metode penataan ruang yang satu dan sama biasanya tidak berhubungan dengan satu struktur primer, tetapi dengan seluruh rangkaian struktur di mana hanya sebagian kecil (hingga 20-30%) residu asam amino yang dapat bertepatan, tetapi dalam kondisi tertentu. tempat dalam rantai kesamaan residu asam amino dipertahankan. Hasilnya adalah pembentukan keluarga besar protein yang dicirikan oleh struktur primer tersier yang serupa dan kurang lebih serupa serta, sebagai suatu peraturan, fungsi yang sama. Ini adalah, misalnya, protein organisme dari spesies berbeda yang memiliki fungsi yang sama dan terkait secara evolusi: mioglobin dan hemoglobin, trypsin, chymotrypsin, elastase, dan proteinase hewani lainnya.

Beras. 4. Akibat penggabungan beberapa makromolekul protein dengan struktur tersier, struktur protein kuaterner terbentuk menjadi kompleks yang kompleks. Contoh protein kompleks tersebut adalah hemoglobin, yang terdiri dari empat makromolekul.
Seringkali, terutama pada protein besar, pelipatan rantai polipeptida terjadi melalui pembentukan bagian-bagian individu dari rantai elemen struktur spasial yang kurang lebih otonom - domain yang dapat memiliki otonomi fungsional, bertanggung jawab atas satu atau beberapa aktivitas biologis dari protein. protein. Dengan demikian, domain N-terminal protein pembekuan darah memastikan perlekatannya pada membran sel.
Ada banyak protein yang molekulnya merupakan kumpulan butiran (subunit) yang disatukan oleh interaksi hidrofobik, hidrogen, atau ikatan ionik. Kompleks seperti ini disebut protein oligomer, multimerik, atau subunit. Susunan subunit dalam kompleks protein yang aktif secara fungsional disebut struktur kuaterner protein. Beberapa protein mampu membentuk struktur tingkat tinggi, misalnya kompleks multienzim, struktur diperluas (protein pelapis bakteriofag), kompleks supramolekul yang berfungsi sebagai satu kesatuan (misalnya ribosom atau komponen rantai pernapasan mitokondria).
Struktur kuaterner memungkinkan terciptanya molekul dengan geometri yang tidak biasa. Jadi, feritin, yang dibentuk oleh 24 subunit, memiliki rongga internal, berkat protein yang berhasil mengikat hingga 3000 ion besi. Selain itu, struktur kuaterner memungkinkan beberapa fungsi berbeda dilakukan dalam satu molekul. Triptofan sintetase menggabungkan enzim yang bertanggung jawab untuk beberapa tahap sintesis asam amino triptofan.
Metode untuk mempelajari struktur protein
Struktur utama protein menentukan semua tingkat organisasi molekul protein lainnya. Oleh karena itu, ketika mempelajari fungsi biologis berbagai protein, pengetahuan tentang struktur ini sangatlah penting. Protein pertama yang urutan asam aminonya ditetapkan adalah hormon pankreas, insulin. Pekerjaan yang memakan waktu 11 tahun ini dilakukan oleh ahli biokimia Inggris Frederick Sanger (1954). Ia menentukan letak 51 asam amino dalam molekul hormon dan menunjukkan bahwa ia terdiri dari 2 rantai yang dihubungkan oleh ikatan disulfida. Belakangan, sebagian besar pekerjaan untuk menetapkan struktur utama protein dilakukan secara otomatis.
Dengan berkembangnya metode rekayasa genetika, proses ini dapat lebih dipercepat dengan menentukan struktur primer protein sesuai dengan hasil analisis urutan nukleotida pada gen yang mengkode protein tersebut. Struktur protein sekunder dan tersier dipelajari dengan menggunakan metode fisika yang cukup kompleks, misalnya dikroisme melingkar atau analisis difraksi sinar-X kristal protein. Struktur tersier pertama kali ditetapkan oleh ahli biokimia Inggris John Cowdery Kendrew (1957) untuk protein otot mioglobin.

Beras. 5. Model molekul mioglobin (konfigurasi spasial molekul)
Denaturasi protein
Ikatan yang relatif lemah yang bertanggung jawab untuk menstabilkan struktur protein sekunder, tersier, dan kuaterner mudah dihancurkan, yang disertai dengan hilangnya aktivitas biologisnya. Penghancuran struktur protein asli (asli), yang disebut denaturasi, terjadi dengan adanya asam dan basa, dengan pemanasan, perubahan kekuatan ion, dan pengaruh lainnya. Biasanya, protein yang terdenaturasi sulit atau tidak larut sama sekali dalam air. Dengan efek jangka pendek dan penghapusan cepat faktor denaturasi, renaturasi protein dimungkinkan dengan restorasi lengkap atau sebagian dari struktur asli dan sifat biologis.
Klasifikasi protein
Kompleksitas struktur molekul protein dan variasi ekstrim fungsi yang dijalankannya membuat sulit untuk membuat klasifikasi yang terpadu dan jelas, meskipun upaya untuk melakukan hal ini telah dilakukan berulang kali sejak akhir abad ke-19. Berdasarkan komposisi kimianya, protein dibedakan menjadi sederhana dan kompleks (kadang disebut proteid). Molekul-molekul yang pertama hanya terdiri dari asam amino. Selain rantai polipeptida itu sendiri, protein kompleks mengandung komponen non-protein yang diwakili oleh karbohidrat (glikoprotein), lipid (lipoprotein), asam nukleat (nukleoprotein), ion logam (metaloprotein), gugus fosfat (fosfoprotein), pigmen (kromoprotein), dll. .
Tergantung pada fungsinya, beberapa kelas protein dibedakan. Kelas yang paling beragam dan terspesialisasi terdiri dari protein dengan fungsi katalitik - enzim yang memiliki kemampuan untuk mempercepat reaksi kimia yang terjadi pada organisme hidup. Dalam kapasitas ini, protein berpartisipasi dalam semua proses sintesis dan pemecahan berbagai senyawa selama metabolisme, dalam biosintesis protein dan asam nukleat, pengaturan perkembangan dan diferensiasi sel. Protein transpor memiliki kemampuan untuk secara selektif mengikat asam lemak, hormon dan senyawa serta ion organik dan anorganik lainnya, dan kemudian mengangkutnya dengan arus ke lokasi yang diinginkan (misalnya, hemoglobin terlibat dalam transfer oksigen dari paru-paru ke seluruh sel). tubuh). Protein transpor juga melakukan transpor aktif ion, lipid, gula dan asam amino melintasi membran biologis.
Protein struktural menjalankan fungsi pendukung atau pelindung; mereka berpartisipasi dalam pembentukan kerangka sel. Yang paling umum di antaranya adalah kolagen jaringan ikat, keratin, kuku dan bulu, elastin sel pembuluh darah dan masih banyak lagi lainnya. Dalam kombinasi dengan lipid, mereka adalah dasar struktural membran seluler dan intraseluler.
Sejumlah protein melakukan fungsi pelindung. Misalnya, imunoglobulin (antibodi) vertebrata, yang memiliki kemampuan untuk mengikat mikroorganisme dan zat patogen asing, menetralkan efek patogennya pada tubuh dan mencegah proliferasi sel. Fibrinogen dan trombin terlibat dalam proses pembekuan darah. Banyak zat protein yang disekresikan oleh bakteri, serta komponen beberapa invertebrata, diklasifikasikan sebagai racun.
Beberapa protein (pengaturan) terlibat dalam pengaturan aktivitas fisiologis tubuh secara keseluruhan, organ individu, sel atau proses. Mereka mengontrol transkripsi gen dan sintesis protein; ini termasuk hormon protein peptida yang disekresikan oleh kelenjar endokrin. Protein penyimpan benih menyediakan nutrisi untuk tahap awal perkembangan embrio. Ini juga termasuk kasein, albumin putih telur (ovalbumin) dan banyak lainnya. Berkat protein, sel otot memperoleh kemampuan untuk berkontraksi dan pada akhirnya memberikan pergerakan pada tubuh. Contoh protein kontraktil tersebut adalah aktin dan miosin otot rangka, serta tubulin, yang merupakan komponen silia dan flagela organisme uniseluler; Mereka juga memastikan perbedaan kromosom selama pembelahan sel.
Protein reseptor adalah target hormon dan senyawa aktif biologis lainnya. Dengan bantuan mereka, sel merasakan informasi tentang keadaan lingkungan luar. Mereka memainkan peran penting dalam transmisi eksitasi saraf dan orientasi pergerakan sel (kemotaksis). Transformasi dan pemanfaatan energi yang masuk ke dalam tubuh, serta energi, juga terjadi dengan partisipasi protein dari sistem bioenergi (misalnya, pigmen visual rhodopsin, sitokrom rantai pernapasan). Ada juga banyak protein dengan fungsi lain yang terkadang agak tidak biasa (misalnya, plasma beberapa ikan Antartika mengandung protein yang memiliki sifat antibeku).
Biosintesis protein
Semua informasi tentang struktur protein tertentu “disimpan” dalam gen terkait dalam bentuk rangkaian nukleotida dan diimplementasikan dalam proses sintesis templat. Pertama, informasi ditransfer (dibaca) dari molekul DNA ke messenger RNA (mRNA) menggunakan enzim RNA polimerase yang bergantung pada DNA, dan kemudian di ribosom pada mRNA, seperti pada matriks sesuai dengan kode genetik, dengan partisipasi RNA transpor yang mengantarkan asam amino, terjadi pembentukan rantai polipeptida.
Rantai polipeptida yang disintesis yang muncul dari ribosom, terlipat secara spontan, memiliki karakteristik konformasi protein dan dapat mengalami modifikasi pasca-translasi. Rantai samping asam amino individu dapat mengalami modifikasi (hidroksilasi, fosforilasi, dll.). Itulah sebabnya, misalnya, hidroksiprolin dan hidroksilisin ditemukan dalam kolagen (lihat). Modifikasi tersebut juga dapat disertai dengan putusnya ikatan polipeptida. Dengan cara ini, misalnya, terjadi pembentukan molekul insulin aktif, yang terdiri dari dua rantai yang dihubungkan oleh ikatan disulfida.

Beras. 6. Skema umum biosintesis protein.
Pentingnya protein dalam nutrisi
Protein adalah komponen terpenting dalam makanan hewani dan manusia. Nilai gizi protein ditentukan oleh kandungan asam amino esensial di dalamnya, yang tidak diproduksi sendiri oleh tubuh. Dalam hal ini, protein nabati kurang bernilai dibandingkan protein hewani: protein tersebut lebih miskin lisin, metionin, dan triptofan, dan lebih sulit dicerna di saluran pencernaan. Kurangnya asam amino esensial dalam makanan menyebabkan gangguan parah pada metabolisme nitrogen.
Protein dipecah menjadi asam amino bebas, yang setelah diserap di usus, masuk dan didistribusikan ke seluruh sel. Beberapa dari mereka terurai menjadi senyawa sederhana dengan pelepasan energi, digunakan untuk berbagai kebutuhan oleh sel, dan beberapa digunakan untuk sintesis protein baru yang merupakan karakteristik organisme tertentu. (R.A. Matveeva, Ensiklopedia Cyril dan Methodius)
Pencacahan protein
- amiloid - amiloid;
- anionik - anionik;
- antivirus - antivirus;
- autoimun - autoimun;
- autologus - autologis;
- bakteri - bakteri;
- protein Bence Jones;
- disebabkan oleh virus - disebabkan oleh virus;
- virus - virus;
- virus nonstruktural - virus nonstruktural;
- struktur virus - struktur virus;
- khusus virus - khusus virus;
- berat molekul tinggi - berat molekul tinggi;
- mengandung heme - heme;
- heterolog - asing;
- hibrida - hibrida;
- glikosilasi - terglikasi;
- bulat - bulat;
- didenaturasi - didenaturasi;
- mengandung besi - besi;
- kuning telur - kuning telur;
- protein hewani - protein hewani;
- protektif - defensif;
- kebal - kebal;
- imunogenik - relevan secara imunologis;
- pengikatan kalsium;
- asam - asam;
- sel darah - sel darah;
- membran - membran;
- mieloma - mieloma;
- mikrosomal - mikrosomal;
- protein susu - protein susu;
- monoklonal - imunoglobulin monoklonal;
- protein otot - protein otot;
- asli - asli;
- nonhiston - nonhiston;
- rusak - sebagian;
- tidak larut - tidak larut;
- tidak dapat dicerna - tidak larut;
- non-enzimatik - nonenzim;
- berat molekul rendah - berat molekul rendah;
- protein baru - protein baru;
- umum - keseluruhan;
- onkogenik - onkoprotein;
- protein fase utama - anionik;
- protein fase akut (peradangan) - protein fase akut;
- makanan - makanan;
- protein plasma darah - protein plasma;
- plasenta - plasenta;
- pelepasan - pelepasan;
- protein regenerasi saraf;
- peraturan - peraturan;
- rekombinasi - rekombinan;
- reseptor - reseptor;
- ribosom - ribosom;
- mengikat - mengikat;
- protein sekretori - protein sekretori;
- C-reaktif - C-reaktif;
- protein whey - protein whey, laktoprotein;
- tisu – tisu;
- beracun - beracun;
- tidak masuk akal - tidak masuk akal;
- utuh - utuh;
- sitosol - sitosol;
- protein alkali - protein anionik;
- eksogen - eksogen;
- endogen - protein endogen.
Baca lebih lanjut tentang protein dalam literatur:
- Volkenshtein M.V., Molekul dan, M., 1965, bab. 3 - 5;
- Gaurowitz F., Kimia dan fungsi protein, trans. dari bahasa Inggris, Moskow, 1965;
- Sissakyan N. M. dan Gladilin K. L., Aspek biokimia sintesis protein, dalam buku: Kemajuan kimia biologi, vol.7, M., 1965, hal. 3;
- Stepanov V. M. Biologi molekuler. Struktur dan fungsi protein. M., 1996;
- Shamin A.N., Perkembangan kimia protein, M., 1966;
- Protein dan peptida. M., 1995-2000. T.1-3;
- Biosintesis protein dan asam nukleat, ed. A. S. Spirina, M., 1965;
- Pengantar biologi molekuler, trans. dari bahasa Inggris, M., 1967
- Molekul dan sel. [Duduk. Seni.], terjemahan. dari bahasa Inggris, M., 1966, hal. 7 - 27, 94 - 106;
- Dasar-dasar biokimia: Terjemahan dari bahasa Inggris M., 1981. T. 1;
- Masalah proteinnya. M., 1995.Vol.1-5;
- Protein. New York, 1975-79. edisi ke-3 V.1-4.
Temukan hal lain yang menarik: