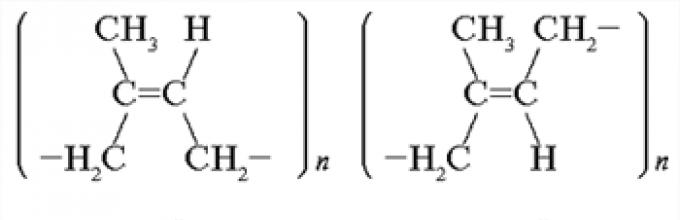Ketergantungan sifat-sifat zat pada struktur molekul
Pelajaran dalam Pikiran Terbuka
Sasaran. Pendidikan – untuk mengkonsolidasikan dan memperdalam pengetahuan siswa tentang teori struktur kimia dan prinsip-prinsip dasarnya.
Pendidikan– mempromosikan pembentukan hubungan dan hubungan sebab-akibat.
Pembangunan– pengembangan keterampilan berpikir, kemampuan untuk mentransfer pengetahuan dan keterampilan ke situasi baru.
Peralatan dan reagen. Satu set model bola dan tongkat; sampel karet alam dan sintetis, dietil eter, butanol, etanol, fenol, litium, natrium, larutan lakmus, air brom, asam format dan asam asetat.
Motto.“Setiap zat - dari yang paling sederhana hingga yang paling kompleks - memiliki tiga aspek yang berbeda namun saling berhubungan - sifat, komposisi, struktur"(V.M. Kedrov).
SELAMA KELAS
Apa saja yang termasuk dalam konsep “kecanduan”? (Cari tahu pendapat siswa).
Tuliskan definisinya di papan tulis: “Kecanduan adalah
1) hubungan suatu fenomena dengan fenomena lainnya sebagai akibat suatu sebab;
2) subordinasi kepada orang lain tanpa adanya kemandirian, kebebasan” (kamus oleh S.I. Ozhegov).
Kita akan menentukan tujuan pelajaran bersama-sama dengan membuat diagram:
Blok orientasi motivasi
Pemanasan intelektual
Tentukan kebenaran pernyataan di bawah ini dan dukung jawaban Anda dengan contoh.
Teori struktur kimia ditemukan oleh D.I.Mendeleev.
Menjawab. A.M.Butlerov, 1861
Valensi karbon dalam senyawa organik dapat berupa II dan IV.
Menjawab. Valensi karbon paling sering IV.
Atom-atom pembentuk molekul zat organik terikat secara acak, tanpa memperhatikan valensi.
Menjawab. Atom-atom dalam molekul terikat dalam urutan tertentu sesuai dengan valensinya.
Sifat-sifat zat tidak bergantung pada struktur molekulnya.
Menjawab. Butlerov, dalam teori struktur kimia, berpendapat bahwa sifat senyawa organik ditentukan oleh komposisi dan struktur molekulnya.
Unit operasi dan eksekusi
Faktor struktur spasial
Apa yang anda ketahui tentang struktur spasial molekul alkana dan alkena?
Menjawab. Dalam alkana, pada setiap karbon terdapat empat atom tetangga, yang terletak di simpul tetrahedron. Karbon sendiri terletak di pusat tetrahedron. Jenis hibridisasi atom karbon – sp 3, sudut antar ikatan (H–C–C, H–C–H, C–C–C) - 109°28". Struktur rantai karbonnya zigzag.
Pada alkena, dua atom karbon yang dihubungkan dengan ikatan rangkap dan empat atom dengan ikatan tunggal berada pada bidang yang sama. Jenis hibridisasi atom – sp 2, sudut antar ikatan (H–C=C, C–C=C) - 120°.
Ingat perbedaan struktur spasial molekul karet alam dan karet sintetis.
Menjawab. Karet alam, polimer linier isoprena, memiliki struktur cis-1,4-poliisoprena. Karet sintetis dapat memiliki struktur kesurupan-1,4-poliisoprena.

Apakah karet ini mempunyai elastisitas yang sama?
Menjawab. Bentuk cis lebih elastis dibandingkan bentuk transformasi. Molekul karet alam lebih panjang dan lebih elastis (pertama menjadi spiral dan kemudian menjadi bola) dibandingkan molekul karet sintetis.
Pati (C 5 H 10 O 5) m adalah bubuk amorf berwarna putih, dan selulosa (C 5 H 10 O 5) n adalah zat berserat.
Apa alasan perbedaan ini?
Menjawab. Pati adalah polimer -glukosa, sedangkan selulosa adalah polimer -glukosa.

Apakah sifat kimia pati dan selulosa berbeda?
Menjawab. Pati + I 2 solusi biru,
selulosa + HNO 3 nitroselulosa.
Kesimpulan. Sifat fisik dan kimia bergantung pada struktur spasial.
Faktor struktur kimia
Apa gagasan pokok teori struktur kimia?
Menjawab. Struktur kimia mencerminkan ketergantungan sifat-sifat zat pada urutan ikatan atom dan interaksinya.
Tentukan persamaan zat-zat tersebut:
Menjawab. Menggabungkan.
Bandingkan sifat fisik zat-zat tersebut. Apa yang Anda lihat sebagai alasan perbedaan ini?
Berdasarkan distribusi kerapatan elektron suatu ikatan kimia, molekul manakah yang lebih polar? Apa hubungannya ini?
Menjawab. –OH ikatan hidrogen.
Eksperimen demonstrasi

Kesimpulan. Reaktivitas alkohol ditentukan oleh pengaruh timbal balik atom-atom dalam molekul.
Faktor struktur elektronik
Apa intinya saling mempengaruhi atom?
Menjawab. Saling mempengaruhi terdiri dari interaksi struktur elektronik atom, yang menyebabkan pergeseran kerapatan elektron ikatan kimia.
Pekerjaan laboratorium
Guru. Di meja Anda ada set untuk Pekerjaan laboratorium. Selesaikan tugas dan buktikan secara eksperimental ketergantungan sifat-sifat zat pada struktur elektronik. Bekerja berpasangan. Patuhi peraturan keselamatan dengan ketat.
Opsi I. Melakukan penelitian tentang sifat kimia etanol dan fenol. Buktikan ketergantungan mereka reaktivitas dari struktur elektronik. Gunakan reagen - logam litium dan air brom. Tuliskan persamaan reaksi yang mungkin terjadi. Tunjukkan pergeseran kerapatan elektron ikatan kimia dalam molekul.
pilihan II. Jelaskan hakikat saling pengaruh gugus karboksil –COOH dan substituen pada karbon karbonil dalam molekul asam karboksilat. Perhatikan contoh asam format dan asam asetat. Gunakan larutan lakmus dan litium. Tuliskan persamaan reaksi. Tunjukkan pergeseran kerapatan elektron ikatan kimia dalam molekul.
Kesimpulan. Sifat kimia bergantung pada pengaruh timbal balik atom.


Kontrol pengetahuan akhir
Guru. Mari kita rangkum pelajaran kita. Kami telah memastikan bahwa sifat-sifat zat bergantung pada struktur kimia dan elektronik spasial.
1. Tuliskan rumus HCOOH, C 6 H 5 OH dan C 4 H 9 COOH berdasarkan kenaikan sifat asam suatu zat.
2. Susun rumus CH 3 COOH, C 3 H 7 COOH, CH 3 OH, ClCH 2 COOH secara berurutan sifat asam zat.
3. Aldehida manakah yang memiliki:

gugus aldehida yang lebih aktif? Mengapa?
Evaluasi pekerjaan Anda di kelas.
L.A.EREMINA,
guru kimia di sekolah no.24
(Abakan, Khakassia)
Uji A6 Zat yang berstruktur molekul dan nonmolekul. Jenis kisi kristal. Ketergantungan sifat-sifat zat pada komposisi dan strukturnya. 1. Kisi kristal kalsium klorida adalah 1) ionik 2) molekuler 3) logam 4) atom 2. Struktur molekulnya adalah 1) merkuri 2) brom 3) natrium hidroksida 4) kalium sulfat 3. Atom adalah partikel struktural dalam kisi kristal 1) metana 2 ) hidrogen 3) oksigen 4) silikon 4. Zat yang keras, tahan api, dan kelarutan yang baik dalam air, biasanya memiliki kisi kristal: 1) molekuler 2) atom 3) ionik 4 ) logam 5. Kisi kristal molekul memiliki 1) HBr 2) K2O 3) BaO 4) KCl 6. Zat dengan kisi kristal atom 1) sangat keras dan tahan api 2) rapuh dan dapat melebur 3) menghantarkan listrik dalam larutan 4) menghantarkan arus listrik dalam lelehan. 7. Kisi kristal molekul memiliki 1) Ca3P2 2) CO2 3) SO2 4) AlF3 8. Masing-masing zat yang terletak pada baris 1) natrium, natrium klorida, natrium hidrida 2) kalsium, kalsium oksida, kalsium karbonat 3 memiliki kisi kristal ionik ) natrium bromida, kalium sulfat, besi (II) klorida 4) magnesium fosfat, kalium klorida, fosfor oksida (V) 9. Kisi kristal grafit 1) ionik 2) molekul 3) atom 4) logam 10. Zat dengan kekerasan dan sifat tahan api , kelarutan yang baik dalam air, biasanya memiliki kisi kristal 1) molekuler 2) ionik 3) atom 4) logam 11. Kisi kristal molekuler memiliki 1) silikon 2) karbon monoksida (IV) 3) silikon dioksida 4) amonium nitrat 12. Kisi kristal halogen adalah 1) atom 2) ionik 3) molekuler 4) logam 13. Zat dengan kisi kristal atom meliputi 1) natrium, fluor, belerang (IV) oksida 2) timbal, Asam sendawa, magnesium oksida 3) boron, intan, silikon karbida 4) kalium klorida, fosfor putih, yodium 14. Struktur molekulnya adalah 1) seng 2) barium nitrat 3) kalium hidroksida 4) hidrogen bromida 15. Zatnya padat, tahan lama, dengan titik leleh tinggi, lelehannya menghantarkan arus listrik, memiliki kisi kristal 1) logam 2) molekuler 3) atom 4) ionik 16. Ion adalah partikel struktural dari 1) oksigen 2) air 3) karbon monoksida (IV) 4 ) natrium klorida 17. Mereka memiliki struktur non-molekul semua non-logam dari golongan 1) karbon, boron, silikon 3) oksigen, belerang, nitrogen 2) fluor, brom, yodium 4) klor, fosfor, selenium 18. Struktur kristal , mirip dengan struktur intan, memiliki 1) silika 2) natrium oksida 3) karbon monoksida (II) 4) fosfor putih P4 19. Atom adalah partikel struktural dalam kisi kristal 1) metana 2) hidrogen 3) oksigen 4) silikon 20. Kristal molekuler masing-masing dua zat memiliki kisi 1) grafit dan intan 2) silikon dan yodium 3) klor dan karbon monoksida (IV) 4) barium klorida dan barium oksida 21. Masing-masing dua zat memiliki kristal atom kisi 1) silikon oksida (IV) dan karbon monoksida (IV) 2) grafit dan silikon 3) kalium klorida dan natrium fluorida 4) klor dan yodium 22. Struktur molekulnya adalah 1) natrium 2) fruktosa 3) natrium fosfat 4) natrium oksida 23. Kisi kristal molekul merupakan ciri masing-masing zat yang tersusun pada deret 1) kalium klorida, nitrogen, metana 2) yodium, karbon dioksida, ozon 3) aluminium, brom, intan 4) hidrogen, magnesium sulfat, besi (III ) oksida 24. Silikon oksida bersifat tahan api, tidak larut dalam air. Kisi kristalnya adalah 1) atom 2) molekuler 3) ionik 4) logam 25. Tergantung pada sifat partikel pembentuk kristal dan sifat gaya interaksi di antara mereka, empat jenis kisi kristal dibedakan: 1) ionik, atom, molekul dan logam 2) ionik, kovalen, atom dan molekul 3) logam, kovalen, atom dan molekul 4) ionik, kubik, segitiga dan berlapis 26. Kisi kristal es: 1) atom 2) molekul 3) ionik 4) logam 27. Tunjukkan zat yang berwujud padat mempunyai kisi kristal molekul. 1) grafit 2) natrium 3) natrium hidroksida 4) hidrogen 28. Tunjukkan zat yang dalam keadaan padat mempunyai kisi kristal atom: 1) hidrogen klorida 2) klor 3) silikon oksida (IV) 4) kalsium oksida 29. Untuk padatan dengan kisi kristal logam dicirikan oleh tinggi... 1) kelarutan dalam air 2) keelektronegatifan atom 3) volatilitas 4) daya hantar listrik 30. Zat kristal dibentuk oleh partikel Na+ dan OH-. Jenis kisi kristal apa yang dimiliki zat ini? 1) atom 2) molekuler 3) ionik 4) logam 31. Masing-masing dua zat mempunyai struktur nonmolekul: 1) S8 dan O2 2) Fe dan NaCl 3) CO dan Mg 4) Na2CO3 dan I2 32. Zat dengan struktur molekulnya adalah 1) ozon 2) barium oksida 3) grafit 4) kalium sulfida 33. Kisi kristal atom suatu zat sederhana: 1) intan 2) tembaga 3) fluor 4) timah 34. Pernyataan bahwa partikel struktural dari zat tertentu adalah molekul yang hanya berlaku untuk 1) intan 2) garam meja 3) silikon 4) nitrogen 35. Kisi kristal ionik memiliki 1) air 2) natrium fluorida 3) perak 4) brom 36. Zat sederhana, mempunyai jenis kisi kristal yang sama, dibentuk oleh unsur-unsur 1) periode kecil 3) subkelompok sekunder 2) subkelompok utama 4) periode besar 37. Struktur kristal, mirip dengan struktur berlian, memiliki: 1) silika SiO2 2 ) natrium oksida Na2O 3) karbon monoksida ( II) CO 4) fosfor putih P4 38. Fosfin PH3 berbentuk gas. Kisi kristalnya adalah 1) atom 2) molekuler 3) ionik 4) logam 39. Kristal terbuat dari molekul. 1) gula 2) garam 3) intan 4) perak 40. Kristal dari 1) gula 2) natrium hidroksida 3) intan 4) perak terbuat dari ion-ion yang bermuatan berlawanan 41. Partikel apa yang membentuk kristal natrium nitrat? 1) Atom Na, N dan O 3) Ion Na+, NO3+ 5+ 22) Ion Na, N, O 4) Molekul NaNO3 42. Mengevaluasi kebenaran penilaian tentang hubungan antara struktur dan sifat suatu zat. A. Di antara zat-zat yang berstruktur molekul, ada yang berbentuk gas, cair, dan padat dalam kondisi normal. B. Zat dengan kisi kristal atom berbentuk padat dalam kondisi biasa. 1) hanya A yang benar 2) hanya B yang benar 3) kedua penilaian benar 4) kedua penilaian salah 43. Evaluasi kebenaran penilaian tentang hubungan antara struktur dan sifat suatu zat: A. Jika ada a ikatan kimia yang kuat antar partikel dalam suatu kristal, maka zat tersebut bersifat tahan api. B.Semua padatan mempunyai struktur non-molekul 1) hanya A yang benar 2) hanya B yang benar 3) kedua penilaian benar 4) kedua penilaian salah 44. Manakah dari pernyataan berikut yang benar: A. Zat dengan kisi molekul memiliki suhu rendah leleh dan konduktivitas listrik yang rendah. B. Zat dengan kisi atom bersifat plastis dan mempunyai daya hantar listrik yang tinggi. 1) hanya A yang benar 2) hanya B yang benar 3) kedua penilaian benar 4) kedua penilaian salah 45. Tetapkan korespondensi antara suatu zat dan jenis kisi kristalnya. JENIS ZAT Kisi KRISTAL 1) garam meja A) molekuler 2) perak B) ionik 3) karbon dioksida C) atom 4) grafit D) logam 5) glukosa 46. Tetapkan korespondensi antara jenis kisi kristal dan sifat-sifat zat . JENIS SIFAT-SIFAT KRISTAL ZAT Kisi A) ionik 1) padat, tahan api, tidak larut dalam air B) logam 2) rapuh, melebur, tidak menghantarkan arus listrik C) atom 3) plastik, mempunyai titik leleh yang berbeda-beda, dapat menghantarkan arus listrik D) molekul 4 ) padat, tahan api, mudah larut dalam air 47. Tunjukkan deret yang ditandai dengan penurunan panjang ikatan kimia 1) SiCl4, MgCl2, AlCl3, NaCl 2) NaCl, MgCl2, SiCl4, AlCl3 3) NaCl , SiCl4, MgCl2, AlCl3 4) NaCl, MgCl2, AlCl3, SiCl4 48. Mengevaluasi kebenaran penilaian tentang hubungan antara struktur dan sifat suatu zat. A. Jika terdapat ikatan kimia yang kuat antar partikel dalam kristal, maka zat tersebut mudah menguap. B. Semua gas memiliki struktur molekul. 1) hanya A yang benar 2) hanya B yang benar 3) kedua penilaian benar 4) kedua penilaian salah
Kuliah 7Ketergantungan sifat-sifat zat padanya
bangunan. Ikatan kimia. Dasar
jenis ikatan kimia.
Masalah yang dibahas:
1. Tingkat pengorganisasian materi. Hierarki struktur.
2. Zat yang berstruktur molekul dan nonmolekul.
3.
4. Penyebab terjadinya ikatan kimia.
5. Ikatan kovalen: mekanisme pembentukan, metode
tumpang tindih orbital atom, polaritas, momen dipol
molekul.
6. Ikatan ionik.
7. Perbandingan ikatan kovalen polar dan ionik.
8. Perbandingan sifat-sifat zat dengan kovalen polar dan
ikatan ionik.
9. Sambungan logam.
10. Interaksi antarmolekul. Substansi (lebih dari 70 juta)
Apa yang perlu Anda ketahui tentang setiap zat?
Rumus (terdiri dari apa)
Struktur (cara kerjanya)
Properti fisik
Sifat kimia
Metode memperoleh
(lab. dan industri)
6. Penggunaan praktis
1.
2.
3.
4.
5.Hirarki struktur materi
Semua zat
terdiri dari
atom, tapi tidak
semuanya berasal dari
molekul.
Atom
Molekul
Untuk semua zat
Hanya untuk zat
molekuler
bangunan
tingkat nano
Untuk semua zat
Volumetrik (makro)
tingkat
Untuk semua zat
Keempat level tersebut menjadi objek studi kimia Zat molekul
dan struktur non-molekul Zat
Molekuler
bangunan
Non-molekuler
bangunan
Terdiri dari molekul
Terdiri dari atom
atau ion
H2O, CO2, HNO3, C60,
hampir semua organisasi. zat
Intan, grafit, SiO2,
logam, garam
Rumusnya mencerminkan
komposisi molekul
Rumusnya mencerminkan komposisi
satuan rumus Zat
Natrium klorida
Satuan rumus NaCl Zat
silika
Satuan rumus SiO2
Museum Mineralogi Fersman terletak di dekat pintu masuk ke Taman Neskuchny.
Alamat: Moskow, Leninsky Prospekt, gedung 18, gedung 2. Keberagaman struktur kimia.
bahan pembakar
C5H6
koroner
(superbenzena)
C24H12
cavitand
C36H32O8 Keanekaragaman struktur kimia.
catenane Keanekaragaman struktur kimia.
catenane Keanekaragaman struktur kimia.
Jalur Mobius Molekul
Molekul adalah sistem stabil yang terdiri dari beberapa
inti atom dan elektron.
Atom bergabung menjadi molekul dengan membentuk
ikatan kimia.
rumah penggerak pembentukan molekul dari
atom – penurunan energi total.
Molekul punya bentuk geometris, ditandai
jarak antar inti dan sudut antar ikatan. Kekuatan pendorong utama
pembentukan ikatan kimia
antar partikel materi -
pengurangan energi total
sistem. Jenis bahan kimia utama
koneksi:
1.ionik
2. Kovalen
3.Logam
Antarmolekul dasar
interaksi:
1.Ikatan hidrogen
2. Koneksi Van der Waals Ikatan ionik
Jika suatu ikatan dibentuk oleh atom-atom yang sangat berbeda
nilai keelektronegatifan (ΔOOE ≥ 1,7),
pasangan elektron bersama hampir seluruhnya
bergeser ke arah yang lebih elektronegatif
atom.
Na Kl
OEO 0.9 3.16
∆ 2,26
+Tidak
Anion
:Klasi
Ikatan kimia antar ion yang terjadi
karena daya tarik elektrostatisnya,
disebut ionik. Ikatan ionik
Potensi Coulomb berbentuk bola
simetris, diarahkan ke segala arah,
oleh karena itu ikatan ioniknya tidak terarah.
Potensi Coulomb tidak dimiliki
pembatasan kuantitas
menambahkan counterion -
karenanya ikatan ionik
tak terpuaskan. Ikatan ionik
Senyawa dengan tipe ikatan ionik
padat, sangat larut dalam
pelarut polar, memiliki tinggi
titik leleh dan titik didih. Ikatan ionik
Kurva I: tarik-menarik ion jika
akankah mereka mewakili
biaya poin.
Kurva II: tolakan inti di
dalam kasus kedekatan ion.
Kurva III: energi minimum E0 pada
sesuai dengan kurva
keadaan kesetimbangan ionik
pasangan, di mana kekuatan
daya tarik elektron ke inti
dikompensasi oleh kekuatan
tolakan inti satu sama lain
jarak r0, Ikatan kimia dalam molekul
Ikatan kimia dalam molekul dapat dijelaskan dengan
posisi dua metode:
- metode ikatan valensi, MBC
- metode orbital molekul, MMO Metode ikatan valensi
Teori Heitler-London
Ketentuan dasar metode BC:
1. Ikatan dibentuk oleh dua elektron yang berlawanan
berputar, dan gelombang gelombang tumpang tindih
fungsi dan kerapatan elektron di antaranya
inti.
2. Koneksi dilokalisasi ke arah maksimum
tumpang tindih fungsi elektron. Semakin kuat
tumpang tindih, semakin kuat ikatannya.
dsv - panjang
komunikasi;
ESV - energi
komunikasi. Pembentukan molekul hidrogen:
N· + ·N → N:N
Ketika dua atom bersatu
kekuatan menarik muncul dan
tolakan:
1) tarik menarik: “inti elektron”
atom tetangga;
2) tolakan: “inti-inti”,
tetangga "elektron-elektron".
atom. Pembentukan molekul hidrogen:
Molekuler
awan dua elektron,
memiliki maksimal
kerapatan elektron. Ikatan kimia dilakukan secara umum
pasangan elektron disebut kovalen.
Pasangan elektron bersama dapat dibentuk oleh dua orang
cara:
1) akibat penyatuan dua elektron tidak berpasangan:
2) sebagai hasil sosialisasi yang tidak terbagi-bagi
pasangan elektron dari satu atom (donor) dan kosong
orbital lain (akseptor).
Dua mekanisme pembentukan ikatan kovalen:
pertukaran dan donor-akseptor.
kepadatan komunikasi terjadi di sepanjang jalur,
menghubungkan pusat-pusat atom (inti), maka ini
tumpang tindih disebut σ-coupling: Metode tumpang tindih orbital atom dengan
pembentukan ikatan kovalen
Jika formasinya elektronik maksimal
kerapatan ikatan terjadi pada kedua sisi
garis yang menghubungkan pusat-pusat atom (inti), lalu
tumpang tindih seperti itu disebut ikatan π: Ikatan kovalen polar dan non polar
1) Jika ikatan dibentuk oleh atom-atom yang identik,
awan komunikasi dua elektron didistribusikan
ruang secara simetris antara inti mereka - seperti itu
ikatannya disebut non-polar: H2, Cl2, N2.
2) jika ikatan terbentuk atom yang berbeda, awan komunikasi
bergeser ke arah atom yang lebih elektronegatif
- ikatan seperti itu disebut polar: HCl, NH3, CO2. Ikatan kovalen polar
Momen dipol kopling
Dipol
H+δCl-δ atau H+0,18Cl-0,18
Dimana ±δ efektif
muatan atom, pecahan
muatan mutlak
elektron.
+δ
-δ
Jangan bingung dengan bilangan oksidasi!
aku
Produk muatan efektif dan panjang dipol
disebut momen listrik dipol: μ = δl
Ini adalah besaran vektor: diarahkan dari positif
muatan menjadi negatif. Ikatan kovalen polar
Momen dipol suatu molekul
Momen dipol suatu molekul sama dengan jumlah
vektor momen dipol ikatan, dengan memperhitungkan
pasangan elektron bebas.
Satuan momen dipol
adalah Debye: 1D = 3,3·10-30 C·m. Ikatan kovalen polar
Momen dipol suatu molekul
Pada hasil kali μ = δl, kedua besaran tersebut mempunyai arah yang berlawanan.
Oleh karena itu, kita harus hati-hati memantau penyebabnya
perubahan μ.
Misalnya,
CsF
CsCl
24
31
δ "hilang" l
CsI
HF
HCl
HBr
HAI
37
5,73
3,24
2,97
1,14
dan sebaliknya Ikatan kovalen polar
Momen dipol suatu molekul
Bisakah suatu molekul menjadi non-polar jika
Apakah semua koneksi di dalamnya bersifat polar?
Molekul tipe AB selalu polar.
Molekul tipe AB2 dapat bersifat polar dan
non-polar...
H2O
TENTANG
N
CO2
μ>0
N
TENTANG
DENGAN
μ=0
TENTANG Ikatan kovalen polar
Molekul yang terdiri dari tiga atom atau lebih
(AB2, AB3, AB4, AB5, AB6) ,
mungkin non-polar jika simetris.
Apa pengaruh kehadiran momen dipol?
molekul?
Ada interaksi antarmolekul, dan
Akibatnya, kepadatan zat meningkat,
suhu leleh dan suhu didih. Perbandingan ikatan polar ionik dan kovalen
Umum: pendidikan umum
pasangan elektron.
Perbedaan: derajat
perpindahan umum
pasangan elektron
(polarisasi ikatan).
Ikatan ionik harus dianggap ekstrem
kasus ikatan kovalen polar.
ikatan polar
Ikatan kovalen: jenuh dan terarah
Saturasi (valensi maksimum) -
ditentukan oleh kemampuan atom untuk terbentuk
jumlah koneksi terbatas (dengan mempertimbangkan keduanya
mekanisme pembentukan).
Arah ikatan ditentukan oleh sudut ikatan yang bergantung pada
jenis hibridisasi orbital atom pusat.
Ikatan ionik: tak jenuh dan tidak terarah. Perbandingan karakteristik ionik dan kovalen
ikatan polar
Arah ikatan ditentukan oleh sudut ikatan.
Sudut ikatan ditentukan secara eksperimental atau
diprediksi berdasarkan teori hibridisasi
orbital atom L. Paulling atau teori
Gillespie.
Lebih detail tentang ini di seminar.
ikatan kovalen
Ikatan kovalen
Kristal atom
Antar atom
dalam kristal itu sendiri
Kekerasan tinggi
titik leleh tinggi, titik didih
panas yang buruk dan
konduktivitas listrik
Kristal molekul
Antar atom
dalam sebuah molekul
Kelembutan sedang
cukup rendah
sampai meleleh, sampai mendidih
panas yang buruk dan
Konduktivitas listrik
Tidak larut dalam air Perbandingan sifat-sifat zat dengan ionik dan
ikatan kovalen
kristal molekuler
Titik lebur 112,85 °C Perbandingan sifat-sifat zat dengan ionik dan
ikatan kovalen
Kristal kovalen atom
Titik lebur ≈ 3700 °C Perbandingan sifat-sifat zat dengan ionik dan
ikatan kovalen
Ikatan ionik
antar ion
dalam kristal
kekerasan dan kerapuhan
titik leleh yang tinggi
konduktivitas termal dan listrik yang buruk
Larut dalam air Perbandingan sifat-sifat zat dengan ionik dan
ikatan kovalen
Kristal ionik
Titik lebur ≈ 800 °C Sambungan logam
Ikatan logam dilakukan oleh elektron,
milik semua atom pada waktu yang sama.
Kepadatan elektron
“gas elektron” terdelokalisasi.
Ciri
kilau metalik
Plastik
Daktilitas
Panas tinggi dan
konduktivitas listrik
Titik lebur
sangat berbeda. Ikatan antarmolekul.
1. Ikatan hidrogen
Tarik menarik antara atom hidrogen (+) satu
molekul dan atom F, O, N (–) dari molekul lain
F
F
H
H
H
H
F
F
HAI
H3C
H
F
C
H
Polimer
(HF)n
HAI
C
HAI
H
CH3
Dimer
asam asetat
HAI
Ikatan hidrogen lemah secara individual,
tapi kuat secara kolektif Ikatan antarmolekul.
2. Ikatan hidrogen pada DNA Ikatan antarmolekul.
3. Ikatan hidrogen dalam air
air cair
Es Ikatan antarmolekul.
4. Pembentukan ikatan hidrogen di
air
air cair
transformasi
air menjadi es Ikatan antarmolekul.
5. Koneksi Van der Waals
Sekalipun tidak ada ikatan hidrogen antar molekul,
molekul selalu tertarik satu sama lain.
Gaya tarik-menarik antar dipol molekul disebut kopling van der Waals.
Atraksi C-d-c semakin kuat semakin banyak:
1) polaritas; 2) ukuran molekul.
Contoh: metana (CH4) – gas, benzena (C6H6) – cair
Salah satu yang terlemah koneksi v-d-v– antar molekul
H2 (mp. –259 oC, bp. –253 oC).
Interaksi antar molekul jauh lebih lemah daripada ikatan antar atom:
Ekow(Cl–Cl) = 244 kJ/mol, Evdv(Cl2–Cl2) = 25 kJ/mol
tetapi justru inilah yang menjamin keberadaan materi cair dan padat Perkuliahan menggunakan materi dari profesor
Fakultas Kimia, Universitas Negeri Moskow. Lomonosov
Eremin Vadim Vladimirovich
Terima kasih
atas perhatian Anda!
Doktrin modern tentang sifat organik merupakan pengembangan dari gagasan A.M.Butlerov tentang ketergantungan pada strukturnya. Mengekspresikan struktur memberikan gambaran tentang keseluruhan keragaman, meskipun prediksi bukan merupakan konsekuensi dari hukum matematika yang ketat, tetapi hanya sekedar karakter kualitatif dan menyerahkan lebih banyak lagi pada bakat dan intuisi ahli kimia eksperimental.
Ciri-ciri sifat fisika suatu senyawa sering dinyatakan sebagai penjumlahan dari beberapa suku yang berkaitan dengan unsur-unsur yang bersesuaian yang termasuk dalam komposisinya. dari hubungan ini. Penggunaan tersebut sirkuit aditif Oleh karena itu, mengetahui sifat fisikokimia suatu senyawa dari rumus strukturnya sama dengan asumsi bahwa unsur tersebut, jika dimasukkan ke dalam berbagai senyawa, selalu memberikan kontribusi yang sama dalam sifat tersebut.
Dalam kasus yang paling sederhana, asumsi ini ternyata sangat mendekati kebenaran (misalnya, nilai volume molekul dan
Kuliah 7 Ketergantungan sifat-sifat zat pada strukturnya. Ikatan kimia. Jenis utama ikatan kimia. Masalah yang dipertimbangkan: 1. Tingkat pengorganisasian materi. Hierarki struktur. 2. Zat yang berstruktur molekul dan nonmolekul. 3. Keanekaragaman struktur kimia. 4. Penyebab terjadinya ikatan kimia. 5. Ikatan kovalen: mekanisme pembentukan, cara tumpang tindih orbital atom, polaritas, momen dipol suatu molekul. 6. Ikatan ionik. 7. Perbandingan ikatan kovalen polar dan ionik. 8. Perbandingan sifat-sifat zat yang mempunyai ikatan kovalen polar dan ionik. 9. Sambungan logam. 10. Interaksi antarmolekul.
 Zat (lebih dari 70 juta) Apa yang perlu Anda ketahui tentang setiap zat? 1. 2. 3. 4. 5. Rumus (terdiri dari apa) Struktur (cara kerja) Sifat fisika Sifat kimia Cara pembuatan (laboratorium dan industri) 6. Penerapan praktis
Zat (lebih dari 70 juta) Apa yang perlu Anda ketahui tentang setiap zat? 1. 2. 3. 4. 5. Rumus (terdiri dari apa) Struktur (cara kerja) Sifat fisika Sifat kimia Cara pembuatan (laboratorium dan industri) 6. Penerapan praktis
 Hierarki struktur materi Semua zat tersusun atas atom, namun tidak semuanya tersusun atas molekul. Atom Molekul Untuk semua zat Hanya untuk zat yang berstruktur molekul Tingkat nano Untuk semua zat Tingkat volumetrik (makro) Untuk semua zat Ke-4 tingkatan tersebut menjadi objek kajian kimia
Hierarki struktur materi Semua zat tersusun atas atom, namun tidak semuanya tersusun atas molekul. Atom Molekul Untuk semua zat Hanya untuk zat yang berstruktur molekul Tingkat nano Untuk semua zat Tingkat volumetrik (makro) Untuk semua zat Ke-4 tingkatan tersebut menjadi objek kajian kimia

 Zat Struktur molekul Struktur non-molekul Terdiri dari molekul Terdiri dari atom atau ion H 2 O, CO 2, HNO 3, C 60, hampir semuanya org. zat Intan, grafit, Si. O 2, logam, garam Rumusnya mencerminkan komposisi molekul Rumusnya mencerminkan komposisi satuan rumus
Zat Struktur molekul Struktur non-molekul Terdiri dari molekul Terdiri dari atom atau ion H 2 O, CO 2, HNO 3, C 60, hampir semuanya org. zat Intan, grafit, Si. O 2, logam, garam Rumusnya mencerminkan komposisi molekul Rumusnya mencerminkan komposisi satuan rumus

 Zat Silikon dioksida Satuan rumus Si. O 2 Museum Mineralogi Fersman terletak di dekat pintu masuk Taman Neskuchny. Alamat: Moskow, Leninsky Prospekt, gedung 18, gedung 2.
Zat Silikon dioksida Satuan rumus Si. O 2 Museum Mineralogi Fersman terletak di dekat pintu masuk Taman Neskuchny. Alamat: Moskow, Leninsky Prospekt, gedung 18, gedung 2.
 Keanekaragaman struktur kimia. propelan C 5 H 6 coronene (superbenzene) C 24 H 12 cavitand C 36 H 32 O 8
Keanekaragaman struktur kimia. propelan C 5 H 6 coronene (superbenzene) C 24 H 12 cavitand C 36 H 32 O 8



 Molekul adalah sistem stabil yang terdiri dari beberapa inti atom dan elektron. Atom bergabung menjadi molekul dengan membentuk ikatan kimia. Kekuatan pendorong utama pembentukan molekul dari atom adalah penurunan energi total. Molekul memiliki bentuk geometris yang ditandai dengan jarak antar inti dan sudut antar ikatan.
Molekul adalah sistem stabil yang terdiri dari beberapa inti atom dan elektron. Atom bergabung menjadi molekul dengan membentuk ikatan kimia. Kekuatan pendorong utama pembentukan molekul dari atom adalah penurunan energi total. Molekul memiliki bentuk geometris yang ditandai dengan jarak antar inti dan sudut antar ikatan.

 Jenis utama ikatan kimia: 1. Ionik 2. Kovalen 3. Logam Interaksi dasar antarmolekul: 1. Ikatan hidrogen 2. Ikatan Van der Waals
Jenis utama ikatan kimia: 1. Ionik 2. Kovalen 3. Logam Interaksi dasar antarmolekul: 1. Ikatan hidrogen 2. Ikatan Van der Waals
 Ikatan ionik Jika suatu ikatan dibentuk oleh atom-atom dengan nilai keelektronegatifan yang sangat berbeda (ΔOOE ≥ 1,7), pasangan elektron bersama hampir seluruhnya bergeser ke arah atom yang lebih elektronegatif. Na Cl OEO 0,9 3,16 ∆ 2,26 +Na Anion: Cl. Kation Ikatan kimia antar ion yang terjadi karena gaya tarik elektrostatisnya disebut ionik.
Ikatan ionik Jika suatu ikatan dibentuk oleh atom-atom dengan nilai keelektronegatifan yang sangat berbeda (ΔOOE ≥ 1,7), pasangan elektron bersama hampir seluruhnya bergeser ke arah atom yang lebih elektronegatif. Na Cl OEO 0,9 3,16 ∆ 2,26 +Na Anion: Cl. Kation Ikatan kimia antar ion yang terjadi karena gaya tarik elektrostatisnya disebut ionik.
 Ikatan ion Potensial Coulomb berbentuk simetris bola, berarah ke segala arah, sehingga ikatan ion bersifat non-arah. Potensi Coulomb tidak memiliki batasan jumlah ion lawan yang ditambahkan - oleh karena itu, ikatan ioniknya tidak jenuh.
Ikatan ion Potensial Coulomb berbentuk simetris bola, berarah ke segala arah, sehingga ikatan ion bersifat non-arah. Potensi Coulomb tidak memiliki batasan jumlah ion lawan yang ditambahkan - oleh karena itu, ikatan ioniknya tidak jenuh.
 Ikatan ionik Senyawa dengan jenis ikatan ionik berbentuk padat, sangat larut dalam pelarut polar, serta mempunyai titik leleh dan titik didih yang tinggi.
Ikatan ionik Senyawa dengan jenis ikatan ionik berbentuk padat, sangat larut dalam pelarut polar, serta mempunyai titik leleh dan titik didih yang tinggi.
 Ikatan ionik Kurva I: tarik menarik ion-ion jika ion-ion tersebut bermuatan titik. Kurva II: tolakan inti jika ion mendekat dengan kuat. Kurva III: energi minimum E 0 pada kurva sesuai dengan keadaan setimbang pasangan ion, di mana gaya tarik-menarik elektron ke inti dikompensasi oleh gaya tolak-menolak inti satu sama lain pada jarak r 0,
Ikatan ionik Kurva I: tarik menarik ion-ion jika ion-ion tersebut bermuatan titik. Kurva II: tolakan inti jika ion mendekat dengan kuat. Kurva III: energi minimum E 0 pada kurva sesuai dengan keadaan setimbang pasangan ion, di mana gaya tarik-menarik elektron ke inti dikompensasi oleh gaya tolak-menolak inti satu sama lain pada jarak r 0,
 Ikatan kimia dalam molekul Ikatan kimia dalam molekul dapat digambarkan dari dua metode: - metode ikatan valensi, MBC - metode orbital molekul, MMO
Ikatan kimia dalam molekul Ikatan kimia dalam molekul dapat digambarkan dari dua metode: - metode ikatan valensi, MBC - metode orbital molekul, MMO
 Metode ikatan valensi Teori Heitler-London Prinsip dasar metode BC: 1. Ikatan terbentuk oleh dua elektron dengan spin berlawanan, sedangkan fungsi gelombang tumpang tindih dan kerapatan elektron antar inti meningkat. 2. Ikatan terlokalisasi pada arah tumpang tindih maksimum fungsi elektron Ψ. Semakin besar tumpang tindihnya, semakin kuat hubungannya.
Metode ikatan valensi Teori Heitler-London Prinsip dasar metode BC: 1. Ikatan terbentuk oleh dua elektron dengan spin berlawanan, sedangkan fungsi gelombang tumpang tindih dan kerapatan elektron antar inti meningkat. 2. Ikatan terlokalisasi pada arah tumpang tindih maksimum fungsi elektron Ψ. Semakin besar tumpang tindihnya, semakin kuat hubungannya.

 Pembentukan molekul hidrogen: H· + ·H → H: H Ketika dua atom bersatu, timbul gaya tarik-menarik dan tolak-menolak: 1) tarik-menarik: “inti-elektron” atom-atom tetangga; 2) tolakan: “inti-inti”, “elektron-elektron” atom tetangga.
Pembentukan molekul hidrogen: H· + ·H → H: H Ketika dua atom bersatu, timbul gaya tarik-menarik dan tolak-menolak: 1) tarik-menarik: “inti-elektron” atom-atom tetangga; 2) tolakan: “inti-inti”, “elektron-elektron” atom tetangga.

 Ikatan kimia yang dilakukan oleh pasangan elektron bersama disebut kovalen. Pasangan elektron bersama dapat terbentuk melalui dua cara: 1) sebagai hasil penyatuan dua elektron yang tidak berpasangan: 2) sebagai hasil dari penggunaan bersama pasangan elektron bebas dari satu atom (donor) dan orbital kosong atom lain ( akseptor). Dua mekanisme pembentukan ikatan kovalen: pertukaran dan donor-akseptor.
Ikatan kimia yang dilakukan oleh pasangan elektron bersama disebut kovalen. Pasangan elektron bersama dapat terbentuk melalui dua cara: 1) sebagai hasil penyatuan dua elektron yang tidak berpasangan: 2) sebagai hasil dari penggunaan bersama pasangan elektron bebas dari satu atom (donor) dan orbital kosong atom lain ( akseptor). Dua mekanisme pembentukan ikatan kovalen: pertukaran dan donor-akseptor.
 Cara tumpang tindih orbital atom pada pembentukan ikatan kovalen Jika pembentukan kerapatan ikatan elektron maksimum terjadi sepanjang garis yang menghubungkan pusat atom (inti), maka tumpang tindih tersebut disebut ikatan σ:
Cara tumpang tindih orbital atom pada pembentukan ikatan kovalen Jika pembentukan kerapatan ikatan elektron maksimum terjadi sepanjang garis yang menghubungkan pusat atom (inti), maka tumpang tindih tersebut disebut ikatan σ:
 Cara tumpang tindih orbital atom pada pembentukan ikatan kovalen Jika pembentukan kerapatan ikatan elektron maksimum terjadi pada kedua sisi garis yang menghubungkan pusat atom (inti), maka tumpang tindih tersebut disebut ikatan π:
Cara tumpang tindih orbital atom pada pembentukan ikatan kovalen Jika pembentukan kerapatan ikatan elektron maksimum terjadi pada kedua sisi garis yang menghubungkan pusat atom (inti), maka tumpang tindih tersebut disebut ikatan π:
 Ikatan kovalen polar dan nonpolar 1) Jika ikatan dibentuk oleh atom yang identik, awan ikatan dua elektron terdistribusi dalam ruang secara simetris di antara intinya - ikatan tersebut disebut nonpolar: H 2, Cl 2, N 2. 2) jika ikatan dibentuk oleh atom yang berbeda, awan ikatan bergeser ke sisi atom yang lebih elektronegatif - ikatan seperti itu disebut polar: HCl, NH 3, CO 2.
Ikatan kovalen polar dan nonpolar 1) Jika ikatan dibentuk oleh atom yang identik, awan ikatan dua elektron terdistribusi dalam ruang secara simetris di antara intinya - ikatan tersebut disebut nonpolar: H 2, Cl 2, N 2. 2) jika ikatan dibentuk oleh atom yang berbeda, awan ikatan bergeser ke sisi atom yang lebih elektronegatif - ikatan seperti itu disebut polar: HCl, NH 3, CO 2.
 Ikatan kovalen polar Momen dipol ikatan Dipol H+δCl-δ atau H+0, 18 Cl-0, 18 +δ -δ Dimana ±δ adalah muatan efektif atom, fraksi muatan absolut elektron. Jangan bingung dengan bilangan oksidasi! l Hasil kali muatan efektif dan panjang dipol disebut momen listrik dipol: μ = δl Ini adalah besaran vektor: diarahkan dari muatan positif ke negatif.
Ikatan kovalen polar Momen dipol ikatan Dipol H+δCl-δ atau H+0, 18 Cl-0, 18 +δ -δ Dimana ±δ adalah muatan efektif atom, fraksi muatan absolut elektron. Jangan bingung dengan bilangan oksidasi! l Hasil kali muatan efektif dan panjang dipol disebut momen listrik dipol: μ = δl Ini adalah besaran vektor: diarahkan dari muatan positif ke negatif.
 Ikatan kovalen polar Momen dipol suatu molekul sama dengan jumlah vektor momen dipol ikatan, dengan memperhitungkan pasangan elektron bebas. Satuan momen dipol adalah Debye: 1 D = 3,3· 10 -30 C m.
Ikatan kovalen polar Momen dipol suatu molekul sama dengan jumlah vektor momen dipol ikatan, dengan memperhitungkan pasangan elektron bebas. Satuan momen dipol adalah Debye: 1 D = 3,3· 10 -30 C m.
 Ikatan kovalen polar Momen dipol suatu molekul Pada hasil kali μ = δl, kedua besaran tersebut berlawanan arah. Oleh karena itu, perlu untuk memantau dengan cermat alasan perubahan μ. Misalnya, Cs. F Cs. Cl 24 31 δ “hilang” l Cs. I HF HCl HBr HI 37 5,73 3,24 2,97 1,14 sebaliknya
Ikatan kovalen polar Momen dipol suatu molekul Pada hasil kali μ = δl, kedua besaran tersebut berlawanan arah. Oleh karena itu, perlu untuk memantau dengan cermat alasan perubahan μ. Misalnya, Cs. F Cs. Cl 24 31 δ “hilang” l Cs. I HF HCl HBr HI 37 5,73 3,24 2,97 1,14 sebaliknya
 Ikatan kovalen polar Momen dipol suatu molekul Bisakah suatu molekul menjadi nonpolar jika semua ikatan di dalamnya bersifat polar? Molekul tipe AB selalu polar. Molekul tipe AB 2 dapat bersifat polar dan non-polar. . . H 2 O O N CO 2 μ>0 H O C μ=0 O
Ikatan kovalen polar Momen dipol suatu molekul Bisakah suatu molekul menjadi nonpolar jika semua ikatan di dalamnya bersifat polar? Molekul tipe AB selalu polar. Molekul tipe AB 2 dapat bersifat polar dan non-polar. . . H 2 O O N CO 2 μ>0 H O C μ=0 O
 Ikatan kovalen polar Molekul yang terdiri dari tiga atom atau lebih (AB 2, AB 3, AB 4, AB 5, AB 6) dapat bersifat nonpolar jika simetris. Apa yang dipengaruhi oleh adanya momen dipol suatu molekul? Interaksi antarmolekul terjadi, dan akibatnya, kepadatan zat, titik leleh dan titik didih meningkat.
Ikatan kovalen polar Molekul yang terdiri dari tiga atom atau lebih (AB 2, AB 3, AB 4, AB 5, AB 6) dapat bersifat nonpolar jika simetris. Apa yang dipengaruhi oleh adanya momen dipol suatu molekul? Interaksi antarmolekul terjadi, dan akibatnya, kepadatan zat, titik leleh dan titik didih meningkat.
 Perbandingan ikatan polar ionik dan kovalen Umum: pembentukan pasangan elektron yang sama. Perbedaan: derajat perpindahan pasangan elektron bersama (polarisasi ikatan). Ikatan ionik harus dianggap sebagai kasus ekstrim dari ikatan kovalen polar.
Perbandingan ikatan polar ionik dan kovalen Umum: pembentukan pasangan elektron yang sama. Perbedaan: derajat perpindahan pasangan elektron bersama (polarisasi ikatan). Ikatan ionik harus dianggap sebagai kasus ekstrim dari ikatan kovalen polar.
 Perbandingan ciri-ciri ikatan ionik dan kovalen polar Ikatan kovalen: jenuh dan terarah Saturasi (valensi maksimum) - ditentukan oleh kemampuan atom untuk membentuk sejumlah ikatan (dengan mempertimbangkan kedua mekanisme pembentukan). Arah ikatan ditentukan oleh sudut ikatan, yang bergantung pada jenis hibridisasi orbital atom pusat. Ikatan ionik: tak jenuh dan tidak terarah.
Perbandingan ciri-ciri ikatan ionik dan kovalen polar Ikatan kovalen: jenuh dan terarah Saturasi (valensi maksimum) - ditentukan oleh kemampuan atom untuk membentuk sejumlah ikatan (dengan mempertimbangkan kedua mekanisme pembentukan). Arah ikatan ditentukan oleh sudut ikatan, yang bergantung pada jenis hibridisasi orbital atom pusat. Ikatan ionik: tak jenuh dan tidak terarah.
 Perbandingan ciri-ciri ikatan polar ionik dan kovalen Arah ikatan ditentukan oleh sudut ikatan. Sudut ikatan ditentukan secara eksperimental atau diprediksi berdasarkan teori hibridisasi orbital atom menurut L. Polling atau teori Gillespie. Lebih detail tentang ini di seminar.
Perbandingan ciri-ciri ikatan polar ionik dan kovalen Arah ikatan ditentukan oleh sudut ikatan. Sudut ikatan ditentukan secara eksperimental atau diprediksi berdasarkan teori hibridisasi orbital atom menurut L. Polling atau teori Gillespie. Lebih detail tentang ini di seminar.
 Perbandingan sifat-sifat zat dengan ikatan ionik dan kovalen Ikatan kovalen Kristal atom Antar atom dalam kristal itu sendiri Kekerasan tinggi titik leleh tinggi, titik didih konduktivitas termal dan listrik buruk Kristal molekul Antar atom dalam molekul Kelembutan sedang titik leleh, titik didih cukup rendah konduktivitas termal dan listrik yang buruk Tidak larut dalam air
Perbandingan sifat-sifat zat dengan ikatan ionik dan kovalen Ikatan kovalen Kristal atom Antar atom dalam kristal itu sendiri Kekerasan tinggi titik leleh tinggi, titik didih konduktivitas termal dan listrik buruk Kristal molekul Antar atom dalam molekul Kelembutan sedang titik leleh, titik didih cukup rendah konduktivitas termal dan listrik yang buruk Tidak larut dalam air

 Perbandingan sifat-sifat zat yang mempunyai ikatan ionik dan kovalen Kristal kovalen atom Titik lebur ≈ 3700 °C
Perbandingan sifat-sifat zat yang mempunyai ikatan ionik dan kovalen Kristal kovalen atom Titik lebur ≈ 3700 °C
 Perbandingan sifat-sifat zat dengan ikatan ionik dan kovalen Ikatan ionik antar ion dalam kristal kekerasan dan kerapuhan titik leleh tinggi konduktivitas termal dan listrik buruk Larut dalam air
Perbandingan sifat-sifat zat dengan ikatan ionik dan kovalen Ikatan ionik antar ion dalam kristal kekerasan dan kerapuhan titik leleh tinggi konduktivitas termal dan listrik buruk Larut dalam air

 Ikatan logam dilakukan oleh elektron-elektron milik semua atom secara bersamaan. Kerapatan elektron terdelokalisasi menjadi "gas elektron". Karakteristik kilau logam Plastisitas Kelenturan Konduktivitas termal dan listrik yang tinggi Titik lebur sangat berbeda.
Ikatan logam dilakukan oleh elektron-elektron milik semua atom secara bersamaan. Kerapatan elektron terdelokalisasi menjadi "gas elektron". Karakteristik kilau logam Plastisitas Kelenturan Konduktivitas termal dan listrik yang tinggi Titik lebur sangat berbeda.
 Ikatan antarmolekul. 1. Ikatan hidrogen Tarik-menarik antara atom hidrogen (+) suatu molekul dan atom F, O, N (–) dari molekul lain Polimer (HF)n Dimer asam asetat Ikatan hidrogen lemah secara individual, namun kuat secara kolektif
Ikatan antarmolekul. 1. Ikatan hidrogen Tarik-menarik antara atom hidrogen (+) suatu molekul dan atom F, O, N (–) dari molekul lain Polimer (HF)n Dimer asam asetat Ikatan hidrogen lemah secara individual, namun kuat secara kolektif
 Ikatan antarmolekul. 5. Ikatan Van der Waals Sekalipun tidak ada ikatan hidrogen antar molekul, molekul-molekul tersebut selalu tertarik satu sama lain. Gaya tarik-menarik antar dipol molekul disebut kopling van der Waals. Semakin kuat daya tariknya: 1) polaritas; 2) ukuran molekul. Contoh: metana (CH 4) berbentuk gas, benzena (C 6 H 6) berbentuk cair. v-d-v lemah ikatan - antara molekul H 2 (mp. - 259 o. C, bp. - 253 o. C). Interaksi antar molekul berkali-kali lebih lemah dibandingkan interaksi antar atom: Ekov(Cl–Cl) = 244 kJ/mol, Evdv(Cl2–Cl2) = 25 kJ/mol, namun hal ini justru menjamin keberadaan wujud cair dan padat materi
Ikatan antarmolekul. 5. Ikatan Van der Waals Sekalipun tidak ada ikatan hidrogen antar molekul, molekul-molekul tersebut selalu tertarik satu sama lain. Gaya tarik-menarik antar dipol molekul disebut kopling van der Waals. Semakin kuat daya tariknya: 1) polaritas; 2) ukuran molekul. Contoh: metana (CH 4) berbentuk gas, benzena (C 6 H 6) berbentuk cair. v-d-v lemah ikatan - antara molekul H 2 (mp. - 259 o. C, bp. - 253 o. C). Interaksi antar molekul berkali-kali lebih lemah dibandingkan interaksi antar atom: Ekov(Cl–Cl) = 244 kJ/mol, Evdv(Cl2–Cl2) = 25 kJ/mol, namun hal ini justru menjamin keberadaan wujud cair dan padat materi
 Perkuliahan menggunakan materi dari guru besar Fakultas Kimia Universitas Negeri Moskow. Lomonosov Eremina Vadim Vladimirovich Terima kasih atas perhatian Anda!
Perkuliahan menggunakan materi dari guru besar Fakultas Kimia Universitas Negeri Moskow. Lomonosov Eremina Vadim Vladimirovich Terima kasih atas perhatian Anda!