Sains ke teknologi. Air yang tersebar luas di alam selalu mengandung zat-zat terlarut. DI DALAM air tawar Terdapat sedikit sungai dan danau, sedangkan air laut mengandung sekitar 3,6% garam terlarut.
Di lautan purba (pada saat munculnya kehidupan di Bumi) fraksi massa garam diasumsikan rendah, sekitar 1%.
Dalam larutan inilah organisme hidup pertama kali berkembang, dan dari larutan inilah mereka menerima zat dan molekul yang diperlukan untuk pertumbuhan dan kehidupannya... Seiring waktu, organisme hidup berkembang dan berubah. APA yang memungkinkan mereka meninggalkan lingkungan perairan dan berpindah ke darat lalu naik ke udara. Mereka memperoleh kemampuan ini, dan organisme mereka mempertahankan larutan berair dalam bentuk cairan yang mengandung pasokan ion dan molekul yang diperlukan” - beginilah cara ahli kimia terkenal Amerika, pemenang penghargaan menilai peran larutan dalam kemunculan dan perkembangan kehidupan di Bumi. Penghargaan Nobel Linus Pauling Di dalam diri kita, di setiap sel Anda, terdapat kenangan akan lautan purba tempat kehidupan berasal - larutan air yang menghasilkan kehidupan itu sendiri.
Dalam setiap organisme hidup, larutan ajaib yang menjadi dasar darah mengalir tanpa henti melalui pembuluh - arteri, vena, dan kapiler; fraksi massa garam di dalamnya sama dengan di lautan primer. - 0,0%. Proses fisik dan kimia kompleks yang terjadi pada tubuh manusia dan hewan juga terjadi dalam larutan. Penyerapan makanan berhubungan dengan transfer nutrisi ke dalam larutan. Larutan berair alami berpartisipasi dalam proses pembentukan tanah dan memasok tanaman nutrisi. Banyak proses teknologi dalam industri kimia dan industri lainnya, misalnya produksi soda, pupuk, asam, logam, kertas, terjadi dalam bentuk larutan. Studi tentang sifat-sifat larutan menempati tempat yang sangat penting ilmu pengetahuan modern. Jadi apa solusinya?
Perbedaan antara larutan dan campuran lainnya adalah ini. partikel itu komponen didistribusikan secara merata di dalamnya, dan dalam volume mikro apa pun dari campuran tersebut, komposisinya sama.
Itu sebabnya solusi yang dimaksud campuran homogen yang terdiri dari dua atau lebih bagian homogen. Pengajuan ini berasal dari teori fisika solusi.
Pendukung teori fisika solusi, yang dikembangkan van't Hoff, Lrenius dan Ostwald, percaya bahwa proses pelarutan merupakan hasil difusi, yaitu penetrasi zat terlarut ke dalam ruang antar molekul air.
Berbeda dengan gagasan teori fisika tentang larutan. D. I. Mendeleev dan pendukung teori kimia larutan membuktikan bahwa pembubaran adalah hasil interaksi kimia suatu zat terlarut dengan molekul air. Oleh karena itu, lebih tepat (lebih akurat) untuk mendefinisikan larutan sebagai suatu sistem homogen yang terdiri dari partikel-partikel zat terlarut, pelarut, dan produk interaksinya.
Sebagai hasil interaksi kimia suatu zat terlarut dengan air, terbentuk senyawa hidrat. TENTANG interaksi kimia tanda-tanda reaksi kimia seperti fenomena termal ketika dilarutkan. Misalnya, ingatlah bahwa pelarutan asam sulfat dalam air terjadi dengan pelepasan asam sulfat tersebut jumlah besar panaskan agar larutan mendidih, lalu tuangkan asam ke dalam air (dan bukan sebaliknya). Pelarutan zat lain, seperti natrium klorida dan amonium nitrat, disertai dengan penyerapan panas.
Isi pelajaran catatan pelajaran kerangka pendukung metode percepatan penyajian pelajaran teknologi interaktif Praktik tugas dan latihan lokakarya tes mandiri, pelatihan, kasus, pencarian pekerjaan rumah, pertanyaan diskusi, pertanyaan retoris dari siswa Ilustrasi audio, klip video dan multimedia foto, gambar, grafik, tabel, diagram, humor, anekdot, lelucon, komik, perumpamaan, ucapan, teka-teki silang, kutipan Pengaya abstrak artikel trik untuk boks penasaran buku teks kamus dasar dan tambahan istilah lainnya Menyempurnakan buku teks dan pelajaranmemperbaiki kesalahan dalam buku teks pemutakhiran suatu penggalan dalam buku teks, unsur inovasi dalam pembelajaran, penggantian pengetahuan yang sudah ketinggalan zaman dengan yang baru Hanya untuk guru pelajaran yang sempurna rencana kalender untuk setahun pedoman program diskusi Pelajaran TerintegrasiDalam cairan biasa yang tidak berasosiasi, seperti bensin, molekul-molekulnya saling meluncur bebas. Di dalam air, mereka menggelinding, bukannya meluncur. Molekul air diketahui terhubung satu sama lain melalui ikatan hidrogen, jadi sebelum terjadi perpindahan, setidaknya salah satu dari ikatan ini harus diputus. Fitur ini menentukan viskositas air.
Konstanta dielektrik air adalah kemampuannya untuk menetralkan gaya tarik-menarik yang ada di antara keduanya muatan listrik. Pelarutan padatan dalam air merupakan proses kompleks yang ditentukan oleh interaksi partikel zat terlarut dan partikel air.
Ketika mempelajari struktur zat dengan menggunakan sinar-X, ditemukan bahwa sebagian besar padatan mempunyai struktur kristal, yaitu partikel-partikel suatu zat tersusun dalam ruang dalam urutan tertentu. Partikel-partikel suatu zat terletak seolah-olah berada di sudut-sudut kubus kecil, partikel-partikel lain - di sudut, tengah dan tengah sisi-sisi tetrahedron, prisma, piramida, dll. Masing-masing bentuk ini adalah sel terkecil kristal yang lebih besar dengan bentuk serupa. Beberapa zat mempunyai simpulnya sendiri kisi kristal ada molekul (sebagian besar senyawa organik), untuk yang lain (misalnya, garam anorganik) - ion, yaitu partikel yang terdiri dari satu atau lebih atom bermuatan positif atau negatif. Gaya-gaya yang menahan ion-ion dalam susunan kisi kristal yang berorientasi spasial tertentu adalah gaya tarik-menarik elektrostatis dari ion-ion bermuatan berlawanan yang membentuk kisi kristal.
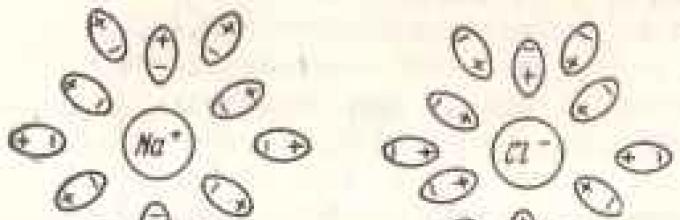
Jika misalnya natrium klorida dilarutkan dalam air, maka ion natrium yang bermuatan positif dan ion klor yang bermuatan negatif akan saling tolak menolak.
Tolakan ini terjadi karena air memiliki konstanta dielektrik yang tinggi, yaitu lebih tinggi dibandingkan cairan lainnya. Ini mengurangi gaya tarik-menarik antara ion-ion yang bermuatan berlawanan sebanyak 100 kali lipat. Alasan kuatnya efek penetralan air harus dicari dalam susunan molekulnya. Atom hidrogen di dalamnya tidak membagi elektronnya secara merata dengan atom oksigen yang mengikatnya. Elektron ini selalu lebih dekat dengan oksigen daripada hidrogen. Oleh karena itu, atom hidrogen bermuatan positif, dan atom oksigen bermuatan negatif.
Ketika suatu zat dilarutkan menjadi ion, atom oksigen tertarik pada ion positif, dan atom hidrogen tertarik pada ion negatif. Molekul air yang mengelilingi ion positif mengirimkan atom oksigennya ke sana, dan molekul yang mengelilingi ion negatif mengirimkan atom hidrogennya ke sana. Jadi, molekul air membentuk semacam kisi yang memisahkan ion satu sama lain dan menetralkan gaya tarik-menariknya (Gbr. 12). Untuk memisahkan ion-ion yang terletak di kisi kristal satu sama lain dan memindahkannya ke dalam larutan, gaya tarik menarik kisi ini perlu diatasi. Ketika garam dilarutkan, gaya ini adalah gaya tarik ion kisi oleh molekul air, yang dicirikan oleh apa yang disebut energi hidrasi. Jika energi hidrasi cukup tinggi dibandingkan dengan energi kisi kristal, maka ion-ion akan melepaskan diri dari kisi kristal dan masuk ke dalam larutan.
Hubungan antara molekul air dan ion-ion yang terpisah dari kisi-kisi dalam larutan tidak hanya tidak melemah, tetapi menjadi semakin erat.
Seperti yang telah disebutkan, dalam suatu larutan, ion-ion dikelilingi dan dipisahkan oleh molekul-molekul air, yang memusatkan perhatian pada ion-ion tersebut dengan bagian-bagian yang berlawanan muatannya, membentuk apa yang disebut cangkang hidrasi (Gbr. 13). Besar kecilnya cangkang ini berbeda-beda tergantung ion yang berbeda dan bergantung pada muatan ion, ukurannya dan, sebagai tambahan, pada konsentrasi ion dalam larutan.
Selama beberapa tahun, ahli kimia fisik mempelajari air terutama sebagai pelarut elektrolit. Akibatnya, banyak informasi yang diperoleh tentang elektrolit, namun sangat sedikit informasi tentang air itu sendiri. Anehnya, tapi hanya di tahun terakhir Ada karya yang ditujukan untuk mempelajari hubungan air dengan zat yang praktis tidak larut di dalamnya.
Banyak fenomena menakjubkan yang diamati. Misalnya, suatu hari sebuah pipa yang mengalirkan gas alam pada suhu t = 19°C ternyata tersumbat oleh salju basah dan air. Menjadi jelas bahwa masalahnya di sini bukanlah suhunya, tetapi sifat-sifat air lainnya. Sejumlah pertanyaan pun muncul: mengapa air membeku pada suhu setinggi itu, bagaimana air bisa bergabung dengan zat yang tidak larut di dalamnya.
Misteri ini belum terpecahkan ketika ditemukan bahwa gas mulia seperti argon dan xenon, yang tidak termasuk dalam komposisi apapun reaksi kimia, dapat berikatan dengan air, membentuk senyawa yang mirip.

Beras. 13. Pemisahan ion Na+ dan C1 - molekul polar air, membentuk cangkang hidrasi di sekelilingnya.
Hasil yang menarik tentang kelarutan metana dalam air diperoleh di Illinois. Molekul metana tidak membentuk ion dalam air dan tidak merasakan ikatan hidrogen; daya tarik antara mereka dan molekul air sangat lemah. Namun, metana masih larut dalam air, meskipun buruk, dan molekul-molekulnya yang terdisosiasi membentuk senyawa dengannya - hidrat, di mana beberapa molekul air terikat pada satu molekul metana. Reaksi ini melepaskan panas 10 kali lebih banyak daripada melarutkan metana dalam heksana (metana lebih larut dalam heksana daripada dalam air).
Fakta bahwa metana larut dalam air sangatlah menarik. Bagaimanapun, molekul metana memiliki volume dua kali lipat lebih banyak molekul air. Agar metana dapat larut dalam air, “lubang” yang cukup besar harus terbentuk di antara molekul-molekulnya. Hal ini memerlukan pengeluaran energi yang signifikan, lebih besar dibandingkan penguapan air (kira-kira 10.000 kalori untuk setiap mol). Dari mana datangnya begitu banyak energi? Gaya tarik menarik antara molekul metana dan air terlalu lemah sehingga tidak dapat menghasilkan energi sebanyak itu. Oleh karena itu, ada kemungkinan lain: struktur perapian berubah dengan adanya metana. Misalkan sebuah molekul metana terlarut dikelilingi oleh cangkang yang terdiri dari 10-20 molekul air. Ketika asosiasi molekul terbentuk, panas dilepaskan. Di ruang yang ditempati oleh molekul metana, gaya tarik-menarik antar molekul air, dan karenanya tekanan internal, menghilang. Dalam kondisi seperti itu, seperti telah kita lihat, air membeku pada suhu di atas nol.
Inilah sebabnya mengapa molekul-molekul di celah antara metana dan air dapat mengkristal, seperti yang terjadi pada kasus yang dijelaskan di atas. Hidrat beku dapat diserap ke dalam larutan dan dilepaskan darinya. Teori ini dikenal dengan teori gunung es. Dalam praktiknya, penelitian menunjukkan bahwa semua zat non-konduktor yang diuji membentuk hidrat kristalin yang stabil. Pada saat yang sama, kecenderungan ini lemah dalam elektrolit. Semua ini mengarah pada pemahaman baru tentang kelarutan.
Dipercayai bahwa pembubaran elektrolit terjadi sebagai akibat dari gaya tarik menarik. Kini telah terbukti bahwa pelarutan zat non-elektrolit terjadi bukan karena gaya tarik-menarik antara zat-zat tersebut dengan air, tetapi karena daya tarik-menarik yang tidak mencukupi di antara keduanya. Zat yang tidak terurai menjadi ion bergabung dengan air, karena menghilangkan tekanan internal dan dengan demikian berkontribusi pada munculnya formasi kristal.
Untuk lebih memahami pembentukan hidrat tersebut, penting untuk mempertimbangkan struktur molekulnya.
Telah terbukti bahwa hidrat yang dihasilkan mempunyai struktur kubik(kisi) berbeda dengan struktur es heksagonal. Pekerjaan selanjutnya para peneliti telah menunjukkan bahwa hidrat dapat memiliki dua kisi kubik: salah satunya memiliki ruang antar molekul 12 A, yang lain - 17 A. Dalam kisi yang lebih kecil terdapat 46 molekul air, yang lebih besar 136. Lubang-lubang molekul gas dalam kisi yang lebih kecil memiliki 12-14 permukaan, dan dalam kisi yang lebih besar - 12-16, terlebih lagi, ukurannya bervariasi dan diisi dengan molekul dengan ukuran berbeda, dan tidak semua lubang dapat terisi. Model ini menjelaskan struktur hidrat sebenarnya dengan tingkat akurasi yang tinggi.
Peran hidrat tersebut dalam proses kehidupan sulit ditaksir terlalu tinggi. Proses-proses ini terjadi terutama di ruang antara molekul air dan protein. Air memiliki kecenderungan kuat untuk mengkristal, karena molekul protein mengandung banyak gugus non-ionik atau non-polar. Bentuk hidrat semacam itu memiliki kepadatan yang lebih rendah daripada es, sehingga pembentukannya dapat menyebabkan ekspansi destruktif yang signifikan.
Jadi, air adalah sejenis menggabungkan dengan spesifik dan bervariasi sifat kimia. Ia memiliki struktur fisik yang ramping dan sekaligus berubah-ubah.
Perkembangan seluruh alam yang hidup dan sebagian besar yang tidak bernyawa terkait erat dengan ciri ciri air.
Margarita Khalisova
Ringkasan pelajaran “Air adalah pelarut. Pemurnian air"
Subjek: Air adalah pelarut. Pemurnian air.
Target: memantapkan pemahaman bahwa zat-zat di dalam air tidak hilang, melainkan larut.
Tugas:
1. Identifikasi zat itu larut di dalam air dan mana yang tidak larut dalam air.
2. Perkenalkan metode pembersihan air – dengan penyaringan.
3. Ciptakan kondisi untuk mengidentifikasi dan menguji berbagai metode pembersihan air.
4. Konsolidasikan pengetahuan tentang aturan perilaku aman saat bekerja dengan berbagai zat.
5. Berkembang berpikir logis dengan memodelkan situasi masalah dan menyelesaikannya.
6. Menumbuhkan ketelitian dan perilaku aman saat bekerja dengan berbagai zat.
7. Kembangkan minat aktivitas kognitif, eksperimen.
Bidang pendidikan:
Perkembangan kognitif
Perkembangan sosial dan komunikatif
Perkembangan fisik
Pekerjaan kosakata:
penyuburan: menyaring, memfilter
pengaktifan: corong
Pekerjaan awal: perbincangan tentang air, perannya dalam kehidupan manusia; melakukan pengamatan terhadap air di dalamnya taman kanak-kanak, Rumah; eksperimen dengan air; melihat ilustrasi tentang topik tersebut « Air» ; menjadi akrab dengan peraturan keselamatan selama penelitian dan eksperimen; menanyakan teka-teki tentang air; membaca fiksi, cerita lingkungan hidup; permainan tentang air.
Demonstrasi dan visual bahan: boneka berjas biru "Tetesan kecil".
selebaran: gelas kosong berisi air; pelarut: gula pasir, garam, tepung terigu, pasir, pewarna makanan, minyak sayur; sendok plastik, corong, serbet kasa, kapas, celemek kain minyak, cangkir teh, lemon, selai, piring sekali pakai, kain minyak untuk meja.
langkah GCD
Pendidik: - Teman-teman, sebelum memulai percakapan denganmu, aku ingin mendoakanmu teka-teki:
Hidup di laut dan sungai
Namun sering kali ia terbang melintasi langit.
Bagaimana dia bisa bosan terbang?
Itu jatuh ke tanah lagi. (air)
Bisakah Anda menebak topik pembicaraannya? Benar sekali, tentang air. Kita sudah mengetahuinya air adalah cairan.
Mari kita ingat properti apa saja air kami membangunnya dengan bantuan eksperimen pada orang lain kelas. Daftar.
Anak-anak:
1.kamu air tidak berbau.
2. Tanpa rasa.
3. Transparan.
4. Tidak berwarna.
5. Air mengambil bentuk wadah tempat ia dituangkan.
6. Memiliki berat.
Pendidik: - Benar. Apakah Anda ingin bereksperimen dengan air lagi? Untuk melakukan ini, kita perlu berubah menjadi ilmuwan sebentar dan melihat ke laboratorium kita percobaan:
Belok kanan, belok kiri,
Temukan diri Anda di laboratorium.
(anak-anak mendekati laboratorium mini).
Pendidik: - Teman-teman, lihat siapa yang mengunjungi kita lagi? Dan apa yang baru di laboratorium?
Anak-anak: - "Tetesan kecil", cucu dari kakek Mengetahui dan kotak yang indah.
Ingin tahu apa yang ada di dalam kotak ini? Tebakan teka-teki:
1. Secara terpisah - saya tidak begitu enak,
Tapi makanan dibutuhkan semua orang (garam)
2. Saya seputih salju
Untuk menghormati semua orang.
Mendapatnya di mulutku -
Di sana dia menghilang. (gula)
3. Mereka membuat kue keju dari saya,
Dan pancake dan pancake.
Jika Anda membuat adonan,
Mereka harus menurunkan saya (tepung)
4. Kuning, bukan matahari,
Hujannya deras, bukan air,
Itu berbusa di wajan,
Percikan dan desis (minyak)
Pewarna makanan - digunakan dalam masakan untuk menghias kue dan mewarnai telur.
Pasir - untuk konstruksi, mainkan di kotak pasir.
Anak-anak memeriksa tabung reaksi yang berisi zat.
Pendidik: - Saya membawa semua zat ini "Tetesan kecil" sehingga kami dapat membantunya memahami apa yang akan terjadi pada air saat berinteraksi dengannya.
Pendidik: - Apa yang kita perlukan untuk memulai pekerjaan kita dengan air?
Anak-anak: - Celemek.
(anak-anak mengenakan celemek kain minyak dan pergi ke meja, di mana ada gelas-gelas air bersih di atas nampan).
Pendidik: - Mari kita ingat aturannya sebelum kita mulai mengerjakannya zat:
Anak-anak:
1. Anda tidak dapat merasakan zatnya - ada kemungkinan keracunan.
2. Anda harus mengendusnya dengan hati-hati, karena zat tersebut bisa sangat pedas dan dapat membakar saluran pernapasan Anda.
Pendidik: - Danil akan menunjukkan cara melakukannya dengan benar (mengarahkan bau dari gelas dengan telapak tangannya).
I. Penelitian Pekerjaan:
Pendidik: - Teman-teman, menurut Anda apa yang akan berubah jika melarutkan zat-zat ini dalam air?
Saya mendengarkan hasil yang diharapkan dari anak-anak sebelum mencampurkan bahan-bahan tersebut dengan air.
Pendidik: - Mari kita periksa.
Saya menyarankan agar anak-anak masing-masing mengambil segelas air.
Pendidik: - Lihat dan tentukan yang mana yang ada air?
Anak-anak: - Airnya jernih, tidak berwarna, tidak berbau, dingin.
Pendidik: - Ambil tabung reaksi yang berisi bahan yang telah dipilih dan larutkan dalam segelas air, aduk dengan sendok.
Kami sedang mempertimbangkan. Saya mendengarkan jawaban anak-anak. Apakah tebakan mereka benar?
Pendidik: - Apa yang terjadi dengan gula dan garam?
Garam dan gula dengan cepat larut dalam air, airnya tetap jernih, tidak berwarna.
Tepung juga larut dalam air, Tetapi air menjadi keruh.
Tapi setelahnya air akan bertahan beberapa saat, tepungnya mengendap di dasar, tapi larutan masih mendung.
Air dengan pasir menjadi kotor, keruh, jika tidak diaduk lagi, pasirnya tenggelam ke dasar gelas, terlihat yaitu tidak larut.
bubuk makanan pelarut cepat berubah warna air, Cara, larut dengan baik.
Minyak tidak larut dalam air: itu juga menyebar di permukaannya sebagai lapisan tipis, atau mengapung di air dalam bentuk tetesan kuning.
Air adalah pelarut! Namun tidak semua zat larut di dalamnya.
Pendidik: - Teman-teman, kami bekerja dengan Anda dan "Tetesan kecil" mengajak kita beristirahat.
(Anak-anak duduk di meja lain dan permainan dimainkan.
Permainan: “Tebak rasa minumannya (teh)».
Minum teh dengan rasa berbeda: gula, selai, lemon.
II Pekerjaan eksperimental.
Kami mendekati tabel 1.
Pendidik: - Teman-teman, apakah mungkin untuk menjernihkan air dari zat-zat yang kita miliki ini larut? Kembalikan ke kondisi transparansi sebelumnya, tanpa sedimen. Bagaimana cara melakukannya?
Saya sarankan Anda mengambil kacamata Anda solusi dan pergi ke tabel 2.
Pendidik: - Anda dapat memfilternya. Untuk ini, Anda memerlukan filter. Filternya bisa dibuat dari apa? Kami akan melakukannya dengan menggunakan serbet kasa dan kapas. Saya tunjukkan (saya memasukkan serbet kasa yang dilipat beberapa lapis dan kapas ke dalam corong dan menaruhnya di gelas kosong).
Membuat filter bersama anak-anak.
Saya tunjukkan cara menyaringnya, kemudian anak-anak sendiri menyaring air dengan bahan pilihannya.
Saya mengingatkan anak-anak untuk tidak terburu-buru, tuangkan dalam aliran kecil larutan ke dalam corong dengan filter. Saya sedang bicara pepatah: “Jika kamu terburu-buru, kamu akan membuat orang tertawa”.
Mari kita lihat apa yang terjadi setelah pemfilteran air dengan zat yang berbeda.
Olinya cepat tersaring karena tidak dilarutkan dalam air, bekas oli terlihat jelas di filter. Hal yang sama terjadi pada pasir. Praktis tidak ada zat yang disaring yang baik dilarutkan dalam air: gula, garam.
Air dengan tepung setelah disaring menjadi lebih transparan. Sebagian besar tepung menempel di saringan, hanya partikel yang sangat kecil yang lolos melalui saringan dan berakhir di gelas air tidak sepenuhnya transparan.
Setelah pewarna disaring, warna filter berubah, tetapi tersaring larutan juga tetap berwarna.
hasil GCD:
1. Zat apa larut dalam air? – gula, garam, pewarna, tepung.
2. Zat manakah yang bukan larut dalam air - pasir, minyak.
3. Dengan metode pembersihan apa air yang kita temui? – penyaringan.
4. Dengan apa? - Saring.
5. Apakah semua orang mengikuti peraturan keselamatan? (salah satu contoh).
6. Yang menarik (baru) apakah kamu mengetahuinya hari ini?
Pendidik: - Hari ini kamu mempelajarinya air adalah pelarut, dicek zat apanya larut dalam air dan bagaimana Anda dapat memurnikan air dari berbagai zat.
"Tetesan kecil" terima kasih atas bantuan Anda dan memberi Anda album untuk membuat sketsa eksperimen Anda. Dengan ini penelitian kami selesai, kami kembali dari laboratorium ke kelompok:
Belok kanan, belok kiri.
Anda akan menemukan diri Anda dalam grup lagi.
literatur:
1. A. I. Ivanova Pengamatan dan eksperimen ekologi di taman kanak-kanak
2. G. P. Tugusheva, A. E. Chistyakova Kegiatan eksperimental anak-anak prasekolah menengah dan atas usia St: Pers Masa Kecil 2010.
3. Kegiatan penelitian kognitif anak prasekolah senior - Anak di TK No.3,4,5 2003.
4. Kegiatan penelitian anak prasekolah - D/v No.7 2001.
5. Percobaan dengan air dan udara - D/V No.6, 2008.
6. Kegiatan eksperimen di TK - Guru pra sekolah Nomor 9 Tahun 2009
7. Permainan - eksperimen anak prasekolah yang lebih muda – Pedagogi prasekolah Nomor 5 tahun 2010
Larutan disebut sistem komposisi variabel homogen (fase tunggal) yang stabil secara termodinamika, terdiri dari dua atau lebih komponen ( zat kimia). Komponen penyusun larutan adalah pelarut dan zat terlarut. Biasanya, pelarut dianggap sebagai komponen yang ada dalam bentuk murninya keadaan agregasi, sebagai larutan yang dihasilkan (misalnya, dalam kasus larutan garam berair, pelarutnya tentu saja adalah air). Jika kedua komponen berada dalam keadaan agregasi yang sama sebelum pelarutan (misalnya alkohol dan air), maka komponen yang jumlahnya lebih banyak dianggap sebagai pelarut.
Larutan berbentuk cair, padat dan gas.
Larutan cair adalah larutan garam, gula, alkohol dalam air. Larutan cair dapat berupa air atau non-air. Larutan berair adalah larutan yang pelarutnya adalah air. Larutan tidak berair adalah larutan yang pelarutnya adalah cairan organik (benzena, alkohol, eter, dll.). Larutan padat adalah paduan logam. Larutan gas - udara dan campuran gas lainnya.
Proses pembubaran. Pembubaran adalah proses fisik dan kimia yang kompleks. Selama proses fisik, struktur zat terlarut dihancurkan dan partikel-partikelnya didistribusikan di antara molekul-molekul pelarut. Proses kimia adalah interaksi molekul pelarut dengan partikel zat terlarut. Akibat interaksi ini, pelarut. Jika pelarutnya adalah air, maka zat pelarut yang dihasilkan disebut hidrat. Proses pembentukan solvat disebut solvasi, proses pembentukan hidrat disebut hidrasi. Saat menguap larutan berair kristal hidrat terbentuk - ini adalah zat kristal, yang mengandung sejumlah molekul air (air kristalisasi). Contoh hidrat kristal: CuSO 4 . 5H 2 O – tembaga (II) sulfat pentahidrat; FeSO4 . 7H 2 O – besi (II) sulfat heptahidrat.
Proses fisik pembubaran terjadi dengan penyerapan energi, kimia - dengan menyoroti. Jika, sebagai akibat dari hidrasi (solvasi), lebih banyak energi yang dilepaskan daripada yang diserap selama penghancuran struktur suatu zat, maka pelarutan adalah eksotermik proses. Energi dilepaskan ketika NaOH, H 2 SO 4, Na 2 CO 3, ZnSO 4 dan zat lainnya dilarutkan. Jika lebih banyak energi yang dibutuhkan untuk menghancurkan struktur suatu zat daripada yang dilepaskan selama hidrasi, maka terjadi pelarutan endotermik proses. Penyerapan energi terjadi ketika NaNO 3, KCl, NH 4 NO 3, K 2 SO 4, NH 4 Cl dan beberapa zat lainnya dilarutkan dalam air.
Banyaknya energi yang dilepaskan atau diserap selama pelarutan disebut efek termal dari pelarutan.
Kelarutan suatu zat adalah kemampuannya untuk terdistribusi pada zat lain dalam bentuk atom, ion atau molekul untuk membentuk sistem komposisi variabel yang stabil secara termodinamika. Ciri kuantitatif kelarutan adalah koefisien kelarutan, yang menunjukkan berapa massa maksimum suatu zat yang dapat larut dalam 1000 atau 100 g air pada suhu tertentu. Kelarutan suatu zat bergantung pada sifat pelarut dan zat, pada suhu dan tekanan (untuk gas). Kelarutan padatan umumnya meningkat dengan meningkatnya suhu. Kelarutan gas menurun dengan meningkatnya suhu, namun meningkat dengan meningkatnya tekanan.
Berdasarkan kelarutannya dalam air, zat dibedakan menjadi tiga kelompok:
1. Larut dengan baik (r.). Kelarutan zat lebih dari 10 g dalam 1000 g air. Misalnya 2000 g gula pasir dilarutkan dalam 1000 g air, atau dalam 1 liter air.
2. Sedikit larut (m.). Kelarutan zat berkisar antara 0,01 g hingga 10 g dalam 1000 g air. Misalnya 2 g gipsum (CaSO 4 . 2 H 2 O) larut dalam 1000 g air.
3. Praktis tidak larut (n.). Kelarutan zat kurang dari 0,01 g dalam 1000 g air. Misalnya, 1,5 dilarutkan dalam 1000 g air . 10 -3 gram AgCl.
Ketika zat dilarutkan, larutan jenuh, tak jenuh, dan lewat jenuh dapat terbentuk.
Solusi jenuh adalah larutan yang mengandung jumlah zat terlarut maksimum pada kondisi tertentu. Ketika suatu zat ditambahkan ke dalam larutan tersebut, zat tersebut tidak lagi larut.
Solusi tak jenuh- larutan yang mengandung lebih sedikit zat terlarut dibandingkan larutan jenuh pada kondisi tertentu. Ketika suatu zat ditambahkan ke dalam larutan tersebut, zat tersebut tetap larut.
Kadang-kadang dimungkinkan untuk memperoleh larutan yang mengandung lebih banyak zat terlarut daripada larutan jenuh pada suhu tertentu. Solusi seperti ini disebut lewat jenuh. Larutan ini dibuat dengan mendinginkan larutan jenuh secara hati-hati hingga suhu kamar. Larutan lewat jenuh sangat tidak stabil. Kristalisasi suatu zat dalam larutan tersebut dapat disebabkan oleh gesekan dengan batang kaca pada dinding bejana tempat larutan berada. Metode ini digunakan ketika melakukan beberapa reaksi kualitatif.
Kelarutan suatu zat juga dapat dinyatakan dengan konsentrasi molar larutan jenuhnya (bagian 2.2).
Kelarutan konstan. Mari kita perhatikan proses yang timbul selama interaksi elektrolit barium sulfat BaSO 4 yang sukar larut tetapi kuat dengan air. Di bawah pengaruh dipol air, ion Ba 2+ dan SO 4 2 - dari kisi kristal BaSO 4 akan masuk ke fase cair. Bersamaan dengan proses ini, di bawah pengaruh medan elektrostatis kisi kristal, sebagian ion Ba 2+ dan SO 4 2 - akan diendapkan kembali (Gbr. 3). Pada suhu tertentu, kesetimbangan akhirnya akan terbentuk dalam sistem heterogen: laju proses pelarutan (V 1) akan sama dengan laju proses pengendapan (V 2), yaitu.
BaSO 4 ⇄ Ba 2+ + SO 4 2 -
solusi padat
Beras. 3. Larutan barium sulfat jenuh
Larutan yang berada dalam kesetimbangan dengan fasa padat BaSO 4 disebut kaya dibandingkan dengan barium sulfat.
Larutan jenuh adalah sistem kesetimbangan heterogen yang bercirikan konstan kesetimbangan kimia:
 , (1)
, (1)
dimana a (Ba 2+) adalah aktivitas ion barium; a(SO 4 2-) – aktivitas ion sulfat;
a (BaSO 4) – aktivitas molekul barium sulfat.
Penyebut pecahan ini - aktivitas kristal BaSO 4 - adalah nilai konstan yang sama dengan satu. Hasil kali dua konstanta menghasilkan konstanta baru yang disebut konstanta kelarutan termodinamika dan menunjukkan K s °:
s° = a(Ba 2+) . sebuah(JADI 4 2-). (2)
Besaran ini sebelumnya disebut hasil kali kelarutan dan disebut PR.
Jadi, dalam larutan jenuh elektrolit kuat yang sedikit larut, produk aktivitas kesetimbangan ion-ionnya adalah nilai konstan pada suhu tertentu.
Jika kita berasumsi bahwa dalam larutan jenuh elektrolit yang sedikit larut, koefisien aktivitasnya F~1, maka aktivitas ion dalam hal ini dapat digantikan oleh konsentrasinya, karena a( X) = F (X) . DENGAN( X). Konstanta kelarutan termodinamika K s ° akan berubah menjadi konstanta kelarutan konsentrasi K s:
K s = C(Ba 2+) . C(JADI 4 2-), (3)
dimana C(Ba 2+) dan C(SO 4 2 -) adalah konsentrasi kesetimbangan ion Ba 2+ dan SO 4 2 - (mol/l) dalam larutan jenuh barium sulfat.
Untuk menyederhanakan perhitungan, biasanya digunakan konstanta kelarutan konsentrasi K s, dengan mengambil F(X) = 1 (Lampiran 2).
Jika elektrolit kuat yang sukar larut membentuk beberapa ion ketika disosiasi, maka ekspresi K s (atau K s °) mencakup pangkat yang sama dengan koefisien stoikiometri:
PbCl 2 ⇄ Pb 2+ + 2 Kl - ; K s = C (Pb 2+) . C 2 (Cl -);
Ag 3 PO 4 ⇄ 3 Ag++ PO 4 3 - ; K s = C 3 (Ag +) . C (PO 4 3 -).
DI DALAM pandangan umum ekspresi konstanta kelarutan konsentrasi untuk elektrolit A m B n ⇄ M Dan + + N B m - memiliki bentuk
K s = m (A n+) . C n (B m -),
di mana C adalah konsentrasi ion A n+ dan B m dalam larutan elektrolit jenuh dalam mol/l.
Nilai K s biasanya hanya digunakan untuk elektrolit yang kelarutannya dalam air tidak melebihi 0,01 mol/l.
Kondisi pembentukan presipitasi
Mari kita asumsikan bahwa c adalah konsentrasi sebenarnya ion-ion elektrolit yang sedikit larut dalam larutan.
Jika C m (A n +) . Dengan n (B m -) > K s, maka akan terjadi pembentukan endapan, karena larutan menjadi lewat jenuh.
Jika C m (A n +) . C n (B m -)< K s , то раствор является ненасыщенным и осадок не образуется.
Sifat-sifat solusi. Di bawah ini kita akan membahas sifat-sifat larutan non-elektrolit. Dalam kasus elektrolit, faktor koreksi isotonik dimasukkan ke dalam rumus yang diberikan.
Jika suatu zat yang tidak mudah menguap dilarutkan dalam suatu cairan, maka tekanan uap jenuhnya di atas larutan lebih kecil daripada tekanan uap jenuhnya di atas pelarut murni. Bersamaan dengan penurunan tekanan uap di atas larutan, terjadi perubahan titik didih dan titik bekunya; Titik didih larutan meningkat, dan titik beku menurun dibandingkan dengan suhu yang menjadi ciri pelarut murni.
Penurunan relatif titik beku atau peningkatan relatif titik didih suatu larutan sebanding dengan konsentrasinya.
Tugas: Tunjukkan pada anak kelarutan dan ketidaklarutan berbagai zat dalam air.
Bahan: tepung terigu, gula pasir, pasir sungai, pewarna makanan, deterjen, gelas berisi air bersih, sendok atau sumpit, nampan, gambar bahan yang disajikan.
Keterangan. Di depan anak-anak di atas nampan terdapat gelas-gelas berisi air, sumpit, sendok dan bahan-bahan dalam berbagai wadah. Anak-anak melihat air dan mengingat sifat-sifatnya. Menurut Anda apa yang akan terjadi jika gula pasir ditambahkan ke dalam air? Kakek Tahu menambahkan gula, mencampur, dan semua orang mengamati bersama apa yang berubah. Apa yang terjadi jika kita menambahkan pasir sungai ke dalam air? Menambahkan pasir sungai ke air dan mencampurnya. Apakah airnya sudah berubah? Apakah cuaca mendung atau tetap cerah? Apakah pasir sungai sudah larut?
Apa jadinya air jika kita menambahkan pewarna makanan ke dalamnya? Menambahkan cat dan campuran. Apa yang berubah? (Airnya berubah warna.) Apakah catnya sudah larut? (Catnya larut dan warna air berubah, air menjadi buram.)
Apakah tepung akan larut dalam air? Anak-anak menambahkan tepung ke dalam air dan aduk. Menjadi apa air itu? Berawan atau cerah? Apakah tepungnya sudah larut dalam air?
Apakah bubuk pencuci akan larut dalam air? Tambahkan bubuk pencuci dan aduk. Apakah bubuknya larut dalam air? Apa yang menurut Anda tidak biasa? Celupkan jari ke dalam adonan dan periksa apakah masih terasa sama seperti air bersih? (Airnya menjadi sabun.) Zat apa saja yang terlarut dalam air kita? Zat apa saja yang tidak larut dalam air?
(Hasilnya dicatat pada kain flanel.)
PASIR BERWARNA
Tugas: mengenalkan anak pada cara pembuatan pasir berwarna (mencampur dengan kapur berwarna); ajari cara menggunakan parutan.
Bahan: krayon warna, pasir, wadah transparan, benda kecil, 2 kantong, parutan kecil, mangkok, sendok (tongkat), toples kecil bertutup.
Keterangan. Gagak kecil, Curiosity, terbang ke arah anak-anak. Dia meminta anak-anak menebak apa yang ada di tasnya. Anak-anak mencoba menentukan dengan sentuhan (di satu tas ada pasir, di tas lain ada potongan kapur.) Guru membuka tas, anak memeriksa tebakannya. Guru dan anak-anak memeriksa isi tas. Apa ini? Pasir jenis apa? Apa yang bisa kamu lakukan dengannya? Apa warna kapurnya? Seperti apa rasanya? Bisakah itu rusak? Untuk apa? Little Gal bertanya: “Bisakah pasir diwarnai? Bagaimana cara membuatnya berwarna? Apa jadinya jika kita mencampurkan pasir dengan kapur? Bagaimana caranya membuat kapur mengalir bebas seperti pasir?” Little Gal membanggakan bahwa dia memiliki alat untuk mengubah kapur menjadi bubuk halus.
Menunjukkan parutan kepada anak-anak. Apa ini? Bagaimana cara menggunakannya? Anak-anak, mengikuti contoh gagak kecil, mengambil mangkuk, parutan, dan menggosok kapur. Apa yang telah terjadi? Apa warna bedakmu? (Kerikil kecil bertanya kepada setiap anak) Bagaimana cara membuat pasir diwarnai sekarang? Anak-anak menuangkan pasir ke dalam mangkuk dan mencampurkannya dengan sendok atau sumpit. Anak-anak melihat pasir berwarna. Bagaimana kita bisa menggunakan pasir ini? (Buatlah gambar yang indah.)
Galchoff kecil menawarkan untuk bermain. Memperlihatkan wadah transparan berisi lapisan pasir beraneka warna dan bertanya kepada anak-anak: “Bagaimana cara cepat menemukan benda tersembunyi?” Anak-anak menawarkan pilihan mereka sendiri. Guru menjelaskan bahwa Anda tidak dapat mencampur pasir dengan tangan, tongkat atau sendok, dan menunjukkan cara mendorong suatu benda keluar dari pasir dengan menggoyangkan bejana.
Apa yang terjadi dengan pasir berwarna-warni? Anak-anak memperhatikan bahwa dengan cara ini kami segera menemukan benda itu dan mencampurkan pasir.
Anak-anak menyembunyikan benda-benda kecil di dalam stoples transparan, menutupinya dengan lapisan pasir warna-warni, menutup stoples dengan penutup dan menunjukkan kepada gadis kecil itu bagaimana mereka dengan cepat menemukan benda tersembunyi dan mencampur pasir. Little Galchon memberi anak-anak sekotak kapur berwarna sebagai hadiah perpisahan.
GAME DENGAN PASIR
Tugas: memantapkan gagasan anak tentang sifat-sifat pasir, mengembangkan rasa ingin tahu dan observasi, mengaktifkan bicara anak, dan mengembangkan keterampilan konstruktif.
Bahan: kotak pasir anak-anak berukuran besar yang di dalamnya terdapat bekas-bekas binatang plastik, mainan binatang, gayung, garu anak, kaleng penyiram, denah area jalan-jalan kelompok ini.
Keterangan. Anak-anak keluar dan menjelajahi area pejalan kaki. Guru mengarahkan perhatian mereka ke jejak kaki yang tidak biasa di kotak pasir. Mengapa jejak kaki terlihat jelas di pasir? Jejak siapa ini? Mengapa menurut Anda demikian?
Anak-anak menemukan binatang plastik dan menguji tebakannya: mereka mengambil mainan, meletakkan cakarnya di atas pasir, dan mencari cetakan yang sama. Jejak apa yang tersisa dari telapak tangan? Anak-anak meninggalkan jejaknya. Telapak tangan siapa yang lebih besar? Siapa yang lebih kecil? Periksa dengan melamar.
Guru menemukan surat di kaki anak beruang dan mengeluarkan denah lokasi darinya. Apa yang ditampilkan? Tempat manakah yang dilingkari merah? (Kotak Pasir.) Apa lagi yang menarik di sana? Mungkin semacam kejutan? Anak-anak, sambil membenamkan tangan ke pasir, mencari mainan. Siapa ini?
Setiap hewan memiliki rumahnya sendiri. Rubah punya... (lubang), beruang punya... (sarang), anjing punya... (kandang). Mari kita membangun rumah pasir untuk setiap hewan. Pasir apa yang terbaik untuk membangun? Bagaimana cara membuatnya basah?
Anak-anak mengambil kaleng penyiram dan menyirami pasir. Kemana perginya air? Mengapa pasir menjadi basah? Anak-anak membangun rumah dan bermain dengan binatang.