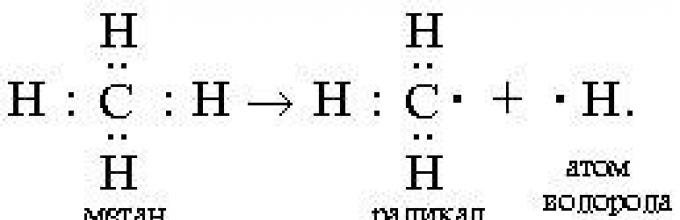CH 3 -CH 3 + Cl 2 – (hv) ---- CH 3 -CH 2 Cl + HCl
C 6 H 5 CH 3 + Cl 2 --- 500 C --- C 6 H 5 CH 2 Cl + HCl
Reaksi penambahan
Reaksi seperti ini khas untuk senyawa organik yang mengandung ikatan rangkap dua atau rangkap tiga. Reaksi jenis ini meliputi reaksi penambahan halogen, hidrogen halida dan air pada alkena dan alkuna
CH 3 -CH=CH 2 + HCl ---- CH 3 -CH(Cl)-CH 3
Reaksi eliminasi
Ini adalah reaksi yang mengarah pada pembentukan ikatan ganda. Ketika hidrogen halida dan air dihilangkan, selektivitas reaksi tertentu diamati, dijelaskan oleh aturan Zaitsev, yang menyatakan bahwa atom hidrogen dihilangkan dari atom karbon yang jumlah atom hidrogennya lebih sedikit. Contoh reaksi
CH3-CH(Cl)-CH 2 -CH 3 + KOH →CH 3 -CH=CH-CH 3 + HCl
Polimerisasi dan polikondensasi
n(CH 2 =CHCl) (-CH 2 -CHCl)n
Redoks
Reaksi oksidatif yang paling intens adalah pembakaran, suatu reaksi yang merupakan karakteristik semua kelas senyawa organik. Dalam hal ini, tergantung pada kondisi pembakaran, karbon dioksidasi menjadi C (jelaga), CO atau CO 2, dan hidrogen diubah menjadi air. Namun, bagi ahli kimia organik, reaksi oksidasi yang dilakukan pada kondisi yang jauh lebih ringan dibandingkan pembakaran merupakan hal yang sangat menarik. Zat pengoksidasi yang digunakan: larutan Br2 dalam air atau Cl2 dalam CCl 4 ; KMnO 4 dalam air atau asam encer; oksida tembaga; perak(I) atau tembaga(II) hidroksida yang baru diendapkan.
3C 2 H 2 + 8KMnO 4 +4H 2 O→3HOOC-COOH + 8MnO 2 + 8KOH
Esterifikasi (dan reaksi hidrolisis kebalikannya)
R 1 COOH + HOR 2 H+ R 1 COOR 2 + H 2 O
Sikloadisi
Y R Y-R
‖ + ‖ → ǀ ǀ
RY RY
‖ + →
11. Klasifikasi reaksi organik berdasarkan mekanismenya. Contoh.
Mekanisme reaksi melibatkan penjelasan rinci langkah demi langkah reaksi kimia. Pada saat yang sama, ditentukan ikatan kovalen mana yang putus, dalam urutan apa dan dengan cara apa. Pembentukan ikatan baru selama proses reaksi juga dijelaskan secara cermat. Saat mempertimbangkan mekanisme reaksi, pertama-tama, perhatikan metode pemutusan ikatan kovalen pada molekul yang bereaksi. Ada dua cara seperti itu - homolitik dan heterolitik.
Reaksi radikal dilanjutkan dengan pembelahan homolitik (radikal) dari ikatan kovalen:

Ikatan kovalen non-polar atau polar rendah (C–C, N–N, C–H) mengalami pembelahan radikal pada suhu tinggi atau di bawah pengaruh cahaya. Karbon dalam radikal CH 3 memiliki 7 elektron terluar (bukan kulit oktet stabil di CH 4). Radikal tidak stabil; mereka cenderung menangkap elektron yang hilang (hingga sepasang atau hingga satu oktet). Salah satu cara untuk membentuk produk stabil adalah dimerisasi (kombinasi dua radikal):
CH 3 + CH 3 CH 3 : CH3,
T + N N : N.
Reaksi radikal - ini misalnya reaksi klorinasi, brominasi dan nitrasi alkana:

Reaksi ionik terjadi dengan pemutusan ikatan heterolitik. Dalam hal ini, ion organik berumur pendek - karbokation dan karbanion - terbentuk secara perantara dengan muatan pada atom karbon. Dalam reaksi ionik, pasangan elektron ikatan tidak dipisahkan, tetapi berpindah seluruhnya ke salah satu atom, mengubahnya menjadi anion:

Ikatan yang sangat polar (H–O, C–O) dan mudah terpolarisasi (C–Br, C–I) rentan terhadap pembelahan heterolitik.
Membedakan reaksi nukleofilik (nukleofil– mencari inti, tempat yang kekurangan elektron) dan reaksi elektrofilik (elektrofil– mencari elektron). Pernyataan bahwa suatu reaksi tertentu bersifat nukleofilik atau elektrofilik selalu mengacu pada reagennya. Reagen– zat yang berpartisipasi dalam reaksi dengan struktur yang lebih sederhana. Substrat– zat awal dengan struktur yang lebih kompleks. Grup keluar adalah ion tergantikan yang telah terikat pada karbon. Produk reaksi– zat baru yang mengandung karbon (ditulis di sebelah kanan persamaan reaksi).
KE pereaksi nukleofilik(nukleofil) meliputi ion bermuatan negatif, senyawa dengan pasangan elektron bebas, senyawa dengan ikatan rangkap karbon-karbon. KE reagen elektrofilik(elektrofil) meliputi ion bermuatan positif, senyawa dengan kulit elektron tidak terisi (AlCl 3, BF 3, FeCl 3), senyawa dengan gugus karbonil, halogen. Elektrofil adalah setiap atom, molekul, atau ion yang mampu menambahkan sepasang elektron dalam proses pembentukan ikatan baru. Kekuatan pendorong reaksi ionik adalah interaksi ion-ion yang bermuatan berlawanan atau fragmen-fragmen molekul yang berbeda dengan muatan parsial (+ dan –).
Contoh berbagai jenis reaksi ionik.
Substitusi nukleofilik :
Substitusi elektrofilik :
Adisi nukleofilik (CN – ditambahkan terlebih dahulu, kemudian H +):

Koneksi elektrofilik (H+ ditambahkan terlebih dahulu, kemudian X –):

Eliminasi melalui aksi nukleofil (basa) :
Eliminasi demi tindakan elektrofil (asam) :
Reaksi zat organik secara formal dapat dibagi menjadi empat jenis utama: substitusi, penambahan, eliminasi (eliminasi) dan penataan ulang (isomerisasi). Jelaslah bahwa seluruh variasi reaksi senyawa organik tidak dapat direduksi menjadi klasifikasi yang diusulkan (misalnya, reaksi pembakaran). Namun klasifikasi seperti itu akan membantu membangun analogi dengan reaksi yang terjadi antara zat anorganik yang sudah Anda kenal.
Biasanya, senyawa organik utama yang terlibat dalam reaksi disebut substrat, dan komponen reaksi lainnya secara konvensional dianggap sebagai reagen.
Reaksi substitusi
Reaksi substitusi- ini adalah reaksi yang mengakibatkan penggantian satu atom atau gugus atom dalam molekul asli (substrat) dengan atom atau gugus atom lain.
Reaksi substitusi melibatkan senyawa jenuh dan aromatik seperti alkana, sikloalkana atau arena. Mari kita beri contoh reaksi tersebut.
Di bawah pengaruh cahaya, atom hidrogen dalam molekul metana dapat digantikan oleh atom halogen, misalnya oleh atom klor:
Contoh lain penggantian hidrogen dengan halogen adalah konversi benzena menjadi bromobenzena:

Persamaan reaksi ini dapat ditulis secara berbeda:
![]()
Dengan bentuk penulisan ini, reagen, katalis, dan kondisi reaksi ditulis di atas tanda panah, dan produk reaksi anorganik ditulis di bawahnya.
Akibat reaksi substitusi zat organik yang terbentuk tidak sederhana dan kompleks zat, seperti dalam kimia anorganik, dan dua zat kompleks.
Reaksi penambahan
Reaksi penambahan- ini adalah reaksi yang mengakibatkan dua atau lebih molekul zat yang bereaksi bergabung menjadi satu.
Senyawa tak jenuh seperti alkena atau alkuna mengalami reaksi adisi. Tergantung pada molekul mana yang bertindak sebagai reagen, hidrogenasi (atau reduksi), halogenasi, hidrohalogenasi, hidrasi, dan reaksi adisi lainnya dibedakan. Masing-masing memerlukan kondisi tertentu.
1.Hidrogenasi- reaksi penambahan molekul hidrogen melalui ikatan rangkap:
2. Hidrohalogenasi- reaksi adisi hidrogen halida (hidroklorinasi):
3. Halogenasi- reaksi penambahan halogen:
![]()
4.Polimerisasi- jenis reaksi adisi khusus di mana molekul suatu zat dengan berat molekul kecil bergabung satu sama lain untuk membentuk molekul suatu zat dengan berat molekul sangat tinggi - makromolekul.
Reaksi polimerisasi adalah proses penggabungan banyak molekul zat dengan berat molekul rendah (monomer) menjadi molekul besar (makromolekul) suatu polimer.
Contoh reaksi polimerisasi adalah produksi polietilen dari etilen (etena) di bawah pengaruh radiasi ultraviolet dan inisiator polimerisasi radikal R.
Ikatan kovalen yang paling khas dari senyawa organik terbentuk ketika orbital atom tumpang tindih dan pembentukan pasangan elektron bersama. Sebagai akibatnya, sebuah orbital yang sama untuk dua atom terbentuk, di mana terdapat pasangan elektron yang sama. Ketika suatu ikatan putus, nasib elektron yang digunakan bersama ini bisa berbeda.
Jenis partikel reaktif
Orbital dengan elektron tidak berpasangan milik satu atom dapat tumpang tindih dengan orbital atom lain yang juga mengandung elektron tidak berpasangan. Dalam hal ini, ikatan kovalen terbentuk melalui mekanisme pertukaran:
Mekanisme pertukaran pembentukan ikatan kovalen terjadi jika pasangan elektron yang sama terbentuk dari elektron yang tidak berpasangan milik atom yang berbeda.
Proses yang berlawanan dengan pembentukan ikatan kovalen melalui mekanisme pertukaran adalah pemutusan ikatan, dimana satu elektron hilang dari setiap atom (). Akibatnya, terbentuk dua partikel tak bermuatan yang memiliki elektron tidak berpasangan:
![]()
Partikel seperti ini disebut radikal bebas.
Radikal bebas- atom atau kelompok atom yang memiliki elektron tidak berpasangan.
Reaksi radikal bebas- ini adalah reaksi yang terjadi di bawah pengaruh dan dengan partisipasi radikal bebas.
Dalam kimia anorganik, ini adalah reaksi hidrogen dengan oksigen, halogen, dan reaksi pembakaran. Reaksi jenis ini ditandai dengan kecepatan tinggi dan pelepasan panas dalam jumlah besar.
Ikatan kovalen juga dapat dibentuk melalui mekanisme donor-akseptor. Salah satu orbital atom (atau anion) yang memiliki pasangan elektron bebas tumpang tindih dengan orbital kosong atom (atau kation) lain yang memiliki orbital kosong, dan terbentuklah ikatan kovalen, misalnya:
![]()
Putusnya ikatan kovalen menyebabkan terbentuknya partikel bermuatan positif dan negatif (); karena dalam hal ini kedua elektron dari pasangan elektron yang sama tetap berada pada salah satu atom, atom lainnya memiliki orbital yang tidak terisi:
![]()
Mari kita perhatikan disosiasi elektrolitik asam:
![]()
Dapat dengan mudah ditebak bahwa partikel yang mempunyai pasangan elektron bebas R: -, yaitu ion bermuatan negatif, akan tertarik ke atom bermuatan positif atau ke atom yang setidaknya terdapat muatan positif parsial atau efektif.
Partikel yang mempunyai pasangan elektron bebas disebut agen nukleofilik (inti- "inti", bagian atom yang bermuatan positif), yaitu "teman" inti, muatan positif.
Nukleofil(Tidak) - anion atau molekul yang memiliki pasangan elektron bebas yang berinteraksi dengan bagian molekul yang mempunyai muatan positif efektif.
Contoh nukleofil : Cl - (ion klorida), OH - (anion hidroksida), CH 3 O - (anion metoksida), CH 3 COO - (anion asetat).
Sebaliknya, partikel yang memiliki orbital tidak terisi akan cenderung mengisinya dan oleh karena itu, akan tertarik ke bagian molekul yang memiliki kerapatan elektron, muatan negatif, dan pasangan elektron bebas yang meningkat. Mereka adalah elektrofil, “teman” elektron, muatan negatif, atau partikel dengan kerapatan elektron yang meningkat.
Elektrofil- kation atau molekul yang memiliki orbital elektron tidak terisi, cenderung mengisinya dengan elektron, karena hal ini menghasilkan konfigurasi elektron atom yang lebih baik.
Tidak ada partikel yang merupakan elektrofil dengan orbital tidak terisi. Misalnya, kation logam alkali mempunyai konfigurasi gas inert dan cenderung tidak memperoleh elektron, karena mempunyai harga yang rendah. afinitas elektron.
Dari sini kita dapat menyimpulkan bahwa meskipun terdapat orbital yang tidak terisi, partikel tersebut tidak akan menjadi elektrofil.
Mekanisme reaksi dasar
Tiga jenis utama partikel yang bereaksi telah diidentifikasi - radikal bebas, elektrofil, nukleofil - dan tiga jenis mekanisme reaksi yang sesuai:
- radikal bebas;
- elektrofilik;
- zeroofilik.
Selain mengklasifikasikan reaksi menurut jenis partikel yang bereaksi, dalam kimia organik dibedakan empat jenis reaksi menurut prinsip perubahan komposisi molekul: adisi, substitusi, pelepasan, atau eliminasi (dari bahasa Inggris. ke menghapuskan- hapus, pisahkan) dan penataan ulang. Karena penambahan dan substitusi dapat terjadi di bawah pengaruh ketiga jenis spesies reaktif, ada beberapa yang dapat dibedakan utamamekanisme reaksi.


Selain itu, kami akan mempertimbangkan reaksi eliminasi yang terjadi di bawah pengaruh partikel nukleofilik - basa.
6. Eliminasi:
Ciri khas alkena (hidrokarbon tak jenuh) adalah kemampuannya untuk mengalami reaksi adisi. Sebagian besar reaksi ini berlangsung melalui mekanisme adisi elektrofilik.
Hidrohalogenasi (penambahan halogen hidrogen):
Ketika hidrogen halida ditambahkan ke alkena hidrogen menambah hidrogen yang lebih terhidrogenasi atom karbon, yaitu atom yang mempunyai atom lebih banyak hidrogen, dan halogen - hingga kurang terhidrogenasi.
>> Kimia: Jenis-jenis reaksi kimia dalam kimia organik
Reaksi zat organik secara formal dapat dibagi menjadi empat jenis utama: substitusi, adisi, eliminasi (eliminasi) dan penataan ulang (isomerisasi). Jelaslah bahwa seluruh variasi reaksi senyawa organik tidak dapat direduksi menjadi kerangka klasifikasi yang diusulkan (misalnya, reaksi pembakaran). Namun klasifikasi semacam itu akan membantu membuat analogi dengan klasifikasi reaksi yang terjadi antara zat anorganik yang sudah Anda kenal dari mata kuliah kimia anorganik.
Biasanya, senyawa organik utama yang terlibat dalam suatu reaksi disebut substrat, dan komponen reaksi lainnya secara konvensional dianggap sebagai reaktan.
Reaksi substitusi
Reaksi yang mengakibatkan penggantian satu atom atau gugus atom pada molekul asal (substrat) dengan atom atau gugus atom lain disebut reaksi substitusi.
Reaksi substitusi melibatkan senyawa jenuh dan aromatik, seperti misalnya alkana, sikloalkana, atau arena.
Mari kita beri contoh reaksi tersebut.
Lembaga pendidikan anggaran kota
"Sekolah Menengah No. 19"
Michurinsk, wilayah Tambov
Jenis reaksi kimia
dalam kimia organik
Golovkina Svetlana Aleksandrovna,
guru kimia Sekolah Menengah MBOU No. 19, Michurinsk
Isi
Abstrak……………………………………………………………………….3
Pendahuluan…………………………………………………………………………………4
Spesifikasi pengujian…………………………………………………...5
Tes kelas 9................................................................................................15
Tes kelas 11…………………………………………………………………………………24
Sumber informasi…………………………………………………..33
Anotasi.
Karya ini mencerminkan pendekatan penulis untuk mempelajari jenis reaksi kimia dalam kimia organik. Materi yang diusulkan mungkin menarik bagi guru kimia yang bekerja di sekolah dasar dan menengah, karena memberikan generalisasi tentang konsep dasar jenis-jenis reaksi kimia dalam kimia organik, yang akan memungkinkan mereka untuk mempersiapkan diri menghadapi Ujian Negara dan Ujian Negara Bersatu. Materi ujian dan latihan tentang topik ini.
Perkenalan.
Materi kimia organik sulit untuk dipahami, terutama di kelas 9 yang waktu pembelajarannya sangat sedikit, dengan jumlah materi teori yang banyak. Soal-soal kimia organik termasuk dalam KIM Akademi Ilmu Pengetahuan Negeri dan Ujian Negara Bersatu, dalam mempersiapkan siswa untuk sertifikasi akhir, guru sering dihadapkan pada kesalahpahaman terhadap materi ini. Anda dapat secara aktif mengintensifkan proses pengajaran dan meningkatkan kualitas asimilasi kimia organik dengan menggunakan teknologi pengajaran modern dalam pembelajarannya, misalnya penggunaan TIK, teknologi pengendalian tes. Dalam manual tersebut, para guru berbagi pengalaman mereka ketika mempelajari materi yang kecil namun kompleks.
Spesifikasi tes untuk persiapan Ujian Negara dan Ujian Negara Bersatu
Meresepkan tes– mengevaluasi pelatihan pendidikan umum siswa berdasarkan jenis reaksi kimia.
Kontinuitas isi materi tes – menunjukkan hubungan antara konsep dasar kimia anorganik dan organik.
Karakteristik konten tes – Setiap versi kontrol tes terdiri dari tiga bagian dan tugas. Tugas-tugas yang tingkat kerumitan dan bentuk penyajiannya sama dikelompokkan dalam bagian-bagian pekerjaan tertentu.
Bagian A berisi 10 tugas memilih jawaban tingkat kerumitan dasar A1, A2.... A10
Bagian B berisi 3 tugas untuk memilih jawaban tingkat kesulitan yang meningkat B1, B2, B3
BagianC berisi 1 tugas tingkat kompleksitas yang tinggi.
Tabel 1 Pembagian tugas menurut bagian pekerjaan.
Soal pilihan ganda Mereka memeriksa bagian utama materi yang dipelajari: bahasa ilmu kimia, ikatan kimia, pengetahuan tentang sifat-sifat zat organik, jenis dan kondisi reaksi kimia.
Tugas dengan tingkat kesulitan yang meningkat Mereka menguji pengetahuan tentang reaksi redoks pada tingkat yang lebih tinggi. Pekerjaan ini menawarkan tugas pilihan ganda.
Menyelesaikan tugas dengan tingkat kerumitan yang meningkat memungkinkan Anda membedakan siswa menurut tingkat persiapannya dan, atas dasar ini, memberi mereka nilai yang lebih tinggi.
Pertanyaan jawaban panjang- yang paling sulit dalam ujian. Tugas-tugas ini menguji asimilasi unsur-unsur isi berikut: jumlah suatu zat, volume molar dan massa molar suatu zat, fraksi massa suatu zat terlarut.
4.Pembagian tugas tes menurut isi, keterampilan dan jenis kegiatan yang diuji.
Saat menentukan isi tugas tes, volume setiap blok konten yang ditempati dalam kursus kimia diperhitungkan.
5. Waktu tunggu
45 menit diberikan untuk menyelesaikan tes (1 pelajaran)
Perkiraan distribusi waktu yang dialokasikan untuk menyelesaikan tugas individu:
untuk setiap tugas bagian A hingga 2 menit.
untuk setiap tugas bagian B hingga 5 menit.
untuk setiap tugas bagian C hingga 10 menit.
6. Sistem evaluasi tugas individu dan pekerjaan secara keseluruhan
Penyelesaian yang benar dari setiap tugas di Bagian A diberi skor 1 poin.
Penyelesaian yang benar dari setiap tugas di Bagian B diberi skor 2 poin;
Kesalahan terjadi pada salah satu elemen jawaban - 1 poin.
Penyelesaian tugas di bagian C bervariasi, penyelesaian tugas C1 dengan benar dan lengkap - 4 poin,
Poin yang diterima siswa untuk menyelesaikan semua tugas dirangkum. Penilaian diberikan pada skala lima poin.
7. Gradasi penilaian:
0% - 25% - dari poin yang dicetak “1”
26% - 50% - dari “2” poin yang dicetak
51% - 75% - dari poin yang dicetak “3”
76% - 85% - dari poin yang dicetak “4”
86% - 100% - dari poin yang dicetak “5”
Jenis reaksi kimia dalam kimia organik
Reaksi kimia - ini adalah perubahan zat di mana ikatan kimia lama terputus dan ikatan kimia baru terbentuk antara partikel (atom, ion) dari mana zat tersebut dibangun.
Reaksi kimia diklasifikasikan:
1. Berdasarkan jumlah dan komposisi reagen dan produk
Jenis reaksi ini dapat mencakup reaksi isomerisasi, yang terjadi tanpa mengubah tidak hanya komposisi kualitatif, tetapi juga kuantitatif dari molekul zat.![]()
Reaksi penguraian dalam kimia organik, berbeda dengan reaksi penguraian dalam kimia anorganik, memiliki kekhasan tersendiri. Proses ini dapat dianggap sebagai proses kebalikan dari penjumlahan, karena proses ini paling sering menghasilkan pembentukan banyak ikatan atau siklus.
CH3-CH2-C=-CH CH3-C=-C-CH3
etil asetilena dimetil asetilena



Untuk dapat masuk ke dalam reaksi adisi, suatu molekul organik harus mempunyai ikatan rangkap (atau siklus), molekul ini akan menjadi yang utama (substrat). Molekul yang lebih sederhana (seringkali merupakan zat anorganik, reagen) ditambahkan di tempat di mana ikatan rangkap diputus atau cincin terbuka. Paling sering, banyak ikatan atau siklus terbentuk.![]()



![]()
Ciri khasnya adalah interaksi zat sederhana dengan zat kompleks. Konsep “substitusi” dalam kimia organik lebih luas dibandingkan dengan kimia anorganik. Jika dalam molekul zat asal ada atom atau gugus fungsi yang digantikan oleh atom atau gugus lain, ini juga merupakan reaksi substitusi.

Reaksi pertukaran adalah reaksi yang terjadi antara zat-zat kompleks yang mana bagian-bagian penyusunnya bertukar tempat. Biasanya reaksi ini dianggap ionik. Reaksi antar ion dalam larutan elektrolit berlangsung hampir seluruhnya menuju pembentukan gas, pengendapan, dan elektrolit lemah.![]()

2. Berdasarkan efek termal
Reaksi eksotermik terjadi dengan pelepasan energi.
Ini mencakup hampir semua reaksi senyawa.
Reaksi eksotermik yang terjadi dengan pelepasan cahaya tergolong reaksi pembakaran. Hidrogenasi etilen adalah contoh reaksi eksotermik. Ini berjalan pada suhu kamar.
Reaksi endotermik terjadi dengan penyerapan energi.
Jelasnya, ini akan mencakup hampir semua reaksi dekomposisi,
CH 2 =CH 2 + H 2 → CH 3 -CH 3

3. Menurut penggunaan katalis
Mereka berjalan tanpa katalis.
Karena semua reaksi biokimia yang terjadi dalam sel organisme hidup terjadi dengan partisipasi katalis biologis khusus yang bersifat protein - enzim, semuanya bersifat katalitik atau, lebih tepatnya, enzimatik.


4. Berdasarkan arah
Mereka mengalir secara bersamaan dalam dua arah yang berlawanan.
Sebagian besar reaksi seperti itu adalah.
Dalam kimia organik, tanda reversibilitas tercermin dari nama – antonim proses:
hidrogenasi - dehidrogenasi,
hidrasi - dehidrasi,
polimerisasi - depolimerisasi.
Semua reaksi bersifat reversibel esterifikasi (proses sebaliknya, seperti yang Anda tahu, disebut hidrolisis) dan hidrolisis protein, ester, karbohidrat, polinukleotida. Reversibilitas proses ini mendasari sifat terpenting organisme hidup - metabolisme.
Dalam kondisi ini alirannya hanya dalam satu arah.
Ini mencakup semua reaksi pertukaran yang disertai dengan pembentukan endapan, gas atau zat yang sedikit terdisosiasi (air) dan semua reaksi pembakaran.
5. Menurut keadaan agregasi
Reaksi di mana reaktan dan produk reaksi berada dalam keadaan agregasi yang berbeda (dalam fase yang berbeda).
Reaksi yang reaktan dan produk reaksinya berada pada keadaan agregasi yang sama (dalam fasa yang sama).


6. Dengan mengubah bilangan oksidasi unsur kimia pembentuk zat
Reaksi yang terjadi tanpa mengubah bilangan oksidasi unsur kimia. Ini termasuk, misalnya, semua reaksi pertukaran ion, serta banyak reaksi penggabungan, banyak reaksi dekomposisi, reaksi esterifikasi.
Reaksi yang terjadi dengan perubahan bilangan oksidasi unsur. Ini mencakup banyak reaksi, termasuk semua reaksi substitusi, serta reaksi kombinasi dan dekomposisi yang melibatkan setidaknya satu zat sederhana.
HCOOH + CH 3 OH → HCOOCH3 + H2O

7. Menurut mekanisme alirannya.
Mereka berada di antara radikal dan molekul yang terbentuk selama reaksi.
Seperti yang telah Anda ketahui, dalam semua reaksi, ikatan kimia lama diputus dan ikatan kimia baru terbentuk. Cara pemutusan ikatan pada molekul zat awal menentukan mekanisme (jalur) reaksi. Jika suatu zat dibentuk oleh ikatan kovalen, maka ada dua cara untuk memutuskan ikatan ini: hemolitik dan heterolitik. Misalnya, untuk molekul Cl2, CH4, dll., terjadi pemutusan ikatan hemolitik, hal ini akan mengarah pada pembentukan partikel dengan elektron tidak berpasangan, yaitu radikal bebas.
Mereka berada di antara ion-ion yang sudah ada atau terbentuk selama reaksi.
Reaksi ionik yang khas adalah interaksi antara elektrolit dalam larutan. Ion terbentuk tidak hanya selama disosiasi elektrolit dalam larutan, tetapi juga di bawah pengaruh pelepasan listrik, pemanasan atau radiasi. Ŷ-Sinar, misalnya, mengubah molekul air dan metana menjadi ion molekul.
Menurut mekanisme ionik lainnya, terjadi reaksi penambahan hidrogen halida, hidrogen, halogen ke alkena, oksidasi dan dehidrasi alkohol, penggantian alkohol hidroksil dengan halogen; reaksi yang mencirikan sifat aldehida dan asam. Dalam hal ini, ion dibentuk oleh pembelahan heterolitik ikatan kovalen polar.

8. Berdasarkan jenis energi yang memulai reaksi.




Mereka diprakarsai oleh radiasi energi tinggi - sinar-X, radiasi nuklir (sinar Ý, partikel a - He2+, dll.). Dengan bantuan reaksi radiasi, radiopolimerisasi yang sangat cepat, radiolisis (dekomposisi radiasi), dll dilakukan.
Misalnya, alih-alih memproduksi fenol dari benzena dalam dua tahap, fenol dapat diperoleh dengan mereaksikan benzena dengan air di bawah pengaruh radiasi. Dalam hal ini, radikal [·OH] dan [·H·] terbentuk dari molekul air, yang bereaksi dengan benzena membentuk fenol:
C6H6 + 2[OH] -> C6H5OH + H20
Vulkanisasi karet dapat dilakukan tanpa belerang dengan menggunakan radiovulkanisasi, dan karet yang dihasilkan tidak lebih buruk dari karet tradisional.
Mereka diprakarsai oleh energi panas. Ini mencakup semua reaksi endotermik dan banyak reaksi eksotermik, yang permulaannya memerlukan pasokan panas awal, yaitu permulaan proses.
Mereka diprakarsai oleh energi cahaya. Selain proses fotokimia sintesis HCl atau reaksi metana dengan klor yang dibahas di atas, proses ini juga mencakup produksi ozon di troposfer sebagai polutan atmosfer sekunder.
Proses terpenting yang terjadi pada sel tumbuhan, fotosintesis, juga termasuk dalam jenis reaksi ini.Mereka diprakarsai oleh arus listrik. Selain reaksi elektrolisis yang terkenal, kami juga akan menunjukkan reaksi elektrosintesis, misalnya reaksi produksi industri zat pengoksidasi anorganik.
Tugas tes untuk kelas 9
Pilihan 1.
Bagian A
A1. Model apa yang sesuai dengan molekul alkena?

a) semuanya kecuali A
b) semuanya kecuali B
c) semuanya kecuali B
d) semuanya kecuali G
A2. Dengan pereaksi apa alkana dapat bereaksi:
a) Br 2 (larutan)
b) Cl 2 (ringan)
c) H 2 JADI 4
d) NaOH
A3. Pada reaksi 1,3-butadiena dengan HCl tidak dapat terbentuk
a) 3-klorobutena-1 c) 1-klorobutena-2
b) 4-klorobutena-1 d) 2,3-diklorobutana
A4. Zat yang asam formatnya, dalam kondisi tertentu, dapat bereaksi redoks adalah:
a) tembaga;
b) tembaga (II) hidroksida;
c) tembaga (II) klorida;
d) tembaga (II) sulfat.
A5. Interaksi ester dengan air dapat disebut :
a) hidrasi;
b) dehidrasi;
c) hidrolisis;
d) hidrogenasi.
A6. Dalam rantai transformasi
reaksi “a” dan “b” masing-masing adalah:
a) hidrasi dan oksidasi;
b) oksidasi dan hidrasi;
c) hidrasi dan hidrasi;
d) oksidasi dan oksidasi.
A7. Reaksi yang disebabkan oleh adanya ikatan rangkap pada molekul senyawa karbonil adalah reaksi:
a) aksesi;
b) dekomposisi;
c) substitusi;
d) pertukaran.
A8. Dengan menggunakan larutan amonia oksida perak, tidak mungkin untuk mengenali:
a) etanol dan etanal;
b) propanal dan propanon;
c) propanal dan gliserin;
d) butanal dan 2-metilpropanal.
A9. Ketika propenal terkena kelebihan hidrogen, ia terbentuk SAYA:
a) membatasi alkohol;
b) alkohol tak jenuh;
c) hidrokarbon tak jenuh;
d) hidrokarbon jenuh.
A10. Asetaldehida terbentuk selama hidrasi:
a) etana;
b) etena;
c) etina;
d) etanol.
Bagian B
DALAM 1. Cocokkan jenis reaksi dengan persamaannya
JENIS REAKSI
PADA 2. Asetilena seberat 10,4 g ditambahkan hidrogen klorida seberat 14,6 g Rumus produk reaksinya adalah _____.
DI 3. Dari kalsium karbida teknis seberat 1 kg, diperoleh asetilena dengan volume 260 l (n.s.). Fraksi massa pengotor (dalam %) yang terkandung dalam sampel kalsium karbida adalah ____ _____. (Tuliskan jawabanmu ke perseratusan terdekat).
Bagian C.
C 1. Tuliskan persamaan reaksi yang dapat digunakan untuk melakukan persamaan berikut
BaCl2
transformasi: C O
Pilihan 2.
Bagian A Untuk setiap tugas A1-A10 diberikan empat pilihan jawaban,
hanya satu yang benar. Lingkari nomor jawaban.
A1.Karakteristik reaksi alkana
a) aksesi
b) substitusi
c) hidrasi
d) pertukaran
A2. Hidrokarbon apa yang dicirikan oleh reaksi polimerisasi?
a) CH
4b)C 2 jam 4
c)C 6 jam 6
d)C 2 jam 5 oh
A3. Suatu zat yang metana mengalami reaksi perpindahan.
a) sel 2 (ringan)
b) H 2 HAI
c) H 2 JADI 4
d) NaOH
A4. Zat mana yang mudah teroksidasi oleh kalium permanganat.
a)C 2 jam 6
b)C 2 jam 2
c)C 2 jam 5 oh
d)C 6 jam 6
A5. Zat apa yang dapat mengalami reaksi dehidrasi.
a)C 2 jam 4
b)C 2 jam 5 oh
c) CH 4
d) C H 3 COH
A6. Dalam rantai transformasi C 2 H 6 – asetilena – reaksi etana “a” dan “b” - ini sesuai
a) hidrasi dan hidrogenasi
b) hidrasi dan oksidasi
c) dehidrogenasi dan hidrogenasi
d) oksidasi dan hidrasi
A7. Apa nama reaksi yang menghasilkan ester?
a) aksesi
b) substitusi
c) esterifikasi
d) dekomposisi
A8. Ketika etilen bereaksi dengan air, ia terbentuk.
a) membatasi alkohol
b) alkohol tak jenuh
c) hidrokarbon jenuh
d) hidrokarbon tak jenuh
A9. Asam asetat terbentuk dari:
a) etana
b) etena
c) etina
d) etanol
A10. Reaksi apa yang khas pada lemak?
a) aksesi
b) oksidasi
c) hidrolisis
d) substitusi
Bagian BSaat menyelesaikan tugas B1, lakukan korespondensi. Q2 dan Q3, buatlah perhitungan dan tuliskan jawabannya.
DALAM 1. Cocokkan jenis reaksi dengan zatnya
Jenis reaksi
PADA 2. Volume oksigen yang diperlukan untuk pembakaran sempurna adalah 50 liter. metana (n.s.) sama dengan ___l.
DI 3. Hidrokarbon mengandung 16,28% hidrogen. Tentukan rumus hidrokarbon jika massa jenis uap hidrogennya adalah 43.
Bagian C. Untuk jawaban tugas C1, gunakan formulir (lembar) tersendiri
Tuliskan nomor tugas dan jawabannya.
C1. Hitung volume karbon dioksida yang dilepaskan selama pembakaran 56 liter metana menjadi 48 liter oksigen
JAWABAN
Pilihan 1
Bagian A
Bagian B
Bagian C
Tuliskan persamaan reaksi yang dapat digunakan untuk melakukan persamaan berikut BaCl 2
transformasi: C O 2 → Na 2 CO 3 → X → CO 2. Untuk proses kedua, tulis persamaan ionik untuk reaksi tersebut.
Menjawab
pilihan 2
Bagian A
A1
Bagian B
Bagian C
Tugas tes untuk kelas 11
Pilihan 1.
Bagian A Untuk setiap tugas A1-A10 diberikan empat pilihan jawaban,
hanya satu yang benar. Lingkari nomor jawaban.
A1. Reaksi Wurtz sesuai dengan deskripsi:
1. hidrasi asetilena
2. pemanjangan kerangka karbon
3. reduksi turunan nitro dengan logam dalam lingkungan asam
4. dehidrasi dan dehidrogenasi etanol secara simultan
A2. Glukosa dan sukrosa dapat dibedakan berdasarkan:
1. asam nitrat
2. larutan amonia oksida perak
3. air
4. natrium hidroksida.
A3. Etanol dapat diproduksi dari etilen melalui reaksi
1. hidrasi
2. hidrogenasi
3.Halogenasi
4. Hidrohalogenasi
A4. Reaksi dengan larutan amonia oksida perak merupakan ciri khasnya
1. propanol-1
2. propana
3. propanol-2
4. dimetil eter
A5. Hidrolisis basa menghasilkan etil format
1. formaldehida dan etanol
2. asam format dan etanol
3. garam asam format dan etanol
4. formaldehida dan asam format
A6. Ciri khas reaksi Kucherov adalah interaksi zat dengan
1. dengan hidrogen
2. dengan klorin
3. dengan air
4. dengan asam
A7. Reaksi Zinin, ciri hidrokarbon aromatik, memiliki nama lain
1. klorinasi
2. brominasi
3. nitrasi
4. hidrogenasi
A8. Reaksi kualitatif terhadap alkohol polihidrat adalah interaksinya
1. dengan oksida tembaga ( II)
2. dengan tembaga hidroksida ( II)
3. dengan tembaga
4. dengan oksida tembaga ( SAYA)
A9. Selama reaksi etanol dengan asam klorida dengan adanya asam sulfat,
1. etilen
2. kloroetana
3. 1,2-dikloroetana
4. vinil klorida
A10. Berbeda dengan etanal, asam asetat bereaksi dengan
1. magnesium
2. tembaga hidroksida ( II)
3. oksigen
4. hidrogen
Bagian B
tuliskan dalam urutan menaik
DALAM 1. Produk hidrolisis ester komposisi C 5 H 10 O 2 dapat berupa
1. pentanal dan metanol
2. asam propanoat dan etanol
3. etanol dan butanal
4. asam butanoat dan metanol
5. asam etanoat dan propanol
6. formaldehida dan pentanol
PADA 2. Bereaksi dengan asam format
1. Tidak 2 BERSAMA 3
2.HCl
3.OH
4.H 2 S
5. CuSO 4
6. Cu(OH)2
DI 3. Zat yang dapat berinteraksi dengan asam α-aminopropanoat
1. etana
2. kalium hidroksida
3. kalium klorida
4. asam sulfat
5. dimetil eter
6. hidrogen klorida
Bagian C. Untuk jawaban tugas C1, gunakan formulir (lembar) tersendiri
Tuliskan nomor tugas dan jawabannya.
C1. Hasil oksidasi katalitik propana diperoleh asam propionat seberat 55,5 g, fraksi massa hasil produk reaksi adalah 60%. Hitung volume propana yang diambil (no.).
pilihan 2
Bagian A Untuk setiap tugas A1-A10 diberikan empat pilihan jawaban,
hanya satu yang benar. Lingkari nomor jawaban.
A1. Masing-masing dari dua zat bereaksi dengan air brom dalam kondisi normal:
1. benzena dan toluena
2. sikloheksana dan propena
3. etilen dan benzena
4. fenol dan asetilena
A2. Etilen terbentuk sebagai hasil reaksi:
1. hidrasi asetilena
2. klorometana dengan natrium
3. asetilena dengan hidrogen klorida
4. dehidrasi etanol
A3. Etanol dapat diproduksi dari etilen melalui reaksi
1. hidrasi
2. hidrogenasi
3. halogenasi
4. hidrohalogenasi
A4. Sebagai hasil dari reaksi trimerisasi asetilena, terbentuklah zat-zat berikut:
1. heksana
2. heksena
3. etana
4. benzena
A5. Selama oksidasi etilen dengan larutan CM berair TIDAK 4 terbentuk:
1. etana
2. etanol
3. gliserin
4. etilen glikol
A6. Hidrolisis basa 2-klorobutana sebagian besar menghasilkan:
1. butanol-2
2. butanol-1
3. butanal
4. butanon
A7. Reaksi substitusi dengan klorin melibatkan:
1. etena 2. etin 3 . butena-2 4. butana
A8. Reaksi khas alkohol polihidrat adalah interaksi dengan:
1. jam 2
2. Cu
3. Ag 2 O (larutan NH 3)
4. Cu(OH)2
A9. Monomer untuk produksi karet buatan dengan metode Lebedev adalah:
1. butena-2
2. etana
3. etilen
4. butadiena-1,3
A10. Butanol-2 dan kalium klorida terbentuk melalui interaksi:
1. 1-klorobutana dan 2-klorobutana
2. 2-klorobutana dan larutan alkohol KOH
3. larutan 1-klorobutana dan alkohol KOH
4. 2-klorobutana dan larutan KOH berair
Bagian B Saat menyelesaikan tugas B1-B3, pilih tiga pilihan jawaban dan
tuliskan dalam urutan menaik
DALAM 1. Produk hidrolisis ester dengan komposisi C 6 H 12 O 2 dapat berupa
1 . etanal dan dimetil eter
2 . asam propanoat dan propanol
3 . metil asetat dan butana
4 . asam etanoat dan butanol
5. asam pentanoat dan metanol
6. propanal dan etanediol
PADA 2. Alkena berinteraksi dengan:
1 . [ Agustus(NH 3) 2 ]OH
2 . H2O
3 . Br 2
4 . KMnO4(H+)
5 . Ca(OH)2
6 . Cu(OH)2
DI 3. Metiletilamina berinteraksi dengan:
1 . etana
2 . potasium hidroksida
3. asam hidrobromat
4 . oksigen
5 . propana
6 . air
Bagian C. Untuk jawaban tugas C1, gunakan formulir (lembar) tersendiri
Tuliskan nomor tugas dan jawabannya.
C1. Gas amonia dilepaskan ketika 160 g larutan 7% kalium hidroksida direbus dengan 9,0 g. Amonium klorida, dilarutkan dalam 75 g air. Tentukan fraksi massa amonia dalam larutan yang dihasilkan.
JAWABAN
Pilihan 1
Bagian A
A1
Bagian B
DALAM 1
Bagian C
Isi jawaban yang benar dan petunjuk penilaian (perkataan lain pada jawaban diperbolehkan yang tidak menyimpangkan maknanya)
Elemen respons:
1. Persamaan reaksi telah disusun
3C 2 H 2  dari 6 jam 6
dari 6 jam 6
2. Jumlah asetilena dan benzena ditentukan
N(C 2 H 2) = 10,08/22,4 = 0,45 mol
sesuai dengan persamaan reaksi N(C 2 H 2) : n(C 6 H 6) =3:1
N(C 6 H 6) = 0,45/3 = 0,15 mol
3. Massa teoritis benzena dihitung
M(C 6 H 6) = 0,15 mol * 78 g/mol = 11,7 g
4. Massa praktis benzena dihitung
M(C 6 H 6) pr = 0,7 * 11,7 = 8,19 gram
pilihan 2
Bagian A
Bagian B
Bagian C
C 1 1. Gas amonia dilepaskan ketika 160 g larutan kalium hidroksida 7% direbus dengan 9,0 g. Amonium klorida, dilarutkan dalam 75 g air. Tentukan fraksi massa amonia dalam larutan yang dihasilkan.
Isi jawaban yang benar dan petunjuk penilaian Elemen respons:- Persamaan reaksinya dibuat:
- Massa dan jumlah zat alkali dalam larutan, serta jumlah zat amonium klorida, dihitung:
- Zat yang berlebih dalam larutan dinyatakan :
- Massa amonia dan fraksi massanya dalam larutan ditentukan
*Catatan. Apabila jawaban mengandung kesalahan perhitungan pada salah satu unsur jawaban sehingga mengakibatkan jawaban salah, maka skor penyelesaian tugas dikurangi hanya 1 poin.
Sumber daya informasi.
Artemenko A.I. Dunia kimia organik yang menakjubkan. – M.: Bustard, 2004.
Gabrielyan O.S., Ostroumov I.G. Buku pegangan guru. Kimia. kelas 10. – M.: Bustard, 2004.
Koroshchenko A.S., Medvedev Yu.N. Tugas tes kimia standar GIA - M.: “Ujian”, 2009.
Kuznetsova N.E., Levkina A.N., Buku soal kimia, kelas 9. – M.: Pusat Penerbitan “Ventana – Graf”, 2004.
Kuznetsova N.E., Titova I.M., Gara N.N., Zhegin A.Yu. Kimia. - kelas 9. – M.: Pusat Penerbitan “Ventana – Graf”, 2002.
Potapov V.M. Kimia organik. – M.: Pendidikan, 1976.
Kamus ensiklopedis seorang ahli kimia muda. – M.: Pedagogi – Pers, 1997.
Pichugina G.V. Kimia dan kehidupan manusia sehari-hari. – M.: Bustard, 2005.
http://www.fipi.ru/
Reaksi zat organik secara formal dapat dibagi menjadi empat jenis utama: substitusi, adisi, eliminasi (eliminasi) dan penataan ulang (isomerisasi). Jelaslah bahwa seluruh variasi reaksi senyawa organik tidak dapat direduksi menjadi kerangka klasifikasi yang diusulkan (misalnya, reaksi pembakaran). Namun klasifikasi semacam itu akan membantu membuat analogi dengan klasifikasi reaksi yang terjadi antara zat anorganik yang sudah Anda kenal dari mata kuliah kimia anorganik.
Biasanya, senyawa organik utama yang terlibat dalam suatu reaksi disebut substrat, dan komponen reaksi lainnya secara konvensional dianggap sebagai reaktan.
Reaksi substitusi
Reaksi yang mengakibatkan penggantian satu atom atau gugus atom pada molekul asal (substrat) dengan atom atau gugus atom lain disebut reaksi substitusi.
Reaksi substitusi melibatkan senyawa jenuh dan aromatik, seperti misalnya alkana, sikloalkana, atau arena.
Mari kita beri contoh reaksi tersebut.
Di bawah pengaruh cahaya, atom hidrogen dalam molekul metana dapat digantikan oleh atom halogen, misalnya atom klor:
CH4 + Cl2→ CH3Cl + HCl
Contoh lain penggantian hidrogen dengan halogen adalah konversi benzena menjadi bromobenzena:
Dengan bentuk penulisan ini, reagen, katalis, dan kondisi reaksi ditulis di atas tanda panah, dan produk reaksi anorganik ditulis di bawahnya.
Reaksi penambahan
Reaksi yang menggabungkan dua atau lebih molekul zat yang bereaksi menjadi satu disebut reaksi adisi.
Senyawa tak jenuh, seperti alkena atau alkuna, mengalami reaksi adisi. Tergantung pada molekul mana yang bertindak sebagai reagen, hidrogenasi (atau reduksi), halogenasi, hidrohalogenasi, hidrasi, dan reaksi adisi lainnya dibedakan. Masing-masing memerlukan kondisi tertentu.
1
. Hidrogenasi - reaksi penambahan molekul hidrogen melalui ikatan rangkap:CH3-CH = CH2 + H2 → CH3-CH2-CH3
propana propana
2
. Hidrohalogenasi - reaksi adisi hidrogen halida (misalnya hidroklorinasi):CH2=CH2 + HCl → CH3-CH2-Cl
etena kloroetana
3
. Halogenasi - reaksi penambahan halogen (misalnya klorinasi):CH2=CH2 + Cl2 → CH2Cl-CH2Cl
etena 1,2-dikloroetana
4
. Polimerisasi - jenis reaksi adisi khusus di mana molekul suatu zat dengan berat molekul kecil bergabung satu sama lain untuk membentuk molekul suatu zat dengan berat molekul sangat tinggi - makromolekul.Reaksi polimerisasi
- ini adalah proses penggabungan banyak molekul zat bermolekul rendah (monomer) menjadi molekul besar (makromolekul) suatu polimer.Contoh reaksi polimerisasi adalah produksi polietilen dari etilen (etena) di bawah pengaruh radiasi ultraviolet dan inisiator polimerisasi radikal R.
Jenis reaksi kimia dalam kimia organik
Reaksi eliminasi
Reaksi yang mengakibatkan terbentuknya molekul beberapa zat baru dari suatu molekul senyawa asal disebut reaksi eliminasi atau eliminasi.
Contoh reaksi tersebut meliputi produksi etilen dari berbagai zat organik.

Jenis reaksi kimia dalam kimia organik
Yang paling penting di antara reaksi eliminasi adalah reaksi pemisahan termal hidrokarbon, yang menjadi dasar perengkahan alkana - proses teknologi yang paling penting:

Dalam kebanyakan kasus, pembelahan molekul kecil dari molekul zat induk menyebabkan pembentukan ikatan-n tambahan antar atom. Reaksi eliminasi terjadi pada kondisi tertentu dan dengan pereaksi tertentu. Persamaan yang diberikan hanya mencerminkan hasil akhir dari transformasi ini.
Reaksi isomerisasi
Reaksi yang mengakibatkan terbentuknya molekul suatu zat dari molekul zat lain dengan komposisi kualitatif dan kuantitatif yang sama, yaitu dengan rumus molekul yang sama, disebut reaksi isomerisasi.
Contoh reaksi tersebut adalah isomerisasi kerangka karbon alkana linier menjadi alkana bercabang, yang terjadi pada aluminium klorida pada suhu tinggi:
Jenis reaksi kimia dalam kimia organik
1
. Jenis reaksi apakah ini:a) memperoleh klorometana dari metana;
b) memperoleh bromobenzena dari benzena;
c) memproduksi kloroetana dari etilen;
d) memproduksi etilen dari etanol;
e) konversi butana menjadi isobutana;
f) dehidrogenasi etana;
g) konversi bromoetana menjadi etanol?
2
. Reaksi apa yang khas untuk: a) alkana; b) alkena? Berikan contoh reaksi.3
. Apa saja ciri-ciri reaksi isomerisasi? Apa persamaannya dengan reaksi yang menghasilkan modifikasi alotropik suatu unsur kimia? Berikan contoh.4.
Di mana reaksi (penambahan, substitusi, eliminasi, isomerisasi) menentukan berat molekul senyawa awal:a) meningkat;
b) menurun;
c) tidak berubah;
d) apakah bertambah atau berkurang tergantung reagennya?