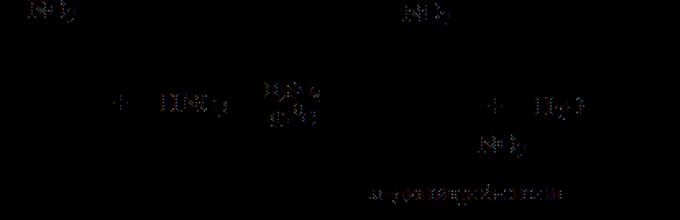Нитрование ароматических соединений – основной путь получения нитросоединений. Процесс нитрования как частный случай электрофильного замещения в ароматическом ряду был уже рассмотрен раньше. Поэтому представляется целесообразным сосредоточить внимание на синтетических возможностях этой реакции.
Достаточно легко и с хорошим результатом нитруется уже сам бензол
В более жестких условиях способен нитроваться и нитробензол с образованием м -динитробензола

Из–за дезактивирующего влияния двух нитрогрупп ввести третью нитрогруппу в м -динитробензол удается лишь с большим трудом. 1,3,5-Три- нитробензол был получен с выходом 45% в результате нитрования м -динитробензола при 100-110 о С и продолжительности реакции 5 суток.
Трудности получения тринитробензола прямым нитрованием бензола привели к разработке косвенных методов. По одному из них более доступный, чем тринитробензол, тринитротолуол окисляется до 2,4,6-тринитробензойной кислоты, которая легко декарбоксилируется при нагревании в воде

Точно также к косвенным методам приходится прибегать и при необходимости получения 1,2-динитробензола. В этом случае обычно используется способность аминогруппы окисляться до нитрогруппы в о -нитроанилине

Даже в тех случаях, когда получение нитросоединений нитрованием не должно было бы встретить особых затруднений, приходится обращаться к косвенным методам. Так, не удается получить пикриновую кислоту нитрованием фенола, т.к. азотной кислотой фенол не нитруется, а окисляется. Поэтому обычно используется следующая схема

Тонкости данной схемы в том, что из-за дезактивации кольца хлором и двумя уже имеющимися нитрогруппами, не удается вводить в него третью нитрогруппу. Поэтому хлор в динитрохлорбензоле предварительно замещается на гидроксил, чему нитрогруппы как раз способствуют (бимолекулярное замещение). Образовавшийся динитрофенол легко принимает еще одну нитрогруппу, не окисляясь в заметной степени. Имеющиеся нитрогруппы предохраняют бензольное кольцо от окисления.
Еще одним неочевидным способом получения пикриновой кислоты является сульфирование фенола до 2,4-фенолдисульфокислоты с последующим нитрованием образовавшегося соединения. При этом одновременно с нитрованием происходит замещение сульфогрупп на нитрогруппы

Один из важнейших ароматических нитропроизводных – тринитротолуол в технике получают нитрованием толуола, которое протекает по следующей схеме

Химические свойства
Ароматические нитросоединения способны реагировать как с участием бензольного кольца, так и нитрогруппы. Указанные структурные элементы влияют на реакционную способность друг друга. Так, под воздействием нитрогруппы нитробензол в реакции электрофильного замещения вступает неохотно и новый заместитель принимает в м -положение. Нитрогруппа влияет не только на реакционную способность бензольного кольца, но и на поведение соседних функциональных групп в химических реакциях.
Рассмотрим реакции ароматических нитросоединений за счет нитрогруппы.
16.2.1. Восстановление. Одной из важнейших реакций нитросоединений является их восстановление до ароматических аминов, широко используемых при производстве красителей, лекарственных препаратов и фотохимикатов.
Возможность преобразования нитрогруппы в аминогруппу восстановлением нитросоединений впервые была показана Зининым в 1842 году на примере реакции нитробензола с сульфидом аммония

В последующем восстановление ароматических нитросоединений было предметом глубокого изучения. При этом установлено, что в общем случае восстановление носит сложный характер, протекает через ряд стадий с образованием промежуточных продуктов. Амины являются лишь конечным продуктом реакции. Результат восстановления определяется силой восстанавливающего агента и рН-среды. При электрохимическом восстановлении состав продуктов зависит от величины потенциала на электродах. Варьируя указанными факторами можно задержать процесс восстановления на промежуточных стадиях. В нейтральной и кислой средах восстановление нитробензола идет последовательно через образование нитрозобензола и фенилгидроксиламина

Когда восстановление проводится в щелочной среде, образовавшийся нитрозобензол и фенилгидроксиламин получают возможность конденсироваться между собой с образованием азоксибензола, в котором атомы азота и кислорода связаны между собой семиполярной связью

Предполагаемый механизм конденсации напоминает механизм альдольной конденсации
Восстановление азоксибензола в анилин идет через азо- и гидразобензолы
Все упомянутые выше промежуточные продукты восстановления нитробензола в анилин могут быть получены либо непосредственно из нитробензола, либо исходя друг из друга. Вот некоторые примеры


16.2.2. Влияние нитрогруппы на реакционную способность других функциональных групп. При изучении ароматических галогенпроизводных мы уже встречались со случаем, когда подходящим образом расположенная нитрогруппа (нитрогруппы) существенно влияла на нуклеофильное замещение галогена (бимолекулярное замещение ароматически связанного галогена). На примере о - и п -динитробензолов было установлено, что нитрогруппа может способствовать нуклеофильному замещению не только галогена, но даже другой нитрогруппы

Механизм бимолекулярного замещения нитрогруппы на гидроксильную группу можно представить как следующий двухстадийный процесс

Карбанион, образующийся на первой стадии рассматриваемой реакции, резонансно стабилизирован из-за вклада предельной структуры 1, в которой нитрогруппа оттягивает электроны именно с того углерода бензольного кольца, у которого их избыток.
Особенностью нуклеофильного замещения одной нитрогруппы под влиянием другой нитрогруппы является то, что реакция весьма чувствительна к расположению нитрогрупп относительно друг друга. Известно, что м -динитробензол не реагирует со спиртовым раствором аммиака даже при 250 о С.
Другими примерами содействия нитрогруппы замещению, в данном случае гидроксила, являются превращения пикриновой кислоты

16.2.3. Комплексообразование с ароматическими углеводородами. Характерным свойством ароматических нитросоединений является их склонность образовать комплексы с ароматическими углеводородами. Связи в таких комплексах носят электростатический характер и возникают между электронодонорными и электроноакцепторными частицами. Рассматриваемые комплексы называют π -комплексами или комплексами с переносом заряда.
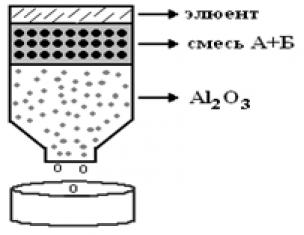
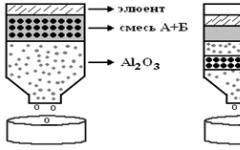
π –Комплексы в большинстве случаев представляют собой кристаллические вещества с характерными температурами плавления. При необходимости π -комплекс может быть разрушен с выделением углеводорода. Благодаря сочетанию указанных свойств π -комплексы используются для выделения, очистки и идентификации ароматических углеводородов. Особенно часто для комплексообразования используется пикриновая кислота, комплексы которой неправильно называются пикратами.
Глава 17
Амины
По степени замещения водородных атомов в аммиаке на алкильные и арильные заместители различают первичные, вторичные и третичные амины. В зависимости от природы заместителей амины могут быть жирно – ароматическими и чисто ароматическими.
Ароматические амины называют путем прибавления окончания «амин» к названию групп, связанных с азотом. В сложных случаях аминогруппу с меньшим заместителем обозначают приставкой «амино» (N–метиламино-, N,N-диметиламино), которую прибавляют к названию более сложного заместителя. Ниже приведены наиболее часто встречающиеся амины и их названия

Методы получения
Со многими из методов получения аминов мы уже встречались при изучении алифатических аминов. При приложении этих методов к синтезу ароматических аминов встречаются некоторые особенности, поэтому, не опасаясь повторов, рассмотрим их.
17.1.1. Восстановление нитросоединений. Восстановление нитросоединений – основной метод как лабораторного, так и промышленного получения аминов, который можно осуществить несколькими способами. К ним относятся каталитическое гидрирование, восстановление атомарным водородом и химическое восстановление.
Каталитическое восстановление осуществляется молекулярным водородом в присутствии тонко измелченных никеля или платины, комплексных соединений меди на носителях. При выборе катализатора и условий восстановления надо иметь в виду, что при этом могут восстановиться и другие функциональные группы. Кроме того, каталитическое восстановление нитросоединений должно проводиться с соблюдением определенной осторожности из-за чрезвычайной экзотермичности реакции.
При использовании в качестве химического восстановителя сульфида аммония появляется возможность восстановления только одной из нескольких нитрогрупп

17.1.2. Аминирование галогенпроизводных. Известны трудности, которые возникают при аминировании ароматических галогенпроизводных по механизму «элиминирования – присоединения». Однако, как уже об этом говорилось не раз, электроноакцепторные заместители в бензольном кольце, расположенные надлежащим образом, значительно облегчают замещение галогена в арилгалогенидах, направляя процесс по бимолекулярному механизму. Для сравнения ниже приведены условия аминирования хлорбензола и динитрохлорбензола

17.1.3. Расщепление по Гофману. Расщепление амидов кислот по Гофману позволяет получить первичные амины, которые содержат на один углерод меньше, чем исходные амиды

Реакция протекает с миграцией фенила от карбонильного углерода к атому азота (1,2-фенильный сдвиг) по следующему предполагаемому механизму

17.1.4. Алкилирование и арилирование аминов. Алкилирование первичных и вторичных ароматических аминов галогеналкилами или спиртами позволяет получить вторичные и третичные жирноароматические амины

К сожалению, при участии в реакции первичных аминов получается смесь. Этого можно избежать, если исходный амин предварительно проацилировать, а уже потом проалкилировать

Такой прием защиты аминогруппы позволяет получить чистые вторичные ароматические амины, а также третичные амины с разными замещающими радикалами

Арилирование аминов дает возможность получить чистые вторичные и третичные ароматические амины
Химические свойства
Ароматические амины реагируют как с участием аминогруппы, так и бензольного кольца. При этом каждая функциональная группа испытывает влияние другой группы.
Реакции по аминогруппе
Благодаря наличию аминогруппы ароматические амины вступают в многочисленные реакции. Некоторые из них были уже рассмотрены: алкилирование, ацилирование, реакция с альдегидами с образованием азометинов. Другие реакции, которым будет уделено внимание, легко предсказуемы, однако им присущи определенные особенности.
Основность
Наличие неподеленной пары электронов у атома азота, которые могут быть представлены на образование связи с протоном, обеспечивает ароматическим аминам основные свойства

Интерес представляет сопоставление основности алифатических и ароматических аминов. Как уже было показано при изучении алифатических аминов, об основности аминов удобно судить по константе основности К в

Сравним основности анилина, метиламина и аммиака
Аммиак 1,7 . 10 -5
Метиламин 4,4 . 10 -4
Анилин 7,1 . 10 -10
Из этих данных видно, что появление электронодонорной метильной группы повышает электронную плотность у атома азота и приводит к усилению основности метиламина по сравнению с аммиаком. В то же время фенильная группа более чем в 10 5 раз ослабляет основность анилина по сравнению с аммиаком.
Уменьшение основности анилина по сравнению с алифатическими аминами и аммиаком может быть объяснено сопряжением неподеленной пары электронов азота с секстетом электронов бензольного кольца

Это снижает способность неподеленной пары электронов присоединять протон. Еще более эта тенденция сказывается у ароматических аминов, которые содержат в бензольном кольце электроноакцепторные заместители

Так, м -нитроанилин как основание в 90 раз слабее, чем анилин.
Как и можно было ожидать, электронодонорные заместители в бензольном кольце усиливают основность ароматических аминов

Жирноароматические амины под влиянием алкильной группы проявляют бóльшую основность, чем анилин и амины с электроноакцепторными группами в кольце.
 Электронное строение нитрогруппы характеризуется наличие семи полярной (полуполярной) связи:
Электронное строение нитрогруппы характеризуется наличие семи полярной (полуполярной) связи:
Нитросоединения жирного ряда – жидкости, не растворимые в воде, хорошо растворимы в спирте и эфире. Ароматические нитросоединения – жидкости или твердые вещества со специфическим запахом. Очень важным свойством нитросоединений – при восстановлении переходить в первичные амины.
С 6 Н 5 - NO 2 + 6 [H]  С 6 Н 5 – NH 2 + 2 Н 2 О
С 6 Н 5 – NH 2 + 2 Н 2 О
Все нитросоединения ядовиты. Многие ароматические нитросоединения обладают взрывчатыми свойствами.
Химические свойства . Химическое поведение нитросоединений определяется наличием в молекуле нитрогруппы и ее особенностями, а также строением углеводородного радикала и их взаимным влиянием.

1. Восстановление нитросоединений
.
При восстановлении нитросоединений образуются первичные амины. Особенно большое промышленное значение имеет восстановление ароматических нитросоединений:
В зависимости от условий восстановления (в кислой, щелочной или нейтральной средах) и характера восстановителя в ходе реакции образуются различные промежуточные продукты, многие из которых нашли широкое применение в технике.
2. Действие щелочей на нитросоединения . При введении в молекулу углеводорода нитрогруппа вследствие ее электроноакцепторных свойств резко повышает подвижность атомов водорода в α-положении. Первичные и вторичные нитросоединения приобретают способность растворяться в щелочах с образованием солей. При действии на соль кислоты образуется нитросоединение в ацинитро-форме:

которая затем переходит в нитро-форму:
Взаимное превращение двух форм нитросоединений является типичным примером динамической изомерии (таутомерии).
3. Реакции бензольного ядра ароматических нитросоединений , Нитрогруппа ориентирует вхождение второго заместителя при электрофильном замещении предпочтительно в ж-положение, при нуклеофильном - в о- и n-положения. Примером производных нитросоединений ароматических углеводородов является 2, 4, 6-тринитрофенол (пикриновая кислота):
Пикриновая кислота и ее соли применяются в качестве взрывчатых веществ и в аналитической химии.

Применение
. Нитропарафины применяются в промышленности в качестве растворителей, добавок к дизельным топливам, снижающих температуру их воспламенения, при производстве взрывчатых веществ, пластмасс, в реактивной технике; в качестве полупродуктов в синтезе аминов, альдегидов и кетонов, жирных кислот. Ароматические нитросоединения широко применяются для получения красителей, пластмасс, душистых и взрывчатых веществ.
Отдельные представители.
Нитрометан С Н 3 -NO 2 . Жидкость, t кип -101,2 °С. Применяется в качестве растворителя, как ракетное топливо. Хлорированием нитрометана получают трихлорнитрометан (хлорпикрин) CCl 3 NO 2 , который применяется для борьбы с грызунами в хлебохранилищах и складах, а также в разнообразных синтезах.
Нитроэтан СН 3 СН 2 -NO 2 . Жидкость, t кип = 113 °С *Кип=ПЗ°С. Применяется для получения гидроксиламина:
Нитроциклогексан C 6 СH 2 NО 2 . Жидкость, t кип =205 °С. Получают нитрованием циклогексана. Применяется в качестве полупродукта в синтезе капролактама.
Нитробензол C 6 H 6 NО 2 . Жидкость желтоватого цвета, с запахом горького миндаля, t кип = 211 °С. Плохо растворим в воде и хорошо растворим во многих органических растворителях. Исходный продукт в производстве анилина, широко применяется в анилино-красочной, парфюмерной, фармацевтической промышленностях.

Тринитротолуол (
тол, тротил)
Твердое вещество, t пл = 80°С. Широко применяется в качестве взрывчатого вещества.
Известны также N- и О-нитро-соединения (см. и Нитраты органические).
Нитрогруппа имеет строение, промежуточное между двумя предельными резонансными структурами:
ФИЗИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ АЛИФАТИЧЕСКИХ НИТРОСОЕДИНЕНИЙ

* При 25°С. ** При 24°С. *** При 14°С.
В ИК спектрах нитросоединений присутствуют две характеристич. полосы, соответствующие антисимметричным и симметричным валентным колебаниям связи N-О: для первичных нитросоединений соотв. 1560-1548 и 1388-1376 см -1 , для вторичных 1553-1547 и 1364-1356 см -1 , для третичных 1544-1534 и 1354-1344см -1 ; для нитроолефинов RCH=CHNO 2 1529-1511 и 1351-1337 см -1 ; для динитроалканов RCH(NO 2) 2 1585-1575 и 1400-1300 см -1 ; для тринитроалканов RC(NO 2) 3 1610-1590 и 1305-1295 см -1 ; для ароматических Н. 1550-1520 и 1350-1330 см -1 (электроноакцепторные заместители сдвигают высокочастотную полосу в область 1570 -1540, а электронодонорные - в область 1510-1490 см -1); для Н. 1610-1440 и 1285-1135 см -1 ; нитроновые эфиры имеют интенсивную полосу при 1630-1570 см, связь С-N-слабую полосу при 1100-800 см -1 .
В УФ спектрах алифатических нитросоединений l макс 200-210 нм (интенсивная полоса) и 270-280 нм (слабая полоса); для и эфиров нитроновых кислот соотв. 220-230 и 310-320 нм; для гем-динитросоед. 320-380 нм; для ароматических Н. 250-300 нм (интенсивность полосы резко снижается при нарушении копланарности).
В спектре ПМР хим. сдвиги a-Н-атома в зависимости от строения 4-6 м.д. В спектре ЯМР 14 N и 15 N хим. сдвиг 5 от - 50 до + 20 м.д.
В масс-спектрах алифатических нитросоединений (за исключением CH 3 NO 2) пик мол. отсутствует или очень невелик; осн. процесс фрагментации - отщепление NO 2 или двух с образованием фрагмента, эквивалентного . Для ароматических нитросоединений характерно присутствие пика мол. ; осн. пик в спектре соответствует , получаемому при отщеплении NO 2 .
Химические свойства.
Нитрогруппа - одна из наиб. сильных электроноакцепторных групп и способна эффективно делокализовать отрицат. заряд. В ароматич. соед. в результате индукционного и особенно она влияет на распределение : ядро приобретает частичный положит. заряд, который локализован главным образом в орто- и пара-положениях; константы Гаммета для группы NO 2 s м 0,71, s n 0,778, s + n 0,740, s - n 1,25. Т. обр., введение группы NO 2 резко увеличивает реакц. способность орг. соед. по отношению к нуклеоф. реагентам и затрудняет реакции с электроф. реагентами. Это определяет широкое применение нитросоединений в орг. синтезе: группу NO 2 вводят в нужное положение орг. соед., осуществляют разл. реакции, связанные, как правило, с изменением углеродного скелета, и затем трансформируют в др. ф-цию или удаляют. В ароматич. ряду часто используют и более короткую схему: нитрование-трансформация группы NO 2 .
Мн. превращения алифатических нитросоединений проходят с предварит. в нитроновые кислоты или образованием соответствующего . В растворах равновесие обычно практически полностью сдвинуто в сторону С-формы; при 20 °С доля аци-формы для 1 10 -7 , для нитропропана 3 . 10 -3 . Нитроновые кислоты в своб. виде, как правило, неустойчивы; их получают осторожным подкислением Н. В отличие от Н. они проводят ток в растворах и дают красное окрашивание с FeCl 3 . Аци-Н.-более сильные СН-кислоты (рК а ~ 3-5), чем соответствующие нитросоединения (рК а ~ 8-10); кислотность нитросоединений повышается с введением электроноакцепторных заместителей в a-положение к группе NO 2 .
Образование нитроновых кислот в ряду ароматических Н. связано с бензольного кольца в хиноидную форму; например, образует с конц. H 2 SO 4 окрашенный солеобразный продукт ф-лы I, о-нитротолуол проявляет в результате внутримол. переноса с образованием ярко-синего О-производного:

При действии оснований на первичные и вторичные Н. образуются нитросоединений; амбидентные в реакциях с электрофилами способны давать как О-, так и С-производные. Так, при алкилировании Н. алкилгалогенидами, триалкилхлорсиланами или R 3 O + BF - 4 образуются продукты О-алкилирования. Последние м.б. получены также при действии диазометана либо N,О-бис-(триметилсилил)аце-тамида на нитроалканы с рК а

Ациклич. алкиловые эфиры нитроновых кислот термически нестабильны и распадаются по внутримол. механизму:
р-цию можно использовать для получения . Более стабильны силиловые эфиры. Об образовании продуктов С-алкилирования см. ниже.
Для нитросоединений характерны реакции с разрывом связи С-N, по связям N=O, O=N О, C=N -> О и реакции с сохранением группы NO 2 .
Р-ц и и с р а з р ы в о м с в я з и С-N. Первичные и вторичные Н. при нагр. с минер. кислотами в присутствии спиртового или водного раствора образуют карбонильные соед. (см. Нефа реакция). Р-ция проходит через промежут. образование нитроновых кислот:

В качестве исходных соед. можно использовать силиловые нитроновые эфиры. Действие сильных кислот на алифатические нитросоединения может приводить к гидроксамовым кислотам, например:

Метод используют в промышленности для синтеза СН 3 СООН и из нитроэтана. Ароматические нитросоединения инертны к действию сильных кислот.
Алифатические нитросоединения, содержащие подвижный Н в b-положении к группе NO 2 , при действии оснований легко элиминируют ее в виде HNO 2 с образованием . Аналогично протекает термич. разложение нитроалканов при температурах выше 450°. Вицинальные динитросоед. при обработке Са в гексамстаноле отщепляют обе группы NO 2 , Ag-соли непредельных нитросоединений при потере групп NO 2 способны димеризоваться:

Нуклеоф. замещение группы NO 2 не характерно для нитроалканов, однако при действии тиолат-ионов на третичные нитроалканы в апротонных растворителях группа NO 2 замещается на . Р-ция протекает по анион-радикальному механизму. В алифатич. и гетероциклич. соед. группа NO 2 при относительно легко замещается на нуклеофил, например:

В ароматич. соед. нуклеоф. замещение группы NO 2 зависит от ее положения по отношению к др. заместителям: группа NO 2 , находящаяся в мета-положении по отношению к электроноакцепторным заместителям и в орто- и пара-положениях к электронодонорным, обладает низкой реакц. способностью; реакц. способность группы NO 2 , находящейся в орто- и пара-положениях к электроноакцепторным заместителям, заметно увеличивается. В некоторых случаях заместитель вступает в орто-положение к уходящей группе NO 2 (напр., при нагр. ароматических Н. со спиртовым раствором KCN, реакция Рихтера):

Р-ц и и п о с в я з и N = O. Одна из важнейших реакций-вос-становление, приводящее в общем случае к набору продуктов:

Азокси-(II), азо-(III) и гидразосоед. (IV) образуются в щелочной среде в результате промежуточно возникающих нитрозосоед. с и . Проведение процесса в кислой среде исключает образование этих веществ. Нитрозосоед. восстанавливаются быстрее, чем соответствующие нитросоединения, и выделить их из реакц. смеси, как правило, не удается. Алифатические Н. восстанавливаются в азокси- или при действии Na, ароматические - при действии NaBH 4 , обработка последних LiAlH 4 приводит к . Электрохим. ароматических Н. при определенных условиях позволяет получить любое из представленных производных (за исключением нитрозосоед.); этим же методом удобно получать из мононитроалканов и амидоксимы из гем-динитроалканов:
Р-ции по связям O = N О и C = N О. Нитросоединения вступают в реакции 1,3-диполярного , например:

Наиб. легко эта реакция протекает между нитроновыми эфира-ми и или . В продуктах (моно- и бициклич. диалкоксиаминах) под действием нуклеоф. и электроф. реагентов связи N - О легко расщепляются, что приводит к разл. алифатич. и гетеро-циклич. соед.:

В препаративных целях в реакции используют стабильные силиловые нитроновые эфиры.
Р-ц и и с с о х р а н е н и е м г р у п п ы NO 2 . Алифатические Н., содержащие a-Н-атом, легко алкилируются и ацилируются с образованием, как правило, О-производных. Однако взаи-мод. дилитиевых первичных Н. с алкилгалогенидами, ангидридами или галогенангидридами карбоновых кислот приводит к продуктам С-алкилирования или С-ацилирования, например:
Известны примеры внутримол. С-алкилирования, например:
Первичные и вторичные нитросоединения реагируют с алифатич. и СН 2 О с образованием р-аминопроизводных (р-ция Манниха); в реакции можно использовать предварительно полученные метилольные производные нитросоединений или аминосоед.:


Легко вступают в реакции присоединения нитроолефины: с в слабокислой или слабощелочной среде с послед. ретрореакцией Анри они образуют карбонильные соед. и нитроалканы; с нитросоединениями, содержащими a-Н-атом,-поли-нитросоединений; присоединяют и др. СН-кислоты, такие, как , и малоновой кислот, реактивы Гриньяра, а также нуклеофилы типа OR - , NR - 2 и др., например:

Нитроолефины могут выступать в роли диенофилов или диполярофилов в реакциях и циклоприсое-динения, а 1,4-динитродиены-в роли диеновых компонентов, например:

Получение.
В промышленности низшие нитроалканы получают жидкофазным (р-ция Коновалова) или парофазным (метод Хэсса) смеси , и , выделяемых из природного или полученных переработкой (см. Нитрование). Таким методом получают и высшие Н., например нитроциклогексан - полупродукт в произ-ве капролактама.
В лаборатории для получения нитроалканов применяют азотной кислотой соед. с активир. метиленовой группой; удобный метод синтеза первичных нитроалканов -нитрование 1,3-индандиона с послед. щелочным a-нитрокетона:

Алифатические нитросоединения получают также взаимод. AgNO 2 с алкилгалогенидами или NaNO 2 с эфирами a-галогенкарбо-новых кислот (см. Мейера реакция). Алифатические Н. образуются при и ; -способ получения гем-ди- и гем-тринитросоединений, например:

Нитроалканы м.б. получены нагреванием ацилнитратов до 200 °С.
Мн. методы синтеза нитросоединений базируются на олефинов , HNO 3 , нитрония, NO 2 Cl, орг. нитратами и т.п. Как правило, при этом получают смесь виц-динитросоединений, нитронитратов, нитронитритов, непредельных нитросоединений, а также продуктов сопряженного присоединения группы NO 2 и растворителя или продуктов их , например:
Нитросоедингениями называют производные углеводородов, в которых один или несколько атомов водорода замещены на нитрогруппу -NO 2 . В зависимости от углеводородного радикала, к которому присоединена нитрогруппа, нитросоединения делятся на ароматические и алифатические. Алифатические соединения различают как первичные 1о, вторичные 2 о и третичные 3о, в зависимости от того к 1 о, 2 о или 3о атому углерода присоединена нитрогруппа.
Нитрогруппу -NO2 не следует путать с нитритной группой -ONO. Нитрогруппа имеет следующее строение:
Наличие полного положительного заряда на атоме азота обусловливает наличие у нее сильного -I-эффекта. Наряду с сильным -I-эффектом нитрогруппа обладает сильным -М-эффектом.
Упр. 1. Рассмотрите строение нитрогруппы и ее влияние на направление, и скорость реакции электрофильного замещения в ароматическом ядре.
Способы получения нитросоединений
Практически все способы получения нитросоединений были уже рассмотрены в предыдущих главах. Ароматические нитросоединения получают, как правило, прямым нитрованием аренов и ароматических гетероциклических соединений. Нитроциклогексан в промышленных условиях получают нитрованием циклогексана:

Таким же путем получают и нитрометан, однако в лабораторных условиях его получают из хлоруксусной кислоты в результате реакций (2-5). Ключевой стадией из них является реакция (3), проходящая по механизму SN2.
Хлоруксусная кислота Хлорацетат натрия
Нитроуксусная кислота
Нитрометан
Реакции нитросоединений
Таутомерия алифатических нитросоединений
Вследствие сильных электроноакцепторных свойств нитрогруппы, -атомы водорода обладают повышенной подвижностью и поэтому первичные и вторичные нитросоединения являются С-Н-кислотами. Так, нитрометан является довольно сильной кислотой (pKa 10,2) и в щелочной среде легко превращается в резонансностабилизированный анион:
Нитрометан pKa 10,2 Резонансностабилизированный анион
Упр.2. Напишите реакции (а) нитрометана и (б) нитроциклогексана с водным раствором NaOH.
Конденсация алифатических нитросоединений с альдегидами и кетонами
Нитрогруппа может быть введена в алифатические соединения альдольной реакцией между анионом нитроалкана и альдегидом или кетоном. В нитроалканах -атомы водорода даже более подвижны, чем в альдегидах и кетонах и поэтому они могут вступать с альдегидами и кетонами в реакции присоединения и конденсации предоставляя свои -атомы водорода. С алифатическими альдегидами обычно проходят реакции присоединения, а с ароматическими - исключительно конденсации.
Так, нитрометан присоедняется к циклогексанону,

1-Нитрометилциклогексанол
но конденсируется с бензальдегидом,
В реакции присоединения с формальдегидом участвуют все три атома водорода нитрометана и образуется 2-гидроксиметил-2-нитро-1,3-динитропропан или триметилолнитрометан.
Конденсацией нитрометана с гексаметилентетрамином мы получили 7-нитро-1,3,5-триазаадамантан:

Упр. 3. Напишите реакции формальдегида (а) с нитрометаном и (б) с нитроциклогексаном в щелочной среде.
Восстановление нитросоединений
Нитрогруппу восстанавливают в аминогруппу различными восстановителями (11.3.3). Гидрированием нитробензола под давлением в присутствии никеля Ренея в промышленных условиях получают анилин

В лабораторных условиях вместо водорода можно использовать гидразин, разлагающийся в присутствии никеля Ренея с выделением водорода.

7-нитро-1,3,5-триазаадамантан 7-амино-1,3,5-триазаадамантан
Нитросоединения восстанавливают металлами в кислой среде с последующим подщелачиванием

В зависимости от рН среды и используемого восстановителя могут быть получены различные продукты. В нейтральной и щелочной среде активность обычных восстанавливающих агентов по отношению к нитросоединениям меньше, чем в кислой среде. Характерным примером может служить восстановление нитробензола цинком. В избытке соляной кислоты цинк восстанавливает нитробензол в анилин, в то время как в буферном растворе аммонийхлорида - в фенилгидроксиламин:

В кислой среде арилгидроксиламины подвергаются перегруппировке:

п-Аминофенол используется в качестве проявителя в фотографии. Фенилгидроксиламин далее может быть окислен до нитрозобензола:

Нитрозобензол
Восстановлением нитробензола хлоридом олова (II) получают азобензол, а цинком в щелочной среде - гидразобензол.


Обработкой нитробензола раствором щелочи в метаноле получают азоксибензол, при этом метанол окисляется в муравьиную кислоту.

Известны методы неполного восстановления и нитроалканов. На этом основан один из промышленных методов получения капрона. Нитрованием циклогексана получают нитроциклогексан, который восстановлением переводят в оксим циклогексанона и далее с помощью перегруппировки Бекмана - в капролактам и полиамид - исходное вещество для приготовления волокна - капрона:

Восстановление нитрогруппы продуктов альдольного присоединения (7) является удобным способом получения -аминоспиртов.

1-Нитрометилциклогексанол 1-Аминометилциклогексанол
Использование в качестве восстановителя сероводорода позволяет восстанавливать одну из нитрогрупп в динитроаренах:

м-Динитробензол м-Нитроанилин

2,4-Динитроанилин 4-Нитро-1,2-диаминобензол
Упр.4. Напишите реакции восстановления (а) м-динитробензола оловом в соляной кислоте, (б) м-динитробензола сероводородом, (в) п-нитротолуола цинком в буферном растворе хлорида аммония.
Упр.5. Завершите реакции:


Восстановление нитросоединений . Все нитросоединения восстанавливаются в первичные амины. Если образующийся амин летуч, его можно обнаружить по изменению окраски индикаторной бумажки:
Реакция с азотистой кислотой . Характерной качественной реакцией на первичные и вторичные нитросоединения является реакция с азотистой кислотой.
Для третичных алифатических нитросоединений специфических реакций обнаружения не имеется.
Обнаружение ароматических нитросоединений. Ароматические нитросоединения обычно окрашены в бледно-желтый цвет. При наличии других заместителей интенсивность и глубина окраски часта усиливается. Для обнаружения ароматических нитросоединений их восстанавливают в первичные амины, последние диазотируют и сочетают с β-нафтолом:
| ArNO 2 →ArNH 2 → ArN 2 Cl → ArN=N |
| OH |
Эта реакция, однако, не является специфической, так как амины образуются при восстановлении не только нитросоединений, но и нитрозо-, азоокси-и гидразосоединений. Для того чтобы сделать окончательный вывод о наличии в соединении нитрогруппы, нужно провести количественное определение.
Качественные реакции N-нитрозосоединений
Реакция с HI. С-Нитрозосоединения можно отличить от N- нитрозосоединений по их отношению к подкисленному раствору йодистого калия: С-нитрозосоединения окисляют иодистоводородную кислоту, N-нитрозосоединения с иодистоводородной кислотой не реагируют.
Реакция с первичными ароматическими аминами . С-Нитрозосоединения конденсируются с первичными ароматическими аминами, образуя окрашенные азосоединения:
| ArN = O + H 2 N – Ar → Ar – N = N – Ar + H 2 O |
Гидролиз N-нитрозосоединений . Чистоароматические и жирноароматические N-нитрозосоединения (нитрозамины) легко гидролизуются спиртовыми растворами НСl, образуя вторичный амин и азотистую кислоту. Если гидролиз вести в присутствии а-нафтиламина, то последний диазотируется образующейся азотистой кислотой, а диазосоединение вступает в реакцию азосочетания с избыточным а-нафтиламином. Образуется азокраситель:
Реакционная смесь окрашивается в розовый цвет; постепенно окраска становится пурпурной.
Качественные реакции нитрилов
В анализе нитрилов RC≡N, ArC≡N используется их способность гидролизоваться и восстанавливаться. Для обнаружения C≡N группы проводят гидролиз:
| RC ≡ N + H 2 O → R – CONH 2 |
Нитрилы удобнее всего характеризовать по кислотам, которые получаются при их гидролизе. Кислоту выделяют из гидролизата перегонкой с паром или экстракцией и превращают в одно из производных - сложный эфир или амид
Качественные реакции тиолов (тиоспиртов, тиоэфиров)
Наиболее важными свойствами тиолов, используемыми в анализе, являются способность к замещению атома водорода в группе -SH и способность к окислению. Вещества, содержащие группу -SH, обладают сильным неприятным запахом, ослабевающим с увеличением числа атомов углерода в молекуле.
Реакция с HNO 2 . Вещества, содержащие группу SH, при действии азотистой кислоты дают цветную реакцию:
Кроме тиолов, эту реакцию дают также тиокислоты RCOSH. Если R -первичный или вторичный алкил, возникает красная окраска, если R-третичный алкил или арил-окраска вначале зеленая, а затем красная.
Образование меркаптидов . Характерной качественной реакцией тиолов является также образование осадков меркаптидов тяжелых металлов (Pb, Сu, Hg). Например,
| 2RSH + PbO → (RS) 2 Pb + H 2 O |
Меркаптиды свинца и меди окрашены.