Карбоксилните киселини се органски киселини. Тие се дел од живите организми и учествуваат во метаболизмот. Хемиски својства карбоксилни киселинисе предизвикани од присуството на карбоксилната група -COOH. Тие вклучуваат оцетна, мравја, оксална, маслена и голем број други киселини.
општ опис
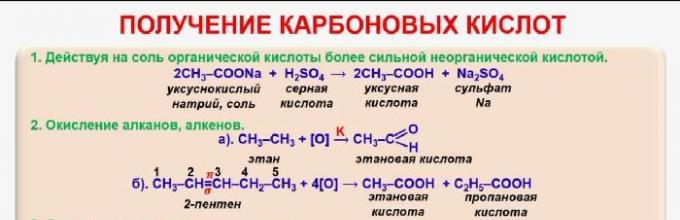
Постојат неколку начини за добивање на карбоксилни киселини:
- оксидација на алкохоли - C 2 H 5 OH + O2 → CH 3 COOH + H 2 O (оцетна киселина се формира од етанол);
- оксидација на алдехиди - CH 3 COH + [O] → CH 3 COOH;
- оксидација на бутан - 2C 4 H 10 + 5O 2 → 4CH 3 COOH + 2H 2 O;
- карбонилација на алкохол - CH 3 + CO → CH 3 COOH;
- распаѓање на оксална киселина за да се добие мравја киселина - C 2 H 2 O 4 → HCOOH + CO 2;
- интеракција на соли со концентрирана сулфурна киселина - CH 3 COONa + H 2 SO 4 → CH 3 COOH + NaHSO 4.

Ориз. 1. Методи за производство на карбоксилни киселини.
Физички својства на карбоксилните киселини:
- точка на вриење повисока од онаа на соодветните јаглеводороди и алкохоли;
- добра растворливост во вода - се раствораат во водородни катјони и анјони на киселинскиот остаток (тие се слаби електролити);
- со зголемување на бројот на јаглеродни атоми се намалува јачината на киселините.
Карбоксилните киселини имаат силни водородни врски (посилни од алкохолите), што е предизвикано од високиот позитивен полнеж на водородниот атом во карбоксилната група.
Интеракција
Карбоксилните киселини ја менуваат бојата на индикаторите. Лакмусот и метил портокалот стануваат црвени.

Ориз. 2. Интеракција со индикатори.
Во табелата хемиски својствакарбоксилните киселини ја опишуваат интеракцијата на киселините со други супстанции.
|
Реакции |
Резултат |
Пример |
|
Со метали |
Се ослободува водород и се формираат соли |
2CH 3 COOH + Mg → (CH 3 COO) 2 Mg + H 2 |
|
Со оксиди |
Се формираат сол и вода |
2CH 3 COOH + ZnO → (CH 3 COO) 2 Zn + H 2 O |
|
Со основа (неутрализација) |
Се формираат сол и вода |
CH 3 COOH + NaOH → CH 3 COONa + H 2 O |
|
Со карбонати |
Јаглерод диоксид и вода се ослободуваат |
2CH 3 COOH + CaCO 3 → (CH 3 COO) 2 Ca + H 2 O + CO 2 |
|
Со соли на слаби киселини |
Се формира неорганска киселина |
2CH 3 COOH + Na 2 SiO 3 → 2CH 3 COONa + H 2 SiO 3 |
|
Со амонијак или амониум хидроксид |
Се формира амониум ацетат. При интеракција со хидроксид, водата се ослободува |
CH 3 COOH + NH 3 → CH 3 COONH 4 CH 3 COOH + NH 4 OH → CH 3 COONH 4 + H 2 O |
|
Со алкохоли (естерификација) |
Се формираат естри |
CH 3 COOH + C 2 H 5 OH → CH 3 COOC 2 H 5 + H 2 O |
|
Халогенација |
Се формира сол |
CH 3 COOH + Br 2 → CH 2 BrCOOH |
Солите формирани од интеракцијата на супстанциите со мравја киселина се нарекуваат формати, а со оцетна киселина - ацетати.
Декарбоксилација
Отстранувањето на карбоксилната група се нарекува декарбоксилација, што се јавува во следниве случаи:
- при загревање на соли во присуство на цврсти алкалии со формирање на алкани - RCOONa цврсто + NaOH цврсто → RH + Na 2 CO 3;
- кога се загрева цврсти соли- (CH 3 COO) 2 Ca → CH 3 -CO-CH 3 + CaCO 3;
- при калцинирање на бензоева киселина - Ph-COOH → PhH + CO 2;
- при електролиза на раствори на сол - 2RCOONa + H 2 O → R-R + 2CO 2 + 2NaOH.
Карбоксилни киселинисе соединенија кои содржат карбоксилна група:
Карбоксилните киселини се разликуваат:
- монобазни карбоксилни киселини;
- дибазни (дикарбоксилни) киселини (2 групи УНС).
Во зависност од нивната структура, карбоксилните киселини се разликуваат:
- алифатичен;
- алициклична;
- ароматични.
Примери на карбоксилни киселини.


Подготовка на карбоксилни киселини.
1. Оксидација на примарни алкохоли со калиум перманганат и калиум дихромат:

2. Хибролиза на јаглеводороди супституирани со халогени кои содржат 3 атоми на халоген по јаглероден атом:
3. Подготовка на карбоксилни киселини од цијаниди:
Кога се загрева, нитрилот се хидролизира за да формира амониум ацетат:
Кога се закиселува, киселината таложи:
4. Употреба на Grignard реагенси:
5. Хидролиза естри:
6. Хидролиза на киселински анхидриди:
7. Специфични методи за добивање на карбоксилни киселини:
Мравја киселина се произведува со загревање на јаглерод (II) моноксид со натриум хидроксид во прав под притисок:
Оцетната киселина се произведува со каталитичка оксидација на бутан со атмосферски кислород:
Бензоевата киселина се добива со оксидација на моносупституирани хомолози со раствор од калиум перманганат:
Реакцијата на Каницијаро. Бензалдехидот се третира со 40-60% раствор на натриум хидроксид на собна температура.

Хемиски својства на карбоксилни киселини.
ВО воден растворКарбоксилните киселини дисоцираат:

Рамнотежата е силно поместена налево, бидејќи карбоксилните киселини се слаби.
Супституентите влијаат на киселоста поради индуктивниот ефект. Таквите супституенти ја повлекуваат густината на електроните кон себе и на нив се јавува негативен индуктивен ефект (-I). Повлекувањето на густината на електроните доведува до зголемување на киселоста на киселината. Супституентите кои донираат електрони создаваат позитивен индуктивен полнеж.

1. Формирање на соли. Реакција со базни оксиди, соли на слаби киселини и активни метали:

Карбоксилните киселини се слаби, бидејќи минералните киселини ги отстрануваат од соодветните соли:
2. Формирање на функционални деривати на карбоксилни киселини:
3. Естери при загревање киселина со алкохол во присуство на сулфурна киселина - реакција на естерификација:
4. Формирање на амиди, нитрили:
3. Својствата на киселините се одредуваат со присуство на јаглеводороден радикал. Ако реакцијата се случи во присуство на црвен фосфор, тој го формира следниот производ:
4. Реакција на додавање.

8. Декарбоксилација. Реакцијата се изведува со спојување на алкали со сол алкален металкарбоксилна киселина:
9. Дибазната киселина лесно се елиминира CO 2кога се загрева:
Дополнителни материјали на тема: Карбоксилни киселини.
Хемиски калкулатори |
|
| Хемија онлајн на нашата веб-страница за решавање проблеми и равенки. | |
Оксидацијата на заситените јаглеводороди со кислород на специјални катализатори до карбоксилни киселини се врши во индустријата, но овој метод не се разликува по селективност. Вообичаено, мешавините на карбоксилни киселини се добиваат затоа што оксидацијата ги раскинува различните врски јаглерод-јаглерод.
Оксидацијата на алкените со силни оксидирачки агенси е многу поселективна. Кога алкените, кои имаат по еден водороден атом на секој јаглероден атом на двојна врска, се загреваат со алкален раствор на калиум перманганат, се формира мешавина од две карбоксилни киселини. Ако алкенот е симетричен, тогаш се формираат две молекули од една карбоксилна киселина. Истата оксидација може да се изврши со загревање на алкените со концентрирана азотна киселина.
![]()
Слично на тоа, кога алкините се оксидираат со алкален раствор на калиум перманганат, се добиваат карбоксилни киселини. На пример, оцетна киселина може да се добие со оксидација на 2-бутен или 2-бутин.

Алкилбензените се оксидираат до бензоева киселина или со кислород на катализаторите (во индустријата) или со загревање со калиум перманганат. На пример, вриење на толуен со воден раствор на калиум перманганат и потоа закиселување на растворот доведува до бензоева киселина.

Карбоксилните киселини може да се добијат и со оксидација на примарни алкохоли или алдехиди. Соединенијата на хром во највисока состојба на оксидација обично се користат како оксидирачки агенси, на пример, хром анхидрид, калиум перманганат во алкална средина, концентрирана азотна киселина. Алдехидите лесно се оксидираат со други оксидирачки агенси, на пример, раствор на амонијак од сребрен оксид (реакција на „сребрено огледало“).

1.2. Синтеза на карбоксилни киселини од халогени деривати
1.2.1.Синтеза на карбоксилни киселини преку нитрили
Алкил халидите реагираат со натриум цијанид за да формираат алкил цијаниди, кои се нитрили на карбоксилни киселини. Последните се хидролизираат во кисела средина до карбоксилни киселини.

Така, се јавува двостепена замена на атомот на халоген во молекулата на дериват на халоген со карбоксилна група. Така, за да се добие валеринска киселина (5 јаглеродни атоми), потребно е да се започне од бутил халид.
1-бромобутанска нитрил валеринска киселина
валеринска киселина
1.2.2. Синтеза на карбоксилни киселини со реакција на Грињард
Грињардовите реагенси, кои се подготвуваат од халогени деривати со реакција со металот на магнезиум, се нуклеофилни реагенси. Затоа, за да се синтетизираат карбоксилни киселини од нив, се користи реакција на карбоксилација со помош на електрофилен јаглерод диоксид.
За да се добие бензоева киселина со овој метод, неопходно е да се земе, на пример, бромобензенот како почетен халоген дериват, кој со реакција со магнезиум, последователна реакција на фенилмагнезиум бромид со јаглерод диоксид и конечна хидролиза на солта на магнезиум се претвора во бензоева киселина. .
1.3. Хидролиза на деривати на карбоксилна киселина
Како нитрилите и солите, чија хидролиза е веќе дискутирана, другите деривати на карбоксилните киселини се хидролизираат до карбоксилни киселини. Реакциите можат да се катализираат и од киселини и со алкалии. На пример, хидролизата на метил естер на пропаноична киселина катализирана од силна минерална киселина произведува пропаноична киселина и метанол.
Кога ацетанилидот (фениламид на оцетна киселина) се загрева со воден раствор на натриум хидроксид, се добиваат натриум ацетат и анилин.
Хидролизата на молекулата на бензоева анхидрид резултира со формирање на две молекули на бензоева киселина.

Катализата и механизмот на хидролиза ќе бидат разгледани подетално во деловите посветени на дериватите на карбоксилна киселина
Подготовка на карбоксилни киселини
Јас. Во индустријата
1. Изолирани од природни производи
(масти, восоци, есенцијални и растителни масла)
2. Оксидација на алкани:
2CH 4 + + 3O 2 т,кат→ 2HCOOH + 2H 2 O
метанот мравја киселина
2CH 3 -CH 2 -CH 2 -CH 3 + 5O 2 т,кат,стр→ 4CH 3 COOH + 2H 2 O
n-бутанооцетна киселина
3. Оксидација на алкени:
CH 2 = CH 2 + O 2 т,кат→CH3COOH
етилен
СО H3 -CH=CH2 + 4[O] т,кат→ CH 3 COOH + HCOOH (оцетна киселина + мравја киселина )
4. Оксидација на бензен хомолози (производство на бензоева киселина):
C 6 H 5 -C n H 2n+1 + 3n[O] KMnO4, H+→ C 6 H 5 -COOH + (n-1)CO 2 + nH 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 -COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
толуенбензоева киселина
5. Добивање на мравја киселина:
Фаза 1: CO + NaOH т , стр→ HCOONa (натриум формат - сол )
2 фаза: HCOONa + H 2 SO 4 → HCOOH + NaHSO 4
6. Подготовка на оцетна киселина:
CH3OH+CO т, стр→CH3COOH
Метанол
II. Во лабораторијата
1. Хидролиза на естри:
2. Од соли на карбоксилни киселини :
R-COONa + HCl → R-COOH + NaCl
3. Растворување анхидриди на карбоксилна киселина во вода:
(R-CO) 2 O + H 2 O → 2 R-COOH
4. Алкална хидролиза на халогени деривати на карбоксилни киселини:

III. Општи методи за подготовка на карбоксилни киселини
1. Оксидација на алдехиди:
R-COH + [O] → R-COOH
На пример, реакцијата „Сребрено огледало“ или оксидација со бакар (II) хидроксид - квалитативни реакцииалдехиди
2. Оксидација на алкохоли:
R-CH2-OH + 2[O] т,кат→ R-COOH + H 2 O
3. Хидролиза на халогени јаглеводороди кои содржат три атоми на халоген по јаглероден атом.

4. Од цијаниди (нитрили) - методот ви овозможува да го зголемите јаглеродниот синџир:
СО H 3 -Br + Na-C≡N → CH 3 -CN + NaBr
CH3-CN - метил цијанид (нитрил на оцетна киселина)
СО H 3 -CN + 2H 2 O т→ CH 3 COONH 4
ацетат амониум
CH 3 COONH 4 + HCl → CH 3 COOH + NH 4 Cl
5. Употреба реагенс Грињард
R-MgBr + CO 2 →R-COO-MgBr H2O→ R-COOH + Mg(OH)Br
ПРИМЕНА НА КАРБОКСИЛНИ КИСЕЛИНИ
Мравја киселина– во медицината - мравја алкохол (1,25% алкохолен раствор на мравја киселина), во пчеларството, во органската синтеза, во производството на растворувачи и конзерванси; како силно средство за намалување.
Оцетна киселина– во прехранбената и хемиската индустрија (производство на целулоза ацетат, од кој се произведуваат ацетатни влакна, органско стакло, филм; за синтеза на бои, лекови и естри). Во домаќинството како арома и конзерванс супстанција.
Бутирна киселина– за производство на ароматични адитиви, пластификатори и реагенси за флотација.
Оксална киселина– во металуршката индустрија (дескалирање).
Стеарик C17H35COOH и палмитични киселина C 15 H 31 COOH – како сурфактанти, лубриканти во обработката на метали.
Олеинска киселина C 17 H 33 COOH е флотациски реагенс и колектор за збогатување на руди од обоени метали.
Поединечни претставници
монобазни заситени карбоксилни киселини
Мравја киселина
првпат беше изолиран во 17 век од црвените шумски мравки. Се наоѓа и во сокот од коприва. Безводна мравја киселина е безбојна течност со лут мирис и лут вкус што предизвикува изгореници на кожата. Се користи во текстилната индустрија како средство за боење ткаенини, за потемнување на кожа, а исто така и за разни синтези.
Оцетна киселина
широко распространета во природата - се наоѓа во животинските екскрети (урина, жолчка, измет), во растенијата (во зелените лисја). Се формира при ферментација, гниење, киселење на виното, пивото, а се наоѓа во киселото млеко и сирењето. Точката на топење на безводната оцетна киселина е + 16,5°C, нејзините кристали се проѕирни како мраз, поради што се нарекува глацијална оцетна киселина. За прв пат е добиен на крајот на 18 век од рускиот научник Т. Е. Ловиц. Природниот оцет содржи околу 5% оцетна киселина. Од него се подготвува оцетна суштина, која се користи во Прехранбена индустријаза конзервирање зеленчук, печурки, риба. Оцетната киселина е широко користена во хемиската индустрија за различни синтези.
Претставници на ароматични и незаситени карбоксилни киселини
Бензоева киселина
C 6 H 5 COOH е најважниот претставник на ароматичните киселини. Распространети во природата во флора: во мелеми, темјан, есенцијални масла. Кај животинските организми се наоѓа во производите на разградување на протеинските материи. Ова кристална супстанција, точка на топење 122°C, лесно се возвишува. Слабо се раствора во ладна вода. Добро се раствора во алкохол и етер.
Незаситени незаситени киселини со една двојна врска во молекулата имаат општата формула C n H 2 n -1 COOH.
Незаситени киселини со висока молекуларна тежина
често спомнати од нутриционистите (тие ги нарекуваат незаситени). Најчестиот од нив е олеинска
CH 3 –(CH 2) 7 –CH=CH–(CH 2) 7 –COOH или C 17 H 33 COOH. Тоа е безбојна течност која се стврднува на студ.
Полинезаситените киселини со неколку двојни врски се особено важни: линоленски
CH 3 –(CH 2) 4 –(CH=CH–CH 2) 2 –(CH 2) 6 –COOH или C 17 H 31 COOH со две двојни врски, линоленска
CH 3 –CH 2 –(CH=CH–CH 2) 3 –(CH 2) 6 –COOH или C 17 H 29 COOH со три двојни врски и арахидонска
CH 3 –(CH 2) 4 –(CH=CH–CH 2) 4 –(CH 2) 2 –COOH со четири двојни врски; тие често се нарекуваат есенцијални масни киселини. Токму овие киселини имаат најголема биолошка активност: тие учествуваат во трансферот и метаболизмот на холестеролот, синтезата на простагландини и други витални материи и ја одржуваат структурата клеточните мембрани, се неопходни за функционирање на визуелниот апарат и нервен систем, влијаат на имунолошкиот систем. Отсуството на овие киселини во храната го инхибира растот на животните, ја инхибира нивната репродуктивна функција и предизвикува разни болести. Човечкиот организам не може сам да ги синтетизира линолните и линоленските киселини и мора да ги прима готови со храна (како витамини). За синтеза на арахидонска киселина во телото, неопходна е линолеинска киселина. Полинезаситените масни киселини со 18 јаглеродни атоми во вид на естери на глицерол се наоѓаат во таканаречените масла за сушење - ленено семе, коноп, афион итн. Линолеинска киселина C17H31COOH и линоленска киселина C 17 H 29 COOH се дел од растителни масла. На пример, маслото од ленено семе содржи околу 25% линоленска киселина и до 58% линоленска киселина.
Сорбинска киселина (2,4-хексадиенонска) киселина CH 3 –CH=CH–CH=CHCOOH е добиена од бобинки од роуан (сорбус на латински). Оваа киселина е одличен конзерванс, така што бобинките од роуан не стануваат мувлосани.
Наједноставната незаситена киселина, акрилик CH 2 = CHCOOH, има лут мирис (на латински acris - лут, лут). Акрилати (естери на акрилна киселина) се користат за производство на органско стакло, а неговиот нитрил (акрилонитрил) се користи за производство на синтетички влакна.
При именување на новоизолираните киселини, хемичарите често ѝ даваат слобода на нивната имагинација. Така, името на најблискиот хомолог на акрилна киселина, кротон
CH 3 – CH = CH – COOH, воопшто не доаѓа од крт, туку од растение Кротон тиглиум, од чие масло е изолирано. Синтетичкиот изомер на кротонската киселина е многу важен - метакрилна киселина CH 2 = C (CH 3) – COOH од чиј естер (метил метакрилат), како и од метил акрилат се прави проѕирна пластика - плексиглас.
Незаситен јаглерод киселините се способни за реакции на додавање:
CH 2 = CH-COOH + H 2 → CH 3 -CH 2 -COOH
CH 2 =CH-COOH + Cl 2 → CH 2 Cl -CHCl -COOH
ВИДЕО:
CH 2 =CH-COOH + HCl → CH 2 Cl -CH 2 -COOH
CH 2 = CH-COOH + H 2 O → HO-CH 2 -CH 2 -COOH
Последните две реакции одат против владеењето на Марковников.
Незаситените карбоксилни киселини и нивните деривати се способни за реакции на полимеризација.