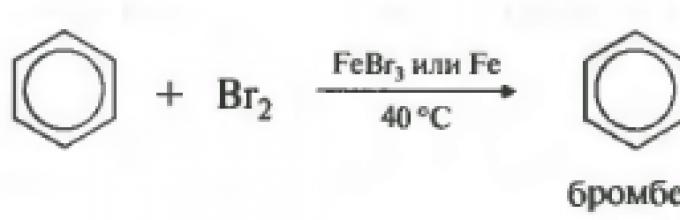Првата група на реакции се реакции на супституција. Рековме дека арените немаат повеќекратни врски во структурата на молекулата, туку содржат конјугиран систем од шест електрони, кој е многу стабилен и му дава дополнителна цврстина на бензенскиот прстен. Затоа, во хемиските реакции прво се случува замена на атомите на водород, а не уништување на бензенскиот прстен.
Веќе наидовме на реакции на супституција кога зборуваме за алканите, но за нив овие реакции се одвиваа според радикален механизам, а за арените јонски механизамреакции на замена.
Првохемиско својство халогенација. Замена на атом на водород со атом на халоген, хлор или бром.
Реакцијата се јавува кога се загрева и секогаш со учество на катализатор. Во случај на хлор, тоа може да биде алуминиум хлорид или железен хлорид три. Катализаторот ја поларизира молекулата на халоген, предизвикувајќи раскинување на хетеролитичката врска и производство на јони.
Хлорот е позитивно наелектризиран јон и реагира со бензен.
Ако реакцијата се случи со бром, тогаш катализатор е железо бромид или алуминиум бромид.

Важно е да се напомене дека реакцијата се случува со молекуларен бром, а не со бром вода. Бензенот не реагира со бромната вода.
Халогенацијата на бензенските хомолози има свои карактеристики. Во молекулата на толуен, метил групата ја олеснува супституцијата во прстенот, реактивностсе зголемува, а реакцијата се јавува при поблаги услови, односно на собна температура.

Важно е да се напомене дека супституцијата секогаш се случува во орто и пара позициите, па се добива мешавина од изомери.
Второособина нитрација на бензенот, внесување на нитро група во бензенскиот прстен.

Тешка жолтеникава течност со мирис на горчливи бадеми се формира нитробензен, така што реакцијата може да биде квалитативна на бензен. За нитрација, се користи нитрациона смеса од концентрирани азотни и сулфурни киселини. Реакцијата се изведува со загревање.
Да ве потсетам дека за нитрирање на алканите во реакцијата на Коновалов се користела разредена азотна киселина без додавање на сулфурна киселина.
При нитрирање на толуенот, како и при халогенација, се формира мешавина од орто- и пара-изомери.

Третоособина алкилација на бензенот со халоалкани.

Оваа реакција овозможува внесување на јаглеводороден радикал во бензенскиот прстен и може да се смета за метод за производство на бензен хомолози. Алуминиум хлоридот се користи како катализатор, кој го промовира распаѓањето на молекулата на халоалкан во јони. Неопходно е и греење.
Четвртоособина алкилација на бензенот со алкени.

На овој начин можете да добиете, на пример, кумен или етилбензен. Катализатор алуминиум хлорид.
2. Реакции на додавање на бензен
Втората група на реакции се реакции на додавање. Рековме дека овие реакции не се типични, но тие се можни под прилично строги услови со уништување на пи-електронскиот облак и формирање на шест сигма врски.
Петтосвојство во генералниот список хидрогенизација, додавање на водород.

Температура, притисок, катализатор никел или платина. Толуенот може да реагира на ист начин.
Шестосопственост хлорирање. Ве молиме имајте предвид дека зборуваме конкретно за интеракција со хлор, бидејќи бромот не влегува во оваа реакција.

Реакцијата се јавува под силно ултравиолетово зрачење. Се формира хексахлороциклохексан, друго име за хексахлоран, цврста супстанција.
Важно е да се запамети дека за бензен не е можнореакции на додавање на водородни халиди (хидрохалогенација) и додавање вода (хидратација).
3. Замена во страничниот синџир на бензен хомолози
Третата група реакции се однесува само на бензен хомолози - ова е замена во страничниот синџир.
Седмосвојство во општата листа халогенација на алфа јаглеродниот атом во страничниот синџир.

Реакцијата се јавува кога се загрева или зрачи и секогаш само на алфа јаглеродот. Како што продолжува халогенацијата, вториот атом на халоген ќе се врати во алфа положбата.
4. Оксидација на бензен хомолози
Четвртата група на реакции е оксидација.
Бензенскиот прстен е премногу силен, па бензен не оксидиракалиум перманганат не го обезбојува неговиот раствор. Ова е многу важно да се запамети.
Но, хомолозите на бензенот се оксидираат со закиселен раствор на калиум перманганат кога се загреваат. И ова е осмо хемиско својство.

Ова произведува бензоева киселина. Се забележува промена на бојата на растворот. Во овој случај, без разлика колку е долг јаглеродниот синџир на супституентот, тој секогаш се прекинува по првиот јаглероден атом и алфа-атомот се оксидира до карбоксилна група со формирање на бензоева киселина. Остатокот од молекулата се оксидира до соодветната киселина или, ако е само еден јаглероден атом, до јаглерод диоксид.
Ако хомологот на бензен има повеќе од еден јаглеводороден супституент на ароматичниот прстен, тогаш оксидацијата се јавува според истите правила - јаглеродот што се наоѓа во положбата алфа се оксидира.

ВО во овој примерсе добива двобазна ароматична киселина која се нарекува фтална киселина.
Особено би сакал да ја забележам оксидацијата на кумен, изопропилбензен, со кислород во атмосферата во присуство на сулфурна киселина.

Ова е таканаречениот кумен метод за производство на фенол. Како по правило, оваа реакција се среќава во прашања поврзани со производството на фенол. Ова е индустриски метод.
Деветтисогорување на имотот, целосна оксидација со кислород. Бензенот и неговите хомолози согоруваат до јаглерод диоксид и вода.
Да ја напишеме равенката на согорување на бензенот во општа форма.
Според законот за зачувување на масата, лево треба да има онолку атоми колку што има десно. Бидејќи во хемиските реакции, атомите не исчезнуваат, туку редоследот на врските меѓу нив едноставно се менува. Значи, ќе има онолку молекули на јаглерод диоксид колку што има јаглеродни атоми во молекулата на аренот, бидејќи молекулата содржи еден јаглероден атом. Тоа е, n молекули на CO 2. Ќе има два пати помалку молекули на вода од атоми на водород, што е (2n-6)/2, што значи n-3.
Има ист број на атоми на кислород лево и десно. На десната страна има 2n од јаглерод диоксид, бидејќи секоја молекула има два атоми на кислород, плус n-3 од водата, за вкупно 3n-3. На левата страна има ист број на атоми на кислород 3n-3, што значи дека има два пати помалку молекули, бидејќи молекулата содржи два атома. Тоа е (3n-3)/2 молекули на кислород.
Така, составивме равенка за согорување на бензен хомолози во општа форма.
ПРТСВШ (Ф) Сојузна државна буџетска образовна институција за високо професионално образование
Одделот за заштита од пожари
Тест
во дисциплината „Теорија на согорување и експлозии“
Задача бр. 1
Определете ги специфичните теоретски количини и волумен на воздух потребни за целосно согорување на пареата на бензен. Условите во кои се наоѓа воздухот се карактеризираат со температура Tb и притисок Pb, а пареата на бензен со температура Tg и притисок Pg. Резултатите од пресметката изразете ги во следните единици: ; ;;;
Почетни податоци (N - број на група, n - број според списокот на ученици:
ТВ=300+(-1) N *2*N-(-1) n *0,2*n= 277,6 К
Рв=?10 3 =95900 Па;
Tg=300?(?1) N?2?N?(?1) n?0,2?n= 321,6 K;
Рr=?10 3 =79400 Pa.
С6Н6+7,5О2+7,5?3,76N2=6CO2+3pO+7,5?3,76N2+Qp (1),
каде што Qр е топлината на хемиската реакција. Од оваа равенка можеме да ги одредиме стехиометриските коефициенти на бензенот и молекуларниот кислород: Vg = 1, V0 = 7,5
2. Специфично теоретско количество воздух - бројот на киломоли воздух кои се неопходни за целосно согорување на еден киломол бензен, пресметан со формулата:
каде што 4,76 е количината на воздух што содржи единечна количина на кислород, = е односот на стехиометриските коефициенти на молекуларниот кислород (Vo) и бензенот (Vg)
Заменувајќи ги вредностите на Vo и Vg во (d), добиваме:
3. Волуменот на воздух потребен за целосно согорување на еден киломол бензен се одредува на следниов начин:
каде е волуменот на еден киломол воздух при температура Тb и притисок Рв. Вредноста се пресметува со формулата
каде што 22,4 е моларниот волумен на гасот во нормални услови, Po = 101325 Pa - нормален притисок, До = 273 K - нормална температура.
Заменувајќи го TV, To, Pv, Po во (5), добиваме
Специфичниот теоретски волумен на воздух се пресметува со формулата (4):
4. Волуменот на воздух потребен за целосно согорување на единица волумен на гасовито гориво се одредува на следниов начин:
каде е волуменот на еден киломол гориво - бензенска пареа при температура Tg и притисок Стр. Со оглед на тоа
и заменувајќи ги (8) и (5) во (7), го добиваме следниов израз за специфичниот теоретски волумен на воздух:
Ја пресметуваме вредноста на овој параметар на процесот на согорување:
Волуменот на воздух потребен за целосно согорување на еден килограм бензен се одредува на следниов начин:
каде е моларната маса на горивото - масата на еден киломол бензен, изразена во килограми. Моларната маса на бензенот е нумерички еднаква на неговата молекуларна тежина, пронајдена со формулата:
Ac?nc+An?nn, УiAi?ni (11)
каде што Ac и An се атомските тежини на јаглерод и водород, nc и nn се броевите на јаглеродни атоми во молекулата на бензен. Заменувајќи ги вредностите Ac = 12, nc = 6, An = 1, nn = 6, добиваме:
Специфичниот теоретски волумен на воздух го наоѓаме со замена на вредностите на n во и во формулата (10):
Резултат од пресметката:
Задача бр. 2
Да се определи специфичното теоретско количество, волумен и состав на производите за согорување на бензен, ако се познати коефициентот на вишок воздух b, температурата Tp и притисокот Pp на производите од согорувањето, температурата Tg и притисокот Pg на пареата на бензенот. Резултатите од пресметката изразете ги во молови фракции (процент) и во следните единици: ; ;;
Првични податоци:
в=1,5+(?1) N ?0,1?N?(?1) n?0,01?n = 0,2;
Рп=?10 3 = 68400 Па;
Тп=1600?(?1) N ?20?N?(?1) n ?2?n = 1816 K;
Tg=273?(?1) N?2?N+(?1) n?0,2?n = 295,4 K;
Рг=?10 3 = 111600 Па;
раствор (N=11, n=2).
1. Да ја напишеме стехиометриската равенка за реакцијата на согорување на бензенот во воздухот:
C 6 H 6 +7,5O 2 +7,5?3,76N 2 =6CO 2 +3H 2 O + 7,5?3,76N 2 +Qp, (1)
каде што Qp е топлината на хемиската реакција. Од оваа равенка ги одредуваме следните стехиометриски коефициенти:
V CO2 =6, V pO =3, V C6H6 =1, V O2 =7,5, V N2 =7,5?3,76
2. Определете ја проценетата количина на производи од согорување на еден киломол гориво:
Заменувајќи ги во (2) вредностите на стехиометриските коефициенти на производи од согорување и гориво, добиваме:
3. Специфичното теоретско количество воздух - бројот на киломоли воздух потребни за целосно согорување на еден киломол гориво, се одредува со формулата:
Каде што 4,76 е количината на воздух што содржи единица количина на кислород,
Однос на стехиометриски коефициенти на молекуларен кислород и бензен.
Заменувајќи ги во (4) вредностите V O2 =7,5 и V C6H6 =1, добиваме:
4. Вишокот на воздух на 1 Kmol гориво се одредува со изразот:
воздух за согорување на бензен пареа
Замена на вредности во овој израз
37,7(0,2-1)=30,16(7)
5. Вкупната количина на производи од согорување по единица количина на горивна супстанција се определува со збирот:
Откако ќе ги замениме вредностите и добиваме:
6. Кртовите фракции на производите за согорување, изразени во проценти, се одредуваат на следниов начин:
Во формулите (9) за моловите фракции на азот и кислород во производите на согорување, 0,79 и 0,21 се моловите фракции на овие супстанции во воздухот, чиј вишок доведува до зголемување на процентот на азот и појава на кислород. во производите за согорување.
7. За да се одредат специфичните волумени и производите на согорување, потребно е да се пресмета нивниот моларен волумен - волумен од еден киломол гас под условите во кои се наоѓаат производите:
каде што 22,4 е волумен на еден киломол гас во нормални услови, T 0 = 273 K е нормална температура, Po = 101325 Pa е нормален притисок.
Заменувајќи ги вредностите Po, To во (10), добиваме:
Обемот на производи што се формираат при согорување на еден килограм гориво, без да се земе предвид вишокот воздух, се пресметува на следниов начин:
каде е моларната маса на горивото - масата на еден киломол бензен, изразена во килограми. Моларната маса на бензен се наоѓа со формулата:
каде што Ac и An се атомските тежини на јаглеродот (12) и водородот (1), nc и n n се броевите на атоми на јаглерод (6) и водород (6) во молекулите на бензен (C 6 H 6).
Заменувајќи ги вредностите и во (12) добиваме
Вишокот на воздух на 1 килограм гориво се одредува на следниов начин:
каде е волуменот на еден киломол вишок воздух, кој е дел од производите за согорување. Бидејќи температурата и притисокот на вишокот воздух одговараат на температурата и притисокот на производите од согорувањето, тогаш = =220,7.
Заменувајќи ја оваа вредност, како и во (14), добиваме:
За да се пресмета специфичниот волумен на производи од целосно согорување на горивото, ќе претпоставиме дека пареата на бензен има температура Tg при притисок:
каде е волуменот на еден киломол бензен пареа при температура Tg и притисок Pg. Моларниот волумен на гориво се пресметува со формулата:
Заменувајќи ја добиената вредност и таквите вредности во (17), добиваме:
Вишокот на волумен на воздух на кубен метар бензен пареа се одредува на следниов начин:
Замена во (20) вредности = 30,16 , = и
го дава следниот резултат:
Вкупниот специфичен волумен на производи за согорување, земајќи го предвид вишокот воздух, се одредува со збирот
Резултат од пресметката:
X CO2 = %; X H2O = 4,4%; X N2 =%; X O2 = 11,7%
Слични документи
Пресметка на коефициентот на запаливост на нитробензен C6H5NO2 и јаглерод дисулфид CS2. Равенка за реакција на согорување на пропил ацетат во воздух. Пресметка на волуменот на воздухот и производите на согорување при согорување на запалив гас. Определување на точката на палење на толуен со помош на формулата на В. Блинов.
тест, додаден 04/08/2017
Пресметка на волуменот на воздухот и производите од согорување формирани за време на согорувањето на супстанцијата. Равенка за реакција на согорување на етилен гликол во воздух. Согорување на мешавина на запаливи гасови. Пресметка на адијабатска температура на согорување за стехиометриска смеса. Согорување на пропанол.
тест, додаден на 17.10.2012 година
Вид на согорување и неговите главни параметри. Хемиска трансформација на гориво и оксидатор во производи за согорување. Равенки на материјална и топлинска рамнотежа на реакцијата на согорување. Влијанието на коефициентот на вишок воздух врз составот на производите на согорување и температурата на согорувањето.
тест, додаден на 17.01.2013 година
Одредување на волуменот на воздухот потребен за целосно согорување на единица маса на запалива супстанција. Состав на производи за согорување по единица маса на запалива материја. Граници на ширење на пламенот на мешавини на гас, пареа, прашина-воздух. Експлозивен притисок на распаѓање.
работа на курсот, додадена 23.12.2013 година
Изработка на мерки за спречување на појава на пожари и експлозии, проценка на условите за нивен развој и сузбивање. Концептот на стапката на исцрпеност, методот на негово одредување. Постапката за составување на равенката за реакција на согорување. Пресметка на волуменот на воздухот потребен за согорување.
работа на курсот, додадена 07/10/2014
Одредување на составот на производите од целосно согорување на гас. Пресметка на адијабатската температура на согорување на мешавина на гас при постојан волумен и постојан притисок. Кинетичките константи на реакцијата на спонтано согорување на природниот гас. Граница на запаливост на мешавината на гас.
работа на курсот, додадена на 19.02.2014 година
Карактеристики на индустриските методи за алкилирање на бензен со пропилен. Принципи на алкилација на бензен со олефини во хемиска технологија. Проблеми на дизајнирање постројки за процес на бензен алкилација. Опис на технологијата на производниот процес.
теза, додадена 15.11.2010
Согорувањето како моќен процес на оксидација. Видови на согорување: тлеење и согорување со пламен. Експлозија како посебен случајсогорување. Електрични својствапламен. Разновидни производи за согорување како последица на нецелосно согорување на горивото. Филтрирање на чад низ вода.
научна работа, додадена 29.07.2009 година
Одредување на волуменот на воздухот потребен за целосно согорување на дадена количина на пропан. Пресметка на промените во енталпијата, ентропијата и енергијата на Гибс, користејќи последици од Хесовиот закон. Дефиниција моларни масиеквиваленти на оксидирачки и редукционен агенс.
тест, додаден 02/08/2012
Методи за одредување на потрошувачката на масло за апсорпција, концентрацијата на бензен во апсорпционото масло што го напушта апсорберот. Пресметка на дијаметарот и висината на спакуваниот апсорбер. Определување на потребната грејна површина во коцката на столбот и брзината на проток на грејната пареа.
Физички својства
Бензенот и неговите најблиски хомолози се безбојни течности со специфичен мирис. Ароматичните јаглеводороди се полесни од водата и не се раствораат во неа, но лесно се раствораат во органски растворувачи - алкохол, етер, ацетон.
Бензенот и неговите хомолози се самите добри растворувачи за многумина органска материја. Сите арени горат со зачаден пламен поради високата содржина на јаглерод во нивните молекули.
Физичките својства на некои арени се претставени во табелата.
Табела. Физички својства на некои арени
|
Име |
Формула |
t°.pl., |
т°.б.п., |
|
Бензен |
C6H6 |
5,5 |
80,1 |
|
Толуен (метилбензен) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
Етилбензен |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Ксилен (диметилбензен) |
C 6 H 4 (CH 3) 2 |
||
|
орто- |
25,18 |
144,41 |
|
|
мета- |
47,87 |
139,10 |
|
|
пар- |
13,26 |
138,35 |
|
|
Пропилбензен |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Кумен (изопропилбензен) |
C 6 H 5 CH (CH 3) 2 |
96,0 |
152,39 |
|
Стирен (винилбензен) |
C 6 H 5 CH = CH 2 |
30,6 |
145,2 |
Бензен – слабо вриење ( тбала= 80,1°C), безбојна течност, нерастворлива во вода
Внимание! Бензен – отров, влијае на бубрезите, ја менува формулата на крвта (со продолжено изложување), може да ја наруши структурата на хромозомите.
Повеќето ароматични јаглеводороди се опасни по живот и токсични.
Подготовка на арени (бензен и неговите хомолози)
Во лабораторијата
1. Спојување на соли на бензоева киселина со цврсти алкалии
C6H5-COONa + NaOH t → C 6 H 6 + Na 2 CO 3
натриум бензоат
2. Вурц-фитинг реакција: (тука G е халоген)
C 6Х 5 -G + 2Na + Р-Г →В 6 Х 5 - Р + 2 NaГ
СО 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
Во индустријата
- изолиран од нафта и јаглен со фракциона дестилација и реформирање;
- од јаглен катран и гас од печка за кокс
1. Дехидроциклизација на алканитесо повеќе од 6 јаглеродни атоми:
C6H14 т , кат→C 6 H 6 + 4H 2
2. Тримеризација на ацетилен(само за бензен) - Р. Зелински:
3С 2 H 2 600°В, Акт. јаглен→ C 6 H 6
3. Дехидрогенизацијациклохексан и неговите хомолози:
Советскиот академик Николај Дмитриевич Зелински утврдил дека бензенот се формира од циклохексан (дехидрогенизација на циклоалканите
C6H12 т, кат→C 6 H 6 + 3H 2

C6H11-CH3 т , кат→C 6 H 5 -CH 3 + 3H 2
метилциклохексантолуен
4. Алкилација на бензен(подготовка на бензен хомолози) – r Friedel-Crafts.
C 6 H 6 + C 2 H 5 -Cl t, AlCl3→C 6 H 5 -C 2 H 5 + HCl
хлороетан етилбензен

Хемиски својства на арените
Јас. ОКСИДАЦИСКИ РЕАКЦИИ
1. Согорување (пламен за чадење):
2C6H6 + 15O2 т→12CO 2 + 6H 2 O + Q
2. Во нормални услови, бензенот не ја обезбојува бромната вода и воден растворкалиум перманганат
3. Хомолозите на бензенот се оксидираат со калиум перманганат (обојува калиум перманганат):
А) во кисела средина до бензоева киселина
Кога хомолозите на бензенот се изложени на калиум перманганат и други силни оксидирачки агенси, страничните синџири се оксидираат. Колку и да е сложен ланецот на супституентот, тој се уништува, со исклучок на а-јаглеродниот атом, кој се оксидира во карбоксилна група.
Хомолозите на бензен со еден страничен синџир даваат бензоева киселина:
Хомолози кои содржат два странични синџири даваат двобазни киселини:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
Поедноставен :
C6H5-CH3+3O KMnO4→C 6 H 5 COOH + H 2 O
Б) во неутрални и малку алкални соли на бензоева киселина
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. РЕАКЦИИ НА ДОДАВАЊЕ (потврдо од алкените)
1. Халогенација
C 6 H 6 + 3Cl 2 ч ν → C 6 H 6 Cl 6 (хексахлороциклохексан - хексахлоран)
2. Хидрогенизација
C6H6 + 3H2 т , PtилиНи→C 6 H 12 (циклохексан)
3. Полимеризација
III. РЕАКЦИИ НА ЗАМЕНА – јонски механизам (полесни од алканите)
1. Халогенација -
а ) бензен
C6H6+Cl2 AlCl 3 → C 6 H 5 -Cl + HCl (хлоробензен)
C6H6 + 6Cl2 t,AlCl3→C 6 Cl 6 + 6HCl( хексахлоробензен)
C 6 H 6 + Br 2 t, FeCl3→ C 6 H 5 -Br + HBr( бромобензен)
б) бензен хомолози при зрачење или загревање
Хемиските својства на алкилните радикали се слични на алканите. Атомите на водород во нив се заменуваат со халоген со механизам на слободни радикали. Затоа, во отсуство на катализатор, при загревање или УВ зрачење, се јавува реакција на радикална супституција во страничниот синџир. Влијанието на бензенскиот прстен врз алкилните супституенти води до фактот дека Атомот на водород секогаш се заменува кај јаглеродниот атом директно поврзан со бензенскиот прстен (а-јаглероден атом).
1) C 6 H 5 -CH 3 + Cl 2 ч ν → C 6 H 5 -CH 2 -Cl + HCl
в) бензен хомолози во присуство на катализатор
C6H5-CH3 + Cl2 AlCl 3 → (орта смеса, пар деривати) +HCl
2. Нитрација (со азотни киселиниУф)
C 6 H 6 + HO-NO 2 t, H2SO4→C 6 H 5 -NO 2 + H 2 O
нитробензен - мирис бадеми!
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4→ СО H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-тринитротолуен (тол, ТНТ)
Примена на бензен и неговите хомолози
Бензен C 6 H 6 е добар растворувач. Бензенот како додаток го подобрува квалитетот на моторното гориво. Служи како суровина за производство на многу ароматични органски соединенија - нитробензен C 6 H 5 NO 2 (растворувач од кој се добива анилин), хлоробензен C 6 H 5 Cl, фенол C 6 H 5 OH, стирен итн.
Толуен C 6 H 5 – CH 3 – растворувач, кој се користи во производството на бои, лекови и експлозиви (ТНТ (ТНТ) или 2,4,6-тринитротолуен ТНТ).
Ксилени C6H4(CH3)2. Техничкиот ксилен е мешавина од три изомери ( орто-, мета- И пар-ксилени) – се користи како растворувач и почетен производ за синтеза на многу органски соединенија.
Изопропилбензен C 6 H 5 - CH(CH 3) 2 се користи за производство на фенол и ацетон.
Хлорирани деривати на бензенсе користи за заштита на растенијата. Така, производот на замена на атомите на H во бензен со атоми на хлор е хексахлоробензен C 6 Cl 6 - фунгицид; се користи за сув третман на семе од пченица и 'рж против мрзливост. Производот од додавање на хлор во бензен е хексахлороциклохексан (хексахлоран) C 6 H 6 Cl 6 - инсектицид; се користи за контрола на штетните инсекти. Споменатите супстанции се класифицирани како пестициди - хемикалииборба против микроорганизми, растенија и животни.
Стирен C 6 H 5 – CH = CH 2 многу лесно се полимеризира, формирајќи полистирен, а при кополимеризација со бутадиен, стирен-бутадиен гуми.
ВИДЕО ИСКУСТВА
Арените се ароматични јаглеводороди кои содржат еден или повеќе бензенски прстени. Бензенскиот прстен се состои од 6 јаглеродни атоми, меѓу кои наизменично се менуваат двојните и единечните врски.
Важно е да се забележи дека двојните врски во молекулата на бензенот не се фиксирани, туку постојано се движат во круг.
Арените се нарекуваат и ароматични јаглеводороди. Прв член хомологни серии- бензен - C 6 H 6. Општата формула на нивната хомологна серија е CnH2n-6.
За долго време структурна формулабензенот остана мистерија. Формулата предложена од Кекуле со две тројни врски не може да го објасни фактот дека бензенот не влегува во реакции на адиција. Како што споменавме погоре, според современите концепти, двојните врски во молекулата постојано се движат, па затоа е поправилно да се нацртаат во форма на прстен.
Поради двојните врски во молекулата на бензенот, се формира конјугација. Сите јаглеродни атоми се во состојба на sp 2 хибридизација. Агол на спојување - 120°.
Номенклатура и изомеризам на арените
Имињата на арените се формираат со додавање на имињата на супституентите на главниот синџир - бензенскиот прстен: бензен, метилбензен (толуен), етилбензен, пропилбензен итн. Замените, како и обично, се наведени по азбучен ред. Ако има неколку супституенти на бензенскиот прстен, тогаш се избира најкратката патека меѓу нив.

Арените се карактеризираат со структурен изомеризам поврзан со положбата на супституентите. На пример, два супституенти на бензен прстен може да се наоѓаат на различни позиции.
Позицијата на супституентите на бензенскиот прстен е именувана врз основа на нивната позиција во однос на едни со други. Се означува со префиксите орто-, мета- и пара. Подолу ќе најдете мнемонички совети за нивно успешно меморирање;)

Добивање арени
Арените се добиваат на неколку начини:

Хемиски својства на арените
Арените се ароматични јаглеводороди кои содржат бензен прстен со конјугирани двојни врски. Оваа карактеристика го отежнува настанувањето на реакциите на додавање (а сепак можни!)
Запомнете дека, за разлика од другите незаситени соединенија, бензенот и неговите хомолози не ја обезбојуваат водата од бром и растворот на калиум перманганат.

© Белевич Јури Сергеевич 2018-2020 година
Оваа статија е напишана од Јуриј Сергеевич Белевич и е негова интелектуална сопственост. Копирање, дистрибуција (вклучително и со копирање на други сајтови и ресурси на Интернет) или каква било друга употреба на информации и предмети без претходна согласност на носителот на авторските права е казниво со закон. За да добиете материјали за написите и дозвола да ги користите, ве молиме контактирајте
Ви претставуваме видео лекција посветена на темата „Хемиски својства на бензенот“. Користејќи го ова видео, можете да стекнете разбирање за хемиските својства на бензенот, како и за суровите услови потребни за бензенот да реагира со други супстанции.
Тема:Ароматични јаглеводороди
Лекција:Хемиски својства на бензенот
Ориз. 1. Молекула на бензен
Тешко е да се скрши р-електронскиот облак во молекула на бензен. Затоа, влегува бензенот хемиски реакциизначително помалку активни во споредба со незаситените соединенија.


За да може бензенот да влезе во хемиски реакции, потребни се прилично строги услови: покачена температура и во многу случаи, катализатор. Во повеќето реакции, стабилниот бензенски прстен се задржува.
1. Бромирање.

Потребен е катализатор (железо (III) или алуминиум бромид, па дури и мали количини на вода не се дозволени. Улогата на катализаторот е дека молекулата на бром е привлечена од еден од атомите на бром до атомот на железо. Како резултат на тоа, тој е поларизиран - пар на сврзувачки електрони оди до атомот на бром поврзан со железо:
Бр +…. Бр - 3 февруари .
Br+ е силен електрофил. Тој е привлечен од облакот од шест електрони на бензенскиот прстен и го распаѓа, формирајќи ковалентна врскасо јаглероден атом:
Бром анјон може да се приклучи на добиениот катјон. Но, намалувањето на ароматичниот систем на бензенскиот прстен е енергетски поповолно од додавањето на анјонот на бром. Затоа, молекулата оди во стабилна состојба, исфрлајќи водороден јон:
Сите реакции на електрофилна супституција во бензенскиот прстен се одвиваат со сличен механизам.
2. Нитрација

Бензенот и неговите хомолози реагираат со мешавина од концентрирана сулфурна и азотна киселина (нитрирачка смеса). Во смесата за нитрација, нитрониумскиот јон NO 2 + постои во рамнотежа, што е електрофил:

3. Сулфонација.
Бензенот и другите арени, кога се загреваат, реагираат со концентрирана сулфурна киселина или олеум - раствор на SO 3 во сулфурна киселина:

4 . Алкилација на Friedel-Crafts
5. Алкилација со алкени

Овие реакции се енергетски неповолни и затоа се јавуваат само кога се загреваат или зрачат.
1. Хидрогенизација.
Кога се загреваат, под висок притисок и во присуство на катализатор Ni, Pt или Pd, бензенот и другите арени додаваат водород за да формираат циклохексан:

2. Хлорирање на бензен.
Под влијание на ултравиолетовото зрачење, бензенот додава хлор. Ако кварцно стаклена колба која содржи раствор од хлор во бензен биде изложена на сончева светлина, растворот брзо ќе се обезбојува и хлорот ќе се комбинира со бензенот за да формира 1,2,3,4,5,6-хексахлороциклохексан, кој е познат како хексахлоран(претходно користен како инсектицид):

3. Согорување на бензен.
За разлика од алканите, бензенот и другите ароматични јаглеводороди имаат светол, зачаден пламен.
Сумирајќи ја лекцијата
Во оваа лекција ја проучувавте темата „Хемиски својства на бензенот“. Користејќи го овој материјал, можевте да стекнете разбирање за хемиските својства на бензенот, како и за суровите услови кои се неопходни за бензенот да реагира со други супстанции.
Библиографија
1. Руџитис Г.Е. Хемија. Основи општа хемија. 10-то одделение: учебник за образовните институции: основно ниво / G. E. Rudzitis, F.G. Фелдман. - 14-то издание. - М.: Образование, 2012 година.
2. Хемија. Одделение 10. Ниво на профил: тетратка за општо образование институции/ В.В. Еремин, Н.Е. Кузменко, В.В. Лунин и други - М.: Бустард, 2008. - 463 стр.
3. Хемија. 11 одделение. Ниво на профил: академски. за општо образование институции/ В.В. Еремин, Н.Е. Кузменко, В.В. Лунин и други - М.: Бустард, 2010. - 462 стр.
4. Хомченко Г.П., Хомченко И.Г. Збирка проблеми по хемија за оние кои влегуваат на универзитетите. - 4-то издание. - М.: РИА „Нов бран“: Издавач Умеренков, 2012. - 278 стр.
Домашна работа
1. Бр. 13, 14 (стр. 62) Руџитис Г.Е., Фелдман Ф.Г. Хемија: Органска хемија. 10-то одделение: учебник за општообразовни институции: основно ниво / Г. Е. Руџитис, Ф.Г. Фелдман. - 14-то издание. - М.: Образование, 2012 година.
2. Зошто ароматични соединенијадали тие се разликуваат по хемиски својства и од заситените и од незаситените јаглеводороди?
3. Напиши ги равенките за реакција за согорување на етилбензен и ксилен.