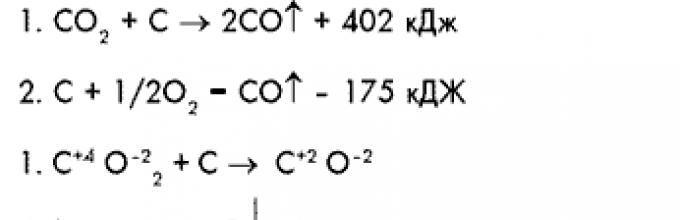Јаглеродни оксиди (II) и (IV)
Интегрирана лекција по хемија и биологија
Задачи:проучување и систематизирање на знаењата за јаглеродните оксиди (II) и (IV); ја откриваат врската меѓу живата и неживата природа; да се консолидираат знаењата за ефектот на јаглеродните оксиди врз човечкото тело; зајакнете ги вашите вештини за работа со лабораториска опрема.
Опрема:Раствор на HCl, лакмус, Ca(OH) 2, CaCO 3, стаклена прачка, домашна масичка, пренослива табла, модел со топка и стап.
ЗА ВРЕМЕ НА ЧАСОТ
Наставник по биологијаја соопштува темата и целите на часот.
Наставник по хемија.Врз основа на доктрината за ковалентни врски, составете електронски и структурна формулаоксиди на јаглерод (II) и (IV).
Хемиската формула на јаглерод моноксид (II) е CO, атомот на јаглерод е во нормална состојба.
Поради спарувањето на неспарените електрони, се формираат две поларни ковалентни врски, а третата ковалентна врска ја формира механизмот донор-акцептор. Донаторот е атом на кислород, бидејќи обезбедува бесплатен пар електрони; акцепторот е јаглероден атом, бидејќи обезбедува празна орбитала.
Во индустријата, јаглерод (II) моноксид се произведува со поминување на CO 2 преку врел јаглен на висока температура. Се формира и при согорување на јаглен со недостаток на кислород. ( Ученик ја запишува равенката на реакцијата на табла)

Во лабораторија, CO се произведува со дејство на концентриран H 2 SO 4 на мравја киселина. ( Равенката на реакцијата ја пишува наставникот.)
![]()
Наставник по биологија.Значи, се запознавте со производството на јаглерод моноксид (II). Какви физички својства има јаглерод моноксид (II)?
Студент.Тој е безбоен гас, отровен, без мирис, полесен од воздухот, слабо растворлив во вода, точка на вриење –191,5 °C, се зацврстува на –205 °C.
Наставник по хемија.Јаглерод моноксид во количини опасни за човечки живот, пронајден во автомобилските издувни гасови. Затоа, гаражите треба да бидат добро проветрени, особено при палење на моторот.
Наставник по биологија.Какво влијание има јаглерод моноксидот врз човечкото тело?
Студент.Јаглерод моноксидот е исклучително токсичен за луѓето - ова се објаснува со фактот дека формира карбоксихемоглобин. Карбоксихемоглобинот е многу силно соединение. Како резултат на неговото формирање, хемоглобинот во крвта не комуницира со кислород, а во случај на тешко труење, едно лице може да умре од кислородно гладување.
Наставник по биологија.Каква прва помош треба да добие лицето за труење со јаглерод моноксид?
Студенти.Потребно е да се повика брза помош, жртвата да се изнесе надвор, да се изврши вештачко дишење, а просторијата да биде добро проветрена.
Наставник по хемија.Напишете ја хемиската формула на јаглерод моноксид (IV) и, користејќи го моделот топка и стап, конструирајте ја неговата структура.
Јаглеродниот атом е во возбудена состојба. Сите четири се ковалентни поларни врскиформирана поради спарување на неспарени електрони. Меѓутоа, поради неговата линеарна структура, нејзината молекула како целина е неполарна.
Во индустријата, CO 2 се добива од распаѓање на калциум карбонат при производството на вар.
(Ученик ја запишува равенката на реакцијата.)
Во лабораторија, CO 2 се добива со реакција на киселини со креда или мермер.
(Учениците изведуваат лабораториски експеримент.)

Наставник по биологија.Кои процеси резултираат со формирање на јаглерод диоксид во телото?
Студент.Јаглерод диоксидот се формира во телото како резултат на реакции на оксидација органска материјавклучени во ќелијата.
(Учениците изведуваат лабораториски експеримент.)

Варовниот малтер се заматил бидејќи се формира калциум карбонат. Покрај процесот на дишење, CO2 се ослободува како резултат на ферментација и распаѓање.
Наставник по биологија.Дали физичката активност влијае на процесот на дишење?
Студент.Со прекумерен физички (мускулен) стрес, мускулите го користат кислородот побрзо отколку што крвта може да го достави, а потоа преку ферментација го синтетизираат АТП неопходен за нивната работа. Во мускулите се формира млечна киселина C 3 H 6 O 3, која влегува во крвта. Акумулацијата на големи количини на млечна киселина е штетна за организмот. По тешка физичка активност, продолжуваме да дишеме тешко извесно време - го отплаќаме „долгот за кислород“.
Наставник по хемија. Голем број наЈаглерод (IV) моноксид се ослободува во атмосферата кога се согоруваат фосилните горива. Дома користиме природен гас како гориво, а тој се состои од речиси 90% метан (CH 4). Поканувам еден од вас да оди на табла, да напише равенка за реакцијата и да ја анализира од гледна точка на оксидација-редукција.

Наставник по биологија.Зошто не можете да користите шпорети на гас за да ја загреете просторијата?
Студент.Метанот е составен дел на природниот гас. Кога гори, содржината на јаглерод диоксид во воздухот се зголемува и содржината на кислород се намалува. ( Работа со Содржината CO 2 во воздухот".)
Кога воздухот содржи 0,3% CO 2, едно лице доживува забрзано дишење; кај 10% - губење на свеста, кај 20% - инстантна парализа и брза смрт. На детето особено му треба чист воздух, бидејќи потрошувачката на кислород во ткивата на телото што расте е поголема од онаа на возрасен. Затоа, неопходно е редовно да се проветрува просторијата. Ако има вишок CO 2 во крвта, се зголемува ексцитабилноста на респираторниот центар и дишењето станува почесто и подлабоко.
Наставник по биологија.Да ја разгледаме улогата на јаглерод моноксид (IV) во животот на растенијата.
Студент.Кај растенијата, формирањето на органски материи се јавува од CO 2 и H 2 O на светлината; покрај органските материи, се формира и кислород.

![]()
Фотосинтезата го регулира количеството на јаглерод диоксид во атмосферата, што го спречува зголемувањето на температурата на планетата. Секоја година растенијата апсорбираат 300 милијарди тони јаглерод диоксид од атмосферата. Процесот на фотосинтеза ослободува 200 милијарди тони кислород во атмосферата годишно. Озонот се формира од кислород за време на грмотевици.
Наставник по хемија.Ајде да размислиме Хемиски својствајаглерод моноксид (IV).

Наставник по биологија.Која е важноста на јаглеродната киселина во човечкото тело за време на дишењето? ( Фрагмент од филмска лента.)
Ензимите во крвта го претвораат јаглеродниот диоксид во јаглеродна киселина, која се дисоцира во водородни и бикарбонати јони. Ако крвта содржи вишок на H + јони, т.е. ако киселоста на крвта е зголемена, тогаш некои од јоните H + се комбинираат со бикарбонатните јони, формирајќи јаглеродна киселина и со тоа ослободувајќи ја крвта од вишокот H + јони. Ако има премалку јони H + во крвта, тогаш јаглеродната киселина се дисоцира и концентрацијата на јони H + во крвта се зголемува. На температура од 37 °C, pH на крвта е 7,36.
Во телото, јаглерод диоксидот се транспортира преку крвта во форма на хемиски соединенија - натриум и калиум бикарбонати.
Поправање на материјалот
Тест
Од предложените процеси за размена на гасови во белите дробови и ткивата, оние што ја комплетираат првата опција мора да ги изберат шифрите на точните одговори на левата страна, а втората - на десната страна.
(1) Премин на О 2 од белите дробови во крвта. (13)
(2) Трансфер на О 2 од крвта во ткивата. (14)
(3) Транзиција на CO 2 од ткива во крв. (15)
(4) Премин на CO 2 од крвта во белите дробови. (16)
(5) Апсорпција на О2 од црвените крвни зрнца. (17)
(6) Ослободување на О 2 од црвените крвни зрнца. (18)
(7) Конверзија на артериска крв во венска крв. (19)
(8) Конверзија на венска крв во артериска крв. (20)
(9) Раскинување на хемиската врска на O 2 со хемоглобинот. (21)
(10) Хемиско врзување на O 2 за хемоглобинот. (22)
(11) Капилари во ткивата. (23)
(12) Белодробни капилари. (24)
Прашања за прва опција
1. Процеси на размена на гасови во ткивата.
2. Физички процеси при размена на гасови.
Прашања за втора опција
1.
Процеси на размена на гасови во белите дробови.
2. Хемиски процеси при размена на гасови
Задача
Да се определи волуменот на јаглерод моноксид (IV) што се ослободува при разградување на 50 g калциум карбонат.
Јаглерод
Во слободна состојба, јаглеродот формира 3 алотропни модификации: дијамант, графит и вештачки произведен карбин.
Во дијамантски кристал, секој јаглероден атом е поврзан со силни ковалентни врски со четири други поставени околу него на еднакви растојанија.
Сите јаглеродни атоми се во состојба на sp 3 хибридизација. Атомската кристална решетка од дијамант има тетраедрална структура.
Дијамантот е безбојна, проѕирна супстанција со силно прекршување. Има најголема цврстина меѓу сите познати супстанции. Дијамантот е кршлив, огноотпорен, слабо ја спроведува топлината и електрична енергија. Малите растојанија помеѓу соседните јаглеродни атоми (0,154 nm) ја одредуваат прилично високата густина на дијамантот (3,5 g/cm3).
ВО кристална решеткана графит, секој јаглероден атом е во состојба на sp 2 хибридизација и формира три силни ковалентни врскисо јаглеродни атоми сместени во истиот слој. Три електрони од секој јаглероден атом учествуваат во формирањето на овие врски, а четвртите валентни електрони формираат n-врски и се релативно слободни (подвижни). Тие ја одредуваат електричната и топлинската спроводливост на графитот.
Должината на ковалентната врска помеѓу соседните јаглеродни атоми во иста рамнина е 0,152 nm, а растојанието помеѓу атомите C во различни слоеви е 2,5 пати поголемо, така што врските меѓу нив се слаби.
Графитот е непроѕирна, мека, мрсна на допир супстанција со сиво-црна боја со метален сјај; добро спроведува топлина и електрична енергија. Графитот има помала густина во споредба со дијамантот и лесно се дели на тенки снегулки.
Нарушената структура на фино-кристалниот графит лежи во основата на структурата различни формиаморфен јаглерод, од кои најважни се кокс, кафеав и црн јаглен, саѓи, активен (активен) јаглерод.
Оваа алотропна модификација на јаглеродот се добива со каталитичка оксидација (дехидрополикондензација) на ацетилен. Carbyne е полимер со синџир кој доаѓа во две форми:
С=С-С=С-... и...=С=С=С=
Карбинот има полупроводнички својства.
При обични температури, двете модификации на јаглеродот (дијамант и графит) се хемиски инертни. Фино-кристалните форми на графит - кокс, саѓи, активен јаглен - се пореактивни, но, по правило, откако претходно ќе се загреат на висока температура.
1. Интеракција со кислород
C + O 2 = CO 2 + 393,5 kJ (во вишок O 2)
2C + O 2 = 2CO + 221 kJ (со недостаток на O 2)
Согорувањето на јагленот е еден од најважните извори на енергија.
2. Интеракција со флуор и сулфур.
C + 2F 2 = CF 4 јаглерод тетрафлуорид
C + 2S = CS 2 јаглерод дисулфид
3. Кока-колата е едно од најважните редуцирачки агенси кои се користат во индустријата. Во металургијата, се користи за добивање метали од оксиди, на пример:
ZS + Fe 2 O 3 = 2Fe + ZSO
C + ZnO = Zn + CO
4. Кога јаглеродот е во интеракција со оксидите на алкалните и земноалкалните метали, редуцираниот метал се комбинира со јаглеродот и формира карбид. На пример: 3S + CaO = CaC 2 + CO калциум карбид
5. Коксот се користи и за производство на силициум:
2C + SiO 2 = Si + 2СО
6. Ако има вишок на кокс, се формира силициум карбид (карборунд) SiC.
Производство на „воден гас“ (гасификација на цврсто гориво)
Со поминување на водена пареа низ врел јаглен, се добива запалива смеса од CO и H 2, наречена воден гас:
C + H 2 O = CO + H 2
7. Реакции со оксидирачки киселини.
Активиран или јагленкога се загрева, ги намалува анјоните NO 3 - и SO 4 2- од концентрирани киселини:
C + 4HNO 3 = CO 2 + 4NO 2 + 2H 2 O
C + 2H 2 SO 4 = CO 2 + 2SO 2 + 2H 2 O
8. Реакции со стопени нитрати алкални метали
При топење на KNO 3 и NaNO 3, кршен јаглен интензивно гори со формирање на блескав пламен:
5C + 4KNO 3 = 2K 2 CO 3 + ZCO 2 + 2N 2
1. Формирање на карбиди слични на сол со активни метали.
Значително слабеење на неметалните својства на јаглеродот се изразува во фактот што неговите функции како оксидирачки агенс се манифестираат во многу помала мера од неговите редукциони функции.
2. Само при реакции со активни метали атомите на јаглеродот се трансформираат во негативно наелектризирани јони C-4 и (C=C) 2-, формирајќи карбиди слични на сол:
ZS + 4Al = Al 4 C 3 алуминиум карбид
2C + Ca = CaC 2 калциум карбид
3. Карбиди јонски тип- многу нестабилни соединенија, тие лесно се распаѓаат под влијание на киселини и вода, што укажува на нестабилност на негативно наелектризираните јаглеродни анјони:
Al 4 C 3 + 12H 2 O = ZSN 4 + 4Al(OH) 3
CaC 2 + 2H 2 O = C 2 H 2 + Ca(OH) 2
4. Формирање на ковалентни соединенија со метали
Во топи мешавини од јаглерод со преодни металикарбидите се формираат главно од ковалентен типкомуникации. Нивните молекули имаат променлив состав, а супстанциите како целина се блиску до легурите. Таквите карбиди се многу стабилни; тие се хемиски инертни во однос на водата, киселините, алкалите и многу други реагенси.
5. Интеракција со водород
При високи T и P, во присуство на никел катализатор, јаглеродот се комбинира со водородот:
C + 2H 2 → CH 4
Реакцијата е многу реверзибилна и нема практично значење.
Јаглерод (II) моноксид– СО
(јаглерод моноксид, јаглерод моноксид, јаглерод моноксид)
Физички својства: безбоен, отровен гас, без вкус и мирис, гори со синкав пламен, полесен од воздухот, слабо растворлив во вода. Концентрацијата на јаглерод моноксид во воздухот е 12,5-74% експлозивна.
Потврда:
1) Во индустријата
C + O 2 = CO 2 + 402 kJ
CO 2 + C = 2CO – 175 kJ
Во генераторите на гас, водена пареа понекогаш се дува низ врел јаглен:
C + H 2 O = CO + H 2 - Q,
мешавина од CO + H 2 се нарекува синтезен гас.
2) Во лабораторија- термичко распаѓање на мравја или оксална киселина во присуство на H 2 SO 4 (конц.):
HCOOH t˚C, H2SO4 → H2O+CO
H2C2O4 t˚C, H2SO4 → CO + CO 2 + H 2 O
Хемиски својства:
Во нормални услови, CO е инертен;кога се загрева - средство за намалување;
CO - оксид што не формира сол.
1) со кислород
2C +2 O + O 2 t ˚ C → 2C +4 O 2
2) со метални оксиди CO + Me x O y = CO 2 + Me
C +2 O + CuO t ˚ C → Сu + C +4 O 2
3) со хлор (на светлина)
CO + Cl 2 светлина → COCl 2 (фосген - отровен гас)
4)* реагира со алкално топење (под притисок)
CO + NaOH P → HCOONa (натриум формат)
Ефектот на јаглерод моноксид врз живите организми:
Јаглерод моноксидот е опасен бидејќи ја спречува крвта да носи кислород до виталните органи како што се срцето и мозокот. Јаглерод моноксид се комбинира со хемоглобинот, кој носи кислород до клетките на телото, што го прави телото несоодветно за транспорт на кислород. Во зависност од количината што се вдишува, јаглерод моноксидот ја нарушува координацијата, ги влошува кардиоваскуларните заболувања и предизвикува замор, главоболки и слабост.Ефектот на јаглерод моноксидот врз здравјето на луѓето зависи од неговата концентрација и времето на изложување на телото. Концентрацијата на јаглерод моноксид во воздухот од повеќе од 0,1% доведува до смрт во рок од еден час, а концентрација од повеќе од 1,2% во рок од три минути.
Примени на јаглерод моноксид:
Јаглерод моноксид главно се користи како запалив гас помешан со азот, таканаречен генератор или воздушен гас или воден гас помешан со водород. Во металургијата за искористување на металите од нивните руди. Да се добијат метали со висока чистота од распаѓањето на карбонилите.
Јаглерод моноксид (IV) CO2 – јаглерод диоксид
Физички својства:Јаглерод диоксид, безбоен, без мирис, растворливост во вода - 0,9V CO 2 се раствора во 1V H 2 O (на нормални услови); потежок од воздухот; t°pl = -78,5°C (цврстиот CO 2 се нарекува „сув мраз“); не поддржува согорување.
Структура на молекулата:
Јаглерод диоксидот ги има следните електронски и структурни формули -
3. Согорување на супстанции што содржат јаглерод:
CH 4 + 2O 2 → 2H2O + CO2
4. Со бавна оксидација во биохемиските процеси (дишење, гниење, ферментација)
Хемиски својства:
Јаглерод диоксидот, познат и како 4, реагира со голем број супстанции, формирајќи соединенија кои се разликуваат по состав и хемиски својства. Која се состои од неполарни молекули, има многу слаби меѓумолекуларни врски и може да биде присутна само ако температурата е повисока од 31 Целзиусов степен. Јаглерод диоксид е хемиско соединение, кој се состои од еден јаглероден атом и два атоми на кислород.
Јаглерод моноксид 4: Формула и основни информации
Јаглерод диоксидот е присутен во ниски концентрации во атмосферата на Земјата и делува како стакленички гас. Неговиот хемиска формула CO2. На високи температури може да постои исклучиво во гасовита состојба. Во својата цврста состојба се нарекува сув мраз.
Јаглерод диоксидот е важна компонента на јаглеродниот циклус. Доаѓа од различни природни извори, вклучително и вулканско дегасирање, согорување на органска материја и респираторни процеси на живите аеробни организми. Антропогените извори на јаглерод диоксид главно доаѓаат од согорувањето на различни фосилни горива за производство и транспорт на електрична енергија.

Го произведуваат и разни микроорганизми од ферментација и клеточно дишење. Растенијата го претвораат јаглеродниот диоксид во кислород за време на процесот наречен фотосинтеза, користејќи јаглерод и кислород за да формираат јаглехидрати. Покрај тоа, растенијата исто така ослободуваат кислород во атмосферата, кој потоа се користи за дишење од хетеротрофни организми.
Јаглерод диоксид (CO2) во телото
Јаглерод моноксид 4 реагира со различни супстанциии е гасовит отпад од метаболизмот. Има повеќе од 90% од него во крвта во форма на бикарбонат (HCO 3). Остатокот е или растворен CO 2 или јаглеродна киселина (H2CO 3). Органите како што се црниот дроб и бубрезите се одговорни за балансирање на овие соединенија во крвта. Бикарбонат е Хемиска супстанција, кој делува како тампон. Ја одржува pH вредноста на крвта на потребното ниво, избегнувајќи зголемување на киселоста.

Структура и својства на јаглерод диоксид
Јаглерод диоксид (CO2) е хемиско соединение кое е гас кога собна температураи повисоко. Се состои од еден јаглероден атом и два атоми на кислород. Луѓето и животните испуштаат јаглерод диоксид при издишување. Покрај тоа, тој се формира секогаш кога нешто органско е изгорено. Растенијата користат јаглерод диоксид за производство на храна. Овој процес се нарекува фотосинтеза.
Својствата на јаглерод диоксид биле проучувани од шкотскиот научник Џозеф Блек уште во 1750-тите. способни да заробат топлинска енергија и да влијаат на климата и времето на нашата планета. Тоа е причина за глобалното затоплување и зголемување на температурата на површината на Земјата.

Биолошка улога
Јаглерод моноксидот 4 реагира со различни супстанции и е краен производ во организмите кои добиваат енергија од разградувањето на шеќери, масти и амино киселини. Познато е дека овој процес е карактеристичен за сите растенија, животни, многу габи и некои бактерии. Кај повисоките животни, јаглеродниот диоксид се движи во крвта од ткивата на телото до белите дробови, каде што се издишува. Растенијата го добиваат од атмосферата за употреба во фотосинтезата.
Сув мраз
Сув мраз или цврст јаглерод диоксид е цврста состојба на гасот CO 2 со температура од -78,5 °C. Оваа супстанца не се јавува природно во природата, туку ја произведува луѓето. Безбоен е и може да се користи при подготовка на газирани пијалоци, како разладен елемент во контејнери за сладолед и во козметологијата, на пример за замрзнување на брадавици. Пареата од сув мраз се задушува и може да предизвика смрт. Бидете внимателни и професионализам кога користите сув мраз.
Под нормален притисок нема да се стопи од течност, туку директно оди од цврста во гасна. Ова се нарекува сублимација. Ќе се промени директно од солиднана гас на која било температура што надминува екстремно ниски температури. Сувиот мраз се сублимира при нормална температура на воздухот. Така се ослободува јаглерод диоксид, кој е без мирис и боја. Јаглерод диоксидот може да се втечнува при притисок над 5,1 атм. Гасот што доаѓа од сувиот мраз е толку ладен што кога се меша со воздух, ја лади водената пареа во воздухот во магла што личи на густ бел чад.

Подготовка, хемиски својства и реакции
Во индустријата, јаглерод моноксид 4 се произведува на два начина:
- Со согорување на гориво (C + O 2 = CO 2).
- Со термичко разложување на варовникот (CaCO 3 = CaO + CO 2).
Добиениот волумен на јаглерод моноксид 4 се прочистува, се втечнува и се пумпа во специјални цилиндри.
Бидејќи е кисел, јаглерод моноксидот 4 реагира со супстанции како што се:
- Вода. Кога се раствора, се формира јаглеродна киселина (H 2 CO 3).
- Алкални раствори. Јаглерод моноксид 4 (формула CO 2) реагира со алкалии. Во овој случај, се формираат средни и кисели соли (NaHCO 3).
- Овие реакции произведуваат карбонатни соли (CaCO 3 и Na 2 CO 3).
- Јаглерод. Кога јаглерод моноксид 4 реагира со врел јаглен, се формира јаглерод моноксид 2 (јаглерод моноксид), кој може да предизвика труење. (CO 2 + C = 2CO).
- Магнезиум. Како по правило, јаглерод диоксидот не поддржува согорување; само при многу високи температури може да реагира со одредени метали. На пример, запалениот магнезиум ќе продолжи да гори во CO 2 за време на редокс реакција (2Mg + CO 2 = 2MgO + C).

Квалитативната реакција на јаглерод моноксид 4 се манифестира кога поминува низ варовничка вода (Ca(OH) 2 или низ баритна вода (Ba(OH) 2). Може да се забележат заматеност и врнежи. Ако продолжите да пропуштате јаглерод диоксид после ова водата повторно ќе стане бистра, бидејќи нерастворливите карбонати се претвораат во растворливи бикарбонати (киселински соли на јаглеродна киселина).

Јаглеродниот диоксид се произведува и со согорување на сите горива што содржат јаглерод, како што се метан (природен гас), нафтени дестилати (бензин, дизел, керозин, пропан), јаглен или дрво. Во повеќето случаи, се ослободува и вода.
Јаглерод диоксидот (јаглерод диоксид) се состои од еден јаглероден атом и два атоми на кислород, кои се држат заедно со ковалентни врски (или споделување на електрони). Чистиот јаглерод е многу редок. Во природата се јавува само во форма на минерали, графит и дијамант. И покрај ова, тој е градежен материјал на животот кој, кога се комбинира со водород и кислород, ги формира основните соединенија кои сочинуваат сè на планетата.

Јаглеводородите како јагленот, нафтата и природниот гас се соединенија направени од водород и јаглерод. Овој елемент се наоѓа во калцитот (CaCo 3), минералите во седиментните и метаморфните карпи, варовникот и мермерот. Тоа е елементот што ја содржи целата органска материја - од фосилни горива до ДНК.
Јаглерод (C)– типичен неметал; В периодниот системе во 2. период од IV група, главната подгрупа. Сериски број 6, Ar = 12,011 amu, нуклеарен полнеж +6.Физички својства:Јаглеродот формира многу алотропни модификации: дијамант- еден од повеќето цврсти материи, графит, јаглен, саѓи.
Јаглеродниот атом има 6 електрони: 1s 2 2s 2 2p 2 . Последните два електрони се наоѓаат во посебни р-орбитали и не се спарени. Во принцип, овој пар би можел да ја окупира истата орбитала, но во овој случај меѓуелектронската одбивност значително се зголемува. Поради оваа причина, еден од нив зема 2p x, а другиот, или 2p y , или 2p z орбитали.
Разликата во енергијата на поднивоата s и p на надворешниот слој е мала, така што атомот лесно оди во возбудена состојба, во која еден од двата електрони од орбиталата 2 преминува во слободна. 2 Бришење.Валентна состојба се појавува со конфигурација 1s 2 2s 1 2p x 1 2p y 1 2p z 1 . Токму оваа состојба на јаглеродниот атом е карактеристична за дијамантската решетка - тетраедарско просторно распоредување на хибридните орбитали, идентична должина и енергија на врските.
Познато е дека овој феномен се нарекува sp 3 -хибридизација,а функциите кои се појавуваат се sp 3 -хибридни . Формирањето на четири сп 3 врски му обезбедува на јаглеродниот атом постабилна состојба од три r-r-и една s-s-врска. Покрај хибридизацијата sp 3, хибридизацијата sp 2 и sp е забележана и кај јаглеродниот атом . Во првиот случај се јавува меѓусебно преклопување s-и две p-орбитали. Се формираат три еквивалентни sp 2 хибридни орбитали, сместени во иста рамнина под агол од 120° една до друга. Третата орбитала p е непроменета и е насочена нормално на рамнината sp2.

За време на sp хибридизацијата, орбиталите s и p се преклопуваат. Агол од 180° се јавува помеѓу двете еквивалентни хибридни орбитали кои се формираат, додека двете p-орбитали на секој атом остануваат непроменети.

Алотропија на јаглерод. Дијамант и графит
Во графитниот кристал, атомите на јаглеродот се наоѓаат во паралелни рамнини, зафаќајќи ги темињата на правилните шестоаголници. Секој јаглероден атом е поврзан со три соседни sp 2 хибридни врски. Врската помеѓу паралелните рамнини се изведува поради силите на Ван дер Валс. Слободните p-орбитали на секој атом се насочени нормално на рамнините на ковалентни врски. Нивното преклопување ја објаснува дополнителната π врска помеѓу јаглеродните атоми. Така, од валентната состојба во која се наоѓаат атомите на јаглерод во супстанцијата ги одредува својствата на оваа супстанца.
Хемиски својства на јаглеродот
Повеќето карактеристични степениоксидација: +4, +2.
На ниски температуријаглеродот е инертен, но кога се загрева неговата активност се зголемува.
Јаглеродот како средство за намалување:
- со кислород
C 0 + O 2 – t° = CO 2 јаглерод диоксид
со недостаток на кислород - нецелосно согорување:
2C 0 + O 2 – t° = 2C +2 O јаглерод моноксид
- со флуор
C + 2F 2 = CF 4
- со водена пареа
C 0 + H 2 O – 1200° = C +2 O + H 2 воден гас
- со метални оксиди. Така се топи металот од руда.
C 0 + 2CuO – t° = 2Cu + C +4 O 2
- со киселини - оксидирачки агенси:
C 0 + 2H 2 SO 4 (конк.) = C +4 O 2 + 2SO 2 + 2H 2 O
C 0 + 4HNO 3 (конк.) = C +4 O 2 + 4NO 2 + 2H 2 O
- формира јаглерод дисулфид со сулфур:
C + 2S 2 = CS 2.
Јаглеродот како оксидирачки агенс:
- формира карбиди со некои метали
4Al + 3C 0 = Al 4 C 3
Ca + 2C 0 = CaC 2 -4
- со водород - метан (како и огромна количина органски соединенија)
C0 + 2H2 = CH4
— со силициум, формира карборунд (на 2000 °C во електрична печка):
Пронаоѓање на јаглерод во природата
Слободниот јаглерод се јавува во форма на дијамант и графит. Во форма на соединенија, јаглеродот се наоѓа во минералите: креда, мермер, варовник - CaCO 3, доломит - MgCO 3 *CaCO 3; хидрокарбонати - Mg(HCO 3) 2 и Ca(HCO 3) 2, CO 2 е дел од воздухот; јаглеродот е главен составен делприродни органски соединенија - гас, нафта, јаглен, тресет, е дел од органски материи, протеини, масти, јаглени хидрати, амино киселини кои ги сочинуваат живите организми.

Неоргански јаглеродни соединенија
Ниту јоните C4+ ниту C4- не се формираат за време на некои конвенционални хемиски процеси: јаглеродните соединенија содржат ковалентни врски со различни поларитети.
Јаглерод моноксид CO
Јаглерод моноксид; безбоен, без мирис, малку растворлив во вода, растворлив во органски растворувачи, токсичен, точка на вриење = -192°C; t pl. = -205°C.
Потврда
1) Во индустријата (во генераторите на гас):
C + O 2 = CO 2
2) Во лабораторија - термичко распаѓање на мравја или оксална киселина во присуство на H 2 SO 4 (конц.):
HCOOH = H2O + CO
H 2 C 2 O 4 = CO + CO 2 + H 2 O
Хемиски својства
Во нормални услови, CO е инертен; кога се загрева - средство за намалување; оксид што не создава сол.
1) со кислород
2C +2 O + O 2 = 2C +4 O 2
2) со метални оксиди
C +2 O + CuO = Cu + C +4 O 2
3) со хлор (на светлина)
CO + Cl 2 - hn = COCl 2 (фосген)
4) реагира со алкално топење (под притисок)
CO + NaOH = HCOONa (натриум формат)
5) формира карбонили со преодни метали
Ni + 4CO – t° = Ni(CO) 4
Fe + 5CO – t° = Fe(CO) 5
Јаглерод моноксид (IV) CO2
Јаглерод диоксид, безбоен, без мирис, растворливост во вода - 0,9V CO 2 се раствора во 1V H 2 O (во нормални услови); потежок од воздухот; t°pl = -78,5°C (цврстиот CO 2 се нарекува „сув мраз“); не поддржува согорување.
Потврда
- Термичко разложување на соли на јаглеродна киселина (карбонати). Печење на варовник:
CaCO 3 – t° = CaO + CO 2
- Акција силни киселиниза карбонати и бикарбонати:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2
NaHCO 3 + HCl = NaCl + H 2 O + CO 2
ХемискисвојстваCO2
Киселински оксид: реагира со основните оксиди и бази за да формира соли на јаглеродна киселина
Na 2 O + CO 2 = Na 2 CO 3
2NaOH + CO 2 = Na 2 CO 3 + H 2 O
NaOH + CO 2 = NaHCO 3
На покачени температури може да покаже оксидирачки својства
C +4 O 2 + 2Mg – t° = 2Mg +2 O + C 0
Квалитативна реакција
Облачност на варова вода:
Ca(OH) 2 + CO 2 = CaCO 3 ¯ (бел талог) + H 2 O
Исчезнува кога CO 2 се минува низ варова вода подолго време, бидејќи нерастворливиот калциум карбонат се претвора во растворлив бикарбонат:
CaCO 3 + H 2 O + CO 2 = Ca (HCO 3) 2
Јаглеродна киселина и нејзинитесол
H 2CO 3 -Слаба киселина, постои само во воден раствор:
CO 2 + H 2 O ↔ H 2 CO 3
Дибазик:
H 2 CO 3 ↔ H + + HCO 3 - Киселини соли- бикарбонати, хидрокарбонати
HCO 3 - ↔ H + + CO 3 2- Средни соли - карбонати
Карактеристични се сите својства на киселините.
Карбонатите и бикарбонатите можат да се трансформираат едни во други:
2NaHCO 3 – t° = Na 2 CO 3 + H 2 O + CO 2
Na 2 CO 3 + H 2 O + CO 2 = 2NaHCO 3
Металните карбонати (освен алкалните метали) декарбоксилираат кога се загреваат за да формираат оксид:
CuCO 3 – t° = CuO + CO 2
Квалитативна реакција- „врие“ под влијание на силна киселина:
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2
CO 3 2- + 2H + = H 2 O + CO 2
Карбиди
Калциум карбид:
CaO + 3 C = CaC 2 + CO
CaC 2 + 2 H 2 O = Ca(OH) 2 + C 2 H 2.
Ацетилен се ослободува кога цинк, кадмиум, лантан и цериум карбиди реагираат со вода:
2 LaC 2 + 6 H 2 O = 2La (OH) 3 + 2 C 2 H 2 + H 2.
Бидете 2 C и Al 4 C 3 се распаѓаат со вода за да формираат метан:
Al 4 C 3 + 12 H 2 O = 4 Al(OH) 3 = 3 CH4.
Во технологијата се користат титаниум карбиди TiC, волфрам W 2 C (тврди легури), силициум SiC (карборунд - како абразив и материјал за грејачи).
Цијанид
добиени со загревање на сода во атмосфера на амонијак и јаглерод моноксид:
Na 2 CO 3 + 2 NH 3 + 3 CO = 2 NaCN + 2 H 2 O + H 2 + 2 CO 2
Цијановодородна киселина HCN е важен производ на хемиската индустрија и широко се користи во органската синтеза. Неговото глобално производство достигнува 200 илјади тони годишно. Електронска структурацијанид анјон е сличен на јаглерод моноксид (II), таквите честички се нарекуваат изоелектронски:
В = О: [:C = N:] -
Цијаниди (0,1-0,2% воден раствор) се користи во ископувањето злато:
2 Au + 4 KCN + H 2 O + 0,5 O 2 = 2 K + 2 KOH.
Кога се варат растворите на цијанид со сулфур или со топење на цврсти материи, тие се формираат тиоцијанати:
KCN + S = KSCN.
Кога се загреваат цијанидите на ниско-активни метали, се добива цијанид: Hg(CN) 2 = Hg + (CN) 2. Растворите на цијанид се оксидираат до цијанати:
2 KCN + O 2 = 2 KOCN.
Цијанската киселина постои во две форми:
H-N=C=O; H-O-C = N:
Во 1828 година, Фридрих Волер (1800-1882) добил уреа од амониум цијанат: NH 4 OCN = CO(NH 2) 2 со испарување на воден раствор.
Овој настан обично се смета за победа на синтетичката хемија над „виталистичката теорија“.
Постои изомер на цијанска киселина - експлозивна киселина
H-O-N=C.
Неговите соли (жива фулминат Hg(ONC) 2) се користат во ударни запалувачи.
Синтеза уреа(уреа):
CO 2 + 2 NH 3 = CO(NH 2) 2 + H 2 O. На 130 0 C и 100 atm.
Уреата е амид на јаглеродна киселина; тука е и неговиот „азотен аналог“ - гванидин.
Карбонати
Најважните неоргански јаглеродни соединенија се солите на јаглеродната киселина (карбонати). H 2 CO 3 е слаба киселина (K 1 = 1,3 10 -4; K 2 = 5 10 -11). Карбонат тампон потпори рамнотежа на јаглерод диоксидво атмосферата. Светските океани имаат огромен тампон капацитет затоа што се отворен систем. Главната пуферска реакција е рамнотежата за време на дисоцијацијата на јаглеродна киселина:
H 2 CO 3 ↔ H + + HCO 3 - .
Кога киселоста се намалува, дополнителна апсорпција на јаглерод диоксид од атмосферата се јавува со формирање на киселина:
CO 2 + H 2 O ↔ H 2 CO 3 .
Како што се зголемува киселоста, карбонатните карпи (школки, креда и варовнички седименти во океанот) се раствораат; ова ја компензира загубата на хидрокарбонатните јони:
H + + CO 3 2- ↔ HCO 3 —
CaCO 3 (цврста) ↔ Ca 2+ + CO 3 2-
Цврстите карбонати се претвораат во растворливи бикарбонати. Токму овој процес на хемиско растворање на вишокот јаглерод диоксид се спротивставува на „ефектот на стаклена градина“ - глобално затоплувањепоради апсорпцијата на топлинското зрачење од Земјата со јаглерод диоксид. Околу една третина од светското производство на сода (натриум карбонат Na 2 CO 3) се користи во производството на стакло.