Долгите периоди на системот на Менделеев, вклучувајќи ги и таканаречените интеркаларни децении, содржат по десет елементи, за кои бројот на електрони во надворешната обвивка е еднаков на два (два -електрони) и кои се разликуваат само по бројот на -електрони во втора надворшколка. Такви елементи се, на пример, елементите скандиум до цинк или итриум до кадмиум.
Втората обвивка однадвор игра помала улога во манифестацијата на хемиските својства отколку надворешната обвивка, бидејќи врската помеѓу електроните на надворешната обвивка и јадрото е послаба отколку во втора надвор. Затоа, елементите во чии атоми надворешните обвивки се конструирани идентично и само вторите обвивки однадвор се разликуваат многу помалку едни од други по хемиски својства отколку елементите со различна структура на надворешните обвивки. Така, сите елементи на интеркаларните децении, кои заедно ги формираат таканаречените секундарни подгрупи од главните осум групи на системот на Менделеев, се метали; сите тие се карактеризираат со променлива валентност. ВО шестиот период периодичен систем, покрај вметнатата деценија, следат уште 14 елементи кои следат лантан, во кои разликата во структурата на електронските обвивки се манифестира само во третата надворешна електронска обвивка (пополнување на /-места во четвртата обвивка се јавува во присуство на пополнети места.Овие елементи (лантаниди) на -23
Како резултат на експериментите за одредување на полнежите на атомските јадра до 4-та година, вкупниот број на познати елементи - од водород (Z = 1) до ураниум (Z = 92) - беше 86. Шест елементи со атомски броеви = 43, Во системот беа пропуштени 61, 72, 75, 85, 87. Сепак, и покрај овие празнини, веќе беше јасно дека во првиот период од периодичниот систем треба да има два елементи - водород и хелиум, во 2-ри и трети - по осум елементи, во четвртиот и петтиот - по осумнаесет, во шестиот има триесет и два елементи.13
Пред да се разјасни структурата на шестиот период на системот на Менделеев, елементот бр. 72 се бараше меѓу елементите на ретките земји, па дури и поединечни научници најавија откривање на овој елемент. Кога стана јасно дека шестиот период од периодичниот системсодржи 32 елементи, од кои 14 се ретка земја, а потоа N. Bohr истакна дека елементот бр. 72 е веќе зад ретките земји, во четвртата група, и е, како што очекуваше Менделеев, аналог на циркониумот.
Слично на тоа, Бор истакна дека елементот бр. 75 е во групата седум и е предвидениот аналог на манган од Менделеев. Навистина, во 3, елементот бр. 72, наречен хафниум, беше откриен во цирконските руди и се покажа дека сè што претходно се нарекувало циркониум во суштина е мешавина од циркониум и хафниум.
Истата 3 година беа преземени пребарувања за елементот бр. Хемиските операции за изолирање на овој елемент беа исто така засновани на неговата наводна сличност во својствата со манганот. Потрагата кулминираше во 5 н.е. со откривање на нов елемент наречен рениум.24
Но, ова сè уште не ги исцрпи сите можности за вештачко добивање на нови елементи. Граница периодниот системво регионот на лесните јадра е даден со водород, бидејќи не може да има елемент со нуклеарен полнеж помал од еден.
Но, во регионот на тешки јадра оваа граница во никој случај не е поставена од ураниум. Всушност, отсуството во природата на елементи потешки од ураниумот само укажува дека полуживотот на таквите елементи е значително помал од староста на Земјата. Затоа, меѓу трите дрвја на природно радиоактивно распаѓање, вклучувајќи ги изотопи со масен број A = 4n, 4n- -2 и 4 4-3, само гранките кои започнуваат со долг периодични изотопи Tb, и 2 и Сите гранки со краток период, фигуративно кажано, се исуши и падна од памтивек. Дополнително, четвртото дрво на радиоактивното распаѓање, вклучително и изотопи со масен број A = 4n + 1, целосно се исуши и умре, ако некогаш постоеле изотопи од оваа серија на Земјата.
Како што е познато, четвртиот и петтиот период од системот на Менделеев содржат 18 елементи, додека шестиот период содржи 32 елементи, бидејќи помеѓу третата група елемент лантан (бр. 57) и четвртата група елемент хафниум (бр. 72) има уште четиринаесет ретки земјени елементи слични на лантан.
По разјаснувањето на структурата на седмиот период од системот на Д.И. Менделеев, стана јасно дека во периодичниот систем, првиот период од два елементи е проследен со два периоди од осум елементи, потоа два периоди од осумнаесет елементи и два периоди од триесет и два. елементи. Во 2. таков период, кој треба да заврши со елемент-. Том бр., додека недостасуваат уште седумнаесет елементи, два од нив не се доволни за комплетирање на семејството на актиниди, а елементот бр. веќе треба да се наоѓа во четвртата група од периодичниот систем, што е аналог на хафниум.
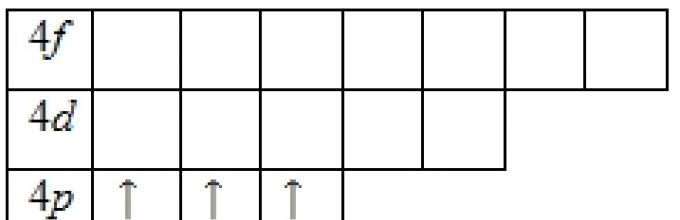
Кога n + / = 5, се пополнуваат нивоата l = 3, 1 = 2 (M), l = 4, / = 1 (4p) и, конечно, l = 5, / = O (55). Ако пред калциумот, пополнувањето на електронските нивоа се одвиваше по зголемен редослед на броеви на електронски обвивки (15, 25, 2p, 33, 3p, 45), тогаш откако ќе се пополнат 5-те места од четвртата електронска обвивка, наместо да се продолжи да се пополнува оваа обвивка со /7-електрони, започнува полнењето на претходната, третата , школки - електрони. Севкупно, секоја обвивка може да содржи, како што е јасно од горенаведеното, 10 електрони. Според тоа, по калциумот во периодниот систем следат 10 елементи од скандиум (3.452) до цинк (3.452), во чии атоми се пополнува -слојот од третата обвивка, а дури тогаш р-слојот на четвртата обвивка е исполнет - од галиум (3(Sh3 p) до криптон ZiShchz r). Во рубидиумот и стронциумот, кои започнуваат со петтиот период, се појавуваат 55 и 552 електрони.19
Истражувањата во изминатите петнаесет години доведоа до вештачко производство на голем број краткопериодни. изотопи на јадрата на елементите од жива до ураниум, до воскреснувањето на одамна мртвите родители на ураниум, протактиниум и ториум во природата - елементи на саураниум од бр. 93 до бр. - и до реконструкција на четвртата серија на распаѓање, вклучувајќи изотопи со масени броеви /4 = 4r-1. Оваа серија може условно да се нарече серија на распаѓање на нептуниум, бидејќи најдолговечниот во серијата е изотопот на елементот бр. 93 - чиј полуживот е близу 2 милиони години.
Шестиот период започнува со пополнување на две места за s-електрони во шестата обвивка, така што структурата на надворешните обвивки на атомите на елементот бр.56 - бариум - има форма 4s j0 d 05s2p66s2. Очигледно е дека со понатамошно зголемување на бројот на електрони во атомите на елементите кои го следат бариумот, обвивките може да се пополнат или со 4/-, или со bd- или, конечно, со br-електрони. Веќе во четвртиот и петтиот период периодичен систем, кој содржи 18 елементи, пополнувајќи г-места втора надворлушпата настанала пред полнењето на п-точките на надворешната обвивка. Така во шестиот периодпополнувањето на 6/7 места започнува само со елементот бр.81-талиум.Во атомите на дваесет и четири елементи сместени помеѓу бариум и талиум, четвртата обвивка е исполнета со /-електрони, а петтата обвивка со d-електрони.
Модели на промени во активноста на г-елементите во периодот
Категории
Одберете го насловот 1. ФИЗИЧКИ И ХЕМИСКИ СВОЈСТВА НА НАФТАТА И ПРИРОДНИОТ ГАС 3. ОСНОВИ НА РАЗВОЈ И РАБОТА НА НАФТЕНИТЕ НИШТА 3.1. Проточна работа на нафтени бунари 3.4. Работа на бунари со потопна електрична центрифугална 3.6. Концептот за развој на нафтени и гасни бунари 7. МЕТОДИ НА ВЛИЈАНИЕ ВРЗ ДВЕТЕТА ЗОНА НА ФОРМИРАЊЕ ГЛАВНИ ЕДИНИЦИ НА ФОРМАЦИОНИСКИ ТЕСТЕР ЗАРАФ ДОЛЕН БЛОК МОТОРИ ИТНИ И СПЕЦИЈАЛНИ РАБОТНИ РАБОТНИ МОДИКИ ЗА ИТНИ И СПЕЦИЈАЛНИ РАБОТНИ МОДИКИ ЕЛС АНАЛИЗА НА ПРЕДИЗВИКУВА НЕКОЛКУ ДОБРА АНАЛИЗА НА ПРОДУКТИВНОСТА НА ТЕХНОЛОГИИТЕ НА ДОБОР РЕМЕНТ Опрема за бунари АСФАЛТНА СМОМИНА-ПАРАФИН ДЕПОЗИТИ Без наслови БЕЗ ПАЧЕНИ СОГРУВАЊЕ НА ГАС БЕЗ шипки БУНАРСКИ ЕДИНИЦИ ЗА ПУМПЊЕ Блогун СО ЦИРКУЛАЦИСКИ СИТ. борбени хидрати БОРБА СО ПАРАФИН ДЕПОЗИЦИЈА ВО ДИГАЊЕ НА ЦЕВКИТЕ дупчење Дрилирање странични шини ДИРЕКТИВА И ХОРИЗОНТАЛНИ БУНАРИ Дупчење бунари ДУПЕЊЕ СТРИНГ ДУПЕЊЕ АВТОМАТСКИ СТАЦИОНЕРНИ МАШЕТИ БУПЕЊЕ ГЕООСТОРНИЦИ ГОДЕЊА ГОДИНИЦИ И ХОРИЗОНТАЛНИ БУПЕЊА ПУМПИ ЗА ДУПЕЊЕ ПУМПИ ЗА ДУПЕЊЕ ЦРЕВА ЗА ДУПЕЊЕ ЦРЕВА ЗА ДУПЕЊЕ ВО ВЕНТИЛ ЗА ВЕЧЕН мраз (MMP). ВИДОВИ ХЕТЕРОГЕНОСТ ВО СТРУКТУРАТА НА РЕЗЕРВИ НА НАФТА Видови на бунари ПУМПИ ЗА ЗАВРТУВАЊЕ ПОТОПНИ КОРИСНИ ВО БУНАРИСКАТА СОДРЖИНА НА ВЛАГА И ПРИРОДЕН ГАС СОСТАВ НА ХИДРАТ Влијание различни фактори за карактеристиките на SDM ПРАШАЊА ЗА ОПТИМИЗАЦИЈА НА РАБОТАТА НА СИСТЕМОТ РЕЗЕРВОАР-ESP ИЗБОР НА ОПРЕМА И РЕЖИМ НА РАБОТА ESP SELECTION OF A PUMPER MACHINE Гас лифт LN инсталација Gas lift Работа на нафтени бунари GIS LIft метод на ГАСНИ ПОЛИВА И НИВНИ СВОЈСТВА ФОРМИРАЊЕ НА ХИДРА ВО БУНАРИ НА ГАСЕН КОНДЕНЗАТ ФОРМИРАЊЕ НА ХИДРАТИ ВО СИСТЕМОТ ЗА СОБИРАЊЕ НА МАСЛА хидраулична заштита на потопниот електричен мотор GIDROKEY GKSH-1500MT хидраулична клипна пумпа Глава 8. СТЕБЛИ ДЛАБОКИ ПУМПИ Хоризонтално дупчење РУДАРСКИ ГЕОЛОШКИ УСЛОВИ НА БУПЕЊЕ НА БУНАРИ ЗА НАФТА И ГАСНИ БУНАРИ ГРАНУЛОМЕТРИСКИ (МЕХАНИКА ЧЕСКИ) СОСТАВ НА КАРПЕТА ДОЛГ ДОЛГ ПРЕВОЗ НА МАЛФО И ГАС ЗА ДЕФОРМАЦИЈА НА ПРИТИСОК МЕБОРНИ Електрични пумпи ДИЗЕЛ-ХИДРАУЛИЧНА ЕДИНИЦА ДИЗЕЛ-ХИДРАУЛИЧНА ЕДИНИЦА50 ДИЗЕЛ- МЕРЕЊЕ НА ДОЛНИ ЕДИНИЦИ НА РАСТЕНИЈАТА СО ЛМП СТРУКТУРИ НА О.Д. ОРЕНБУРГНЕФТ“ производство на нафта Производство на нафта во тешки услови ПРОИЗВОДСТВО НА МАСЛО СО КОРИСТЕЊЕ НА ТЕЧНИ МАНОМЕРИ НА ПРИТИСОК DOWNHEATH МОТОРИ Вбризгување на киселински раствори во бунарот УСТАВНИ ОПРЕМА. ЗАШТИТА НА ОПРЕМА НА НАФТЕНО ПОЛЕ ОД КОРОЗИЈА ЗАШТИТА ОД КОРОЗИЈА НА ОПРЕМА НА НАФТЕНО ПОЛЕ ГИ ПРОМЕНА НА ТЕКОТ НА БУНАРСКИ мерење на притисок, проток, течност, гас и пареа МЕРЕЊЕ НА КОЛИЧИНАТА НА КОЛИЧНИЦАТА НА ГОЛЕМИ ТЕЧНОСТИ, И ПАРЕНИТЕ МЕРЕЊЕ МЕРЕЊЕ НА НИВО НА ТЕЧНОСТ МЕРЕЊА НА ПРОИЗВОДИ со ниски приноси ИНФОРМАТИЧКА ТЕХНОЛОГИЈА ВО ПРОИЗВОДСТВО НА НАФТА И ГАС ТЕСТИРАЊЕ НА ДОБОРНИ ЕЛЕКТРИЧНИ ГРЕАЧИ Истражување на бунари за пумпање длабоки бунари ЕФИКАСНОСТ СТУДИЈА K. ДИЗАЈН НА ЕДИНИЦАТА НА ВЕНТИЛ корозија Кранови. ФИКСИРАЊЕ НА БУНАРИ КТППН КОЛЕКТИ Распоред на нишалото Безбедносни мерки при подготовка на киселински раствори МЕТОД НА ПРЕСМЕТКА ЗА НИЗИ НА БУПШЕЊЕ EVEL МЕТОДИ ЗА БОРБА СО ПАРАФИНСКИ ДЕПОЗИТИ ВО ПРОТОЧНИ БУНАРИ Методи за влијание врз зоната блиску до бунарот MAND МЕТОД НА ПРЕСМЕТУВАЊЕ НА РЕШЕНИ МЕТОДИ ЗА Зголемување на нафтата Методи за проучување на бунарските делови . МЕТОДИ НА ИНДИРЕКТНИ МЕРЕЊА НА ПРИТИСОК МЕТОДИ НА ОТСТРАНУВАЊЕ НА СОЛ МЕХАНИЗМИ НА ДВИЖЕЊЕ И ПОРАМОГУВАЊЕ НА РАБОТНИЦИ ЗА БУПЕЊЕ МЕХАНИЗМИ НА ДВИЖЕЊЕ И ПОРАСОВАЊЕ МЕХАНИЗМИ ВО ВРЕМЕ НА МЕШАЊЕТО НА РЕГИРАЊЕТО опрема Пумпна работа на бунари ПУМПАЊЕ И КОМПРЕСОРСКИ ЦЕВКИ хетероген резервоар Нафта и нафтени деривати Новости на порталот НОВИ ТЕХНОЛОШКИ И ТЕХНИЧКИ ОСИГУРУВАЊЕ НА ЕКОЛОШКА БЕЗБЕДНОСТ НА ПРОИЗВОДНИ ПРОЦЕСИ ОПРЕМА ЗА ГАС ЛИФТ БУНАРИ ОПРЕМА ЗА МЕХАНИЗАЦИЈА НА ОПЕРАЦИИ ЗА ОЧЕКА ОПРЕМА ЗА ОПРЕМА ЗА ОПРЕМА ЗА нафта и гас ОТВОРЕНИ РЕСУРСИ НОВА ОПРЕМА ЗА ОПШТА НАМЕНА Опрема за бунар комплетирана со дупчење КОМПРЕСОРСКА БУНАРСКА ГЛАВА ОПРЕМА БУНАРСКИ ОПРЕМА Опрема за бунар за работа на ESP ОПРЕМА ЗА ПРОТОЧНИ БУНАРИ ОПРЕМА ЗА ПРОТОЧНИ БУНАРИ третман на зоната на долна дупка ФОРМИРАЊЕ НА ХИДРАТИ И МЕТОДИ ЗА БОРБА НИВ ФОРМИРАЊЕ НА КРИСТАЛНИ ХИДРАТИ ГИ НЕГОРЕНИ ВЕЛИДРАТИ HAUL PAIRS ОПШТИ КОНЦЕПТИ СУМ ЗА ГРАДЕЊЕ НА БУНАРИ КОИ ГО ОГРАНИЧУВААТ ПРИЛИКОТ НА ФОРМИРАНА ВОДА Опасни и штетни физички фактори ОПРЕДЕЛУВАЊЕ НА ПРИТИСОК НА ИСЛЕЗОТ НА ПУМПТА ТЕСТИРАЊЕ НА ВЕТУВАЊЕ ХОРИЗОНТИ ОПТИМИЗАЦИЈА НА РАБОТА РЕЖИМ НА ПРИКАЖНАТА ЕДИНИЦА НА ПРИКАЧНАТА ЕДИНИЦА БИЛО ИСКУСТВО ЕКСПЕРТИРАЊЕ НА ПУМПАТА И ИСПИТУВАЊЕ НА РАЗВОЈ НА БУНАРИ И ПЛАЦИРАЊЕ НА ЦВЕТОТ КОМПЛИКАЦИИ НА БУНАРИ ВО ПРОЦЕСОТ НА ДОБОРНО ПРОдлабочување на ДРУГИ ОСНОВНИ КОНЦЕПТИ И ОДРЕДБИ ОСНОВНИ КОНЦЕПТИ И ОДРЕДБИ ОСНОВНИ ИНФОРМАЦИИ ЗА НАФТАТА, ГАСОТ И ГАСНИОТ КОНДЕНЗАТ ОСНОВИ НА ХИДРАУЛИЧКАТА ГОДИНА ОСНОВИ НА ДИЗАЈНУВАЊЕ НА ДИРЕКТИРАНИ БУНАРИ ОСНОВИ НА ИНДУСТРИСКА БЕЗБЕДНОСТ ЧИСТЕЊЕ НА БУПЕЊЕ БУНАР ОД ИСЕКОВИ ЧИСТЕЊЕ ПОВРЗАНИ ЧИСТЕЊА ГАСОВИ лемење и површина ХИДРОМЕХАНИЧКИ ПАКЕР ЗА ДВОЈНИ ЧАШИ PGMD1 ХИДРОМЕХАНИЧКИ ПАКЕРИ IE, ХИДРАУЛИЧКИ И МЕХАНИЧКИ ПАКЕРИ ЗА ТЕСТИРАЊЕ НА ТЕСТИРАЊЕ НА ПАКУВАЊЕТО НА КОЛУМПАНСКИ ПАКУВАЧИ-1. RS ПАРАМЕТРИ И КОМПЛЕТНОСТ НА ЦИРКУЛАЦИОНИ СИСТЕМИ Параметри на патувачки блокови за работа со ASP ПРИМАРНО ОТВОРАЊЕ НА ПРОИЗВОДНИТЕ ФОРМАЦИИ ПРИМАРНИ МЕТОДИ НА ЦЕМЕНТИРАЊЕ НА МОБИЛНИ ПУМПНИ ЕДИНИЦИ И ЕДИНИЦИ ЗА ПРЕРАБОТУВАЊЕ НА МАСЛО ЗАКУПУВАЊЕ (НАФТЕЛНА ТАНА) ПЕРИОДИЧЕН ЛИФТ НА ГАС ЗА КОРИСТЕЊЕ НА ЕДНИЦАТА ГО ЗГОЛЕМУВААТ ПУМПИЊЕТО s потопување под динамичко ниво Подземна опрема за тече бунари КРЕВАЊЕ ВИСКОЗНА ТЕЧНОСТ НИЗ ГОДИШНИ АЛАТКИ ЗА УНИШТУВАЊЕ НА КАРПИТЕ ПРОСТОР НА КЛИПНИ МАНОМЕРИ НА ПРИТИСОК Губење на притисок при движење на течност по цевката Безбедносни правила за работа на бунарот Правила за поправка во бунари RD 153-39-023-97 СПРЕЧУВАЊЕ НА СОЛ Теоретска основабезбедност ТЕХНИКИ НА МЕРЕЊЕ НА ТЕК Техничка физика ТРАЕКТОРИЈА НА ДВИЖЕЊЕ НА ДНОТО НА БУНАР Цевки ИНСТРУКЦИИ ЗА ПРЕСМЕТУВАЊЕ СТРУИ НА КРАТОК СЛОЖУВАЊЕ УСЛОВИ НА ТЕЧНИ И ГАСНИ Производство на ТЕЧНИ И ГАСНИ ТЕЧНИ И ГАСНИ ПУМПИ ПРИЛИВИ на потопни завртки електрични пумпи Инсталации на потопни дијафрагми замена електр пумпи Опрема за бунари ТЕЖИРАНИ ЦЕВКИ ЗА БУШТАЊЕ ESP ESP целосно ФАКТОРИ КОИ ВЛИЈААТ НА ИНТЕНЗИТЕТОТ НА ФОРМИРАЊЕ НА ASPO Физички и механички својства на акумулираните карпи ФИЗИЧКИ КАРАКТЕРИСТИКИ НА ГАСОВИТЕ МАСЛО И ГАСНИ МЕСТА ФИЛТЕРИ МЕСТА НА ФОНТАНА ФОНТАНА ИГС Згура-песок цементи Згура- песочни цементи на ко-брусење Ер. РЕЖИМ НА РАБОТА НА БУНАРИ КОИ СОДРЖАТ ПАРАФИН БУНАРИ РАБОТЕЊЕ ESP ESP ЕЛЕКТРИЧЕН ДЕХИДРАТОР. ЕЛЕКТРИЧНА МЕМЈАФРАГМА ПУМПА ЕЛЕКТРИЧНА ПУМПА ЕЛЕКТРИЧНА ЕЛЕКТРИЧНА ПУМПНА единица за заштеда на енергија YAKORId-елементите и нивните соединенија имаат голем број на карактеристични својства: променливи состојби на оксидација; способност да формира сложени јони; формирање на обоени соединенија.
Цинкот не е преоден елемент. Неговите физички и хемиски својства не дозволуваат да се класифицира како преоден метал. Особено, во неговите соединенија покажува само една оксидациска состојба и не покажува каталитичка активност.
d-Elements имаат некои карактеристики во споредба со елементите на главните подгрупи.
1. Во d-елементите, само мал дел од валентните електрони се делокализирани низ кристалот (додека кај алкалните и земноалкални металивалентни електрони се целосно предадени на колективна употреба). Останатите d-електрони учествуваат во формирањето на насочени ковалентни врски помеѓу соседните атоми. Така, овие елементи во кристална состојба немаат чисто метална врска, туку ковалентно-метална врска. Затоа, сите тие се тврди (освен Hg) и огноотпорни (освен Zn, Cd) метали.
Најогноотпорни метали се металите од подгрупата VB и VIB. Во нив половина од d-поднивото е исполнето со електрони и се остварува максималниот можен број на неспарени електрони и затоа, најголем бројковалентни врски. Понатамошното полнење доведува до намалување на бројот на ковалентни врски и пад на температурите на топење.
2. Поради ненаполнетите d-школки и присуството на неисполнети ns- и np-нивоа кои се блиски по енергија, d-елементите се склони кон формирање на комплекси; нивните комплексни соединенија, по правило, се обоени и парамагнетни.
3. d-елементите почесто од елементите на главните подгрупи формираат соединенија со променлив состав (оксиди, хидриди, карбиди, силициди, нитриди, бориди). Покрај тоа, тие формираат легури едни со други и со други метали, како и меѓуметални соединенија.
4. Д-елементите се карактеризираат со голем сет на валентни состојби (Табела 8.10) и, како последица на тоа, промени во киселинско-базните и редокс својствата во широк опсег.
Бидејќи некои од валентните електрони се во s-орбитали, најниските состојби на оксидација што тие ги покажуваат обично се еднакви на два. Исклучок се елементите чии јони E +3 и E + имаат стабилни конфигурации d 0, d 5 и d 10: Sc 3+, Fe 3+, Cr +, Cu +, Ag +, Au +.
Соединенијата во кои d-елементите се во најниска состојба на оксидација формираат кристали од јонски тип, во хемиски реакциипокажуваат основни својства и се, по правило, редуцирачки агенси.
Стабилноста на соединенијата во кои d-елементите се во највисока состојба на оксидација (еднаква на бројот на групата) се зголемува во секоја преодна серија од лево кон десно, достигнувајќи максимум за 3d-елементи во Mn и во втората и третата преодна серија во Ру и Ос, соодветно. Во рамките на една подгрупа, стабилноста на соединенијата со највисока состојба на оксидација се намалува во серијата 5d > 4d > 3d, што е потврдено од природата на промената на енергијата на Гибс (изобарско-изотермичен потенцијал) на соединенија од ист тип, на пример. :
Овој феномен се должи на фактот дека со зголемување на главниот квантен број во една подгрупа, разликата помеѓу енергиите на (n – 1)d- и ns-поднивоата се намалува. Овие соединенија се карактеризираат со ковалентни поларни врски. Тие се со кисела природа и се оксидирачки агенси (CrO 3 и K 2 CrO 4, Mn 2 O 7 и KMnO 4).
Соединенијата во кои d-електроните се во средни оксидациски состојби покажуваат амфотерични својства и редокс двојност.
5. Сличноста на d-елементите со елементите на главните подгрупи E(0) целосно се манифестира во елементите од третата група ns 2 np 1 и (n – 1)d 1 ns 2. Како што се зголемува бројот на групата, тој се намалува; елементи од подгрупата VIIIA се гасови, VIIIB се метали. Во првата група повторно се појавува далечна сличност (сите елементи се метали), а елементите од подгрупата IB се добри спроводници; оваа сличност е засилена во втората група, бидејќи d-елементите Zn, Cd и Hg не учествуваат во формирањето на хемиска врска.
6. d-елементите IIIB–VIIB на подгрупите во повисоки оксидациски состојби се слични по својства на соодветните p-елементи. Така, во повисоки состојби на оксидација, Mn (VII) и Cl (VII) се електронски аналози. Сличноста на електронските конфигурации (s 2 p 6) доведува до слични својства на соединенијата на хептавалентен манган и хлор. Mn 2 O 7 и Cl 2 O 7 во нормални услови се нестабилни течности, кои се анхидриди на силни киселини со општа формула NEO 4. Во пониски состојби на оксидација, манганот и хлорот имаат различни електронска структура, што предизвикува остра разлика во својствата на нивните соединенија. На пример, понискиот хлор оксид Cl 2 O (s 2 p 4) е гасовита супстанција која е анхидрид на хипохлорна киселина (HClO), додека понискиот манган оксид MnO (d 5) е цврста кристална супстанцијаосновен карактер.
7. Како што е познато, редуцирачката способност на металот се определува не само од неговата енергија на јонизација (M – ne – → M n + ; +∆H јонизација), туку и од енталпијата на хидратација на формираниот катјон (M n + + mH 2 O → M n + mH 2 O; –∆H hydr). Енергиите на јонизација на d-елементите се високи во споредба со другите метали, но тие се компензираат со големите енталпии на хидратација на нивните јони. Следствено електродни потенцијалиповеќето d-елементи се негативни.
Како што Z се зголемува, намалувачките својства на металите се намалуваат, достигнувајќи минимум за елементите од групата IB. Тешки металиГрупите VIIIB и IV се нарекуваат благородни поради нивната инерција.
Редокс тенденциите на соединенијата на d-елементите се одредуваат со промени во стабилноста на повисоките и пониските оксидациони состојби, во зависност од нивната положба во периодичниот систем. Соединенијата со највисока состојба на оксидација на елементот покажуваат исклучиво оксидирачки својства, а оние со најниски - редуцирачки својства. Mn(OH) 2 лесно се оксидира во воздухот Mn(OH) 2 + 1/2O 2 = MnO 2 + H 2 O. Mn(IV) соединенијата лесно се намалуваат до Mn (II): MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O, но се оксидира до Mn (VII) со силни оксидирачки агенси. Перманганатниот јон MnO 4 може да биде само оксидирачки агенс.
Бидејќи за d-елементите во подгрупата стабилноста на повисоките оксидациони состојби се зголемува од врвот до дното, оксидирачките својства на соединенијата со највисоки состојби на оксидација нагло се намалуваат. Така, соединенијата на хром (VI) (CrO 3, K 2 CrO 4, K 2 Cr 2 O 7) и манган (VII) (Mn 2 O 7, KMnO 4) се силни оксидирачки агенси, а WO 3, Re 2 O 7 и солите на нивните соодветни киселини (H 2 WO 4, HReO 4) се намалуваат со тешкотии.
8. Киселинско-базните својства на хидроксидите на d-елементот се под влијание на истите фактори (јонскиот радиус и јонскиот полнеж) како и хидроксидите на p-елементот.
Хидроксидите со пониски оксидациски состојби на d-елементите обично покажуваат основни својства, а соодветните повисоки степениоксидација – кисела. Во средните состојби на оксидација, хидроксидите се амфотерични. Промената на киселинско-базните својства на хидроксидите со промена на степенот на оксидација е особено изразена кај соединенијата на манган. Во серијата Mn(OH) 2 – Mn(OH) 3 – Mn(OH) 4 – H 2 MnO 4 – HMnO 4 својствата на хидроксидите варираат од слабата база Mn(OH) 2 преку амфотерната Mn(OH) 3 и Mn(OH) 4 k силни киселини H 2 MnO 4 и HMnO 4 .
Во рамките на една подгрупа, хидроксидите на d-елементите со иста состојба на оксидација се карактеризираат со зголемување на основните својства кога се движат од врвот до дното. На пример, во групата IIIB Sc(OH) 3 е слаба база, а La(OH) 3 е силна база. Елементите IVB од групата Ti, Zn, Hf формираат амфотерни хидроксиди E(OH) 4, но киселински својстватие слабеат при преминот од Ti во Hf.
9. Карактеристична карактеристикатранзициски елементи е формирање на фази со променлив состав. Ова се, прво, интерстицијални и супституционални цврсти раствори и, второ, соединенија со променлив состав. Цврстите раствори се формираат од елементи со слична електронегативност, атомски радиуси и идентични кристални решетки. Колку повеќе елементи се разликуваат по својата природа, толку помалку се растворливи еден во друг и толку се повеќе склони да формираат хемиски соединенија. Таквите соединенија можат да имаат и постојан и променлив состав. За разлика од цврстите раствори, во кои е зачувана решетката на една од компонентите, соединенијата се карактеризираат со формирање на нова решетка и нова хемиски врски. Со други зборови, да хемиски соединенијаги вклучуваат само оние фази на променлив состав кои остро се разликуваат по структура и својства од оригиналните.
Соединенијата со променлив состав се карактеризираат со следниве карактеристики:
а) Составот на овие соединенија зависи од начинот на подготовка. Така, во зависност од условите на синтезата, титаниум оксидите имаат состав TiO 1,2–1,5 и TiO 1,9–2,0; титаниум и ванадиум карбиди – TiC 0,6–1,0 и VС 0,58–1,09, титаниум нитрид TiN 0,45–1,00.
б) Врските ги задржуваат своите кристална решеткасо значителни флуктуации во квантитативниот состав, односно имаат широк опсег на хомогеност. Така, TiC 0,6-1,0, како што следува од формулата, ја задржува решетката од титаниум карбид со недостаток од до 40% јаглеродни атоми во неа.
в) Природата на врската кај таквите соединенија се одредува според степенот на полнење на d-орбиталите на металот. Електроните на внесениот неметал зафаќаат празни d-орбитали, што доведува до зголемена ковалентност на врските. Затоа е намален процентот на метални врски во соединенијата на почетните елементи од серијата d (IV–V групи).
Достапност ковалентна врскатие се потврдени со големи позитивни енталпии на формирање на соединенија, поголема цврстина и точка на топење, помала електрична спроводливост во споредба со металите што ги формираат.
Бакарот е елемент од единаесеттата група од четвртиот период на периодниот систем хемиски елементиД.И.Менделев, со атомски број 29. Се означува со симболот Cu (лат. Cuprum). Едноставната супстанција бакар (CAS број: 7440-50-8) е еластична преоден металзлатна- Розова боја(розова боја во отсуство на оксиден филм). Тој е широко користен од луѓето долго време.
ДЕФИНИЦИЈА
Калиум- првиот елемент од четвртиот период. Се наоѓа во групата I од главната (А) подгрупа на Периодниот систем.
Се однесува на елементи од s - семејството. Метал. Металните елементи вклучени во оваа група колективно се нарекуваат алкални. Ознака - К. Сериски број- 19. Релативна атомска маса - 39,102 аму.
Електронска структура на атомот на калиум
Атомот на калиум се состои од позитивно наелектризирано јадро (+19), внатре во кое има 19 протони и 20 неутрони, а 19 електрони се движат наоколу во 4 орбити.
Сл.1. Шематска структура на атомот на калиум.
Распределбата на електроните меѓу орбиталите е како што следува:
1с 2 2с 2 2стр 6 3с 2 3стр 6 4с 1 .
Надворешното енергетско ниво на атомот на калиум содржи 1 електрон, што е валентен електрон. Состојбата на оксидација на калиумот е +1. Енергетскиот дијаграм на основната состојба ја има следната форма:
Возбудена состојба, и покрај присуството на празно 3 стр- и 3 г-нема орбитали.
Примери за решавање проблеми
ПРИМЕР 1
| Вежбајте | Атомот на елементот ја има следната електронска конфигурација 1 с 2 2с 2 2стр 6 3с 2 3стр 6 3г 10 4с 2 4стр 3. Наведете: а) нуклеарен полнеж; б) број на пополнети нивоа на енергијаво електронската обвивка на овој атом; в) максималниот можен степен на оксидација; г) валентност на атомот во комбинација со водород. |
| Решение | За да одговорите на поставените прашања, прво треба да го одредите вкупниот број на електрони во атом на хемиски елемент. Ова може да се направи со собирање на сите електрони присутни во атомот, без да се земе предвид нивната дистрибуција на нивоата на енергија: 2+2+6+2+6+10+2+3 = 33. Ова е арсен (As). Сега да одговориме на прашањата: а) нуклеарното полнење е +33; б) атомот има четири нивоа, од кои три се целосни; в) запишете го енергетскиот дијаграм за валентни електрони на атомот на арсен во основна состојба. Арсенот е способен да оди во возбудена состојба: електрони с-поднивоата излегуваат на пареа и едно од нив се префрла на празно г-орбитална. Пет неспарени електрони покажуваат дека максималната можна состојба на оксидација на арсенот е +5; г) Валентноста на арсенот во комбинација со водородот е III (AsH 3). |
Оваа статија нема врски до извори на информации. Информациите мора да бидат проверливи, во спротивно може да бидат доведени во прашање и избришани. Можеш... Википедија
Период е ред од периодичниот систем на хемиски елементи, низа од атоми со редослед на зголемување на нуклеарното полнење и пополнување на надворешната електронска обвивка со електрони. Периодниот систем има седум периоди. Првиот период кој содржи 2 елементи ... Википедија
104 Laurencium ← Rutherfordium → Dubnium ... Википедија
Д.И. Менделеев, природна класификација на хемиски елементи, што е табеларен (или друг графички) израз периодичен законМенделеев (Види периодичен закон на Менделеев). П.С. д. развиен од Д.И. Менделеев во 1869 година... ... Голема советска енциклопедија
Менделеев Дмитриј Иванович- (Дмитриј Иванович Менделеев) Биографија на Менделеев, научна дејност на Менделеев Информации за биографијата на Менделеев, научна дејност на Менделеев Содржина Содржина 1. Биографија 2. Припадник на рускиот народ 3. Научна дејностПериодични... Инвеститор енциклопедија
Периодичен систем на хемиски елементи (табела на Менделеев) класификација на хемиски елементи, утврдување на зависноста на различните својства на елементите од полнењето атомско јадро. Системот е графички израз на периодичниот закон, ... ... Википедија
Периодичен систем на хемиски елементи (табела на Менделеев) е класификација на хемиски елементи со која се утврдува зависноста на различните својства на елементите од полнежот на атомското јадро. Системот е графички израз на периодичниот закон, ... ... Википедија
Периодичен систем на хемиски елементи (табела на Менделеев) е класификација на хемиски елементи со која се утврдува зависноста на различните својства на елементите од полнежот на атомското јадро. Системот е графички израз на периодичниот закон, ... ... Википедија
Хемиски елементи (периодична табела) класификација на хемиски елементи, утврдување на зависноста на различните својства на елементите од полнежот на атомското јадро. Системот е графички израз на периодичниот закон воспоставен од руската... ... Википедија
Концепт преоден елементобично се користи за да се однесува на кој било елемент со d или f валентни електрони. Овие елементи заземаат преодна позиција во периодниот систем помеѓу електропозитивните s-елементи и електронегативните p-елементи.
d-елементите обично се нарекуваат главни преодни елементи. Нивните атоми се карактеризираат со внатрешна структура на d-подобвивки. Факт е дека s-орбиталата на нивната надворешна обвивка обично се пополнува пред да започне полнењето на d-орбиталите во претходната електронска обвивка. Ова значи дека секој нов електрон додаден на електронска обвивкаследниот d-елемент, во согласност со принципот на полнење, не паѓа на надворешната обвивка, туку на внатрешната подобвивка што му претходи. Хемиски својстваод овие елементи се одредуваат со учество на електрони од двете овие обвивки во реакциите.

d-Elements формираат три преодни серии - во 4-тиот, 5-тиот и 6-тиот период, соодветно. Првата преодна серија вклучува 10 елементи, од скандиум до цинк. Се карактеризира со внатрешна конфигурација на 3d орбитали. Орбиталата 4s се полни порано од орбиталата 3d,бидејќи има помалку енергија (правило на Клечковски).
Сепак, треба да се забележи дека има две аномалии. Хромот и бакарот имаат само по еден електрон во нивните орбитали 4s. Факт е дека полупополнетите или целосно пополнетите подшколки се постабилни од делумно пополнетите подшколки.
Атомот на хром има по еден електрон во секоја од петте 3d орбитали кои ја формираат 3d подобвивката. Оваа подшколка е половина пополнета. Во бакарниот атом, секоја од петте 3d орбитали содржи пар електрони. Слична аномалија е забележана и кај среброто.
Сите d-елементи се метали.
Електронски конфигурации на елементите од четвртиот период од скандиум до цинк: 


Хром
Хром е во 4-ти период, во група VI, во секундарна подгрупа. Тоа е метал со средна активност. Во неговите соединенија, хромот покажува состојби на оксидација +2, +3 и +6. CrO е типичен основен оксид, Cr 2 O 3 - амфотеричен оксид, CrO 3 е типичен кисел оксид со својства на силно оксидирачко средство, т.е., зголемувањето на степенот на оксидација е придружено со зголемување на киселинските својства.

Железо
Железото е во 4-ти период, во VIII група, во секундарна подгрупа. Железото е метал со средна активност; во неговите соединенија најмногу покажува карактеристични степениоксидација +2 и +3. Познати се и соединенијата на железо во кои покажува оксидациона состојба од +6, кои се силни оксидирачки агенси. FeO покажува основни својства, а Fe 2 O 3 покажува амфотерични својства со доминација на основните својства.

Бакар
Бакарот е во 4-тиот период, во групата I, во секундарната подгрупа. Неговите најстабилни состојби на оксидација се +2 и +1. Во низата напони на металите, бакарот се наоѓа по водородот, неговиот хемиска активностне многу голем. Бакарни оксиди: Cu2O CuO. Вториот и бакар хидроксид Cu(OH)2 покажуваат амфотерични својства со доминација на основните.
Цинк
Цинкот е во 4. период, во група II, во секундарна подгрупа. Цинкот е средно активен метал; во неговите соединенија покажува единечна оксидациска состојба од +2. Цинк оксидот и хидроксидот се амфотерични.