HNO3, монобазна силна киселина која содржи кислород. Цврста азотна киселина формира две кристални модификации со моноклинични и орторомбни решетки.
Азотна киселина се меша со вода во кој било сооднос. ВО водени раствориречиси целосно се дисоцира на јони.
Се добива со каталитичка оксидација на синтетички амонијак на катализатори на платина-родиум (метод Хабер) до мешавина од азотни оксиди (азотни гасови), со нивна понатамошна апсорпција со вода.
4NH3 + 5O2 (Pt) > 4NO + 6H2O
2NO + O2 > 2NO2 4NO2 + O2 + 2H2O > 4HNO3 Концентрацијата на азотна киселина добиена со овој метод варира, во зависност од технолошкиот дизајн на процесот, од 45 до 58%. Алхемичарите беа првите кои добија азотна киселина со загревање на мешавина од шалитра и железен сулфат:
4KNO3 + 2(FeSO4 7H2O) (t°) > Fe2O3 + 2K2SO4 + 2HNO3^ + NO2^ + 13H2O
Чистата азотна киселина првпат ја добил Јохан Рудолф Глаубер со третирање на нитрат со концентрирана сулфурна киселина:
KNO3 + H2SO4(конц.) (t°) > KHSO4 + HNO3^
Со понатамошна дестилација т.н „испарена азотна киселина“ која практично не содржи вода.
Апликација:
во производството на минерални ѓубрива;
во воената индустрија;
во фотографијата - закиселување на некои раствори за нијансирање;
во штафелајска графика - за офорт за печатење форми (табли за офорт, обрасци за цинкографско печатење и клишеа од магнезиум).
1. Разредената азотна киселина ги покажува сите својства на силните киселини во водени раствори, таа се дисоцира според следната шема:
HNO3 H+ + NO3–,
безводна киселина:
2HNO3® NO2+ + NO3–+ H2O.
Постепено, особено на светлина или кога се загрева, азотна киселина се распаѓа за време на складирањето, растворот станува кафеав поради азот диоксид;
4HNO3 4NO2 + 2H2O + O2.
2. Азотната киселина реагира со речиси сите метали. Разредена азотна киселина со алкални и земноалкални метали, како и со железо и цинк, ги формира соодветните нитрати, амониум нитрат или азот хемиоксид, во зависност од активноста на металот и водата:
4Mg + 10HNO3® 4Mg(NO3)2 + N2O + 5H2O,
Со тешки метали, разредената киселина ги формира соодветните нитрати, се ослободува вода и азотен оксид, а во случај на посилно разредување, азот:
5Fe + 12HNO3(ултра дил.)®5Fe(NO3)3 + N2+ 6H2O,
3Cu + 8HNO3® 3Cu(NO3)2 + 2NO + 4H2O.
Концентрирана азотна киселина, при интеракција со алкали и алкални метали, ги формира соодветните нитрати, се ослободува вода и азотен хемиоксид:
8Na + 10HNO3® 8NaNO3 + N2O + 5H2O.
Металите како железо, хром, алуминиум, злато, платина, иридиум, тантал се пасивираат со концентрирана киселина, т.е. На површината на металот се формира филм од оксиди, непропустливи за киселина. Друго тешки металипри интеракција со концентрирана азотна киселина, тие ги формираат соодветните нитрати, вода и ослободуваат азотен оксид или диоксид:
3Hg + 8HNO3(ладно)®3Hg(NO3)2 + 2NO + 4H2O,
Hg + 4HNO3(hor.)®Hg(NO3)2 + 2NO2+ 2H2O,
Ag + 2HNO3® AgNO3 + NO2+ 2H2O.
3. Азотната киселина е способна да раствори злато, платина и други благородни метали, но во мешавина со хлороводородна киселина. Нивната мешавина во однос на три волумени на концентрирана хлороводородна киселинаа еден волумен на концентрирана азотна киселина се нарекува „aqua regia“. Ефектот на аква регија е дека азотна киселина оксидира хлороводородна киселина до слободен хлор, кој се комбинира со метали:
HNO3 + HCl ® Cl2 + 2H2O + NOCl,
2NOCl ® 2NO + Cl2.
Aqua regia е способен да раствори злато, платина, родиум, иридиум и тантал, кои не се раствораат во азотна, а уште помалку хлороводородна киселина:
Au + HNO3 + 3HCl ® AuCl3 + NO + 2H2O,
HCl + AuCl3® H;
3Pt + 4HNO3 + 12HCl ® 3PtCl4 + 4NO + 8H2O,
2HCl + PtCl4® H2.
4. Неметалите исто така се оксидираат со азотна киселина до соодветните киселини кои ослободуваат азотен оксид;
3P + 5HNO3 + 2H2O ® 3H3PO4 + 5NO,
концентрирана киселина ослободува азот диоксид:
S + 6HNO3® H2SO4 + 6NO2+ 2H2O,
азотна киселина, исто така, може да оксидира некои неоргански соединенија:
3H2S + 8HNO3® 3H2SO4 + 8NO + 4H2O.
HNO2 е слаба монопротична киселина која постои само во разредени водени раствори, обоени во слабо сина боја и во гасна фаза. Солите на азотна киселина се нарекуваат нитрити или азотни киселини. Нитратите се многу постабилни од HNO2, од кои сите се токсични.
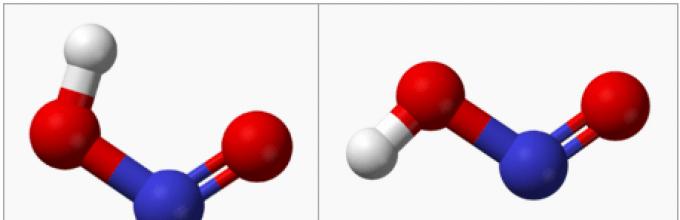
Во гасната фаза, рамната молекула на азотна киселина постои во две конфигурации, cis и trans. На собна температурапреовладува транс изомерот
Chem. светци
Во водени раствори постои рамнотежа:
2HNO2 - N2O3 + H2O - NO^ + NO2^ + H2O
Кога растворот се загрева, азотна киселина се распаѓа, ослободувајќи NO и NO2:
3HNO2 - HNO3 + 2NO^ + H2O.
HNO2 е малку појак оцетна киселина. Лесно се заменуваат со посилни киселини од соли:
H2SO4 + Ba(NO2)2 > BaSO4v + HNO2.
Азотна киселинапокажува и оксидирачки и редуцирачки својства. Под влијание на посилни оксидирачки агенси (H2O2, KMnO4) се оксидира до HNO3:
2HNO2 + 2HI > 2NO^ + I2v + 2H2O;
5HNO2 + 2HMnO4 >2Mn(NO3)2 + HNO3 + 3H2O;
HNO2 + Cl2 + H2O > HNO3 + 2HCl.
Азотна киселина се користи за дијазотизација на примарната ароматични аминии формирање на соли на дијазониум. Нитритите се користат во органската синтеза во производството на органски бои.
Потврда:
N2O3 + H2O 2HNO2,
NaNO2 + H2SO4 (0° C)® NaHSO4 + HNO2
AgNO2 + HCl ® AgCl + HNO2
Својства на солите
Сите нитрати се многу растворливи во вода. Со зголемување на температурата, нивната растворливост значително се зголемува. Кога се загреваат, нитратите се распаѓаат, ослободувајќи кислород. Амониум нитрати, алкални и земноалкални металинаречен нитрат, на пример NaNO3 - натриум нитрат (чилеански нитрат), KNO3 - калиум нитрат, NH4NO3 - амониум нитрат. Нитратите се произведуваат со дејство на азотна киселина HNO3 на метали, оксиди, хидроксиди и соли. Речиси сите нитрати се многу растворливи во вода.
Нитратите се стабилни на обични температури. Тие обично се топат на релативно ниски температури(200-600°C), често со распаѓање.
Нитрати алкални металисе разградуваат до нитрити со ослободување на кислород (и со продолжено загревање постепено се разградуваат на метален оксид, молекуларен азот и кислород, поради што се добри оксидирачки агенси).
Металните нитрати со средна активност се распаѓаат кога се загреваат на метални оксиди, при што се ослободуваат азот диоксид и кислород.
Нитратите се најмали активни метали(благородни метали) главно се распаѓаат до слободни метали со ослободување на азот диоксид и кислород.
Нитратите се прилично силни оксидирачки агенси во цврста состојба (обично во форма на топење), но практично немаат оксидирачки својства во растворот, за разлика од азотна киселина.
Нитритот е сол на азотна киселина HNO2. Нитритите се термички помалку стабилни од нитратите. Тие се користат во производството на азо бои и во медицината.
HNO 2 има слаб карактер. Многу нестабилен, може да се најде само во разредени раствори:2 HNO 2 БР + БР 2 + Х 2 О.
Соли на азотна киселина се нарекуваат нитритиили азотна киселина. Нитритите се многу постабилни од HNO2, сите тие се токсични.
2HNO 2 + 2HI = I 2 + 2NO + 2H 2 O,
HNO 2 + H 2 O 2 = HNO 3 + H 2 O,
5KNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5KNO 3 + K 2 SO 4 + 2MnSO 4 + 3H 2 O.
Структура на азотна киселина.
Во гасната фаза, рамната молекула на азотна киселина постои во форма на две конфигурации: цис- и транс-:

На собна температура преовладува транс изомерот: оваа структура е постабилна. Значи, за cis - HNO2(Г) DG° f= -42,59 kJ/mol, а за транс- HNO2(Г) ДГ= −44,65 kJ/mol.
Хемиски својства на азотна киселина.
Во водени раствори постои рамнотежа:
Кога се загрева, растворот на азотна киселина се распаѓа, ослободувајќи БРи формирање на азотна киселина:
HNO2се дисоцира во водени раствори ( К Д=4,6·10−4), малку посилен од оцетната киселина. Лесно се заменуваат со посилни киселини од соли:
Азотната киселина покажува оксидирачки и редуцирачки својства. Под дејство на посилни оксидирачки агенси (водород пероксид, хлор, калиум перманганат), се јавува оксидација во азотна киселина:
Покрај тоа, може да оксидира супстанции кои имаат редуцирачки својства:
Подготовка на азотна киселина.
Азотна киселина се добива со растворање на азотен оксид (III) N2O3во вода:
Покрај тоа, тој се формира кога азотен оксид (IV) се раствора во вода. НЕ 2:
.
Примена на азотна киселина.
Азотна киселина се користи за дијазотизирање на примарните ароматични амини и формирање на соли на дијазониум. Нитритите се користат во органската синтеза во производството на органски бои.
Физиолошки ефект на азотна киселина.
Азотна киселина е токсична и има изразен мутаген ефект, бидејќи е деаминирачки агенс.
Азотна киселина.Чистата азотна киселина HNO 3 е безбојна течност со густина од 1,51 g/cm на -42 °C, која се зацврстува во проѕирна кристална маса. Во воздухот, како концентрирана хлороводородна киселина, „чади“, бидејќи нејзините пареи формираат мали капки магла со влагата во воздухот,
Азотната киселина не е издржлива дури и под влијание на светлината, постепено се распаѓа.
Колку е повисока температурата и повеќе концентрирана киселина, толку побрзо се случува распаѓањето. Ослободениот азот диоксид се раствора во киселината и и дава кафена боја.
Азотна киселина е една од најмоќните киселини; во разредени раствори целосно се разградува на јони H + и - NO 3.
Оксидативни својства на азотна киселина. Карактеристично својство на азотна киселина е неговата изразена оксидирачка способност. Азотна киселина-еден
еден од најенергичните оксидирачки агенси. Многу неметали лесно се оксидираат со него, претворајќи се во соодветните киселини. Така, сулфурот, кога се вари со азотна киселина, постепено се оксидира во сулфурна киселина, фосфорот во фосфорна киселина. Јагленот што тлее потопен во концентриран HNO 3 се разгорува силно.
Азотната киселина делува на скоро сите метали (со исклучок на златото, платината, танталот, родиумот, иридиумот), претворајќи ги во нитрати, а некои метали во оксиди.
Концентрираниот HNO 3 пасивизира некои метали. Ломоносов, исто така, открил дека железото, кое лесно се раствора во разредена азотна киселина, не се раствора
во ладно концентрирано HNO 3. Подоцна беше откриено дека азотна киселина има сличен ефект врз хромот и алуминиумот. Овие метали одат под
со дејство на концентрирана азотна киселина во пасивна состојба.
Степенот на оксидација на азот во азотна киселина е 4-5. Дејствувајќи како оксидирачки агенс, HNO 3 може да се редуцира на различни производи:
Потврда.
1. Во лабораторија, азотна киселина се добива со реакција на безводни нитрати со концентрирана сулфурна киселина:
Ba (NO 3) 2 + H 2 SO 4 → BaSO 4 ↓ + 2HNO 3.
2. Во индустријата, производството на азотна киселина се јавува во три фази:
1. Оксидација на амонијак во азотен оксид (II):
4NH 3 + 5O 2 → 4NO + 6 H 2 O
2. Оксидација на азотен оксид (II) до азотен оксид (IV):
2NO + O 2 → 2NO 2
3. Распуштање на азотен оксид (IV) во вода со вишок кислород:
4NO 2 + 2H 2 O + O 2 → 4HNO 3
Хемиски својства .
Ги покажува сите својства на киселините. Азотната киселина е една од најмоќните минерални киселини.
1. Во водени раствори целосно се дисоцира на јони:
HNO 3 → H + + NO - 3
2. Реагира со метални оксиди:
MgO + 2HNO 3 → Mg(NO 3) 2 + H 2 O,
3. Реагира со основи:
Mg(OH) 2 + 2HNO 3 → Mg(NO 3) 2 + 2H 2 O,
4. Концентрираниот HNO 3, при интеракција со најактивните метали до Al, се сведува на N 2 O. На пример:
4Ca + 10HNO 3 → 4Ca(NO 3) 2 + N 2 O+ 5H 2 O
5. Концентрираниот HNO 3, при интеракција со помалку активни метали (Ni, Cu, Ag, Hg), се намалува на NO 2. На пример:
4HNO 3 + Ni → Ni(NO 3) 2 + 2NO 2 + 2H 2 O.
6. Концентрираниот HNO 3 реагира слично со неметали. Неметалот се оксидира. На пример:
5HNO 3 + Po → HP + 5O 3 + 5NO 2 + 2H 2 O. В соли на азотна киселина - нитрати
кога се загреваат, тие се распаѓаат според следнава шема:
лево Mg: MeNO 3 → MeNO 2 + O 2
Mg – Cu: MeNO 3 → MeO + NO 2 + O 2
десно Cu MeNO 3 → Me + NO 2 +O 2
Апликација.
Азотна киселина се користи за производство на азотни ѓубрива, лековити материи и експлозиви.
Водород. Атомска структура, физички и хемиски својства, производство и употреба на водород.ВОДОРОД , H, хемиски елемент со атомски број 1, 1,00794.
Природниот водород се состои од мешавина од два стабилни нуклиди со масен број од 1,007825 (99,985% во смесата) и 2,0140 (0,015%). Покрај тоа, природниот водород секогаш содржи занемарливи количини на радиоактивен нуклид - тритиум 3 H (полуживот T1/2 = 12,43 години). Бидејќи јадрото на атом на водород содржи само 1 протон (не може да има помалку протони во јадрото на атомот на елементот), понекогаш се вели дека водородот ја формира природната долна граница на периодичниот систем на елементи на Д. И. Менделеев (иако елементот самиот водород се наоѓа во табелите на најгорните делови). Елементот водород се наоѓа во првиот период од периодниот систем. Припаѓа на групата 1 (група IA алкални метали) и групата 7 (група VIIA халогени).
Атомските маси на водородните изотопи се разликуваат многу (за неколку пати). Ова води до забележливи разлики во нивното однесување во физичките процеси (дестилација, електролиза, итн.) и до одредени хемиски разлики (разликите во однесувањето на изотопите на еден елемент се нарекуваат изотопски ефекти; за водородот, ефектите на изотоп се најзначајни). Затоа, за разлика од изотопите на сите други елементи, водородните изотопи имаат посебни симболи и имиња. Водородот со масен број 1 се нарекува лесен водород, или протиум (латински Protium, од грчкиот protos - прво), означен со симболот H, а неговото јадро се нарекува протон, симбол стр. Водородот со масен број 2 се нарекува тежок водород, деутериум (латински Деутериум, од грчкиот деутерос - второ), симболите 2 H или D (читај „де“) се користат за да се означи, јадрото d е деутрон. Радиоактивен изотопсо маса број 3 се нарекува супертежок водород, или тритиум (латински Tritum, од грчки tritos - трето), симбол 3 H или T (читај „оние“), јадро t - тритон.
Конфигурацијата на единечниот електронски слој на неутрален невозбуден атом на водород е 1s1. Во соединенијата покажува оксидациски состојби +1 и поретко -1 (валентност I). Радиусот на неутрален водороден атом е 0,0529 nm. Енергијата на јонизација на атомот е 13,595 eV, афинитетот на електроните е 0,75 eV. Според Полинговата скала, електронегативноста на водородот е 2,20. Водородот е неметал.
Во својата слободна форма, тој е лесен запалив гас без боја, мирис или вкус.
Физички и хемиски својства: во нормални услови, водородот е лесен (густина во нормални услови 0,0899 kg/m3) безбоен гас. Точка на топење –259,15°C, точка на вриење –252,7°C. Течниот водород (на точка на вриење) има густина од 70,8 kg/m 3 и е најлесната течност. Стандардниот електроден потенцијал H 2 /H– во воден раствор се зема еднаков на 0. Водородот е слабо растворлив во вода: на 0 ° C растворливоста е помала од 0,02 cm 3 / ml, но е многу растворлив во некои метали ( сунѓерско железо и други), особено добро - во метален паладиум (околу 850 волумени водород во 1 волумен метал). Топлината на согорување на водородот е 143,06 MJ/kg.
Постои во форма на дијатомски H 2 молекули. Константата на дисоцијација на H2 во атоми на 300 K е 2,56·10-34. Енергијата на дисоцијација на молекулата H 2 во атоми е 436 kJ/mol. Меѓунуклеарното растојание во молекулата H 2 е 0,07414 nm.
Бидејќи јадрото на секој атом H што е дел од молекулата има свој спин, молекуларниот водород може да биде во две форми: во форма на ортоводород (o-H 2) (двата спина имаат иста ориентација) и во форма на параводород ( p-H 2 ) (задните страни имаат различни ориентации). Во нормални услови, нормалниот водород е мешавина од 75% o-H2 и 25% p-H2. Физичките својства на p- и o-H 2 малку се разликуваат едни од други. Значи, ако температурата на вриење чисто о-Х 2 20,45 К, тогаш чист p-N 2 - 20,26 К. Трансформација o-H 2 во p-H 2 е придружено со ослободување на 1418 J/mol топлина.
Високата јачина на хемиската врска помеѓу атомите во молекулата H2 (што, на пример, со помош на методот на молекуларна орбитала, може да се објасни со фактот дека во оваа молекула електронскиот пар се наоѓа во орбиталата за поврзување, а орбиталата против сврзување е не е окупирана од електрони) води до фактот дека на собна температура водородниот гас е хемиски неактивен. Значи, без загревање, со едноставно мешање, водородот реагира (експлозивно) само со флуор гас (F):
H 2 + F 2 = 2HF + Q.
Ако мешавина од водород и хлор (Cl) се озрачи со ултравиолетова светлина на собна температура, се забележува непосредно формирање на водород хлорид HCl. Реакцијата на водородот со кислородот (O) настанува експлозивно ако во мешавината на овие гасови се додаде катализатор, металот паладиум (Pd) (или платина (Pt)). Кога ќе се запали, експлодира мешавина од водород и кислород (О) (наречен детонирачки гас), а експлозијата може да се случи во мешавини во кои содржината на водород се движи од 5 до 95 проценти по волумен. Чистиот водород во воздухот или во чистиот кислород (O) тивко гори, ослободувајќи голема количина топлина:
H 2 + 1/2O 2 = H 2 O + 285,75 kJ/mol
Ако водородот е во интеракција со други неметали и метали, тоа е само под одредени услови (греење, висок притисок, присуство на катализатор). Така, водородот реагира реверзибилно со азот (N) при покачен притисок (20-30 MPa или повеќе) и на температура од 300-400 ° C во присуство на катализатор - железо (Fe):
3H 2 + N 2 = 2NH 3 + Q.
Исто така, само кога се загрева, водородот реагира со сулфур (S) за да формира водород сулфид H 2 S, со бром (Br) за да формира водород бромид HBr, со јод (I) за да формира водород јодид HI. Водородот реагира со јаглен (графит) за да формира мешавина од јаглеводороди со различен состав. Водородот директно не комуницира со бор (B), силициум (Si), фосфор (P) соединенијата на овие елементи со водородот се добиваат индиректно.
Кога се загрева, водородот е способен да реагира со алкали, метали на алкална земја и магнезиум (Mg) за да формира соединенија со јонска врска, кои содржат водород во -1 оксидациона состојба. Така, кога калциумот се загрева во водородна атмосфера, се формира хидрид налик на сол со составот CaH 2. Полимер алуминиум хидрид (AlH 3)x - еден од најмоќните средства за намалување - се добива индиректно (на пример, со користење на органоалуминиумски соединенија). Со многу преодни метали (на пример, циркониум (Zr), хафниум (Hf), итн.), Водородот формира соединенија со променлив состав (цврсти раствори).
Водородот е способен да реагира не само со многу едноставни, туку и со сложени супстанции. Пред сè, неопходно е да се забележи способноста на водородот да редуцира многу метали од нивните оксиди (како што се железо (Fe), никел (Ni), олово (Pb), волфрам (W), бакар (Cu) итн. ). Така, кога се загрева на температура од 400-450°C и повеќе, железото (Fe) се редуцира со водород од кој било од неговите оксиди, на пример:
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O.
Треба да се напомене дека само металите лоцирани во серијата можат да се редуцираат со водород од оксиди стандардни потенцијализа манган (Mn). Поактивни метали (вклучувајќи манган (Mn)) не се редуцираат во метал од оксиди.
Водородот е способен да додаде двојна или тројна врска на многу органски соединенија (ова се таканаречени реакции на хидрогенизација). На пример, во присуство на никел катализатор, можно е да се изврши хидрогенизација на етилен C 2 H 4, и се формира етан C 2 H 6:
C 2 H 4 + H 2 = C 2 H 6.
Метанолот се произведува индустриски со реакција на јаглерод моноксид (II) и водород:
2H 2 + CO = CH 3 OH.
Во соединенијата во кои атом на водород е поврзан со атом на повеќе електронегативен елемент E (E = F, Cl, O, N), се формираат водородни врски помеѓу молекулите (два E атоми од ист или два различни елементимеѓусебно се поврзани преку атомот H: E"... N... E"", а сите три атоми се наоѓаат на иста права линија).Такви врски постојат меѓу молекулите на водата, амонијак, метанол итн. и доведуваат до забележливо зголемување на температурите на вриење, овие супстанции, зголемување на топлината на испарување итн.
Потврда: Водородот може да се произведува на многу начини. Во индустријата за ова се користат природни гасови, како и гасови добиени од рафинирање на нафта, коксирање и гасификација на јаглен и други горива. Кога се произведува водород од природен гас (главната компонента е метан), тој е подложен на каталитичка интеракција со водена пареа и нецелосна оксидација со кислород (O):
CH 4 + H 2 O = CO + 3H 2 и CH 4 + 1/2 O 2 = CO 2 + 2H 2
Одвојувањето на водородот од гасот од кокс печката и гасовите за рафинирање на нафта се заснова на нивното втечнување при длабоко ладење и отстранување од мешавината на гасови кои полесно се втечнуваат од водородот. Кога е достапна евтина електрична енергија, водородот се произведува со електролиза на вода со поминување струја низ алкални раствори. Во лабораториски услови, водородот лесно се добива со реакција на метали со киселини, на пример, цинк (Zn) со хлороводородна киселина.
Апликација: водородот се користи во синтезата на амонијак NH3, водород хлорид HCl, метанол CH 3 OH, при хидрокрекирање (пукање во водородна атмосфера) на природни јаглеводороди, како редукционо средство во производството на одредени метали. Со хидрогенизација на природни растителни масла се добива цврста маст - маргарин. Течниот водород се користи како ракетно гориво, а исто така и како течност за ладење. Во заварувањето се користи мешавина од кислород (О) и водород.
Едно време, се сугерираше дека во блиска иднина главен извор на производство на енергија ќе биде реакцијата на согорување на водородот, а водородната енергија ќе ги помести традиционалните извори на производство на енергија (јаглен, нафта, итн.). Се претпоставуваше дека би било можно да се користи електролиза на вода за производство на водород во голем обем. Електролизата на водата е прилично енергетски интензивен процес, а во моментов е непрофитабилно да се произведува водород со електролиза на индустриско ниво. Но, се очекуваше дека електролизата ќе се заснова на употреба на топлина со средна температура (500-600°C), која се јавува во големи количини за време на работата на нуклеарните централи. Оваа топлина има ограничена употреба, а можноста за производство на водород со негова помош би овозможила да се реши еколошки проблем (кога водородот се согорува во воздухот, количината на еколошки генерирана штетни материиминимална) и проблемот на искористување на среднотемпературната топлина. Меѓутоа, по катастрофата во Чернобил, развојот на нуклеарната енергија беше скратен насекаде, така што овој извор на енергија стана недостапен. Затоа, изгледите за широка употреба на водородот како извор на енергија сè уште се менуваат, барем до средината на 21 век.
Карактеристики на лекување : водородот не е токсичен, но при ракување со него, мора постојано да се води сметка за неговата висока опасност од пожар и експлозија, а опасноста од експлозија на водородот е зголемена поради високата способност на гасот да дифузира дури и низ некои цврсти материјали. Пред да започнете какви било операции за загревање во водородна атмосфера, треба да бидете сигурни дека е чист (при палење на водород во епрувета свртена наопаку, звукот треба да биде тап, а не да лае).
27 Положбата на микроорганизмите во системот на живиот свет. Разновидност на микроорганизми и нивна заедништво со други организми. Суштински карактеристики на микроорганизмите: мала големина на клетки, висока метаболичка активност, висока пластичност на нивниот метаболизам (брза адаптација на променливите услови на животната средина, „секаде“), способност за брза репродукција, слаба морфолошка диференцијација, разновидност на метаболичките процеси.
Микроорганизми, (микроби) е збирно име за група живи организми кои се премногу мали за да бидат видливи со голо око (нивната карактеристична големина е помала од 0,1 mm). Микроорганизмите вклучуваат и нуклеарни (прокариоти: бактерии, археи) и еукариоти: некои габи, протисти, но не и вируси, кои обично се изолирани во посебна група. Повеќето микроорганизми се состојат од една клетка, но има и повеќеклеточни микроорганизми, исто како што има некои едноклеточни макроорганизми видливи со голо око, на пример Thiomargarita namibiensis, претставници на родот Caulerpa (тие се џиновски поликарјони). Науката за микробиологија ги проучува овие организми.
Сеприсутноста и вкупната моќ на метаболичкиот потенцијал на микроорганизмите ја одредува нивната витална улогаво циркулацијата на материите и одржување на динамичка рамнотежа во биосферата на Земјата.
Краткото испитување на различни претставници на микросветот, кои зафаќаат одредени „подови“ со големина, покажува дека, по правило, големината на предметите е дефинитивно поврзана со нивната структурна сложеност. Долната граница на големината на слободно живиот едноклеточен организам е одредена од просторот потребен за да се спакува внатре во клетката апаратот неопходен за независно постоење. Ограничувањето на горната граница на големината на микроорганизмите се определува, според современите концепти, со односот помеѓу површината на клетката и волуменот. Како што се зголемуваат големините на ќелиите, површината се зголемува во квадрат, а волуменот се зголемува во коцката, така што односот помеѓу овие количини се поместува кон второто.
Микроорганизмите живеат речиси насекаде каде што има вода, вклучувајќи ги и топлите извори, дното на светските океани, а исто така и длабоко во земјината кора. Тие се важна алка во метаболизмот во екосистемите, главно играат улога на разградувачи, но во некои екосистеми тие се единствените производители на биомаса - производители.
Микроорганизмите кои живеат во различни средини учествуваат во циклусот на сулфур, железо, фосфор и други елементи, вршат распаѓање на органски материи од животинско и растително потекло, како и абиогено потекло (метан, парафини) и обезбедуваат самопрочистување на вода во акумулации.
Сепак, не сите видови на микроорганизми имаат корист за луѓето. Многу голем број видови на микроорганизми се опортунистички или патогени за луѓето и животните. Некои микроорганизми предизвикуваат расипување на земјоделските производи, ја осиромашуваат почвата од азот, предизвикуваат загадување на водните тела и акумулација на токсични материи во прехранбените производи (на пример, микробиолошки токсини).
Микроорганизмите се карактеризираат со добра приспособливост на дејството на факторите на животната средина. Различни микроорганизми можат да растат на температури од -6° до +50-75°. Рекордот за преживување на покачени температури беше поставен од археите, од кои некои проучувани култури растат на хранливи подлоги над 110 °C, на пример, Methanopyrus kandleri (сој 116) расте на 122 °C, рекордна висока температура за сите познати организми.
Во природата, живеалиштата на оваа температура постојат под притисок во топли вулкански извори на дното на океаните (Black Smokers).
Познато е дека микроорганизмите напредуваат на нивоа кои се фатални за повеќеклеточните суштества. јонизирачко зрачење, во широк опсег на pH вредности, при 25% концентрација на натриум хлорид, во услови на различна содржина на кислород до негово целосно отсуство (Анаеробни микроорганизми).
Во исто време, патогените микроорганизми предизвикуваат болести кај луѓето, животните и растенијата.
Најшироко прифатените теории за потеклото на животот на Земјата сугерираат дека протомикроорганизмите биле првите живи организми кои се појавиле низ процесот на еволуција.
Во моментов, сите микроорганизми се поделени во 3 царства:
1. Procariotae. Ова царство ги вклучува сите видови бактерии, рикеција, кламидија, микоплазма итн. Клетките имаат јадро со еден хромозом. Јадрото не е одвоено од цитоплазмата на клетката. Едноставен циклус на делење со стегање. Постојат голем број на уникатни органели, како што се плазмидите и мезозомите. Нема способност за фотосинтеза.
2. Еукариоти. Претставници на ова кралство се габи и протозои. Клетката содржи јадро, ограничено од цитоплазмата со мембрана, со неколку хромозоми. Постојат голем број на органели карактеристични за повисоките животни: митохондрии, ендоплазматичен ретикулум, апарат Голџи. Некои претставници на ова кралство имаат хлоропласти и се способни за фотосинтеза. Тие имаат сложен животен циклус.
3. Вира. Вирусите припаѓаат на ова кралство. Карактеристичните карактеристики на вирионот се присуството на само еден вид нуклеинска киселина: РНК или ДНК, затворена во капсид. Можеби вирусот нема заедничка надворешна обвивка. Репродукцијата на вирусот може да се случи само по вградување во друга клетка, каде што се јавува репликација.
Ако загреете калиум или натриум нитрат, тие губат дел од својот кислород и се претвораат во соли на азотна киселина HNO 2. Распаѓањето е полесно во присуство на олово, кое го врзува ослободеното:
KNO3 + Pb = KNO2 + PbO
Солите на азотна киселина - нитрити - се кристални, многу растворливи во вода (со исклучок на сребрената сол). NaNO 2 е широко користен во производството на различни бои.
Кога растворот на некои нитрити е изложен на разредена сулфурна киселина, се добива слободна азотна киселина:
2NaNO 2 + H 2 SO 4 = Na 2 SO 4 + 2HNO 2
Таа е една од слабите киселини (ДО= 5 10 -4) и е познат само во високо разредени водени раствори. Кога растворот се концентрира или се загрева, азотна киселина се распаѓа и ослободува азотен оксид и диоксид:
2HNO2 = NO + NO2 + H2O
Азотната киселина е силна, но во исто време, под дејство на други, поенергични оксидирачки агенси, самата може да се оксидира во азотна киселина.
Читате статија на тема Азотна киселина HNO2
Азотна киселина постои или во раствор или во гасна фаза. Тој е нестабилен и, кога се загрева, се распаѓа во пареа:
2HNO 2 “NO+NO 2 +H 2 O
Водните раствори на оваа киселина се распаѓаат кога се загреваат:
3HNO 2 “HNO 3 +H 2 O+2NO
Оваа реакција е реверзибилна, затоа, иако растворањето на NO 2 е придружено со формирање на две киселини: 2NO 2 + H 2 O = HNO 2 + HNO 3
Практично, со реакција на NO 2 со вода, се добива HNO 3:
3NO 2 +H 2 O=2HNO 3 +NO
Од страна на кисели својстваАзотната киселина е само малку посилна од оцетната киселина. Нејзините соли се нарекуваат нитрити и, за разлика од самата киселина, се стабилни. Од растворите на неговите соли, раствор на HNO 2 може да се добие со додавање на сулфурна киселина:
Ba(NO 2) 2 +H 2 SO 4 = 2HNO 2 +BaSO 4 ¯
Врз основа на податоците за неговите соединенија, се предлагаат два вида структура на азотна киселина:
кои одговараат на нитрити и нитро соединенија. Нитритите на активните метали имаат структура од типот I, а ниско-активните метали имаат структура од типот II. Речиси сите соли на оваа киселина се многу растворливи, но сребрениот нитрит е најтежок. Сите соли на азотна киселина се отровни. За хемиска технологијаВажни се KNO 2 и NaNO 2, кои се неопходни за производство на органски бои. Двете соли се добиваат од азотни оксиди:
NO+NO 2 +NaOH=2NaNO 2 +H 2 O или кога се загреваат нивните нитрати:
KNO 3 +Pb=KNO 2 +PbO
Pb е неопходен за врзување на ослободениот кислород.
Од хемиските својства на HNO 2, оксидативните својства се поизразени, додека самиот тој е намален на NO:

Сепак, може да се дадат многу примери на такви реакции каде азотна киселина покажува редуцирачки својства:

Присуството на азотна киселина и нејзините соли во растворот може да се утврди со додавање на раствор од калиум јодид и скроб. Нитритниот јон го оксидира јодниот анјон. Оваа реакција бара присуство на H +, т.е. се јавува во кисела средина.
Азотна киселина
Во лабораториски услови, азотна киселина може да се добие со дејство на концентрирана сулфурна киселина на нитрати:
NaNO 3 +H 2 SO 4(k) =NaHSO 4 +HNO 3 Реакцијата се јавува при слабо загревање.
Производството на азотна киселина на индустриско ниво се врши со каталитичка оксидација на амонијак со атмосферски кислород:
1. Прво, мешавина од амонијак и воздух се пренесува преку платина катализатор на 800°C. Амонијакот се оксидира до азотен оксид (II):
4NH 3 + 5O 2 = 4NO + 6H 2 O
2. По ладењето, дополнително се оксидира NO до NO 2: 2NO+O 2 =2NO 2
3. Добиениот азотен оксид (IV) се раствора во вода во присуство на вишок O 2 и формира HNO 3: 4NO 2 +2H 2 O+O 2 =4HNO 3
Почетните производи - амонијак и воздух - се темелно прочистени од штетни нечистотии, труење на катализаторот (водород сулфид, прашина, масла, итн.).
Добиената киселина е разредена (40-60% киселина). Концентрирана азотна киселина (јачина 96-98%) се добива со дестилирање на разредена киселина во мешавина со концентрирана сулфурна киселина. Во овој случај, само азотна киселина испарува.
Физички својства
Азотна киселина е безбојна течност со лут мирис. Многу хигроскопски, „чад“ во воздухот, затоа што неговите пареи со влажноста на воздухот формираат капки магла. Се меша со вода во кој било сооднос. На -41,6°C преминува во кристална состојба. Врие на 82,6°C.
Во HNO 3, валентноста на азот е 4, состојбата на оксидација е +5. Структурна формулаазотна киселина е претставена на следниов начин:
И двата атоми на кислород, поврзани само со азот, се еквивалентни: тие се на исто растојание од атомот на азот и секој носи половина од полнежот на електрон, т.е. четвртиот дел од азот е поделен подеднакво помеѓу два атоми на кислород.
Електронска структураазотна киселина може да се добие на следниов начин:
1. Водороден атом се поврзува со атом на кислород преку ковалентна врска:
2. Поради неспарениот електрон, атомот на кислород формира ковалентна врска со атомот на азот:
3. Две неспарен електронсе формираат азотни атоми ковалентна врскасо вториот атом на кислород:
4. Третиот атом на кислород, кога е возбуден, формира слободен 2p-орбитална со спарување на електрони. Интеракцијата на осамен пар на азот со празна орбитала на третиот атом на кислород доведува до формирање на молекула на азотна киселина:
Хемиски својства
1. Разредената азотна киселина ги покажува сите својства на киселините. Се однесува на силни киселини. Се дисоцира во водени раствори:
HNO 3 “Н + +NO - 3 Делумно се распаѓа под влијание на топлина и светлина:
4HNO 3 =4NO 2 +2H 2 O+O 2 Затоа, чувајте го на ладно и темно место.
2. Азотната киселина се карактеризира исклучиво со оксидирачки својства. Најважните хемиско својствое интеракција со речиси сите метали. Водородот никогаш не се ослободува. Намалувањето на азотна киселина зависи од нејзината концентрација и природата на редукционото средство. Степенот на оксидација на азот во производите за редукција е во опсег од +4 до -3:
HN +5 O 3 ®N +4 O 2 ®HN +3 O 2 ®N +2 O®N +1 2 O®N 0 2 ®N -3 H 4 NO 3
Производите за редукција од интеракцијата на азотна киселина со различни концентрации со метали со различна активност се прикажани на дијаграмот подолу.

Концентрирана азотна киселина на обични температури не комуницира со алуминиум, хром и железо. Тоа ги става во пасивна состојба. На површината се формира филм од оксиди, кој е непропустлив за концентрирана киселина.

3. Азотната киселина не реагира со Pt, Rh, Ir, Ta, Au. Платина и злато се раствораат во „aqua regia“ - мешавина од 3 тома на концентрирана хлороводородна киселина и 1 волумен на концентрирана азотна киселина:
Au+HNO 3 +3HCl= AuCl 3 +NO+2H 2 O HCl+AuCl 3 =H
3Pt+4HNO 3 +12HCl=3PtCl 4 +4NO+8H 2 O 2HCl+PtCl 4 =H 2
Ефектот на „региа вотка“ е дека азотна киселина оксидира хлороводородна киселина до слободен хлор:
HNO 3 +HCl=Cl 2 +2H 2 O+NOCl 2NOCl=2NO+Cl 2 Ослободениот хлор се комбинира со метали.
4. Неметалите се оксидираат со азотна киселина до соодветните киселини, а во зависност од концентрацијата се намалува на NO или NO 2:
S+bHNO 3(conc) =H 2 SO 4 +6NO 2 +2H 2 OP+5HNO 3(conc) =H 3 PO 4 +5NO 2 +H 2 O I 2 +10HNO 3 (конц) =2HIO 3 +10NO 2 +4H 2 O 3P+5HNO 3(p asb) +2H 2 O= 3H 3 PO 4 +5NO
5. Исто така, има интеракција со органски соединенија.
Солите на азотна киселина се нарекуваат нитрати и се кристални материи, високо растворлив во вода. Тие се добиваат со дејство на HNO 3 на металите, нивните оксиди и хидроксиди. Калиум, натриум, амониум и калциум нитрати се нарекуваат нитрати. Нитратот главно се користи како минерални азотни ѓубрива. Покрај тоа, KNO 3 се користи за подготовка на црн прав (мешавина од 75% KNO 3, 15% C и 10% S). Експлозивниот амонал е направен од NH 4 NO 3, алуминиумски прав и тринитротолуен.
Солите на азотна киселина се распаѓаат кога се загреваат, а производите на распаѓање зависат од положбата на металот што формира сол во серијата стандардни електродни потенцијали:

Распаѓањето при загревање (термолиза) е важно својство на солите на азотна киселина.
2KNO 3 =2KNO 2 +O 2
2Cu(NO 3) 2 = 2CuO+NO 2 +O 2
Солите на металите лоцирани во низата лево од Mg формираат нитрити и кислород, од Mg до Cu - метален оксид, NO 2 и кислород, по Cu - слободен метал, NO 2 и кислород.
Апликација
Азотната киселина е најважниот производ на хемиската индустрија. Се трошат големи количини за подготовка на азотни ѓубрива, експлозиви, бои, пластика, вештачки влакна и други материјали. Пушењето
Азотна киселина се користи во ракетната технологија како оксидатор за ракетно гориво.