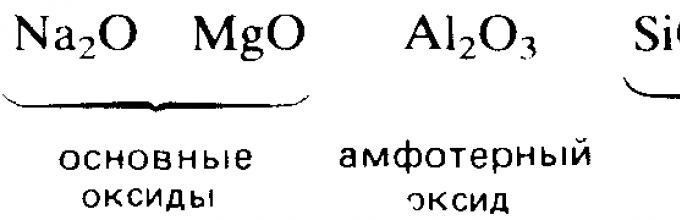Водородни соединенија на неметали. Правилности во промените во нивните својства во врска со положбата на хемиските елементи во периодниот систем на Д.И. Менделеев.
Хидриди. Во соединенијата со неметали, водородот покажува состојба на оксидација од +1. Бидејќи енергијата на јонизација на водородот е многу висока, неговата хемиска врска со неметали не е јонска, туку поларно-ковалентна. Најелектронегативните p-елементи на десната страна на периодите, како што се сулфурот и хлорот, реагираат со водород за да формираат ковалентни хидриди, кои имаат киселински својства и јачината на овие киселини се зголемува како што се зголемува големината на атомот на неметалот поврзан со водородот се зголемува. Исклучок се метанот CH 4, кој е неутрално соединение, како и амонијакот NH 3, кој има основни својства. Водородните соединенија на неметали се многу растворливи во вода и формираат киселини со исти формули.
Повеќе електронегативни p-елементи, како што се алуминиум, силициум и фосфор, не реагираат со водород кога се загреваат.
Билет број 14.
Повисоки оксиди на хемиски елементи од третиот период. Правилности во промените во нивните својства во врска со положбата на хемиските елементи во периодниот систем на Д.И. Менделеев. Карактеристични хемиски својства на оксидите: базични, амфотерични, кисели.
Реактивноста на елементите во интеракција со кислородот, општо земено, се намалува како што се движите надесно долж секој период. На пример, во третиот период, два s-метали, натриум и магнезиум, и два п-елементи, алуминиум и фосфор, бурно реагираат со кислородот и формираат оксиди. Во истиот период, елементите силикон и сулфур се способни само бавно да реагираат со кислородот. Хлорот и аргонот, лоцирани на десниот крај на периодот, воопшто не реагираат со кислород.
Електропозитивните s-метали формираат јонски оксиди, како што се натриум оксид Na 2 O и магнезиум оксид MgO. Оксидите на елементите лоцирани во средниот и десниот дел на периодот се претежно ковалентни соединенија, како што се оксидите на азот и сулфур.
Киселинско-базниот карактер на оксидите исто така се менува од базен во оксиди на елементи од левата страна на периодот до амфотеричен во оксиди на елементи во средниот дел од периодот, а потоа во кисел во оксиди на елементи од десната страна на период. На пример, s-металите обично формираат оксиди кои се раствораат во вода за да формираат алкални раствори:
Молекуларните оксиди на п-елементите, како што се јаглерод диоксид и сулфур триоксид, обично имаат кисели својства. Природната промена на основните својства со преминот кон киселински својства јасно се манифестира во оксидите на елементите од 3-тиот период.

Билет број 15.
Киселини, нивната класификација и хемиски својства врз основа на концептот на електролитичка дисоцијација. Карактеристики на својствата на концентрирана сулфурна киселина користејќи го примерот на интеракција со бакар.
Киселината е сложена супстанција, чија дисоцијација произведува само еден вид катјони - водородни јони.
Класификација на киселини.

Хлороводородна киселина е воден раствор на гас водород хлорид во вода.
Хемиски својства.Киселините ја менуваат бојата на индикаторите: лакмусот станува црвен, метил портокалот станува жолт.
При реакција со бази се формираат сол и вода (реакција на неутрализација). И базите растворливи во вода и нерастворливи во вода реагираат:

Кога се реагира со основни оксидисе формираат со:

Киселините реагираат со метали,лоциран во опсег на напонидо водород, кој ослободува водороден гас и формира сол:

Силните киселини реагираат со соли на слаби киселини,поместување на слабите киселини од нивните соли:
Добивање киселини.Многу киселини може да се добијат со реакција на киселински оксиди со вода:


Концентрирана сулфурна киселинана обични температури не влијае на многу метали. Поради оваа причина, на пример, безводната сулфурна киселина, за разлика од нејзините раствори, може да се чува во железни контејнери.
Но, концентрираната сулфурна киселина делува на речиси сите метали кога се загреваат. Во овој случај, се формираат соли на сулфурна киселина, но водородот не се ослободува, туку се произведуваат други супстанции, како што е сулфур диоксид.
Така, кога концентрираната сулфурна киселина се загрева со бакар, сулфурната киселина прво го оксидира бакарот во бакар оксид, а самата се редуцира до сулфурна киселина, која веднаш се распаѓа на сулфур диоксид и вода:

Добиениот бакар оксид реагира со вишокот на сулфурна киселина за да формира сол и вода:
Така, бакарниот оксид е средна супстанција во оваа реакција. Додавајќи ги овие равенки, ја добиваме равенката за конечна реакција, која ги вклучува само почетните и завршните супстанции:

Тестот е дизајниран во четири верзии. Секоја опција вклучува два дела. Првиот дел содржи 14 задачи со избор на одговори (основно ниво на сложеност), вториот дел содржи две задачи (Б1 и Б2) со краток одговор (зголемено ниво на сложеност). Се препорачува за ученици од 9-то одделение како тековна контрола, како и за подготовка за Единствен државен испит.
Преземи:
Преглед:
ТЕСТ на тема „Периодично право и периодичен систем
Хемиски елементи Д.И. Менделеев“
Опција број 1
А1. Атомот на сулфур има ист број на електрони во неговото надворешно ниво и полнењето на неговото јадро, соодветно.
1) 4 и +16 2) 6 и +32 3) 6 и +16 4) 4 и +32
А2. Атомите на арсен и арсен имаат слична структура на надворешниот електронски слој.
Алуминиум→силициум→фосфор→сулфур
Највисока состојба на оксидација
А4. Привлекување на електрони од надворешниот слој до јадротосе зголемува во серија
2) зголемување на силата на привлекување на валентни електрони кон јадрото
3) намалување на електронегативноста
А6. Со цел зголемување на неметалните својства, тие се лоцирани
А7. Најголемиот радиус на атом
1) бром 2) цинк 3) калциум 4) германиум
А8. Има најголема ресторативна активност
1) Si 2) P 3) S 4) C1
А9. Највисокиот оксиден состав ЕО го формираат сите елементи
1) Група IV А 2) Група IIA 3) Период IV 4) Период II
А10. Според бројот на периодот можете да го одредите
1) бројот на електрони на надворешното ниво на атомот 3) полнежот на атомското јадро
2) бројот на сите електрони во атомот 4) бројот на енергетските нивоа во атомот
А11. Колку нивоа на енергија има во атом на скандиум?
1) 1 2) 2 3) 3 4) 4
А. Металните и намалувачките својства на елементите во главните подгрупи се зголемуваат со зголемување на нуклеарното полнење.
Б . Како што се зголемува нуклеарното полнење, се зголемуваат основните својства на оксидите и хидроксидите.
Б1.
Б2.
Опција бр. 2
1) Ca 2+ 2) Al 3+ 3) Na + 4) F ─
А2. Атоми на силикон и
1) фосфор 2) селен 3) германиум 4) ванадиум
А3. Во серијата хемиски елементи:
алуминиум→силициум→фосфор→сулфуратомски радиус
1) се зголемува 3) не се менува
2) се намалува 4) прво се зголемува, а потоа се намалува
се зголемува во серија
А5. Во серијата се јавува Be-B-C-N
1) зголемување на радиусот на атомите
4) намалување на бројот на валентни електрони
1) само А е точно 2) само Б е точно 3) двете пресуди се точни 4) двете пресуди се неточни
1) A1 2) Mg 3) Na 4) Si
Б1.
1) полнежите на атомските јадра се намалуваат
2) се зголемува бројот на електрони во надворешниот електронски слој
3) електронегативноста се намалува
4) радиусот на атомите се намалува
5) металните својства се зајакнати
Б2.
Опција бр. 3
А1. Бројот на валентни електрони во атом на стронциум е
1) 2 2) 3 3) 4 4) 38
А2. Што го одредува местото на хемискиот елемент во периодниот систем на Менделеев?
1) бројот на електрони на надворешното ниво на атомот 3) полнежот на атомското јадро
2) бројот на неутрони во јадрото 4) масата на атомот
А3. Парот на елементи кои имаат најмногу слични хемиски својства е
1) Ca и K 2) Na и K 3) B и C 4) C и O
А4. Во која серија се распоредени хемиските елементи по опаѓачки редослед на нивните атомски радиуси?
1) N, C, B 2) N, P, како 3) Na, Mg, K 4) Si, C, N
А5. Има најголема ресторативна активност
1) Si 2) P 3) S 4) C1
А6. Формула на повисокиот оксид формиран од елемент од четвртата група
1) EO 2 2) E 2 O 3 3) EO 3 4) E 2 O 5
А7. Во серијата хемиски елементи Si─ P ─ S
1) се зголемува бројот на валентни електрони во атомите
2) бројот на валентни електрони во атомите се намалува
3) електронегативноста се намалува
4) зголемување на атомските радиуси
А8. Привлекување на електрони од надворешниот слој до јадротосе зголемува во серија
1) Si-P-N 2) S-P-As 3) Na-K-Rb 4) Si-Ca-K
А. Елементите од главната подгрупа имаат ист број на електрони во надворешното ниво
Б. Во главните подгрупи, способноста за намалување се зголемува со намалување на атомскиот радиус
1) само А е точно 2) само Б е точно 3) двете пресуди се точни 4) двете пресуди се неточни
А10. Највисоката состојба на оксидација во низата хемиски елементи е хлор-бром-јод
1) се зголемува 2) не се менува 3) се намалува 4) периодично се менува
А11. Во која серија се распоредени хемиските елементи по редослед на зголемување на металните својства?
1) Br- Se- K 2) Mg- Al- Si 3) N- Li- C 4) S- Cl - P
А12. Со цел зголемување на неметалните својства, тие се лоцирани
1) S-Se 2) Se-Br 3) Br-I 4) I-Te
А13. Хидроксидот има најсилни основни својства
1) KOH 2) NaOH 3) RbOH 4) CsOH
А14. Киселите својства се најизразени кај
1) Br 2 O 7 2) SeO 3 3) Како 2 O 5 4) GeO 2
Б1. Во серијата хемиски елементи Na ─ Mg─ A1:
1) полнежите на атомските јадра се намалуваат
2) се зголемува бројот на електрони во надворешниот електронски слој
3) електронегативноста се намалува
4) радиусот на атомите се намалува
5) металните својства се зајакнати
Б2. Во серијата хемиски елементи F─ Br ─ I:
1) сите елементи имаат највисока состојба на оксидација еднаква на бројот на групата
2) ослабуваат неметалните својства
3) се зголемува највисоката состојба на оксидација
4) радиусот на атомите се зголемува
5) формираат испарливи водородни соединенија со општа формула NE
Опција бр. 4
А1. Бројот на електрони во атом на аргон е еднаков на бројот на електрони во јон
1) Mg 2+ 2) Al 3+ 3) Na + 4) C1 ─
А2. Атомите на сулфур и
1) фосфор 2) селен 3) германиум 4) ванадиум
А3. Во серијата хемиски елементи:
алуминиум→силициум→фосфор→сулфуратомски радиус
1) се зголемува 3) не се менува
2) се намалува 4) прво се зголемува, а потоа се намалува
А4. Способност за донирање електронисе зголемува во серија
1) Si-P-S 2) S-P-Cl 3) Na-K-Rb 4) Ca-K-Na
А5. Во серијата се јавува Be-B-C-N
1) намалување на бројот на валентни електрони
2) намалување на силата на привлекување на валентни електрони кон јадрото
3) зголемување на електронегативноста
4) зголемување на радиусот на атомите
А6. Металните својства се подобрени по ред
1) Mg-Ca-Ba 2) Na-Mg-Al 3) K-Ca-Fe 4) Se-Ca-Mg
А7. Најголемата количина на енергија мора да се потроши за да се отстрани електрон од атомот.
1) сулфур 2) силициум 3) калциум 4) арсен
А. Во главната подгрупа, со зголемување на нуклеарното полнење, киселинските својства на хидроксидите слабеат.
Б . Како што се зголемува нуклеарното полнење, неметалните својства на елементите се зголемуваат.
1) само А е точно 2) само Б е точно 3) двете пресуди се точни 4) двете пресуди се неточни
А9. Хидроксидот има најсилни основни својства
1) фосфор 2) калциум 3) магнезиум 4) бариум
А10. Елемент кој покажува најизразени метални својства
1) A1 2) Mg 3) Na 4) Si
А11. Во серијата B→C→N→O, оксидирачки својства
1) ослабне 2) зајакне 3) не се менува 4) периодично менува
А12. Во главните подгрупи со зголемен атомски број, металните својства на елементот
1) интензивира 2) ослабне 3) не се менува 4) периодично менува
А13. Во серијата Na→K→Rb→Cs, способноста на металите да даруваат електрони
1) слабее 2) зајакнува 3) не се менува 4) периодично се менува
А14. Елемент чиј атом има четири електрони во својата надворешна обвивка
1) берилиум 2) титаниум 3) германиум 4) фосфор
Б1. Во серијата хемиски елементи Li ─ Be ─ B:
1) полнежите на атомските јадра се намалуваат
2) се зголемува бројот на електрони во надворешниот електронски слој
3) електронегативноста се намалува
4) радиусот на атомите се намалува
5) металните својства се зајакнати
Б2. Елементите на 3. период се карактеризираат со
1) намалување на атомскиот радиус со зголемување на нуклеарното полнење
2) ист број на валентни електрони
3) ист број на електронски нивоа во атомите
4) зголемување на киселиот карактер на повисоките хидроксиди формирани од овие елементи
5) иста состојба на агрегација во нормални услови
Одговори:
опции |
||||
Вежбајте | ||||
1) (2 поени). Откриени се атомски јадра:
А.Д. Менделеев. В. Џеј Томсон.
Б.Е.Радерфорд. Г.Д.Чадвиг.
2) (2 поени). Бројот на периодот во периодичниот систем се одредува со:
А). Полнење на јадрото на атомот.
Б). Бројот на електрони во надворешниот слој на атомот.
ВО). Бројот на електронски слоеви во атомот.
G). Бројот на електрони во атомот.
3*) (2 поени). Обликот на електронските орбитали се карактеризира со:
А). Главен квантен број.
Б). Магнетен квантен број.
ВО). Орбитален квантен број.
G). Спин квантен број.
4) (2 поени). Пар елементи кои имаат слична структура на надворешното и преднадворешното ниво на енергија:
А). S и Cl. Б). Биди и Б. Б). Кр и Ксе. G). Мо и Се.
5) (2 поени). П-елементот е:
А). Скандиум. Б). бариум. ВО). Арсен. G). Хелиум.
6) (2 поени). Електронската конфигурација …3d104s2 одговара на елементот:
А). Калциум. Б). Криптон. ВО). Кадмиум. G). Цинкот.
7) (2 поени). Амфотеричен хидроксид е супстанца чија формула е:
А). Zn(OH)2. Б). Mg(OH)2. ВО). Ca(OH)2. G). Cr(OH)2.
8) (2 поени). Низа елементи распоредени по редослед на зголемување на металните својства:
А). Mg-Ca-Zn. Б). Al-Mg-Ca. ВО). Ср-Рб-К. G).Ge-Si-Sb.
9) (2 поени). Елементот Е со електронска формула 1s22s22p63s23p63d104s24p1 формира повисок оксид што одговара на формулата:
А). E2O. Б). E2O3. ВО). ЕО2. G). ЕО3.
10) (2 поени) Изотоп на железо, чие јадро содржи 22 неутрони, се означува со:
А). 40/20Ca. Б). 42/20Ca. ВО). 44/20Ca. G). 48/20Ca.
11) (9 поени). Натпревар.
А).1s22s22p63s23p1 1). Алуминиум.
Б).1s22s22p63s2 2). Калиум.
Б).1s22s22p63s23p63d104s24p4 3). Селен.
Г).1s22s22p63s23p64s1 4). Магнезиум.
Формула за повисок оксид.
1.E2O 2.E2O3 3.EO 4.EO3.
Формула за повисока хидроксид
1.EON 2. E(OH)2 3. E(OH)3 4.H2EO4.
12) (3 поени). Врз основа на нивната позиција во Периодниот систем, подредете ги елементите: Германиум, Арсен, Сулфур, Фосфор - по опаѓачки редослед на оксидирачките својства. Објаснете го вашиот одговор.
13) (6 поени). Како и зошто се менуваат металните својства во Периодниот систем?
А). Во рамките на периодот.
Б). Во рамките на главната подгрупа.
14).(7 поени). Направете електронска формула за елемент со атомски број 30 во Периодниот систем. Извлечете заклучок дали овој елемент е метал или неметал. Запишете ги формулите на неговиот повисок оксид и хидроксид, означете ја нивната природа.
15) (5 поени). Кои хемиски својства се карактеристични за оксидот на елемент од третиот период, главната подгрупа од групата VI од Периодниот систем? Потврдете го вашиот одговор со пишување на равенките на реакцијата.
А1. Хемиски знаказотен елемент:
А)
Al б) N в) Na
г) О
А2. Име на ставка
со знакот Fe:
А) Бакар
б) Железо в) Злато г) Алуминиум
А3. Комплексна супстанција
- Ова…
А) јаглерод диоксид б) бакар в)
водород г) кислород
А4. Супстанцијата има најголема релативна молекуларна тежина
Со формула:
А) H2S б) SO2 в) K2S г) CuS
А5.
Елемент од третиот период од главната подгрупа од групата II
Периодичен систем на хемиски елементи Д.И. Менделеев е ...
А) алуминиум б) берилиум в) магнезиум г) калциум
А6. Означување на изотоп чие јадро содржи 8 протони и
8 неутрони:
А) 168О б) 178О в) 188О г) 198О
А7. Атом на хемиски елемент чија електронска обвивка содржи
16 електрони:
А) Кислород б) Сулфур
в) Хлор
г) Натриум
А8. Атомот содржи два електронски слоја (нивоа на енергија):
А) Бора
б) калиум в) алуминиум г) магнезиум
А9. Пар хемиски елементи кои имаат на надворешно енергетско ниво
По 4 електрони:
А) P и C б) Si и Ca в) N и P г) C и Si
А11. Информации за
број на енергетски (електронски) нивоа
Атомот на елементот дава:
А) период број б) група број в)
атомски број г) релативна атомска маса
А10. Најмалку електронегативни
елемент (од наведените):
А) Азот
б) Водород в) Хлор г) Фосфор
А12.Хемиски
елемент со 20е;20р11;20n01
А) Mg
б) Na в) Ве г) Ca
Б1. Атом или јон
со следнава дистрибуција на електрони преку енергетските нивоа 2e8e:
А) Не
б) Ca+2 в) Mg+2 г) Na+
Б2. Изберете
хемиски елементи распоредени по редослед на намалување на металните својства:
А) Ли, Ф, На, О б) Ли, На, О, Ф
в) F, Na, O, Li г) F, O, Na, Li
Б3. Калиумовите јони и
хлорот има:
А) истиот нуклеарен полнеж
Б) истиот роднина
молекуларна тежина
Б) ист вкупен број
електрони
Г) ист број на електрони по
надворешно ниво на енергија
C1. Запишете ги дијаграмите
формирање на соединенија кои се состојат од атоми на хемиски елементи:
А)
водород и флуор б) магнезиум и хлор
Дефинирајте го типот
хемиска врска во нив
C2. Напиши
соединенија со ковалентна поларна врска: O2, Li, H2Se, K2O, BaCl2,
Fe, J2, FeS, HJ, SO3,
S, ZnО
се однесуваат? Зошто?
2) Напиши ги хемиските формули на повисоките оксиди на елементите Mg и S. На кои оксиди (основни, кисели или амфотерни) припаѓаат? Зошто?
3) Напиши ги хемиските формули на повисоките оксиди на елементите Ca и Cl. Кои оксиди (основни, кисели или амфотерични) се тие? Зошто?
4) Напиши ги хемиските формули на повисоките оксиди на елементите K и N. На кои оксиди (основни, кисели или амфотерни) припаѓаат? Зошто?
5) Напиши ги хемиските формули на повисоките оксиди на елементите Si и Li. Кои оксиди (основни, кисели или амфотерични) се тие? Зошто?
Опција 2. ДЕЛ А. Тест ставки со повеќе избор. ^1.(2 поени). Електронска формула на атом на елемент од главната подгрупа од групата IV, период 3Периодичен систем: A. 1s22s22p2. Б. 1s22s22p63s23p4. V. 1s22s22p63s23p2. G. 1s22s22p63s23p6. ^2.(2 поени). Повисоките оксиди и хидроксиди на елемент од главната подгрупа од групата V од Периодниот систем одговараат на општите формули: A. E02 и H2EO3. B. E03 и N2EO4. B. E2O5 и NEO3. G. E2O7 и NEO4. ^3.(2 поени). Оксидирачките својства слабеат кај повеќе елементи: A. P-N-O-F. B. C1-S-P-As. B. Br-C1-F-I. G. V-S-N-R. 4.(2 поени). Електронската формула Is22s22p63s2 одговара на честичка чија ознака е: A.S0. Б.А13+. B.S4+. G, Si0. 5.(2 поени). Ковалентна поларна врска се формира во соединение чија формула е: A. PH3. Б. Нал. B. 02. D. S02 6.(2 поени). Валентната и оксидациската состојба на азотот во азотна киселина се соодветно еднакви: A. Пет и +5. Б. Четири и +5. Б. Три и +5. D. Три и + 3. 7. (2 поени). Атомската кристална решетка има: A. Озон. Б. Дијамант. Б. Кислород. G. Водород. 8.(2 поени). Киселини својства во низа соединенија чии формули се N2O5 - P2O5 - As2O5: ^ A. Периодично менување. Б. Не менувај. Б. Интензивирајте. D. Ослабени. 9.(2 поени). Едноставната супстанција сулфур влегува во интеракција со секоја од супстанциите од серијата: A. HC1, Na, 02. B. K, Zn, Na2SO4. B. Mg, 02, H2. G. A1, N20, 02.10 (2 поени). Шемата за трансформација C-4 → C+4 одговара на равенката: A. CH4 + O2 = C + 2H2O. B. C + O2 = CO2. B. CH4 + 2O2 = CO2 + 2H2O. ^ G. CO2 + C = 2CO. ДЕЛ Б. Прашања со бесплатен одговор. 11. (10 поени). Напишете ги равенките на реакцијата со кои можете да ги извршите следните трансформации: NH3 ← N2 → NO → NO2 → HNO3. Наведете ги видовите на хемиски реакции. 12.(4 поени). Кој гас ќе заземе поголем волумен (n.v.): 100 g јаглерод диоксид или 5 g водород? Потврдете го вашиот одговор со пресметки. ^ 13.(4 поени). Во кое соединение ковалентната врска ќе биде пополарна: метан или силин? Дајте образложен одговор. 14.(6 поени). Подредете ги коефициентите во шемата за реакција P + H2SO4(KOH.) → H3PO4 + SO2 + H2O користејќи го методот на електронска рамнотежа. Наведете го оксидирачкиот агенс и средството за редукција. 15. (6 поени). 13 g цинк се ставени во киселината добиена со растворање на 11,2 литри гас водород хлорид (HC) во вода. Пресметајте го волуменот на гасот ослободен за време на овој процес (бр.).
1. Која едноставна супстанција - формирана од елементите бр. 11, бр. 12 или бр. 13 - има најизразени метални својства? Зошто? Напишете ги формулите на хидроксидите на овие елементи и означете ја нивната природа.
2. Идентификувајте го најтипичниот метал и неметал од 4-тиот период. Оправдајте го вашиот одговор.
Типичен метал од четвртиот период е K, неметал е Kr (метализмот се зголемува од десно кон лево низ периодот). Типичните метали содржат 1-2 електрони во нивното надворешно енергетско ниво (калиумот има 1), а неметалите имаат повеќе од 4 (криптонот има 8).
3. Која едноставна супстанција - формирана од елементот бр. 14, бр. 15 или бр. 16 - има најизразени неметални својства? Зошто? Напишете ги формулите на киселините што одговараат на повисоките оксиди на овие елементи. 
4. Елемент со константна валентност од два се наоѓа во 4-тиот период. Неговиот оксид и хидроксид се основни по природа. Кој елемент е ова? Каква е структурата на неговиот атом? Напишете ги формулите за оксидот и хидроксидот на овој хемиски елемент.
Ca. Атомска структура: 20 електрони, 20 протони, 20 неутрони. Основно полнење +20. Во надворешното енергетско ниво има два електрони. CaO – калциум оксид, Ca(OH)2 – калциум хидроксид.
5. Наведете го серискиот број, полнежот на јадрото и пресметајте го бројот на протони, неутрони и електрони во волумени од: а) калиум (41K); б) берилиум (9Be); в) магнезиум (24Mg); г) калциум (42Ca); д) алуминиум (27Al); д) титаниум (48Ti); е) ванадиум (51V); ж) железо (56Fe). 
6. Како се разликува составот на изотопските јадра: а) 63Cu и 65Cu; б) 107Ag и 109Ag? Дајте образложен одговор врз основа на пресметки. 
7. Пресметај ги моларните маси на супстанциите чии формули се 2SO, NO3, O. Напиши ги формулите на сличните соединенија што го содржат изотопот H и пресметај ги нивните моларни маси. 
8. Колку молекули на сулфур оксид (IV) со различна маса може да се формираат од заемното дејство на изотопите 16O, 17O, 18O и 32S? Запишете ги формулите за сите молекули и пресметајте ги нивните моларни маси. 
9. Напиши ги електронските формули на атомите: а) сулфур и натриум; б) аргон и калиум; в) калциум и хлор; г) неон и алуминиум; д) силициум и бром; д) арсен и јаглерод. 
10. Врз основа на теоријата за атомска структура објаснете ги причините за периодичноста на промените во својствата на елементите и нивните соединенија. Потврдете го вашиот одговор со конкретни примери.
Својствата на едноставни супстанции и соединенија на елементите се повторуваат периодично бидејќи електронските конфигурации на атомите периодично се повторуваат. Така, атомите Be, Mg, Ca, Sr, Ba имаат иста структура на надворешната електронска обвивка, таа содржи 2 електрони. Овие елементи лесно се откажуваат од нив, покажувајќи редуцирачки својства и состојба на оксидација од +2.
11. Како да се објасни, врз основа на теоријата на атомската структура, остриот премин од инертни гасови кон алкални метали?
Во благородните гасови, надворешното енергетско ниво е завршено откако ќе се додаде уште еден електрон на него, се полни уште едно енергетско ниво, кое станува надворешно. Еден електрон во надворешното енергетско ниво е карактеристика на алкалните метали.
12. Определи го местото на елементите во периодниот систем користејќи ги електронските формули на нивните атоми: 1s2 2s2 2p6 3s2; 1s2 2s2 2p6 3s2 3p6; 1s2 2s2 2p6 3s2 3p6 4s2. Составете формули на оксиди и хидроксиди и киселини кои одговараат на овие елементи.

13. Врз основа на нивната позиција на периодниот систем, карактеризирајте ги елементите калиум, бром и алуминиум. 
14. Оксидот на елементот (метал од третиот период) има молекуларна тежина 102. Идентификувајте го елементот и нацртајте дијаграм за структурата на неговиот атом. Напишете ги формулите на оксидот и хидроксидот на овој елемент и означете ја нивната природа. 
15. Пресметај ја масата (н.с.): а) 8,96 литри гасовита соединение на флуор со водород; б) 13,44 литри гасовита соединение на фосфор со водород; в) 17,92 литри гасовити соединенија од сулфур и водород. 
16. Елементите А и Б припаѓаат на истиот период. Едноставна супстанција формирана од елементите А бурно реагира со вода. Едноставна супстанција формирана од елементот Б е тешка, токсична, црвено-кафена течност со непријатен мирис. За кои елементи зборуваме?
Br – елемент B (Br2 е тешка токсична црвено-кафеава течност). К – елемент А, бурно реагира со вода. Ca - исто така комуницира со вода, но не толку насилно како К.
17. Супстанцијата што се користи како минерално ѓубриво се состои од два елементи - А и Б. Едноставната супстанција што одговара на елементот А е алкален метал. Елементот А припаѓа на истиот период како и елементот што го формира единствениот неметал кој е течен во обични услови. Елементот Б е во групата VIIA, неговите атоми се дел од кујнска сол. Идентификувајте ги елементите А и Б и запишете: а) електронски формули на нивните атоми; б) формулата на супстанцијата формирана при нивната интеракција.
18. Елементите X и Y се во 2-ри период. Едноставна супстанција формирана од елементот X реагира со вода и ослободува водород. Молекуларната маса на водородното соединение на елементот Y е 20. Идентификувајте ги овие елементи и напишете: а) електронски формули на нивните атоми; б) равенката на заемно дејство на едноставни супстанции формирана од овие елементи; в) равенката за реакција на хидроксидот на елементот X со испарливото водородно соединение на елементот Y.
19. Какви хемиски својства има елементот со атомски број 34? На кој елемент неговите својства се најмногу слични? даде аргументиран одговор врз основа на позициите на елементите во периодниот систем. 
20. Најдете во периодниот систем елемент кој се наоѓа во 4-тиот период, 5-ти ред и покажува валентност од шест кога се комбинира со кислород. Која е неговата валентност кога се комбинира со водород? Напиши ги формулите на овие соединенија.
Се. SeO3 – селен оксид (VI), H2Se (валентност на селен во комбинација со водород – II).