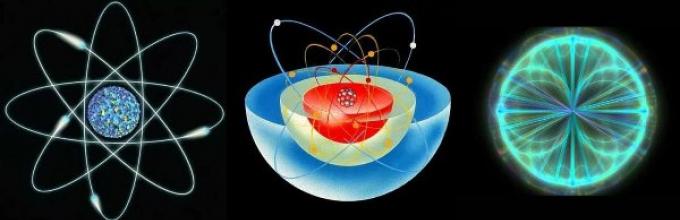
Состав на атомот.
Атомот е составен од атомско јадро И електронска обвивка .
Јадрото на атомот се состои од протони ( p+) и неутрони ( n 0). Повеќето атоми на водород имаат јадро кое се состои од еден протон.
Број на протони Н(p+) е еднаков на нуклеарниот полнеж ( З) и редниот број на елементот во природната серија на елементи (и во периодниот систем на елементи).
Н(стр +) = З
Збир на неутрони Н(n 0), означено едноставно со буквата Ни број на протони Зповикани масен броји се означува со писмото А.
А = З + Н
Електронската обвивка на атомот се состои од електрони кои се движат околу јадрото ( д -).
Број на електрони Н(д-) во електронската обвивка на неутрален атом е еднаква на бројот на протони Зво неговото јадро.
Масата на протонот е приближно еднаква на масата на неутронот и 1840 пати поголема масаелектрон, така што масата на атомот е практично еднаква на масата на јадрото.
Обликот на атомот е сферичен. Радиусот на јадрото е приближно 100.000 пати помал од радиусот на атомот.
Хемиски елемент- тип на атоми (збирка на атоми) со ист нуклеарен полнеж (со ист број на протони во јадрото).
Изотоп- збирка на атоми од ист елемент со ист број на неутрони во јадрото (или тип на атом со ист број на протони и ист број на неутрони во јадрото).
Различни изотопи се разликуваат едни од други по бројот на неутрони во јадрата на нивните атоми.
Означување на поединечен атом или изотоп: (Симболот на елементот Е), на пример: .
Структура на електронската обвивка на атомот
Атомска орбитала- состојба на електрон во атом. Симболот за орбиталата е . Секоја орбитала има соодветен електронски облак.
Орбиталите на реалните атоми во основната (невозбудена) состојба се од четири типа: с, стр, гИ ѓ.
Електронски облак- делот од просторот во кој може да се најде електрон со веројатност од 90 (или повеќе) проценти.
Забелешка: понекогаш концептите „атомска орбитала“ и „електронски облак“ не се разликуваат, нарекувајќи ги и двете „атомска орбитала“.
Електронската обвивка на атомот е слоевита. Електронски слојформирани од електронски облаци со иста големина. Се формираат орбитали од еден слој електронско („енергетско“) ниво, нивните енергии се исти за атомот на водород, но различни за другите атоми.
Орбиталите од ист тип се групирани во електронски (енергетски)поднивоа:
с-подниво (се состои од едно с-орбитали), симбол - .
стр-подниво (се состои од три стр
г-подниво (се состои од пет г-орбитали), симбол - .
ѓ-подниво (се состои од седум ѓ-орбитали), симбол - .
Енергиите на орбиталите од истото подниво се исти.
При означување на поднивоа, бројот на слојот (електронско ниво) се додава на симболот на поднивото, на пример: 2 с, 3стр, 5гзначи с-подниво на второ ниво, стр-подниво на трето ниво, г-подниво на петто ниво.
Вкупниот број на поднивоа на едно ниво е еднаков на бројот на нивоата n. Вкупниот број на орбитали на едно ниво е еднаков на n 2. Според тоа, вкупниот број на облаци во еден слој е исто така еднаков на n 2 .
Ознаки: - слободна орбитала (без електрони), - орбитала со неспарен електрон, - орбитала со електронски пар (со два електрони).
Редоследот по кој електроните ги исполнуваат орбиталите на атомот е одреден со три природни закони (формулациите се дадени во поедноставени термини):
1. Принципот на најмала енергија - електроните ги пополнуваат орбиталите по редослед на зголемување на енергијата на орбиталите.
2. Паули принцип - не може да има повеќе од два електрони во една орбитала.
3. Хандово правило - во рамките на едно подниво, електроните прво ги исполнуваат празните орбитали (една по една), а дури потоа формираат електронски парови.
Вкупниот број на електрони во електронското ниво (или електронскиот слој) е 2 n 2 .
Распределбата на поднивоата по енергија се изразува на следниов начин (по редослед на зголемување на енергијата):
1с, 2с, 2стр, 3с, 3стр, 4с, 3г, 4стр, 5с, 4г, 5стр, 6с, 4ѓ, 5г, 6стр, 7с, 5ѓ, 6г, 7стр ...
Оваа низа е јасно изразена со енергетски дијаграм:
Распределбата на електроните на атомот низ нивоа, поднивоа и орбитали (електронска конфигурација на атомот) може да се прикаже како електронска формула, енергетски дијаграм или, поедноставно, како дијаграм на електронски слоеви („електронски дијаграм“).
Примери електронска структураатоми:
Валентни електрони- електрони на атомот кои можат да учествуваат во формирањето хемиски врски. За секој атом, ова се сите надворешни електрони плус оние преднадворешни електрони чија енергија е поголема од онаа на надворешните. На пример: атомот на Ca има 4 надворешни електрони с 2, тие се исто така валентни; атомот на Fe има 4 надворешни електрони с 2 но тој има 3 г 6, затоа атомот на железо има 8 валентни електрони. Валентната електронска формула на атомот на калциум е 4 с 2, а атоми на железо - 4 с 2 3г 6 .
Периодичен систем на хемиски елементи од Д.И. Менделеев
(природен систем на хемиски елементи)
Периодичен законхемиски елементи (модерна формулација): својства на хемиски елементи, како и едноставни и комплексни супстанции, формирани од нив, периодично зависат од вредноста на полнежот од атомските јадра.
Периодичен систем- графички израз на периодичниот закон.
Природна серија на хемиски елементи- низа хемиски елементи распоредени според зголемениот број на протони во јадрата на нивните атоми или, што е исто, според зголемените полнежи на јадрата на овие атоми. Атомскиот број на елементот од оваа серија е еднаков на бројот на протони во јадрото на кој било атом на овој елемент.
Табелата на хемиски елементи е изградена со „сечење“ на природната серија на хемиски елементи во периоди(хоризонтални редови на табелата) и групирања (вертикални колони на табелата) на елементи со слична електронска структура на атомите.
Во зависност од начинот на кој ги комбинирате елементите во групи, табелата може да биде долг период(елементите со ист број и тип на валентни електрони се собираат во групи) и краток период(елементите со ист број на валентни електрони се собираат во групи).
Групите табели со краток период се поделени во подгрупи ( главенИ страна), што се совпаѓа со групите од табелата со долг период.
Сите атоми на елементи од истиот период имаат ист број на електронски слоеви, еднаков на бројот на периодот.
Број на елементи во периоди: 2, 8, 8, 18, 18, 32, 32. Повеќето елементи од осмиот период се добиени вештачки, а последните елементи од овој период сè уште не се синтетизирани. Сите периоди освен првиот започнуваат со формирање на елемент алкален метал(Li, Na, K, итн.) и завршуваат со елемент за формирање благороден гас (He, Ne, Ar, Kr итн.).
Во табелата со краток период има осум групи, од кои секоја е поделена на две подгрупи (главна и секундарна), во табелата со долг период има шеснаесет групи, кои се нумерирани со римски броеви со буквите А или Б, за пример: IA, IIIB, VIA, VIIB. Групата IA од табелата со долг период одговара на главната подгрупа од првата група од табелата со краток период; група VIIB - секундарна подгрупа од седмата група: останатите - слично.
Карактеристиките на хемиските елементи природно се менуваат во групи и периоди.
Во периоди (со зголемување на серискиот број)
- нуклеарното полнење се зголемува
- бројот на надворешни електрони се зголемува,
- радиусот на атомите се намалува,
- јачината на врската помеѓу електроните и јадрото се зголемува (енергија на јонизација),
- електронегативноста се зголемува,
- оксидирачките својства се зајакнати едноставни материи(„неметаличност“),
- слабеат намалувачките својства на едноставните супстанции („металност“),
- го ослабува основниот карактер на хидроксидите и соодветните оксиди,
- се зголемува киселиот карактер на хидроксидите и соодветните оксиди.
Во групи (со зголемен сериски број)
- нуклеарното полнење се зголемува
- радиусот на атомите се зголемува (само во А-групите),
- јачината на врската помеѓу електроните и јадрото се намалува (енергија на јонизација; само во А-групи),
- електронегативноста се намалува (само во А-групите),
- ослабуваат оксидирачките својства на едноставните супстанции („неметаличност“; само во А-групи),
- намалувачките својства на едноставните супстанции се зајакнати („металичност“; само во А-групи),
- основниот карактер на хидроксидите и соодветните оксиди се зголемува (само во А-групите),
- го ослабува киселиот карактер на хидроксидите и соодветните оксиди (само во А-групи),
- се намалува стабилноста на водородните соединенија (нивната редуцирачка активност се зголемува; само во А-групите).
Задачи и тестови на тема „Тема 9. „Структура на атомот. Периодичен закон и периодичен систем на хемиски елементи од Д.И. Менделеев (ПШЕ) "."
- Периодичен закон - Периодичен закон и структура на атомите оценки 8–9
Мора да ги знаете: законите за полнење на орбиталите со електрони (принципот на најмала енергија, принципот на Паули, правилото на Хунд), структурата на периодниот систем на елементи.Мора да бидете способни: да го одредите составот на атомот според положбата на елементот во периодниот систем и, обратно, да пронајдете елемент во периодниот систем, знаејќи го неговиот состав; прикажете го дијаграмот на структурата, електронската конфигурација на атом, јон и, обратно, од дијаграмот и електронската конфигурација одреди ја позицијата на хемискиот елемент во PSCE; карактеризирање на елементот и супстанциите што ги формира според неговата позиција во PSCE; да ги определи промените во радиусот на атомите, својствата на хемиските елементи и супстанциите што тие ги формираат во еден период и една главна подгрупа на периодичниот систем.
Пример 1.Одреди го бројот на орбитали во третото електронско ниво. Кои се овие орбитали?
За да го одредиме бројот на орбитали, ја користиме формулата Норбитали = n 2 каде n- број на ниво. Норбитали = 3 2 = 9. Еден 3 с-, три 3 стр- и пет 3 г-орбитали.Пример 2.Определи кој атом на елемент има електронска формула 1 с 2 2с 2 2стр 6 3с 2 3стр 1 .
За да одредите за кој елемент станува збор, треба да го дознаете неговиот атомски број, кој е еднаков на вкупниот број на електрони на атомот. Во овој случај: 2 + 2 + 6 + 2 + 1 = 13. Ова е алуминиум.Откако ќе се уверите дека се што ви треба е научено, продолжете со завршување на задачите. Ви посакуваме успех.
Препорачана литература:- О.С.Габриелјан и др.Хемија 11 одд. М., Бустард, 2002;
- Г. Е. Руџитис, Ф. Г. Фелдман. Хемија 11 одделение. М., Образование, 2001 година.
Како што знаете, сè што е материјално во Универзумот се состои од атоми. Атомот е најмалата единица на материјата која ги носи своите својства. За возврат, структурата на атомот е составена од магично тројство на микрочестички: протони, неутрони и електрони.
Покрај тоа, секоја од микрочестичките е универзална. Односно, не можете да најдете два различни протони, неутрони или електрони во светот. Сите тие се апсолутно слични едни на други. И својствата на атомот ќе зависат само од квантитативниот состав на овие микрочестички во општа структураатом.
На пример, структурата на атом на водород се состои од еден протон и еден електрон. Следниот најкомплексен атом, хелиумот, се состои од два протони, два неутрони и два електрони. Атом на литиум - направен од три протони, четири неутрони и три електрони итн.
Атомска структура (од лево кон десно): водород, хелиум, литиумАтомите се комбинираат за да формираат молекули, а молекулите се комбинираат за да формираат супстанции, минерали и организми. Молекулата на ДНК, која е основа на сите живи суштества, е структура составена од истите три магични тули на универзумот како каменот што лежи на патот. Иако оваа структура е многу посложена.
Уште повеќе неверојатни фактисе откриваат кога ќе се обидеме подетално да ги разгледаме пропорциите и структурата на атомскиот систем. Познато е дека атомот се состои од јадро и електрони кои се движат околу него долж траекторијата што опишува сфера. Односно, тоа не може ни да се нарече движење во вообичаена смисла на зборот. Наместо тоа, електронот се наоѓа насекаде и веднаш во оваа сфера, создавајќи електронски облак околу јадрото и формирајќи електромагнетно поле.
 Шематски прикази на структурата на атомот
Шематски прикази на структурата на атомот Јадрото на атомот се состои од протони и неутрони, а во него е концентрирана речиси целата маса на системот. Но, во исто време, самото јадро е толку мало што ако неговиот радиус се зголеми на скала од 1 cm, тогаш радиусот на целата атомска структура ќе достигне стотици метри. Така, сè што гледаме како густа материја се состои од повеќе од 99% од енергетските врски само помеѓу физичките честички и помалку од 1% од самите физички форми.
Но, кои се овие физички форми? Од што се направени и како материјал се? За да одговориме на овие прашања, да ги разгледаме подетално структурите на протоните, неутроните и електроните. Значи, се спуштаме уште еден чекор во длабочините на микросветот - до нивото на субатомски честички.
Од што се состои електронот?
Најмалата честичка на атомот е електрон. Електронот има маса, но нема волумен. Во научниот концепт, електронот не се состои од ништо, туку е точка без структура.
Електронот не може да се види под микроскоп. Тоа е видливо само во форма електронски облак, која изгледа како матна сфера околу атомското јадро. Во исто време, невозможно е да се каже со точност каде се наоѓа електронот во одреден момент во времето. Инструментите се способни да ја фатат не самата честичка, туку само нејзината енергетска трага. Суштината на електронот не е вградена во концептот на материјата. Тоа е повеќе како некоја празна форма која постои само при движење и поради движење.

Сè уште не е откриена структура во електронот. Тоа е истата точкаста честичка како енергетскиот квант. Всушност, електронот е енергија, но тој е постабилен облик на него од оној претставен со фотони на светлина.
Во моментов, електронот се смета за неделив. Ова е разбирливо, бидејќи е невозможно да се подели нешто што нема волумен. Сепак, теоријата веќе има развој на настани според кои електронот содржи тројство од такви квазичестички како што се:
- Орбитон – содржи информации за орбиталната положба на електронот;
- Спинон - одговорен за центрифугирање или вртежен момент;
- Холон - носи информации за полнежот на електронот.
Меѓутоа, како што гледаме, квазичестичките немаат апсолутно ништо заедничко со материјата и носат само информации.
 Фотографии од атоми различни супстанцииВ електронски микроскоп
Фотографии од атоми различни супстанцииВ електронски микроскоп
Интересно е што електронот може да апсорбира енергетски кванти, како светлина или топлина. Во овој случај, атомот се движи на ново енергетско ниво, а границите на електронскиот облак се шират. Исто така, се случува енергијата што ја апсорбира електронот да биде толку голема што може да скокне од атомскиот систем и да го продолжи своето движење како независна честичка. Во исто време, тој се однесува како фотон на светлина, односно се чини дека престанува да биде честичка и почнува да ги покажува својствата на бранот. Ова беше докажано во експеримент.
Јунговиот експеримент
За време на експериментот, млаз од електрони беше насочен кон екран со два процепи исечени во него. Поминувајќи низ овие процепи, електроните се судриле со површината на друг проекциски екран, оставајќи свој белег на неа. Како резултат на ова „бомбардирање“ на електрони, на екранот на проекцијата се појави шема на пречки, слична на онаа што би се појавила ако брановите, но не и честичките, поминат низ два процепи.
Оваа шема настанува затоа што бранот што минува помеѓу два процепи е поделен на два бранови. Како резултат на понатамошно движење, брановите се преклопуваат еден со друг, а во некои области тие меѓусебно се откажуваат. Резултатот е многу линии на проекцискиот екран, наместо само една, како што би било кога електронот се однесувал како честичка.

Структура на јадрото на атомот: протони и неутрони
Протоните и неутроните го сочинуваат јадрото на атомот. И покрај фактот дека јадрото зафаќа помалку од 1% од вкупниот волумен, во оваа структура е концентрирана речиси целата маса на системот. Но, физичарите се поделени за структурата на протоните и неутроните, и овој моментИма две теории одеднаш.
- Теорија бр. 1 - Стандард
Стандардниот модел вели дека протоните и неутроните се составени од три кваркови поврзани со облак од глуони. Кварковите се точки честички, исто како квантите и електроните. А глуоните се виртуелни честички кои обезбедуваат интеракција на кварковите. Сепак, ниту кваркови ниту глуони никогаш не биле пронајдени во природата, па овој модел е предмет на жестоки критики.
- Теорија #2 - Алтернатива
Но, според алтернативната теорија на унифицирано поле развиена од Ајнштајн, протонот, како неутронот, како и секоја друга честичка физичкиот свет, е електромагнетно поле кое ротира со брзина на светлината.
 Електромагнетни полињачовекот и планетата
Електромагнетни полињачовекот и планетата Кои се принципите на атомската структура?
Сè во светот - тенко и густо, течно, цврсто и гасовито - е само енергетските состојби на безброј полиња кои продираат во просторот на Универзумот. Колку е повисоко нивото на енергија на полето, толку е потенко и помалку забележливо. Колку е пониско нивото на енергија, толку е постабилно и поопипливо. Структурата на атомот, како и структурата на која било друга единица на Универзумот, лежи во интеракцијата на таквите полиња - различни по енергетската густина. Излегува дека материјата е само илузија на умот.
Електрони
Концептот на атом се појавил во античкиот свет за да означи честички од материјата. Во превод од грчки, атом значи „неделив“.

Ирскиот физичар Стони, врз основа на експерименти, дошол до заклучок дека електричната енергија ја носат најмалите честички кои постојат во атомите на сите хемиски елементи. Во 1891 година, Стони предложи овие честички да се наречат електрони, што на грчки значи „килибар“. Неколку години откако електронот го доби своето име, англискиот физичар Џозеф Томсон и францускиот физичар Жан Перин докажаа дека електроните носат негативен полнеж. Ова е најмалиот негативен полнеж, кој во хемијата се зема како еден (-1). Томсон дури успеа да ја одреди брзината на електронот (брзината на електронот во орбитата е обратно пропорционална со бројот на орбитата n. Радиусите на орбитите се зголемуваат пропорционално со квадратот на бројот на орбитата. Во првата орбита на атом на водород (n=1; Z=1) брзината е ≈ 2,2·106 m/s, односно околу сто пати помала од брзината на светлината c = 3·108 m/s) и масата на електронот (тоа е речиси 2000 пати помала од масата на атомот на водород).

Состојба на електрони во атомот
Состојбата на електронот во атомот се подразбира како збир на информации за енергијата на одреден електрон и просторот во кој се наоѓа. Електронот во атомот нема траекторија на движење, т.е. можеме само да зборуваме за тоа веројатноста да се најде во просторот околу јадрото.
 Може да се наоѓа во кој било дел од овој простор што го опкружува јадрото, а севкупноста на неговите различни позиции се смета како електронски облак со одредена негативна густина на полнеж. Фигуративно, ова може да се замисли вака: ако е можно да се фотографира позицијата на електрон во атом по стотинки или милионити делови од секундата, како во фото-финиш, тогаш електронот на таквите фотографии би бил претставен како точки. Кога би биле поставени безброј вакви фотографии, сликата би била електронски облак со најголема густина каде што би имало најмногу од овие точки.
Може да се наоѓа во кој било дел од овој простор што го опкружува јадрото, а севкупноста на неговите различни позиции се смета како електронски облак со одредена негативна густина на полнеж. Фигуративно, ова може да се замисли вака: ако е можно да се фотографира позицијата на електрон во атом по стотинки или милионити делови од секундата, како во фото-финиш, тогаш електронот на таквите фотографии би бил претставен како точки. Кога би биле поставени безброј вакви фотографии, сликата би била електронски облак со најголема густина каде што би имало најмногу од овие точки.
Просторот околу атомското јадро во кој најверојатно ќе се најде електрон се нарекува орбитала. Содржи приближно 90% електронски облак, а тоа значи дека околу 90% од времето електронот е во овој дел од вселената. Тие се разликуваат по форма 4 моментално познати типови на орбитали, кои се означени со латински буквите s, p, d и f. Графичка сликаНекои форми на електронски орбитали се прикажани на сликата.

Најважната карактеристика на движењето на електронот во одредена орбитала е енергија на неговото поврзување со јадрото. Електроните со слични енергетски вредности формираат единствен електронски слој, или енергетско ниво. Нивоата на енергија се нумерирани почнувајќи од јадрото - 1, 2, 3, 4, 5, 6 и 7.
Целиот број n, кој го означува бројот на енергетското ниво, се нарекува главен квантен број. Ја карактеризира енергијата на електроните кои заземаат дадено енергетско ниво. Електроните од првото енергетско ниво, најблиску до јадрото, имаат најниска енергија.Во споредба со електроните од првото ниво, електроните на следните нивоа ќе се карактеризираат со голема понуда на енергија. Следствено, електроните од надворешното ниво се најмалку цврсто врзани за атомското јадро.
Најголемиот број електрони на енергетско ниво се одредува со формулата:
N = 2n 2,
каде N е максималниот број на електрони; n е бројот на нивото или главниот квантен број. Следствено, на првото енергетско ниво најблиску до јадрото не може да има повеќе од два електрони; на вториот - не повеќе од 8; на третиот - не повеќе од 18; на четвртиот - не повеќе од 32.
Почнувајќи од второто енергетско ниво (n = 2), секое од нивоата е поделено на поднивоа (подслоеви), малку различни едни од други во енергијата на врзувањето со јадрото. Бројот на поднивоа е еднаков на вредноста на главниот квантен број: првото енергетско ниво има едно подниво; вториот - два; трето - три; четврто - четири поднивоа. Поднивоата, пак, се формираат од орбитали. Секоја вредностn одговара на бројот на орбитали еднаков на n.
Поднивоата обично се означуваат со латински букви, како и со обликот на орбиталите од кои се состојат: s, p, d, f.

Протони и неутрони

Атом од кој било хемиски елемент е споредлив со мал Сончев систем. Затоа, овој модел на атомот, предложен од Е. Радерфорд, се нарекува планетарен.
Атомското јадро, во кое е концентрирана целата маса на атомот, се состои од честички од два вида - протони и неутрони.
Протоните имаат полнеж еднаков на полнежот на електроните, но спротивен во знакот (+1) и маса еднаква на масатаатом на водород (се зема како единица во хемијата). Неутроните не носат полнеж, тие се неутрални и имаат маса еднаква на масата на протонот.
Протоните и неутроните заедно се нарекуваат нуклеони (од латинскиот јадро - јадро). Збирот на бројот на протони и неутрони во атомот се нарекува масен број. На пример, масениот број на атом на алуминиум е:

13 + 14 = 27
број на протони 13, број на неутрони 14, маса број 27
Бидејќи масата на електронот, која е занемарливо мала, може да се занемари, очигледно е дека целата маса на атомот е концентрирана во јадрото. Електроните се означени како e-.
Од атомот електрично неутрален, тогаш исто така е очигледно дека бројот на протони и електрони во атомот е ист. Тоа е еднакво на серискиот број на хемискиот елемент што му е доделен во Периодичен систем. Масата на атомот се состои од масата на протони и неутрони. Знаејќи го атомскиот број на елементот (Z), т.е. бројот на протони и масовниот број (A), еднаков на збирот на броевите на протоните и неутроните, можете да го најдете бројот на неутрони (N) користејќи ја формулата :

N = A - Z
На пример, бројот на неутрони во атом на железо е:
56 — 26 = 30
Изотопи
Се нарекуваат сорти на атоми од ист елемент кои имаат ист нуклеарен полнеж, но различен масен број изотопи. Хемиските елементи кои се наоѓаат во природата се мешавина од изотопи. Така, јаглеродот има три изотопи со маси 12, 13, 14; кислород - три изотопи со маси 16, 17, 18, итн. Релативната атомска маса на хемиски елемент обично дадена во Периодниот систем е просечната вредност на атомските маси на природна мешавина на изотопи на даден елемент, земајќи ја предвид нивното релативно изобилство во природата. Хемиски својстваИзотопите на повеќето хемиски елементи се сосема исти. Сепак, водородните изотопи се разликуваат во голема мера во својствата поради драматичното повеќекратно зголемување на нивната релативна атомска маса; дури добиваат поединечни имиња и хемиски симболи.

Елементи од првиот период
Дијаграм на електронската структура на атомот на водород:

Дијаграмите на електронската структура на атомите ја покажуваат распределбата на електроните низ електронските слоеви (нивоа на енергија).

Графичка електронска формула на атомот на водород (ја покажува дистрибуцијата на електроните по енергетски нивоа и поднивоа):

Графичките електронски формули на атомите ја покажуваат распределбата на електроните не само меѓу нивоата и поднивоата, туку и меѓу орбиталите.
Во атом на хелиум, првиот електронски слој е завршен - има 2 електрони. Водородот и хелиумот се s-елементи; S-орбиталата на овие атоми е исполнета со електрони.

За сите елементи од вториот период се пополнува првиот електронски слој, а електроните ги исполнуваат s- и p-орбиталите на вториот електронски слој во согласност со принципот на најмала енергија (прво s, а потоа p) и правилата на Паули и Хун.
Во неонскиот атом, вториот електронски слој е завршен - има 8 електрони.
За атомите на елементите од третиот период, првиот и вториот електронски слој се завршени, па се пополнува третиот електронски слој, во кој електроните можат да ги окупираат поднивоата 3s-, 3p- и 3d.
Атомот на магнезиум ја комплетира својата електронска орбитала 3s. Na и Mg се s-елементи.
Во алуминиум и последователни елементи, поднивото 3p е исполнето со електрони.
Елементите од третиот период имаат непополнети 3d орбитали.
Сите елементи од Al до Ar се p-елементи. s- и p-елементите ги формираат главните подгрупи во Периодниот систем.

Елементи од четвртиот - седмиот период
Четвртиот електронски слој се појавува во атомите на калиум и калциум, а поднивото 4s е исполнето, бидејќи има помала енергија од 3d поднивото.
K, Ca - s-елементи вклучени во главните подгрупи. За атомите од Sc до Zn, 3d поднивото е исполнето со електрони. Ова се 3Д елементи. Тие се вклучени во секундарни подгрупи, нивниот најоддалечен електронски слој е пополнет и тие се класифицирани како преодни елементи.
Обрнете внимание на структурата на електронските обвивки на атоми на хром и бакар. Во нив, еден електрон „пропаѓа“ од 4s на 3d подниво, што се објаснува со поголемата енергетска стабилност на добиените електронски конфигурации 3d 5 и 3d 10:

Во атомот на цинкот, третиот електронски слој е завршен - во него се пополнети сите поднивоа 3s, 3p и 3d, со вкупно 18 електрони. Во елементите по цинкот, четвртиот електронски слој, поднивото 4p, продолжува да се пополнува.
Елементите од Ga до Kr се p-елементи.
Атомот на криптон има надворешен слој (четврт) кој е целосен и има 8 електрони. Но, може да има вкупно 32 електрони во четвртиот електронски слој; атомот на криптон сè уште има непополнети поднивоа 4d и 4f. За елементите од петтиот период, поднивоата се пополнуваат по следниот редослед: 5s - 4d - 5p. Исто така, постојат исклучоци поврзани со „ неуспех» електрони, y 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
Во шестиот и седмиот период се појавуваат f-елементи, т.е. елементи во кои се пополнуваат 4f- и 5f-поднивоата на третиот надворешен електронски слој, соодветно.
4f елементите се нарекуваат лантаниди.
5f елементите се нарекуваат актиниди.
Редоследот на пополнување на електронските поднивоа во атомите на елементите од шестиот период: 55 Cs и 56 Ba - 6s елементи; 57 La … 6s 2 5d x - 5d елемент; 58 Ce - 71 Lu - 4f елементи; 72 Hf - 80 Hg - 5d елементи; 81 T1 - 86 Rn - 6d елементи. Но, и овде има елементи во кои е „нарушен“ редоследот на пополнување на електронските орбитали, што, на пример, е поврзано со поголема енергетска стабилност на половина и целосно пополнетите поднивоа f, т.е. nf 7 и nf 14. Во зависност од тоа кое потниво на атомот е последно исполнето со електрони, сите елементи се поделени во четири електронски семејства или блокови:
- s-елементи. s-поднивото на надворешното ниво на атомот е исполнето со електрони; С-елементите вклучуваат водород, хелиум и елементи од главните подгрупи од групите I и II.
- p-елементи. П-поднивото на надворешното ниво на атомот е исполнето со електрони; p-елементите вклучуваат елементи од главните подгрупи од групите III-VIII.
- d-елементи. d-поднивото на преднадворешното ниво на атомот е исполнето со електрони; d-елементите вклучуваат елементи на секундарни подгрупи од групите I-VIII, т.е. елементи на plug-in децении големи периоди лоцирани помеѓу s- и p-елементи. Тие се нарекуваат и преодни елементи.
- f-елементи. F-поднивото на третото надворешно ниво на атомот е исполнето со електрони; тие вклучуваат лантаниди и антиноиди.

Швајцарскиот физичар В. Паули во 1925 година утврдил дека во атом во една орбитала не може да има повеќе од два електрони кои имаат спротивни (антипаралелни) спинови (преведено од англиски како „вретено“), т.е. имаат такви својства што условно може да се замислат како ротација на електрон околу неговата замислена оска: во насока на стрелките на часовникот или спротивно од стрелките на часовникот.

Овој принцип се нарекува Паули принцип. Ако има еден електрон во орбиталата, тогаш тој се нарекува неспарен; ако има два, тогаш тоа се спарени електрони, односно електрони со спротивни спинови. На сликата е прикажан дијаграм на поделба на енергетските нивоа на поднивоа и редоследот по кој тие се пополнуваат.


Многу често, структурата на електронските обвивки на атомите е прикажана со помош на енергија или квантни ќелии - напишани се таканаречените графички електронски формули. За оваа нотација се користи следната нотација: секоја квантна клетка е означена со клетка што одговара на една орбитала; Секој електрон е означен со стрелка што одговара на насоката на центрифугирање. Кога пишувате графичка електронска формула, треба да запомните две правила: Принципот на Паули и правилото на Ф.Хунд, според кој електроните ги заземаат слободните ќелии прво една по една и имаат иста вредност на спинот, па дури потоа се парат, но спиновите, според принципот на Паули, веќе ќе бидат обратно насочени.
Хундовото правило и принципот на Паули
Хундовото правило- правило за квантна хемија кое го одредува редоследот на пополнување на орбиталите на одреден подслој и е формулирано на следниов начин: вкупната вредност на спин квантниот број на електрони на даден подслој мора да биде максимална. Формулиран од Фридрих Хунд во 1925 година.
Тоа значи дека во секоја од орбиталите на подслојот прво се полни по еден електрон, а дури откако ќе се исцрпат ненаполнетите орбитали, на оваа орбитала се додава втор електрон. Во овој случај, во една орбитала има два електрони со полуцелобројни вртења со спротивен знак, кои се парат (формираат облак од два електрони) и, како резултат на тоа, вкупниот спин на орбиталата станува еднаков на нула.
Друга формулација: Пониско во енергија лежи атомскиот поим за кој се исполнети два услови.
- Мноштвото е максимална
- Кога множествата се совпаѓаат, вкупниот орбитален импулс L е максимален.
Дозволете ни да го анализираме ова правило користејќи го примерот за пополнување на орбитали со p-подниво стр-елементи од вториот период (односно, од бор до неон (на дијаграмот подолу, хоризонталните линии означуваат орбитали, вертикалните стрелки означуваат електрони, а насоката на стрелката ја означува ориентацијата на центрифугата).
Владеењето на Клечковски
Правилото на Клечковски -како што се зголемува вкупниот број на електрони во атомите (како што се зголемуваат полнежите на нивните јадра, или сериски броевихемиски елементи) атомските орбитали се населени на таков начин што појавата на електрони во орбитала со поголема енергија зависи само од главниот квантен број n и не зависи од сите други квантни броеви, вклучувајќи го и l. Физички, тоа значи дека во атом сличен на водород (во отсуство на меѓуелектронска одбивност), орбиталната енергија на електронот се определува само со просторното растојание на густината на полнежот на електронот од јадрото и не зависи од карактеристиките на неговото движење во полето на јадрото.
Емпириското правило на Клечковски и шемата за подредување што произлегува од него се донекаде контрадикторни со реалната енергетска низа на атомските орбитали само во два слични случаи: за атомите Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au. , доаѓа до „неуспех“ на електрон со s -поднивото на надворешниот слој се заменува со d-поднивото на претходниот слој, што доведува до енергетски постабилна состојба на атомот, имено: по полнењето на орбиталата 6 со два електрони с
Атомот е најмалата честичка на хемиската супстанција која може да ги задржи своите својства. Зборот „атом“ доаѓа од старогрчкиот „атом“, што значи „неделив“. Во зависност од тоа колку и какви честички има во атомот, може да се одреди хемиски елемент.
Накратко за структурата на атомот
Како можете накратко да ги наведете основните информации за честичка со едно јадро, која е позитивно наелектризирана. Околу ова јадро е негативно наелектризиран облак од електрони. Секој атом во својата нормална состојба е неутрален. Големината на оваа честичка може целосно да се определи со големината на електронскиот облак што го опкружува јадрото.
Самото јадро, пак, исто така се состои од помали честички - протони и неутрони. Протоните се позитивно наелектризирани. Неутроните не носат никакво полнење. Сепак, протоните и неутроните се комбинираат во една категорија и се нарекуваат нуклеони. Ако накратко се потребни основни информации за структурата на атомот, тогаш оваа информација може да се ограничи на наведените податоци.

Први информации за атомот
Старите Грци се сомневале дека материјата може да се состои од мали честички. Тие веруваа дека сè што постои е направено од атоми. Меѓутоа, таквото гледиште имало чисто филозофски карактер и не може да се толкува научно.
Првиот кој добил основни информации за структурата на атомот бил англиски научник.Токму овој истражувач успеал да открие дека две хемиски елементможе да влезе во различни соодноси и секоја таква комбинација ќе претставува нова супстанција. На пример, осум делови од елементот кислород предизвикуваат јаглерод диоксид. Четири дела кислород се јаглерод моноксид.
Во 1803 година, Далтон го открил таканаречениот закон за повеќекратни соодноси во хемијата. Користејќи индиректни мерења (бидејќи ниту еден атом не можеше да се испита под тогашните микроскопи), Далтон донесе заклучок за релативната тежина на атомите.

Истражувањето на Радерфорд
Речиси еден век подоцна, основните информации за структурата на атомите беа потврдени од друг англиски хемичар - Научникот предложи модел на електронската обвивка од најмалите честички.
Во тоа време, Радерфордовиот „Планетарен модел на атомот“ беше еден од најважните чекоритоа може да го направи хемијата. Основните информации за структурата на атомот покажаа дека тој е сличен на сончев систем: електронските честички ротираат околу јадрото во строго дефинирани орбити, исто како што тоа го прават планетите.
Електронска обвивка од атоми и формули на атоми на хемиски елементи
Електронската обвивка на секој атом содржи точно онолку електрони колку што има протони во неговото јадро. Ова е причината зошто атомот е неутрален. Во 1913 година, друг научник добил основни информации за структурата на атомот. Формулата на Нилс Бор била слична на онаа што ја добил Радерфорд. Според неговиот концепт, електроните исто така се вртат околу јадрото лоцирано во центарот. Бор ја рафинирал теоријата на Радерфорд и донел хармонија на нејзините факти.
Дури и тогаш, формули за некои хемиски супстанции. На пример, шематски структурата на атомот на азот е означена како 1s 2 2s 2 2p 3, структурата на атомот на натриум е изразена со формулата 1s 2 2s 2 2p 6 3s 1. Преку овие формули можете да видите колку електрони се движат во секоја од орбиталите на одредена хемиска супстанција.

Шредингер модел
Меѓутоа, подоцна и овој атомски модел стана застарен. Основните информации за структурата на атомот, познати на науката денес, во голема мера станаа достапни благодарение на истражувањето на австрискиот физичар
Тој понуди нов моделнеговата структура е брановидна. Во тоа време, научниците веќе докажаа дека електронот е обдарен не само со природата на честичката, туку има и својства на бран.
Сепак, моделот Шредингер и Радерфорд исто така има општи одредби. Нивните теории се слични по тоа што електроните постојат на одредени нивоа.
Таквите нивоа се нарекуваат и електронски слоеви. Користејќи го бројот на нивоа, може да се карактеризира енергијата на електронот. Колку е повисок слојот, толку повеќе енергија има. Сите нивоа се бројат од дното кон врвот, така што бројот на нивоата одговара на неговата енергија. Секој од слоевите во електронската обвивка на атомот има свои поднивоа. Во овој случај, првото ниво може да има едно подниво, второто - две, третото - три и така натаму (видете ги горните електронски формули за азот и натриум).

Дури и помали честички
Во моментов, се разбира, се откриени дури и помали честички од електронот, протонот и неутронот. Познато е дека протонот се состои од кваркови. Има уште помали честички на универзумот - на пример, неутриното, кое е сто пати помало по големина од кварк и милијарда пати помало од протон.
Неутриното е толку мала честичка што е 10 септилиони пати помала од, на пример, тираносаурус рекс. Самиот тираносаурус е исто толку пати помал по големина од целиот видлив универзум.
Основни информации за структурата на атомот: радиоактивност
Отсекогаш се знаело дека ниту еден хемиска реакцијане може да трансформира еден елемент во друг. Но, во процесот на радиоактивно зрачење тоа се случува спонтано.
Радиоактивноста е способност на атомските јадра да се трансформираат во други јадра - постабилни. Кога луѓето добивале основни информации за структурата на атомите, изотопите, до одреден степен, би можеле да послужат како олицетворение на соништата на средновековните алхемичари.
Како што се распаѓаат изотопите, се емитува радиоактивно зрачење. Овој феномен прв го открил Бекерел. Главен погледРадиоактивното зрачење е алфа распаѓање. Кога ќе се појави, се ослободува алфа честичка. Постои и бета распаѓање, во кое бета честичка се исфрла од јадрото на атомот.
Природни и вештачки изотопи
Во моментов се познати околу 40 природни изотопи. Повеќето од нив се лоцирани во три категории: ураниум-радиум, ториум и актиниум. Сите овие изотопи може да се најдат во природата - во карпите, почвата, воздухот. Но, покрај нив, познати се и околу илјада изотопи изведени од вештачки пат, кои се произведуваат во нуклеарни реактори. Многу од овие изотопи се користат во медицината, особено во дијагностиката..

Пропорции во еден атом
Ако замислиме атом чии димензии се споредливи со димензиите на меѓународен спортски стадион, тогаш визуелно можеме да ги добиеме следните пропорции. Електроните на атомот на таков „стадион“ ќе се наоѓаат на самиот врв на трибините. Секој од нив ќе биде помал од главата на игла. Тогаш јадрото ќе се наоѓа во центарот на ова поле, а неговата големина нема да биде поголема од големината на грашок.
Понекогаш луѓето прашуваат како всушност изгледа еден атом. Всушност, буквално не личи на ништо - не од причина што микроскопите што се користат во науката не се доволно добри. Димензиите на атомот се во оние области каде што концептот на „видливост“ едноставно не постои.
Атомите се многу мали по големина. Но, колку се навистина мали овие големини? Факт е дека најмалото зрно сол, едвај видливо за човечкото око, содржи околу еден квинтилион атоми.
Ако замислиме атом со таква големина што би можел да се вклопи во човечка рака, тогаш до него би имало вируси долги 300 метри. Бактериите би биле долги 3 километри, а дебелината на човечко влакно би била 150 километри. Во лежечка положба, тој ќе може да ги надмине границите на земјината атмосфера. И ако таквите пропорции беа валидни, тогаш човечко влакно може да достигне должина до Месечината. Ова е толку сложен и интересен атом, кој научниците продолжуваат да го проучуваат до ден-денес.
Атом- најмалата честичка на супстанција која е неделива со хемиски средства. Во 20 век беше откриено комплексна структураатом. Атомите се составени од позитивно наелектризирани кернелии обвивка формирана од негативно наелектризирани електрони. Вкупниот полнеж на слободниот атом е нула, бидејќи полнежите на јадрото и електронска обвивкаизбалансираат едни со други. Во овој случај, нуклеарното полнење е еднакво на бројот на елементот во периодниот систем ( атомски број) и е еднаков на вкупниот број на електрони (електронскиот полнеж е −1).
Атомското јадро се состои од позитивно наелектризирано протонии неутрални честички - неутрони, без наплата. Генерализираните карактеристики на елементарните честички во атомот може да се претстават во форма на табела:
Бројот на протони е еднаков на полнењето на јадрото, затоа е еднаков на атомскиот број. За да го пронајдете бројот на неутрони во атомот, треба да го одземете полнењето на јадрото (бројот на протони) од атомската маса (која се состои од масите на протони и неутрони).
На пример, во атомот на натриум 23 Na бројот на протони е p = 11, а бројот на неутрони е n = 23 − 11 = 12
Бројот на неутрони во атомите на истиот елемент може да биде различен. Таквите атоми се нарекуваат изотопи .
Електронската обвивка на атомот исто така има сложена структура. Електроните се наоѓаат во енергетските нивоа (електронски слоеви).
Бројот на нивоа ја карактеризира енергијата на електронот. Ова се должи на фактот дека елементарни честичкиможе да пренесува и прима енергија не во произволно мали количини, туку во одредени делови - кванти. Колку е повисоко нивото, толку повеќе енергија има електронот. Бидејќи колку е помала енергијата на системот, толку е постабилен (споредете ја ниската стабилност на каменот на врвот на планината, кој има голема потенцијална енергија, и стабилната положба на истиот камен долу на рамнината, кога неговата енергија е многу помала), прво се пополнуваат нивоата со ниска електронска енергија, а дури потоа високите.
Максималниот број на електрони што може да ги собере едно ниво може да се пресмета со формулата:
N = 2n 2, каде што N е максималниот број на електрони на ниво,
n - број на ниво.
Потоа за првото ниво N = 2 1 2 = 2,
за вториот N = 2 2 2 = 8, итн.
Број на електрони по надворешно нивоза елементи од главните (А) подгрупи е еднаков на бројот на групата.
Во повеќето модерни периодични табели, распоредот на електроните по ниво е означен во ќелијата со елементот. Многу важноразберете дека нивоата се читливи доле горе, што одговара на нивната енергија. Затоа, колоната со броеви во ќелијата со натриум:
1
8
2
на прво ниво - 2 електрони,
на второ ниво - 8 електрони,
на 3 ниво - 1 електрон
Внимавајте, ова е многу честа грешка!
Дистрибуцијата на ниво на електрони може да се претстави како дијаграм:
11 На)))
2 8 1
Ако периодниот систем не ја означува распределбата на електроните по нивоа, можете да користите:
- максимален број на електрони: на прво ниво не повеќе од 2 e − ,
на 2-ри - 8 e − ,
на надворешно ниво - 8 e − ; - број на електрони во надворешното ниво (за првите 20 елементи се совпаѓа со бројот на групата)
Тогаш, за натриум, линијата на расудување ќе биде како што следува:
- Вкупниот број на електрони е 11, затоа, првото ниво е пополнето и содржи 2 e − ;
- Третото, надворешно ниво содржи 1 e − (I група)
- Второто ниво ги содржи преостанатите електрони: 11 − (2 + 1) = 8 (целосно пополнети)
* Голем број автори, со цел појасна разлика помеѓу слободен атом и атом во соединението, предлагаат да се користи терминот „атом“ само за да се означи слободен (неутрален) атом и да се назначат сите атоми, вклучително и оние во соединенија, предложете го терминот „атомски честички“. Каква ќе биде судбината на овие термини ќе покаже времето. Од наша гледна точка, атом по дефиниција е честичка, затоа изразот „атомски честички“ може да се смета како тавтологија („масло“).
2. Задача. Пресметка на количината на супстанцијата на еден од производите на реакцијата ако е позната масата на почетната супстанција.
Пример:
Колкаво количество на водородна супстанција ќе се ослободи кога цинкот реагира со хлороводородна киселина со тежина од 146 g?
Решение:
- Ја пишуваме равенката на реакцијата: Zn + 2HCl = ZnCl 2 + H 2
- Ние најдовме моларна маса на хлороводородна киселина: M (HCl) = 1 + 35,5 = 36,5 (g/mol)
(моларната маса на секој елемент, нумерички еднаква на релативната атомска маса, се гледа во периодниот систем под знакот на елементот и се заокружува на цели броеви, освен за хлорот, кој се зема како 35,5) - Најдете ја количината на хлороводородна киселина: n (HCl) = m / M = 146 g / 36,5 g/mol = 4 mol
- Ги запишуваме достапните податоци над равенката на реакцијата, а под равенката - бројот на молови според равенката (еднаков на коефициентот пред супстанцијата):
4 mol x mol
Zn + 2HCl = ZnCl 2 + H 2
2 мол 1 мол - Ајде да направиме пропорција:
4 мол - xкрт
2 мол - 1 мол
(или со објаснување:
од 4 молови хлороводородна киселина добивате xмол водород,
и од 2 молови - 1 мол) - Ние најдовме x:
x= 4 mol 1 mol / 2 mol = 2 mol
Одговор: 2 мол.