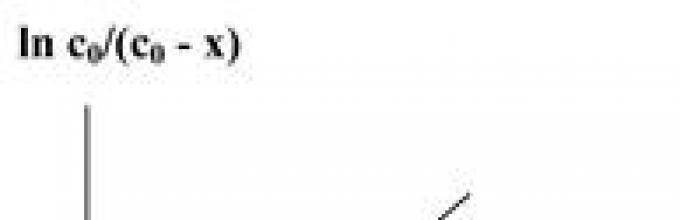Дел 5. КИНЕТИКА НА ХЕМИСКИТЕ РЕАКЦИИ И КАТАЛИЗАТА.
Термодинамички можните реакции не се спроведуваат секогаш во реалноста. Ова се должи на фактот што термодинамиката нема временски параметар, па затоа не одговара колку брзо ќе се појави дадена состојба. Утврдувањето на условите под кои термодинамички можните реакции ќе се одвиваат со доволна брзина е еден од главните проблеми на хемиската кинетика. Во кинетиката се воведува факторот време, кој не се разгледува во термодинамиката.
Хемиска кинетика - ова е доктрина за регуларноста на текот на хемискиот процес со текот на времето или доктрина за механизмите и брзината на хемиските реакции.
Множеството на фази кои сочинуваат хемиска реакција се нарекува механизам или шема на хемиска реакција.
Брзината на хемиската реакција.
Под брзина на хемиска реакција да ја разбере промената на бројот на молови на супстанции кои реагираат по единица време по единица волумен.
Има просечни брзини ( у сп) и вистинито ( u).
Просечна брзина - промена во концентрацијата на реактантите во одреден временски период:
u av = ± (n 2 – n 1) / V(t 2 - t 1) = ± Dn / V Δt = ± Δс / Δt.
Односот Δс/Δt може да биде позитивен или негативен. Брзината може да се измери со следење на намалувањето на концентрацијата на оригиналното соединение, а потоа ставаме знак минус пред односот, бидејќи брзината е секогаш позитивна вредност. Ако брзината се изразува преку концентрацијата на супстанцијата што прима, тогаш знакот плус:
- Δс А / Δt= + Δс В /Δt.
Можете да ја поврзете промената на концентрацијата со бесконечно мал временски период (t 2 -t 1 → 0), дефинирајќи вистинска брзина на реакција во моментот како дериват на концентрацијата со текот на времето (u = ±dс/dt).
- dc A /dt = + dc B /dt
Зависност на брзината на реакција од концентрацијата.
Главниот постулат на хемиската кинетика е законот за масовно дејство воспоставен од Гулдберг и Вахе. Размислете за хемиската реакција:
m 1 A + m 2 B → m 3 C + m 4 D.
Равенката што ја опишува зависноста на брзината на хемиската реакција од концентрацијата на компонентите на реакционата смеса се вика кинетичка равенка на хемиска реакција.
Кинетичката равенка на реакцијата што се разгледува:
u = kс А m 1s Б m 2 ,
каде k е коефициент на пропорционалност (константа на брзина).
Закон за масовно дејство: брзината на хемиската реакција во секој момент од времето е директно пропорционална со производот од концентрациите на супстанциите што реагираат во дадено време во моќности што одговараат на стехиометриските коефициенти на реакцијата (во наједноставниот случај).
Во повеќето случаи, не се пресметува брзината, туку константата на брзината. Ако c A = c B = 1 mol/l, тогаш u = k.
Физичко значење на константата на брзина: константата на брзината на хемиската реакција е нумерички еднаква на брзината на реакцијата, под услов концентрациите на реактантите да се константни и еднакви на единство. Константата на брзината е независна од концентрацијата и зависи од температурата, природата на растворувачот и присуството на катализатор.
Сите реакции се кинетички двонасочни или кинетички реверзибилни. Хемиската реакција е реверзибилна кога реакционите производи можат да реагираат едни со други за да формираат почетни материјали. Во пракса, обратната реакција може да биде толку бавна во споредба со директната што, со секаква разумна точност, реверзибилноста на реакцијата може да се занемари и реакцијата да се смета за неповратна или еднострана. Строго кажано, сите хемиски реакции се реверзибилни:
m 1 A 4 +m 2 B « m 3 C+m 4 D
u = u 1 - u 2 = k 1 s А m 1s Б m 2 - k 2 s СО m 3's Д m 4,
Во моментот на хемиска рамнотежа u 1 = u 2 , тие
k 1 s А m 1s Б m 2 = k 2 s СО m 3's Д m 4,
ДО =k 1 / k 2=Со СО m 3´ Со Д m 4/ Со А m 1´ Со Б m 2
каде K е константа на хемиската рамнотежа, еднаква на односот на константата на брзината на напредната реакција со константата на брзината на обратната реакција.
Класификација на реакциите по молекуларност и редослед.
Кога се проучува кинетиката, хемиските реакции се разликуваат по молекуларност и редослед.
Молекуларност на реакцијата се определува со бројот на молекули кои учествуваат истовремено во фазата што ја одредува брзината на целата реакција (најбавно). Врз основа на тоа, реакциите се поделени на моно-, би- и тримолекуларни. Реакциите со поголема молекуларност се практично непознати, бидејќи веројатноста за средба на четири молекули е занемарлива.
Редоследот на реакции се определува со збирот на експонентите на концентрациите во изразот на законот за масовно дејство. Се прави разлика помеѓу целосен (општ) редослед на реакција и делумен (за секој реагенс). Збирот на експонентите во кои концентрациите на сите почетни материи влегуваат во кинетичката равенка го одредува целокупниот редослед. Има реакции од нула, прв, втор, трет и фракционо ред.
Совпаѓањето на молекуларноста со редот се забележува само во наједноставните случаи, кога реакцијата се одвива во една фаза:
2NO + H 2 ↔ N 2 O + H 2 O,
општ ред - 3, молекуларност - 3.
5.3.1. Равенка за еднонасочна реакција од прв ред.
Размислете за хемиската реакција: A → B.
u = kс = - dс/dt.
Да ги одвоиме променливите: -dс/с = k dt, интегрираме
Lnc = kt + const,
ако τ = 0 (почетен момент на реакцијата), тогаш const = ln c 0, т.е.
Ln с = kt - ln с 0,
ln s 0 - ln s = kt или ln s 0 / s = kt,
k = (1/t)´ ln s 0 /s.
Да го означиме x - степенот на претворање на почетната супстанција: x = c 0 – c.
k = (1/t) ´ln s 0 /(s 0 - x),
димензија - [време -1 ].
Константата на брзината на реакцијата од прв ред е независна од концентрацијата. Можете да ја замените концентрацијата (mol/l) или бројот на молови во добиената равенка. Наместо „c 0“ и „(c 0 - x)“ можете да ги замените сите вредности пропорционални на концентрацијата (електрична спроводливост, густина, вискозност, итн.).
За да се карактеризира брзината на реакција од прв ред, заедно со константата на брзината, често се користи количина наречена полуживот.
Полуживот(t 1/2)- временскиот период во кој реагира половина од земената количина на супстанција:
t 1/2 = (1/k)´ ln s 0 /(s 0 - x), каде што x = 1/2s 0.
Добиваме:
t 1/2 = ln2/k = 0,693/k.
Полуживотот не зависи од почетните концентрации, туку зависи од константата на брзината, т.е. тоа е карактеристика на реакција од прв ред.
Реакциите од прв ред вклучуваат радиоактивно распаѓање, изомеризација и повеќето реакции на хидролиза. Кога има голем вишок на еден од реактантите во споредба со другите, неговата концентрација останува речиси константна за време на реакцијата. Во овој случај, редоследот на реакцијата ќе биде за еден помал отколку што би се очекувало од стехиометриската равенка.
Бимолекуларните реакции во кои редоследот на реакцијата, поради вишок на еден од реактантите, се намалува за еден, се нарекуваат псевдомолекуларни.
Пример, реакција на хидролитичко распаѓање на шеќер во разреден воден раствор (инверзија на шеќер):
C 12 H 22 O 11 + H 2 O ↔ C 12 H 22 O 11 + C 12 H 22 O 11
сахароза гликоза фруктоза
u = k[сахароза]',
u = k* [сахароза], каде k* = k´.
Ова е пример за реакција од псевдо прв ред.
Равенка на еднонасочна реакција од втор ред.
A + B → C + D
Пример: H 2 + J 2 = 2HJ;
2HJ = H2 + J2;
CH 3 COOC 2 H 5 + NaOH = CH 3 COONa + C 2 H 5 OH.
Dс/dt = ks 1 ´с 2
Кога с 1 = с 2 добиваме: -dс/dt =kс 2 или -dс/с 2 = k dt. Ајде да се интегрираме:
1/s = kt + const.
На t = 0 → const = 1/s 0.
1/s - 1/s 0 = kt или (s 0 – s)/s´s 0 = kt;
с 0 - с = x, каде што x е степенот на трансформација; c = c 0 - x;
x / s 0 (s 0 - s) = kt;
k = (1/t)',
димензија - [време -1 ´концентрација -1 ].
Константата на брзината на реакцијата од втор ред зависи од димензијата на концентрацијата.
Полуживот: t 1/2 = (1/ k), каде x = 1/2s 0, тогаш
t 1/2 = 1/ ks 0.
Полуживотот зависи од почетната концентрација и не е карактеристика на реакција од втор ред.
Равенка на реакција од нула ред.
Брзината на хемиската реакција не зависи од концентрацијата на реактантите (реакции на интерфејсот, ограничувачкиот процес е процесот на дифузија):
Dc/dt = ks 0 ; или -dс = k dt.
Интегрираме, добиваме: -с = kt + const.
На t = 0 → const = -с 0. Добиваме: -с = kt - с 0;
k = (c 0 - c) /t = x/t,
димензија - [концентрација 'време -1].
Полуживот:
t 1/2 = c 0 /2k
Методи за одредување редослед на реакција и константа на брзина.
Во кинетиката на реакции од едноставни и сложени типови, главно се решаваат следниве проблеми:
1. Директна задача: познат е редоследот на реакцијата и нејзината константа на брзина. Потребно е да се најде концентрацијата на која било од почетните супстанци или производи на реакцијата во одреден момент во времето или да се најде времето во кое концентрацијата на кој било од реактантите или производите на реакцијата достигнува одредена вредност.
2. Инверзен проблем: добиени се експериментални податоци за кинетиката на претходно непроучена реакција. Потребно е да се одреди редоследот на реакцијата и константата на брзината.
За да се одреди редоследот на реакцијата, неопходно е да се имаат експериментални податоци за промените во концентрацијата на реактантите со текот на времето:
| од 0 | од 1 | од 2 | од 3 | од 4 | ….. |
| т 0 | т 1 | т 2 | т 3 | т 4 | ….. |
1. Метод за избор на равенки.
Методот се состои од замена на експериментални податоци за концентрацијата на супстанции за секој момент од почетокот на реакцијата во кинетички равенки од различен ред (оваа техника не дава ништо ако редоследот на реакцијата надминува 3 или е фракционо):
k = (s 0 - s) /t = x/t(нулта редослед);
k = (1/t) lnc 0 /s(прв ред);
k = (1/t) x /s 0 s (втор ред).
Редоследот на реакцијата ќе одговара на кинетичката равенка за која, при различни почетни концентрации на почетните супстанции и во различни времиња на дадена температура, константата на брзината ќе биде константна вредност.
2. Графички интегрални методи.
 |  |
нулта редослед: прв ред втор ред
Ориз. 5.1. Концентрацијата се менува со текот на времето за реакции
различни нарачки.
Најдете таква функција на концентрација, исцртувајќи ја на графиконот, во зависност од времето, добивате права линија (сл. 5.1.).
3. Со полуживот.
Според зависноста на полуживотот од почетната концентрација:
нулта редослед: t 1/2 = c 0 /2k;
прв ред: t 1/2 = 0,693/ k;
втор ред: t 1/2 = 1 / ks 0.
Општо земено:
t 1/2 ≈ 1 /k s 0 n-1.
Експериментите се изведуваат на две различни почетни концентрации (од 0)“ и (од 0)“:
(t 1/2) ’ = 1 /k (s 0) 1 n-1 (1)
(t 1/2)” = 1 /k (s 0) 2 n-1 (2)
Ајде да поделиме (1) со (2):
(t 1/2) ’ / (t 1/2)” = (s 0) 2 n-1 / (s 0) 1 n-1 .
Да земеме логаритам:
log(t 1/2) ’ / (t 1/2)” = (n-1) ´ log[(s 0) 2 /(s 0) 1 ],
n = 1 + / .
4.Диференцијален метод (метод ван'т Хоф).
Се користи зависноста на брзината на реакцијата од концентрацијата, под услов концентрациите на сите почетни материи да се еднакви (сл. 5.2.): u = kс n. Да земеме логаритам на овој израз: lgu = lgk + nlgс.

Ориз. 5.2. Зависност на брзината на реакција од концентрацијата.
5. Интегрален van't Hoff метод (според зависноста на брзината на реакцијата од почетната концентрација во првите моменти на времето - 10-15 с).
u = k (c 0 - x) n = k c 0 n,
Бидејќи во првиот момент од времето x ≈ 0.
Експериментот се изведува со различни почетни концентрации.
u 1 = k c 1 n (1)
u 2 = k c 2 n (2)
Равенката (1) ја делиме со равенката (2): u 1 / u 2 = (c 1 / c 2) n.
Да земеме логаритми:
n = (lgu 1 - lgu 2) / (lgс 1 -lgс 2),
каде што c 1 и c 2 се земени како просеци во делот за реакција што се испитува, што одговара на Δt.
6. Метод на изолација на Оствалд.
Да ја запишеме кинетичката равенка на реакцијата: u = kс А n 1 ´с Б n 2 s Со n 3.
Ја зголемуваме концентрацијата на „Б“ и „Ц“ за повеќе од 10 пати. Редоследот за овие супстанции ќе биде нула, нивните концентрации нема да се променат. Ние одредуваме „n 1“ користејќи еден од методите дискутирани погоре. Истото го правиме и при одредување на редоследот на реакцијата врз основа на супстанциите B и C, т.е. n 2 и n 3.
Елементарниот чин на хемиската реакција се јавува во моментот на судир на честичките кои реагираат. Зголемувањето на концентрацијата на реагенсите одговара на зголемување на бројот на честички во волуменот, што доведува до почести судири и, следствено, зголемување на брзината на реакцијата. Квантитативната зависност на брзината на реакцијата од концентрацијата се изразува со основниот постулат на хемиската кинетика, т.н. закон за масовна акција.
Брзината на едноставна хомогена реакција на константна температура е пропорционална на производот од концентрациите на реактантите зголемени до моќи нумерички еднакви на нивните стехиометриски коефициенти.
Каде АИ б-стехиометриски коефициенти на реагенси; c(A) и c(B) се моларните концентрации на реагенсите; к- константна брзина на реакција.
Овој израз на брзина на реакција е кинетичка равенка само за едноставна реакција.
Константата на брзината на реакцијата е индивидуална карактеристика на реакцијата. Вредноста на константата на брзината на реакцијата зависи од природата на реактантите, температурата на системот и присуството на катализатор во него. Значење кза дадени услови на реакција не зависи од концентрацијата на реагенсите и затоа константата на брзината останува непроменета во текот на реакцијата и е нејзин основен кинетички параметар.
Вредноста на константата на брзината на реакцијата е нумерички еднаква на брзината на реакција при концентрации на реагенсот еднаква на 1 mol/l.
Константата на брзината на реакцијата може да се определи само експериментално со проучување на кинетиката на оваа реакција и составување на нејзината кинетичка равенка врз основа на добиените податоци.
Кинетичката равенка на секоја реакција се определува експериментално, бидејќи не може да се предвиди од формата на хемиската равенка на реакцијата. Затоа, прво, при константна температура, зависноста на брзината на реакцијата од концентрацијата на секој реагенс посебно се утврдува експериментално, додека концентрациите на сите други реагенси мора да останат константни, што обично се обезбедува со нивниот голем вишок во медиумот за реакција. За да ја одредите концентрацијата на реагенсот од интерес во секое време, користете ги следните методи: титрација (Дел 8.3.2), потенциометрија (Дел 25.6), спроводливост (Дел 24.5), хроматографија (Дел 26.7) или други, избирајќи од нив такви дека вредноста на карактеристиката измерена со овој метод јасно зависела од концентрацијата на овој реагенс. Врз основа на добиените експериментални податоци, се изготвува кинетичка равенка за реакцијата што се проучува:
![]()
Каде n Аи n б- редослед на реакција за реагенсите А и Б, соодветно.
Редослед на реакција по реагенсе еднаков на експонентот до кој треба да се зголеми концентрацијата на даден реагенс во кинетичката равенка на сложената реакција, така што брзината пресметана од оваа равенка е еднаква на брзината пронајдена експериментално.
Така, редоследот на реакцијата во однос на реактантот е кинетички параметар за дадена реакција, заедно со константата на брзината.
Редоследот на реакцијата во однос на реагенсот не зависи од стехиометриските коефициенти во равенката на реакцијата, туку се одредува според неговиот механизам. Ако вредностите на редоследот на реакцијата за секој реактант се совпаѓаат со стехиометриските коефициенти во хемиската равенка на реакцијата, тоа обично значи дека реакцијата што се проучува е едноставна.
Несовпаѓањето помеѓу редоследот на реакцијата во реагенсот и неговиот стехиометриски коефициент во равенката на реакцијата укажува на сложеноста и повеќестепената природа на оваа реакција. Идејата за механизмот на таквата реакција може да се формира ако претпоставиме дека нејзината брзина е главно одредена од брзината на најбавната, т.е., ограничувачката фаза. Во овој случај, кинетичката равенка добиена од експериментални податоци првенствено го одразува текот на ограничувачката фаза, а не целиот процес.
Размислете за реакцијата на термичко распаѓање на азотен оксид (V):
Сепак, експерименталните податоци покажуваат дека брзината на оваа реакција е пропорционална не со втората, туку со првата моќност на концентрацијата на азотен оксид (V), а всушност нејзината кинетичка равенка ја има формата:
Ова ни овозможува да го претпоставиме следниов механизам на реакција, кој вклучува две фази кои остро се разликуваат во нивната стапка на појава:
![]()
Само ако брзината на првата фаза е неспоредливо помала од втората, ќе има целосна согласност со експериментално добиените кинетички податоци рефлектирани во кинетичката равенка, каде што редоследот на реакцијата во N2O5 е еднаков на 1.
Ориз. 5.2. Одредување на редот на реакција n Аспоред компонентата А
Експериментално да се одредат вредностите на константата на брзината на реакцијата (к)и редоследот на реакција за реагенсот А (n A)потребно е да се проучи зависноста на брзината на оваа реакција од концентрацијата на реагенсот А, под услов концентрациите на другите реагенси во реакционата смеса да бидат толку големи што практично да не се менуваат во текот на овој експеримент. Тогаш кинетичката равенка на реакцијата што се проучува ќе ја има формата:
Откако ќе го земеме логаритамот на овој израз ја добиваме равенката
кој, кога е графички изразен, има форма на права линија, тангентата на аголот на наклон на оската log c(A) е еднаква на редот на реакцијата стр А(Сл. 5.2). Отсечката отсечена со оваа права линија на lg y оската, кога lg c(A) = 0, ја дава вредноста lg к.Следствено, со таква обработка на експериментални податоци, можно е да се одредат вредностите на најважните кинетички параметри на реакцијата - редоследот на реакцијата во однос на реагенсот и константата на брзината на оваа реакција.
Кинетичките криви на промените во концентрацијата на реагенсите за две последователни реакции, кога брзината на реакцијата е константа k1И k2не се разликуваат многу едни од други, имаат сложен изглед (сл. 5.3). Кинетичка крива Аодговара на монотоно намалување на концентрацијата на почетната супстанција А.
Концентрацијата на меѓусупстанцијата Б поминува низ максимум, бидејќи прво се акумулира, а потоа исчезнува. Висината на овој максимален Cl;(B) и времето за достигнување (tl,) може да бидат многу различни во зависност од односот на вредностите на константите k1И k2.Крива Дја карактеризира акумулацијата на реакциониот производ Д.
Ориз. 5.3. Кинетички криви на промени во концентрациите на компонентите А, Б и Д за наведената трансформација
Прецизната анализа на кинетиката на ваквите сложени реакции бара решавање на систем на диференцијални равенки.
Реакција од прв ред [k] = .
Реакција од втор ред [k] = [l/mol∙t]
Реакција од n-ти ред [k] = [mol 1- n ∙ l n -1 ∙ t - t ]
III. Температура.Со зголемување на температурата, кинетичката енергија на молекулите се зголемува и, следствено, брзината на нивното движење. Зголемувањето на брзината доведува до зголемување на бројот на судири на молекулите и, како последица на тоа, до зголемување на брзината на реакција. Експериментално беше утврдено дека со зголемување на температурата за секои 10 0, брзината на хемиска реакција се зголемува за 2-4 пати:
V 2 = V 1 ∙γ (T 2 - T 1) / 10 или V 2 / V 1 = γ (T 2 - T 1) / 10
каде V 1 е брзината на реакција на температура T 1, V 2 е брзината на реакција на температура T 2,
γ е температурен коефициент на брзината на реакцијата неговата вредност за повеќето неоргански реакции варира од два до четири. Овој модел се нарекува правило Вант Хоф.
Како што се зголемува температурата, брзината на реакцијата се зголемува, но концентрациите на реактантите не се менуваат. Следствено, константата на брзина се менува и се зголемува со зголемување на температурата. Зависноста на константата на брзината на хемиската реакција од температурата е опишана со равенката Арениус:
k = k o ∙e -Ea /RT
каде k o е коефициент земајќи го предвид бројот на активни судири, R е универзална гасна константа, T е температура, E a е енергија на активирање.
Енергија за активирањее енергијата на молекулите при која секој судир води до хемиска реакција.
Физичкото значење на енергијата за активирање е лесно да се разбере од сликата.
прод.р-ција
Оската на ординатите го покажува збирот на енталпиите на почетните материјали и производите на реакцијата, а оската на апсцисата ја покажува насоката на реакцијата. Во овој случај, разликата помеѓу збирот на енергиите на почетните супстанции и максимумот на кривата ја дава енергијата на активирање на напредната реакција (Е а), а разликата помеѓу збирот на енергиите на производите на реакцијата и истиот максимум ја дава енергијата на активирање на обратната реакција (Е "а).
IV. Катализатор.Катализаторите се супстанции кои ја менуваат брзината на хемиската реакција, но не се вклучени во стехиометриската равенка на реакцијата. Катализаторите можат или да ја зголемат брзината на хемиската реакција или да ја намалат. Супстанциите кои ја намалуваат брзината на реакцијата се нарекуваат инхибитори. Катализаторите се директно вклучени во хемиската реакција, но на крајот од реакцијата тие можат да се изолираат од реакционата смеса во првобитната количина. Катализаторите се карактеризираат со селективност, т.е. способност да се влијае на поминување на реакција во одредена насока:
4 NH 3 + 3 O 2 = 6 H 2 O + 2 N 2 (без катализатор)
4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O (Pt катализатор)
Co, Rh→ CH 3 CH 2 CH 2 OH + CH 3 CH OH CH 3
Биокатализаторите заземаат посебно место - ензими,кои претставуваат протеини. Тие влијаат на брзината на строго дефинираните реакции, т.е. имаат висока селективност. Тие се способни да ја зголемат брзината на реакции за милијарди и трилиони пати на собна температура. Кога температурата се зголемува, тие ја губат својата активност, бидејќи се јавува денатурација на протеини.
Механизмите на хемиските трансформации и нивните стапки се изучуваат со хемиска кинетика. Хемиските процеси се случуваат со текот на времето со различни стапки. Некои се случуваат брзо, речиси веднаш, додека на други им треба многу долго време да се појават.
Брзина на реакција- брзината со која се трошат реагенсите (нивната концентрација се намалува) или се формираат реакциони производи по единица волумен.
Фактори кои можат да влијаат на брзината на хемиската реакција
Следниве фактори можат да влијаат на тоа колку брзо се случува хемиската реакција:
- концентрација на супстанции;
- природата на реагенсите;
- температура;
- присуство на катализатор;
- притисок (за реакции во гасна средина).
Така, со менување на одредени услови на хемиски процес, можете да влијаете на тоа колку брзо ќе продолжи процесот.
 Во процесот на хемиска интеракција, честичките на супстанциите што реагираат се судираат едни со други. Бројот на такви совпаѓања е пропорционален на бројот на честички на супстанции во волуменот на смесата што реагира, и затоа е пропорционален на моларните концентрации на реагенсите.
Во процесот на хемиска интеракција, честичките на супстанциите што реагираат се судираат едни со други. Бројот на такви совпаѓања е пропорционален на бројот на честички на супстанции во волуменот на смесата што реагира, и затоа е пропорционален на моларните концентрации на реагенсите.
Закон за масовна акцијаја опишува зависноста на брзината на реакцијата од моларните концентрации на супстанциите што комуницираат.
За елементарна реакција (A + B → ...) овој закон се изразува со формулата:
υ = k ∙С A ∙С B,
каде k е константа на брзина; C A и C B се моларните концентрации на реагенсите A и B.
Ако една од супстанците кои реагираат е во цврста состојба, тогаш интеракцијата се јавува на интерфејсот, затоа, концентрацијата на цврстата супстанција не е вклучена во равенката на кинетичкиот закон за масовно дејство. За да се разбере физичкото значење на константата на брзината, неопходно е да се земат C, A и C B еднакви на 1. Тогаш станува јасно дека константата на брзината е еднаква на брзината на реакција при концентрации на реактант еднаква на единство.
Природата на реагенсите
Бидејќи за време на интеракцијата хемиските врски на супстанциите што реагираат се уништуваат и се формираат нови врски на производите на реакцијата, природата на врските вклучени во реакцијата на соединенијата и структурата на молекулите на супстанциите што реагираат ќе играат голема улога. .
Површина на контакт на реагенси
Таквата карактеристика како површината на контакт на цврстите реагенси влијае на текот на реакцијата, понекогаш доста значително. Мелењето на цврсто тело ви овозможува да ја зголемите површината на контакт на реагенсите и затоа да го забрзате процесот. Областа на контакт на растворливи материи лесно се зголемува со растворање на супстанцијата.
Температура на реакција
 Како што се зголемува температурата, енергијата на честичките кои се судруваат ќе се зголемува, очигледно е дека со зголемување на температурата самиот хемиски процес ќе се забрза. Јасен пример за тоа како зголемувањето на температурата влијае на процесот на интеракција на супстанции може да се сметаат податоците дадени во табелата.
Како што се зголемува температурата, енергијата на честичките кои се судруваат ќе се зголемува, очигледно е дека со зголемување на температурата самиот хемиски процес ќе се забрза. Јасен пример за тоа како зголемувањето на температурата влијае на процесот на интеракција на супстанции може да се сметаат податоците дадени во табелата.
Табела 1. Ефект на температурните промени врз брзината на формирање на вода (O 2 + 2H 2 → 2H 2 O)
За квантитативно да се опише како температурата може да влијае на стапката на интеракција на супстанциите, се користи правилото Van't Hoff. Правилото на Ван'т Хоф е дека кога температурата се зголемува за 10 степени, се случува забрзување за 2-4 пати.
Математичката формула што го опишува правилото на Вант Хоф е како што следува:
Каде γ е температурен коефициент на брзината на хемиската реакција (γ = 2−4).
Но, равенката Арениус многу попрецизно ја опишува температурната зависност на константата на брзината:
Каде што R е универзална гасна константа, A е фактор определен од типот на реакцијата, E, A е енергијата на активирање.
Енергијата на активирање е енергијата што мора да ја добие молекулата за да се случи хемиска трансформација. Односно, тоа е еден вид енергетска бариера која молекулите кои се судираат во волуменот на реакцијата ќе треба да ја надминат за да ги прераспределат врските.
Енергијата на активирање не зависи од надворешни фактори, туку зависи од природата на супстанцијата. Енергетската вредност за активирање до 40 - 50 kJ/mol им овозможува на супстанциите доста активно да реагираат едни со други. Ако енергијата на активирање надминува 120 kJ/mol, тогаш супстанциите (на обични температури) ќе реагираат многу бавно. Промената на температурата доведува до промена на бројот на активни молекули, односно молекули кои достигнале енергија поголема од енергијата на активирање и затоа се способни за хемиски трансформации.
Катализаторско дејство
 Катализаторот е супстанца која може да го забрза процесот, но не е дел од неговите производи. Катализата (забрзување на хемиската трансформација) е поделена на хомогена и хетерогена. Ако реагенсите и катализаторот се во исти состојби на агрегација, тогаш катализата се нарекува хомогена ако е во различни состојби, тогаш таа е хетерогена. Механизмите на дејство на катализаторите се различни и доста сложени. Покрај тоа, вреди да се напомене дека катализаторите се карактеризираат со селективност на дејството. Односно, истиот катализатор, додека забрзува една реакција, не може да ја промени брзината на друга.
Катализаторот е супстанца која може да го забрза процесот, но не е дел од неговите производи. Катализата (забрзување на хемиската трансформација) е поделена на хомогена и хетерогена. Ако реагенсите и катализаторот се во исти состојби на агрегација, тогаш катализата се нарекува хомогена ако е во различни состојби, тогаш таа е хетерогена. Механизмите на дејство на катализаторите се различни и доста сложени. Покрај тоа, вреди да се напомене дека катализаторите се карактеризираат со селективност на дејството. Односно, истиот катализатор, додека забрзува една реакција, не може да ја промени брзината на друга.
Притисок
Ако во трансформацијата се вклучени гасовити материи, тогаш брзината на процесот ќе биде под влијание на промените во притисокот во системот . Ова се случува затоа штодека за гасните реагенси, промената на притисокот доведува до промена на концентрацијата.
Експериментално определување на брзината на хемиска реакција
Брзината на хемиската трансформација може да се определи експериментално со добивање податоци за тоа како се менува концентрацијата на супстанциите што влегуваат во реакцијата или производите по единица време. Методите за добивање на такви податоци се поделени на
- хемиски,
- физичко-хемиски.
 Хемиските методи се прилично едноставни, достапни и точни. Со нивна помош, брзината се одредува со директно мерење на концентрацијата или количината на супстанцијата на реактантите или производите. Во случај на бавна реакција, се земаат примероци за да се следи како се троши реагенсот. Потоа се одредува содржината на реагенсот во примерокот. Со земање примероци во редовни интервали, можно е да се добијат податоци за промените во количината на супстанцијата во текот на процесот на интеракција. Најчесто користени типови на анализа се титриметрија и гравиметрија.
Хемиските методи се прилично едноставни, достапни и точни. Со нивна помош, брзината се одредува со директно мерење на концентрацијата или количината на супстанцијата на реактантите или производите. Во случај на бавна реакција, се земаат примероци за да се следи како се троши реагенсот. Потоа се одредува содржината на реагенсот во примерокот. Со земање примероци во редовни интервали, можно е да се добијат податоци за промените во количината на супстанцијата во текот на процесот на интеракција. Најчесто користени типови на анализа се титриметрија и гравиметрија.
Ако реакцијата продолжи брзо, тогаш треба да се прекине за да се земе примерок. Ова може да се направи со ладење, нагло отстранување на катализаторот, можно е и разредување или пренесување на еден од реагенсите во нереактивна состојба.
Методите на физичко-хемиска анализа во современата експериментална кинетика се користат почесто од хемиските. Со нивна помош, можете да ги набљудувате промените во концентрациите на супстанциите во реално време. Во овој случај, нема потреба да се прекине реакцијата и да се земаат примероци.
Физичкохемиските методи се засноваат на мерење на физичко својство кое зависи од квантитативната содржина на одредено соединение во системот и се менува со текот на времето. На пример, ако гасовите се вклучени во реакцијата, тогаш притисокот може да биде такво својство. Се мерат и електричната спроводливост, индексот на прекршување и апсорпционите спектри на супстанции.
Фактор к во кинетичките равенки (1.3)-(1.8), покажувајќи со која брзина се случува процесот при концентрации на реактантите еднакви на единство, се нарекува константа на брзината на хемискиот процес.
Заедно со брзината, константата на брзината на хемискиот процес е главниот параметар во хемиската кинетика.
Константите на брзината за реакции од различен ред имаат различни димензии. Од равенката (1.5) произлегува дека димензијата на константата на брзината за реакција од прв ред т -1 ; од равенката (1.7) – димензијата на константата на брзина од втор ред c -1 t -1 ; константата на брзина од трет ред, како што следува од равенката (1.8), ја има димензијата c -2 t -1 , Каде в -концентрација, т - време.
Концентрацијата обично се мери во mol/l, а времето е во секунди ( Со). Тогаш димензијата на константата на стапка од прв ред е s -1 , второ - l.mol -1 s -1, трето - l 2.mol -2.s -1.
Константата на брзината на реакцијата зависи од соединението за кое се мери. На пример, во реакцијата на димеризација на азот диоксид
стапката на исчезнување на NO 2 е двојно поголема од стапката на појава на N 2 O 4.

Арениус равенка
Константата на брзината на хемиската реакција обично нагло се зголемува со зголемување на температурата. Вообичаено, зголемувањето на температурата на реакционата смеса за 10°C доведува до зголемување на брзината на реакцијата за 2-4 пати. Зависноста на константата на брзината на реакцијата од температурата во повеќето случаи може да се опише со равенката Арениус
 ,
(1.9)
,
(1.9)
Каде Еа- енергија за активирање;
Р- универзална гасна константа еднаква на 8,3 J/(mol.K),
А - предекспоненцијален фактор - фактор на фреквенција кој има димензија на константа на брзина.
Колку е поголема вредноста Еа , толку побрзо се зголемува брзината на реакцијата со температурата. Ако реакциите се едноставни, количината Еапокажува колкав минимум вишок енергија на 1 мол мора да имаат честичките кои реагираат за да влезат во реакција. Честички чија енергија е поголема или еднаква на Еа, се нарекуваат активни.
За сложени реакции кои се состојат од неколку фази, параметарот Еаво равенката (1.9) не секогаш има едноставно физичко значење и често е во функција на енергијата на активирање на одделни фази. Меѓутоа, и во овој случај параметарот Еасе смета за енергија на активирање, иако е поправилно да се нарече ефективна или емпириска енергија на активирање.
Опции Е а И А може да се одреди од зависноста на константата на брзината на реакцијата од температурата користејќи ја равенката (1.9), напишана како:
![]() (1.10)
(1.10)
Од графикот на зависност ln код 1/Т(сл. 1.2) лесно се наоѓаат ln А И ЕА /Р , и од нив А И ЕА.Во принцип, да се утврди ЕАИ А доволно е да се знаат константите на брзината к 1 И к 2 на две температури Т 1 И Т 2

Слика 1.2 - Arrhenius зависност на брзината на реакција од температурата

Потоа, според равенката (1.10)
Оваа дефиниција Е а , како по правило, не обезбедува доволна точност и се препорачува да се одреди енергијата за активирање користејќи најмалку четири вредности на константата на брзината на четири различни температури во опсег од најмалку 30-40 °C.
Реакција со нула редослед
При спроведување на хомогена нитрација на бензен, толуен, етилбензен со голем вишок на азотна киселина (5 молови НNO 3 на 0,1 мол од нитрираното соединение), беше откриено дека стапката на нитрација останува непроменета додека целото нитрирано соединение не реагира.
Според тоа, реакцијата е од нулта редослед:
Константата на брзина за нитрирање на бензен, толуен и етилбензен во овие услови е иста и не зависи од концентрацијата на нитрираното соединение. Ова се објаснува со фактот дека брзината на формирање на катјонот на нитрониум при автопротолиза на азотна киселина е помала од стапката на нитрација на ароматичното соединение:

а бидејќи азотна киселина е присутна во голем вишок, нејзината концентрација практично не се менува во текот на реакцијата.