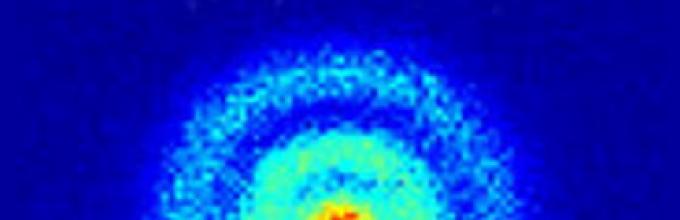
Всушност, авторот на RTCh отишол толку далеку во своите „рефлексии“ што е време да предизвика тешка контра-аргументација, имено, податоци од експериментот на јапонските научници за фотографирање на атомот на водород, кој стана познат на 4 ноември. , 2010 година. Сликата јасно ја покажува атомската форма, потврдувајќи ја и дискретноста и заобленоста на атомите: „Група научници и специјалисти од Универзитетот во Токио фотографираа за прв пат во светот поединечен атом на водород - најлесниот и најмалиот од сите атоми. јавуваат новинските агенции.
Фотографијата е направена со помош на еден од најнови технологии– специјално скенирање електронски микроскоп. Користејќи го овој уред, беше фотографиран посебен атом на ванадиум заедно со атом на водород.
Дијаметарот на атом на водород е десет милијардити дел од метар. Претходно се веруваше дека фотографирањето на него модерна опремаречиси невозможно. Водородот е најчестата супстанција. Неговиот удел во целиот универзум е приближно 90%.
Според научниците, на ист начин можат да се фатат и други елементарни честички. „Сега можеме да ги видиме сите атоми што го сочинуваат нашиот свет“, рече професорот Јуичи Икухара. „Ова е пробив на нови форми на производство, кога во иднина ќе биде можно да се носат одлуки на ниво на поединечни атоми и молекули“.

Атом на водород, релативни бои
http://prl.aps.org/abstract/PRL/v110/i21/e213001
Група научници од Германија, Грција, Холандија, САД и Франција го фотографираа атомот на водород. Овие слики, добиени со помош на микроскоп за фотојонизација, покажуваат дистрибуција на густината на електроните што е целосно во согласност со резултатите од теоретските пресметки. Работата на меѓународниот тим е претставена на страниците на Physical Review Letters.
Суштината на методот на фотојонизација е секвенцијална јонизација на атомите на водород, односно отстранување на електрон од нив поради електромагнетно зрачење. Одделените електрони се насочени кон осетливата матрица преку позитивно наелектризиран прстен, а положбата на електронот во моментот на судир со матрицата ја рефлектира положбата на електронот во моментот на јонизација на атомот. Наполнетиот прстен, кој ги отклонува електроните на страна, делува како леќа и со негова помош сликата се зголемува милиони пати.
Овој метод, опишан во 2004 година, веќе бил користен за фотографирање на поединечни молекули, но физичарите отишле понатаму и користеле фотојонизациски микроскоп за да ги проучуваат атомите на водород. Бидејќи ударот на еден електрон произведува само една точка, истражувачите акумулирале околу 20 илјади поединечни електрони од различни атоми и составиле просечна слика на електронските обвивки.
Според законите на квантната механика, електронот во атомот сам по себе нема специфична положба. Само кога атомот е во интеракција со надворешната средина, електронот се појавува со една или друга веројатност во одредено соседство на атомското јадро: регионот во кој веројатноста за откривање електрон е максимална се нарекува електронска обвивка. Новите слики покажуваат разлики помеѓу атомите од различни енергетски состојби; Научниците беа во можност јасно да ја покажат формата на електронските обвивки предвидени од квантната механика.
Со помош на други инструменти, микроскопи за скенирање тунели, поединечни атоми не само што може да се видат, туку и да се преместат во Вистинско место. Пред околу еден месец, оваа техника им овозможи на инженерите на IBM да нацртаат цртан филм, чија секоја рамка е составена од атоми: таквите уметнички експерименти немаат никаков практичен ефект, но ја демонстрираат основната можност за манипулирање со атомите. За применети цели, повеќе не се користи атомско склопување, туку хемиски процеси со самоорганизирање на наноструктурите или самоограничување на растот на монатомските слоеви на подлогата.
На оваа фотографија ја гледате првата директна слика на орбитите на електрон околу атомот - всушност, брановата функција на атомот!
За да добиете фотографија орбитална структураатом на водород, истражувачите го користеа најновиот квантен микроскоп - неверојатен уред кој им овозможува на научниците да ѕирнат во регионот квантна физика.
Орбиталната структура на просторот во атомот е окупирана од електрон. Но, за да ги опишат овие микроскопски својства на материјата, научниците се потпираат на брановите функции - математички начини за опишување на квантните состојби на честичките - имено, како тие се однесуваат во просторот и времето.
Како по правило, во квантната физика формули како Шредингеровата равенка се користат за да се опишат состојбите на честичките.
Пречки на патот на истражувачите
Досега, научниците всушност никогаш не ја набљудувале брановата функција. Обидот да се долови точната позиција или импулсот на еден електрон беше како обид да се фати рој муви. Директните набљудувања беа искривени од многу непријатен феномен - квантна кохерентност.
За да ги измерите сите квантни состојби, потребна ви е алатка која може да врши повеќекратни мерења на состојбите на честичката со текот на времето.
Но, како да се зголеми веќе микроскопската состојба на квантната честичка? Група меѓународни истражувачи го нашле одговорот. Со помош на квантен микроскоп, уред кој користи фотојонизација за директно набљудување на атомските структури.
Во својата статија во популарното списание Physical Review Letters, Анета Стодолна, која работи во институтот молекуларна физика(AMOLF) во Холандија опишува како таа и нејзиниот тим ги добиле структурите на јазолските електронски орбитали на атом на водород сместен во статичко електрично поле.

Метод на работа
По зрачењето со ласерски импулси, јонизираните електрони ги напуштија своите орбити и по измерената траекторија паднаа во 2D детектор (двојна микроканална плоча. Детекторот се наоѓа нормално на самото поле). Постојат многу траектории по кои електроните можат да патуваат пред да се судрат со детекторот. Ова им обезбедува на истражувачите збир на шеми на пречки - модели кои ја рефлектираат нодалната структура на брановата функција.
Истражувачите користеле електростатска леќа која го зголемува излезниот електронски бран за повеќе од 20.000 пати.

Трул почна да фаќа атоми, да гребе електрони од нив, да меси протони додека не му треперат само прстите, подготви тесто за протони, постави електрони околу него и - за следниот атом; Не поминаа ни пет минути додека тој држеше блок од чисто злато во рацете: го подаде на муцката, а таа, откако го проба блокот на забот и кимна со главата, рече:
- И навистина е злато, но јас не можам да бркам атоми така. Јас сум преголем.
- Во ред е, ќе ви дадеме посебен уред! - го убеди Трул.
Станислав Лем, Киберијада
Дали е можно, со помош на микроскоп, да се види атом, да се разликува од друг атом, да се набљудува уништувањето или формирањето на хемиска врска и да се види како една молекула се трансформира во друга? Да, ако не е едноставен микроскоп, туку атомска сила. И не треба да се ограничувате на набљудување. Живееме во време кога микроскопот со атомска сила повеќе не е само прозорец во микросветот. Денес овој уред може да се користи за движење на атоми, уништување хемиски врски, проучување на границата на истегнување на единечни молекули - па дури и за проучување на човечкиот геном.
Букви направени од ксенонски пиксели
Гледањето на атомите не било секогаш толку лесно. Историјата на микроскопот со атомска сила започна во 1979 година, кога Герд Карл Биниг и Хајнрих Рорер, кои работеа во Истражувачкиот центар IBM во Цирих, почнаа да создаваат инструмент кој ќе овозможи проучување на површини со атомска резолуција. За да дојдат до таков уред, истражувачите одлучија да го искористат ефектот на тунелирање - способноста на електроните да ги надминат навидум непробојните бариери. Идејата беше да се одреди позицијата на атомите во примерокот со мерење на јачината на струјата на тунелирање што произлегува помеѓу сондата за скенирање и површината што се проучува.
Биниг и Рорер успеаја и влегоа во историјата како пронаоѓачи на микроскопот за скенирање тунели (STM), а во 1986 година ја добија Нобеловата награда за физика. Микроскопот за скенирање тунели направи вистинска револуција во физиката и хемијата.
Во 1990 година, Дон Ајглер и Ерхард Швајцер, работејќи во Истражувачкиот центар IBM во Калифорнија, покажаа дека STM може да се користи не само за набљудување на атомите, туку и за манипулирање со нив. Со помош на сонда за микроскоп за скенирање тунели, тие ја создадоа можеби најпопуларната слика што ја симболизира транзицијата на хемичарите кон работа со поединечни атоми - тие насликаа три букви на површината на никел со 35 атоми на ксенон (сл. 1).
Биниг не мируваше на своите ловорики - во годината што ја доби Нобелова наградаЗаедно со Кристофер Гербер и Келвин Квајт, кои исто така работеа во Истражувачкиот центар IBM во Цирих, тој започна да работи на друг уред за проучување на микросветот, без недостатоци својствени за STM. Факт е дека со помош на микроскоп за скенирање тунели беше невозможно да се проучуваат диелектрични површини, туку само проводници и полупроводници, а за да се анализираат вторите, неопходно беше да се создаде значителен вакуум помеѓу нив и сондата за микроскоп. Сфаќајќи дека создавањето на нов уред е полесно отколку надградба на постоечка, Биниг, Гербер и Квајт го измислиле микроскопот за атомска сила или AFM. Принципот на неговото функционирање е радикално различен: за да се добијат информации за површината, тие не ја мерат моменталната јачина што се појавува помеѓу сондата за микроскоп и примерокот што се проучува, туку вредноста на привлечните сили што се појавуваат меѓу нив, односно слабите. нехемиски интеракции - ван дер Валс сили.
Првиот работен модел на AFM беше релативно едноставен. Истражувачите преместија дијамантска сонда над површината на примерокот, поврзана со флексибилен микромеханички сензор - конзола направена од златна фолија (привлечноста се јавува помеѓу сондата и атомот, конзолата се наведнува во зависност од силата на привлекување и го деформира пиезоелектрикот) . Степенот на свиткување на конзолата беше одреден со помош на пиезоелектрични сензори - на сличен начин како што жлебовите и гребените на винил плоча се претвораат во аудио снимка. Дизајнот на микроскопот со атомска сила му овозможи да открие привлечни сили до 10-18 њутни. Една година по создавањето на работен прототип, истражувачите успеаја да добијат слика од топографијата на површината на графит со резолуција од 2,5 ангстроми.
Во текот на трите децении што поминаа оттогаш, AFM се користи за проучување на речиси секој хемиски објект - од површината на керамичкиот материјал до живите клетки и поединечните молекули, и во статична и динамична состојба. Микроскопијата со атомска сила стана работа на хемичарите и научниците за материјали, а бројот на студии кои го користат овој метод постојано расте (сл. 2).
Со текот на годините, истражувачите избираа услови и за контактно и за бесконтактно проучување на објекти користејќи микроскопија на атомска сила. Контактниот метод е опишан погоре и се заснова на ван дер Валсовата интеракција помеѓу конзолата и површината. Кога работи во режим без контакт, пиезовибраторот ги возбудува осцилациите на сондата со одредена фреквенција (најчесто резонантна). Силата што ја врши површината предизвикува промена и на амплитудата и на фазата на осцилациите на сондата. И покрај некои недостатоци на методот без контакт (првенствено чувствителност на надворешен шум), тој го елиминира влијанието на сондата врз предметот што се проучува и затоа е поинтересен за хемичарите.
Жив на сонди, во потрага по врски
Микроскопијата со атомска сила стана бесконтактна во 1998 година благодарение на работата на студентот на Биниг, Франц Јозеф Гисибл. Токму тој предложи да се користи кварцен референтен осцилатор со стабилна фреквенција како конзола. 11 години подоцна, истражувачите од лабораторијата IBM во Цирих презедоа уште една модификација на бесконтактната AFM: улогата на сензорска сонда не ја играше остар дијамантски кристал, туку единствена молекула - јаглерод моноксид. Ова овозможи да се премине кон субатомска резолуција, како што покажа Лео Грос од одделот на IBM во Цирих. Во 2009 година, користејќи AFM, тој направи видливи не атоми, туку хемиски врски, добивајќи прилично јасна и недвосмислено читлива „слика“ за молекулата на пентаценот (сл. 3; Науката, 2009, 325, 5944, 1110-1114, doi: 10.1126/science.1176210).

Убеден дека хемиските врски може да се видат со помош на AFM, Лео Грос одлучи да оди подалеку и да користи микроскоп со атомска сила за мерење на должината и редот на врските - клучни параметри за разбирање хемиска структура, и следствено, својствата на супстанциите.
Потсетете се дека разликата во редоследот на врските покажува различни значењагустина на електрони и различни меѓуатомски растојанија помеѓу два атома (во едноставни термини, двојната врска е пократка од една врска). Кај етанот редот на врската јаглерод-јаглерод е еден, кај етиленот е два, а кај класичната ароматична молекула бензен редот на врската јаглерод-јаглерод е поголем од еден, но помал од два и се смета дека е 1,5.
Одредувањето на редоследот на врската е многу потешко кога се движите од едноставни ароматични системи кон рамни или масивни поликондензирани циклични системи. Така, редоследот на врски во фулерените, кој се состои од кондензирани пет- и шест-члени јаглеродни прстени, може да има вредност од еден до два. Истата несигурност е теоретски својствена за полицикличните ароматични соединенија.
Во 2012 година, Лео Грос, заедно со Фабијан Мон, покажаа дека микроскопот со атомска сила со бесконтактна метална сонда модифицирана со јаглерод моноксид може да ги измери разликите во распределбата на полнежот на атомите и меѓуатомските растојанија - односно параметрите поврзани со редот на врската ( Науката, 2012, 337, 6100, 1326–1329, doi: 10.1126/science.1225621).
За да го направат ова, тие проучувале два типа хемиски врски во фулерен - врска јаглерод-јаглерод, заедничка за двата шестчлени прстени што содржат јаглерод на C60 фулеренот и врска јаглерод-јаглерод, заедничка за пет и шест. -членувани прстени. Микроскопот со атомска сила покажа дека кондензацијата на шестчлените прстени создава врска која е пократка и со поголем ред од кондензацијата на цикличните фрагменти C 6 и C 5 . Студијата за карактеристиките на хемиското поврзување во хексабензокороненот, каде што уште шест C 6 прстени се симетрично лоцирани околу централниот C 6 прстен, ги потврди резултатите од квантното хемиско моделирање, според кое редот C-C врскицентрален прстен (на слика 4 буквата јас) мора да биде поголема од врските што го поврзуваат овој прстен со периферните циклуси (на слика 4 буквата ј). Слични резултати се добиени за покомплексен полицикличен ароматичен јаглеводород кој содржи девет шестчлени прстени.
Редоследот на врски и меѓуатомските растојанија, се разбира, беа од интерес за органските хемичари, но тоа беше поважно за оние кои работеа на теоријата на хемиски врски, предвидувањето реактивности проучување на механизмите на хемиските реакции. Сепак, и синтетичките хемичари и специјалисти во проучувањето на структурата на природните соединенија беа изненадувачки: се покажа дека микроскопот со атомска сила може да се користи за да се одреди структурата на молекулите на ист начин како NMR или IR спектроскопијата. Покрај тоа, тој дава јасен одговор на прашања со кои овие методи не можат да се справат.
Од фотографија до кино
Во 2010 година, истиот Лео Грос и Рајнер Ебел успеаја недвосмислено да ја воспостават структурата на природното соединение - цефаландол А, изолирано од бактерија Dermacoccus abyssi(Хемија на природата, 2010, 2, 821-825, doi: 10.1038/nchem.765). Составот на цефаландол А беше претходно воспоставен со помош на масена спектрометрија, но анализата на спектрите NMR на ова соединение не даде јасен одговор на прашањето за неговата структура: можни се четири опции. Со помош на микроскоп со атомска сила, истражувачите веднаш елиминирале две од четирите структури, а од преостанатите две правилен изборнаправени со споредување на резултатите добиени со помош на AFM и квантни хемиски симулации. Задачата се покажа како тешка: за разлика од пентаценот, фулеренот и коронените, цефаландол А не содржи само атоми на јаглерод и водород, покрај тоа, оваа молекула нема рамнина на симетрија (слика 5) - но и овој проблем беше решен.

Уште една потврда дека микроскопот со атомска сила може да се користи како аналитичка алатка е добиена во групата на Оскар Кустанца, кој во тоа време работел во инженерско училиштеУниверзитетот во Осака. Тој покажа како да се користи AFM за да се разликуваат атомите кои се разликуваат едни од други многу помалку од јаглеродот и водородот ( Природата, 2007, 446, 64–67, doi: 10.1038/nature05530). Кустант ја испитувал површината на легура составена од силициум, калај и олово со позната содржина на секој елемент. Како резултат на бројни експерименти, тој открил дека силата што произлегува помеѓу врвот на сондата AFM и различни атоми, варира (сл. 6). На пример, најсилната интеракција е забележана кога се истражува силиконот, а најслабата интеракција е забележана кога се истражува олово.

Се претпоставува дека во иднина резултатите од микроскопијата на атомската сила за препознавање на поединечни атоми ќе се обработуваат на ист начин како и резултатите од NMR - со споредување на релативните вредности. Бидејќи точниот состав на иглата на сензорот е тешко да се контролира, апсолутната вредност на силата помеѓу сензорот и различни атомиповршината зависи од експерименталните услови и брендот на уредот, но односот на овие сили за кој било состав и облик на сензорот останува константен за секој хемиски елемент.
Во 2013 година, се појавија првите примери за користење на AFM за да се добијат слики од поединечни молекули пред и по хемиски реакции: се создава „фотосет“ од производите и посредниците на реакцијата, кои потоа може да се монтираат во еден вид документарен филм (Науката, 2013, 340, 6139, 1434–1437; doi: 10.1126/science.1238187).
Феликс Фишер и Мајкл Кроми од Универзитетот во Калифорнија во Беркли нанесоа сребро на површината 1,2-бис[(2-етинилфенил)етинил]бензен, ги сликаше молекулите и ја загреа површината за да иницира циклизација. Половина од оригиналните молекули се претворија во полициклични ароматични структури составени од споени пет шестчлени и два петчлени прстени. Друга четвртина од молекулите формираа структури составени од четири шестчлени прстени поврзани преку еден четиричлен прстен и два петчлени прстени (сл. 7). Останатите производи беа олигомерни структури и, во помали количини, полициклични изомери.
Овие резултати двапати ги изненадија истражувачите. Прво, само два главни производи беа формирани за време на реакцијата. Второ, нивната структура беше изненадувачка. Фишер забележува дека хемиската интуиција и искуство овозможиле да се извлечат десетици можни производиреакции, но ниту една од нив не одговараше на соединенијата што се формираа на површината. Можно е појавата на атипични хемиски процеси да била олеснета со интеракцијата на почетните супстанции со подлогата.
Секако, по првите сериозни успеси во проучувањето на хемиските врски, некои истражувачи одлучија да го користат AFM за да ги набљудуваат послабите и помалку проучени интермолекуларни интеракции, особено водородните врски. Сепак, работата во оваа област допрва започнува, а резултатите се контрадикторни. Така, некои публикации известуваат дека микроскопијата со атомска сила овозможила да се набљудува водородната врска ( Науката, 2013, 342, 6158, 611–614, doi: 10.1126/science.1242603), други тврдат дека ова се само артефакти поради дизајнерските карактеристики на уредот и експериментални резултатитреба да се толкува повнимателно ( Писма за физички преглед, 2014, 113, 186102, doi: 10.1103/PhysRevLett.113.186102). Можеби конечниот одговор на прашањето дали водородот и другите интермолекуларни интеракции можат да се набљудуваат со помош на микроскопија на атомска сила ќе се добие веќе во оваа деценија. За да го направите ова, потребно е да ја зголемите резолуцијата на AFM барем неколку пати повеќе и да научите да добивате слики без пречки ( Физички преглед Б, 2014, 90, 085421, doi: 10.1103/PhysRevB.90.085421).
Синтеза на единечна молекула
ВО во способни рацеИ STM и AFM се претвораат од уреди способни да ја проучуваат материјата во уреди способни намерно да ја менуваат структурата на материјата. Со помош на овие уреди веќе е можно да се добие „најмалата хемиски лаборатории“, во која наместо колба се користи потпора, а наместо молови или милимоли реактанти се користат поединечни молекули.
На пример, во 2016 г меѓународна групаНаучниците предводени од Такаши Кумагаи користеле микроскопија на атомска сила без контакт за да ја претворат молекулата на порфицен од една во друга форма ( Хемија на природата, 2016, 8, 935-940, doi: 10.1038/nchem.2552). Порфиценот може да се смета за модификација на порфирин, чиј внатрешен прстен содржи четири атоми на азот и два атоми на водород. Вибрациите на сондата AFM пренесоа доволно енергија на молекулата на порфицен за да ги пренесат овие водогени од еден атом на азот во друг, а резултатот беше „огледална слика“ на оваа молекула (сл. 8).

Тимот, предводен од неуморниот Лео Грос, исто така покажа дека е можно да се иницира реакција на една молекула - тие го претворија дибромомантраценот во десетчлен цикличен дијн (сл. 9; Хемија на природата, 2015, 7, 623-628, doi: 10.1038/nchem.2300). За разлика од Кумагаи и соработниците, тие користеле микроскоп за скенирање на тунели за да ја активираат молекулата, а резултатот од реакцијата бил следен со помош на микроскоп со атомска сила.

Комбинираната употреба на микроскоп за скенирање тунел и микроскоп со атомска сила дури овозможи да се добие молекула што не може да се синтетизира со користење на класични техники и методи ( Природа нанотехнологија, 2017, 12, 308-311, doi: 10.1038/nnano.2016.305). Ова е триангулен, нестабилен ароматичен дирадикал чие постоење беше предвидено пред шест децении, но сите обиди за синтеза не успеаја (сл. 10). Хемичарите од групата на Нико Павличек го добија посакуваното соединение со отстранување на два атоми на водород од неговиот претходник со помош на STM и потврдување на синтетичкиот резултат со помош на AFM.

Се претпоставува дека бројот на дела посветени на употребата на микроскопија на атомска сила во органска хемија, сепак ќе расте. Во моментов, се повеќе и повеќе научници се обидуваат да реплицираат на површината реакции кои се добро познати во „хемијата на растворите“. Но, можеби синтетичките хемичари ќе почнат да ги репродуцираат во раствор реакциите што првично беа спроведени на површината со помош на AFM.
Од нежив до жив
Конзоли и сонди на микроскопи со атомска сила може да се користат не само за аналитички студии или синтеза на егзотични молекули, туку и за решавање применети проблеми. Веќе се познати случаи на употреба на АФМ во медицината, на пример, за рана дијагноза на ракот, а тука пионер е истиот Кристофер Гербер, кој имал рака во развојот на принципот на микроскопија на атомска сила и создавање на АФМ.
Така, Гербер успеа да го научи AFM да детектира точкеста мутација рибонуклеинска киселиназа меланом (на материјал добиен како резултат на биопсија). За да се направи ова, златната конзола на микроскопот со атомска сила беше модифицирана со олигонуклеотиди кои можат да влезат во интермолекуларна интеракција со РНК, а јачината на оваа интеракција може да се измери и поради пиезоелектричниот ефект. Чувствителноста на сензорот AFM е толку висока што тие веќе се обидуваат да го користат за да ја проучат ефективноста на популарниот метод за уредување на геномот CRISPR-Cas9. Тука се здружуваат технологии создадени од различни генерации истражувачи.
За да парафразираме класика на една од политичките теории, можеме да кажеме дека веќе ги гледаме неограничените можности и неисцрпноста на микроскопијата на атомската сила и тешко можеме да замислиме што ни претстои во врска со понатамошниот развој на овие технологии. Но, денес, микроскопите за скенирање тунели и микроскопите со атомска сила ни даваат можност да ги видиме и допираме атомите. Можеме да кажеме дека ова не е само продолжување на нашите очи, што ни овозможува да погледнеме во микрокосмосот на атомите и молекулите, туку и нови очи, нови прсти, способни да го допираат и контролираат овој микрокосмос.
Сепак, фотографирањето на самиот атом, а не само на кој било дел од него, се чинеше дека е исклучително тешка задача дури и кога се користат најтехнолошките уреди.
Факт е дека според законите на квантната механика, невозможно е подеднакво точно да се утврдат сите својства на субатомска честичка. Оваа гранка на теоретската физика е изградена на принципот на несигурност Хајзенберг, кој вели дека е невозможно да се измерат координатите и импулсот на честичката со еднаква прецизност - точните мерења на едното својство сигурно ќе ги променат податоците за другото.
Затоа, наместо да се одреди локацијата (координати на честички), квантна теоријапредлага да се измери таканаречената бранова функција.
Функцијата за бранови работи на ист начин како и звучниот бран. Единствената разлика е во тоа што математичкиот опис на звучниот бран го одредува движењето на молекулите во воздухот на одредено место, а брановата функција ја опишува веројатноста за појава на честичка на одредено место според равенката на Шредингер.
Мерењето на брановата функција е исто така тешко (директните набљудувања доведуваат до негов колапс), но теоретските физичари грубо можат да ги предвидат неговите вредности.
Можно е експериментално да се измерат сите параметри на брановата функција само ако се соберат од одделни деструктивни мерења извршени на целосно идентични системи на атоми или молекули.
Презентираа физичари од холандскиот истражувачки институт AMOLF нов метод, што не бара никакво „реструктуирање“, а резултатите од нивната работа ги објави во списанието Physical Review Letters. Нивната техника се заснова на хипотезата од 1981 година три годиниСоветски теоретски физичари, како и на подоцнежните истражувања.
За време на експериментот, тим од научници насочиле два ласерски зраци кон атоми на водород сместени во посебна комора. Како резултат на ова влијание, електроните ги напуштија своите орбити со брзина и насока одредени од нивните бранови функции. Силното електрично поле во комората што ги содржи атомите на водород ги насочувало електроните кон одредени делови од рамниот (рамен) детектор.
Позицијата на електроните што удираа во детекторот беше одредена од нивната почетна брзина, а не од нивната положба во комората. Така, распределбата на електроните на детекторот им кажа на научниците за брановата функција на овие честички што ја имале кога ја напуштиле орбитата околу јадрото на атом на водород.
Движењата на електроните беа прикажани на фосфоресцентен екран во форма на темни и светли прстени, кои научниците ги фотографираа со дигитална камера со висока резолуција.
„Многу сме задоволни од нашите резултати. Квантната механика има толку малку врска секојдневниот животлуѓе, дека ретко кој би можел да помисли да добие вистинска фотографија од квантни интеракции во атом“, вели водечкиот автор на студијата Анета Стодолна. Таа исто така тврди дека развиената техника може да има практична употреба, на пример, да се создадат проводници со дебелина на атом, развивајќи технологија на молекуларна жица, што значително ќе ги подобри современите електронски уреди.
„Вреди да се одбележи дека експериментот беше спроведен специјално на водород - во исто време наједноставната и најчеста супстанција во нашиот универзум. Ќе треба да се разбере дали оваа техника може да се примени на посложени атоми. Ако е така, тогаш ова е голем пробив што ќе ни овозможи да развиеме не само електроника, туку и нанотехнологија“, вели Џеф Лундин од Универзитетот во Отава, кој не бил вклучен во студијата.
Сепак, самите научници кои го спроведоа експериментот не размислуваат за практичната страна на прашањето. Тие веруваат дека нивното откритие првенствено се однесува на фундаменталната наука, која ќе помогне да се пренесе повеќе знаење на идните генерации физичари.
PostScience ги разоткрива научните митови и ги објаснува вообичаените заблуди. Ги замоливме нашите експерти да коментираат за популарните идеи за структурата и својствата на атомите.
Моделот на Радерфорд одговара на современите идеи за структурата на атомот
Ова е точно, но делумно.Планетарниот модел на атомот, во кој лесни електрони орбитираат околу тешко јадро, како планетите околу Сонцето, беше предложен од Ернест Радерфорд во 1911 година, откако самото јадро беше откриено во неговата лабораторија. Со бомбардирање на парче метална фолија со алфа честички, научниците открија дека огромното мнозинство честички поминуваат низ фолијата, слично како светлината низ стаклото. Сепак, мал дел од нив - околу еден од 8.000 - биле рефлектирани назад до изворот. Радерфорд ги објасни овие резултати со фактот дека масата не се распределува рамномерно во материјата, туку е концентрирана во „грутки“ - атомски јадра кои носат позитивен полнеж што ги одбива позитивно наелектризираните алфа честички. Лесните, негативно наелектризирани електрони избегнуваат „паѓање“ на јадрото вртејќи се околу нив, така што центрифугалната сила ја балансира електростатската привлечност.
Се вели дека откако го измислил овој модел, Радерфорд извикал: „Сега знам како изгледа еден атом!“ Меѓутоа, наскоро, по инспирација, Радерфорд ја сфатил погрешната природа на неговата идеја. Ротирајќи околу јадрото, електронот создава електрични и магнетно поле. Овие полиња се шират со брзина на светлината во форма електромагнетен бран. И таков бран носи енергија со себе! Излегува дека, ротирајќи околу јадрото, електронот континуирано ќе губи енергија и ќе падне на јадрото во рок од милијардити дел од секундата. (Некој би можел да се запраша дали истиот аргумент може да се примени и на планетите сончев систем: Зошто не паѓаат на Сонцето? Одговор: гравитационите бранови, доколку воопшто постојат, се многу послаби од електромагнетните бранови, а енергијата складирана во планетите е многу поголема отколку во електроните, така што „резервата на моќ“ на планетите е многу реда на големина подолга.)
Радерфорд му ја доверил задачата на својот соработник, младиот теоретичар Нилс Бор, да ја реши противречноста. По две години работа, Бор најде делумно решение. Тој постулираше дека меѓу сите можни орбити на електрон има и такви во кои електронот може да остане долго време без да емитира. Електронот може да се движи од една стационарна орбита во друга, додека апсорбира или емитува квант електромагнетно полесо енергија еднаква на енергетската разлика помеѓу двете орбити. Користејќи ги првичните принципи на квантната физика, кои веќе беа откриени во тоа време, Бор можеше да ги пресмета параметрите на стационарни орбити и, соодветно, енергиите на квантите на зрачење што одговараат на транзициите. Овие енергии дотогаш биле мерени со помош на спектроскопски методи, а теоретските предвидувања на Бор речиси совршено се совпаѓале со резултатите од овие мерења!
И покрај овој триумфален резултат, теоријата на Бор речиси и не донесе јасност на прашањето за атомската физика, бидејќи беше полуемпириска: додека го постулираше присуството на стационарни орбити, таа не ги објасни на никаков начин. физичка природа. За темелно разјаснување на прашањето беа потребни најмалку уште две децении, за време на кои квантната механика беше развиена како систематска, интегрална физичка теорија.
Во рамките на оваа теорија, електронот е предмет на принципот на несигурност и не е опишан материјална точка, како планета, но бранова функција „намачкана“ по целата орбита. Во секој момент од времето е во суперпозиција на состојби што одговараат на сите точки на орбитата. Бидејќи густината на распределбата на масата во просторот, одредена од брановата функција, не зависи од времето, наизменичното електромагнетно поле не се создава околу електронот; нема загуба на енергија.
Така, планетарниот модел дава вистинска визуелна претстава за тоа како изгледа атомот - беше во право Радерфорд во својот извик. Сепак, тоа не објаснува како работи атомот: структурата е многу посложена и подлабока од она што го моделираше Радерфорд.
Како заклучок, забележувам дека „митот“ за планетарниот модел е во самиот центар на интелектуалната драма што доведе до пресвртница во физиката пред сто години и во голема мера ја обликуваше оваа наука во нејзината модерна форма.
Александар Лвовски
Доктор по физика, професор на Факултетот за физика на Универзитетот во Калгари, водач на научната група, член на научниот совет на рускиот квантен центар, уредник на научното списание Optics Express
Може да се контролираат поединечни атоми
Ова е вистина.Секако дека можеш, зошто да не? Можете да контролирате различни параметри на атомот, а атомот има доста од нив: има позиција во просторот, брзината, а има и внатрешни степени на слобода. Внатрешните степени на слобода ги одредуваат магнетните и електрични својстваатом, како и подготвеноста да емитува светлина или радио бранови. Во зависност од внатрешната состојба на атомот, тој може да биде повеќе или помалку активен при судири и хемиски реакции, промена на својствата на околните атоми, нејзиниот одговор на надворешни маргини. Во медицината, на пример, тие користат таканаречени поларизирани гасови за да конструираат томограми на белите дробови - во такви гасови сите атоми се во иста внатрешна состојба, што им овозможува да го „видат“ волуменот што го пополнуваат со нивниот одговор.
Не е толку тешко да се контролира брзината на атомот или неговата позиција; многу е потешко да се избере точно еден атом за контрола. Но, и ова може да се направи. Еден од пристапите кон таквото одвојување на атомите се реализира со ласерско ладење. За контрола, секогаш е погодно да се има позната почетна позиција; доста е добро ако атомот сè уште не се движи. Ласерското ладење ви овозможува да ги постигнете и двете, да ги локализирате атомите во вселената и да ги изладите, односно да ја намалите нивната брзина на речиси нула. Принципот на ласерско ладење е ист како оној на млазен авион, само вториот испушта струја на гас за да забрза, а во првиот случај, атомот, напротив, апсорбира млаз од фотони (светлински честички) и забавува . Современи методиЛасерското ладење може да олади милиони атоми до брзина на одење и под. Потоа во игра влегуваат разни видови пасивни стапици, на пример диполна стапица. Ако ласерското ладење користи светлосно поле што атомот активно го апсорбира, тогаш за да се задржи во диполна стапица, фреквенцијата на светлината се избира подалеку од каква било апсорпција. Излегува дека високо фокусираната ласерска светлина е способна да ги поларизира малите честички и зрната прашина и да ги повлече во регионот со најголем интензитет на светлина. Атомот не е исклучок и исто така е вовлечен во регионот на најсилното поле. Излегува дека ако ја фокусирате светлината што е можно поцврсто, тогаш само точно еден атом може да се држи во таква стапица. Факт е дека ако второто падне во стапицата, тогаш излегува дека е толку цврсто притиснато на првата што формираат молекула и во исто време паѓаат од стапицата. Сепак, таквото остро фокусирање не е единствениот начин да се изолира еден атом; можете да ги користите и својствата на интеракцијата на атомот со резонатор за наелектризирани атоми, јони, можете да користите електрични полиња за да фатите и задржите точно еден јон, и така натаму. Дури е можно да се возбуди еден атом во прилично ограничен ансамбл на атоми во многу возбудена, таканаречена Ридберг состојба. Атомот, откако ќе се возбуди во Ридберговата состојба, ја блокира можноста за возбудување на неговите соседи во истата состојба и, ако волуменот со атомите е доволно мал, ќе биде единствениот.
На еден или друг начин, штом ќе се зароби атом, може да се контролира. Внатрешната состојба може да се промени со светлосни и радиофреквентни полиња користејќи ги саканите фреквенции и поларизацијата на електромагнетниот бран. Можно е да се пренесе атом во која било однапред одредена состојба, било да е тоа одредена состојба - ниво или нивна суперпозиција. Единственото прашање е достапноста на потребните фреквенции и способноста да се направат доволно кратки и моќни контролни импулси. Неодамна, стана можно поефективно да се контролираат атомите, држејќи ги во близина на наноструктури, што овозможува не само да се „разговара“ со атомот поефикасно, туку и да се користи самиот атом - поточно, неговиот внатрешни состојби- да го контролира протокот на светлината, а во иднина, можеби, за компјутерски цели.
Контролирањето на положбата на атомот што го држи стапица е доста потесно едноставна задача- само поместете ја самата стапица. Во случај на диполна стапица, поместете го светлосниот зрак, што може да се направи, на пример, со подвижни огледала за ласерско шоу. На атомот повторно може да му се даде брзина на реактивен начин - може да се направи да апсорбира светлина, а јонот лесно може да се забрза електрични полиња, исто како што беше направено во цевките со катодни зраци. Така, денес, во принцип, се може да се направи со атом, тоа е само прашање на време и напор.

Алексеј Акимов
Атомот е неделив
Делумно точно, делумно не.Википедија ни ја дава следнава дефиниција: „Атомот (од старогрчки ἄτομος - неделив, неотсечен) е честичка на супстанција со микроскопска големина и маса, најмал дел од хемиски елемент, кој е носител на неговите својства. Атомот се состои од атомско јадро и електрони“.
Во денешно време, секој образован човек го замислува атомот во моделот на Радерфорд, накратко претставен со последната реченица од оваа општоприфатена дефиниција. Се чини дека одговорот на поставеното прашање/мит е очигледен: атомот е композитен и сложен објект. Сепак, ситуацијата не е толку јасна. Античките филозофи попрво во дефиницијата на атом го ставија значењето на постоењето на елементарна и неделива честичка на материјата и веројатно немаше да го поврзат проблемот со структурата на елементите на периодниот систем. Во атомот на Радерфорд всушност наоѓаме таква честичка - тоа е електрон.
Електрон според модерни идеи, вклопувајќи се во т.н
Стандардниот модел е точка чија состојба се опишува со позиција и брзина. Важно е дека истовремената спецификација на овие кинематички карактеристики е невозможна поради Хајзенберговиот принцип на несигурност, но со разгледување само на една од нив, на пример координатата, може да се одреди со произволно висока точност.
Дали тогаш е можно, користејќи модерна експериментална технологија, да се обидеме да локализираме електрон на скала значително помала од атомската големина (~0,5 * 10-8 cm) и да ја провериме неговата сличност со точка? Излегува дека ако се обидете да локализирате електрон на скалата на таканаречената бранова должина на Комптон - околу 137 пати помала од големината на атом на водород - електронот ќе комуницира со својата антиматерија и системот ќе стане нестабилен.
Посоченост и неделивост на електронот и други елементарни честичкиматеријата е клучен елемент на принципот на дејство на краток дострел во теоријата на теренот и е присутна во сите фундаментални равенки кои ја опишуваат природата. Така, античките филозофи не биле толку далеку од вистината во претпоставката дека постојат неделиви честички на материјата.

Дмитриј Купријанов
Доктор по физичко-математички науки, професор по физика на Државниот политехнички универзитет во Санкт Петербург, раководител. Катедра за теоретска физика SPbSPU
Науката сè уште не го знае ова.Планетарниот модел на атомот на Радерфорд претпоставувал дека електроните орбитираат околу атомското јадро, како планети кои орбитираат околу сонцето. Во исто време, природно беше да се претпостави дека електроните се цврсти сферични честички. Класичниот модел на Радерфорд беше внатрешно контрадикторен. Јасно подвижните забрзани наелектризирани честички (електрони) би морале да изгубат енергија поради електромагнетно зрачењеи на крајот паѓаат на јадрата на атомите.
Нилс Бор предложи да се забрани овој процес и да се воведат одредени барања за радиусите на орбитите по кои се движат електроните. Феноменолошкиот модел на Бор го отстапи местото на квантниот модел на атомот, развиен од Хајзенберг, и квантниот, но повизуелен модел на атомот, предложен од Шредингер. Во моделот на Шредингер, електроните повеќе не се топчиња што летаат во орбитата, туку стоечки брановикои како облаци висат атомско јадро. Обликот на овие „облаци“ беше опишан со брановата функција воведена од Шредингер.
Веднаш се постави прашањето: кое е физичкото значење на брановата функција? Одговорот го предложи Макс Борн: квадратниот модул на брановата функција е веројатноста да се најде електрон во дадена точка во просторот. И тука започнаа тешкотиите. Се појави прашањето: што значи да се најде електрон во дадена точка во вселената? Зарем изјавата на Борн не треба да се сфати како признание дека електронот е мала топка која лета по одредена траекторија и која може да се фати во одредена точка од оваа траекторија со одредена веројатност?
Токму тоа е гледиштето на Шредингер и Алберт Ајнштајн, кои му се придружија по ова прашање. На нив се спротивставија физичарите од Копенхагенската школа - Нилс Бор и Вернер Хајзенберг, кои тврдеа дека помеѓу мерните чинови електронот едноставно не постои, што значи дека нема смисла да се зборува за траекторијата на неговото движење. Дискусијата помеѓу Бор и Ајнштајн за толкувањето на квантната механика отиде во историјата. Бор изгледаше како победник: тој успеа, иако не многу јасно, да ги побие сите парадокси формулирани од Ајнштајн, па дури и познат парадокс„Шродингеровата мачка“, формулирана од Шродингер во 1935 година. Веќе неколку децении, повеќето физичари се согласуваа со Бор дека материјата не е објективна реалност што ни се дава во сензации, како што поучуваше Карл Маркс, туку нешто што се појавува само во моментот на набљудување и не постои без набљудувач. Интересно е што во советско времеКатедрите за филозофија на универзитетите учеа дека таквото гледиште е субјективен идеализам, односно тренд што се коси со објективниот материјализам - филозофијата на Маркс, Енгелс, Ленин и Ајнштајн. Во исто време, на катедрите за физика, студентите беа учени дека концептите на Копенхагенската школа се единствените точни (можеби затоа што најпознатиот советски теоретски физичар Лев Ландау припаѓаше на ова училиште).
Во моментов мислењата на физичарите се поделени. Од една страна, копенхагенската интерпретација на квантната механика продолжува да биде популарна. Обиди експериментална верификацијаВалидноста на ова толкување (на пример, успешната верификација на таканаречената Белова нееднаквост од францускиот физичар Ален Аспе) ужива речиси едногласно одобрување од научната заедница. Од друга страна, на теоретичарите им е доста удобно да разговараат за алтернативните теории, како што е теоријата паралелни светови. Враќајќи се на електронот, можеме да кажеме дека неговите шанси да остане топка од билијард сè уште не се многу големи. Во исто време, тие се различни од нула. Во 20-тите години на 20 век, билијардниот модел на расејување на Комптон овозможи да се докаже дека светлината се состои од кванти - фотони. Во многу проблеми поврзани со важни и корисни уреди (диоди, транзистори), погодно е да се размислува за електрон како топка за билијард. Бранова природаелектронот е важен за опишување на посуптилни ефекти, како што е негативната магнетоотпорност на металите.
Филозофското прашање дали постои топка-електрон помеѓу мерните акти нема никаква важност во обичниот живот. од големо значење. Сепак, ова прашање продолжува да биде едно од најпознатите сериозни проблеми модерна физика.

Алексеј Кавокин
Кандидат за физичко-математички науки, професор на Универзитетот во Саутемптон, раководител на групата за квантна поларитоника на рускиот квантен центар, научен директор на Медитеранскиот институт за фундаментална физика (Италија)
Атомот може целосно да се уништи
Ова е вистина.Кршењето не е градење. Можете да уништите сè, вклучително и атом, до кој било степен на комплетност. Според првото приближување, атомот е позитивно наелектризирано јадро опкружено со негативно наелектризирани електрони. Првото деструктивно дејство што може да се изврши на атом е да се откинат електроните од него. Ова може да се направи на различни начини: можете да фокусирате моќно ласерско зрачење на него или можете да го зрачите со брзи електрони или други брзи честички. Атомот кој изгубил дел од своите електрони се нарекува јон. Во оваа состојба постојат атомите на Сонцето, каде температурите се толку високи што е практично невозможно атомите да ги задржат своите електрони при судири.
Колку повеќе електрони изгубил еден атом, толку потешко е да се отстранат останатите. Во зависност од атомскиот број, атомот има повеќе или помалку електрони. Водородниот атом генерално има само еден електрон и често го губи дури и во нормални услови, а водородот кој ги изгубил своите електрони ја одредува pH вредноста на водата. Атомот на хелиум има два електрони, а во целосно јонизирана состојба се нарекува алфа честичка - вид на честички што веќе ги очекуваме од нуклеарен реактор наместо од обична вода. Атомите што содржат многу електрони бараат уште повеќе енергија за да се отстранат сите електрони, но сепак, можно е да се отстранат сите електрони од кој било атом.
Ако сите електрони се откинат, тогаш јадрото останува, но може и да се уништи. Јадрото се состои од протони и неутрони (обично хадрони), и иако тие се доста силно врзани, инцидентна честичка со доволно висока енергија може да ги раздели. Тешките атоми, во кои има премногу неутрони и протони, имаат тенденција сами да се распаѓаат, ослободувајќи доста енергија - нуклеарните централи се засноваат на овој принцип.
Но, дури и ако го скршите јадрото и ги откинете сите електрони, остануваат оригиналните честички: неутрони, протони, електрони. Тие, се разбира, исто така можат да бидат уништени. Всушност, тоа е она што го прави, што ги забрзува протоните до огромни енергии, целосно уништувајќи ги при судири. Во овој случај, се раѓаат многу нови честички, кои судирот ги проучува. Истото може да се направи со електроните и сите други честички.
Енергијата на уништената честичка не исчезнува, таа се дистрибуира меѓу другите честички, а ако ги има доволно, тогаш станува невозможно брзо да се следи оригиналната честичка во морето на нови трансформации. Се може да се уништи, нема исклучоци.

Алексеј Акимов
Кандидат за физичко-математички науки, шеф на групата „Квантни симулатори“ на рускиот квантен центар, наставник во МИПТ, вработен во Физичкиот институт Лебедев, истражувач на Универзитетот Харвард