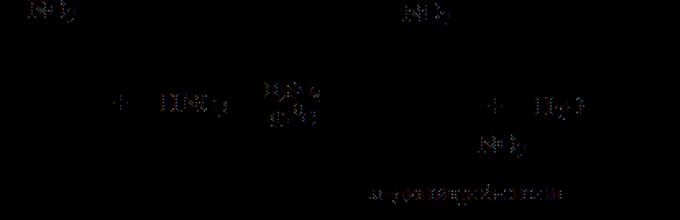Нитрацијата на ароматичните соединенија е главниот начин за добивање на нитро-соединенија. Процесот на нитрација како посебен случај на електрофилна супституција во ароматичните серии е веќе разгледан порано. Затоа, се чини дека е соодветно да се фокусираме на синтетичкиот потенцијал на оваа реакција.
Самиот бензен се нитрира прилично лесно и со добри резултати.
Во потешки услови, нитробензенот може да се нитрира и да се формира м-динитробензен

Поради деактивирачкиот ефект на две нитро групи, воведете трета нитро група м-динитробензен може да се добие само со голема тешкотија. 1,3,5-тринитробензен е добиен со 45% принос како резултат на нитрација м-динитробензен на 100-110 o C и времетраење на реакцијата од 5 дена.
Тешкотиите во добивањето тринитробензен со директно нитрирање на бензенот доведоа до развој на индиректни методи. Според еден од нив, тринитротолуенот, кој е попристапен од тринитробензенот, се оксидира до 2,4,6-тринитробензоева киселина, која лесно се декарбоксилира кога се загрева во вода.

На ист начин, треба да се прибегне кон индиректни методи кога е неопходно да се добие 1,2-динитробензен. Во овој случај, способноста на амино групата да се оксидира до нитро група во О-нитроанилин

Дури и во случаи кога подготовката на нитро соединенија со нитрација не треба да наиде на некои посебни тешкотии, треба да се прибегне кон индиректни методи. Така, не е можно да се добие пикринска киселина со нитрирање на фенолот, бидејќи Со азотна киселина, фенолот не се нитрира, туку се оксидира. Затоа, обично се користи следнава шема

Суптилностите на оваа шема се дека поради деактивирањето на прстенот со хлор и две веќе постоечки нитро групи, не е можно да се воведе трета нитро група во него. Затоа, хлорот во динитрохлоробензенот најпрво се заменува со хидроксил, во кој придонесуваат нитро групите (бимолекуларна супституција). Добиениот динитрофенол лесно прифаќа друга нитро група без да се оксидира во забележлива мера. Постојните нитро групи го штитат бензенскиот прстен од оксидација.
Друг неочигледен начин за добивање пикринска киселина е сулфонација на фенол во 2,4-фенол дисулфонска киселина, проследена со нитрација на добиеното соединение. Во овој случај, истовремено со нитрација, сулфо групите се заменуваат со нитро групи

Еден од најважните ароматични нитро деривати, тринитротолуен, се произведува во технологијата со нитрирање на толуен, што се одвива според следната шема

Хемиски својства
Ароматичните нитро-соединенија се способни да реагираат и со учество на бензенскиот прстен и нитро групата. Овие структурни елементи влијаат на реактивноста на едни со други. Така, под влијание на нитро групата, нитробензенот неволно влегува во реакција на електрофилна супституција и новиот супституент прифаќа м- позиција. Нитро групата влијае не само на реактивноста на бензенскиот прстен, туку и на однесувањето на соседните функционални групи во хемиските реакции.
Да ги разгледаме реакциите на ароматичните нитро соединенија поради нитро групата.
16.2.1. Закрепнување.Една од најважните реакции на нитро-соединенијата е нивната редукција до ароматични амини, кои се широко користени во производството на бои, лекови и фотохемикалии.
Можноста за претворање на нитро група во амино група со намалување на нитро-соединенијата првпат ја покажал Зинин во 1842 година користејќи го примерот на реакцијата на нитробензен со амониум сулфид

Последователно, намалувањето на ароматичните нитро-соединенија беше предмет на длабинска студија. Утврдено е дека во општиот случај намалувањето е сложено и продолжува низ повеќе фази со формирање на меѓупроизводи. Амините се само крајниот производ на реакцијата. Резултатот од реставрацијата се одредува според јачината на средството за редукција и pH околината. При електрохемиска редукција, составот на производите зависи од потенцијалот на електродите. Со менување на овие фактори, можете да го одложите процесот на обновување во средните фази. Во неутрални и кисели медиуми, редукцијата на нитробензенот се одвива последователно преку формирање на нитрозобензен и фенилхидроксиламин

Кога редукцијата се изведува во алкална средина, добиениот нитрозобензен и фенилхидроксиламин се способни да се кондензираат едни со други за да формираат азоксибензен, во кој атомите на азот и кислород се меѓусебно поврзани со полуполарна врска

Предложениот механизам за кондензација наликува на механизмот за кондензација на алдол
Редукцијата на азоксибензен во анилин се јавува преку азо- и хидразобензен
Сите меѓупроизводи споменати погоре за редукција на нитробензен во анилин може да се добијат или директно од нитробензен или едни од други. Еве неколку примери


16.2.2. Влијанието на нитро групата врз реактивноста на другите функционални групи.Во нашата студија за ароматичните халогени деривати, веќе наидовме на случај кога соодветно поставените нитро групи значително влијаеле на нуклеофилната замена на халогенот (бимолекуларна замена на ароматски врзаниот халоген). Користејќи го примерот О- И n-динитробензен, беше откриено дека нитро групата може да промовира нуклеофилна супституција не само на халоген, туку дури и на друга нитро група

Механизмот на бимолекуларна замена на нитро група со хидроксилна група може да се претстави како следниот процес во две фази

Карбанионот формиран во првата фаза од реакцијата што се разгледува е резонантно стабилизиран поради придонесот на ограничувачката структура 1, во која нитро групата ги повлекува електроните токму од јаглеродот на бензенскиот прстен кој има вишок од нив.
Карактеристика на нуклеофилната супституција на една нитро група под влијание на друга нитро група е тоа што реакцијата е многу чувствителна на локацијата на нитро групите релативно една на друга. Познато е дека м-динитробензенот не реагира со алкохолен раствор на амонијак дури и на 250 o C.
Други примери на нитрогрупа кои промовираат супституција, во овој случај хидроксил, се трансформациите на пикринската киселина

16.2.3. Комплексирање со ароматични јаглеводороди.Карактеристично својство на ароматичните нитро-соединенија е нивната тенденција да формираат комплекси со ароматични јаглеводороди. Врските во таквите комплекси се од електростатска природа и се јавуваат помеѓу честичките кои донираат електрони и честичките кои примаат електрони. Комплексите што се разгледуваат се нарекуваат π -комплекси или комплекси за пренос на полнеж.
π – Комплексите во повеќето случаи се кристални материи со карактеристични точки на топење. Доколку е потребно π -комплексот може да се уништи со ослободување на јаглеводороди. Поради комбинацијата на овие својства π -комплексите се користат за изолација, прочистување и идентификација на ароматични јаглеводороди. Пикринската киселина особено често се користи за формирање на комплекси, чии комплекси погрешно се нарекуваат пикрати.
Поглавје 17
Амини
Врз основа на степенот на замена на атомите на водород во амонијак со алкилни и арилни супституенти, се разликуваат примарни, секундарни и терциерни амини. Во зависност од природата на супституентите, амините можат да бидат масно-ароматични или чисто ароматични.
Ароматичните амини се именуваат со додавање на суфиксот „амин“ на името на групите поврзани со азот. Во сложени случаи, амино група со помал супституент се означува со префиксот „амино“ (N-метиламино-, N, N-диметиламино), кој се додава на името на посложениот супституент. Подолу се најчестите пронајдени амини и нивните имиња.

Методи на прием
Веќе наидовме на многу од методите за подготовка на амини при проучувањето на алифатичните амини. При примена на овие методи за синтеза на ароматични амини, се појавуваат некои особености, затоа, без страв од повторување, ќе ги разгледаме.
17.1.1. Намалување на нитро соединенија.Редукцијата на нитро-соединенијата е главниот метод и за лабораториско и за индустриско производство на амини, што може да се изврши на неколку начини. Тие вклучуваат каталитичка хидрогенизација, редукција со атомски водород и хемиска редукција.
Каталитичката редукција се врши со молекуларен водород во присуство на фино мелен никел или платина, бакарни комплексни соединенија на носачите. При изборот на катализатор и условите за редукција, мора да се има предвид дека може да се намалат и други функционални групи. Покрај тоа, каталитичката редукција на нитро-соединенијата мора да се изврши со одредена претпазливост поради екстремната егзотермична природа на реакцијата.
Кога амониум сулфид се користи како хемиски редуцирачки агенс, станува возможно да се намали само една од неколкуте нитро групи

17.1.2. Аминирање на халогени деривати.Познати се тешкотиите што се јавуваат при аминирање на ароматични халогени деривати со помош на механизмот „елиминација-додавање“. Меѓутоа, како што веќе беше споменато повеќе од еднаш, супституентите кои повлекуваат електрони во бензенскиот прстен, правилно лоцирани, значително ја олеснуваат супституцијата на халоген во арил халиди, насочувајќи го процесот преку бимолекуларен механизам. За споредба, подолу се дадени условите за аминирање на хлоробензен и динитрохлоробензен

17.1.3. Хофман се разделува.Хофмановото расцепување на киселинските амиди произведува примарни амини кои содржат еден јаглерод помалку од почетните амиди

Реакцијата продолжува со миграција на фенил од карбонилниот јаглерод во атом на азот (1,2-фенил поместување) според следниот предложен механизам

17.1.4. Алкилација и арилација на амини.Алкилацијата на примарните и секундарните ароматични амини со халоалкили или алкохоли произведува секундарни и терциерни масни ароматични амини

За жал, кога примарните амини учествуваат во реакцијата, се добива мешавина. Ова може да се избегне ако почетниот амин е предацилиран, а потоа алкилиран

Овој метод на заштита на амино групата овозможува да се добијат чисти секундарни ароматични амини, како и терциерни амини со различни супституентни радикали

Арилацијата на амините овозможува да се добијат чисти секундарни и терциерни ароматични амини
Хемиски својства
Ароматичните амини реагираат и со амино групата и со бензенскиот прстен. Покрај тоа, секоја функционална група е под влијание на друга група.
Реакции на амино групата
Поради присуството на амино група, ароматичните амини подлежат на бројни реакции. Некои од нив веќе се дискутирани: алкилација, ацилација, реакција со алдехиди за формирање на азометини. Другите реакции на кои ќе им се посвети внимание се лесно предвидливи, но имаат одредени карактеристики.
Основност
Присуството на осамен пар електрони на азотниот атом, кој може да се претстави за да формира врска со протон, обезбедува ароматични амини со основни својства

Од интерес е да се спореди базичноста на алифатичните и ароматичните амини. Како што веќе беше покажано во студијата за алифатични амини, погодно е да се суди за базичноста на амините според константата на базичност К во

Ајде да ги споредиме основите на анилин, метиламин и амонијак
Амонијак 1.7. 10 -5
Метиламин 4.4. 10 -4
Анилин 7.1. 10-10
Од овие податоци е јасно дека појавата на метил група која донира електрони ја зголемува густината на електроните во атомот на азот и доведува до зголемена базичност на метиламин во споредба со амонијакот. Во исто време, фенилната група ја ослабува базичноста на анилин за повеќе од 10 5 пати во споредба со амонијакот.
Намалувањето на базичноста на анилин во споредба со алифатични амини и амонијак може да се објасни со конјугација на единствениот пар на азотни електрони со секстетот електрони на бензенскиот прстен

Ова ја намалува способноста на единствениот пар електрони да прими протон. Оваа тенденција е уште поизразена кај ароматичните амини, кои содржат супституенти кои ги повлекуваат електроните на бензенскиот прстен.

Значи, м-нитроанилинот како основа е 90 пати послаб од анилинот.
Како што може да се очекува, супституентите кои донираат електрони на бензенскиот прстен ја подобруваат базичноста на ароматичните амини

Масните ароматични амини, под влијание на алкилната група, покажуваат поголема базичност од анилинот и амини со групи што повлекуваат електрони во прстенот.
 Електронската структура на нитро групата се карактеризира со присуство на седум поларна (полуполарна) врска:
Електронската структура на нитро групата се карактеризира со присуство на седум поларна (полуполарна) врска:
Масните нитро-соединенија се течности кои се нерастворливи во вода, но многу растворливи во алкохол и етер. Ароматичните нитро-соединенија се течности или цврсти материи со специфичен мирис. Многу важно својство на нитро-соединенијата е тоа што при редукција се трансформираат во примарни амини.
C 6 H 5 - NO 2 + 6 [H]  C 6 H 5 – NH 2 + 2 H 2 O
C 6 H 5 – NH 2 + 2 H 2 O
Сите нитро соединенија се отровни. Многу ароматични нитро-соединенија имаат експлозивни својства.
Хемиски својства. Хемиското однесување на нитро-соединенијата се одредува со присуството на нитро група во молекулата и нејзините карактеристики, како и структурата на јаглеводородниот радикал и нивното меѓусебно влијание.

1. Намалување на нитро соединенија
.
Кога нитро-соединенијата се намалуваат, се формираат примарни амини. Намалувањето на ароматичните нитро-соединенија е од особено големо индустриско значење:
Во зависност од условите за редукција (во кисела, алкална или неутрална средина) и природата на редукционото средство, за време на реакцијата се формираат различни меѓупроизводи, од кои многу се широко користени во технологијата.
2. Ефектот на алкалите врз нитро-соединенијата . Кога нитро група се внесува во молекула на јаглеводород, поради неговите својства за повлекување електрони, таа нагло ја зголемува подвижноста на атомите на водород во α-позицијата. Примарните и секундарните нитро-соединенија стекнуваат способност да се раствораат во алкали за да формираат соли. Кога киселина делува на сол, се формира нитро соединение во ацинитро форма:

кој потоа преминува во нитро форма:
Интерконверзијата на две форми на нитро соединенија е типичен пример за динамичка изомеризам (тавтомеризам).
3. Реакции на бензенскиот прстен на ароматични нитро-соединенија , Нитро групата го ориентира влегувањето на вториот супституент за време на електрофилната супституција по можност на l-позицијата, а при нуклеофилната супституција - на позициите o- и n. Пример за деривати на нитро соединенија на ароматични јаглеводороди е 2, 4, 6-тринитрофенол (пикринска киселина):
Пикринската киселина и нејзините соли се користат како експлозиви и во аналитичката хемија.

Апликација. Нитропарафините се користат во индустријата како растворувачи, адитиви на дизел горивата кои ја намалуваат нивната температура на палење, во производството на експлозиви, пластика и во технологијата на млазот; како посредници во синтезата на амини, алдехиди и кетони, масни киселини. Ароматичните нитро соединенија се широко користени за производство на бои, пластика, мириси и експлозиви.
Поединечни претставници.
Нитрометан Ц H 3 -NO 2. Течност, точка на вриење -101,2 °C. Се користи како растворувач, како ракетно гориво. Со хлорирање на нитрометан се добива трихлоронитрометан (хлоропикрин) CCl 3 NO 2, кој се користи за сузбивање на глодари во пекари и магацини, како и во различни синтези.
Нитроетан CH 3 CH 2 -NO 2. Течност, t врие = 113 °C * Kip = PZ ° C. Се користи за производство на хидроксиламин:
Нитроциклохексан C 6 CH 2 NO 2. Течност, точка на вриење =205 °C. Подготвено со нитрација на циклохексан. Се користи како посредник во синтезата на капролактам.
Нитробензен C 6 H 6 NO 2. Течноста има жолтеникава боја, со мирис на горчлив бадем, точка на вриење = 211 °C. Малку растворлив во вода и високо растворлив во многу органски растворувачи. Почетниот производ во производството на анилин е широко користен во анилинската боја, парфемите и фармацевтската индустрија.

тринитротолуен (
тол, ТНТ)
Цврста супстанција, t pl = 80°C. Широко се користи како експлозив.
Познати се и N- и O-нитро соединенијата (види и Органски нитрати).
Нитро групата има структура средна помеѓу две ограничувачки резонантни структури:
ФИЗИЧКИ СВОЈСТВА НА НЕКОИ АЛИФАТИЧКИ НИТРОСОЕДЕНИЈА

*На 25°C. **На 24°C. ***На 14°C.
IR спектрите на нитро соединенијата содржат две карактеристики. ленти кои одговараат на антисиметрични и симетрични вибрации на истегнување на N-O врската: за примарни нитро соединенија, соодветно. 1560-1548 и 1388-1376 cm -1, за секундарни 1553-1547 и 1364-1356 cm -1, за терциерни 1544-1534 и 1354-1344 cm -1; за нитроолефини RCH=CHNO 2 1529-1511 и 1351-1337 cm-1; за динитроалкани RCH(NO 2) 2 1585-1575 и 1400-1300 cm-1; за тринитроалкани RC(NO 2) 3 1610-1590 и 1305-1295 cm-1; за ароматични N. 1550-1520 и 1350-1330 cm-1 (супституентите што повлекуваат електрони го поместуваат опсегот на висока фреквенција во регионот 1570-1540, а супституентите кои донираат електрони во регионот од 1510-1490 cm -1); за N. 1610-1440 и 1285-1135 cm-1; нитронските етери имаат интензивна лента на 1630-1570 cm, врската C-N има слаба лента на 1100-800 cm -1.
Во УВ спектрите на алифатични нитро соединенија, l max 200-210 nm (интензивна лента) и 270-280 nm (слаба лента); за и естри на азотни киселини, соодветно. 220-230 и 310-320 nm; за што содржи хем-динитро 320-380 nm; за ароматични N. 250-300 nm (интензитетот на лентата нагло се намалува кога се нарушува копланарноста).
Во PMR спектарот на хем. поместувања на атомот a-H, во зависност од структурата, 4-6 ppm. Во спектарот NMR 14 N и 15 N хемикалија. смена 5 од - 50 до + 20 ppm
Во масените спектри на алифатични нитро соединенија (со исклучок на CH 3 NO 2), врвот на мол. отсутен или многу мал; основни процес на фрагментација - елиминација на NO 2 или два за да се формира фрагмент еквивалентен на . Ароматичните нитро-соединенија се карактеризираат со присуство на врвен мол. ; основни врвот во спектарот одговара на оној добиен при елиминацијата на NO 2.
Хемиски својства.Нитро групата е една од најпознатите силни групи за повлекување електрони и е во состојба ефикасно да ги делокализира негативните. наплаќаат. Во ароматични конн. како резултат на индукција и особено влијае на дистрибуцијата: јадрото добива делумна позитивност. полнење кое е локализирано првенствено во орто и пара позициите; Хамет константи за групата NO 2 s m 0,71, s n 0,778, s + n 0,740, s - n 1,25. Така, воведувањето на групата NO 2 нагло ја зголемува реакцијата. способност за орг. конн. во однос на нуклеофот. реагенси и ги комплицира реакциите со електроф. реагенси. Ова ја одредува широката употреба на нитро соединенија во орг. синтеза: групата NO 2 се внесува во саканата положба на орг. поврзување, изврши распаѓање. реакции поврзани, како по правило, со промена на јаглеродниот скелет, а потоа се трансформираат во друга функција или отстранети. Во ароматични Во некои случаи, често се користи пократка шема: нитрација-трансформација на групата NO 2.
Мн. трансформации на алифатични нитро соединенија се случуваат со предтретман. во азотни киселини или формирање на соодветните . Во растворите, рамнотежата обично е речиси целосно поместена кон C-формата; на 20 °C пропорцијата на аци формата за 1 е 10 -7, за нитропропан 3. 10 -3. Нитронски киселини бесплатно. формата е обично нестабилна; се добиваат со внимателно закиселување на N. За разлика од N. спроведуваат струја во растворите и даваат црвена боја со FeCl 3. Aci-N се посилни CH-киселини (pK a ~ 3-5) од соодветните нитро соединенија (pK a ~ 8-10); киселоста на нитро-соединенијата се зголемува со воведувањето на супституенти кои повлекуваат електрони во а-позиција во групата NO 2.
Формирањето на азотни киселини во ароматичните серии е поврзано со бензенскиот прстен во киноидна форма; на пример, форми со конц. H 2 SO 4 обоен производ сличен на сол од тип I, о-нитротолуен резултира со интрамол. префрлете се за да формирате светло сино дериват О:

Кога базите делуваат на примарен и секундарен азот, се формираат нитро-соединенија; амбиентните во реакциите со електрофилите се способни да произведат и O- и C-деривати. Така, кога H. се алкилира со алкил халиди, триалкилхлоросилани или R 3 O + BF - 4, се формираат производи на О-алкилација. Најнови м.б. исто така добиени со дејство на диазометан или N,O-бис-(триметилсилил)ацетамид на нитроалкани со pK a

Ациклични алкилните естри на азотни киселини се термички нестабилни и го разградуваат интрамолот. механизам:
r-ција може да се користи за да се добие. Силилните етери се постабилни. За формирање на производи за C-алкилација, видете подолу.
Нитро-соединенијата се карактеризираат со реакции со расцепување на врската C-N, долж врските N=O, O=N O, C=N -> O и реакции со зачувување на групата NO 2.
R-ts и s r a r s во околу m со врски и S-N. Примарен и секундарен N. при загревање. со рудар. киселините во присуство на алкохол или воден раствор формираат карбонилни соединенија. (види реакција на Нав). R-ција минува низ празнините. формирање на азотни киселини:

Како почетна врска. Може да се користат силилни нитронски етери. Дејството на силните киселини на алифатични нитро-соединенија може да доведе до хидроксамични киселини, на пример:

Методот се користи во индустријата за синтеза на CH 3 COOH и од нитроетан. Ароматичните нитро-соединенија се инертни на дејството на силните киселини.
Алифатичните нитро-соединенија кои содржат подвижни H во b-позиција до групата NO 2, под дејство на бази, лесно го елиминираат во форма на HNO 2 со формирањето. Термичкиот проток се одвива слично. разградување на нитроалканите на температури над 450°. Вицинални динитрооиди. кога Ca се обработува во хексамстанол, двете NO 2 групи се елиминираат Ag соли на незаситени нитро соединенија се способни да се димеризираат кога NO 2 групите се губат:

Nucleof. супституцијата на групата NO 2 не е типична за нитроалканите, меѓутоа, кога тиолатните јони делуваат на терциерните нитроалкани во апротичните растворувачи, групата NO 2 се заменува со . Реакцијата се одвива преку механизмот на анјонско-радикал. Во алифатичка и хетероциклични. конн. групата NO 2 во релативно лесно се заменува со нуклеофил, на пример:

Во ароматични конн. нуклеоф. замената на групата NO 2 зависи од нејзината позиција во однос на другите супституенти: групата NO 2, која се наоѓа во мета позиција во однос на супституентите што влечат електрони и во орто- и пара-позициите во однос на електрон- донирачки, има ниска реактивност. способност; реакција способноста на групата NO 2 лоцирана во орто- и пара-позициите да прифаќа супституенти кои повлекуваат електрони значително се зголемува. Во некои случаи, супституентот влегува во орто-позиција на напуштачката група NO 2 (на пример, кога ароматичното N. се загрева со алкохолен раствор на KCN, реакција на Рихтер):

R-ts и за врската N = O. Една од најважните реакции е намалувањето, што генерално води до збир на производи:

Азокси-(II), азо-(III) и што содржи хидразо. (IV) се формираат во алкална средина како резултат на нитрозо соединенија кои се појавуваат во средно време. и . Спроведувањето на процесот во кисела средина го елиминира формирањето на овие супстанции. Содржи нитрозо се намалуваат побрзо од соодветните нитро-соединенија и ги изолираат од реакцијата. смесата обично не успева. Алифатичните N. се намалуваат во азокси-или под дејство на Na, ароматични - под дејство на NaBH 4, третманот на вториот со LiAlH 4 доведува до. Електрохемија. ароматичниот N., под одредени услови, ви овозможува да добиете кој било од презентираните деривати (со исклучок на нитрозо соединенија); Користејќи го истиот метод, погодно е да се добие од мононитроалкани и амидоксими од хем-динитроалкани:
Оброци за врските O = N O и C = N O. Нитро-соединенијата влегуваат во 1,3-диполарни реакции, на пример:

Наиб. Оваа реакција лесно се јавува помеѓу нитронските естри и или. Во производи (моно- и бициклични диалкоксиамини) под влијание на нуклеофили. и електроф. Реагенсите за врска N - O лесно се разградуваат, што доведува до распаѓање. алифатичен и хетероциклични. врска:

За подготвителни цели, во реакцијата се користат стабилни силил нитронски естри.
R-ts и зачувување на групата NO 2. Алифатични Ns кои содржат атом a-H лесно се алкилираат и ацилираат, обично формирајќи О-деривати. Сепак, взаемно мод. дилитиум примарниот N. со алкил халиди, анхидриди или киселински халиди на карбоксилни киселини доведува до C-алкилација или C-ацилирани производи, на пример:
Постојат познати примери на интрамол. Ц-алкилација, на пример:
Примарните и секундарните нитро-соединенија реагираат со алифатични соединенија. и CH2O со формирање на p-амино деривати (Маних раствор); во реакцијата можете да користите претходно подготвени метилол деривати на нитро соединенија или амино соединенија:


Нитроолефините лесно влегуваат во реакции на додавање: со во малку кисела или малку алкална средина со последната. со ретрореакција на Анри тие формираат карбонилни соединенија. и нитроалкани; со нитро соединенија кои содржат a-H-атом, -поли-нитро соединенија; додајте други CH киселини, како што се и малински киселини, Grignard реагенси, како и нуклеофили како OR -, NR - 2, итн., на пример:

Нитроолефините можат да дејствуваат како диенофили или диполарофили во реакциите на циклоадиција, а 1,4-динитродиените можат да дејствуваат како компоненти на диен, на пример:

Потврда.Во индустријата, пониските нитроалкани се добиваат со мешавини во течна фаза (метод на Коновалов) или пареа-фаза (метод Хес) од , и , изолирани од природни или добиени со преработка (види Нитрација). Овој метод се користи и за добивање повисоки нитрати, на пример, нитроциклохексан, посредник во производството на капролактам.
Во лабораторија, за добивање на нитроалкани, се користи азотна киселина. со активиран метиленска група; пригоден метод за синтеза на примарни нитроалкани е нитрација на 1,3-индандион со последниот. алкален а-нитрокетон:

Алифатичните нитро-соединенија исто така добиваат интеракција. AgNO 2 со алкил халиди или NaNO 2 со естри на а-халокарбоксилни киселини (види Мејерова реакција). Алифатични N. се формираат кога и; - метод за производство на хем-ди- и хем-тринитро соединенија, на пример:

Нитроалкани m.b. добиени со загревање на ацилни нитрати до 200 °C.
Мн. методите за синтеза на нитро соединенија се базираат на олефини, HNO 3, нитрониум, NO 2 Cl, org. нитрати итн. Како по правило, ова произведува мешавина од вик-динитро соединенија, нитронитрати, нитронитрити, незаситени нитро-соединенија, како и производи од конјугираниот додаток на групата NO 2 и растворувачот или нивните производи, на пример:
Нитро-соединенијата се јаглеводородни деривати во кои еден или повеќе атоми на водород се заменети со нитро група -NO2. Во зависност од јаглеводородниот радикал на кој е прикачена нитро групата, нитро-соединенијата се делат на ароматични и алифатични. Алифатичните соединенија се разликуваат како примарни 1o, секундарни 2o и терциерни 3o, во зависност од тоа дали нитро група е прикачена на атомот на јаглерод 1o, 2o или 3o.
Нитро групата -NO2 не треба да се меша со нитритната група -ONO. Нитро групата ја има следната структура:
Присуството на вкупен позитивен полнеж на азотниот атом предизвикува тој да има силен -I ефект. Заедно со силниот -I ефект, нитро групата има силен -М ефект.
Пр. 1. Размислете за структурата на нитро групата и нејзиниот ефект врз насоката и брзината на реакцијата на електрофилна супституција во ароматичниот прстен.
Методи за добивање на нитро соединенија
Речиси сите методи за производство на нитро соединенија се веќе дискутирани во претходните поглавја. Ароматичните нитро-соединенија обично се добиваат со директно нитрирање на арените и ароматичните хетероциклични соединенија. Нитроциклохексан се произведува индустриски со нитрирање на циклохексан:

На ист начин се добива и нитрометан, но во лабораториски услови се добива од хлорооцетна киселина како резултат на реакции (2-5). Клучната фаза од нив е реакцијата (3), која се јавува преку механизмот SN2.
Хлорооцетна киселина Натриум хлороацетат
Нитрооцетна киселина
Нитрометан
Реакции на нитро соединенија
Тавтомеризам на алифатични нитро соединенија
Поради силните својства на нитро-групата за повлекување електрони, атомите на водород имаат зголемена подвижност и затоа примарните и секундарните нитро-соединенија се CH-киселини. Така, нитрометанот е прилично силна киселина (pKa 10,2) и во алкална средина лесно се претвора во анјон стабилизиран со резонанца:
Нитрометан pKa 10.2 Резонанцно стабилизиран анјон
Вежба 2. Напиши ги реакциите на (а) нитрометан и (б) нитроциклохексан со воден раствор на NaOH.
Кондензација на алифатични нитро соединенија со алдехиди и кетони
Нитро група може да се внесе во алифатични соединенија со реакција на алдол помеѓу нитроалкански анјон и алдехид или кетон. Во нитроалканите, атомите на водород се уште поподвижни отколку кај алдехидите и кетоните, и затоа тие можат да влезат во реакции на додавање и кондензација со алдехиди и кетони, обезбедувајќи ги нивните водородни атоми. Кај алифатичните алдехиди обично се случуваат реакции на додавање, а кај ароматичните алдехиди се случуваат само реакции на кондензација.
Така, нитрометан се додава во циклохексанон,

1-Нитрометилциклохексанол
но се кондензира со бензалдехид,
Реакцијата на додавање со формалдехид ги вклучува сите три водородни атоми на нитрометан за да се формира 2-хидроксиметил-2-нитро-1,3-динитропропан или триметилолнитрометан.
Со кондензација на нитрометан со хексаметилентетрамин добивме 7-нитро-1,3,5-триазаадамантан:

Пр. 3. Напиши ги реакциите на формалдехид (а) со нитрометан и (б) со нитроциклохексан во алкална средина.
Намалување на нитро соединенија
Нитро групата се сведува на амино група со различни редукциони агенси (11.3.3). Анилинот се произведува со хидрогенизација на нитробензен под притисок во присуство на никел Рани во индустриски услови.

Во лабораториски услови, наместо водород, може да се користи хидразин, кој се распаѓа во присуство на никел од Рани и ослободува водород.

7-нитро-1,3,5-триазаадамантан 7-амино-1,3,5-триазаадамантан
Нитро-соединенијата се редуцираат со метали во кисела средина проследена со алкализација

Во зависност од рН на медиумот и средството за намалување што се користи, може да се добијат различни производи. Во неутрална и алкална средина, активноста на конвенционалните редукциони агенси кон нитро-соединенијата е помала отколку во кисела средина. Типичен пример е редукцијата на нитробензенот со цинк. Во вишокот на хлороводородна киселина, цинкот го редуцира нитробензенот во анилин, додека во пуфер раствор на амониум хлорид се сведува на фенилхидроксиламин:

Во кисела средина, арилхидроксиламините се подложени на преуредување:

p-Aminophenol се користи како развивач во фотографијата. Фенилхидроксиламин може дополнително да се оксидира до нитрозобензен:

Нитрозобензен
Со редукција на нитробензенот со калај(II) хлорид се добива азобензен, а со цинк во алкална средина се добива хидразобензен.


Со третирање на нитробензенот со раствор на алкали во метанол, се добива азоксибензен, а метанолот се оксидира до мравја киселина.

Познати се методи за нецелосно намалување на нитроалканите. На ова се заснова еден од индустриските методи за производство на најлон. Со нитрација на циклохексан, се добива нитроциклохексан, кој се претвора со редукција во циклохексанон оксим, а потоа, користејќи го Бекмановиот преуредување, во капролактам и полиамид - почетен материјал за подготовка на влакна - најлон:

Намалувањето на нитро групата на производи за додавање на алдол (7) е пригоден метод за подготовка на α-амино алкохоли.

1-Нитрометилциклохексанол 1-Аминометилциклохексанол
Употребата на водород сулфид како средство за намалување овозможува да се намали една од нитро групите во динитроарените:

m-Динитробензен m-Нитроанилин

2,4-Динитроанилин 4-Нитро-1,2-диаминобензен
Вежба 4. Напишете ги реакциите на редукција на (а) м-динитробензен со калај во хлороводородна киселина, (б) м-динитробензен со водород сулфид, (в) р-нитротолуен со цинк во пуфер раствор на амониум хлорид.
Вежба 5. Пополнете ги реакциите:


Намалување на нитро соединенија . Сите нитро соединенија се сведуваат на примарни амини. Ако добиениот амин е испарлив, може да се открие со промена на бојата на индикаторската хартија:
Реакција со азотна киселина. Карактеристична квалитативна реакција на примарните и секундарните нитро-соединенија е реакцијата со азотна киселина.
За терциерни алифатични нитро соединенијаНема специфични реакции за откривање.
Откривање на ароматични нитро соединенија.Ароматичните нитро-соединенија обично имаат бледо жолта боја. Во присуство на други супституенти, интензитетот и длабочината на бојата често се зголемуваат. За да се откријат ароматични нитро-соединенија, тие се сведуваат на примарни амини, вторите се диазотизираат и се комбинираат со β-нафтол:
| ArNO 2 → ArNH 2 → ArN 2 Cl → ArN=N |
| О |
Оваа реакција, сепак, не е специфична, бидејќи амини се формираат за време на редукцијата не само на нитро-соединенијата, туку и на нитрозо, азоокси и хидразо-соединенија. За да се донесе конечен заклучок за присуството на нитро група во соединението, неопходно е да се изврши квантитативно определување.
Квалитативни реакции на N-нитрозо соединенија
Реакција со HI. C-Nitroso соединенијата може да се разликуваат од N-nitroso соединенијата по нивната врска со закиселениот раствор на калиум јодид: C-Nitroso соединенијата оксидираат хидројодна киселина, N-nitroso соединенијата не реагираат со хидројодната киселина.
Реакција со примарни ароматични амини. C-Nitroso соединенијата се кондензираат со примарни ароматични амини, формирајќи обоени азо соединенија:
| ArN = O + H 2 N – Ar → Ar – N = N – Ar + H 2 O |
Хидролиза на N-нитрозо соединенија. Чистите ароматични и масни ароматични N-нитрозо соединенија (нитрозамини) лесно се хидролизираат со алкохолни раствори на HCl, формирајќи секундарен амин и азотна киселина. Ако хидролизата се изведува во присуство на а-нафтиламин, тогаш вториот се дијазотизира од добиената азотна киселина, а диазо-соединението влегува во реакција на азо спојување со вишок а-нафтиламин. Се формира азо боја:
Реакционата смеса станува розова; Постепено бојата станува виолетова.
Квалитативни реакции на нитрили
При анализата на нитрилите RC≡N, ArC≡N се користи нивната способност да се хидролизираат и да се редуцираат. За да се открие групата C≡N, се врши хидролиза:
| RC ≡ N + H 2 O → R – CONH 2 |
Нитрилите најпогодно се карактеризираат со киселини кои се добиваат со нивната хидролиза. Киселината се изолира од хидролизатот со дестилација или екстракција со пареа и се претвора во еден од дериватите - естер или амид.
Квалитативни реакции на тиоли (тиоалкохоли, тиоетери)
Најважните својства на тиолите кои се користат во анализата се способноста да се замени атом на водород во групата -SH и способноста да се оксидираат. Супстанциите што ја содржат групата -SH имаат силен непријатен мирис, кој слабее со зголемување на бројот на јаглеродни атоми во молекулата.
Реакција со HNO 2.Супстанциите што ја содржат групата SH даваат реакција на боја кога се изложени на азотна киселина:
Покрај тиолите, оваа реакција ја даваат и тиоакиселините RCOSH. Ако R е примарен или секундарен алкил, се појавува црвена боја ако R е терциерен алкил или арил, бојата е прво зелена, а потоа црвена.
Формирање Меркаптид. Карактеристична квалитативна реакција на тиолите е и формирањето на таложење на меркаптиди на тешки метали (Pb, Cu, Hg). На пример,
| 2RSH + PbO → (RS) 2Pb + H2O |
Оловните и бакарните меркаптиди се обоени.