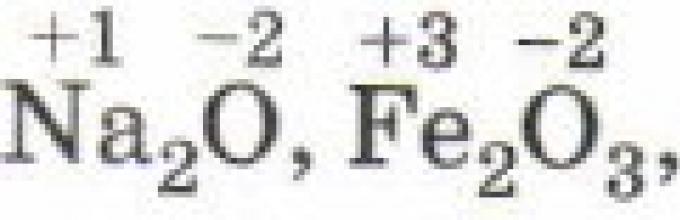За да се карактеризира состојбата на елементите во соединенијата, беше воведен концептот на состојба на оксидација.
ДЕФИНИЦИЈА
Бројот на електрони поместени од атом на даден елемент или до атом на даден елемент во соединение се нарекува оксидациона состојба.
Позитивната оксидациска состојба го означува бројот на електрони кои се поместени од даден атом, а негативната оксидациска состојба го означува бројот на електрони кои се поместени кон даден атом.
Од оваа дефиниција произлегува дека кај соединенијата со неполарни врски оксидационата состојба на елементите е нула. Примери за такви соединенија се молекули кои се состојат од идентични атоми (N 2, H 2, Cl 2).
Состојбата на оксидација на металите во елементарна состојба е нула, бидејќи распределбата на густината на електроните во нив е рамномерна.
Во едноставни јонски соединенија, оксидационата состојба на нивните составни елементи е еднаква на Електрично полнење, бидејќи при формирањето на овие соединенија има речиси целосен пренос на електрони од еден атом во друг: Na +1 I -1, Mg +2 Cl -1 2, Al +3 F -1 3, Zr +4 Br - 1 4.
При одредување на состојбата на оксидација на елементите во соединенијата со поларни ковалентни врски, се споредуваат нивните вредности на електронегативност. Бидејќи за време на формирањето на хемиска врска, електроните се поместуваат во атомите на повеќе електронегативни елементи, вторите имаат негативна состојба на оксидација во соединенијата.
Најниска состојба на оксидација
За елементите кои покажуваат различни состојби на оксидација во нивните соединенија, постојат концепти на највисоки (максимално позитивни) и најниски (минимално негативни) состојби на оксидација. Најниска состојба на оксидација хемиски елементобично нумерички еднаква на разликата помеѓу бројот на групата во Периодниот систем на Д.И. Менделеев, во кој се наоѓа хемискиот елемент, и бројот 8. На пример, азотот е во групата VA, што значи дека неговата најниска оксидациска состојба е (-3): V-VIII = - 3; сулфурот е во групата VIA, што значи дека неговата најниска оксидациска состојба е (-2): VI-VIII = -2, итн.
Примери за решавање проблеми
ПРИМЕР 1
ДЕФИНИЦИЈА
Состојба на оксидацијае квантитативна проценка на состојбата на атом на хемиски елемент во соединение, врз основа на неговата електронегативност.
Таа ги прифаќа и позитивните и негативни вредности. За да ја означите состојбата на оксидација на елементот во соединението, треба да поставите арапски број со соодветниот знак („+“ или „-“) над неговиот симбол.
Треба да се запомни дека состојбата на оксидација е количина што нема физичко значење, бидејќи не го одразува вистинското полнење на атомот. Сепак, овој концепт е многу широко користен во хемијата.
Табела на оксидациски состојби на хемиски елементи
Максималната позитивна и минималната негативна оксидациска состојба може да се одредат со помош на Периодниот систем D.I. Менделеев. Тие се еднакви на бројот на групата во која се наоѓа елементот и разликата помеѓу вредноста на „највисоката“ состојба на оксидација и бројот 8, соодветно.
Ако земеме предвид хемиски соединенијапоконкретно, кај супстанциите со неполарни врски оксидационата состојба на елементите е нула (N 2, H 2, Cl 2).
Состојбата на оксидација на металите во елементарна состојба е нула, бидејќи распределбата на густината на електроните во нив е рамномерна.
Во едноставни јонски соединенија, состојбата на оксидација на елементите вклучени во нив е еднаква на електричниот полнеж, бидејќи за време на формирањето на овие соединенија постои речиси целосна транзиција на електроните од еден атом во друг: Na +1 I -1, Mg +2 Cl -1 2, Al +3 F - 1 3, Zr +4 Br -1 4.
При одредување на состојбата на оксидација на елементите во соединенијата со поларни ковалентни врски, се споредуваат нивните вредности на електронегативност. Бидејќи за време на формирањето на хемиска врска, електроните се поместуваат во атомите на повеќе електронегативни елементи, вторите имаат негативна состојба на оксидација во соединенијата.
Постојат елементи кои се карактеризираат со само една вредност на оксидациона состојба (флуор, метали од групите IA и IIA итн.). Флуор, се карактеризира со највисока вредностелектронегативност, во соединенијата секогаш има постојана негативна оксидациска состојба (-1).
Алкалните и земноалкалните елементи, кои се карактеризираат со релативно ниска вредност на електронегативноста, секогаш имаат позитивна оксидациска состојба еднаква на (+1) и (+2), соодветно.
Сепак, постојат и хемиски елементи кои се карактеризираат со неколку оксидациони состојби (сулфур - (-2), 0, (+2), (+4), (+6) итн.).
За полесно да запомните колку и какви оксидациски состојби се карактеристични за одреден хемиски елемент, користете табели со состојби на оксидација на хемиските елементи, кои изгледаат вака:
|
Сериски број |
Руски / Англиски Име |
Хемиски симбол |
Состојба на оксидација |
|
Водород |
|||
|
Хелиум |
|||
|
Литиум |
|||
|
Берилиум |
|||
|
(-1), 0, (+1), (+2), (+3) |
|||
|
Јаглерод |
(-4), (-3), (-2), (-1), 0, (+2), (+4) |
||
|
Азот / Азот |
(-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
||
|
Кислород |
(-2), (-1), 0, (+1), (+2) |
||
|
Флуор |
|||
|
Натриум/Натриум |
|||
|
Магнезиум / Магнезиум |
|||
|
Алуминиум |
|||
|
Силикон |
(-4), 0, (+2), (+4) |
||
|
Фосфор / Фосфор |
(-3), 0, (+3), (+5) |
||
|
Сулфур/Сулфур |
(-2), 0, (+4), (+6) |
||
|
Хлор |
(-1), 0, (+1), (+3), (+5), (+7), ретко (+2) и (+4) |
||
|
Аргон / Аргон |
|||
|
Калиум / Калиум |
|||
|
Калциум |
|||
|
Скандиум / Скандиум |
|||
|
Титаниум |
(+2), (+3), (+4) |
||
|
Ванадиум |
(+2), (+3), (+4), (+5) |
||
|
Хром / Хром |
(+2), (+3), (+6) |
||
|
Манган / Манган |
(+2), (+3), (+4), (+6), (+7) |
||
|
Железо |
(+2), (+3), ретки (+4) и (+6) |
||
|
Кобалт |
(+2), (+3), ретко (+4) |
||
|
Никел |
(+2), ретки (+1), (+3) и (+4) |
||
|
Бакар |
+1, +2, ретко (+3) |
||
|
Галиум |
(+3), ретко (+2) |
||
|
Германиум / Германиум |
(-4), (+2), (+4) |
||
|
Арсен/Арсен |
(-3), (+3), (+5), ретко (+2) |
||
|
Селен |
(-2), (+4), (+6), ретко (+2) |
||
|
Бром |
(-1), (+1), (+5), ретко (+3), (+4) |
||
|
Криптон / Криптон |
|||
|
Рубидиум / Рубидиум |
|||
|
Стронциум / Стронциум |
|||
|
Итриум / Итриум |
|||
|
Циркониум / Циркониум |
(+4), ретки (+2) и (+3) |
||
|
Ниобиум / Ниобиум |
(+3), (+5), ретки (+2) и (+4) |
||
|
Молибден |
(+3), (+6), ретки (+2), (+3) и (+5) |
||
|
Технициум / Technetium |
|||
|
Рутениум / Рутениум |
(+3), (+4), (+8), ретки (+2), (+6) и (+7) |
||
|
Родиум |
(+4), ретки (+2), (+3) и (+6) |
||
|
Паладиум |
(+2), (+4), ретко (+6) |
||
|
Сребрена |
(+1), ретки (+2) и (+3) |
||
|
Кадмиум |
(+2), ретко (+1) |
||
|
Индиум |
(+3), ретки (+1) и (+2) |
||
|
Калај/Калај |
(+2), (+4) |
||
|
Антимон / Антимон |
(-3), (+3), (+5), ретко (+4) |
||
|
Телуриум / Телуриум |
(-2), (+4), (+6), ретко (+2) |
||
|
(-1), (+1), (+5), (+7), ретко (+3), (+4) |
|||
|
Ксенон / Ксенон |
|||
|
Цезиум |
|||
|
Бариум / бариум |
|||
|
Лантан / Лантан |
|||
|
Цериум |
(+3), (+4) |
||
|
Прасеодимиум / Praseodymium |
|||
|
Неодимиум / Неодимиум |
(+3), (+4) |
||
|
Прометиум / Прометиум |
|||
|
Самариум / Самариум |
(+3), ретко (+2) |
||
|
Европиум |
(+3), ретко (+2) |
||
|
Гадолиниум / Gadolinium |
|||
|
Тербиум / Тербиум |
(+3), (+4) |
||
|
Диспрозиум / Диспрозиум |
|||
|
Холмиум |
|||
|
Ербиум |
|||
|
Тулиум |
(+3), ретко (+2) |
||
|
Итербиум / Итербиум |
(+3), ретко (+2) |
||
|
Лутетиум / Лутетиум |
|||
|
Хафниум / Hafnium |
|||
|
Тантал / Тантал |
(+5), ретко (+3), (+4) |
||
|
Волфрам/волфрам |
(+6), ретки (+2), (+3), (+4) и (+5) |
||
|
Рениум / Рениум |
(+2), (+4), (+6), (+7), ретко (-1), (+1), (+3), (+5) |
||
|
Осмиум / Осмиум |
(+3), (+4), (+6), (+8), ретко (+2) |
||
|
Иридиум / Иридиум |
(+3), (+4), (+6), ретко (+1) и (+2) |
||
|
Платина |
(+2), (+4), (+6), ретки (+1) и (+3) |
||
|
Злато |
(+1), (+3), ретко (+2) |
||
|
Меркур |
(+1), (+2) |
||
|
Талиум / Талиум |
(+1), (+3), ретко (+2) |
||
|
Олово/Олово |
(+2), (+4) |
||
|
Бизмут |
(+3), ретки (+3), (+2), (+4) и (+5) |
||
|
Полониум |
(+2), (+4), ретко (-2) и (+6) |
||
|
Астатин |
|||
|
Радон / Радон |
|||
|
Франциум |
|||
|
Радиум |
|||
|
Актиниум |
|||
|
ториум |
|||
|
Проактиниум / Протактиниум |
|||
|
Ураниум / Ураниум |
(+3), (+4), (+6), ретки (+2) и (+5) |
Примери за решавање проблеми
ПРИМЕР 1
- Оксидационата состојба на фосфорот во фосфинот е (-3), а во ортофосфорната киселина - (+5). Промена на оксидационата состојба на фосфорот: +3 → +5, т.е. опција за прв одговор.
- Состојбата на оксидација на хемискиот елемент во едноставна супстанција е нула. Степенот на оксидација на фосфорот во оксидот од составот P 2 O 5 е (+5). Промена на оксидационата состојба на фосфорот: 0 → +5, т.е. трета опција за одговор.
- Степенот на оксидација на фосфорот во киселинскиот состав HPO 3 е (+5), а H 3PO 2 е (+1). Промена на оксидационата состојба на фосфорот: +5 → +1, т.е. петта опција за одговор.
ПРИМЕР 2
| Вежбајте | Состојбата на оксидација (-3) на јаглеродот во соединението е: а) CH3Cl; б) C2H2; в) HCOH; г) C 2 H 6. |
| Решение | За да го дадеме точниот одговор на поставеното прашање, наизменично ќе го одредуваме степенот на оксидација на јаглеродот во секое од предложените соединенија. а) оксидационата состојба на водородот е (+1), а на хлорот е (-1). Да ја земеме оксидационата состојба на јаглеродот како „x“: x + 3×1 + (-1) =0; Одговорот е неточен. б) оксидационата состојба на водородот е (+1). Да ја земеме оксидационата состојба на јаглеродот како „y“: 2×y + 2×1 = 0; Одговорот е неточен. в) оксидационата состојба на водородот е (+1), а на кислородот е (-2). Да ја земеме оксидационата состојба на јаглеродот како „z“: 1 + z + (-2) +1 = 0: Одговорот е неточен. г) оксидационата состојба на водородот е (+1). Да ја земеме оксидационата состојба на јаглеродот како „а“: 2×a + 6×1 = 0; Точен одговор. |
| Одговори | Опција (г) |
Кога ги проучувавте јонските и ковалентни поларни хемиски врски, се запознавте со комплексни супстанции, кој се состои од два хемиски елементи. Таквите супстанции се нарекуваат бинарни (од латинскиот би - два) или двоелементи.
Да се потсетиме на типичните бинарни соединенија што ги наведовме како пример за да ги разгледаме механизмите на формирање на јонски и ковалентни поларни хемиски врски: NaCl - натриум хлорид и HCl - водород хлорид.
Во првиот случај, врската е јонска: атомот на натриум го префрлил својот надворешен електрон во атомот на хлор и се претворил во јон со полнење +1, а атомот на хлор прифатил електрон и се претворил во јон со полнење од - 1. Шематски, процесот на претворање на атомите во јони може да се прикаже на следниов начин:
Во молекулата на водород хлорид HC1, се формира хемиска врска поради спарување на неспарени надворешни електрони и формирање на заеднички електронски пар на атоми на водород и хлор:
Поправилно е да се замисли формирањето на ковалентна врска во молекула на водород хлорид како преклопување на едноелектронскиот s-облак на атомот на водород со едноелектронскиот p-облак на атомот на хлор:
На хемиска интеракцијазаедничкиот електронски пар се поместува кон поелектронегативниот атом на хлор: т.е. електронот нема целосно да се префрли од атомот на водород во атомот на хлор, туку делумно, со што ќе се одреди делумното полнење на атомите 5 (види § 12): . Ако замислиме дека во молекулата на водород хлорид HCl, како и во натриум хлоридот NaCl, електронот целосно се префрлил од атомот на водород во атомот на хлор, тогаш тие би добиле полнежи +1 и -1: . Ваквите конвенционални полнежи се нарекуваат состојби на оксидација. При дефинирањето на овој концепт, конвенционално се претпоставува дека во ковалентни поларни соединенија сврзувачките електрони се целосно префрлени во поелектронегативен атом и затоа соединенијата се состојат само од позитивно и негативно наелектризирани јони.
Бројот на оксидација може да има негативни, позитивни или нула вредности, кои обично се поставуваат над симболот на елементот на врвот, на пример:
Оние атоми кои прифатиле електрони од други атоми или на кои се поместени заеднички електронски парови, т.е. атоми на повеќе електронегативни елементи, имаат негативна оксидациска состојба. Флуорот секогаш има состојба на оксидација од -1 во сите соединенија. Кислородот, вториот елемент по флуорот во однос на електронегативноста, речиси секогаш има оксидациона состојба од -2, освен соединенијата со флуор, на пример:
![]()
Позитивна оксидациска состојба се доделува на оние атоми кои ги донираат своите електрони на други атоми или од кои се извлекуваат заеднички електронски парови, т.е., атоми на помалку електронегативни елементи. Металите во соединенијата секогаш имаат позитивна оксидациска состојба. За метали од главните подгрупи: група I (група IA) кај сите соединенија оксидационата состојба е +1, групата II (група IIA) е +2, група III (група IIIA) е +3, на пример:
![]()
![]()
но во соединенијата со метали, водородот има состојба на оксидација од -1:
![]()
Атомите во молекулите имаат нулта оксидациона состојба едноставни материии атомите во слободна состојба, на пример:
Блиску до концептот на „состојба на оксидација“ е концептот на „валентност“, со кој се запознавте кога размислувате за ковалентен хемиска врска. Сепак, ова не е иста работа.
Концептот на „валентност“ е применлив за супстанции кои имаат молекуларна структура. Огромно мнозинство органска материја, со кој ќе се запознаете во 10-то одделение, ја има токму оваа структура. Во основниот училишен курс, учите неорганска хемија, чиј предмет се супстанции со молекуларна и немолекуларна, на пример, јонска структура. Затоа, се претпочита да се користи концептот на „состојба на оксидација“.
Која е разликата помеѓу валентната и оксидациската состојба?
Често валентниот и оксидациониот број се совпаѓаат нумерички, но валентноста нема знак за полнење, туку оксидациониот број има. На пример, едновалентен водород ги има следните оксидациски состојби разни материиО:
![]()
Се чини дека едновалентен флуор, најелектронегативниот елемент, треба да има целосна совпаѓање на оксидациската состојба и вредностите на валентноста. На крајот на краиштата, неговиот атом е способен да формира само еден сингл ковалентна врска, бидејќи му недостига еден електрон за да го комплетира надворешниот електронски слој. Сепак, и тука има разлика:
Валентноста и состојбата на оксидација се разликуваат уште повеќе ако не се совпаѓаат нумерички. На пример:
Во соединенијата, вкупната состојба на оксидација е секогаш нула. Знаејќи го ова и состојбата на оксидација на еден од елементите, можете да ја најдете состојбата на оксидација на друг елемент користејќи ја формулата, на пример, бинарно соединение. Значи, да ја најдеме оксидационата состојба на хлорот во соединението C1 2 O 7.
Да ја означиме оксидационата состојба на кислородот: . Според тоа, седум атоми на кислород ќе имаат вкупен негативен полнеж од (-2) × 7 = -14. Тогаш вкупниот полнеж на два атоми на хлор ќе биде еднаков на +14, а на еден атом на хлор: (+14) : 2 = +7. Затоа, оксидационата состојба на хлорот е.
Слично на тоа, знаејќи ги состојбите на оксидација на елементите, можете да креирате формула за соединение, на пример, алуминиум карбид (соединение од алуминиум и јаглерод).
Лесно е да се види дека сте работеле слично со концептот „валентност“ кога сте ја извлекле формулата на ковалентно соединение или ја одредувате валентноста на елементот од формулата на неговото соединение.
Имињата на бинарните соединенија се формираат од два збора - имињата на хемиските елементи вклучени во нивниот состав. Првиот збор го означува електронегативниот дел од соединението - неметал; неговото латинско име со наставката -id секогаш се појавува во номинативен случај. Вториот збор го означува електропозитивниот дел - метал или помалку електронегативен елемент; неговото име секогаш се појавува во генитив случај:
На пример: NaCl - натриум хлорид, MgS - магнезиум сулфид, KH - калиум хидрид, CaO - калциум оксид. Ако електропозитивен елемент покажува различни состојби на оксидација, тогаш тоа се рефлектира во името, означувајќи го степенот на оксидација со римски број, кој се става на крајот од името, на пример: - железо (II) оксид (читај „железен оксид два“), - железен (III) оксид (читај „железен оксид три“).
Ако соединението се состои од два неметални елементи, тогаш на името на поелектронегативниот од нив се додава наставката -id, а втората компонента се става после ова во генитив. На пример: - кислород флуорид (II), - сулфур оксид (IV) и - сулфур оксид (VI).
Во некои случаи, бројот на атоми на елементите се означува користејќи ги имињата на бројките на грчки - моно, ди, три, тетра, пента, хекса, итн. На пример: - јаглерод моноксид или јаглерод оксид (II), - јаглерод диоксид, или оксид јаглерод (IV), - олово тетрахлорид или олово (IV) хлорид.
На хемичарите различни земјисе разбираа, беше неопходно да се создаде унифицирана терминологија и номенклатура на супстанции. Принципи хемиска номенклатурапрвпат беа развиени од француските хемичари A. Lavoisier, A. Fourcroix, L. Guiton de Mervo и C. Berthollet во 1785 година. Во моментов, Меѓународната унија за чиста и применета хемија (IUPAC) ги координира активностите на научниците од различни земји и дава препораки за номенклатурата на супстанциите и терминологијата што се користи во хемијата.
Клучни зборови и фрази
- Бинарни, или соединенија со два елементи.
- Состојба на оксидација.
- Хемиска номенклатура.
- Определување на оксидациони состојби на елементите со помош на формулата.
- Изработка на формули на бинарни соединенија според оксидационите состојби на елементите.
Работа со компјутер
- Погледнете ја електронската апликација. Проучете го материјалот за лекцијата и завршете ги зададените задачи.
- Најдете адреси на е-пошта на Интернет кои можат да послужат како дополнителни извори кои ја откриваат содржината на клучните зборови и фрази во параграфот. Понудете му ја вашата помош на наставникот во подготовката на нова лекција - направете извештај за клучните зборови и фрази од следниот пасус.
Прашања и задачи
- Запишете ги формулите на азотни оксиди (II), (V), (I), (III), (IV).
- Наведете ги имињата на бинарните соединенија чии формули се: а) C1 2 0 7, C1 2 O, C1O 2; б) FeCl2, FeCl3; в) MnS, MnO2, MnF4, MnO, MnCl4; r) Cu2O, Mg2Si, SiCl4, Na3N, FeS.
- Најдете ги во референтните книги и речници сите можни имиња на супстанции со формули: а) CO 2 и CO; б) SO 2 и SO 3. Објаснете ја нивната етимологија. Наведете две имиња на овие супстанции според меѓународна номенклатураво согласност со правилата утврдени во ставот.
- Кое друго име може да се даде на амонијакот H 3 N?
- Најдете го волуменот што го имаат на n. u. 17 g водород сулфид.
- Колку молекули има во овој волумен?
- Да се пресмета масата на 33,6 m3 метан CH 2 во воздухот. u. и определи го бројот на неговите молекули содржани во овој волумен.
- Одреди ја оксидационата состојба на јаглеродот и запиши структурни формулиследните супстанции, знаејќи дека јаглеродот е во органски соединенијасекогаш четиривалентен: метан CH 4, јаглерод тетрахлорид CC1 4, етан C 2 H 4, ацетилен C 2 H 2.
Состојбата на оксидација е условното полнење на атомите на хемиски елемент во соединението, пресметано од претпоставката дека сите врски имаат јонски тип. Состојбите на оксидација можат да имаат позитивна, негативна или нулта вредност, затоа алгебарскиот збир на состојбите на оксидација на елементите во молекулата, земајќи го предвид бројот на нивните атоми, е еднаков на 0, а во јон - полнењето на јонот .
Оваа листа на состојби на оксидација ги прикажува сите познати состојби на оксидација на хемиските елементи од периодниот систем. Списокот се базира на табелата на Гринвуд со сите додатоци. Линиите кои се означени во боја содржат инертни гасови чија оксидациска состојба е нула.
| 1 | −1 | Х | +1 | ||||||||||
| 2 | Тој | ||||||||||||
| 3 | Ли | +1 | |||||||||||
| 4 | -3 | Биди | +1 | +2 | |||||||||
| 5 | −1 | Б | +1 | +2 | +3 | ||||||||
| 6 | −4 | −3 | −2 | −1 | В | +1 | +2 | +3 | +4 | ||||
| 7 | −3 | −2 | −1 | Н | +1 | +2 | +3 | +4 | +5 | ||||
| 8 | −2 | −1 | О | +1 | +2 | ||||||||
| 9 | −1 | Ф | +1 | ||||||||||
| 10 | Не | ||||||||||||
| 11 | −1 | Na | +1 | ||||||||||
| 12 | Мг | +1 | +2 | ||||||||||
| 13 | Ал | +3 | |||||||||||
| 14 | −4 | −3 | −2 | −1 | Си | +1 | +2 | +3 | +4 | ||||
| 15 | −3 | −2 | −1 | П | +1 | +2 | +3 | +4 | +5 | ||||
| 16 | −2 | −1 | С | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 17 | −1 | Cl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| 18 | Ар | ||||||||||||
| 19 | К | +1 | |||||||||||
| 20 | Ca | +2 | |||||||||||
| 21 | Sc | +1 | +2 | +3 | |||||||||
| 22 | −1 | Ти | +2 | +3 | +4 | ||||||||
| 23 | −1 | В | +1 | +2 | +3 | +4 | +5 | ||||||
| 24 | −2 | −1 | Кр | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 25 | −3 | −2 | −1 | Мн | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||
| 26 | −2 | −1 | Fe | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 27 | −1 | Ко | +1 | +2 | +3 | +4 | +5 | ||||||
| 28 | −1 | Ни | +1 | +2 | +3 | +4 | |||||||
| 29 | Cu | +1 | +2 | +3 | +4 | ||||||||
| 30 | Zn | +2 | |||||||||||
| 31 | Га | +1 | +2 | +3 | |||||||||
| 32 | −4 | Ге | +1 | +2 | +3 | +4 | |||||||
| 33 | −3 | Како | +2 | +3 | +5 | ||||||||
| 34 | −2 | Се | +2 | +4 | +6 | ||||||||
| 35 | −1 | Бр | +1 | +3 | +4 | +5 | +7 | ||||||
| 36 | Кр | +2 | |||||||||||
| 37 | Rb | +1 | |||||||||||
| 38 | Ср | +2 | |||||||||||
| 39 | Y | +1 | +2 | +3 | |||||||||
| 40 | Зр | +1 | +2 | +3 | +4 | ||||||||
| 41 | −1 | Nb | +2 | +3 | +4 | +5 | |||||||
| 42 | −2 | −1 | Мо | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 43 | −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| 44 | −2 | Ру | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |||
| 45 | −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| 46 | Pd | +2 | +4 | ||||||||||
| 47 | Аг | +1 | +2 | +3 | |||||||||
| 48 | Cd | +2 | |||||||||||
| 49 | Во | +1 | +2 | +3 | |||||||||
| 50 | −4 | Сн | +2 | +4 | |||||||||
| 51 | −3 | Сб | +3 | +5 | |||||||||
| 52 | −2 | Те | +2 | +4 | +5 | +6 | |||||||
| 53 | −1 | Јас | +1 | +3 | +5 | +7 | |||||||
| 54 | Xe | +2 | +4 | +6 | +8 | ||||||||
| 55 | Cs | +1 | |||||||||||
| 56 | Ба | +2 | |||||||||||
| 57 | Ла | +2 | +3 | ||||||||||
| 58 | Це | +2 | +3 | +4 | |||||||||
| 59 | Пр | +2 | +3 | +4 | |||||||||
| 60 | Нд | +2 | +3 | ||||||||||
| 61 | ПМ | +3 | |||||||||||
| 62 | См | +2 | +3 | ||||||||||
| 63 | ЕУ | +2 | +3 | ||||||||||
| 64 | Гд | +1 | +2 | +3 | |||||||||
| 65 | Тб | +1 | +3 | +4 | |||||||||
| 66 | Дај | +2 | +3 | ||||||||||
| 67 | Хо | +3 | |||||||||||
| 68 | Ер | +3 | |||||||||||
| 69 | Тм | +2 | +3 | ||||||||||
| 70 | Yb | +2 | +3 | ||||||||||
| 71 | Лу | +3 | |||||||||||
| 72 | Хф | +2 | +3 | +4 | |||||||||
| 73 | −1 | Та | +2 | +3 | +4 | +5 | |||||||
| 74 | −2 | −1 | В | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 75 | −3 | −1 | Одг | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| 76 | −2 | −1 | Ос | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||
| 77 | −3 | −1 | Ир | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 78 | Pt | +2 | +4 | +5 | +6 | ||||||||
| 79 | −1 | Ов | +1 | +2 | +3 | +5 | |||||||
| 80 | Хг | +1 | +2 | +4 | |||||||||
| 81 | Тл | +1 | +3 | ||||||||||
| 82 | −4 | Pb | +2 | +4 | |||||||||
| 83 | −3 | Би | +3 | +5 | |||||||||
| 84 | −2 | По | +2 | +4 | +6 | ||||||||
| 85 | −1 | На | +1 | +3 | +5 | ||||||||
| 86 | Rn | +2 | +4 | +6 | |||||||||
| 87 | о | +1 | |||||||||||
| 88 | Ра | +2 | |||||||||||
| 89 | Ак | +3 | |||||||||||
| 90 | Т | +2 | +3 | +4 | |||||||||
| 91 | Па | +3 | +4 | +5 | |||||||||
| 92 | У | +3 | +4 | +5 | +6 | ||||||||
| 93 | Нп | +3 | +4 | +5 | +6 | +7 | |||||||
| 94 | Пу | +3 | +4 | +5 | +6 | +7 | |||||||
| 95 | Am | +2 | +3 | +4 | +5 | +6 | |||||||
| 96 | Цм | +3 | +4 | ||||||||||
| 97 | Бк | +3 | +4 | ||||||||||
| 98 | Сп | +2 | +3 | +4 | |||||||||
| 99 | Ес | +2 | +3 | ||||||||||
| 100 | Fm | +2 | +3 | ||||||||||
| 101 | MD | +2 | +3 | ||||||||||
| 102 | Бр | +2 | +3 | ||||||||||
| 103 | Lr | +3 | |||||||||||
| 104 | Рф | +4 | |||||||||||
| 105 | Дб | +5 | |||||||||||
| 106 | Sg | +6 | |||||||||||
| 107 | Бх | +7 | |||||||||||
| 108 | Хс | +8 |
Највисоката состојба на оксидација на елементот одговара на бројот на групата периодниот систем, каде што се наоѓа овој елемент (исклучоци се: Au+3 (група I), Cu+2 (II), од групата VIII оксидационата состојба +8 може да се најде само во осмиум Os и рутениум Ru.
Состојби на оксидација на металите во соединенијата
Состојбите на оксидација на металите во соединенијата се секогаш позитивни, но ако зборуваме за неметали, тогаш нивната оксидациска состојба зависи од тоа со кој атом е поврзан елементот:
- ако со неметален атом, тогаш состојбата на оксидација може да биде или позитивна или негативна. Тоа зависи од електронегативноста на атомите на елементот;
- ако со метален атом, тогаш состојбата на оксидација е негативна.
Негативна оксидациона состојба на неметали
Највисоката негативна оксидациска состојба на неметали може да се одреди со одземање од 8 на бројот на групата во која се наоѓа хемискиот елемент, т.е. највисоката позитивна оксидациска состојба е еднаква на бројот на електрони во надворешниот слој, што одговара на бројот на групата.
Ве молиме имајте предвид дека оксидационите состојби на едноставни материи се 0, без разлика дали се работи за метал или неметал.
Извори:
- Гринвуд, Норман Н.; Earnshaw, A. Chemistry of the Elements - 2nd ed. - Оксфорд: Батерворт-Хајнеман, 1997 година
- Зелени стабилни соединенија на магнезиум(I) со врски Mg-Mg / Џонс Ц.; Stasch A.. - Science Magazine, 2007. - Декември (број 318 (бр. 5857)
- Списание Science, 1970. - Vol. 3929. - бр 168. - Стр. 362.
- Весник на хемиското друштво, хемиски комуникации, 1975. - стр. 760b-761.
- Ирвинг Лангмуир Распоредот на електроните во атомите и молекулите. - списание J.Am Chem. Соц., 1919. - Број. 41.
Во хемиските процеси главна улогаиграат атоми и молекули, чии својства го одредуваат исходот хемиски реакции. Една од важните карактеристики на атомот е оксидациониот број, што го поедноставува методот на сметководство за пренос на електрони во честичка. Како да се одреди состојбата на оксидација или формалното полнење на честичката и кои правила треба да ги знаете за ова?
Дефиниција
Секоја хемиска реакција е предизвикана од интеракцијата на атоми на различни супстанции. Процесот на реакција и неговиот резултат зависат од карактеристиките на најмалите честички.
Терминот оксидација (оксидација) во хемијата значи реакција при која група атоми или еден од нив губи електрони или добива; во случај на стекнување, реакцијата се нарекува „редукција“.
Состојбата на оксидација е величина што се мери квантитативно и ги карактеризира редистрибуираните електрони за време на реакцијата. Оние. За време на процесот на оксидација, електроните во атомот се намалуваат или се зголемуваат, редистрибуирајќи се меѓу другите честички кои содејствуваат, а нивото на оксидација точно покажува како тие се реорганизираат. Овој концепт е тесно поврзан со електронегативноста на честичките - нивната способност да привлекуваат и одбиваат слободни јони.
Одредувањето на нивото на оксидација зависи од карактеристиките и својствата на одредена супстанција, така што постапката за пресметување не може недвосмислено да се нарече лесна или сложена, но нејзините резултати помагаат условно да се забележат процесите на редокс реакции. Треба да се разбере дека добиениот резултат од пресметката е резултат на земање предвид на преносот на електрони и нема физичко значење и не е вистинското полнење на јадрото.
Важно е да се знае! Неорганска хемијачесто го користи терминот валентност наместо оксидационата состојба на елементите, тоа не е грешка, но треба да се има на ум дека вториот концепт е поуниверзален.
Концептите и правилата за пресметување на движењето на електроните се основа за класификација хемиски супстанции(номенклатура), описи на нивните својства и изготвување формули за комуникација. Но, најчесто овој концепт се користи за опишување и работа со редокс реакции.
Правила за одредување на степенот на оксидација
Како да ја дознаете состојбата на оксидација? Кога работите со редокс реакции, важно е да се знае дека формалното полнење на честичката секогаш ќе биде еднакво на вредноста на електронот, изразена во нумеричка вредност. Оваа карактеристика се должи на претпоставката дека електронските парови кои формираат врска секогаш се целосно поместени кон повеќе негативни честички. Треба да се разбере дека зборуваме јонски врски, а во случај на реакција на електроните ќе бидат подеднакво поделени помеѓу идентични честички.
Оксидацискиот број може да има и позитивни и негативни вредности. Работата е во тоа што за време на реакцијата атомот мора да стане неутрален, а за ова е неопходно или да се додаде одреден број електрони на јонот, ако е позитивен, или да се одземат ако е негативен. За да се означи овој концепт, при пишување формула, арапскиот број со соодветниот знак обично се пишува над ознаката на елементот. На пример, или итн.
Треба да знаете дека формалното полнење на металите секогаш ќе биде позитивно, и во повеќето случаи, можете да го користите периодниот систем за да го одредите. Постојат голем број карактеристики кои мора да се земат предвид за правилно да се одредат индикаторите.

Степен на оксидација:
Откако ќе се сетите на овие карактеристики, ќе биде прилично едноставно да се одреди бројот на оксидација на елементите, без оглед на сложеноста и бројот на атомските нивоа.
Корисно видео: одредување на состојбата на оксидација
Периодниот систем на Менделеев ги содржи речиси сите потребни информации за работа со хемиски елементи. На пример, учениците го користат само за да опишат хемиски реакции. Значи, за да ги одредите максималните позитивни и негативни вредности на бројот на оксидација, треба да ја проверите ознаката на хемискиот елемент во табелата:
- Максималниот позитивен е бројот на групата во која се наоѓа елементот.
- Максималната негативна состојба на оксидација е разликата помеѓу максималната позитивна граница и бројот 8.
Така, доволно е едноставно да се дознаат екстремните граници на формалното полнење на одреден елемент. Ова дејство може да се изврши со помош на пресметки врз основа на периодниот систем.
Важно е да се знае! Еден елемент може истовремено да има неколку различни стапки на оксидација.
Постојат два главни методи за одредување на нивото на оксидација, чии примери се претставени подолу. Првиот од нив е метод кој бара знаење и способност за примена на законите на хемијата. Како да се организираат состојби на оксидација користејќи го овој метод?

Правило за определување на состојби на оксидација
За да го направите ова ви треба:
- Определи дали дадената супстанција е елементарна и дали е надвор од врската. Ако е така, тогаш неговиот оксидациски број ќе биде 0, без оглед на составот на супстанцијата (поединечни атоми или атомски соединенија на повеќе нивоа).
- Определете дали предметната супстанција се состои од јони. Ако е така, тогаш степенот на оксидација ќе биде еднаков на нивниот полнеж.
- Ако предметната супстанција е метал, тогаш погледнете ги индикаторите на другите супстанции во формулата и пресметајте ги металните отчитувања користејќи аритметички операции.
- Ако целото соединение има едно полнење (во суштина тоа е збир на сите честички на претставените елементи), тогаш доволно е да се одредат индикаторите на едноставни супстанции, потоа да се одземат од вкупниот број и да се добијат податоците за металот.
- Ако врската е неутрална, тогаш вкупната сума мора да биде нула.
Како пример, размислете за комбинирање со алуминиумски јон чиј нето полнеж е нула. Правилата на хемијата го потврдуваат фактот дека јонот на Cl има оксидационен број -1, а во овој случај во соединението има три од нив. Ова значи дека јонот на Al мора да биде +3 за целото соединение да биде неутрално.
Овој метод е многу добар, бидејќи исправноста на растворот секогаш може да се провери со додавање на сите нивоа на оксидација заедно.
Вториот метод може да се користи без познавање на хемиските закони:
- Најдете податоци за честички за кои не постојат строги правила и точниот број на нивните електрони е непознат (ова може да се направи со исклучување).
- Откријте ги индикаторите на сите други честички и потоа пронајдете ја саканата честичка од вкупниот број со одземање.
Да го разгледаме вториот метод користејќи го примерот на супстанцијата Na2SO4, во која атомот на сулфур S не е одреден, само се знае дека е различен од нула.
За да откриете колку се еднакви сите состојби на оксидација:
- Најдете познати елементи, имајќи ги предвид традиционалните правила и исклучоци.
- Na јон = +1, и секој кислород = -2.
- Помножете го бројот на честички на секоја супстанција со нивните електрони за да се добијат состојбите на оксидација на сите атоми освен еден.
- Na2SO4 содржи 2 натриум и 4 кислород; кога ќе се помножи, излегува: 2 X +1 = 2 е оксидациониот број на сите честички на натриум и 4 X -2 = -8 - кислород.
- Додадете ги добиените резултати 2+(-8) =-6 - ова е вкупниот полнеж на соединението без сулфурна честичка.
- Претстави ја хемиската ознака како равенка: збир на познати податоци + непознат број = вкупен полнеж.
- Na2SO4 е претставен на следниов начин: -6 + S = 0, S = 0 + 6, S = 6.
Така, за да се користи вториот метод, доволно е да се знаат едноставните аритметички закони.