Мали РНК кои формираат шноли или кратки РНК кои формираат шноли (shRNA кратка шнола RNA, мала шнола RNA) молекули на кратки РНК кои формираат густи шноли во секундарната структура. ShRNA може да се користат за исклучување на изразување... ... Википедија
РНК полимераза- од клетка T. aquaticus при репликација. Некои елементи на ензимот се направени транспарентни, а синџирите на РНК и ДНК се појасно видливи. Јонот на магнезиум (жолт) се наоѓа на активното место на ензимот. РНК полимеразата е ензим кој врши ... ... Википедија
РНК интерференција- Испорака на мали РНК кои содржат шноли со помош на вектор базиран на лентивирус и механизмот на интерференција на РНК во клетките на цицачите РНК интерференција (а ... Википедија
РНК ген- Некодирачка РНК (ncRNA) се молекули на РНК кои не се преведуваат во протеини. Претходно користениот синоним, мала РНК (смРНК, мала РНК), повеќе не се користи, бидејќи некои некодирачки РНК може да бидат многу ... ... Википедија
Мали нуклеарни РНК- (snRNA, snRNA) класа на РНК што се наоѓа во јадрото на еукариотските клетки. Тие се транскрибираат со РНК полимераза II или РНК полимераза III и се вклучени во важни процеси како што се спојување (отстранување на интрони од незрела мРНК), регулација ... Википедија
Мали нуклеоларни РНК- (snoRNA, англиски snoRNA) класа на мали РНК вклучени во хемиски модификации (метилација и псеудуридилација) на рибозомалната РНК, како и tRNA и мала нуклеарна РНК. Според класификацијата MeSH, малите нуклеоларни РНК се сметаат за подгрупа... ... Википедија
мали нуклеарни (нуклеарни со мала молекуларна тежина) РНК- Широка група (105.106) мали нуклеарни РНК (100.300 нуклеотиди), поврзани со хетерогена нуклеарна РНК, се дел од малите рибонуклеопротеински гранули на јадрото; M.n.RNA се неопходна компонента на системот за спојување... ...
мали цитоплазматски РНК- Мали (100-300 нуклеотиди) РНК молекули локализирани во цитоплазмата, слични на малата нуклеарна РНК. [Арефјев В.А., Лисовенко Л.А. Англиско-руски објаснувачки речник на генетски термини 1995 407 стр.] Теми генетика МК scyrpssмал цитоплазматски... ... Водич за технички преведувач
мали нуклеарни РНК од класа U- Група асоцирани со протеини мали (од 60 до 400 нуклеотиди) РНК молекули кои сочинуваат значителен дел од содржината на спликомот и се вклучени во процесот на ексцизија на интроните; во 4 од 5-те добро проучени Usn типови, U1, U2, U4 и U5 РНК се 5... ... Водич за технички преведувач
РНК биомаркери- * РНК биомаркери * РНК биомаркери огромен број човечки транскрипти кои не ја кодираат синтезата на протеини (nsbRNA или npcRNA). Во повеќето случаи, малите (miRNA, snoRNA) и долгите (антисенс РНК, dsRNA и други видови) молекули на РНК се... ... Генетика. енциклопедиски речник
Книги
- Купете за 1877 UAH (само во Украина)
- Клиничка генетика. Учебник (+ЦД), Бочков Николај Павлович, Пузирев Валери Павлович, Смирнихина Светлана Анатолиевна. Сите поглавја се ревидирани и дополнети во врска со развојот на медицинската наука и практика. Поглавјата за мултифакторни заболувања, превенција, третман на наследни болести,…
), спречувајќи ја транслацијата на mRNA на рибозомите во протеинот што го шифрира. На крајот на краиштата, ефектот на мала интерференцијална РНК е идентичен со оној на едноставно намалување на генската експресија.
Мали интерферентни РНК беа откриени во 1999 година од групата на Дејвид Баулкомб во ОК како компонента на пост-транскрипциониот систем за замолчување на гените во растенијата. PTGS, ен: пост-транскрипциско замолчување на гените). Тимот ги објави своите наоди во списанието Science.
Двоверижна РНК може да ја подобри генската експресија преку механизам наречен активирање на гените зависни од РНК. RNAa, мала генска активација индуцирана од РНК). Се покажа дека двојно-верижните РНК комплементарни на промоторите на целните гени предизвикуваат активирање на соодветните гени. За човечки клетки е докажано активирање зависно од РНК при администрација на синтетичка двоверижна РНК. Не е познато дали сличен систем постои во клетките на другите организми.
Со обезбедувањето на способноста да се исклучи во суштина секој ген по желба, малата интерференцијална РНК-базирана интерференција генерира огромен интерес за основната и применетата биологија. Расте бројот на тестови базирани на RNAi со широка основа за да се идентификуваат важни гени во биохемиските патишта. Бидејќи развојот на болестите се одредува и од активноста на гените, се очекува дека во некои случаи исклучувањето на генот со помош на мала интерферентна РНК може да има терапевтски ефект.
Меѓутоа, примената на мали интерферентни РНК-базирани пречки кај животните, а особено кај луѓето, се соочува со многу тешкотии. Експериментите покажаа дека ефективноста на малата интерферентна РНК е различна за различни типовиклетки: некои клетки лесно реагираат на мала интерферентна РНК и демонстрираат намалување на генската експресија, додека кај други тоа не е забележано, и покрај ефективната трансфекција. Причините за овој феномен сè уште се слабо разбрани.
Резултатите од фаза 1 испитувања на првите две RNAi терапевти (наменети за лекување на макуларна дегенерација), објавени кон крајот на 2005 година, покажуваат дека малите интерферентни РНК лекови лесно се толерираат од пациентите и имаат прифатливи фармакокинетски својства.
Прелиминарните клинички испитувања на мали интерферентни РНК кои го таргетираат вирусот на ебола покажуваат дека тие може да бидат ефикасни за пост-експозиција профилакса на болеста. Овој лек и овозможи на целата група експериментални примати да преживеат откако примиле смртоносна доза на заир еболавирусот
Метафората што лежи во основата на името на феноменот на интерференција на РНК се однесува на експериментот со петунија, кога вештачки внесените гени на розова и виолетова пигментна синтетаза во растението не го зголемија интензитетот на бојата, туку, напротив, го намалија. Слично на тоа, во „обични“ пречки, суперпозицијата на два бранови може да доведе до меѓусебно „откажување“.
Во живата клетка, протокот на информации помеѓу јадрото и цитоплазмата никогаш не пресушува, но разбирањето на сите негови „вртења“ и дешифрирањето на информациите кодирани во неа е навистина херкулова задача. Еден од најважните откритија во биологијата од минатиот век може да се смета за откривање на информациски (или матрични) молекули на РНК (мРНК или мРНК), кои служат како посредници кои носат информациски „пораки“ од јадрото (од хромозомите) до цитоплазмата. . Одлучувачката улога на РНК во синтезата на протеините беше предвидена уште во 1939 година во работата на Торбјорн Касперсон, Жан Браше и Џек Шулц, а во 1971 година Џорџ Марбе ја започна синтезата на хемоглобин во ооцити жаби со инјектирање на првиот изолиран зајачки протеин кој го пренесува РНК. .
Во 1956-57 година, во Советскиот Сојуз, А.Н. Белозерски и А. Рибозомалната РНК, вториот „главен“ тип на клеточна РНК, го формира „скелетот“ и функционалниот центар на рибозомите кај сите организми; Тоа е rRNA (а не протеини) што ги регулира главните фази на синтезата на протеините. Во исто време, беше опишан и проучен третиот „главен“ тип на РНК - преносни РНК (tRNA), кои во комбинација со две други - mRNA и rRNA - формираат единствен комплекс за синтеза на протеини. Според прилично популарната хипотеза „светот на РНК“, токму оваа нуклеинска киселина лежи во самото потекло на животот на Земјата.
Поради фактот што РНК е значително похидрофилна во споредба со ДНК (поради замената на деоксирибозата со рибоза), таа е полабилна и може релативно слободно да се движи во клетката, па затоа испорачува краткотрајни реплики генетски информации(mRNA) до местото каде што започнува синтезата на протеините. Сепак, вреди да се забележи „непријатноста“ поврзана со ова - РНК е многу нестабилна. Таа е многу полошо складирана од ДНК (дури и внатре во клетката) и се деградира при најмала промена на условите (температура, pH). Покрај „својата“ нестабилност, огромен придонесприпаѓа на рибонуклеази (или RNases) - класа на ензими за расцепување на РНК кои се многу стабилни и „сеприсутни“ - дури и кожата на рацете на експериментаторот содржи доволно од овие ензими за да го негира целиот експеримент. Поради ова, работата со РНК е многу потешка отколку со протеините или ДНК - вторите генерално може да се складираат стотици илјади години без практично никакво оштетување.
Фантастична грижа за време на работата, тридистилат, стерилни ракавици, лабораториски стакларија за еднократна употреба - сето тоа е неопходно за да се спречи деградација на РНК, но одржувањето на таквите стандарди не беше секогаш можно. Затоа, долго време, тие едноставно не обрнуваа внимание на кратките „фрагменти“ на РНК, кои неизбежно ги контаминираа растворите. Меѓутоа, со текот на времето, стана јасно дека, и покрај сите напори да се одржи стерилноста на работната површина, природно продолжи да се откриваат „остатоци“, а потоа се покажа дека илјадници кратки двоверижни РНК секогаш се присутни во цитоплазмата. , извршуваат многу специфични функции и се апсолутно неопходни за нормален развој на клетките и организмот.
Принцип на интерференција на РНК
Денес, проучувањето на малите регулаторни РНК е една од областите кои најбрзо се развиваат молекуларна биологија. Откриено е дека сите кратки РНК ги извршуваат своите функции врз основа на феноменот наречен РНК интерференција (суштината на овој феномен е потиснување на генската експресија во фазата на транскрипција или транслација со активно учество на мали молекули на РНК). Механизмот на интерференција на РНК е прикажан многу шематски на Сл. 1:
Ориз. 1. Основи на РНК интерференција
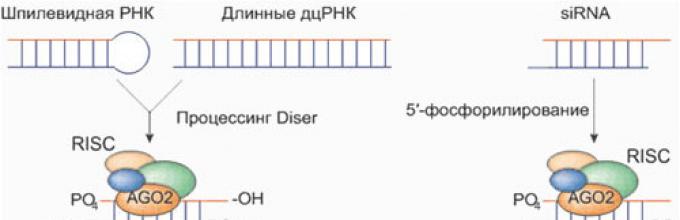
Двоверижните молекули на РНК (dsRNA) се невообичаени во нормалните клетки, но тие се суштински чекор во животниот циклус на многу вируси. Специјален протеин наречен Dicer, откако откри dsRNA во клетката, ја „сече“ на мали фрагменти. Антисенсната влакно на таков фрагмент, која веќе може да се нарече кратка интерферентна РНК (siRNA, од siRNA - мала интерферентна РНК), е врзана со комплекс од протеини наречени RISC (РНК-индуциран комплекс за замолчување), чиј централен елемент е ендонуклеаза од семејството Аргонаут. Врзувањето за siRNA го активира RISC и предизвикува пребарување во клетката за молекули на ДНК и РНК кои се комплементарни на „шаблонот“ siRNA. Судбината на таквите молекули е да бидат уништени или деактивирани од комплексот RISC.
Да резимираме, кратките „пресеци“ на туѓа (вклучувајќи намерно воведена) двоверижна РНК служат како „шаблон“ за големо пребарување и уништување на комплементарната mRNA (и ова е еквивалентно на потиснување на изразувањето на соодветниот ген) , не само во една ќелија, туку и во соседните. За многу организми - протозои, мекотели, црви, инсекти, растенија - овој феномен е еден од главните начини на имунолошка одбрана од инфекции.
Во 2006 година, Ендрју Фајр и Крег Мело добија Нобелова наградапо физиологија и медицина „За откривање на феноменот на интерференција на РНК - механизмот на замолчување на гените со учество на dsRNA“. Иако самиот феномен на интерференција на РНК беше опишан многу порано (на почетокот на 1980-тите), тоа беше дело на Фајр и Мело во општ прегледго утврди регулаторниот механизам на малите РНК и наведе дотогаш непозната област на молекуларно истражување. Еве ги главните резултати од нивната работа:
- За време на интерференцијата на РНК, мРНК (и ниедна друга) се расцепува;
- Двоверижна РНК делува (предизвикува расцеп) многу поефикасно од едноверижна РНК. Овие две набљудувања го предвидоа постоењето на специјализиран систем кој посредува во дејството на dsRNA;
- dsRNA, комплементарна на дел од зрела mRNA, предизвикува расцепување на второто. Ова укажува на цитоплазматска локализација на процесот и присуство на специфична ендонуклеаза;
- Мала количина на dsRNA (неколку молекули по клетка) е доволна за целосно „исклучување“ на целниот ген, што укажува на постоење на каскаден механизам на катализа и/или засилување.
Овие резултати ја поставија основата за цела област на модерната молекуларна биологија - интерференција на РНК - и го одреди векторот на работа на многу истражувачки групи низ светот со децении. До денес, откриени се три големи групи на мали РНК кои играат на молекуларното поле како „тим за интерференција на РНК“. Ајде да ги запознаеме подетално.
Играч #1 – кратка интерферентна РНК
Специфичноста на интерференцијата на РНК се одредува со кратки интерферентни РНК (siRNA) - мали двоверижни РНК молекули со јасно дефинирана структура (види Сл. 2).
siRNA се најраните во еволуцијата и се најраспространети кај растенијата, едноклеточните организми и безрбетниците. Кај 'рбетниците, практично не се наоѓаат siRNAs, бидејќи тие беа заменети со подоцнежни „модели“ на кратки РНК (види подолу).
siRNA - „шаблони“ за пребарување во цитоплазмата и уништување на мРНК молекули - имаат должина од 20-25 нуклеотиди и „посебна карактеристика“: 2 неспарени нуклеотиди на 3' краевите и фосфорилирани 5' краеви. Антисмислената siRNA е способна (се разбира, не сама по себе, туку со помош на комплексот RISC) да ја препознае mRNA и конкретно да предизвика нејзина деградација: целната mRNA е исечена на точното место комплементарно на 10-тиот и 11-тиот нуклеотиди на анти-смислен siRNA синџир.

Ориз. 2. Механизам на „интерференција“ помеѓу mRNA и siRNA
Кратките молекули на РНК кои „попречуваат“ можат или да навлезат во клетката однадвор или да бидат „отсечени“ на место од подолгата двоверижна РНК. Главниот протеин потребен за сечење на dsRNA е Dicer ендонуклеазата. „Исклучувањето“ на генот со механизмот за интерференција го врши siRNA заедно со протеинскиот комплекс RISC, кој се состои од три протеини - ендонуклеазата Ago2 и два помошни протеини PACT и TRBP. Подоцна беше откриено дека комплексите Dicer и RISC можат да користат како „семе“ не само dsRNA, туку и едноверижна РНК што формира двоверижна фиба, како и готова siRNA (последната го заобиколува „сечењето“ фаза и веднаш се врзува за RISC).
Функциите на siRNA во клетките на безрбетниците се доста разновидни. Првата и главната работа е имунолошка заштита. „Традиционалниот“ имунолошки систем (лимфоцити + леукоцити + макрофаги) е присутен само во сложени повеќеклеточни организми. Кај едноклеточните организми, безрбетниците и растенијата (кои или немаат таков систем или е во повој), имунолошката одбрана се заснова на интерференција на РНК. Имунитетот базиран на интерференција на РНК не бара сложени органи за „тренинг“ за прекурсори на имуните клетки (слезина, тимус); во исто време, разновидноста на теоретски можните кратки РНК секвенци (421 варијанта) е во корелација со бројот на можни протеински антитела на вишите животни. Дополнително, siRNA се синтетизираат врз основа на „непријателската“ РНК што ја инфицирала клетката, што значи, за разлика од антителата, тие веднаш се „прилагодени“ за специфичен тип на инфекција. И иако заштитата базирана на интерференција на РНК не функционира надвор од клетката (барем, сè уште нема такви податоци), таа обезбедува интрацелуларен имунитет повеќе од задоволително.
Пред сè, siRNA создава антивирусен имунитет со уништување на mRNA или геномска РНК на заразни организми (на пример, вака се откриени siRNAs кај растенијата). Воведувањето на вирусна РНК предизвикува моќно засилување на специфичните siRNA врз основа на молекулата на прајмерот - самата вирусна РНК. Покрај тоа, siRNA го потиснува изразот на различни мобилни генетски елементи (MGEs), и затоа обезбедува заштита од ендогени „инфекции“. Мутациите во гените на комплексот RISC често доведуваат до зголемена нестабилност на геномот поради високата активност на MGE; siRNA може да дејствува како ограничувач на изразувањето на сопствените гени, предизвикувајќи како одговор на нивната прекумерна експресија. Регулирањето на функцијата на генот може да се случи не само на ниво на транслација, туку и за време на транскрипцијата - преку метилација на гените кај хистон H3.
Во модерната експериментална биологија, важноста на интерференцијата на РНК и кратките РНК тешко може да се прецени. Развиена е технологија за „исклучување“ (или соборување) на поединечни гени in vitro (на клеточни култури) и in vivo (на ембриони), што веќе стана де факто стандард при проучување на кој било ген. Понекогаш, дури и за да се утврди улогата на поединечните гени во некој процес, тие систематски ги „исклучуваат“ сите гени по ред.
Фармацевтите исто така се заинтересираа за можноста за користење на siRNA, бидејќи способноста за специфично регулирање на функционирањето на поединечни гени ветува невидени изгледи во лекувањето на низа болести. Малата големина и високата специфичност на дејството ветуваат висока ефикасност и ниска токсичност на лековите базирани на siRNA; Сепак, сè уште не е можно да се реши проблемот со испорака на siRNA до заболените клетки во телото - ова се должи на кревкоста и кревкоста на овие молекули. И иако десетици тимови сега се обидуваат да најдат начин да ги насочат овие „магични куршуми“ точно кон целта (внатре во заболените органи), тие сè уште не постигнале видлив успех. Покрај ова, има и други тешкотии. На пример, во случај на антивирусна терапија, високата селективност на дејството на siRNA може да биде лоша услуга - бидејќи вирусите брзо мутираат, модифицираниот вид многу брзо ќе ја изгуби чувствителноста на siRNA избрана на почетокот на терапијата: познато е дека заменувањето на само еден нуклеотид во siRNA води до значително намалување на интерферентниот ефект.
Во овој момент вреди да се потсетиме уште еднаш - siRNAs беа пронајдени само кај растенијата, безрбетниците и едноклеточните организми; Иако хомолози на протеини за интерференција на РНК (Dicer, RISC комплекс) се исто така присутни кај виши животни, siRNA не беа откриени со конвенционални методи. Какво изненадување беше кога вештачки воведените синтетички аналози на siRNA предизвикаа силен специфичен ефект зависен од дозата во клеточните култури на цицачи! Ова значеше дека во клетките на 'рбетниците, интерференцијата на РНК не беше заменета со посложени имунолошки системи, туку еволуираше заедно со организмите, претворајќи се во нешто „понапредно“. Следствено, кај цицачите беше неопходно да не се бараат точни аналози на siRNA, туку нивните еволутивни наследници.
Играч #2 – микроРНК
Навистина, врз основа на еволутивно античкиот механизам на интерференција на РНК, поразвиените организми развија два специјализирани системи за контролирање на работата на гените, секој користејќи своја група мали РНК - микроРНК и пиРНК (РНК со интеракција со Пиви). И двата системи се појавија во сунѓери и колентерати и еволуираа заедно со нив, поместувајќи ја сиРНК и механизмот на „гола“ интерференција на РНК. Нивната улога во обезбедувањето имунитет се намалува, бидејќи оваа функција е преземена од понапредните механизми на клеточниот имунитет, особено интерферонскиот систем. Сепак, овој систем е толку чувствителен што ја активира и самата siRNA: појавата на мала двоверижна РНК во клетка на цицач предизвикува „алармен сигнал“ (го активира лачењето на интерферон и предизвикува изразување на гени зависни од интерферон, кои целосно ги блокира сите процеси на превод). Во овој поглед, механизмот на интерференција на РНК кај повисоките животни е посредуван главно од микроРНК и пиРНК - едноверижни молекули со специфична структура кои не се откриени од системот на интерферон.
Како што геномот стана покомплексен, микроРНК и пиРНК се повеќе се вклучени во регулирањето на транскрипцијата и транслацијата. Со текот на времето, тие се претворија во дополнителен, прецизен и суптилен систем на регулација на геномот. За разлика од сиРНК, микроРНК и пиРНК (откриени во 2001 г., види Сл. 3, А-Б) не се произведуваат од туѓи двоверижни РНК молекули, туку првично се кодирани во геномот на организмот домаќин.
Претходникот на микроРНК е транскрибиран од двете нишки на геномната ДНК со РНК полимераза II, што резултира со појава на средна форма - при-микроРНК - што ги носи карактеристиките на редовна мРНК - капа од m7G и опашка од полиА. Овој претходник формира јамка со две едножилни „опашки“ и неколку неспарени нуклеотиди во центарот (сл. 3А). Таквата јамка се подложува на обработка во две фази (сл. Б): прво, ендонуклеазата Дроша ги отсекува едноверижните РНК „опашки“ од шнолата, по што исечената фиба (пред-микроРНК) се извезува во цитоплазмата, каде што е препознаен од Dicer, кој прави уште две резови (сече со двојно жица е отсечено, боја кодирана на Сл. 3А). Во оваа форма, зрелата микроРНК, слична на siRNA, е вклучена во комплексот RISC.
Механизмот на дејство на многу микроРНК е сличен на дејството на siRNA: кратка (21-25 нуклеотиди) едноверижна РНК како дел од протеинскиот комплекс RISC се врзува со висока специфичност за комплементарното место во 3'-непреведениот регион на целната mRNA. Врзувањето доведува до расцепување на mRNA од протеинот Аго. Сепак, активноста на микроРНК (во споредба со сиРНК) е веќе подиференцирана - ако комплементарноста не е апсолутна, целната мРНК можеби нема да се разградува, туку само реверзибилно блокирана (нема да има транслација). Истиот RISC комплекс може да користи и вештачки воведени siRNAs. Ова објаснува зошто siRNA направени по аналогија со протозои се активни и кај цицачите.
Така, можеме да ја надополниме илустрацијата за механизмот на дејство на интерференцијата на РНК кај повисоките (билатерално симетрични) организми со комбинирање во една слика на акциониот дијаграм на микроРНК и биотехнолошки воведените siRNA (сл. 3Б).
Ориз. 3А: Структура на двоверижна прекурсорска молекула на микроРНК
Главни карактеристики: присуство на зачувани секвенци кои формираат фиба; присуство на комплементарна копија (микроРНК*) со два „екстра“ нуклеотиди на 3’ крај; специфична секвенца (2-8 bp) која формира место за препознавање на ендонуклеази. Самата микроРНК е означена со црвено - тоа е она што Dicer го отсекува.

Ориз. 3Б: Општ механизам на обработка на микроРНК и имплементација на нејзината активност

Ориз. 3Б: Генерализирана шема на дејство на вештачки микроРНК и сиРНК
Вештачките siRNA се внесуваат во клетката со помош на специјализирани плазмиди (таргетирање siRNA вектор).
Функции на микроРНК
Физиолошките функции на микроРНК се исклучително разновидни - всушност, тие дејствуваат како главни непротеински регулатори на онтогенезата. микроРНК не се откажуваат, туку ја надополнуваат „класичната“ шема на генска регулација (индуктори, супресори, набивање на хроматин, итн.). Покрај тоа, синтезата на самите микроРНК е сложено регулирана (одредени базени на микроРНК може да се вклучат со интерферони, интерлеукини, фактор на туморска некроза α (TNF-α) и многу други цитокини). Како резултат на тоа, се појавува мрежа на повеќе нивоа на подесување на „оркестар“ од илјадници гени, неверојатна по својата сложеност и флексибилност, но ова не завршува тука.
микроРНК се повеќе „универзални“ од siRNA: гените „одделенија“ не мора да бидат 100% комплементарни - регулацијата исто така се спроведува преку делумна интеракција. Денес, една од најжешките теми во молекуларната биологија е потрагата по микроРНК кои дејствуваат како алтернативни регулатори на познатите физиолошки процеси. На пример, микроРНК вклучени во регулирањето на клеточниот циклус и апоптозата кај растенијата, Drosophila и нематодите веќе се опишани; кај луѓето, микроРНК го регулираат имунолошкиот систем и развојот на хематопоетски матични клетки. Употребата на технологии засновани на биочипови (скрининг со микро низа) покажа дека цели групи на мали РНК се вклучуваат и исклучуваат во различни фази од животот на клетките. За биолошки процесиидентификувани десетици специфични микроРНК, чие ниво на изразување под одредени услови се менува илјадници пати, нагласувајќи ја исклучителната контролираност на овие процеси.
До неодамна, се веруваше дека микроРНК само ја потиснува - целосно или делумно - работата на гените. Сепак, неодамна се покажа дека дејството на микроРНК може радикално да се разликува во зависност од состојбата на клетката! Во клетка која активно се дели, микроРНК се врзува за комплементарна секвенца во 3' регионот на mRNA и ја инхибира синтезата на протеини (превод). Меѓутоа, во состојба на одмор или стрес (на пример, кога растете во лоша средина), истиот настан доведува до сосема спротивен ефект - зголемена синтеза на целниот протеин!
Еволуција на микроРНК
Бројот на сорти на микроРНК во повисоките организми сè уште не е целосно утврден; според некои податоци, тој надминува 1% од бројот на гени кои кодираат протеини (кај луѓето, на пример, велат дека има 700 микроРНК, а овој број е постојано расте). микроРНК ја регулираат активноста на околу 30% од сите гени (целите за многу од нив сè уште не се познати), а има и сеприсутни и ткивни специфични молекули - на пример, еден таков важен базен на микроРНК го регулира созревањето на стеблото на крвта клетките.
Широк изразен профил во различни ткива различни организмии биолошкото изобилство на микроРНК сугерира еволутивно античко потекло. МикроРНК за првпат биле откриени во нематоди, и долго време се верувало дека овие молекули се појавуваат само во сунѓери и колентерати; сепак, подоцна биле откриени во едноклеточни алги. Интересно, како што организмите стануваат посложени, бројот и хетерогеноста на базенот на miRNA исто така се зголемува. Ова индиректно укажува дека сложеноста на овие организми е обезбедена, особено, преку функционирањето на микроРНК. Можната еволуција на miRNA е прикажана на Сл. 4.

Ориз. 4. Разновидност на микроРНК во различни организми
Колку е поголема организацијата на организмот, толку повеќе микроРНК се наоѓаат во него (бројот во загради). Видовите во кои се пронајдени единечни микроРНК се означени со црвено. Според .
Може да се направи јасна еволутивна врска помеѓу siRNA и microRNA, врз основа на следните факти:
- дејството на двата типа е заменливо и е посредувано од хомологни протеини;
- siRNAs внесени во клетките на цицачите конкретно ги „исклучуваат“ саканите гени (и покрај одредено активирање на заштитата од интерферон);
- микроРНК се откриваат во се повеќе антички организми.
Овие и други податоци укажуваат на потеклото на двата системи од заеднички „предок“. Исто така, интересно е да се забележи дека имунитетот на „РНК“ како независен претходник на протеинските антитела ја потврдува теоријата за потеклото на првите форми на живот засновани на РНК, а не на протеини (да потсетиме дека ова е омилената теорија на академик А.С. Спирин). .
Додека имаше само двајца „играчи“ во арената на молекуларната биологија – siRNA и microRNA – главната „цел“ на интерференцијата на РНК изгледаше сосема јасна. Навистина: збир на хомологни кратки РНК и протеини во различни организми извршуваат слични дејства; Како што организмите стануваат покомплексни, така се зголемува и функционалноста.
Меѓутоа, во процесот на еволуција, природата создала друг, еволутивно најнов и високо специјализиран систем заснован на истиот успешен принцип на интерференција на РНК. Зборуваме за пиРНК (пиРНК, од РНК со интеракција на Пиви).
Колку е покомплексен геномот организиран, толку е поразвиен и поадаптиран организмот (или обратно? ;-). Сепак, зголемената сложеност на геномот има и негативна страна: сложениот генетски систем станува нестабилен. Ова доведува до потреба од механизми одговорни за одржување на интегритетот на геномот - инаку спонтано „мешање“ на ДНК едноставно ќе го оневозможи. Мобилните генетски елементи (MGE), еден од главните фактори за нестабилност на геномот, се кратки нестабилни региони кои можат автономно да се транскрибираат и мигрираат низ геномот. Активирањето на таквите транспонирани елементи доведува до повеќекратни прекини на ДНК во хромозомите, што може да има смртоносни последици.
Бројот на MGE се зголемува нелинеарно со големината на геномот и нивната активност мора да биде содржана. За да го направите ова, животните, почнувајќи од колентератите, го користат истиот феномен на интерференција на РНК. Оваа функција се врши и од кратки РНК, но не од веќе дискутираните, туку од трет тип - пиРНК.
„Портрет“ на пиРНК
пиРНК се кратки молекули долги 24-30 нуклеотиди, кодирани во центромерните и теломерите области на хромозомот. Секвенците на многу од нив се комплементарни со познатите мобилни генетски елементи, но има и многу други пиРНК кои се совпаѓаат со региони на работни гени или со фрагменти од геном чии функции се непознати.
пиРНК (како и микроРНК) се кодирани во двете нишки на геномската ДНК; тие се многу променливи и разновидни (до 500.000 (!) видови во еден организам). За разлика од siRNA и microRNA, тие се формираат од еден синџир со карактеристична особина– урацил (U) на 5’ крај и метилиран 3’ крај. Постојат и други разлики:
- За разлика од siRNA и microRNAs, тие не бараат обработка од Dicer;
- ПиРНК гените се активни само во герминативните клетки (за време на ембриогенезата) и околните ендотелијални клетки;
- Протеинскиот состав на системот piRNA е различен - ова се ендонуклеази од класата Piwi (Piwi и Aub) и посебна сорта на Argonaute - Ago3.
Обработката и активноста на пиРНК сè уште се слабо разбрани, но веќе е јасно дека механизмот на дејство е сосема различен од другите кратки РНК - денес е предложен пинг-понг модел на нивната работа (сл. 5 А, Б).
Пинг-понг механизам на биогенезата на пиРНК

Ориз. 5А: Цитоплазматски дел од обработката на пиРНК
Биогенезата и активноста на пиРНК е посредувана од фамилијата на ендонуклеази Piwi (Ago3, Aub, Piwi). Активноста на пиРНК е обезбедена од двете едноверижни молекули на пиРНК - смисла и анти-смисла - од кои секоја се поврзува со специфична Piwi ендонуклеаза. ПиРНК го препознава комплементарниот регион на транспозонската mRNA (сина нишка) и го отсекува. Ова не само што го инактивира транспозонот, туку и создава нова пиРНК (поврзана со Ago3 преку метилација на 3' крај со Hen1 метилаза). Оваа пиРНК, пак, препознава мРНК со транскрипти од кластерот прекурсори на пиРНК (црвена нишка) - на овој начин циклусот се затвора и повторно се произведува саканата пиРНК.

Ориз. 5Б: пиРНК во јадрото
Покрај ендонуклеазата Aub, ендонуклеазата Piwi исто така може да врзе антисенс пиРНК. По врзувањето, комплексот мигрира во јадрото, каде што предизвикува деградација на комплементарните транскрипти и преуредување на хроматин, предизвикувајќи супресија на активноста на транспозоните.
Функции на пиРНК
Главната функција на пиРНК е да ја потисне активноста на MGE на ниво на транскрипција и транслација. Се верува дека пиРНК се активни само за време на ембриогенезата, кога непредвидливото мешање на геномот е особено опасно и може да доведе до смрт на ембрионот. Ова е логично - кога имунолошкиот систем сè уште не почнал да работи, на клетките на ембрионот им е потребна едноставна, но ефикасна заштита. Ембрионот е сигурно заштитен од надворешни патогени со плацентата (или лушпата од јајцето). Но, покрај ова, неопходна е и одбрана од ендогени (внатрешни) вируси, првенствено MGE.
Оваа улога на пиРНК е потврдена со искуство - „нокаут“ или мутации на гените Ago3, Piwi или Aub доведуваат до сериозни развојни нарушувања (и нагло зголемување на бројот на мутации во геномот на таков организам), а исто така предизвикуваат неплодност поради нарушување на развојот на герминативните клетки.
Дистрибуција и еволуција на пиРНК
Првите пиРНК веќе се наоѓаат во морските анемони и сунѓери. Растенијата очигледно тргнаа по поинаков пат - во нив не беа пронајдени протеини од Piwi, а улогата на „муцка“ за транспозоните ја извршуваат ендонуклеазата Ago4 и siRNA.
Кај повисоките животни, вклучително и луѓето, системот на пиРНК е многу добро развиен, но може да се најде само во ембрионските клетки и во амнионскиот ендотел. Зошто дистрибуцијата на пиРНК во телото е толку ограничена, останува да се види. Може да се претпостави дека, како и секое моќно оружје, пиРНК се корисни само под многу специфични услови (за време на развојот на фетусот), а кај возрасното тело нивната активност ќе предизвика повеќе штета отколку добро. Сепак, бројот на пиРНК го надминува бројот на познати протеини по ред на големина, а неспецифичните ефекти на пиРНК во зрелите клетки е тешко да се предвидат.
| siRNA | микроРНК | пиРНК | |
| Ширење | Растенија, Дрософила, C. elegans. Не се наоѓа кај 'рбетниците | Еукариоти | Ембрионски клетки на животни (почнувајќи со колентерати). Не во протозои и растенија |
| Должина | 21-22 нуклеотиди | 19-25 нуклеотиди | 24-30 нуклеотиди |
| Структура | Двојно-верижна, 19 комплементарни нуклеотиди и два неспарени нуклеотиди на 3' крај | Комплексна структура со еден синџир | Комплексна структура со еден синџир. U на 5'-крај, 2'- О-метилиран 3' крај |
| Обработка | Dicer-зависен | Dicer-зависен | Dicer-независен |
| Ендонуклеази | Пред 2 | Аго1, Аго2 | Ago3, Piwi, Aub |
| Активност | Деградација на комплементарни mRNA, ацетилација на геномната ДНК | Деградација или инхибиција на транслацијата на целната mRNA | Деградација на мРНК што го кодира МГЕ, регулирање на транскрипцијата на МГЕ |
| Биолошка улога | Антивирусна имунолошка одбрана, потиснување на активноста на сопствените гени | Регулирање на генската активност | Сузбивање на активноста на MGE за време на ембриогенезата |
Заклучок
Како заклучок, би сакал да дадам табела што ја илустрира еволуцијата на протеинскиот апарат вклучен во интерференцијата на РНК (сл. 6). Може да се види дека протозоите имаат најразвиен siRNA систем (протеински семејства Ago, Dicer), и како што организмите стануваат посложени, акцентот се префрла на поспецијализирани системи - бројот на протеински изоформи за микроРНК (Дроша, Паша) и пиРНК ( Piwi, Hen1) се зголемува. Во исто време, разновидноста на ензимите кои посредуваат во дејството на siRNA се намалува.

Ориз. 6. Разновидност на протеини вклучени во интерференција на РНК
И
Броевите го означуваат бројот на протеини во секоја група. Елементите карактеристични за siRNA и microRNA се означени со сино, а протеините поврзани со пиРНК се означени со црвено. Според .
Феноменот на интерференција на РНК почна да се користи од наједноставните организми. Врз основа на овој механизам, природата создаде прототип на имунолошкиот систем, а како што организмите стануваат покомплексни, интерференцијата на РНК станува незаменлив регулатор на активноста на геномот. Два различни механизми плус три типа на кратки РНК (види сумарна табела) - како резултат на тоа, гледаме илјадници фини регулатори на различни метаболички и генетски патишта. Оваа впечатлива слика ја илустрира разновидноста и еволутивната адаптација на молекуларните биолошки системи. Кратките РНК повторно докажуваат дека нема „мали нешта“ во клетката - има само мали молекули, целосното значење на чија улога само што почнуваме да го разбираме.
Точно, таквата фантастична сложеност повеќе сугерира дека еволуцијата е „слепа“ и делува без однапред одобрена „ мастер план» .
Литература
- Gurdon J. B., Lane C. D., Woodland H. R., Marbaix G. (1971). Употреба на јајца од жаба и ооцити за проучување на гласник РНК и нејзин превод во живите клетки. Природа 233, 177-182;
- Spirin A. S. (2001). Биосинтеза на протеини, светот на РНК и потеклото на животот. Билтен на Руската академија на науките 71, 320-328;
- Елементи: „Од влакната сега може да се извлечат целосни митохондријални геноми на изумрени животни“;
- Fire A., Xu S., Montgomery M.K., Kostas S.A., Driver S.E., Mello C.C. (1998). Моќна и специфична генетска интерференција од двоверижна РНК во Caenorhabditis elegans. Nature 391, 806-311;
- Биомолекула: „МикроРНК откриени за прв пат во едноклеточен организам“;
- Covey S., Al-Kaff N., Lángara A., Turner D. (1997). Растенијата се борат против инфекцијата со замолчување на гените. Nature 385, 781-782;
- Биомолекула: „Молекуларно двојно работење: човечките гени работат за вирусот на грип“;
- Рен Б. (2010). Транскрипција: Зајакнувачите создаваат некодирачка РНК. Природа 465, 173–174;
- Таганов К.Д., Болдин М.П., Чанг К.Ј., Балтимор Д. (2006). NF-κB-зависна индукција на микроРНК miR-146, инхибитор насочен кон сигнализирање на протеините на вродените имунолошки одговори. Proc. Натл. акад. Sci. САД. 103, 12481-12486;
- O'Connell R. M., Rao D. S., Chaudhuri A. A., Boldin M. P., Taganov K. D., Nicoll J., Paquette R. L., Baltimore D. (2008). Одржливата експресија на микроРНК-155 во хематопоетските матични клетки предизвикува миелопролиферативно нарушување. J. Exp. Med. 205, 585-594;
- Биомолекула: „микроРНК – колку подалеку во шумата, толку повеќе огревно дрво“;
- Елементи: „Компликацијата на телото кај древните животни беше поврзана со појавата на нови регулаторни молекули“;
- Гримсон А., Сривастава М., Фахеј Б., Вудкрофт Б.Џ., Чианг Х.Р., Кинг Н., Дегнан Б.М., Роксар Д.С., Бартел Д.П. (2008). Рано потекло и еволуција на микроРНК и РНК со интеракција со Пиви кај животните. Природа 455, 1193–1197.
- Аравин А., Ханон Г., Бренеке Ј. (2007). Патеката Piwi-piRNA обезбедува адаптивна одбрана во трката за вооружување со транспосон. Наука 318, 761–764;
- Биомолекула:
Статија за натпреварот „био/мол/текст“: Во последниве години, РНК - и особено нејзините „некласични“ сорти - го привлече вниманието на биолозите ширум светот. Се испостави дека регулирањето со некодирачки РНК е широко распространето - од вируси и бактерии до луѓето. Студијата за разновидноста на малите бактериски РНК регулатори јасно ја покажа нивната важна улога и во посредничкиот метаболизам и во адаптивните одговори. Оваа статија ги опишува типовите на мали РНК на бактерии и регулаторните механизми што се спроведуваат со нивна помош. Посебен акцент е ставен на улогата на овие молекули во животот на бактериските агенси кои предизвикуваат особено опасни инфекции.
РНК: повеќе од само копија на ДНК
Повеќето читатели на оваа страница ги знаат основните механизми на жива клетка уште од училиште. На курсевите по биологија, од законите на Мендел до најсовремените проекти за секвенционирање на геномот, црвената нишка се провлекува низ идејата за голема генетска програма за развој на организам, позната на професионалните биолози како централна догма на молекуларната биологија. Во него се наведува дека молекулата на ДНК делува како носител и чувар на генетските информации, кои преку посредник - гласник РНК (мРНК) и со учество на рибозомална (рРНК) и трансферна РНК (тРНК), - се реализира во форма на протеини. Вторите го одредуваат видот и индивидуалниот фенотип.
Ваквата состојба и доделувањето на РНК на улогата на помал учесник во молекуларните перформанси опстојуваше во научната заедница до 80-тите години на минатиот век. Работата на Т. Чек, кој покажа дека РНК може да дејствува како катализатор, нè принуди да ја разгледаме одблизу РНК хемиски реакции. Претходно, се веруваше дека забрзувањето на хемиските процеси во клетката е привилегија на ензимите кои се исклучиво протеинска по природа. Откривањето на каталитичката активност во РНК имаше далекусежни последици - заедно со претходните теоретски дела на К. Воуз и овозможи да се нацрта можна слика за еволуцијата на пребиотиците на нашата планета. Факт е дека од откривањето на функцијата на ДНК како носител на генетски информации, дилемата за она што се појави порано во текот на еволуцијата - ДНК или протеинот неопходен за репродукција на ДНК - изгледаше речиси исто толку филозофска (односно, бесмислена). како прашањето за приматот на изгледот на кокошката или јајцето. По откривањето на Т.Чек, решението добило многу реална форма - пронајдена е молекула која има својства и на носител на информации и на биокализатор (иако во својата рудиментирана форма). Со текот на времето, овие студии прераснаа во цела насока во биологијата, проучувајќи го потеклото на животот низ призмата на таканаречениот „свет на РНК“.
Така стана очигледно дека антички светРНК може да биде поврзана со потеклото и процутот на примарниот живот. Сепак, од ова автоматски не произлегува дека РНК во современите организми не е архаизам прилагоден на потребите на интрацелуларните молекуларни системи, туку навистина важен учесник во молекуларниот ансамбл на клетката. Само развој на молекуларни методи - особено, секвенционирање нуклеински киселини, - покажа дека РНК е навистина есенцијална во клетката, а не само во форма на канонското тројство „mRNA, rRNA, tRNA“. Веќе првите опсежни податоци за секвенционирањето на ДНК укажаа на фактот што на почетокот изгледаше тешко да се објасни - повеќето од нив се покажа дека е некодирање- тоа е, не носи информации за протеински молекули или „стандардна“ РНК. Се разбира, ова може делумно да се припише на „генетски отпад“ - „исклучени“ или изгубени функционални фрагменти од геномот. Но, заштедата на толкава количина „мираз“ за биолошките системи кои се обидуваат да ја трошат енергијата се чини нелогично.
Навистина, подетални и суптилни методи на истражување овозможија да се открие цела класа на РНК регулатори на генската експресија, делумно пополнувајќи го меѓугенскиот простор. Дури и пред да се прочитаат целосните секвенци на еукариотски геноми кај кружните црви C. elegansБеа изолирани микроРНК - мали молекули (околу 20 нуклеотиди) кои можат специфично да се врзат за региони на mRNA според принципот на комплементарност. Лесно е да се погоди дека во такви случаи повеќе не е можно да се читаат информации за кодираните протеини со mRNA: рибозомот едноставно не може да „трча“ низ таква локација што одеднаш станала двоверижна. Овој механизам на супресија на генската експресија, наречен РНК интерференција, веќе е доволно детално анализиран на „биомолекулата“. До денес се откриени илјадници молекули на микроРНК и други некодирачки РНК (пиРНК, сноРНК, наноРНК итн.). Кај еукариотите (вклучувајќи ги и луѓето), тие се наоѓаат во меѓугенски региони. Утврдена е нивната важна улога во клеточната диференцијација, канцерогенезата, имунолошкиот одговор и другите процеси и патологии.
Малите РНК се тројански коњ за бактериски протеини
И покрај фактот дека не-протеинско-кодирачките РНК во бактериите се откриени многу порано од првиотслични регулатори кај еукариотите, нивната улога во метаболизмот на бактериските клетки одамна е прикриена за научната заедница. Ова е разбирливо - традиционално, бактериската клетка се сметаше за попримитивна и помалку мистериозна структура за истражувачот, чија сложеност не може да се спореди со акумулацијата на структури во еукариотска клетка. Покрај тоа, во бактериските геноми содржината на некодирачките информации сочинува само неколку проценти од вкупната должина на ДНК, достигнувајќи максимум 40% кај некои микобактерии. Но, имајќи предвид дека микроРНК се наоѓаат дури и кај вирусите, кај бактериите тие треба да играат важна регулаторна улога, уште повеќе.
Се покажа дека прокариотите имаат доста мали регулатори на РНК. Конвенционално, сите од нив можат да се поделат во две групи:
- РНК молекули кои мора да се врзат за протеините за да ја извршат својата функција.
- РНК кои комплементарно се врзуваат за други РНК (го сочинуваат мнозинството познати регулаторни молекули на РНК).
Првата група вклучува мали РНК за кои е можно, но не и неопходно поврзување со протеини. Добро познат пример е RNase P, која делува како рибозим на „зреење“ tRNA. Меѓутоа, ако RNase P може да функционира без протеинска компонента, тогаш за другите мали РНК од оваа група, врзувањето за протеините е задолжително (а тие самите се, всушност, кофактори). На пример, tmRNA активира комплексен протеински комплекс, дејствувајќи како „главен клуч“ за „заглавен“ рибозом - ако гласникот РНК од кој се чита го достигнала својот крај, а стоп-кодонот не се сретнал.
Познат е уште поинтригантен механизам на директна интеракција на малите РНК со протеините. Протеините кои се врзуваат за „традиционалните“ нуклеински киселини се широко распространети во секоја клетка. Прокариотската клетка не е исклучок. На пример, неговите протеини слични на хистон помагаат правилно да се спакува ДНК-жицата, а специфичните репресорски протеини имаат афинитет за операциониот регион на бактериските гени. Се покажа дека овие репресори можат да бидат инхибирани од мали РНК кои имитираат места за врзување на ДНК „родните“ за овие протеини. Така, на малата РНК CsrB (слика 1) има 18 места „мамка“ кои служат за спречување на протеинот на репресорот CsrA да ја достигне својата вистинска цел - гликогенскиот оперон. Патем, меѓу репресорските протеини кои се губат поради толку мали РНК, постојат регулатори на глобалните метаболички патишта, што овозможува постојано подобрување на инхибиторниот сигнал на малата РНК. На пример, го прави ова мала РНК 6S, „имитирајќи“ протеински фактор σ 70. Со конфигурациската „измама“, окупирајќи ги сврзувачките центри на РНК полимеразата со факторот сигма, го забранува изразувањето на гените за „домаќинство“.
Слика 1. Биоинформатски предвидена секундарна структура на малата РНК CsrB од Vibrio choleraeМ66-2.Малите РНК се едноверижни молекули, но, како и за другите РНК, преклопувањето во стабилна просторна структура е придружено со формирање на области каде што молекулата се хибридизира со себе. Се нарекуваат бројни свиоци на структурата во форма на отворени прстени штикли. Во некои случаи, комбинацијата на шноли и овозможува на РНК да дејствува како „сунѓер“, нековалентно врзувајќи одредени протеини. Но, почесто, молекулите од овој тип се мешаат со ДНК или РНК; во овој случај, просторната структура на малата РНК е нарушена и се формираат нови места на хибридизација со целната молекула. Топлинската карта ја одразува веројатноста дека соодветниот нуклеотиден пар всушност ќе биде поврзан со интрамолекуларна водородна врска; за неспарени делови - веројатноста за формирање на водородни врски со какви било делови во молекулата. Сликата е добиена со помош на програмата RNAfold.
Мали РНК на бактерии интерферираат... и тоа многу успешно!
Механизмот со кој функционираат регулаторите од втората група е, генерално, сличен на оној на регулаторните РНК кај еукариотите - ова е истата интерференција на РНК преку хибридизација со mRNA, само синџирите на самите мали РНК често се подолги - до неколку стотици нуклеотиди ( цм.оризот. 1). Како резултат на тоа, поради малата РНК, рибозомите не можат да читаат информации од mRNA. Иако често, се чини, не доаѓа до ова: добиените комплекси „мала РНК - мРНК“ стануваат цел на RNase (како што е RNase P).
Компактноста и густината на пакувањето на прокариотскиот геном се чувствуваат: ако кај еукариотите повеќето регулаторни РНК се запишани во посебни (најчесто не протеинско-кодирачки) локуси, тогаш многу мали РНК на бактерии може да бидат кодирани во истиот ДНК-регион како и супресираните ген, но на спротивните синџири! Овие РНК се нарекуваат cis-кодирана(антисенс) и мали РНК кои лежат на одредено растојание од потиснатиот дел на ДНК - транс-кодирани. Очигледно, распоредот на cis-RNA може да се смета за триумф на ергономијата: тие можат да се читаат од спротивната нишка на ДНК во моментот на нејзиното одмотување истовремено со целниот транскрипт, што овозможува фино да се контролира количината на синтетизиран протеин.
Малите РНК во транс еволуираат независно од целната mRNA, а низата на регулаторот се менува посилно како резултат на мутации. Можеби оваа ситуација е само корисна за бактериската клетка, бидејќи малата РНК стекнува активност против претходно невообичаени цели, што ги намалува трошоците за време и енергија за создавање други регулатори. Од друга страна, притисокот на селекција спречува транс-малата РНК да мутира премногу бидејќи ќе ја изгуби активноста. Меѓутоа, за да се хибридизираат со гласник РНК, повеќето транс-мали РНК бараат помошник, протеинот Hfq. Очигледно, во спротивно, нецелосната комплементарност на малата РНК може да создаде проблеми за врзување за целта.
Очигледно, потенцијалниот регулаторен механизам заснован на принципот „една мала РНК - многу цели“ помага да се интегрираат метаболичките мрежи на бактеријата, што е исклучително неопходно во услови на краток живот на една клетка. Може да се продолжи со шпекулирање на темата и да се претпостави дека со помош на транс-кодирани мали РНК, изразите „инструкции“ се испраќаат од функционално поврзани, но физички оддалечени локуси. Потребата од ваков вид генетски „прозивка“ е логично објаснета голем број намали РНК пронајдени во патогени бактерии. На пример, неколку стотици мали РНК беа пронајдени во рекордерот за овој индикатор - Vibrio cholerae ( Vibrio cholerae). Ова е микроорганизам кој може да преживее во околната водна средина (и свежа и солена), и на водни школки, и кај риби и во човечките црева - нема начин да се направи без сложена адаптација со помош на регулаторни молекули!
CRISPR го штити здравјето на бактериите
Мали РНК, исто така, се користени во решавањето на друг проблем за бактериите. Дури и најзлобните патогени коки и бацили можат да бидат немоќни пред опасноста што ја претставуваат специјалните вируси - бактериофагите, способни да ја уништат бактериската популација со молскавична брзина. Повеќеклеточните организми имаат специјализиран систем за заштита од вируси - имуни, со помош на клетките и супстанциите што ги лачат, штитејќи го телото од непоканети гости(вклучувајќи ги и оние од вирусна природа). Бактериската клетка е осамена, но не е толку ранлива како што може да изгледа на прв поглед. Локусите делуваат како чувари на рецептите за одржување на антивирусниот имунитет на бактериите CRISPR- групирани редовни-прекинати кратки палиндромски повторувања ( групирани редовно меѓупросторни кратки палиндромски повторувања) (сл. 2; ). Во прокариотските геноми, секоја CRISPR касета е претставена со водечка секвенца долга неколку стотини нуклеотиди, проследена со серија од 2-24 (понекогаш и до 400) повторувања одделени со просторни региони кои се слични по должина, но единствени по нуклеотидна секвенца. Должината на секој разделник и повторување не надминува сто базни парови.

Слика 2. CRISPR локус и обработка на неговата соодветна мала РНК во функционален транскрипт.Во геномот CRISPR- касетата е претставена со разделувачи прошарани еден со друг (на сликата се означени како Сп), делумно хомологни за регионите на фагната ДНК, и се повторува ( Од страна на) Долга 24–48 bp, демонстрирајќи дијадична симетрија. За разлика од повторувањата, разделувачите во истиот локус се исти по должина (кај различни бактерии ова може да биде 20-70 нуклеотиди), но се разликуваат по нуклеотидна секвенца. Секциите за „повторување на растојание“ може да бидат прилично долги и да се состојат од неколку стотици единици. Целата структура е опкружена од едната страна со водечка низа ( ЛП, неколку стотици базни парови). Cas гени се наоѓаат во близина ( В RISPR-какоповрзани), организирани во оперон. Протеините што се читаат од нив вршат голем број на помошни функции, обезбедувајќи обработка на преписот од кој се чита CRISPR-локус, негова успешна хибридизација со целта на ДНК на фагот, вметнување на нови елементи во локусот итн. CrRNA формирана како резултат на повеќестепена обработка се хибридизира со дел од ДНК (долниот дел од сликата) инјектирана од фагот во бактеријата. Ова ја замолчува машината за транскрипција на вирусот и ја запира неговата репродукција во прокариотската клетка.
Детален механизам за појава на сè CRISPR-локусот останува да се проучува. Но, денес, предложен е шематски дијаграм на изгледот на разделувачите, најважните структури во неговиот состав. Излегува дека „ловците на бактерии“ се претепани од сопственото оружје - нуклеинските киселини, поточно, „трофејните“ генетски информации добиени од бактериите од фагите во претходните битки! Факт е дека не сите фаги кои влегуваат во бактериска клетка излегуваат фатални. ДНК на таквите фаги (можеби класифицирани како умерени) се сече со специјални Cas протеини (нивните гени на крило CRISPR) во мали фрагменти. Некои од овие фрагменти ќе бидат вградени во CRISPR- локуси на геномот „домаќин“. И кога ДНК на фагот повторно ќе влезе во бактериската клетка, таа наидува на мала РНК од CRISPR-локус, во тој момент изразен и обработен со Cas протеини. По ова, инактивирањето на вирусните генетски информации се случува според механизмот на интерференција на РНК веќе опишан погоре.
Од хипотезата за формирање на дистанци, не е јасно зошто се потребни повторувања меѓу нив, во еден локус малку различен по должина, но речиси идентичен по низа? Отвора овде широко отворен просторза фантазија. Можеби, без повторувања, би било проблематично да се поделат генетските податоци на семантички фрагменти, слични на секторите на компјутерскиот хард диск, а потоа да се пристапи до машината за транскрипција до строго дефинирани области CRISPR-локусот би станал тежок? Или можеби повторувањата ги поедноставуваат процесите на рекомбинација кога се вметнуваат нови елементи на ДНК на фагот? Или тие се „интерпункциски знаци“ кои се неопходни за обработка на CRISPR? Како и да е, биолошката причина што го објаснува однесувањето на бактериската клетка на начин на Гоголов Пљушкин ќе се најде во догледно време.
CRISPR, како „хроника“ на врската помеѓу бактеријата и фагот, може да се користи во филогенетските студии. Така, неодамна извршено пишување според CRISPRни овозможи да ја разгледаме еволуцијата на поединечните видови на микробот на чумата ( Yersinia pestis). Истражувајте ги CRISPR- „Педигре“ фрли светлина врз настаните пред половина милениум, кога во Монголија влегоа соеви од денешна Кина. Но, не за сите бактерии, а особено за патогени, овој методприменливи. И покрај неодамнешните докази за предвидените протеини за обработка на CRISPR кај патогените на туларемија ( Francisella tularensis) и колера, самите CRISPR, доколку се присутни во нивниот геном, се малку на број. Можеби фагите, со оглед на нивниот позитивен придонес за стекнување на вирулентност од страна на патогените претставници на бактериското царство, не се толку штетни и опасни за одбрана од нив со помош на CRISPR? Или дали вирусите кои ги напаѓаат овие бактерии се премногу разновидни, а стратегијата за „попречување“ на имунитетот на РНК против нив е залудна?

Слика 3. Некои механизми на работа на рибо-прекинувачот. Riboswitches (riboswitches) се вградени во РНК гласник, но се одликуваат со голема слобода на конформациско однесување, во зависност од специфичните лиганди, што дава основа да се сметаат рибо-прекинувачите како независни единици на мали РНК. Промената во конформацијата на платформата за изразување влијае на местото на слетување на рибозомот на mRNA ( RBS), и, како последица на тоа, ја одредува достапноста на целата mRNA за читање. Рибо-прекинувачите се до одреден степен слични на доменот на операторот во класичниот модел лак-оперон - но само аптамерните региони обично се регулирани со нискомолекуларни супстанции и ја менуваат работата на генот на ниво на mRNA, а не на ДНК. А - Во отсуство на лиганди, рибопрекинувачи btuB (кобаламин транспортер)И thiM (зависен од тиамин пирофосфат), кои вршат ненуклеолитичка репресија на mRNA, се „вклучени“ ( НА) и дозволете му на рибозомот да си ја заврши работата. Врзување на лиганд за рибопрекинувач ( ИСКЛУЧЕНО-позиција) доведува до формирање на фиба, што го прави овој регион недостапен за рибозомот. б - Лизински рибопрекинувач lysCво отсуство на лиганд исто така е вклучен ( НА). Исклучувањето на рибо-прекинувачот го блокира рибозомот да пристапи до mRNA. Но, за разлика од рибо-прекинувачите опишани погоре, во лизинскиот прекинувач, кога е исклучен, делот е „изложен“, исечен со специјален комплекс RNase ( деградозомни), и целата mRNA се користи, распаѓајќи на мали фрагменти. Репресијата од рибо-прекинувачот во овој случај се нарекува нуклеолитичка ( нуклеолитички) и е неповратен, бидејќи, за разлика од примерот ( А ), обратно префрлување (назад на НА) повеќе не е можно. Важно е да се напомене дека на овој начин може да се постигне искористување на група „непотребни“ mRNA: рибо-прекинувачот е сличен на дел од детскиот конструктивен сет, а цела група функционално поврзани матрични молекули може да имаат прекинувачи слични во структура.
Riboswitch - сензор за бактерии
Значи, постојат мали РНК кои се поврзуваат со протеини, има мали РНК кои се мешаат со сопствената мРНК на бактериите, а исто така и РНК заробени од бактерии од вируси и ја потиснуваат ДНК на фагот. Дали е можно да се замисли некој друг механизам на регулација користејќи мали РНК? Излегува да. Ако го анализираме она што беше опишано погоре, ќе откриеме дека во сите случаи на антисенс регулација, интерференција на малата РНК и целта е забележана како резултат на хибридизација на две индивидуалнамолекули. Зошто да не организирате мала РНК како дел од самиот препис? Тогаш е можно, со менување на конформацијата на таков „погрешно сместен Козак“ во мРНК, да се промени пристапноста на целиот шаблон за читање при преведување или, што е уште поенергетски целисходно, да се регулира биосинтезата на mRNA, т.е. транскрипција!
Таквите структури се широко присутни во бактериските клетки и се познати како рибо-прекинувачи ( рибо-прекинувач). Тие се наоѓаат пред почетокот на кодираниот дел од генот, на 5' крајот на mRNA. Конвенционално, во составот на рибо-прекинувачите може да се разликуваат два структурни мотиви: аптамерски регион, одговорен за врзување со лигандот (ефектор) и платформа за изразување, обезбедувајќи регулација на генската експресија преку транзиција на mRNA во алтернативни просторни структури. На пример, таков прекинувач (тип „исклучен“) се користи за работа лизински оперон: кога има вишок на лизин, тој постои во форма на „заплеткано“ просторна структура, што го блокира читањето од оперонот, а доколку има недостаток од него, рибо-прекинувачот се „одмотува“ и се синтетизираат протеините неопходни за биосинтеза на лизин (сл. 3).
Опишаниот шематски дијаграм на уредот со рибо-прекинувач не е канон, има варијации. Во Vibrio cholerae е откриен љубопитен „вклучен“ тандемски прекинувач: на платформата за изразување и претходи два одеднашаптамерски регион. Очигледно, ова обезбедува поголема чувствителност и помазен одговор на појавата на друга амино киселина во клетката - глицин. Можеби, „двојниот“ рибо-прекинувач во геномот на патогенот, сличен по принцип на дејство, индиректно е вклучен во високата стапка на преживување на бактеријата антракс (Bacillus anthracis). Тој реагира на соединение кое е дел од минималниот медиум и е од витално значење за овој микроб - тиамин пирофосфат.
Покрај менувањето на метаболичките патишта во зависност од „менито“ достапно за бактериската клетка, рибо-прекинувачите можат да бидат сензори за бактериска хомеостаза. Така, тие беа забележани во регулирањето на достапноста на генот за читање кога функционирањето на системот за превод внатре во клетката е нарушено (на пример, сигнали како што се појавата на „ненаполнети“ tRNA и „неисправни“ (закочени) рибозоми ), или кога факторите на околината се менуваат (на пример, зголемување на температурата) .
Нема потреба од протеини, дајте ни РНК!
Значи, што значи присуството на таква разновидност на мали регулатори на РНК во бактериите? Дали ова укажува на отфрлање на концептот каде што протеините се главни „менаџери“ или гледаме друг моден тренд? Очигледно, ниту едното ниту другото. Се разбира, некои мали РНК се глобални регулатори на метаболичките патишта, како што е споменатиот CsrB, кој е вклучен, заедно со CsrC, во регулирањето на складирањето на органски јаглерод. Но, со оглед на принципот на удвојување на функциите во биолошките системи, бактериските мали РНК може да се споредат со „менаџер со кризи“ наместо со извршен директор. Така, во услови кога за опстанок на микроорганизам е потребно брзого реконфигурираат интрацелуларниот метаболизам, нивната регулаторна улога може да биде одлучувачка и поефикасна од онаа на протеините со слични функции. Така, регулаторите на РНК се одговорни, наместо, за брз одговор, помалку стабилен и сигурен отколку во случајот со протеините: не треба да заборавиме дека малата РНК ја одржува својата 3Д структура и се држи на инхибираната матрица со слаби водородни врски.
Веќе споменатите мали РНК на Vibrio cholerae можат да обезбедат индиректна потврда на овие тези. За оваа бактерија влегувањето во човечкото тело не е посакувана цел, туку, очигледно, итна ситуација. Производството на токсини и активирањето на други патишта поврзани со вирулентноста во овој случај е само одбранбена реакција на агресивното спротивставување на околината и телесните клетки на „странци“. „Спасителите“ овде се малите РНК, на пример Qrr, кои му помагаат на вибриото, во стресни услови, да ја модифицира својата стратегија за преживување, менувајќи го колективното однесување. Оваа хипотеза може индиректно да се потврди со откривањето на малата РНК VrrA, која активно се синтетизира кога вибриите се во телото и го потиснува производството на мембрански протеини Omp. „Скриените“ мембрански протеини во почетната фаза на инфекцијата може да помогнат да се избегне моќен имунолошки одговор од човечкото тело (сл. 4).

Слика 4. Мали РНК во спроведувањето на патогените својства на Vibrio cholerae. А - Vibrio cholerae се чувствува добро и добро се размножува во водната средина. Човечкото тело веројатно не е главната еколошка ниша за овој микроб. б - Еднаш низ водата или прехранбениот пат на пренос на инфекцијата во агресивна средина - човечкото тенко црево - вибриите, во смисла на организирано однесување, почнуваат да личат на псевдо-организам, чија главна задача е да го ограничи имунолошкиот одговор и создаваат поволна средина за колонизација. Големо значењеМембранските везикули се одговорни за координирање на дејствата во рамките на бактериската популација и нивната интеракција со телото. Не целосно разбраните фактори на животната средина во цревата дејствуваат како сигнали за изразување на мали РНК (на пример, VrrA) во вибрионите. Како резултат на тоа, се активира механизмот на формирање на везикули, кои се неимуногени кога бројот на Vibrio клетките во цревата е мал. Покрај опишаниот ефект, малите РНК помагаат да се „сокријат“ мембранските протеини на Omp кои се потенцијално провокативни за човечкиот имунолошки систем. Со индиректно учество на малите РНК Qrr1-4, се активира интензивно производство на токсин од колера (не е прикажано на сликата), што го надополнува опсегот на адаптивни реакции на Vibrio cholerae. В - Во рок од неколку часа, бројот на бактериски клетки се зголемува, а збирот на мали VrrA РНК се намалува, што веројатно доведува до изложување на мембрански протеини. Бројот на „празни“ везикули, исто така, постепено се намалува, и во оваа фаза тие се заменуваат со имуногени доставени до ентероцитите. Очигледно, ова е дел од „планот“ за спроведување на комплексен сигнал, чие значење е да се испровоцира евакуација на вибриите од човечкото тело. Забелешка: односот на големината на бактериските клетки и ентероцитите не е забележан.
Ќе биде интересно да се види како нашето разбирање за малите регулатори на РНК ќе се промени кога ќе се добијат нови податоци на платформите RNAseq, вклучително и за слободните и некултурните форми. Неодамнешната работа со користење на „длабоко секвенционирање“ веќе даде неочекувани резултати, што укажува на присуство на молекули слични на микроРНК во мутантните стрептококи. Се разбира, на таквите податоци им е потребна внимателна двојна проверка, но како и да е, можеме со сигурност да кажеме дека проучувањето на малите РНК во бактериите ќе донесе многу изненадувања.
Признанија
Оригиналните идеи и композицискиот дизајн при креирањето на насловната слика, како и сликата 4, припаѓаат на дипломец на Институтот за архиологија на Јужниот федерален универзитет Копаева Е.А. Присуството на Слика 2 во статијата е заслуга на вонреден професор на катедрата. Зоологија СФУ Г.Б. Бахтаџе. Тој, исто така, изврши научна лекторирање и ревизија на насловната фигура и Слика 4. Авторот им изразува длабока благодарност за нивното трпение и креативниот пристап кон ова прашање. Посебна благодарност до мојот колега, виш истражувач. лабораторија. биохемија на микроби на Ростовскиот институт против чума Сорокин В.М. за дискусија за текстот на статијата и давање вредни коментари.
Литература
- Карл Воуз (1928–2012) ;;. 80 , 1148-1154;
- R. R. Брејкер. (2012). Рибо-прекинувачи и светот на РНК. Перспективите на пристаништето на Колд Спринг во биологијата. 4 , a003566-a003566;
- Ј. Патрик Бардил, Брајан К. Хамер. (2012). Некодирачките sRNA ја регулираат вирулентноста во бактерискиот патоген Vibrio cholerae. РНК биологија. 9 , 392-401;
- Хеон-Џин Ли, Су-Хјунг Хонг. (2012). Анализа на мали РНК со големина на микроРНК во Streptococcus mutans со длабоко секвенционирање. FEMS Microbiol Lett. 326 , 131-136;
- М.-П. Карон, Л. Бастет, А. Лусиер, М. Симонео-Рој, Е. Мас, Д.А. Лафонтен. (2012). Контрола на рибо-прекинувач со двојно дејство на иницијација на транслација и распаѓање на mRNA. Зборник на трудови на Националната академија на науките. 109 , E3444-E3453.
А.М. Дејхман, С.В.Зиновиев, А.Ју.Баришников
ГЕНСКО ИЗРАЗУВАЊЕ И МАЛИ РНК ВО ОНКОЛОГИЈАТА
GU RONC im. Н.Н.Блохин ОВНИ, Москва
РЕЗИМЕ
Статијата ја прикажува улогата на малите РНК кои ги контролираат повеќето од виталните функции на клетката и телото, и нивната можна поврзаност, особено, со онкогенезата и другите (вклучувајќи хипотетички) интрацелуларни механизми на геномска експресија.
Клучни зборови: мали РНК, интерференција на РНК (РНКи), двоверижна РНК (дсРНК), уредување на РНК, онкогенеза.
А.М. Дајхман, С.В.Зиновиев, А.Ју.Баришников.
ГЕНСКИОТ ИЗРАЗ И МАЛИ РНК ВО ОНКОЛОГИЈАТА
Н.Н. Руски центар за истражување на рак Блохин RAMS, Москваох
АПСТРАКТ
Во трудот е претставена улогата на малите РНК кои ги надгледуваат мнозинските витални функции на клетката и организмот и можната нивна поврзаност особено со онкогенезата и другите (вклучувајќи хипотетички) интрацелуларни механизми на изразување на геномот.
Клучни зборови: Мали РНК, интерферентни РНК (РНКи), РНК со двострана (дсРНК), уредување на РНК, туморогенеза.
Вовед
Изразот на поединечни гени и цели еукариотски геноми, вклучувајќи обработка, разни видови транскрипција, спојување, преуредување, уредување на РНК, рекомбинација, превод, интерференција на РНК, е регулирано со одредени протеини (производи на регулаторни, структурни, хомеотски гени, фактори на транскрипција) , мобилни елементи, РНК и ефектори со ниска молекуларна тежина. Меѓу обработувачките РНК се rRNA, tRNA, mRNA, некои видови на регулаторна РНК и мала РНК.
Сега е познато дека малите РНК не ги кодираат протеините, често се бројат во стотици по геном, и се вклучени во регулирањето на изразувањето на различни еукариотски гени (соматски, имунолошки, герминални, матични клетки). Процесите на диференцијација (хематопоеза, ангиогенеза, адипогенеза, миогенеза, неврогенеза), морфогенеза (вклучувајќи ембрионални фази, развој/раст, физиолошка регулација), пролиферација, апоптоза, канцерогенеза, мутагенеза, имуногенеза, стареење (продолжување на животот), епигенетско замолчување; забележани се случаи на метаболичко регулирање (на пример, гликосфинголипиди). Поширока класа на некодирачки РНК од 20-300/500 нуклеотиди и нивните РНП се наоѓаат не само во јадрото/јадрото/цитоплазмата, туку и во клеточните органели кои содржат ДНК (животински митохондрии; микроРНК и мали консензусни секвенци за транскрипти на хлоропласт се пронајдени во РНК на растенијата).
За контрола и регулирање на с.н. процеси, важно е: 1. дека малите природни/вештачки РНК (мали РНК, tRNA, итн.) и нивните комплекси со протеини (РНП) се способни за трансмембрански клеточен и митохондријален транспорт; 2. дека по разградувањето на митохондриите дел од нивната содржина РНК и РНП може да заврши во цитоплазмата и јадрото. Наведените својства на малите РНК (СРНК), чија функционално значајна улога само се зголемува во процесот на проучување, очигледно имаат врска со факторот на будност за рак и други генетски болести. Во исто време, стана јасно високото значење на епигеномските модификации на хроматин во појавата на тумори. Ќе разгледаме само многу ограничен број случаи од многу слични.
Мали РНК
Механизмот на дејство на малите РНК е нивната способност речиси комплементарно да се врзат за 3"-непреведените региони (3"-UTRs) на целните mRNA (кои понекогаш содржат ДНК/РНК транспонирачки елементи MIR/LINE-2, како и конзервативен Alu се повторува ) и предизвикува интерференција на РНК (РНКи=РНКи; особено за време на антивирусен одговор). Меѓутоа, компликацијата е што покрај клеточните, има и мали РНК кодирани со вируси (херпес, SV40 итн.; EBV, на пример, содржи 23, а KSHV - 12 miRNA) кои комуницираат со транскриптите на двете вирусот и домаќинот. Само повеќе од 5 илјади клеточни/вирусни miRNAs се познати во 58 видови. RNAi иницира или деградација (со учество на комплексот RISC, комплекс за замолчување индуциран од РНК) долж фрагменти ранливи на нуклеаза од континуирани lncRNA спирали (двојно-верижна РНК mRNA, итн.), или делумно реверзибилна инхибиција на дисконтинуирано спирална lncRNA за време на транслацијата на целни мРНК. Зрели мали РНК (~ 15-28 нуклеотиди) се формираат во цитоплазмата од нивните нуклеарно обработени прекурсори со различна должина (десетици и стотици нуклеотиди). Дополнително, малите РНК се вклучени во формирањето на тивката структура на хроматин, регулирањето на транскрипцијата на поединечните гени, супресијата на експресијата на транспозоните и одржувањето на функционалната структура на проширените региони на хетерохроматин.
Постојат неколку главни типови на мали РНК. Најдобро проучени се микроРНК (миРНК) и малите интерферентни РНК (сиРНК). Покрај тоа, меѓу малите РНК, се проучуваат: пиРНК активни во герминалните клетки; мали интерферентни РНК поврзани со ендогени ретротранспонзони и елементи што се повторуваат (со локална/глобална хетерохроматизација - почнувајќи од раните фази на ембриогенезата; одржување на нивото на теломерите), Drosophila rasiRNAs; често кодирани од интрони на протеински гени и функционално важни при транслација, транскрипција, спојување (де-/метилација, псеудуридилација на нуклеинските киселини) мали нуклеарни (snRNAs) и нуклеоларни (snoRNAs) RNA; мали модулаторни РНК, smRNA, со малку познати функции, комплементарни со мотивите NRSE (Невронски рестриктивен елемент за придушување) што се врзува за ДНК; растителни трансактивирачки мали интерферентни РНК, тасиРНК; кратки шноли RNA, shRNA, кои обезбедуваат долгорочно RNAi (стабилно замолчување на гените) на долги lncRNA структури за време на антивирусниот одговор кај животните.
Малите РНК (миРНК, сиРНК, итн.) стапуваат во интеракција со новосинтетизираните транскрипти на јадрото/цитоплазмата (регулирање на спојување, транслација на мРНК; метилација/псевдууридилација на РРНК, итн.) и хроматин (за време на привремена локална и епигенетски наследена хетерохроматизација на диохроматизирање герминативни клетки). Хетерохроматинизацијата, особено, е придружена со де-/метилација на ДНК, како и метилација, ацетилација, фосфорилација и убиквитинација на хистоните (модификација на „хистонскиот код“).
Првите меѓу малите РНК беа miRNA на нематодата Caenorhabditis elegans (lin-4), нивните својства и гени, а нешто подоцна и miRNA на растението Arabidopsis thaliana. Во моментов тие се поврзани со повеќеклеточни организми, иако тие се прикажани во едноклеточната алга Chlamydomonas reinhardtii и патеките за замолчување слични на RNAi, во врска со антивирусна/слична заштита која вклучува т.н. psiRNAs, дискутирани за прокариоти. Геномите на многу еукариоти (вклучувајќи Drosophila и луѓето) содржат неколку стотици miRNA гени. Овие гени специфични за фаза/ткиво (како и нивните соодветни целни mRNA региони) често се високо хомологни кај филогенетски далечните видови, но некои од нив се специфични за лозата. МиРНК се содржани во егзони (кодирање на протеини, РНК гени), интрони (најчесто пред-мРНК), меѓугенски разделувачи (вклучувајќи повторувања), имаат должина до 70-120 нуклеотиди (или повеќе) и формираат јамка/стебло за фиба. структури. За одредување на нивните гени, не се користат само биохемиски и генетски пристапи, туку и компјутерски пристапи.
Најтипична должина на „работниот регион“ на зрелите miRNA е 21-22 нуклеотиди. Овие се можеби најбројните гени кои не ги кодираат протеините. Тие можат да бидат лоцирани во форма на единечни копии (почесто) или кластери кои содржат многу слични или различни гени на miRNAs, транскрибирани (често од автономни промотери) како подолг прекурсор, обработени во неколку фази до поединечни miRNAs. Се верува дека постои регулаторна мрежа на miRNA која контролира многу фундаментални биолошки процеси (вклучувајќи туморигенеза/метастаза); веројатно најмалку 30% од гените изразени на човекот се регулирани со miRNAs.
Овој процес ги вклучува ензимите слични на lncRNA-RNase III Drosha (нуклеарна рибонуклеаза; иницира обработка на интроничните пред-miRNA по спојувањето на главниот транскрипт) и Dicer, кој функционира во цитоплазмата и ја расцепува/разградува, соодветно, фиба пред МиРНК (за созревање на МИРНК) и хибридни миРНК/мРНК структури формирани подоцна. Мали РНК, заедно со неколку протеини (вклучувајќи vn RNases, AGO-фамилијарни протеини, трансметилази/ацетилази итн.) и со учество на т.н. Комплексите слични на RISC и RITS (вториот индуцира замолчување на транскрипцијата) се способни, соодветно, да предизвикаат RNAi/деградација и последователно замолчување на генот на нивоата на РНК (пред/за време на транслацијата) и ДНК (за време на транскрипција на хетерохроматин).
Секоја miRNA потенцијално се спарува со повеќе цели и секоја цел е контролирана од голем број miRNAs (потсетува на уредувањето на пред-mRNA посредувано од gRNA во трипанозомските кинетопласти). Ин витро анализата покажа дека регулацијата на miRNA (како и уредувањето на РНК) е клучен пост-транскрипциски модулатор на генската експресија. Слични miRNA кои се натпреваруваат за истата цел се потенцијални трансрегулатори на РНК-РНК и РНК-протеинските интеракции.
Кај животните, miRNAs најдобро се проучуваат кај нематодата Caenorhabditis Elegans; опишани се повеќе од 112 гени. Илјадници ендогени siRNAs (нема гени; поврзани, особено, со транскрипти и транспозони посредувани од сперматогенезата) се исто така пронајдени овде. И двете мали РНК на метазоаните може да се генерираат од РНК полимерази кои покажуваат активност (не хомологија) на RdRP-II (како и за повеќето други РНК) и RdRP-III типови. Зрелите мали РНК се слични по состав (вклучувајќи ги терминалните 5"-фосфати и 3"-OH), должината (обично 21-22 нуклеотиди) и функцијата и можат да се натпреваруваат за истата цел. Сепак, деградацијата на РНК, дури и со целосна целна комплементарност, почесто се поврзува со siRNAs; преводна репресија, со делумна, обично 5-6 нуклеотиди, комплементарност - со miRNAs; и прекурсорите, соодветно, се егзо-/ендогени (стотици/илјадници нуклеотиди) за siRNA, и обично ендогени (десетици/стотици нуклеотиди) за miRNA и нивната биогенеза е различна; сепак, во некои системи овие разлики се реверзибилни.
RNAi, со посредство на siRNA и miRNAs, има различни природни улоги: од регулирање на генската експресија и хетерохроматин до заштита на геномот од транспозони и вируси; но siRNA и некои miRNA не се зачувани помеѓу видовите. Кај растенијата (Arabidopsis thaliana) пронајдени се следново: siRNA кои одговараат и на гените и на меѓугенските (вклучувајќи ги разделувачите, повторувачките) региони; огромен број на потенцијални геномски локации за различни типови на мали РНК. Нематодите имаат и т.н променлива автономно изразена 21U-RNAs (dasRNAs); тие имаат 5"-Y-монофосфат, содржат 21 нуклеотид (20 од нив се променливи) и се наоѓаат помеѓу или внатре во интроните на гените за кодирање на протеините на повеќе од 5700 места во два региони на хромозомот IV.
MiRNAs играат важна улога во генската експресија во здравјето и болестите; кај луѓето има најмалку 450-500 такви гени. Обично се врзуваат за 3"-UTR регионите на mRNA (други цели), тие можат селективно и квантитативно (особено, кога се отстрануваат производите на гените со низок израз од циркулацијата) да ја блокираат работата на некои гени и активноста на други гени. се покажа дека групите на профили на изразени микро-РНК (и нивните цели) динамично се менуваат за време на онтогенезата, диференцијацијата на клетките и ткивата. Овие промени се специфични, особено за време на кардиогенезата, процесот на оптимизирање на големината на должината на дендритите и број на синапси нервна клетка(вклучувајќи miRNA-134, други мали РНК), развој на многу патологии (онкогенеза, имунодефициенција, генетски заболувања, паркинсонизам, Алцхајмерова болест, офталмолошки нарушувања (ретинобластом, итн.) поврзани со инфекции од различна природа). Вкупниот број на откриени miRNA расте многу побрзо од описот на нивната регулаторна улога и поврзаноста со специфични цели.
Пресметковната анализа предвидува стотици цели на мРНК за поединечни миРНК и регулација на поединечни мРНК со повеќе миРНК. Така, miRNAs може да служат за елиминирање на транскриптите на целните гени, или фино подесувањенивното изразување на транскрипциско/преведувачко ниво. Теоретско разгледување и експериментални резултатиго поддржуваат постоењето на различни улоги за miRNAs.
Поцелосен список на аспекти поврзани со фундаменталната улога на малите РНК во еукариотите во процесите на раст/развој и во некои патологии (вклучувајќи ја епигеномијата на ракот) е рефлектирана во прегледот.
Мали РНК во онкологијата
Процесите на раст, развој, прогресија и метастазирање на туморите се придружени со многу епигенетски промени кои се развиваат во поретки, постојано наследни генетски промени. Ретките мутации, сепак, можат да имаат голема тежина (за одредена индивидуа, нозологија), бидејќи во однос на поединечни гени (на пример APC, K-ras, p53) т.н Ефект на „инка“ поврзан со речиси неповратен развој/последици од рак. Тумор-специфичната хетерогеност на прогениторните клетки во однос на профилот на изразување на различни гени (протеини, РНК, мали РНК) се одредува со придружните варијации во реструктуираните епигеномски структури. Епигеномот е модулиран со метилација, пост-транслациони модификации/замени на хистони (со не-канонски), ремоделирање на нуклеозомската структура на гените/хроматин (вклучувајќи геномско втиснување, т.е. дисфункција на изразувањето на алели на родителскиот геном и ). Сето ова, и со учество на РНКи регулирани со мали РНК, доведува до појава на неисправни хетерохроматски (вклучувајќи хипометилирани центромерни) структури.
На формирањето на генски специфични мутации може да му претходи познатата акумулација на стотици илјади соматски клонални мутации во едноставни повторувања или микросателити на некодирачки (ретко кодирање) регион - барем кај тумори со фенотип на микросателитски мутатор (MMP). ; тие сочинуваат значителен дел од колоректалниот карцином, како и на белите дробови, желудникот, ендометриумот, итн. го контролира изразот (интрони, интергени) отколку во кодираните (екзонски) региони на геномот на микросателитски нестабилни, MSI+, тумори. Иако природата на изгледот и механизмите на локализација на MS-стабилните/нестабилните региони не се целосно јасни, формирањето на нестабилност на МС е во корелација со фреквенцијата на мутации на многу гени кои претходно не биле мутирани во туморите на MSI+ и веројатно ги канализирале патиштата на нивната прогресија; Покрај тоа, фреквенцијата на повторувачки мутации на MSI кај овие тумори се зголеми за повеќе од два реда на големина. Не се анализирани сите гени за присуство на повторувања, но нивниот степен на мутабилност во кодираните/некодирачките региони е различен, а точноста на методите за одредување на фреквенцијата на мутациите е релативна. Важно е дека некодирачките региони на MSI-променливи повторувања често се биалелни, додека регионите за кодирање се моноалелични.
Глобалното намалување на метилацијата кај туморите е типично за повторувања, транспонирани елементи (ТЕ; нивната транскрипција се зголемува), промотери, CpG места на гените за супресор на туморот miRNA и е во корелација со хипертранскрипцијата на ретротранспозоните во прогресивните канцерогени клетки. Вообичаено, флуктуациите во „метиломот“ се поврзани со „метилациски бранови“ специфични за родител/фаза/ткиво и силна метилација на центромерните сателитски региони на хетерохроматин, регулирани со мали РНК. Кога сателитите се недоволно метилирани, добиената хромозомска нестабилност е придружена со зголемена рекомбинација, а нарушувањето на МЕ метилацијата може да предизвика нивно изразување. Овие фактори придонесуваат за развој на туморски фенотип. Терапијата со мала РНК може да биде многу специфична, но мора да се контролира бидејќи целите може да бидат не само индивидуални, туку и многу мРНК/РНК молекули и новосинтетизирани РНК од различни (вклучувајќи некодирачки меѓугенски повторувања) региони на хромозомите.
Поголемиот дел од човечкиот геном е составен од повторувања и МЕ. Ретротранспозонот L1 (ЛИНК елемент) содржи, како и ендогени ретровируси, реверзаза (RTase), ендонуклеаза и е потенцијално способен да пренесува неавтономни (Alu, SVA, итн.) ретроелементи; замолчувањето на елементите слични на L1 се јавува како резултат на метилација на местата на CpG. Забележете дека меѓу CpG местата на геномот, CpG островите на генските промотори се слабо метилирани, а самиот 5-метилцитозин е потенцијално мутагена база, деаминирана во тимин (хемиски или со учество на уредување на РНК/(ДНК), ДНК поправка); сепак, некои од CpG островите се предмет на прекумерна аберантна метилација, придружена со репресија на супресорните гени и развој на рак. Понатаму: РНК-врзувачкиот протеин кодиран од L1, во интеракција со протеините AGO2 (Argo-naute семејство) и FMRP (кршлив протеин за ментална ретардација, протеин на ефекторниот комплекс RISC), го промовира движењето на елементот L1 - што укажува на можна меѓусебна регулација на системите RNAi и ретропозиција на елементите на човечки ЛИНИЈА. Важно е, особено, повторувањата на Алу да можат да се преселат во регионот на интрон/екзон на гените.
Овие и слични механизми можат да ја подобрат патолошката пластичност на геномот на туморските клетки. Супресијата на RTase (кодирана, како ендонуклеазата, со L1 елементи; RTase е исто така кодирана од ендогени ретровируси) преку механизмот RNAi беше придружена со намалување на пролиферацијата и зголемена диференцијација во голем број клеточни линии на рак. Кога елементот L1 беше воведен во прото-онкоген или супресорен ген, беа забележани прекини на ДНК со двојни жици. Во герминативните ткива (глувци/човек), нивото на изразување на L1 беше зголемено, а неговата метилација зависеше од системот за замолчување поврзан со piRNAs-(26-30-bp), каде што протеините PIWI се варијанти на големото семејство на протеини Argo-naute , мутации во кои тие доведуваат до деметилација/дерепресија на елементите слични на L1 со долги терминални повторувања. Протеините PIWI, во поголема мера од протеините Dicer-1/2 и Ago, се поврзани со патеките за замолчување на rasiRNAs. Патеките на замолчување посредувани од пиРНК/сиРНК се реализираат преку интрануклеарни тела кои содржат големи еволутивно конзервирани мултипротеински PcG комплекси, чии функции често се нарушени во клетките на туморот. Овие комплекси се одговорни за дејство на долг дострел (на повеќе од 10 kb, помеѓу хромозомите) и го регулираат кластерот на HOX гени одговорни за планот на телото.
Може да се развијат нови принципи на антисенс терапија земајќи го предвид знаењето за поспецифичните (од хистоно-модифицираните инхибитори на ДНК/протеинската метилација) антитуморни епигеномски агенси, основните принципи на замолчувањето на епигеномната РНК и улогата на малите РНК во канцерогенезата.
Микро-РНК во онкологијата
Познато е дека зголемениот раст на туморот и метастазите може да бидат придружени со зголемување на некои и намалување на експресијата на други поединци/групи на miRNAs (Табела 1). Некои од нив може да имаат предизвикувачка улога во туморигенезата; па дури и истите miRNAs (како miR-21/-24) во различни туморски клетки може да покажат и онкогени и супресивни својства. Секој тип на човечки малигнен тумор јасно се разликува по неговиот „отпечаток од прст miRNA“, а некои miRNA може да функционираат како онкогени, туморски супресори, иницијатори на клеточна миграција, инвазија и метастази. Во патолошки изменетите ткива, често се наоѓаат намалени количини на клучните miRNAs кои веројатно се вклучени во антиканцерогените одбранбени системи. MiRNAs (miRs) вклучени во онкогенезата ја формираа идејата за т.н. „oncomirah“: анализата на изразот на повеќе од 200 miRNA во над 1000 примероци на лимфоми и цврсти канцери овозможи успешно да се класифицираат туморите во подтипови според нивното потекло и фаза на диференцијација. Функциите и улогата на miRNAs се успешно проучени со користење на: анти-miR олигонуклеотиди модифицирани (за да се зголеми животниот век) во 2"-O-метил и 2"-O-метоксиетил групи; како и LNA олигонуклеотиди, во кои атомите на рибоза кислород во позициите 2" и 4" се поврзани со метиленски мост.
(Табела 1)………………….
Тумор | miRNAs |
Рак на белите дробови | 17-92 , нека-7↓ , 124а↓ , 126 ↓ , 143 ↓ , 145 ↓ , 155 , 191 , 205 , 210 |
Рак на дојка | 21 , 125б↓ , 145 ↓ , 155 |
Рак на простата | 15а ↓ , 16-1 ↓ , 21 , 143 ↓ ,145 ↓ |
Рак на дебелото црево | 19а , 21 , 143 ↓ , 145 ↓ |
Рак на панкреасот | 21 , 103 , 107 , 155 v |
Рак на јајчник | 210 |
Хронична лимфоцитна леукемија | 15а ↓ , 16-1 ↓ , 16-2 , 23 б , 24-1 , 29 ↓ , 146 , 155 , 195 , 221 , 223 ↓ |
Табела 1 .
miRNA чиј израз се зголемува () или се намалува ( ↓ ) кај некои од најчестите тумори во споредба со нормалните ткива (види и исто така).
Се верува дека регулаторната улога на изразување, исчезнување и засилување на miRNA гените во подложноста на иницијација, раст и прогресија на повеќето тумори е значајна, а мутациите во паровите miRNA/целна mRNA се синхронизирани. Профилот на изразување на miRNA може да се користи за класификација, дијагноза и клиничка прогноза во онкологијата. Промените во изразувањето на miRNA може да влијаат на клеточниот циклус, програмата за преживување на клетката. Мутациите на miRNA во матичните и соматските клетки (како и изборот на полиморфни варијанти на целите на mRNA) може да придонесат, па дури и да играат клучна улога во растот, прогресијата и патофизиологијата на многу (ако не и сите) малигни тумори. Со помош на miRNAs можна е корекција на апоптозата.
Покрај поединечните miRNAs, откриени се кластери од нив, кои дејствуваат како онкоген кој предизвикува развој, особено, на рак на хематопоетско ткиво кај експериментални глувци; МиРНК гените со онкогени и супресорни својства може да се лоцираат во истиот кластер. Кластерската анализа на профилите на изразување на miRNA во туморите овозможува да се одреди неговото потекло (епител, хематопоетско ткиво, итн.) и да се класифицираат различни тумори на исто ткиво со неидентични механизми за трансформација. Проценката на профилот на изразување на miRNAs може да се изврши со користење на нано-/микронизи; Точноста на таквата класификација, при развивање на технологијата (што не е лесно), се покажува дека е поголема од користењето на профили на mRNA. Некои од miRNA се вклучени во диференцијацијата на хематопоетските клетки (глувче, човек), иницирање на прогресијата на канцерогените клетки. Човечките miRNA гени често се наоѓаат во т.н. „Кревки“ места, области со доминација на бришења/вметнувања, прекини на точки, транслокации, транспозиции, минимално избришани и засилени региони на хетерохроматин вклучени во онкогенезата.
Ангиогенеза . Улогата на miRNAs во ангиогенезата е веројатно значајна. Зголемената ангиогенеза кај некои човечки аденокарциноми активирани од Myc беше придружена со промени во моделот на изразување на некои miRNA, а генската нокадаун на другите miRNA доведе до слабеење и потиснување на растот на туморот. Растот на туморот беше проследен со мутации во гените K-ras, Myc и TP53, зголемено производство на ангиогениот VEGF фактор и степенот на васкуларизација поврзана со Myc; додека антиангиогените фактори Tsp1 и CTGF беа потиснати од miR-17-92 и други кластер-асоцирани miRNAs. Туморската ангиогенеза и васкуларизацијата беа подобрени (особено кај колоноцитите) со коекспресија на два онкогени наместо еден.
Неутрализацијата на антиангиогениот фактор LATS2, инхибитор на киназа зависна од животинско циклин (CDK2; човек/глувче), со miRNAs-372/373 („потенцијални онкогени“) го стимулира растот на туморот на тестисите без да го оштети генот p53.
Потенцијални модулатори на ангиогените својства (ин-витро/ин-виво) се miR-221/222, чии цели, рецепторите на c-Kit (други), се фактори на ангиогенеза на ендотелијалните венски HUVEC клетки на папочната врвца итн. Овие miRNA и c-Kit комуницираат како дел од сложениот циклус кој ја контролира способноста на ендотелните клетки да формираат нови капилари.
Хронична лимфоцитна леукемија (ХЛЛ). Кај Б-клеточната хронична лимфоцитна леукемија (CLL), намалено ниво на генска експресија miR-15a/miR-16-1 (и други) е забележано во регионот 13q14 на човечкиот хромозом - местото на најчестите структурни абнормалности ( вклучувајќи ги и бришењата на регионот од 30 kb), иако геномот изразува стотици човечки зрели и пред-miRNAs. Двете miRNAs, потенцијално ефикасни во терапијата на туморот, содржеа антисенс региони на антиапоптотичниот протеин Bcl2, ја потиснаа неговата прекумерна експресија, стимулираа апоптоза, но беа речиси/целосно отсутни во две третини од „девијантните“ клетки на CLL. Честите мутации на секвенционирани miRNAs во матични/соматски клетки беа идентификувани кај 11 од 75 пациенти (14,7%) со фамилијарна предиспозиција за CLL (непознат начин на наследување), но не и кај 160 здрави пациенти. Овие набљудувања покренуваат шпекулации за директното функционирање на miRNAs во леукемогенезата. Во моментов, не е сè познато за врската помеѓу нивоата на генска експресија на miRNAs (и нивните функции) и другите гени во нормалните/туморските клетки.
ДокументРелевантност. Дисфункција на фацијалниот нерв за време на операцијата на паротидната плунковна жлезда е една од тековни проблемии се определува и од преваленцата на болеста и од значителната фреквенција
Досон црква - генијот е во вашите гени епигенетската медицина и новата биологија на намерите книга од библиотеката www e - puzzle ru книга од библиотеката www e - puzzle ru содржина
КнигаЕтика духовност онкологија хив п гарјаев* резиме на енфи
ДокументОваа статија се одразува Нов изгледза проблемот со онкологијата и ХИВ инфекцијата во светлината на лингвистичката-бранова генетика (LWG) и Теоријата за кодирање на суштината (ESC) заснована на руската и другите социо-културни реалности.
Онколошки истражувачки центар и Блохина Одинцова Анастасија Сергеевна нови режими на хемотерапија за напреднат и рекурентен рак на грлото на матката 14.01.12 – онкологија
Теза4.4. Определување на изоензимскиот ген на уридин глукоронил трансфераза (UGT1A1) во крвниот серум на пациенти со рак на грлото на матката кои примале хемотерапија од прва линија со иринотекан со деривати на платина 105