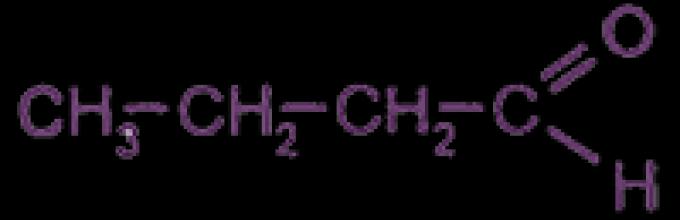(за наједноставниот алдехид R=H)
Класификација на алдехиди
Според структурата на јаглеводородниот радикал:
Граница; На пример:

Неограничено; На пример:

Ароматични; На пример:

Алициклични; На пример:

Општа формула на заситени алдехиди

Хомологни серии, изомеризам, номенклатура

Алдехидите се изомерни на друга класа соединенија, кетони.

На пример:

Алдехидите и кетоните содржат карбонилна група ˃C=O и затоа се нарекуваат карбонилни соединенија.
Електронска структура на молекулите на алдехид
Јаглеродниот атом на алдехидната група е во состојба на sp 2 хибридизација, затоа сите σ врски во оваа група се наоѓаат во иста рамнина. Облаците од p електрони кои формираат π врска се нормални на оваа рамнина и лесно се поместуваат кон поелектронегативниот атом на кислород. Затоа, двојната врска C=O (за разлика од C=C двојната врска кај алкените) е многу поларизирана.
Физички својства

Хемиски својства
Алдехидите се реактивни соединенија кои подлежат на бројни реакции. Најкарактеристични за алдехидите:
а) реакции на додавање на карбонилната група; Реагенсите од типот HX се додаваат на следниов начин:

б) реакции на оксидација C-H врскиалдехидна група, што резултира со формирање на карбоксилни киселини:
I. Реакции на додавање
1. Хидрогенизација (се формираат примарни алкохоли

2. Додавање на алкохоли (се формираат хемиацетали и ацетали)

Во вишок алкохол во присуство на HCl, хемиацеталите се претвораат во ацетали:

II. Реакции на оксидација
1. Реакцијата на „сребрено огледало“.

Поедноставено:

Оваа реакција е квалитативна реакција на алдехидната група (на ѕидовите на садот за реакција се формира огледална обвивка од метално сребро).
2. Реакција со бакар(II) хидроксид

Оваа реакција е исто така квалитативна реакција на алдехидната група y (црвен талог од Cu 2 O таложи).
Формалдехидот се оксидира со различни оксидатори кои содржат О, прво до мравја киселина, а потоа до H 2 CO 3 (CO 2 + H 2 O ):

III. Реакции на ди-, три- и полимеризација
1. Алдолска кондензација

2. Тримеризација на ацеталдехид

3. Полимеризација на формалдехид
За време на долгорочно складирање на формалдехид (40% воден раствор на формалдехид), во него се јавува полимеризација со формирање на бел талог од параформа:

IV. Реакција на поликондензација на формалдехид со фенол

Предавање бр.11
АЛДЕХИДИ И КЕТОНИ
Планирајте
1. Методи на прием.
2. Хемиски својства.
2.1. Нуклеофилни реакции
пристапување.
2.2. Реакции на А - јаглероден атом.
2.3.
Предавање бр.11
АЛДЕХИДИ И КЕТОНИ
Планирајте
1. Методи на прием.
2. Хемиски својства.
2.1. Нуклеофилни реакции
пристапување.
2.2. Реакции на А - јаглероден атом.
2.3. Реакции на оксидација и редукција.
Алдехидите и кетоните содржат карбонилна група
C=O. Општа формула:
1. Методи на добивање.

2. Хемиски
својства.
Алдехидите и кетоните се една од најреактивните класи
органски соединенија. Нивните Хемиски својстваутврдени со присуството
карбонилна група. Поради големата разлика во електронегативноста
јаглерод и кислород и висока поларизација стр -врски Врската C=O има значителен поларитет
( m C=O =2,5-2,8 D). Карбонилен јаглероден атом
група носи ефективен позитивен полнеж и е предмет за напад
нуклеофили. Главниот тип на реакции на алдехиди и кетони е реакции
нуклеофилно додавање АдН. Покрај тоа, карбонилната група влијае
реактивност S-N врскиа -позиција, зголемувајќи ја неговата киселост.
Така, молекулите на алдехиди и кетони
содржат два главни реакциони центри - врската C=O и C-H врскаВа-позиција:

2.1. Нуклеофилни реакции
пристапување.
Алдехидите и кетоните лесно додаваат нуклеофилни реагенси во врската C=O.
Процесот започнува со напад на нуклеофил на карбонилниот јаглероден атом. Потоа
Тетраедарскиот посредник формиран во првата фаза додава протон и
дава додаток на производот:

Активност на карбонилните соединенија во
АдН -реакциите зависат од големината
ефективен позитивен полнеж на карбонилниот јаглероден атом и волумен
супституенти на карбонилната група. Електрони-донатори и гломазни супституенти
ја комплицираат реакцијата, супституентите кои повлекуваат електрони ја зголемуваат реакцијата
способност за карбонил соединение. Затоа, алдехидите во
АдН -реакциите се поактивни од
кетони.
Активноста на карбонилните соединенија се зголемува во
присуство на киселински катализатори, кои го зголемуваат позитивниот полнеж за
карбонилен јаглероден атом:

Алдехидите и кетоните додаваат вода, алкохоли,
тиоли, цијановодородна киселина, натриум хидросулфит, соединенија како
Н.Х. 2 X. Сите реакции на додавање
продолжи брзо, под благи услови, но добиените производи, по правило,
термодинамички нестабилен. Затоа, реакциите продолжуваат реверзибилно, а содржината
производите за додавање во смесата за рамнотежа може да бидат ниски.
Поврзување на вода.
Алдехидите и кетоните додаваат вода во
формирање на хидрати. Реакцијата е реверзибилна. Формирање хидрати
термодинамички нестабилен. Рамнотежата е поместена кон производите
додавање само во случај на активни карбонилни соединенија.

Производ за хидратација на трихлороцет алдехид
хлорал хидрат е стабилно кристално соединение кое се користи во
лек како седатив и хипнотик.
Додавање на алкохоли и
тиоли.
Алдехидите се комбинираат со алкохоли за да се формираат хемиацетали. Во вишок на алкохол и во присуство на киселински катализатор
реакцијата оди понатаму - до формирањето ацетали

Реакцијата на формирање на хемиацетал продолжува како
нуклеофилно додавање и се забрзува во присуство на киселини или
основи.

Процесот на формирање на ацетал оди вака:
нуклеофилна замена на групата OH во хемиацеталот и е можна само под услови
киселинска катализа, кога OH групата се претвора во добра напуштачка група
(Х 2 O).

Формирањето на ацетали е реверзибилен процес. ВО
Во кисела средина, хемиацеталите и ацеталите лесно се хидролизираат. Во алкална средина
хидролиза не се случува. Реакциите на формирање и хидролиза на ацеталите играат важна улога во
хемија на јаглехидрати.
Кетоните под слични услови не
даде.
Тиолите се посилни нуклеофили од алкохолите
формираат производи за додавање и со алдехиди и со кетони.
Спојување на цијановодородна
киселини
Цијановодородна киселина се додава во карбонил соединение под услови
основна катализа за формирање на цијанохидрини.

Реакцијата има препаративна вредност и
се користи во синтезатаа-хидрокси- и а -амино киселини (види предавање бр. 14). Плодови на некои растенија
(на пр. горчливите бадеми) содржат цијанохидрини. Се издвојува кога тие
Кога се распаѓа, цијановодородната киселина има отровно дејство.
Додаток на бисулфит
натриум
Алдехидите и метил кетони додаваат натриум бисулфит NaHSO 3 со формирање на бисулфитни деривати.

Бисулфитни деривати на карбонилни соединенија
– кристални материи кои се нерастворливи во вишок раствор на натриум бисулфит.
Реакцијата се користи за изолирање на карбонилни соединенија од мешавини. Карбонил
соединението може лесно да се регенерира со третирање на бисулфитниот дериват
киселинаили алкали.
Интеракција со заеднички врски
формула NH 2 X.
Реакциите се одвиваат според општа шемакако процес
приврзаност-елиминација. Адуктот формиран во првата фаза не е
стабилна и лесно ја отстранува водата.

Според дадената шема со карбонил
соединенијата реагираат со амонијак, примарни амини, хидразин, супституирани хидразини,
хидроксиламин.

Добиените деривати се
кристални материи кои се користат за изолација и идентификација
карбонилни соединенија.
Имините (Шифовите бази) се средни
производи во многу ензимски процеси (трансаминација под влијание
коензим пиридоксал фосфат; редуктивна аминација на кето киселини кај
учество на коензимот NADN). Каталитичката хидрогенизација на имините произведува
амини Процесот се користи за синтеза на амини од алдехиди и кетони и
наречена редуктивна аминација.
Редуктивната аминација се јавува in vivo
за време на синтезата на амино киселини (види предавање бр. 16)
2.2. Реакции од страна наа - јаглероден атом.
Кето-енол тавтомеризам.
Водородот во а -положбата на карбонилната група е кисела
својства, бидејќи анјонот формиран при неговата елиминација се стабилизира со
резонантна сметка.

Резултат на мобилноста на протонот на атомот на водород
Ва - позиција
е способноста на карбонилните соединенија да формираат енолни форми поради
миграција на протон ода -позиција на атомот на кислород од карбонилната група.

Кетон и енол се тавтомери.
Тавтомерите се изомери кои можат брзо и реверзибилно да се претворат еден во друг
поради миграцијата на група (во овој случај, протон). Рамнотежа помеѓу
кетон и енол се нарекуваат кето-енол тавтомеризам.
Процесот на енолизирање се катализира со киселини и
причини. Енолизацијата под влијание на база може да се претстави со
со следниот дијаграм:
Повеќето карбонилни соединенија постојат
претежно во кетонска форма. Содржината на формата на енол се зголемува со
зголемување на киселоста на карбонилното соединение, како и во случај на
дополнително стабилизирање на енолната форма поради водородното поврзување или поради
спарување.
Табела 8. Содржина на енолни форми и
киселост на карбонилните соединенија
На пример, во 1,3-дикарбонилни соединенија
мобилноста на протоните од метиленската група нагло се зголемува поради
ефект на повлекување електрони на две карбонилни групи. Покрај тоа, енол
формата се стабилизира поради присуството во него на систем на конјугатстр -врски и интрамолекуларни
водородна врска.

Ако соединението во форма на енол е
е конјугиран систем со висока енергија на стабилизација, потоа формата на енол
преовладува. На пример, фенолот постои само во форма на енол.
Енолизирање и формирање на енолат анјони се
првите фази на реакциите на карбонилните соединенија кои се случуваат прекуа - јаглероден атом. Најважниот
од кои се халогенацијаИ алдолично-кротонски
кондензација
.
Халогенација.
Алдехидите и кетоните лесно реагираат со халогени (Cl2,
Бр 2, јас 2 ) со образование
исклучивоа -халогени деривати.

Реакцијата се катализира со киселини или
причини. Брзината на реакција не зависи од концентрацијата и природата на халогенот.
Процесот се одвива преку формирање на енол форма (бавна фаза), која
потоа реагира со халоген (брз чекор). Така, халогенот не е
вклучени во брзината—фаза на дефинирање
процес.

Ако карбонилното соединение содржи неколкуа - водород
атоми, тогаш замената на секоја наредна се случува побрзо од претходната,
поради зголемување на нивната киселост под влијание на влијанието на повлекување на електрони
халоген. Во алкална средина даваат ацеталдехид и метил кетони
трихалогени деривати, кои потоа се разградуваат од вишокот на алкали со
формирање на трихалометани ( халоформска реакција)
.
Разградувањето на тријодоацетонот се јавува како реакција
нуклеофилна замена. CI групи 3 — хидроксид анјон, како СН -реакции во карбоксилната група (види предавање бр. 12).
Јодоформот се таложи од реакционата смеса во форма
бледо жолт кристален талог со карактеристичен мирис. Јодоформ
реакцијата се користи за аналитички цели за откривање на соединенија од типот
CH 3 -CO-R, вклучувајќи
клинички лаборатории за дијагноза на дијабетес мелитус.
Реакции на кондензација.
Во присуство на каталитички количини на киселини
или алкали карбонилни соединенија кои содржата - атоми на водород,
подложени на кондензација за да се формираатб -хидроксикарбонилни соединенија.

Во образованието S-S врскивклучен карбонил
јаглероден атом од една молекула ( карбонилна компонента) Иа -јаглеродниот атом е различен
молекули ( метиленска компонента). Оваа реакција се нарекува алдолска кондензација(со името на производот на кондензација на ацеталдехид -
алдол).
Кога реакцијата смеса се загрева, производот лесно
дехидрира за да се формираа , б - незаситен карбонил
врски.

Овој тип на кондензација се нарекува кротон(со името на производот на кондензација на ацеталдехид - кротон
алдехид).
Да го разгледаме механизмот на кондензација на алдол во
алкална средина. Во првата фаза, анјонот на хидроксид апстрахира протон ода - карбонилна положба
соединенија за да се формира енолат анјон. Потоа анјонот на енолата како нуклеофил
го напаѓа карбонилниот јаглероден атом на друга молекула на карбонил соединение.
Резултирачкиот тетраедарен меѓупроизвод (алкоксиден анјон) е силен
база и понатаму апстрахира протон од молекулата на водата.

За време на алдолска кондензација на две различни
можни се карбонилни соединенија (вкрстена алдолска кондензација).
формирање на 4 различни производи. Сепак, ова може да се избегне ако еден од
не содржи карбонилни соединенијаа - атоми на водород (на пример, ароматични алдехиди
или формалдехид) и не може да дејствува како метиленска компонента.

Како метиленска компонента во реакциите
кондензација може да биде не само карбонилни соединенија, туку и други
C-H-киселини. Реакциите на кондензација имаат подготвителна вредност, бидејќи дозволуваат
се прошири синџирот на јаглеродни атоми. Според видот на алдолската кондензација и
распаѓање на ретроалдол (обратен процес) се случуваат многу биохемиски реакции
процеси: гликолиза, синтеза на лимонска киселина во Кребсовиот циклус, синтеза на невраминска киселина
киселини.
2.3. Реакции на оксидација и
закрепнување
Закрепнување
Карбонилните соединенија се сведуваат на
алкохоли како резултат на каталитичка хидрогенизација или под влијание
редукциони агенси кои се донатори на хидридни анјони.

[H]: H 2 /кат., мачка. - Ни, Пт,
Pd;
LiAlH4; NaBH4.
Редукција на карбонилни соединенија
комплексни метални хидриди вклучува нуклеофилен напад на карбонилната група
хидрид анјон. Последователната хидролиза произведува алкохол.
Закрепнувањето се случува на ист начин
карбонилна група in vivo под влијание на коензимот NADN, што е
донатор на хидрид јон (види предавање бр. 19).
Оксидација
Алдехидите многу лесно оксидираат
било какви оксидирачки агенси, дури и такви слаби како што се воздушниот кислород и соединенија
сребро (I) и бакар(II).
Последните две реакции се користат како
квалитативни за алдехидната група.
Во присуство на алкалии, алдехиди кои не содржата - атоми на водород
непропорционално да формира алкохол и киселина (реакција на Канизаро).
2HCHO + NaOH ® HCOONa + CH 3 OH
Ова е причината што водениот раствор
формалдехидот (формалин) за време на долгорочно складирање станува кисел
реакција.
Кетоните се отпорни на оксидирачки агенси
неутрална средина. Во кисели и алкални средини под влијание на силна
оксидирачки агенси(KMnO 4 ) Тие
оксидираат со кршење на врската C-C. Јаглеродниот скелет е разложен од
јаглерод-јаглерод двојна врска на енол формира карбонилно соединение, слично на
оксидација на двојни врски кај алкените. Ова произведува мешавина на производи
кои содржат карбоксилни киселини или карбоксилни киселини и кетони.
Органската хемија е многу сложена, но интересна наука. На крајот на краиштата, врските на истите елементи, во различни количинии низата придонесува за формирање на различни Да ги погледнеме соединенијата од карбонилната група наречени „кетони“ (хемиски својства, физички карактеристики, методи на нивна синтеза). Ќе ги споредиме и со други супстанции од ист вид - алдехиди.
Кетони
Овој збор е општо име за цела класа органски материи, во чии молекули карбонилната група (C=O) е поврзана со два јаглеродни радикали.
Во нивната структура, кетоните се блиску до алдехидите и карбоксилните киселини. Сепак, тие содржат два атома C (јаглерод или јаглерод) поврзани со C=O.
Формула
Општата формула на супстанциите од оваа класа е како што следува: R 1 -CO-R 2.
За да биде поразбирливо, по правило се пишува вака.

Во него, C=O е карбонилна група. И R 1 и R 2 се јаглеродни радикали. На нивно место може да има различни соединенија, но тие мора да содржат јаглерод.
Алдехиди и кетони
Физичките и хемиските својства на овие групи на супстанции се доста слични едни на други. Поради оваа причина, тие често се разгледуваат заедно.

Факт е дека алдехидите содржат и карбонилна група во нивните молекули. Тие дури имаат многу слични формули со кетоните. Меѓутоа, ако во супстанците што се разгледуваат C=O е врзан за 2 радикали, тогаш кај алдехидите има само еден, наместо вториот - атом на водород: R-CO-H.
Како пример, можеме да ја дадеме формулата на супстанција од оваа класа - формалдехид, попознат на сите како формалин.

Врз основа на формулата CH 2 O, јасно е дека нејзината карбонилна група не е поврзана со еден, туку со два атоми H одеднаш.
Физички својства
Пред да се разберат хемиските својства на алдехидите и кетоните, вреди да се разгледаат нивните физички својства.

- Кетоните се топливи или испарливи течности. Пониските претставници на оваа класа се многу растворливи во H2O и добро комуницираат со нивното потекло.
Поединечни претставници(на пример, CH 3 COCH 3) се извонредно растворливи во вода и во апсолутно сите пропорции.
За разлика од алкохолите и карбоксилните киселини, кетоните се поиспарливи, со иста молекуларна тежина. Ова е олеснето со неможноста на овие соединенија да формираат врски со H, како што може H-CO-R. - Различни видови на алдехиди може да постојат во различни состојби на агрегација. Значи повисок R-CO-H се нерастворливи цврсти материи. Долните се течности, од кои некои совршено се мешаат со H 2 O, но некои од нив се растворливи само во вода, но не повеќе.
Наједноставниот од овој тип на супстанција, мрав алдехид, е гас кој има лут мирис. Оваа супстанца е многу растворлива во H2O.
Најпознатите кетони
Постојат многу R 1 -CO-R 2 супстанции, но не се познати многу од нив. Пред сè, тоа е диметил кетон, кој сите го знаеме како ацетон.

Исто така, неговиот колега растворувач е бутанон или, како што правилно се нарекува, метил етил кетон.
Други кетони чии хемиски својства активно се користат во индустријата вклучуваат ацетофенон (метил фенил кетон). За разлика од ацетонот и бутанонот, неговиот мирис е прилично пријатен, поради што се користи во парфимеријата.
На пример, циклохексанонот е типичен претставник на R1-CO-R2 и најчесто се користи во производството на растворувачи.
Невозможно е да не се споменат дикетони. Ова име е дадено на R 1 -CO-R 2, кои имаат не една, туку две карбонилни групи во нивниот состав. Така, нивната формула изгледа вака: R 1 -CO-CO-R 2. Еден од наједноставните, но широко користен во Прехранбена индустријапретставници на дикетони е диацетил (2,3-бутанедион).
Наведените супстанции се само мала листа на кетони синтетизирани од научниците (хемиските својства се дискутирани подолу). Всушност, ги има повеќе, но не сите нашле примена. Покрај тоа, вреди да се земе предвид дека многу од нив се токсични.
Хемиски својства на кетоните
- Кетоните се способни да додадат H на себе (реакција на хидрогенизација). Меѓутоа, за да се случи оваа реакција, неопходно е присуство на катализатори во форма на метални атоми на никел, кобалт, пехар, платина, паладиум и други. Како резултат на реакцијата, R1-CO-R2 еволуира во секундарни алкохоли.
Исто така, при интеракција со водород во присуство алкални металиили Mg амалгами, гликолите се добиваат од кетоните. - Кетоните кои имаат барем еден алфа-водороден атом обично се подложени на тавтомеризација на кето-енол. Се катализира не само од киселини, туку и од бази. Типично, кето формата е постабилна од формата на енол. Оваа рамнотежа овозможува да се синтетизираат кетони со хидратација на алкини. Релативната стабилизација на формата на енол кето со конјугација доведува до прилично силна киселост на R1-CO-R2 (кога се споредува со алканите).
- Овие супстанции може да реагираат со амонијак. Сепак, тие се одвиваат многу бавно.
- Кетоните влегуваат во интеракција со добиените α-хидроксинитрили, чиешто сапонификација придонесува за појава на α-хидрокси киселини.
- Реакцијата со алкилмагнезиум халиди доведува до формирање на секундарни алкохоли.
- Додавањето на NaHSO 3 го промовира формирањето на хидросулфитни (бисулфитни) деривати. Вреди да се запамети дека само метил кетони се способни да реагираат во серијата масти.
Покрај кетоните, алдехидите можат да комуницираат и со натриум хидросулфит на сличен начин.
Кога се загреваат со раствор на NaHCO 3 (сода бикарбона) или минерална киселина, дериватите на NaHSO 3 може да се распаѓаат, ослободувајќи слободен кетон. - За време на реакцијата на R1-CO-R2 со NH2OH (хидроксиламин), се формираат кетоксими и H2O како нуспроизвод.
- Во реакциите кои вклучуваат хидразин, се формираат хидразони (односот на земените супстанции е 1:1) или азини (1:2).
Ако производот добиен од реакцијата (хидразон) реагира со каустичниот калиум под влијание на температурата, N и заситени јаглеводороди. Овој процеснаречена Кижнерова реакција. - Како што споменавме погоре, алдехидите и кетоните имаат слични хемиски својства и производствени процеси. Во овој случај, се формираат ацетали R 1 -CO-R 2 кои се посложени од ацеталите R-CO-H. Тие се појавуваат како резултат на дејството на естерите на ортоформните и ортосиличните киселини врз кетоните.
- Во услови со поголема концентрација на алкалии (на пример, кога се загрева со концентриран H2SO4), R1-CO-R2 се подложува на интермолекуларна дехидрација со формирање на незаситени кетони.
- Ако во реакцијата со R1-CO-R2 се присутни алкали, кетоните се подложени на алдолска кондензација. Како резултат на тоа, се формираат β-кето алкохоли, кои лесно можат да ја изгубат молекулата H2O.
- Хемиските својства на кетоните се прилично откривачки во примерот на ацетон реагиран со мезитил оксид. Во овој случај, се формира нова супстанција наречена „форон“.
- Исто така и на хемиските својства на субјектот органска материјаможе да се припише на реакцијата Leuckart-Wallach, која промовира редукција на кетоните.
Од што се добива R1-CO-R2?
Откако се запознавте со својствата на предметните супстанции, вреди да се дознаат најчестите методи за нивна синтеза.
- Една од најпознатите реакции за производство на кетони е алкилација и ацилација ароматични соединенијаво присуство на кисели катализатори (AlCl 3, FeCI 3, минерални киселини, оксиди, смоли за размена на катјони итн.). Овој методпозната како реакција на Фридел-Крафтс.
- Кетоните се синтетизираат со хидролиза на кетимини и вик-диоли. Во случајот на второто, неопходно е присуство на катализатори.
- Исто така, за добивање на кетони се користи хидратација на ацетиленски хомолози или како што се нарекува реакцијата Кучеров.
- Реакциите на Губен-Геш.
- Циклизацијата Ружичка е погодна за синтеза на циклокетони.
- Исто така, овие супстанции се екстрахираат од терциерни пероксоетери користејќи го преуредувањето Криге.
- Постојат неколку начини за синтеза на кетони за време на оксидационите реакции на секундарните алкохоли. Во зависност од активното соединение, се разликуваат 4 реакции: Сверн, Корнблум, Кори-Ким и Парик-Деринг.
Опсег на примена
Откако ги разбравме хемиските својства и производството на кетоните, вреди да се открие каде се користат овие супстанции.

Како што споменавме погоре, повеќето од нив се користат во хемиската индустрија како растворувачи за лакови и емајли, како и во производството на полимери.
Дополнително, некои R1-CO-R2 се покажаа добро како ароматични агенси. Во овој капацитет, кетони (бензофенон, ацетофенон и други) се користат во парфимеријата и готвењето.
Ацетофенонот се користи и како компонента за производство на апчиња за спиење.

Бензофенонот, поради неговата способност да апсорбира штетно зрачење, е честа состојка во козметиката против потемнување и во исто време конзерванс.
Ефекти на R1-CO-R2 врз телото
Откако дознавте какви соединенија се нарекуваат кетони (хемиски својства, примена, синтеза и други податоци за нив), вреди да се запознаете со биолошките карактеристики на овие супстанции. Со други зборови, дознајте како тие дејствуваат на живите организми.
И покрај прилично честа употреба на R 1 -CO-R 2 во индустријата, секогаш вреди да се запамети дека таквите соединенија се многу токсични. Многу од нив имаат канцерогени и мутагени својства.
Специјалните претставници може да предизвикаат иритација на мукозните мембрани, дури и изгореници. Алицикличниот R 1 -CO-R 2 може да делува на телото како лекови.
Сепак, не сите супстанции од овој вид се штетни. Факт е дека некои од нив земаат активно учество во метаболизмот на биолошките организми.
Исто така, кетоните се единствени маркери за нарушувања на метаболизмот на јаглеродот и недостаток на инсулин. При анализа на урина и крв, присуството на R 1 -CO-R 2 укажува на различни метаболички нарушувања, вклучувајќи хипергликемија и кетоацидоза.
Алдехиди се соединенија чии молекули содржат карбонилна група поврзана со атом на водород, т.е. општата формула на алдехидите може да се запише како
каде што R е јаглеводороден радикал, кој може да биде со различен степен на заситеност, на пример, заситен или ароматичен.
Групата –CHO се нарекува алдехид.
Кетони – органски соединенија, чии молекули содржат карбонилна група поврзана со два јаглеводородни радикали. Општата формула за кетони може да се напише како:
каде што R и R' се јаглеводородни радикали, на пример, заситени (алкил) или ароматични.
Хидрогенизација на алдехиди и кетони
Алдехидите и кетоните може да се редуцираат со водород во присуство на катализатори и загревање на примарни и секундарни алкохоли, соодветно:
Оксидација на алдехид
Алдехидите можат лесно да се оксидираат дури и со такви благи оксидирачки агенси како бакар хидроксид и раствор на амонијак од сребрен оксид.
Кога бакар хидроксид и алдехид се загреваат, почетната сина боја на реакционата смеса исчезнува и се формира талог од тули-црвен оксид од бакар:
Во реакцијата со раствор на амонијак на сребрен оксид, наместо самата карбоксилна киселина, се формира нејзината амониумова сол, бидејќи амонијакот во растворот реагира со киселини:
Кетоните не реагираат со бакар (II) хидроксид и раствор на амонијак од сребрен оксид. Поради оваа причина, овие реакции се квалитативни за алдехидите. Значи реакцијата со раствор на амонијак на сребрен оксид при правилна техниканеговото спроведување доведува до формирање на карактеристично сребрено огледало на внатрешната површина на садот за реакција.
Очигледно, ако благите оксидирачки агенси можат да оксидираат алдехиди, тогаш посилните оксидирачки агенси, на пример, калиум перманганат или калиум дихромат, природно можат да го направат истото. Кога овие оксидирачки агенси се користат во присуство на киселини, се формираат карбоксилни киселини:
Хемиски својства на карбоксилни киселини
Карбоксилни киселини се јаглеводородни деривати кои содржат една или повеќе карбоксилни групи.
Карбоксилни групиА:
Како што можете да видите, карбоксилната група се состои од карбонилна група -C(O)- поврзана со хидроксилна група -OH.
Поради фактот што карбонилната група е директно поврзана со хидроксилната група, која има негативен индуктивен ефект O-H врскае пополарен отколку во алкохолите и фенолите. Поради оваа причина, карбоксилните киселини се значително поизразени од алкохолите и фенолите, кисели својства. ВО водени растворитие покажуваат својства на слаби киселини, т.е. реверзибилно се дисоцира на водородни катјони (H+) и анјони на киселински остатоци:
Реакции на формирање на сол
За да формираат соли, карбоксилните киселини реагираат со:
1) метали до водород во серијата активности:
2) амонијак
3) основни и амфотерни оксиди:
4) базни и амфотерни метални хидроксиди:
5) соли на послаби киселини - карбонати и бикарбонати, сулфиди и хидросулфиди, повисоки соли (со голем бројјаглеродни атоми во молекула) киселини:
Систематските и тривијалните имиња на некои киселини и нивните соли се претставени во следната табела:
| Киселинска формула | Име на киселина тривијално/систематско | Името на сол тривијално/систематско |
| HCOOH | мравја / метан | формат/метаноат |
| CH3COOH | оцет/етан | ацетат/етаноат |
| CH3CH2COOH | пропион/пропан | пропионат/пропаноат |
| CH 3 CH 2 CH 2 COOH | масло/бутан | бутират/бутаноат |
Треба да се запомни и спротивното: силните минерални киселини ги менуваат карбоксилните киселини од нивните соли како послаби:
Реакции кои ја вклучуваат групата OH
Карбоксилни киселинивлегуваат во реакција на естерификација со монохидрични и полихидрични алкохоли во присуство на силни неоргански киселини, во овој случај се формираат естри:
Овој тип на реакција е реверзибилен, и затоа, со цел да се префрли рамнотежата кон формирањето естертие треба да се изведат со дестилирање на поиспарливиот естер со загревање.
Обратно од реакцијата на естерификација се нарекува естерска хидролиза:
Оваа реакција се јавува неповратно во присуство на алкалии, бидејќи добиената киселина реагира со металниот хидроксид за да формира сол:
Реакции на замена на атоми на водород во јаглеводороден супституент
При спроведување на реакции на карбонати со хлор или бром во присуство на црвен фосфор, при загревање, атомите на водород во атомот на јаглерод α се заменуваат со атоми на халоген:
Во случај на повисок сооднос халоген/киселина, може да дојде до подлабоко хлорирање:
Реакции на уништување на карбоксилната група (декарбоксилација)
Специјални хемиски својства на мравја киселина
Молекулата на мравја киселина, и покрај нејзината мала големина, содржи два функционални групи:
Во овој поглед, тој ги покажува не само својствата на киселините, туку и својствата на алдехидите:
Кога е изложена на концентрирана сулфурна киселина, мравја киселина се распаѓа на вода и јаглерод моноксид.
Алдехидите и кетоните се деривати на јаглеводороди чии молекули содржат карбонилна група. Алдехидите се разликуваат по структура од кетоните во положбата на карбонилната група. ЗА физички својстваалдехиди и кетони, како и нивната класификација и номенклатура, се дискутирани во овој напис.
Физички својства
За разлика од алкохолите и фенолите, алдехидите и кетоните не се карактеризираат со формирање на водородни врски, поради што нивните точки на вриење и топење се многу пониски. Така, формалдехидот е гас; ацеталдехидот врие на температура од 20,8 степени, додека метанолот врие на температура од 64,7 степени. Слично на фенол - кристална супстанција, а бензалдехидот е течност.
Формалдехидот е безбоен гас со лут мирис. Останатите членови на алдехидната серија се течности, а повисоките алдехиди се цврсти материи. Долните членови на серијата (формалдехид, ацеталдехид) се растворливи во вода и имаат лут мирис. Високите алдехиди се многу растворливи во повеќето органски растворувачи (алкохоли, етери), C3-C8 алдехидите имаат многу непријатен мирис, а повисоките алдехиди се користат во парфимеријата поради нивните цветни мириси.

Ориз. 1. Табела класификација на алдехиди и кетони.
Општата формула на алдехиди и кетони е како што следува:
- алдехидна формула - R-COH
- кетонска формула - R-CO-R
Класификација и номенклатура
Алдехидите и кетоните се разликуваат по типот на јаглеродниот синџир што ја содржи карбонилната група. Да ги разгледаме масните и ароматичните соединенија:
- ациклична, гранична. Првиот член на хомологната серија на алдехиди е формален алдехид (формалдехид, метанал) – CH 2 =O.
Формалниот алдехид се користи како антисептик. Се користи за дезинфекција на простории и третман на семиња.
Вториот член на серијата алдехиди е ацеталдехид (ацеталдехид, етанал). Се користи како посредник во синтезата оцетна киселинаИ етил алкохолод ацетилен.

Ориз. 2. Формула: ацеталдехид.
- неограничено. Неопходно е да се спомене таков незаситен алдехид како акролеин (пропенал). Овој алдехид се формира при термичко распаѓање на глицерин и масти, составен делшто е глицерин.
- ароматични. Првиот член на хомологната серија на ароматични алдехиди е бензен алдехид (бензалдехид). Можете исто така да забележите алдехид од растително потекло како што е ванилин (3-метокси-4-хидроксибензалдехид).

Ориз. 3. Формула за ванилин.
Кетоните можат да бидат чисто ароматични или масно-ароматични. На пример, дифенил кетонот (бензофенон) е чисто ароматичен. Масниот ароматичен е, на пример, метил фенил кетон (ацетофенон)
Што научивме?
На часовите по хемија во 10-то одделение, најважна задача е да се изучуваат алдехиди и кетони. Кај алдехидите, јаглеродниот атом од карбонилната група е примарен, а кај кетоните е секундарен. Затоа, кај алдехидите, карбонилната група е секогаш поврзана со атом на водород. Алдехидната група има повеќе хемиска активностотколку кетонот, особено во реакциите на оксидација.
Тест на темата
Евалуација на извештајот
Просечна оцена: 4.2. Вкупно добиени оценки: 166.