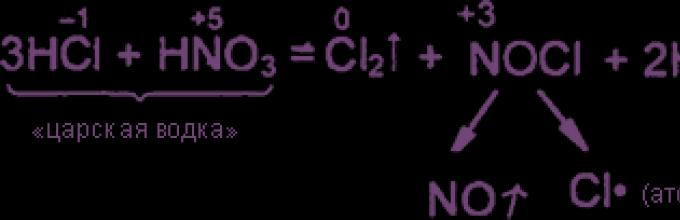Водород хлорид (HC Јас ) класа на опасност 3
Безбоен гас со лут мирис, потежок од воздухот, се втечнува на температура од -85,1 0 C и се зацврстува на температура од -114,2 0 C. Во воздухот пуши поради формирање на капки магла со водена пареа. Незапалив, експлозивен кога контејнерите се загреваат. Добро се раствора во вода, а помалку во органски течности. Во нормални услови, 450-500 волумени гас се раствораат во еден волумен на вода. 27,5-38% раствор на водород хлорид во вода формира хлороводородна киселина, а 36% раствор на водород хлорид во вода формира концентрирана хлороводородна киселина.
Се користи водород хлорид за производство на хлороводородна киселина, винил хлорид, алкил хлориди, за оксидативно хлорирање органски соединенија, добивање метални хлориди, хидролитичен алкохол, гликоза, шеќер, желатин и лепак, во бојадисување на текстил, офорт на метал, во хидрометалуршки процеси и галванизација. Водород хлоридот се произведува како нуспроизвод на хлорирањето и дехидрохлорирањеоргански соединенија, како и во интеракцијата на натриум хлорид со сулфурна киселина. Во моментов, тој се произведува синтетички со согорување на водород во проток на хлор.
Водород хлорид се транспортира во железнички и патни резервоари, контејнери и цилиндри, кои се привремени складирани. Вообичаено се складира водород хлоридво течна состојба на амбиентална температура под притисок на сопствените пареи од 6-18 kgf/cm 2 во надземни цилиндрични хоризонтални резервоари. Максималниот волумен на складирање е 1,98 тони.
Максимална дозволена концентрација (MPC) водород хлорид во воздухот населби: просечно дневно - 0,02 mg/m 3, максимална единечна - 0,05 mg/m 3, во воздухот на работната површина на производните простории - 5 mg/m3.Водород хлоридот има силно иритирачко дејство врз респираторниот систем. Долготрајната изложеност на ниски концентрации предизвикува катара на горниот респираторен тракт и брзо уништување на забната глеѓ. Концентрациите од 50-75 mg/m3 тешко се поднесуваат, акутно труење е придружено со засипнатост, гушење и кашлање. Концентрациите од 75-150 mg/m 3 се неподносливи, предизвикувајќи иритација на мукозните мембрани, конјунктивитис, чувство на задушување и губење на свеста.
При елиминирање на несреќите поврзано со истекување (емисија) на водород хлорид, неопходно е да се изолира опасната област, да се отстранат луѓето од неа, да се остане на страната на ветерот, да се избегне ниски места, влегувајте во зоната на несреќата само во целосна заштитна облека. Директно на местото на несреќата и на растојание до 50 метри од изворот на контаминација, се работи на изолациони гасни маски IP-4M, IP-5, IP-6 (со користење на хемиски врзан кислород), апарати за дишење ASV-2, DASV (со користење на компримиран воздух) 8, KIP-9 (на компримиран кислород) и производи за заштита на кожата (L-1, OZK, KIH-4, KIH-5, итн.). На растојание од повеќе од 50 метри од изворот, каде што концентрацијата на водород хлорид нагло се намалува, не треба да се користи заштитна опрема за кожата, а за заштита на респираторниот систем се користат филтри: индустриски гасни маски со големи димензии со кутии B и BKF, со мала големина со кутија од одделение Б, цивилни гасни маски GP-5, GP-7, PDF-2D, PDF-2Sh комплетни со DPG-3 или респиратори RPG-67, RU-60M со кутија со марка V.
|
Средства за заштита |
Заштитно времедејство (час) при концентрации(mg/m3) |
||||
|
Име |
Марка на кутии |
5000 |
|||
|
Индустриски гас маски: голема големина Мала големина |
БКФ |
||||
|
Цивилни гасни маски: GP-5, GP-7, PDF-2Sh, PDF-2D |
|||||
|
Респиратори: RPG-67, RU-60M |
|||||
Присуството на водород хлорид се одредува:
Во воздухот на индустриска зона со гасен анализатор OKA-T-N Cl , детектор за гас IGS-98-N Cl , универзален гасен анализатор UG-2 со мерен опсег од 0-100 mg/m 3 , детектор за гас на индустриски хемиски емисии GPHV-2 во опсег од 5-500 mg/m 3 .
На отворен простор – со уреди SIP „CORSAR-X“.
Во затворен простор - со SIP уреди „VEGA-M“
Неутрализирајте го водород хлоридот следните алкални раствори
5% воден раствор на каустична сода (на пример, 50 кг каустична сода на 950 литри вода);
5% воден раствор на сода во прав (на пример, 50 кг сода малку прашокза 950 литри вода);
5% воден раствор на гасена вар (на пример, 50 kg гасена вар на 950 литри вода);
5% воден раствор на каустична сода (на пример, 50 кг каустична сода на 950 литри вода);
При неутрализирање на водород хлоридот, неговите пареи се таложат со поставување на водена завеса (потрошувачката на вода не е стандардизирана); кога се неутрализираат таложените пареи, се користи вода или 5% воден раствор на каустична сода, сода во прав, гасена вар и каустична сода. За прскање вода или раствори, се користат возила за наводнување и противпожарни возила, станици за автоматско полнење (ATs, PM-130, ARS-14, ARS-15), како и хидранти и специјални системи достапни во хемиски опасни објекти.
За да се отстрани загадената почва на местото на излевање кога водород хлоридот е неутрализиран, површинскиот слој на почвата се сече до длабочината на контаминацијата, се собира и се транспортира за отстранување со помош на возила за земјување (булдожери, гребење, моторни грејдери, камиони дампери). Сечените површини се покриени со свеж слој земја и се мијат со вода за контролни цели.
Дејства на лидерот: изолирајте ја опасната зона во радиус од најмалку 50 метри, отстранете ги луѓето од неа, останете на страната на ветерот, избегнувајте ниски места. Влезете во зоната на несреќата само со целосна заштитна облека.
Обезбедување прва помош:
Во контаминирана област: обилно исплакнете ги очите и лицето со вода, облечете анти-вогаза, итно повлекување (отстранување) од епидемијата.
По евакуација на контаминирана област: затоплување, одмор, миење на киселината формирана од интеракцијата на водород хлорид со вода од отворени површини на кожата и облеката со вода, обилно миење на очите со вода, ако дишењето е тешко, нанесете топлина на пределот на вратот, субкутано - 1 ml. 0,1% раствор на атропин сулфат. Итна евакуација во медицинска установа.
3. Апликација
Водород хлорид, водород хлорид безбоен, термички стабилен гас со лут мирис, испарува во влажен воздух, лесно се раствора во вода и формира хлороводородна киселина. На -85,1 °C се кондензира во безбојна, подвижна течност. На -114,22 °C, HCl се претвора во цврста состојба. Во цврста состојба, водород хлоридот постои во форма на две кристални модификации: орторомбна, стабилна под -174,75 °C и кубна.
Својства
Воден раствор на водород хлорид се нарекува хлороводородна киселина. Кога се раствора во вода, се случуваат следниве процеси:
HCl g + H 2 O l ⇌ H 3 O l + Cl l
Процесот на растворање е многу егзотермичен. Со вода, HCl формира азеотропна смеса која содржи 20,24% HCl.
Хлороводородна киселина е силна монобазна киселина; таа енергично комуницира со сите метали во напонската серија лево од водородот, со основните и амфотерни оксиди, бази и соли, кои формираат соли хлориди:
Mg + 2 HCl → MgCl 2 + H 2 FeO + 2 HCl → FeCl 2 + H 2 O
Хлоридите се исклучително чести и имаат најширока примена. Повеќето од нив се многу растворливи во вода и целосно се дисоцираат во јони. Малку растворливи се олово хлорид, сребро хлорид, жива хлорид и бакар хлорид.
Кога е изложен на силни оксидирачки агенси или за време на електролиза, водород хлоридот покажува редуцирачки својства:
MnO 2 + 4 HCl → MnCl 2 + Cl 2 + 2 H 2 O
Кога се загрева, водород хлоридот се оксидира со кислород CuCl 2):
4 HCl + O 2 → 2 H 2 O + 2 Cl 2
Сепак, концентрирана хлороводородна киселина реагира со бакар за да формира едновалентен бакар комплекс:
2 Cu + 4 HCl → 2 H + 2 H 2
Мешавина од 3 делови по волумен концентрирана хлороводородна киселина и 1 дел по волумен концентрирана азотни киселининаречена „кралска вотка“. Aqua regia може дури и да раствори злато и платина. Високата оксидативна активност на аква регија се должи на присуството на нитросил хлорид и хлор во него, кои се во рамнотежа со почетните супстанции:
4 H 3 O + 3 Cl + NO 3 ⇌ NOCl + Cl 2 + 6 H 2 O
Поради високата концентрација на хлоридни јони во растворот, металот се врзува за комплекс на хлорид, што го промовира неговото растворање.
Cl 2 во том. Т - жолто-зелен гас со остар задушувачки мирис, 2,5 пати потежок од воздухот, малку растворлив во вода (~ 6,5 g/l); X. Р. во неполарни органски растворувачи. Во слободна форма се наоѓа само во вулканските гасови.
Начини за добивање
Врз основа на процесот на оксидација на Cl - анјони
2Cl - - 2e - = Cl 2 0
Индустриски
Електролиза на водени раствори на хлориди, почесто NaCl:
2NaCl + 2H 2 O = Cl 2 + 2NaOH + H 2
Лабораторија
Оксидација на конц. HCI со различни оксидирачки агенси:
4HCI + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O
16HCl + 2KMnO 4 = 5Cl 2 + 2MnCl 2 + 2KCl + 8H 2 O
6HCl + KClO 3 = 3Cl 2 + KCl + 3H 2 O
14HCl + K 2 Cr 2 O 7 = 3Cl 2 + 2CrCl 3 + 2KCl + 7H 2 O
Хемиски својства
Хлорот е многу силен оксидирачки агенс. Оксидира метали, неметали и комплексни супстанции, претворајќи се во многу стабилни Cl-анјони:
Cl 2 0 + 2e - = 2Cl -
Реакции со метали
Активните метали во атмосфера на сув гас хлор се запалат и горат; во овој случај, се формираат метални хлориди.
Cl 2 + 2Na = 2NaCl
3Cl 2 + 2Fe = 2FeCl 3
Ниско-активните метали полесно се оксидираат со влажен хлор или неговите водени раствори:
Cl 2 + Cu = CuCl 2
3Cl 2 + 2Au = 2AuCl 3
Реакции со неметали
Хлорот не комуницира директно само со O 2, N 2, C. Реакциите со други неметали се случуваат под различни услови.
Се формираат неметални халиди. Најважната реакција е интеракцијата со водородот.
Cl 2 + H 2 = 2HC1
Cl 2 + 2S (топење) = S 2 Cl 2
ЗCl 2 + 2Р = 2РCl 3 (или РCl 5 - во вишок од Cl 2)
2Cl 2 + Si = SiCl 4
3Cl 2 + I 2 = 2ICl 3
Поместување на слободните неметали (Br 2, I 2, N 2, S) од нивните соединенија
Cl 2 + 2KBr = Br 2 + 2KCl
Cl 2 + 2KI = I 2 + 2KCl
Cl 2 + 2HI = I 2 + 2HCl
Cl 2 + H 2 S = S + 2HCl
3Cl 2 + 2NH 3 = N 2 + 6HCl
Непропорционалност на хлорот во вода и водени раствори на алкалии
Како резултат на само-оксидација-саморедукција, некои атоми на хлор се претвораат во Cl - анјони, а други во позитивен степеноксидацијата се дел од ClO - или ClO 3 - анјоните.
Cl 2 + H 2 O = HCl + HClO хипохлорна киселина
Cl 2 + 2KOH = KCl + KClO + H 2 O
3Cl 2 + 6KOH = 5KCl + KClO 3 + 3H 2 O
3Cl 2 + 2Ca (OH) 2 = CaCl 2 + Ca (ClO) 2 + 2H 2 O
Овие реакции се важни бидејќи доведуваат до кислородни соединенијахлор:
KClO 3 и Ca(ClO) 2 - хипохлорити; KClO 3 - калиум хлорат (Бертоле сол).
Интеракција на хлорот со органски материи
а) замена на атоми на водород во OM молекулите
б) прицврстување на Cl 2 молекули на местото на прекин на повеќе јаглерод-јаглеродни врски
H 2 C = CH 2 + Cl 2 → ClH 2 C-CH 2 Cl 1,2-дихлороетан
HC≡CH + 2Cl 2 → Cl 2 HC-CHCl 2 1,1,2,2-тетрахлороетан
Водород хлорид и хлороводородна киселина
Гас водород хлорид
Физички и хемиски својства
HCl - водород хлорид. На врт. Т - безбоен. гас со лут мирис, лесно се втечнува (mp -114°C, bp -85°C). Безводниот HCl, и во гасовита и во течна состојба, е неелектрично спроводлив и хемиски инертен кон металите, металните оксиди и хидроксидите, како и кон многу други супстанции. Ова значи дека во отсуство на вода, водород хлоридот не се манифестира кисели својства. Само при многу високи температури гасовитиот HCl реагира со метали, дури и со такви нискоактивни како Cu и Ag.
Намалувачките својства на хлоридниот анјон во HCl, исто така, се појавуваат во мала мера: тој се оксидира со флуор во том. Т, а исто така и на висока Т (600°C) во присуство на катализатори, реагира реверзибилно со кислородот:
2HCl + F 2 = Cl 2 + 2HF
4HCl + O 2 = 2Сl 2 + 2H 2 O
Гасовитиот HCl е широко користен во органската синтеза (реакции на хидрохлорирање).
Начини за добивање
1. Синтеза од едноставни материи:
H 2 + Cl 2 = 2HCl
2. Формиран како нуспроизвод при хлорирање на јаглеводородите:
R-H + Cl2 = R-Cl + HCl
3. Во лабораторија се добива со дејство на конц. H 2 SO 4 за хлориди:
H 2 SO 4 (конк.) + NaCl = 2HCl + NaHSO 4 (со слабо загревање)
H 2 SO 4 (конк.) + 2NaCl = 2HCl + Na 2 SO 4 (со многу високо загревање)
Воден раствор на HCl - силна киселина (хлороводородна или хлороводородна)
HCl е многу растворлив во вода: на вол. Во 1 литар H 2 O ~ 450 литри гас се раствораат (распуштањето е придружено со ослободување на значително количество топлина). Заситениот раствор има масен удел HCl еднаква на 36-37%. Овој раствор има многу лут, задушувачки мирис.
Молекулите на HCl во водата речиси целосно се распаѓаат во јони, т.е. воден раствор HCl е силна киселина.
Хемиски својства на хлороводородна киселина
1. HCl растворен во вода открива сè општи својствакиселини поради присуството на H + јони
HCl → H + + Cl -
Интеракција:
а) со метали (до H):
2HCl 2 + Zn = ZnCl 2 + H 2
б) со основни и амфотерни оксиди:
2HCl + CuO = CuCl 2 + H 2 O
6HCl + Al 2 O 3 = 2AlCl 3 + ZN 2 O
в) со бази и амфотерни хидроксиди:
2HCl + Ca(OH) 2 = CaCl 2 + 2H 2 O
3HCl + Al(OH) 3 = AlCl 3 + ZH 2 O
г) со соли на послаби киселини:
2HCl + CaCO 3 = CaCl 2 + CO 2 + H 3 O
HCl + C 6 H 5 ONa = C 6 H 5 OH + NaCl
д) со амонијак:
HCl + NH 3 = NH 4 Cl
Реакции со силни оксидирачки агенси F 2, MnO 2, KMnO 4, KClO 3, K 2 Cr 2 O 7. Cl - анјонот се оксидира до слободен халоген:
2Cl - - 2e - = Cl 2 0
За равенките на реакцијата, видете „Производство на хлор“. Од особена важност е ORR помеѓу хлороводородна и азотна киселина:

Реакции со органски соединенија
Интеракција:
а) со амини (како органски бази)
R-NH 2 + HCl → + Cl -
б) со амино киселини (како амфотерни соединенија)

Хлор оксиди и оксокиселини
Кисели оксиди

Киселини

Соли
Хемиски својства
1. Сите хлор оксокиселини и нивните соли се силни оксидирачки агенси.
2. Речиси сите соединенија се распаѓаат кога се загреваат поради интрамолекуларно намалување на оксидација или диспропорција.

Прашок за белење
Хлоричната (белење) вар е мешавина од хипохлорит и калциум хлорид, има белење и дезинфекција. Понекогаш се смета за пример за мешана сол која истовремено содржи анјони на две киселини:

Вода од џавел
Воден раствор на калиум хлорид и хапохлорит KCl + KClO + H 2 O
Хлоридите се исклучително чести по природа и имаат најширока примена (халит, силвит). Повеќето од нив се многу растворливи во вода и целосно се дисоцираат во јони. Малку растворливи се олово хлорид (PbCl 2), сребро хлорид (AgCl), (Hg 2 Cl 2, каломел) и бакар (I) хлорид (CuCl).
Водород хлоридот се карактеризира и со реакции на додавање на повеќе врски (електрофилно додавање):
Потврда
Во лабораториски услови, водород хлоридот се добива со реакција на концентрирана сулфурна киселина со натриум хлорид (готвена сол) со слабо загревање:
Во индустријата, водород хлоридот претходно се добиваше главно со сулфат метод (метод Лебланк), врз основа на интеракцијата на натриум хлорид со концентрирана сулфурна киселина. Во моментов, директна синтеза од едноставни супстанции обично се користи за да се добие водород хлорид:
Во услови на производство, синтезата се изведува во специјални инсталации во кои водородот непрекинато гори со рамномерен пламен во проток на хлор, мешајќи се со него директно во факелот на горилникот. Ова обезбедува мирна (без експлозија) реакција. Водородот се снабдува во вишок (5 - 10%), што овозможува целосно користење на повредниот хлор и добивање на хлороводородна киселина незагадена со хлор.
Хлороводородна киселина се подготвува со растворање на гасот водород хлорид во вода.
Апликација
Воден раствор е широко користен за производство на хлориди, за кисење метали, чистење на површината на садовите и бунарите од карбонати, преработка на руди, за производство на гуми, мононатриум глутамат, сода, хлор и други производи. Се користи и во органска синтеза. Растворот на хлороводородна киселина е широко користен во производството на мали парчиња бетон и производи од гипс: плочки за поплочување, производи од армиран бетон итн.
Безбедност
Вдишување на водород хлорид може да доведе до кашлање, гушење, воспаление на носот, грлото и горниот респираторен тракт, а во тешки случаи, белодробен едем, дисфункција циркулаторниот систем, па дури и смрт. Контактот со кожата може да предизвика црвенило, болка и сериозни изгореници. Водород хлоридот може да предизвика сериозни изгореници на очите и трајно оштетување.
Напишете преглед за написот „Хород хлорид“
Белешки
Литература
- Левински М.И., Мазанко А.Ф., Новиков И.Н. „Хород хлорид и хлороводородна киселина“ М.: Хемија 1985 г.
Врски
Извадок што го карактеризира водород хлорид
Следниот ден, принцезата замина вечерта, а неговиот главен менаџер дојде кај Пјер со веста дека парите што ги бара за да го опреми полкот не може да се добијат освен ако не се продаде еден имот. Генералниот директор генерално му кажа на Пјер дека сите овие зафати на полкот требаше да го уништат. На Пјер му беше тешко да ја скрие насмевката додека ги слушаше зборовите на менаџерот.„Па, продаде го“, рече тој. - Што да правам, не можам да одбијам сега!
Колку беше полоша состојбата на работите, а особено неговите работи, толку попријатно беше за Пјер, толку поочигледно беше дека се приближува катастрофата што ја чекаше. Речиси никој од познаниците на Пјер не бил во градот. Џули замина, принцезата Марија замина. Од блиските познаници останаа само Ростовците; но Пјер не отиде кај нив.
На овој ден, Пјер, за да се забавува, отишол во селото Воронцово да гледа голема балон, кој го градеше Лепич за да го уништи непријателот и пробен балон кој требаше да биде лансиран утре. Оваа топка сè уште не беше подготвена; но, како што дознал Пјер, бил изграден на барање на суверенот. Царот му напиша на грофот Растопчин следново за оваа топка:
„Aussitot que Leppich sera pret, composez lui un equipage pour sa nacelle d“hommes surs et intelligents et depechez un courrier au general Koutousoff pour l“en prevenir. Je l"ai instruit de la избра.
Recommandez, je vous prie, a Leppich d"etre bien attentif sur l"endroit ou il descendra la premiere fois, pour ne pas se tromper et ne pas tomber dans les mains de l"ennemi. avec le general en готвач“.
[Штом Лепич е подготвен, соберете екипа за неговиот брод од верниците и паметни луѓеи испрати курир кај генералот Кутузов да го предупреди.
Го известив за ова. Ве молиме да му наложите на Лепич внимателно да внимава на местото каде што првпат се спушта, за да не погреши и да не падне во рацете на непријателот. Неопходно е тој да ги координира своите движења со движењата на главниот командант.]
Враќајќи се дома од Воронцов и возејќи по плоштадот Болотнаја, Пјер виде толпа на Лобноје Место, застана и се симна од друшки. Тоа беше егзекуција на француски готвач обвинет за шпионажа. Егзекуцијата штотуку заврши, а џелатот од кобилата го одврзуваше жалосно офкачкиот дебел човек со црвени бакенбари, сини чорапи и зелена камилица од кобилата. Друг криминалец, слаб и блед, стоеше токму таму. И двајцата, судејќи по нивните лица, беа Французи. Со исплашен, болен поглед, сличен на оној на слабиот Французин, Пјер се проби низ толпата.
- Што е ова? СЗО? За што? - тој ме праша. Но, вниманието на толпата - службеници, жители на градот, трговци, мажи, жени во наметки и бунди - беше толку лакомо насочено кон она што се случува во Лобноје Место што никој не му одговори. Дебелиот стана, намуртено, ги крена рамениците и, очигледно сакајќи да изрази цврстина, почна да го облекува дублетот без да гледа околу себе; но наеднаш усните му затреперија и почна да плаче, лут на себе, како што плачат возрасни сангвисти. Толпата зборуваше гласно, како што му се чинеше на Пјер, за да го удави чувството на сожалување во себе.
- Нечиј принц готвач...
„Па, господине, јасно е дека рускиот желе сос го налути Французинот... му ги заби забите“, рече разумниот службеник кој стоеше до Пјер, додека Французинот почна да плаче. Службеникот погледна околу него, очигледно очекувајќи оценка за неговата шега. Некои се смееја, некои продолжија со страв да гледаат во џелатот, кој соблекуваше друг.
Пјер шмркаше, го збрчка носот и брзо се сврте и се врати кон друшката, не престанувајќи да мрмори нешто во себе додека одеше и седеше. Продолжувајќи по патот, неколку пати се стресе и врескаше толку силно што кочијашот го праша:
- Што нарачувате?
-Каде одиш? – му викна Пјер на кочијашот кој заминуваше за Лубјанка.
„Ме наредија на врховниот командант“, одговори кочијашот.
- Будала! ѕвер! – извика Пјер, што ретко му се случуваше, пцуејќи го својот кочијаш. - Нарачав дома; и побрзај, идиоту. „Ние сè уште треба да заминеме денес“, рече Пјер во себе.
Пјер, гледајќи го казнетиот Французин и толпата што го опкружува Местото за извршување, па конечно реши дека не може повеќе да остане во Москва и тој ден оди во војска, дека му се чинеше дека или му кажал на кочијарот за ова, или дека и самиот кочијар требало да го знае тоа .
Пристигнувајќи дома, Пјер му нареди на својот кочијаш Евстафиевич, кој знаеше сè, можеше сè и беше познат низ Москва, дека таа вечер ќе оди во Можајск во војската и дека неговите јавачки коњи треба да бидат испратени таму. Сето ова не можеше да се направи истиот ден, и затоа, според Евстафиевич, Пјер мораше да го одложи своето заминување до друг ден за да даде време за базите да излезат на патот.
На 24-ти се расчисти по лошото време, а тоа попладне Пјер ја напушти Москва. Ноќе, откако ги смени коњите во Перхушково, Пјер дозна дека таа вечер имало голема битка. Рекоа дека овде, во Перхушково, од истрелите се тресела земјата. Никој не можеше да одговори на прашањата на Пјер за тоа кој победи. (Ова беше битката кај Шевардин на 24.) Во зори, Пјер се приближи до Можајск.
Сите куќи на Можајск беа окупирани од војници, а во гостилницата, каде што Пјер го пречека неговиот господар и кочијаш, немаше место во горните простории: сè беше полно со офицери.
Во Можајск и надвор од Можајск, војниците стоеја и маршираа насекаде. Козаци, пешаци и коњски војници, вагони, кутии, пушки беа видливи од сите страни. Пјер брзаше да тргне напред што е можно побрзо, и колку подалеку се оддалечуваше од Москва и колку подлабоко се фрлаше во ова море од војници, толку повеќе го обземаше вознемиреност и ново радосно чувство дека тој уште не доживеал. Тоа беше чувство слично на она што го доживеа во палатата Слободски за време на пристигнувањето на царот - чувство на потреба да се направи нешто и да се жртвува нешто. Сега доживеа пријатно чувство на свесност дека сè што ја сочинува среќата на луѓето, удобностите на животот, богатството, дури и самиот живот, се глупости, што е пријатно да се отфрли во споредба со нешто... Со што, Пјер не можеше да си даде сметка, и навистина таа се обиде сам да разбере, за кого и за што смета дека е особено шармантно да се жртвува сè. Не го интересираше за што сака да се жртвува, но самата жртва за него претставуваше ново радосно чувство.
Хлор– елемент од 3. период и VII А-група Периодичен систем, сериски број 17. Електронска формула на атомот [ 10 Ne]3s 2 3p 5, карактеристични оксидациски состојби 0, -I, +I, +V и +VII. Најстабилна состојба е Cl‑I. Скала на оксидациона состојба на хлор:
Хлорот има висока електронегативност (2,83) и покажува неметални својства. Тој е дел од многу супстанции - оксиди, киселини, соли, бинарни соединенија.
Во природа - дванаесеттиелемент по хемиско изобилство (петти меѓу неметалите). Се наоѓа само во хемиски врзана форма. Третиот најсодржински елемент во природни води(по О и H), особено многу хлор во морска вода(до 2% по тежина). Витално важен елементза сите организми.
Хлор Cl2.Едноставна супстанција. Жолто-зелен гас со лут задушувачки мирис. Молекулата Cl 2 е неполарна и содржи CI-Cl σ врска. Термички стабилен, незапалив во воздух; мешавина со водород експлодира на светлина (водородот гори во хлор):
Тој е многу растворлив во вода, се подложува на 50% дисмутација во неа и целосно во алкален раствор:
Растворот на хлор во вода се нарекува хлорна вода,на светлина, киселината HClO се распаѓа на HCl и атомски кислород O 0, па „хлорната вода“ мора да се чува во темно шише. Присуството на киселина HClO во „хлорната вода“ и формирањето на атомски кислород ги објаснуваат неговите силни оксидирачки својства: на пример, многу бои се обезбојуваат во влажниот хлор.
Хлорот е многу силно оксидирачко средство за метали и неметали:
Реакции со соединенија на други халогени:
а) Cl 2 + 2KBr (p) = 2KCl + Br 2 (врие)
б) Cl 2 (недела) + 2KI (p) = 2КCl + I 2 ↓
3Cl 2 (g) + ZN 2 O + KI = 6НCl + KIO 3 (80 °C)
Квалитативна реакција – интеракција на недостаток на Cl 2 со KI (види погоре) и откривање на јод со сина боја по додавање на раствор од скроб.
Потврдахлор во индустријата:
и во лаборатории:
4HCl (конц.) + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O
(слично со учество на други оксидирачки агенси; за повеќе детали, видете реакции за HCl и NaCl).
Хлорот е еден од главните производи хемиско производство, се користи за производство на бром и јод, хлориди и деривати што содржат кислород, за избелување на хартијата, како средство за дезинфекција за пиење вода. Отровни.
Водород хлорид HCl.Аноксична киселина. Безбоен гас со лут мирис, потежок од воздухот. Молекулата содржи ковалентна σ-врска H – Cl. Термички стабилен. Многу растворлив во вода; се нарекуваат разредени раствори хлороводородна киселина,и концентриран раствор за пушење (35-38%) - хлороводородна киселина(името го дале алхемичарите). Силна киселинаво раствор, неутрализиран со алкалии и амонијак хидрат. Силно редукционо средство во концентриран раствор (поради Cl-I), слабо оксидирачко средство во разреден раствор (поради H I). Компонента„кралска вотка“
Квалитативна реакција на јонот Cl е формирањето на бели талози AgCl и Hg 2 Cl 2, кои не се пренесуваат во растворот со дејство на разредена азотна киселина.
Водород хлоридот служи како суровина во производството на хлориди, органохлорни производи и се користи (во форма на раствор) при офорт на метали и разградување на минерали и руди.
Равенки на најважните реакции:
HCl (дил.) + NaOH (дил.) = NaCl + H 2 O
HCl (дил.) + NH 3 H 2 O = NH 4 Cl + H 2 O
4HCl (конц., хоризонтална) + MO 2 = MCl 2 + Cl 2 + 2H 2 O (M = Mn, Pb)
16HCl (кон., хоризонтална) + 2KMnO 4 (t) = 2MnCl 2 + 5Cl 2 + 8H 2 O + 2KCl
14HCl (конк.) + K 2 Cr 2 O 7 (t) = 2CrCl 3 + 3Cl 2 + 7H 2 O + 2KCl
6HCl (конк.) + KClO 3 (t) = KCl + 3Cl 2 + 3H 2 O (50-80 °C)
4HCl (конц.) + Ca(ClO) 2(t) = CaCl 2 + 2Cl 2 | + 2H 2 O
2HCl (дил.) + M = MCl2 + H2 (M = Fe, Zn)
2HCl (дил.) + MSO 3 = MCl 2 + CO 2 + H 2 O (M = Ca, Ba)
HCl (дил.) + AgNO 3 = HNO 3 + AgCl↓
Потврда HCl во индустријата - согорување на H 2 во Cl 2 (види), во лабораторија - поместување од хлориди со сулфурна киселина:
NaCl (t) + H 2 SO 4 (конк.) = NaHSO 4 + HCl(50°C)
2NaCl (t) + H 2 SO 4 (конк.) = Na 2 SO 4 + 2HCl(120°C)