Добивање на манган
Користејќи го алуминиотермичкиот метод, редуцирајќи го оксидот Mn 2 O 3 формиран за време на калцинирањето на пиролузитот:
Пасивира при оксидација во воздухот. Манганот во прав согорува во кислород:
Кога се загрева, манганот ја разградува водата, поместувајќи го водородот:
Во овој случај, формираниот слој на манган хидроксид ја забавува реакцијата.
Манганот апсорбира водород, а со зголемување на температурата се зголемува неговата растворливост во манган. На температури над 1200 °C реагира со азот, формирајќи нитриди со различен состав.
Јаглеродот реагира со стопениот манган, формирајќи карбиди Mn 3 C и други. Исто така, формира силициди, бориди и фосфиди.
Реагира со хлороводородна и сулфурна киселина според равенката:
Со концентрирана сулфурна киселина, реакцијата се одвива според равенката:
Со разредена азотна киселина, реакцијата се одвива според равенката:
Манганот е стабилен во алкален раствор.
Оксиди и хидроксиди на манган
| Оксиди | MnO | Mn2O3 | MnO2 | (MnO3) | Mn2O7 |
| Својства | изречена основна | основни | амфотеричен | кисела | Силно кисело |
| Хидроксиди | Mn(OH)2 | Mn(OH)3 | Mn(OH)4 H2MnO3 | H2MnO4 | HMnO4 |
| Својства | изречена основна | основни | амфотеричен | кисела | високо кисела |
| Наслови | манган(II) хидроксид; Mn(II) соли | манган (III) хидроксид; Mn(III) соли | манган(IV) хидроксид; манганати (IV) | Манган (VI) киселина; манганати (VI) | манган (VII) киселина, перманганати |
Оксиди и хидроксиди на манган
Соединенија на манган (II).Манган (II) оксид и хидроксид покажуваат само основни својства. Тие се нерастворливи во вода, но лесно се раствораат во киселини за да формираат двовалентни соли на манган.
Повеќето двовалентни соли на манган се многу растворливи во вода и се подложени на хидролиза во катјонот. Ретко растворливите соли вклучуваат меѓусоли - сулфид, фосфат и карбонат.
Во кристална состојба, солите на манган (II) имаат малку розова боја, во водени раствори– речиси безбоен.
Дивалентен манган хидроксид се формира индиректно - со дејство на алкали на раствори на сол. Во моментот на формирање, се формира бел талог (почесто се забележува како цврст), кој во воздухот постепено станува кафеав под влијание на атмосферскиот кислород:
2Mn(OH) 2(s) + 2H 2 O (l) + O 2(g) → 2Mn(OH) 4(s).3MnSO 4 (а) + 2KClO 3 (а) +12KOH (а) → 3K 2 MnO 4 (а) + 2KCl (а) + 3K 2 SO 4 (а) + 6H 2 O (l)
2MnSO 4 (c) +5PbO 2 (t) +6HNO 3 (c) →2HMnO 4 (c) +3Pb(NO 3) 2 (c) +2PbSO 4 (c) +2H 2 O (l).
Манган(II) оксид MnO
- солидназелена - може да се добие со редуцирање на манган (IV) оксид во проток на водород:
MnO2+H2=MnO+H2O
MnO- типичен основен оксид, не реагира со вода. Тоа одговара на манган (II) хидроксид, Mn(OH)2, кој е слаба база. Се таложи како талог со боја на месо за време на интеракцијата на алкалите со солите на манган (II):
MnСl2+2NaOH=Mn(OH)2¯+2NaCl
Mn(OH)2+2HCl=MnСl2+2H2O
Солите на манган (II), по правило, се многу растворливи во вода, освен Mn3(PO4)2, MnS, MnCO3.
Соединенија на манган (III).Тривалентни соли на манган се со темна боја и имаат тенденција да се формираат комплексни соли(киселински комплекси ). Сите соли на манган (III) се нестабилни. Во кисел раствор тие лесно се редуцираат до соли на манган (II). Во неутрален раствор, едноставните соли лесно се хидролизираат за да формираат хидроксид Mn(III),кој брзо се трансформира во воздухот во манган (IV) хидроксид. Манган (III) хидроксид - Mn2O3ּ H 2 Oили MnО(OH)природно се јавува како минерал манганита(кафеава манганска руда).
Потврда
Минералите кои се наоѓаат во природата се бранинит, курнакит и биксбиит - манган оксид со различни нечистотии.
Оксидација на манган(II) оксид:
Редукција на манган(IV) оксид:
Соединенија на манган (IV).Оксид Mn(IV)најстабилна во нормални услови кислородно соединениеманган MnO2а неговиот соодветен хидроксид практично се нерастворливи во вода.
Подготовка на манган оксид 4:
· Во лабораториски услови се добива со термичко разложување на калиум перманганат.
4KMnO4→4MnO2+2K2O+3O2
· но реакцијата всушност ја следи равенката:
2KMnO4→MnO2+K2MnO4+O2
· Може да се подготви и со реакција на калиум перманганат со водород пероксид.
2KMnO4+H2O2→2KOH+2MnO2+2O2
· На температури над 100 °C, калиум перманганат се намалува со водород:
2KMnO4+2H2→K2MnO4+MnO2+2H2O
Хемиски својства
1) Кога манган (IV) оксид (пиролузит) се спојува со алкалии во присуство на кислород, се формираат манганати:
2) Манган(II) хлорид – во безводна состојба се појавува како светло розеви листови и се добива со третирање на манган, неговиот оксид или карбонат со сув водород хлорид
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O (од оваа реакција се добива хлор во лаборатории)
MnCO 3 + 2HCl = MnCl 2 + CO 2 + H 2 O
3) MnO 2 + KClO 3 + 6KOH = 3K 2 MnO 4 + KCl + 3H 2 O (реакцијата се јавува при фузија)
4) 2MnO 2 + 2H 2 SO 4 = 2MnSO 4 + O 2 + 2H 2 O.
Експонати на манган(IV) хидроксид амфотеричен карактер– кисели и базични во еднакви количини Манган диоксид може да се добие во лабораторија со калцинирање на Mn(NO 3) 2 во воздух:
Mn(NO 3) 2 = MnO 2 + 2NO 2
Соединенија на манган (VI).Шестовалентен манган оксид не е изолиран во слободна форма. Манганот (VI) хидроксид покажува кисел карактер. Слободната манганова киселина (VI) е нестабилна и непропорционална во воден раствор според следната шема:
3H 2 MnO 4 (c) → 2HMnO 4 (c) + MnO 2 (s) + 2H 2 O (l).
Манганите (VI) се формираат со фузија на манган диоксид со алкали во присуство на оксидирачки агенси и имаат смарагдно зелена боја. Во силно алкална средина, манганите (VI) се доста стабилни. При разредување на алкалните раствори, се јавува хидролиза, придружена со диспропорција:
3K 2 MnO 4 (c) + 2H 2 O (l) → 2KMnO 4 (c) + MnO 2 (s) + 4KOH (c).
Манганите (VI) се силни оксидирачки агенси кои се редуцираат во кисела средина до Mn(II),а во неутрални и алкални средини – до MnO2.Под влијание на силни оксидирачки агенси, може да се оксидираат манганати (VI). Mn(VII):
2K 2 MnO 4 (c) + Cl 2 (g) → 2KMnO 4 (c) + 2KCl (c).
Кога се загрева над 500 o C, манганат (VI) се распаѓа на производи:
манганат (IV) и кислород:
2K 2 MnO 4 (t) → K 2 MnO 3 (t) + O 2 (g).
Соединенија на манган (VII).Манган (VII) оксид - Mn2O7се ослободува како темно зелена мрсна течност кога концентрирана сулфурна киселина реагира со калиум перманганат:
2KMnO 4 (t) + H 2 SO 4 (k) = K 2 SO 4 (c) + Mn 2 O 7 (l) + H 2 O (l).
Оксидот на манган (VII) е стабилен до 10 o C и експлозивно се распаѓа според следнава шема:
Mn 2 O 7 (l) → 2MnO 2 (s) + O 3 (g).
При интеракција Mn2O7перманганска киселина се формира со вода HMnO4, која има виолетова-црвена боја:
Mn 2 O 7 (l) + H 2 O (l) = 2HMnO 4 (c) (само во форма на MnO 4 - и H + јони).
Не беше можно да се добие безводна перманганска киселина, во раствор таа е стабилна до концентрација од 20%. Ова Многу силна киселина , привидниот степен на дисоцијација во раствор со концентрација од 0,1 mol/dm 3 е 93%.
Перманганската киселина е силен оксидирачки агенс.Содејствува уште поенергично Mn2O7, запаливи материи се палат при контакт со него. Манган(VII) оксид Mn 2 O 7 - анхидрид на манган е зелено-кафеаво тешко масло кое се добива со дејство на концентрирана сулфурна киселина на цврст калиум перманганат:
2KMnO 4 + H 2 SO 4 = Mn 2 O 7 + K 2 SO 4 + H 2 O
Соли на манган
1) Растворот од манганат има темно зелена боја. Кога се закиселува, реакцијата се јавува:
2) Кога се калцинираат, перманганите се распаѓаат со ослободување на кислород (еден од лабораториските методи за производство на чист кислород). Реакцијата се одвива според равенката (користејќи го примерот на калиум перманганат):
3) Под влијание на силни оксидирачки агенси, јонот Mn 2+ се трансформира во јон MnO 4 −:
4) Калиум перманганат се користи како антисептик. Водни раствори со различни концентрации од 0,01 до 0,5% се користат за дезинфекција на рани, гаргара и други антиинфламаторни процедури. Успешно 2 - 5% раствори на калиум перманганат се користат за изгореници на кожата (кожата се суши и не се формира меур). За живите организми, перманганите се отрови (тие предизвикуваат коагулација на протеините). Нивната неутрализација се врши со 3% раствор H 2 O 2, закиселена оцетна киселина:
2KMnO 4 +5H 2 O 2 +6CH 3 COOH→2Mn(CH 3 COO) 2 +2CH 3 ГОТВИ +8H 2 O+ 5O 2
5) Перманганите оксидираат органски материи и во кисела и во алкална средина:
· 2KMnO 4 + 3H 2 SO 4 + 5C 2 H 5 OH → 2MnSO 4 + K 2 SO 4 + 5CH 3 COH + 8H 2 O
· 4KMnO 4 + 2NaOH + C 2 H 5 OH → MnO 2 ↓ + 3CH 3 COH + 2K 2 MnO 4 + Na 2 MnO 4 + 4H 2 O
6) MnSO 4 + 2NaOH → Mn(OH) 2 ↓ + Na 2 SO 4
7) Сите соли на манган (II) во ORR што течат во растворите се редуцирачки агенси:
3Mn(NO 3) 2 + 2KMnO 4 + 2H 2 O → 5MnO 2 + 4HNO 3 + 2KNO 3
8) Солите на манган (II) не се хидролизираат, формирајќи силни аква комплекси:
Mn 2+ + 6H 2 O → 2+
MnCl 2 + 6H 2 O → Cl 2
9) Mn(CN) 2 – нерастворливо бело соединение, поради формирањето на комплексот се раствора во присуство на KCN:
4KCN + Mn(CN) 2 = K4 калиум хексоцианоманганат
Исто така:
4KF + MnF 2 = K 4
2KCl + MnCl 2 = K 2

Примена на бои:
| Оксиди | MnO | Mn2O3 | MnO2 | (MnO3) | Mn2O7 |
| Својства | изречена основна | основни | амфотеричен | кисела | силно кисела |
| Хидроксиди | Mn(OH)2 | Mn(OH)3 | Mn(OH) 4 H 2 MnO 3 | H2MnO4 | HMnO4 |
| Својства | изречена основна | основни | амфотеричен | кисела | високо кисела |
| Наслови | манган(II) хидроксид; Mn(II) соли | манган (III) хидроксид; Mn(III) соли | манган(IV) хидроксид; манганати (IV) | Манган (VI) киселина; манганати (VI) | манган (VII) киселина; перманганати |
| Добивка кисели својства | |||||
| Зајакнување на основните својства |
Соединенија на манган (II).Манган (II) оксид и хидроксид покажуваат само основни својства. Тие се нерастворливи во вода, но лесно се раствораат во киселини за да формираат двовалентни соли на манган.
Повеќето двовалентни соли на манган се многу растворливи во вода и се подложени на хидролиза во катјонот. Ретко растворливите соли вклучуваат меѓусоли - сулфид, фосфат и карбонат.
Во кристална состојба, солите на манган (II) имаат малку розова боја, но во водени раствори тие се практично безбојни.
Дивалентен манган хидроксид се формира индиректно - со дејство на алкали на раствори на сол. Во моментот на формирање, се формира бел талог (почесто се забележува како цврст), кој во воздухот постепено станува кафеав под влијание на атмосферскиот кислород:
2Mn(OH) 2(s) + 2H 2 O (l) + O 2(g) → 2Mn(OH) 4(s)
Форми на манган (II). комплексни соединенијасо координативен број од шест. Во водените раствори, катјонските комплекси се познати во форма на аква комплекс [ Мн(H 2 O) 6 ] 2+ и амонијак [ Мн(NH 3) 6 ] 2+ и анјонски - тиоцијанат [ Мн(Н.С.Ц.) 6 ] 4 - и цијанид [ Мн(CN) 6 ] 4- . Но, сложените соединенија на двовалентен манган се нестабилни и брзо се распаѓаат во водени раствори.
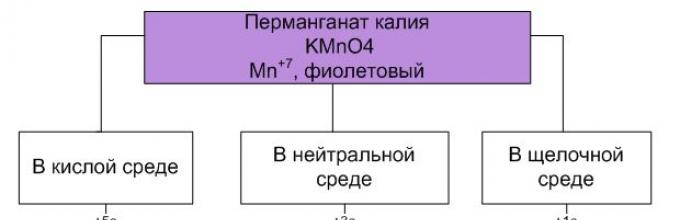
Соединенијата на манган (II) покажуваат редуцирачки својства, оксидираат во неутрална средина до манган (IV), во силно алкална средина до манган (VI) и во кисела средина до манган (VII):
3MnSO 4 (а) + 2KClO 3 (а) +12KOH (а) → 3K 2 MnO 4 (а) + 2KCl (а) + 3K 2 SO 4 (а) + 6H 2 O (l)
2MnSO 4 (c) +5PbO 2 (t) +6HNO 3 (c) →2HMnO 4 (c) +3Pb(NO 3) 2 (c) +2PbSO 4 (c) +2H 2 O (l)
Ако ин витро Mn 2+покажува ресторативни својства, потоа ин виво Mn 2+ресторативните својства се слабо изразени поради стабилизирачкиот ефект на биолигандите.
Соединенија на манган (III).Солите на тривалентен манган се со темна боја и имаат тенденција да формираат сложени соли (киселински комплекси). Сите соли на манган (III) се нестабилни. Во кисел раствор тие лесно се редуцираат до соли на манган (II). Во неутрален раствор, едноставните соли лесно се хидролизираат за да формираат хидроксид Mn(III),кој брзо се трансформира во воздухот во манган (IV) хидроксид. Манган (III) хидроксид - Mn2O3ּ H 2 Oили MnО(OH)природно се јавува како минерал манганита(кафеава манганска руда). Како црно-кафеава боја се користи вештачки произведен манган (III) хидроксид. Манган (III) оксид, кога се загрева на температура од повеќе од 940 o C во воздух или над 1090 o C во проток на кислород, се трансформира во мешан оксид Mn3O4стабилен состав, кој се користи при анализа на тежината.
Соединенија на манган (IV).Оксид Mn(IV)најстабилното кислородно соединение на манган во нормални услови. MnO2а неговиот соодветен хидроксид практично се нерастворливи во вода.
MnO2покажува редокс двојност. Во кисела средина делува како силно оксидирачко средство (+ 1,23 V), намалувајќи на Mn(II).Еден од методите за производство на хлор се заснова на ова својство:
MnO 2 (s) + 4HCl (c) → MnCl 2 (c) + Cl 2 (g) + 2H 2 O (l)
Во алкална средина под влијание на оксидирачки агенси Mn(IV)оксидира до Mn(VI).
Експонати на манган(IV) хидроксид амфотеричен карактер– кисели и базни во еднаква мерка.
Солите на манган (IV) се нестабилни и се распаѓаат во водени раствори за да формираат соли Mn(II).
Соединенија на манган (VI).Шестовалентен манган оксид не е изолиран во слободна форма. Манганот (VI) хидроксид покажува кисел карактер. Слободната манганова киселина (VI) е нестабилна и непропорционална во воден раствор според следната шема:
3H 2 MnO 4 (c) → 2HMnO 4 (c) + MnO 2 (s) + 2H 2 O (l).
Манганите (VI) се формираат со фузија на манган диоксид со алкали во присуство на оксидирачки агенси и имаат смарагдно зелена боја. Во силно алкална средина, манганите (VI) се доста стабилни. При разредување на алкалните раствори, се јавува хидролиза, придружена со диспропорција:
3K 2 MnO 4 (c) + 2H 2 O (l) → 2KMnO 4 (c) + MnO 2 (s) + 4KOH (c).
Манганите (VI) се силни оксидирачки агенси кои се редуцираат во кисела средина до Mn(II),а во неутрални и алкални средини – до MnO2.Под влијание на силни оксидирачки агенси, може да се оксидираат манганати (VI). Mn(VII):
2K 2 MnO 4 (c) + Cl 2 (g) → 2KMnO 4 (c) + 2KCl (c).
Кога се загрева над 500 o C, манганат (VI) се распаѓа на производи:
манганат (IV) и кислород:
2K 2 MnO 4 (t) → K 2 MnO 3 (t) + O 2 (g).
Соединенија на манган (VII).Манган (VII) оксид - Mn2O7се ослободува како темно зелена мрсна течност кога концентрирана сулфурна киселина реагира со калиум перманганат:
2KMnO 4 (t) + H 2 SO 4 (k) = K 2 SO 4 (c) + Mn 2 O 7 (l) + H 2 O (l).
Оксидот на манган (VII) е стабилен до 10 o C и експлозивно се распаѓа според следнава шема:
Mn 2 O 7 (l) → 2MnO 2 (s) + O 3 (g).
При интеракција Mn2O7перманганска киселина се формира со вода HMnO4, која има виолетова-црвена боја:
Mn 2 O 7 (l) + H 2 O (l) = 2HMnO 4 (c) (само во форма на MnO 4 - и H + јони).
Не беше можно да се добие безводна перманганска киселина, во раствор таа е стабилна до концентрација од 20%. Ова многу силна киселина, привидниот степен на дисоцијација во раствор со концентрација од 0,1 mol/dm 3 е 93%.
Перманганската киселина е силен оксидирачки агенс.Содејствува уште поенергично Mn2O7, запаливи материи се палат при контакт со него.
Соли на перманганска киселина се нарекуваат перманганати. Најважен од нив е калиум перманганат, кој е многу силен оксидирачки агенс. Со своите оксидирачки својства кон органски и неоргански материичесто се среќава во хемиската практика.
Стапка на закрепнување перманганат јонзависи од природата на околината:
кисела средина Mn(II) (соли на Mn2+)
MnO 4 - +8H + +5ē = Mn 2+ +4H 2 O, E 0 = +1,51 B
Перманганат неутрален медиум Mn(IV) (манган(IV) оксид)
MnO 4 - +2H 2 O + 3ē = MnO 2 +4OH - ,E 0 = +1,23 B
алкална средина Mn(VI) (манганати M 2 MnO 4)
MnO 4 - +ē = MnO 4 2-, E 0 = +0,56 B
Како што може да се види, перманганатите покажуваат најсилни оксидирачки својства во кисела средина.
Формирањето на манганати се јавува во силно алкален раствор, кој ја потиснува хидролизата K2MnO4. Бидејќи реакцијата обично се одвива во прилично разредени раствори, крајниот производ од редукцијата на перманганат во алкална средина, како и во неутрална средина, е MnO 2 (види несразмерност).
На температура од околу 250 o C, калиум перманганат се распаѓа според следната шема:
2KMnO 4 (t) K 2 MnO 4 (t) + MnO 2 (t) + O 2 (g)
Калиум перманганат се користи како антисептик. Водни раствори со различни концентрации од 0,01 до 0,5% се користат за дезинфекција на рани, гаргара и други антиинфламаторни процедури. Успешно 2 - 5% раствори на калиум перманганат се користат за изгореници на кожата (кожата се суши и не се формира меур). За живите организми, перманганите се отрови (тие предизвикуваат коагулација на протеините). Нивната неутрализација се врши со 3% раствор H 2 O 2, закиселена со оцетна киселина:
2KMnO 4 +5H 2 O 2 +6CH 3 COOH →2Mn(CH 3 COO) 2 +2CH 3 COOC +8H 2 O+ 5O 2
Манганот е биолошки активен микроелемент кој се наоѓа во живите организми. Човечкото тело содржи околу 12 mg манган, при што 43% од оваа количина се наоѓаат во коските, а остатокот во меките ткива. Тој е дел од голем број ензими. Дивалентен манган ја подобрува каталитичката активност голем бројензими од различни класи - трансферази, хидролази, изомерази. Ензимот глутамин синтетаза кој содржи манган ја катализира биосинтезата на глутаминот од глутаминска киселина и амонијак со учество на АТП. Јони Mn 2+стабилизирање на конформацијата нуклеински киселини, учествуваат во процесите на репликација на ДНК, РНК и синтеза на протеини. Јони Mn 3+заедно со Fe 3+е дел од трансферин, супероксид дисмутаза и кисела фосфатаза - дел од типични металопротеини.
Манганот влијае на хематопоезата, растот, репродукцијата, метаболизмот на минералите, липидите и јаглените хидрати и скелетниот развој.
Во токсикологијата, калиум перманганат се користи за квалитативно откривање на метанол, новокаин и кокаин.
Растворот на калиум перманганат се користи како титрант за квантитативно определување на редукционите агенси: Fe 2+, C2O42-, поли- и хидроксикарбоксилни киселини, алдехиди, мравја, урична, аскорбинска киселина со директна титрација и голем број оксидирачки агенси (на пример, нитрати и нитрити) со обратна титрација.
Соединенијата на манган се силни отрови кои делуваат на централниот нервен систем, кои влијаат на бубрезите, белите дробови, срцето.
Потврда
- · Минерали кои се наоѓаат во природатабраунит, курнакит и биксбиит - манган оксид со различни нечистотии.
- · Оксидација на манган(II) оксид:
- Редукција на манган(IV) оксид:
Физички својства
Манганот (III) оксид формира кафеаво-црни кристали со неколку модификации:
- · b-Mn2O3, ромбичен систем, минерал курнакит;
- · β-Mn2O3, кубен систем, просторна група I a3, параметри на ќелијата a = 0,941 nm, Z = 16, минерал биксбајт;
- · g-Mn2O3, тетрагонален систем, клеточни параметри a = 0,57 nm, c = 0,94 nm.
Не се раствора во вода.
Парамагнетни.
Хемиски својства
Се распаѓа кога се загрева:
- Намалено со водород:
- · Кога се раствора во киселини, непропорционално:
- · Кога се спојува со метални оксиди, формира манганитни соли:
Манган (IV) оксид
Табела 6. Манган(IV) оксид.
Хемиски својства
Во нормални услови се однесува прилично инертно. Кога се загрева со киселини, покажува оксидирачки својства, на пример, оксидира концентрирана хлороводородна киселина во хлор:
Со сулфурна и азотна киселина, MnO2 се распаѓа со ослободување на кислород:
При интеракција со силни оксидирачки агенси, манган диоксидот се оксидира до соединенија Mn7+ и Mn6+:
Манган диоксидот покажува амфотерични својства. Така, кога раствор на сулфурна киселина од солта MnSO4 се оксидира со калиум перманганат во присуство на сулфурна киселина, се формира црн талог од солта Mn(SO4)2.
Кога се спојува со алкали и базични оксиди, MnO2 делува како кисел оксид, формирајќи манганитни соли:
Е катализатор за распаѓање на водород пероксид:
Потврда
Во лабораториски услови се добива со термичко разложувањекалиум перманганат:
Може да се подготви и со реакција на калиум перманганат со водород пероксид. Во пракса, добиениот MnO2 каталитички го разградува водород пероксид, како резултат на што реакцијата не продолжува до завршување.
На температури над 100 °C, редукција на калиум перманганат со водород:
Манган (VII) оксид
- · Манган(VII) оксид Mn2O7 - зеленикаво-кафеава мрсна течност (топење=5,9 °C), нестабилна при собна температура; силен оксидатор, при контакт со запаливи материи ги запалува, можеби со експлозија. Експлодира од притискање, од силен блесок на светлина, при интеракција со органски материи. Манган(VII) оксид Mn2O7 може да се добие со дејство на концентрирана сулфурна киселина на калиум перманганат:
- · Добиениот манган(VII) оксид е нестабилен и се распаѓа на манган(IV) оксид и кислород:
- Во исто време, озонот се ослободува:
- Манган (VII) оксид реагира со вода за да формира перманганска киселина:
Манган (VI) оксид
Табела 7. Манган(VI) оксид.
Манган (VI) оксид -- неорганско соединение, оксид на металот манган со формула MnO3, темноцрвена аморфна супстанција, реагира со вода.
хемикалија за производство на манган диоксид
Потврда
· Формирана со кондензација на виолетови пареи што се ослободуваат кога растворот се загревакалиум перманганат во сулфурна киселина:
Физички својства
Манганот (VI) оксид формира темноцрвена аморфна супстанција.
Хемиски својства
- · Се распаѓа кога се загрева:
- Реагира со вода:
- Со алкалии формира соли - манганати:
Модели на промени во својствата на манган оксидите
Најстабилни се MnO2, Mn2O3 и Mn3O4 (мешан оксид - триманган тетрооксид).
Карактеристиките на манган оксидите зависат од степенот на оксидација на металот: со зголемување на степенот на оксидација, киселинските својства се зголемуваат:
MnO > Мn2О3 > MnO2 > Мn2О7
Оксидите на манган покажуваат оксидирачки или редукциони својства во зависност од степенот на оксидација на металот: повисоките оксиди се оксидирачки агенси и се сведуваат на MnO2, пониските оксиди се редукциони агенси и кога се оксидираат формираат MnO2. Така, MnO2 е најстабилен оксид.
методи за производство на манган диоксид
Пронајдокот се однесува на полето на металургијата, поконкретно, на производството на висококвалитетни манган оксиди, кои можат широко да се користат во хемиската и металуршката индустрија. Методот за производство на манган диоксид вклучува растворање на суровините што содржат манган во азотна киселинада се добие раствор од манган нитрати и нитрати од калциум, калиум, магнезиум и натриум нечистотии присутни во рудата. Потоа се врши термичко распаѓање на нитрати во автоклав. Термичкото распаѓање се врши со постојано намалување на притисокот во автоклавот, почнувајќи од притисок од 0,6 MPa и намалувајќи го на 0,15 MPa на крајот од процесот. Во овој случај, пулпата при термичко распаѓање континуирано се меша со мешалка која ротира со брзина од 1-15 вртежи во минута и на неа се нанесува вибрација со фреквенција од 20-50 херци. Методот може да се имплементира во хемиски претпријатија кои имаат автоклави кои работат под притисок. Техничкиот резултат на пронајдокот е производство на манган диоксид со подобрен квалитет. 2 таб., 2 пр.
Пронајдокот се однесува на полето на црната металургија, поконкретно, на производството на висококвалитетен манган диоксид, кој може широко да се користи во хемиската и металуршката индустрија, особено во производството на електролитски и електротермички манган, фероманган со средно јаглерод , и легури со низок фосфор врз основа на него.
Од техничката литература, познати се неколку методи за производство на чист манган диоксид: хемиски, хидрометалуршки, пирохидрометалуршки и пирометалуршки.
Главните барања за хемиски методиДобивањето манган диоксид се:
- - ефикасност на отстранување на фосфор и отпадни карпи;
- - едноставност на хардверски дизајн;
- - високи перформанси;
- - достапност и ниска цена на реагенси.
Постои познат метод за производство на чист манган диоксид со помош на методот на сулфурна киселина. Суштината на методот е како што следува: сулфур диоксид кој содржи сулфур диоксид (SO2) и сулфурен анхидрид (SO3) се пренесува преку суспензија (S:L = 1:4) подготвена од руда и раствор на калциум дитионат. Распуштањето на овие гасови во вода доведува до формирање на сулфурна и сулфурна киселина. Оксидите на манган интензивно се раствораат во сулфурна киселина и формираат манганова сол на дитионат киселина и манган сулфат според реакциите: MnO2+2SO2 = MnS2O6; MnO2+SO2 = MnSO4.
Во присуство на вишок на калциум дитионат, се таложи калциум сулфат и се формира манган дитионат: MnSO4+CaS2O6=MnS2O6+CaSO4
Исцедената пулпа се неутрализира со варово млеко до рН од 4-5, потоа се газира за да се оксидира железен оксид и да се отстрани сулфур диоксидот. Се таложи: железо, фосфор, алуминиум, силициум диоксид. Талогот се филтрира, се мие со топла вода и се испраќа на депонија. Од прочистениот раствор со додавање жива вар се таложи манган во форма на хидроксид и повторно се добива калциум дитионат кој се враќа во процесот:
MnS2O6+Ca(OH)2=Mn(OH) 2+CaS2O6.
Талогот од манган хидроксид се филтрира, се мие, суши и калцинира. Калцинираниот концентрат содржи, %: 92 - MnO2, 1,5 - SiO2, 4,0 - CaO, 0,02 - P2O5 и 0,5-3 - SO 2 (M.I. Gasik. Metalurgy of manganese. Киев: Технологија, 1979, стр.55-).
Недостатоци познат методДобивањето манган диоксид се:
- - комплексност на хардверски дизајн;
- - производот е контаминиран со отпадна карпа (SiO2, CaO итн.);
- - висока концентрација на сулфур во финалниот производ (од 0,5 до 3%).
Најблиску до предложеното според техничката суштина и постигнатиот ефект е методот на производство на манган диоксид со термичко разложување на манган нитрат во присуство на калциум, магнезиум, калиум и натриум нитрати, според кој разградувањето се врши на притисок од 0,15-1,0 MPa (Уверение за автор бр. 1102819, класа C22B 47/00; C01G 45/02, приоритет од 20.05.83, објавено 15.07.84, билтен бр. 26).
Според методот на прототип, манган диоксид се произведува во присуство на калциум, магнезиум, калиум и натриум нитрати, распаѓањето се врши под притисок од 0,15-1,0 MPa.
Технолошки параметри и својства на методот на прототип:
- - температура на распаѓање, °C - 170-190;
- - стапка на формирање на манган диоксид, kg/m3h - 500-700;
- - степен на распаѓање на Mn(NO3)2,% од првобитната количина - 78-87;
- - услови за истовар на пулпа од реакторот - по гравитација;
- - содржина на влага во азотни оксиди, % - 19-25;
- - потрошувачка на енергија, МЈ/кг - 1,7-2,2;
- - Содржина на MnO2 во манган диоксид, % - 99,5.
Недостатоците на овој познат метод се ниската стапка на распаѓање на манган нитрат, високата потрошувачка на енергија и големата количина на вода во добиените азотни оксиди.
Целта на овој изум е да ја поедностави технологијата за производство на манган диоксид, зголемувајќи ја стапката на распаѓање и приносот на производот.
Целта се постигнува со тоа што процесот на термичко распаѓање се изведува со постепено намалување на притисокот во автоклавот, почнувајќи од притисок од 0,6 MPa и сведувајќи го на 0,15 MPa на крајот од процесот, додека пулпата е непрекинато обработено со мешалка која ротира со брзина од 1-15 вртежи / мин; во овој случај, за време на процесот на термичко распаѓање, на ротирачката мешалка се нанесува вибрација со фреквенција од 20-50 херци.
Горната вредност на притисокот за термичко распаѓање на нитрати се определува со условите за преработка на азотни оксиди во киселина (се врши под притисок не поголем од 0,6 MPa), а долната граница се одредува со практична целисходност. Постепеното намалување на притисокот до 0,15 MPa обезбедува поцелосно термичко распаѓање на нитратите на манган.
Намалувањето на брзината на ротација на миксер под 1 вртежи во минута не дава хомоген раствор на пулпа. Зголемувањето на брзината на ротација над 15 вртежи во минута доведува до одвојување на пулпата и појава на области со поголема концентрација на вода (поради разликите во густините).
Пониските фреквенции на вибрации - под 20 херци, наметнати на миксер, практично немаат ефект врз термичкото распаѓање на манган нитрат. Зголемувањето на фреквенцијата на вибрации над 50 херци не е економски оправдано.
Доколку се исполнат овие услови, не само што се зголемува стапката на распаѓање на манган нитрат, туку самиот процес како целина станува технолошки понапреден. Утврдено е дека во предложениот процес, приносот на пулпата не зависи многу од него физички својства, што во голема мера го поедноставува процесот на истоварување од реакторот, додека азотните оксиди содржат помали концентрации на вода и лесно може да се преработат назад во киселина. Во табела 1 се дадени компаративни податоци за технолошките параметри за производство на манган диоксид со користење на познатите и предложените методи. Индикаторите (во просек) за предложениот метод за производство на манган диоксид, претставени во Табела 8, се земени врз основа на резултатите од експериментите (пример 1).
Табела 8
|
Технолошки параметри и својства |
||
|
Познати |
Предложено |
|
|
Температура на распаѓање, °C |
||
|
Притисок, MPa |
Постепено намалување на притисокот од 0,6 до 0,15 |
|
|
Стапка на формирање на манган диоксид, kg/m3h |
||
|
Потребно време за формирање на 200 kg манган диоксид, ч |
||
|
Степен на распаѓање на Mn(NO3)2, % од првобитната количина |
||
|
Услови за истовар на пулпа од реакторот |
Со гравитација |
Со гравитација |
|
Потрошувачка на енергија, MJ/kg MnO2 |
||
|
Брзина на ротација на миксер, вртежи во минута. |
При термичко распаѓање, на ротирачката мешалка се примени вибрации со фреквенција од 30 херци - степенот на распаѓање на Mn(NO3)2 се зголемува за 2-3,5%.
Физичко-хемиски својства на прашокот:
- - густина - 5,10 g/cm3;
- - содржина на MnO2 - 99,6 wt.%;
- - Содржина на Fe - помала од 3×10-4 wt.%,
- - содржина на P - не повеќе од 5H10-3 wt.%;
- - H 2O - не повеќе од 3×10-2 wt.%.
Подолу се дадени примери, кои не се исклучиви на други, во опсегот на тврдењата.
1,5 kg раствор на нитрат од следниот состав, wt.%: 40,15 Mn(NO3)2; 25,7 Ca(NO3) 2; 7,3 Mg(NO3)2; 9,2 KNO3; 5,7 NaNO3; 15,0 H2O.
Тежината на водата отстранета при термичко распаѓање беше одредена од разликата во нејзината тежина во почетниот раствор и во течната фаза на пулпата. Количеството на ослободените азотни оксиди е одредено со стехиометријата на реакцијата на термичко разложување на манган нитрат во согласност со добиената количина на MnO2. Главните резултати од експериментите се претставени во Табела 9.
Табела 9
|
Опции |
Примери за конкретна имплементација |
||||
|
Познат метод |
Предложен метод |
||||
|
Температура на распаѓање, C° |
|||||
|
Притисок, MPa* |
|||||
|
Брзина на ротација на миксер, вртежи во минута |
|||||
|
Фреквенција на вибрации, Hz |
|||||
|
Време на распаѓање, мин |
|||||
|
Стапка на формирање MnO2, kg/m3h |
|||||
|
Волумен на ослободени гасови, m3 на 1 kg MnO2 |
|||||
|
Принос на сув манган диоксид, % |
|||||
|
Горната граница на притисок за термичко распаѓање на нитратите се определува со условите за преработка на азотни оксиди во киселина |
Манган диоксид е добиен со следниот состав, wt.%: MnO2 - 99,6; Р<0,005; S<0,05; SiO2<0,1; (К, Mg, Na, Ca)<0,1.
Така, предложениот метод обезбедува не само побрзо распаѓање на манган нитрат, туку и значително ја поедноставува технологијата на производство на MnO2, како во фазата на истовар, така и во фаза на регенерација на азотни оксиди; во исто време, трошоците за прераспределба се значително намалени. Приносот на добиениот сув манган диоксид е 84-92% наспроти 78% (според познатиот метод) од теоретски можното.
Добиениот манган диоксид се користи за топење на метален манган со процес во екстра-печка.
Полнењето го имаше следниот состав, кг:
- - MnO2 - 10;
- - Ал - 4,9;
- - CaO - 0,6.
Само 15,5 кг.
Смесата беше измешана, натоварена во вратило за топење и запалена со помош на осигурувач. Времето на топење беше 2,4 минути. Добивме 5,25 кг метален состав од манган. % Mn 98,9; Ал 0,96; P - траги (помалку од 0,005%) и 9,3 kg состав на згура, wt.%: MnO 14,6; Al2O3 68,3; CaO 18,0.
Екстракцијата на манган во легурата беше 85,0%.
Згура од топење на метал од манган може да се користи како суровина (наместо боксит) во производството на алуминиум.
Примената на предложениот пронајдок ќе го реши проблемот со користење на значителни резерви на руди на манган со низок степен, особено карбонатни руди на наоѓалиштето Усинск или нодули на фероманган, чие збогатување со кој било друг начин во моментов е непрофитабилно.
Добиените легури на манган се одликуваат со висока концентрација на водечкиот елемент (манган) и мала содржина на штетни нечистотии (фосфор и јаглерод).
Употребата на феролегури од манган при топење на висококвалитетни челични оценки доведува до намалување на потрошувачката на метал на конструкциите, го поедноставува процесот на легирање и обезбедува значителен економски ефект.
Производството на мангански концентрати со хемиски методи значително ќе го намали недостигот на феролегури на манган во земјата, а неговото производство може да се организира во хемиски погони.
Предложениот метод за производство на манган диоксид може да се организира во претпријатија кои имаат способност да користат азотни оксиди.
ПОБАРУВАЊЕ
Метод за производство на манган диоксид со термичко распаѓање, вклучувајќи растворање на суровини што содржат манган во азотна киселина за да се добие раствор од нитрати и нитрати на манган, нечистотии од калциум, калиум, магнезиум, натриум присутни во рудата и последователно термичко распаѓање на нитрати во автоклав, се карактеризира со тоа што термичкото распаѓање се врши при постојано намалување на притисокот во автоклавот, почнувајќи од притисок од 0,6 MPa и намалувајќи го до крајот на процесот на 0,15 MPa, додека пулпата континуирано се обработува со миксер ротира со брзина од 1-15 вртежи во минута и вибрира со фреквенција од 20 -50 Hz.

експериментален дел

Горенаведените искуства се применуваат во големите претпријатија.
Сакам да разгледам лабораториски метод за добивање манган диоксид во калај диоксид.
Додатоци:
- 1. Порцелански сад:
- 2. Стаклен филтер.
Суштината на методот: Подготовка на цврсти оксиди со термичко разложување на мешавина од SnC2O4*H2O и MnSO4*5H2O, калцинирање во воздух.
Прелиминарна синтеза на SnC2O4*H2O.
За да се добие калај оксалат, земавме 10 g калај сулфат и 4,975 g амониум оксалат. Подготвени се раствори од двете супстанци, за таа цел, калај сулфат се раствора во 100 ml вода, а амониум оксалат беше растворен во 50 ml вода. Потоа, раствор од амониум оксалат се додава во растворот на калај сулфат. Забележано е активно таложење на бел фин талог (SnC2O4*H2O). Добиената суспензија се филтрира на густ стаклен филтер.
Равенка на реакција:
SnSO4* H2O +(NH4)2C2O4*H2O>SnC2O4*H2Ov+(NH4)2SO4 + H2O
Резултатот беше 7,934 g калај оксалат, со проценета маса од 9,675. Приносот на реакцијата беше 82,0%.
Според равенките на реакцијата
MnSO4*5H2O >MnO + SO3 (g)+ 5 H2O(g) >MnO2.
SnC2O4*H2O >SnO + CO2 + H2O >SnO2
А) 7,5% MnO2 / 92,5% SnO2.
За да го добиеме, зедовме: 0,75 g SnC2O4 * H2O, 0,07 g MnSO4 * 5H2O. (Бидејќи количината на манган сулфат беше значително помала од количината на амониум оксалат, за да се постигне поголема хомогеност на смесата, по ставањето во порцеланска сад, се додадоа неколку капки вода. Потоа смесата се калцинираше на горилник. ). Режимот на калцинирање на 900 °C за 2 часа не даде никаков резултат (сиво-крем бојата на смесата остана). Како резултат на калцинирање на 1200 °C за 2 часа, примерокот се здоби со светло црвена боја. Тежина на примерокот 0,5 g.
- Б) 15% MnO2 / 85% SnO2. (0,761 g SnC2O4*H2O, 0,088 g MnSO4*5H2O) Тежина на примерокот 0,53 g.
- Б) 22% MnO2 / 78% SnO2. (0,67 g SnC2O4*H2O, 0,204 g MnSO4*5H2O). Тежина на примерокот 0,52 g.
- Г) 28% MnO2 / 72% SnO2 (0,67 g. SnC2O4 * H2O, 0,2911 g. MnSO4 * 5H2O). Тежина на примерокот 0,56 g.
Манган (II) оксид MnO - зелена цврстина - може да се добие со редуцирање на манган (IV) оксид во проток на водород:
MnO 2 + H 2 = MnO + H 2 O
MnO е типичен основен оксид и не реагира со вода. Тоа одговара на манган (II) хидроксид, Mn(OH) 3, кој е слаба база. Се таложи како талог со боја на месо за време на интеракцијата на алкалите со солите на манган (II):
MnСl 2 +2NaOH=Mn(OH) 2 ¯+2NaCl
Mn(OH) 2 +2HCl=MnСl 2 +2H 2 O
Солите на манган (II), по правило, се многу растворливи во вода, освен Mn 3 (PO 4) 2, MnS, MnCO 3.
Манган сулфат(II) MnSO 4 е бела сол, едно од најстабилните соединенија на манган (II). Се јавува во природата во форма на кристален хидрат MnSO 4 7H 2 O. Се користи во боење ткаенини, а исто така, заедно со манган (II) хлорид MnCl 2, за производство на други соединенија на манган.
Манган карбонат(II) MnCO 3 се јавува во природата во форма на манган пшат и се користи во металургијата.
Манган нитрат(II) Mn(NO 3) 2 се добива само вештачки и се користи за сепарација на ретките метали.
Во реакциите на редокс, соединенијата на манган (II) се добри редуцирачки агенси:
3Mn +2 SO 4 +2KCl +5 O 3 +12KOH=3K 2 Mn +6 O 4 +2KCl -1 +3K2SO 4 +6H 2 O (оваа реакција се јавува при фузија)
![]()
2Mn +2 SO 4 +5Pb +4 O 2 + 6HNO 3 =2HMn +7 O 4 +3Pb +2 (NO 3) 2 +2Pb +2 SO 4 +2H 2 O
![]()
Манган (IV) оксид MnO 2 природно се јавува како минерал пиролузит, кој е најважната манганова руда. Манган (IV) оксид е темно кафеава боја, стабилен за време на складирањето, има амфотерични својства, со доминација на киселински својства:
MnO 2 +2KOH=K 2 MnO 3 + H 2 O (реакцијата се јавува при фузија)
И во процесите на редокс, во зависност од условите, може да се однесува или како оксидирачки агенс или како редукционен агенс.
На пример, еден од начините за добивање на хлор е оксидацијата на концентрираниот хлороводородна киселина HСl на манган (IV) оксид според равенката:

Во реакцијата (се јавува при фузија) MnO 2 е редукционо средство:

Манган (IV) оксид служи како катализатор во реакции кои вклучуваат елиминација на кислород, како што е распаѓање бертолет солили водород пероксид:
2КlO 3 = MnO 2 2Кl+3O 2
2H 2 O 2 = MnO 2 2H 2 O + O 2
Манган (IV) оксид се користи во производството на стакло и металургијата.
Манганот (IV) хидроксид е нестабилен, неговата формула може да се претстави во две форми: Mn(OH) 4 и H 4 MnO 4 ортомангана киселина и H 2 MnO 3 метаманганна киселина. Исто како манган (IV) оксид, манган (IV) хидроксид е амфотеричен.
Со употреба на алуминитермичен метод, редуцирање на оксидот Mn 2 O 3 формиран за време на калцинирањето на пиролизитот: ;
Mn 6+ е непропорционален на MnO 2 и MeMnO 4 .
Мн 3+ непропорционално на Mn 2+ и MnO 2 (сол.)
Оксиди:
Познати се манган оксидите во кои се наоѓа во оксидациони состојби +2, +3, +4, +7, како и неколку мешани, на пример Mn 3 0 4. Со зголемување на степенот на оксидација, се зголемува ковалентната природа на врската Mn-O, ослабуваат основните својства и се зголемуваат киселинските својства и се зголемува оксидативната активност. Така, манган (2) оксидот покажува основни и доминантни редукциони својства, а повисокиот манган оксид има кисели својства.
многу карактер. Има изразени оксидирачки својства. Оксидите на манган во средно оксидациони состојби се амфотерични и лесно се редуцираат до Mn(II), покажувајќи својства на силни оксидирачки агенси.
Манган оксид (2).Понискиот оксид MnO е сиво-зелен кристален прав со структура на NaCl. Се јавува природно како минерал манганозит. Неговиот
реактивноста зависи од големината на зрното. Високо дисперзирана форма на оксид, формирана при распаѓање на ниски температури (420 -450 °C) на манган (II) карбонат, оксалат или ацетат, има значителна хемиска активност - се запали во воздухот. Неговото калцинирање во инертна атмосфера доведува до зголемување на зрната и слабеење на хемиската активност. За да се добие фаза на стехиометриски состав, оксидите Mn 3 0 4 и Mn0 2 се редуцираат со водород на високи температури. Понизок манган оксид може да се добие и со реакција на манган
со јаглерод диоксид на температура од 300 °C, редукција или калцинирање на други манган оксиди, како и при дехидрација на Mn(OH)2 хидроксид во редуктивна атмосфера на 800 °C.
Манган (2) оксид е претежно основен по природа. Лесно се раствора во киселини за да формира двовалентни соли на манган. Слабата амфотеричност се појавува само кога
долгорочно вриење со концентрирани алкални раствори:
MnO + 20H - + H 2 0= 4[Mn(OH) 4 ] 2- Спојувањето со натриум хидроксид доведува до оксидација на манган: MnO + 2NaOH = Na 2 Mn0 3 + H 2
Манганот (2) оксид практично не се редуцира со водород, туку реагира со активни метали. Реакцијата со натриум веќе се случува на собна температура, но алуминотермијата бара иницирање со запалива смеса. Јаглеродот или јаглерод моноксидот може да се користат и како средство за намалување.
Оксидот на манган (2) е силен редукционен агенс - на покачени температури тој реагира дури и со толку слаб оксидирачки агенс како јаглерод моноксид (4).
Манган оксид (3). Mn 2 0 3 оксидот е кафеав
прашок кој се распаѓа при загревање. кога се складира во воздух, полека се оксидира во манган(4) оксид, а во евтектичкото топење NaOH-KOH (227 °C) кислородот го претвора во
манганат (5). Манган (3) оксид не комуницира со вода, но е непропорционален во кисела средина.
Како и понискиот манган оксид, тој е претежно основен по карактер, но под одредени услови покажува некои знаци на амфотеричност. Така, при продолжено вриење со алкални раствори, се формираат анјонски хексахидроксоманганати (3) [Mn(OH) 6] 3-, кои постојат само во силно алкална средина. Mn 2 0 3 покажува оксидирачки својства кога се вари со концентрирана хлороводородна киселина.
Манган оксид (4).За манган, ова е најчестиот минерал кој се наоѓа во природата, пиролузит Mn0 2. Меѓу бројните реакции за формирање на Mn0 2, само неколку се претпочитаат поради нивната леснотија на имплементација и репродуктивност. Тие вклучуваат оксидација на соединенија на манган(2) со раствори на хлорати, перманганат
нати, персулфати, хлор и озон, редукција на перманганати со дејство на водород пероксид, хлороводородна киселина, сулфур диоксид, сулфити, алкохоли, соли на манган (2). Поголемиот дел од манган диоксидот се ослободува како кафеав талог, но дел од него останува во форма на колоиден раствор. Манган диоксидот, како соединение со средна оксидациска состојба, покажува оксидирачки и редуцирачки својства. Покажува потипично оксидирачко однесување. Кога се загрева, се јавува интрамолекуларна редокс реакција, придружена со ослободување на кислород и постепено намалување на оксидационата состојба на манган со секвенцијално формирање на различни оксиди. Со сув водород сулфид, реакцијата се одвива многу брзо дури и на собна температура. Кога водородниот сулфид се поминува низ водена суспензија од Mn02, се формира белузлав талог, кој се состои од мешавина од манган(2) сулфид и сулфур; растворот содржи јони S0 4- и S 2 0 2-.
Оксидационите својства на манган диоксидот се најизразени во силно кисела средина. Кога манган диоксидот се третира со ладна концентрирана хлороводородна киселина, останува темен раствор кој содржи комплексна киселина H2 [MnCl6], а можеби и MnCl4 тетрахлорид, не изолиран поединечно. Постепено растворот осветлува поради намалувањето на хлоридот
комплекси [MnС1 6 ] 2- -» [МnС1 6 ] 3- -> Mn 2+ + 6C1 - и ослободување на хлор.
Mn02 е нерастворлив во азотни и разредени сулфурни киселини; само кога се чува долго време под киселински раствор, се забележува постепено ослободување на кислород поради оксидација на водата. Интеракцијата на Mn0 2 диоксид со алкалите се јавува само во концентрирани раствори и се топи. Во зависност од температурата на реакцијата, односот на реагенсите и присуството или отсуството на оксидирачки агенси, како што е атмосферскиот кислород, се формираат анјонски оксоманганати кои содржат манган во различни состојби на оксидација од +3 до +6. На пример, кога манган диоксид реагира со топол концентриран раствор на калиум хидроксид во инертна атмосфера, прво се формира зелен раствор на манганат(4), кој потоа се претвора во темно син раствор кој содржи еквимоларни количества манганат (5) и манганат (3). Кога реакцијата се изведува во воздух на температура од 350 - 450 °C, се формира манганат (6), на температура од 600 -800 °C - манганат (5).
Хидроксиди.
Манган хидроксид (2),талогот што испаѓа во вид на бел (боја на слонова коска) талог под дејство на алкали на водени раствори на соли на манган(2) во воздухот брзо се оксидира, па неговата синтеза се врши во инертна атмосфера. Посилните оксидирачки агенси, како што се бромната вода и хипохлоритот, го претвораат во пиролузит. За разлика од повеќето преодни метални хидроксиди, хидроксид
манган(2) има стехиометриски состав кој одговара на формулата Mn(OH)2; тој е изоструктурен со магнезиум хидроксид; е база со средна јачина, супериорна во однос на амонијакот, затоа влегува во раствор не само под дејство на киселини, туку и во присуство на јони на амониум.
Слабата амфотерна природа на Mn(2) хидроксид се манифестира во неговата способност да формира анјонски хидрокс комплекси: Mn(OH) 2+ OH -<->[Mn(OH) 3] -
Манган хидроксид (3)се формира во форма на кафеав талог со променлив состав при оксидација на манган(2) хидроксид со атмосферски кислород. Првично формираниот производ содржи атоми на манган во две оксидациски состојби: +2 и +3 - и одговара на составот MnOx*nH 2 0.
Кога стои, се претвора во форма на оксохидроксид MnOOH, познат во форма на две модификации: ортохомбична (γ-MnOOH, манганит) и моноклинична (a-MnOOH, груит). Манган(3) оксохидроксид е амфотеричен.
Солта.
Со реакција на манган(2) хидроксид со киселини се добиваат различни соли. За разлика од хидроксидот, сите тие се отпорни на оксидација од атмосферскиот кислород.
Соли на манган (2)формираат хидрати обоени во бледо розова боја, карактеристични за [Mn(H 2 0)6] 2+ катјони. Тие се дел од некои хидрати, на пример MnS0 4 * 7H 2 0, Mn(C10 4) 2 * 6H 2 0, Mn(N0 3) 2 * 6H 2 0. Во водени раствори на соли на манган(2) се јавува хидролиза : [Mn (H 2 0) 6 ] 2+ + H 2 0 = [Mn(H 2 0) 5 OH] + + H 3 0 +
Дејството на сулфитите на алкалните метали врз растворите на соли на манган доведува до таложење на базични соли, на пример NaMn 2 OH(S0 3) 2 (H 2 0).
Кога јоните на Mn 2+ се таложат со раствори на сулфид, се формира талог со боја на месо од хидриран манган(2) сулфид MnS *xH20. Иако кристалната структура на овој производ е непозната, бледо розовата боја покажува дека молекулите на водата ја комплетираат координативната сфера на манган во октаедар. Кога се складира во воздух, талогот постепено оксидира, претворајќи се во кафеав оксохидроксид MnOOH, а во инертна атмосфера губи вода за кристализација, добивајќи зелена боја карактеристична за природниот минерал алабадин (α-MnS), кој има структура
тура тип NaCl. Со третирање на раствор од манган сол со натриум дихидроген фосфат во речиси неутрална средина, можно е да се таложи бел талог од среден ортофосфат Mn 3 (P0 4) 2 * 7H 2 0.
Во алкална средина, основните соли се таложат, на пример Mn 2 (OH) P0 4, Mn 5 (OH) 4 (P0 4) 2.
Познати се и различни киселински фосфати, на пример Mn(H 2 P0 4) 2 * H 2 0, многу растворлив во вода и слабо растворлив MnHP0 4 *H 2 0. Кога растворите на солите на манган (2) се изложени на раствор од натриум карбонат се ослободува бел карбонат талог МnС0 3 кој содржи само мала количина на основна сол. За да се избегне неговото формирање, врнежите се вршат со хидрокарбонат.
Соли на манган (3)
Кога MtOOH се раствора на студ во 70% сулфурна киселина, се формира црвен раствор, од кој може да се изолираат црвени кристали. Најчестиот метод за добивање соли на манган(3) се редокс трансформациите. Така, манган (3) сулфат се синтетизира со анодна оксидација на топол раствор на манган (2) сулфат во сулфурна киселина или со редукција на калиум перманганат со сулфурна киселина:
2KMn0 4 + 4H 2 S0 4 = Mn 2 (S0 4) 3 + K 2 S0 4 + 20 2 + 4H 2 0
Неоргански соли на манган (4)крајно нестабилна и малку проучена. Така, манган (4) сулфат Mn (S0 4) 2 се ослободува во форма на црни кристали од доволно концентрирани сулфатни раствори на манган (2) сулфат кога на нив се додава калиум перманганат.
Соли на манган (6).
Манганите(6) првпат ги подготвил И.Глаубер во
1659 година кога пиролизитот бил растворен во стопена шалитра. Овие супстанции се темнозелени, речиси црни кристали, растворливи во алкални раствори за да формираат смарагдно зелени раствори.
Во неутрални и малку кисели раствори, манганите лесно се раствораат
поделено, како што се суди со формирање на темно кафеав талог од диоксид и појава на темноцрвена боја на растворот. За да се забрза процесот, јаглеродниот диоксид обично се пренесува низ растворот. Меѓу манганатите највисока вредностима калиумова сол K 2 Mn0 4, која се користи за производство на перманганат KM p 04. Погодно е да се добијат манганати од алкални метали во лабораториски услови
оксидација на вода со перманганат во силен алкален раствор. За да го направите ова, перманганатот се става во концентриран алкален раствор и се загрева.