Наставник:
Образовна институција: стручен лицеј на метрото во Санкт Петербург
Академска дисциплина: хемијата
Тема: „Органски соединенија што содржат кислород и азот“
Целна публика: 1 курс
Тип на лекција: генерализација на материјалот, 1 академски. час.
Цели на лекцијата:
Знаење:ги знае формулите и својствата на органските материи што содржат кислород и азот
Разбирање:да ја разбере зависноста на својствата на супстанциите од структурата на молекулата, од функционалната група
Апликација:користат информации за својствата на супстанциите за да изготват равенки на хемиски реакции.
Анализа:анализирајте меѓусебно влијаниегрупи на атоми во молекули на органски материи.
Синтеза:ги сумира информациите за својствата на органските материи во форма на синџир на трансформации
Оценка:Спроведете самооценување користејќи ги предложените рубрики.
Опрема: интерактивна табла, мултимедијална презентација.
План за лекција:
1. Орг. момент
2. Повторување на претходно изучени.
3. Ученички изведби.
4. Самоопределување на учениците по нивоа на самопочит.
5. Самостојна работаучениците.
6. Сумирање на системот ориентиран кон критериуми.
7. Домашна задача.
За време на часовите
1. Време на организирање.
Формирање на групата, извештај од водачот на групата за бројот на присутни ученици.
2. Повторување на претходно научено
Информации за функционални групиах, класи на супстанции кои содржат кислород и азот, за наједноставните претставници на овие класи со помош на интерактивна табла и мултимедијална презентација.
Која група на атоми, нужно присутни во молекулите на супстанции од дадена класа, одредува хемиска функцијасупстанции, т.е Хемиски својства?
Одговор: функционална група на атоми
Наведете го името на функционалната група - OH
Одговор: хидроксилна група на атоми.
Која класа на супстанции ја одредува хидроксилната група на атоми?
Одговор: Алкохоли, ако 1 група е OH, монохидрични алкохоли, ако повеќе од една група е OH, полихидрични алкохоли.
Дајте ѝ име на функционалната група - SON. Која класа на супстанции ја дефинира?
Одговор: алдехидна група, ја дефинира класата на алдехиди.
Дајте го името на функциите на групата - SLEEP. Која класа ја дефинира?
Одговор: карбоксилна група, ја дефинира класата на карбоксилни киселини.
Наведете го името на функциите на групата - NH2. Која класа ја дефинира?
Одговор: Амино групата ја дефинира класата на амини или класата на амино киселини.
Ги слушаме пораките на учениците со мултимедијални презентации за наједноставните претставници различни класисупстанции кои содржат кислород и азот.
3.Студентски настапи.
Порака 1.
Етанол C2H5OH, класа монохидрични алкохоли, функционална група - хидроксилна група на атоми - OH. Квалитативна реакција - интеракција со бакар (II) оксид за формирање на алдехид. Хемиски својства (разликуваме 2 реакции) - согорување и интеракција со метали (Na).
Порака 2.
Пропанетриол (глицерол) C3H7(OH)3. Класа – полихидрични алкохоли, функционални групи – неколку хидроксилни групи – OH. Квалитативна реакција - интеракција со бакар (II) хидроксид. Хемиски својства - интеракција со натриум и водородни халиди.
Лабораториско искуство:
Истурете околу 1 ml раствор на бакар (II) суморат во епрувета и додадете малку раствор на натриум хидроксид додека не се формира син талог од бакар (II) хидроксид. Додадете раствор од глицерин капка по капка во добиениот талог. Протресете ја смесата. Ја забележуваме трансформацијата на синиот талог во син раствор.
(глицерол + Cu(OH)2 ----- синарешение)
Порака 3.
Фенол C6H5OH е наједноставниот претставник на класата на феноли.
Функционална група е хидроксилната група –OH. Квалитативна реакција - формирање на пурпурен раствор при интеракција со железо (III) хлорид или формирање на бел талог при интеракција со бром. Хемиски својства: фенолот е слаба киселина, реагира со метали (Na) со алкалии (NaOH) и бром.
Порака 4.
Етанол или ацеталдехид CH3-COH Функционална група – COH алдехидна група. Класа - алдехиди. Квалитативна реакција е реакција на „сребрено огледало“. Хемиски својства: реакција на редукција и реакција на оксидација.
Лабораториско искуство: демонстративно искуство.
Во епрувета која содржи 1 ml алдехид ( воден раствор) додадете неколку капки раствор на амонијак од сребрен оксид. Ја загреваме епрувета. Набљудуваме ослободување на сребро на ѕидовите на епрувета, површината на стаклото станува огледало.
Порака 5.
Етанонска киселина CH3-COOH (оцетна киселина). Класа - карбоксилни киселини. Функционална група – COOH карбоксилна група. Квалитативна реакција - индикаторот за лакмус станува црвено.
Хемиски својства: како која било киселина комуницира со метали (Na), базни оксиди (Na2O), алкали (NaOH).
Лабораториско искуство:
Истурете малку во сува, чиста епрувета со универзален индикатор. оцетна киселина. Индикаторот станува црвено.
Порака 6.
Гликоза C6H12O6. Класа - јаглехидрати. Функционални групи: 5-OH и 1-COH, т.е. алдехидроалкохол. Квалитативни реакции: реакција со бакар хидроксид за да се формира син раствор. Реакцијата на „сребрено огледало“ со ослободување на сребро на ѕидовите на епрувета. Хемиски својства: редукција до хексахидричен алкохол, оксидација до глуконска киселина, реакција на ферментација.
Порака 7.
Анилин C6H5-NH2.
Функционална група – NH2 амино група. Класа - амини. Квалитативна реакција: интеракција со бромна вода за да се формира бел талог. Хемиски својства: интеракција со хлороводородна киселинаи со бром.
Порака 8.
Аминоетаноична киселина NH2-CH2-COOH или аминооцетна киселина.
Класа - амино киселини. Функционални групи: - NH2 амино група и –COOH карбоксилна група. Хемиски својства: АК - амфотерични соединенија; - NH2 дава основни својства, - COOH дава кисели својства. Затоа, амино киселините се способни да се комбинираат едни со други, формирајќи протеински молекули, а протеините се основата на животот на нашата планета.
4. Самоопределување на учениците по нивоа на самопочит.
Интерактивна табла: учениците на час се запознаваат со развојната картичка за самооценување и го означуваат нивното ниво.
1. Можам да ја идентификувам функционалната група и наједноставниот претставник на класата органски материи со помош на наставникот и белешки (6-7 поени).
2. Можам да идентификувам функционална група, наједноставен претставник на класата органски материи, без помош од наставник и без помош на белешка (8-10 поени).
3. Можам да одредам квалитативна реакција и хемиски својства на супстанција со помош на наставник и белешки (11-14 поени).
4. Можам да одредам квалитативна реакција и хемиски својства на супстанција без помош на наставник и без забелешка (15-18 поени).
Класа | Функционални групи | Наједноставниот претставник | Квалитативни реакции | Хемиски својства |
Монатомски алкохоли | ||||
Полихидрични алкохоли | ||||
Феноли | ||||
Алдехиди | ||||
Карбоксилни киселини | ||||
Јаглехидрати | ||||
Амини | ||||
Амино киселини |
Учениците се запознаваат со системот за оценување ориентирано кон критериумите.
Критериуми:
18 – 15 поени – „одлично“
поени - „добро“
10 – 6 поени – „задоволително“
5 или помалку - „незадоволително“
5. Самостојна работа на учениците.
6. Сумирање на резултатите според системот ориентиран кон критериумот (објавување на бројот на бодови на учениците).
7. Домашна задача:пополнување на табелата.
Со кликнување на копчето „Преземи архива“, целосно бесплатно ќе ја преземете датотеката што ви треба.
Пред да ја преземете оваа датотека, запомнете ги добрите есеи, тестови, термински трудови, тези, статии и други документи кои лежат неподигнати на вашиот компјутер. Ова е ваша работа, таа треба да учествува во развојот на општеството и да им користи на луѓето. Најдете ги овие дела и поднесете ги до базата на знаење.
Ние и сите студенти, дипломирани студенти, млади научници кои ја користат базата на знаење во нивните студии и работа ќе ви бидеме многу благодарни.
За да преземете архива со документ, внесете петцифрен број во полето подолу и кликнете на копчето „Преземи архива“
Слични документи
- - примарни амини NMN 2;
- - секундарни амини KI/UN;
- - терциерни амини KK"K"Y.
Номенклатура на деривати на бензен, нивни сорти и методи на производство, принципи и насоки практична употреба. Структурата на бензенот и неговата ароматичност. Правило на Хакел и карактеристики на неговата примена. Небензеноидни ароматични соединенија.
апстракт, додаде 08/05/2013
Ароматични јаглеводороди: општи карактеристики. Номенклатура и изомеризам, физички и хемиски својства на ароматични јаглеводороди. Механизмот на електрофилни и нуклеофилни реакции на супституција во ароматичните серии. Употребата на арени, нивната токсичност.
апстракт, додаден на 11.12.2011 година
Алканите се заситени јаглеводороди кои содржат само едноставни јаглеродни врски. Подготовка на алкани: индустриски метод, нитрација и оксидација. Јаглеводороди кои содржат двојна јаглеродна врска се алкени или етилен јаглеводороди. Диен јаглеводороди.
предавање, додадено на 05.02.2009 година
Незаситените соединенија со две двојни врски во молекулата се диен јаглеводороди. Врска помеѓу структурата на диен јаглеводороди и нивните својства. Методи за производство на девинил, изопрен, синтетичка гума. Органски халиди и нивна класификација.
предавање, додадено на 19.02.2009 година
Структура, номенклатура на алкените. Незаситени јаглеводороди чии молекули содржат една двојна C-C врска. Хибридизација на орбитали. Слика просторна структураатоми. Просторна изомеризам на јаглеродниот скелет. Физички својства на алкените.
презентација, додадена на 06.08.2015 година
Развој на идеи за органското потекло на маслото. Парафински, нафтански и ароматични јаглеводороди. Притисокот на сатурација на нафтен гас. Температура на кристализација, заматување, замрзнување. Разлики во својствата на маслото во резервоар со масло.
упатство, додадено на 05.02.2014 година
Концептот на алкани (заситени јаглеводороди, парафини, алифатични соединенија), нивните систематски и рационална номенклатура. Хемиски својства на алканите, реакции на радикална супституција и оксидација. Производство и обновување на незаситени јаглеводороди.
Органските супстанции се класа на соединенија кои содржат јаглерод (со исклучок на карбиди, карбонати, јаглеродни оксиди и цијаниди). Името „органски соединенија“ се појави во рана фаза во развојот на хемијата и научниците зборуваат сами за себе... Википедија
Еден од најважните типови органски соединенија. Тие содржат азот. Тие содржат јаглерод-водород и азот-јаглерод врска во молекулата. Маслото содржи хетероцикл што содржи азот, пиридин. Азот е вклучен во протеини, нуклеински киселинии... ...Википедија
Соединенијата на органогерманиум се органометални соединенија кои содржат германиум-јаглеродна врска. Понекогаш тие се однесуваат на какви било органски соединенија што содржат германиум. Првото органогерманско соединение, тетраетилгерман, беше... ... Википедија
Органосилициумските соединенија се соединенија во чии молекули постои директна силициум-јаглеродна врска. Органосилициумските соединенија понекогаш се нарекуваат силикони, од латинското име за силициум, силициум. Органосилициумски соединенија... ... Википедија
Органски соединенија, органска материјаКласа хемиски соединенија, кои содржат јаглерод (со исклучок на карбиди, јаглеродна киселина, карбонати, јаглеродни оксиди и цијаниди). Содржина 1 Историја 2 Час... Википедија
Органометални соединенија (MOCs) се органски соединенија во чии молекули постои врска помеѓу метален атом и јаглероден атом/атоми. Содржина 1 Видови органометални соединенија 2 ... Википедија
Органохалогените соединенија се органски материи кои содржат најмалку една јаглеродна халогена врска C Hal. Органохалогените соединенија, во зависност од природата на халогенот, се делат на: Органофлуорни соединенија; ... ... Википедија
Органометални соединенија (MOCs) се органски соединенија во чии молекули постои врска помеѓу метален атом и јаглероден атом/атоми. Содржина 1 Видови органометални соединенија 2 Начини на подготовка ... Википедија
Органските соединенија кои содржат калај-јаглеродна врска може да содржат и двовалентен и четиривалентен калај. Содржина 1 Методи на синтеза 2 Видови 3 ... Википедија
- (хетероцикли) органски соединенија кои содржат циклуси, кои заедно со јаглеродот вклучуваат и атоми на други елементи. Тие може да се сметаат како карбоциклични соединенија со хетеросупституенти (хетероатоми) во прстенот. Повеќето... ... Википедија
Азотот, како и кислородот, често се наоѓа во органската материја, а неговите соединенија се неопходни за живите организми.
Соединенијата што содржат азот се разликуваат голема разновидностотколку оние што содржат кислород. Ова се должи на фактот дека азотот има поголема валентност и во исто време има три хибридни состојби, како јаглеродниот атом. Врски со сингл врска S-Yсе нарекуваат амини, со двојна врска C=N - имини, со тројна врска C=K - нитрили.
Значајна разлика помеѓу азот и кислород е тоа што азот може да влезе во органски соединенија и во редуцирана и во оксидирана состојба. Електронегативноста на азот (x = 3,0) е поголема од онаа на јаглеродот (x = 2,5) и помала од онаа на кислородот (x = 3,5). Ако азот е поврзан со јаглерод и водород, тогаш неговата оксидациона состојба е -3. Во соединенијата што ја содржат нитро групата -G) 2, азотот е поврзан со кислород и јаглерод и е во +3 оксидациона состојба. Органските соединенија со оксидиран азот содржат внатрешно снабдување со оксидирачки агенс. Ако има неколку нитро групи во молекулата, соединението станува експлозивно. Супстанции од овој тип вклучуваат 2,4,6-тринитротолуен (ТНТ).
Намалениот азот им дава на органските соединенија исти својства како и кислородот: поларитет, базичност и киселост, способност
формираат водородни врски. Сепак, поларитетот на соединенијата што содржат азот е помал, а водородните врски се послаби од оние на соединенијата што содржат кислород. Затоа, според некои физички својстваамините се наоѓаат помеѓу јаглеводородите и алкохолите. Додека сите алкохоли се течности во нормални услови, некои амини се гасови:
Азотот е во состојба vr 3-хибридизацијата е добар донатор на електронски пар. Затоа, како што веќе знаеме, амините покажуваат прилично силни основни својства. Во помала мера, својствата на донаторот се изразени во азот во состојба на хибридизација $p 2. Киселите својства на органските соединенија што содржат азот се многу послаби од оние што содржат кислород. Но, со учество на азотните електрони во конјугација со електроните и јаглеродот, се појавуваат кисели својства.
Една од класите на супстанции што содржат азот - аминиОва е името дадено на органските супстанции кои содржат азот во кои азотниот атом е комбиниран со јаглеводородни радикали и соодветниот број на атоми на водород. Во зависност од бројот на радикали, постојат:
Треба да се напомене дека концептите на примарни, секундарни и терциерни амини не се совпаѓаат со соодветните концепти за алкохоли.
Постојат хомологни серии на заситени, незаситени и ароматични амини. Разлика има и во терминологијата кога се споредуваат алкохоли и амини. Во ароматичните алкохоли, хидроксо групата мора да биде поврзана со јаглеродниот атом во радикалот, а не во ароматичниот прстен. Во случај на соединенија што содржат азот, супстанцијата со NH 2 група поврзана со ароматичниот прстен исто така се смета за амин.
Амините со мала молекуларна тежина се течни или гасовити материи кои се многу растворливи во вода. Имаат непријатен мирис, кој потсетува на амонијак. Специфичниот мирис на рибата се поврзува и со присуството на амини. Високите амини ги покажуваат истите карактеристики што беа забележани за алкохолите и киселините - растворливоста во вода се намалува и се појавува површинска активност.
Подготовка на амини.Еден од методите за производство на амини е сличен на производството на алкохоли. Ова се реакции на халогени јаглеводороди со амонијак, кои се одвиваат преку механизмот на нуклеофилна супституција:
Аминот овде не може да биде директен производ на реакцијата, бидејќи добиениот водород хлорид реагира со него како основа.
давајќи ја аминската сол. Да обележи бесплатноамин, добиената сол се третира со алкали:
Халоген дериват на јаглеводород реагира не само со амонијак, туку и со примарен амин. Во овој случај, се формира секундарен амин, а во следната фаза - терцијарен амин:
Амините се добиваат и со хидрогенизација на нитрилите:
Ароматичните амини се добиваат со редукција на нитро-соединенијата. Металите се користат како редуцирачки агенси во кисела средина:
Овој ароматичен амин се нарекува анилин. Редукцијата на нитро-соединенијата била откриена од N. N. Zinin во 1842 година. Во индустријата, нитробензенот се редуцира со водород преку никел катализатор на ~300°C. Анилинот стана многу важен меѓупроизвод кој се користи за производство на бои, полимери, лекови итн. Светското производство на анилин е над 1 милион тони годишно.
Хемиски својства на амините.Амините се меѓу супстанциите што можат да изгорат за да формираат C0 2, H 2 0 и азот N 2.
Како бази, амините се слични на амонијакот, од кој се произведуваат со замена на водородот со јаглеводородни радикали. Овие радикали влијаат на јачината на базите. Ефектите на индуктивните и мезомерните ефекти врз основните својства се генерално спротивни на нивните ефекти врз киселинските својства. Заситени алкохолиОд страна на кисели својствапослаби од водата, а заситените амини се посилни од амонијакот; фенолите се многу посилни во киселинските својства од алкохолите, а анилинот во основните својства е многу послаб од заситените амини.
ВО екстремни аминиЕфектот +/- на радикалот ја зголемува густината на електроните на азот, со што се зголемува способноста на азотот да донира електронски пар за да формира врска донаторски-акцептор. Кај анилинот, азотниот електронски пар учествува во конјугација со ароматични ТТ електрони и станува помалку достапен за формирање на врска донор-акцептор. Според тоа, супстанциите се распоредени во следниот ред според слабеењето на нивните основни својства:
заситени амини > NH 3 > ароматични амини.
Пример 22.15. Во која насока е поместена рамнотежата на реакцијата помеѓу етиламин и анилин хидрохлорид?
Решение.Етиламинот е посилна основа од анилинот. Затоа, рамнотежата се поместува кон формирање на анилин:
Амините како бази реагираат со металните јони за да формираат сложени соединенија. Металниот јон делува како акцептор за електронскиот пар на азот, како во случај на реакции со амонијак. Многу е познато комплексни соединенијаметали (/-блок со различни амини. При мешање раствори на бакар сулфат и метиламин, се формира интензивно обоен раствор со почиста сина нијанса отколку во случај на реакција со амонијак (став 210):
диамините од типот rIII 2 CH 2 CH 2 1H 2 даваат посилни комплекси од моноамините, бидејќи секоја молекула има два донорски атоми на азот и е поврзана со две врски донор-акцептор.
Примарните амини под дејство азотна киселина(или натриум нитрит во кисела средина) деаминирани,претворање во алкохол:
Во примарните и секундарните амини, водородот од амино групата се заменува со јаглеводородни радикали при реакции со халогени деривати (види подготовка на амини). Амин со киселински халид дава киселински амид кој содржи радикал врзан за азот:
Терциерните амини додаваат халогени деривати на јаглеводороди за да формираат тетрасупституирани (кватернерни) соли на амониум:
Тоа се кристални материи кои се многу растворливи во вода. За разлика од обичните амониумови соли, тие не се хидролизираат и не се разградуваат од алкали.
Во анилин и други ароматични амини, групата NH 2 покажува позитивен мезомерен ефект, забрзувајќи ги реакциите на електрофилна супституција во ароматичниот радикал. Анилинот ја обезбојува бромната вода, формирајќи бел талог од трибромоанилин.
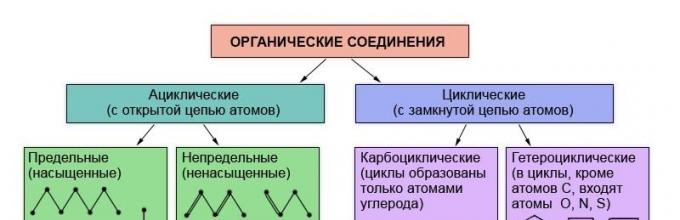
Познато е дека својствата на органските материи се одредуваат според нивниот состав и хемиска структура. Затоа, не е изненадувачки што класификацијата на органските соединенија се заснова на теоријата на структурата - теоријата на L. M. Butlerov. Органските материи се класифицираат според присуството и редоследот на поврзување на атомите во нивните молекули. Најиздржливиот и најмалку променлив дел од молекулата на органска супстанција е нејзиниот скелет - синџир од јаглеродни атоми. Во зависност од редоследот на поврзување на јаглеродните атоми во овој синџир, супстанциите се делат на ациклични, кои не содржат затворени синџири на јаглеродни атоми во молекулите и карбоциклични, кои содржат такви синџири (циклуси) во молекули.
Покрај атомите на јаглерод и водород, молекулите на органските материи можат да содржат атоми на други хемиски елементи. Супстанциите во чии молекули овие таканаречени хетероатоми се вклучени во затворен синџир се класифицирани како хетероциклични соединенија.
Хетероатомите (кислород, азот, итн.) можат да бидат дел од молекули и ациклични соединенија, формирајќи функционални групи во нив, на пример, хидроксил - OH, карбонил, карбоксил, амино група -NH2.
Функционална група- група на атоми што ги одредува најкарактеристичните хемиски својства на супстанцијата и нејзината припадност на одредена класа на соединенија. 
Јаглеводороди- Станува збор за соединенија што се состојат само од атоми на водород и јаглерод.
Во зависност од структурата на јаглеродниот синџир, органските соединенија се делат на соединенија со отворен синџир - ациклични (алифатични) и циклични- со затворен синџир на атоми.
Цикличните се поделени во две групи: карбоциклични соединенија(циклусите се формираат само од јаглеродни атоми) и хетероциклични(циклусите вклучуваат и други атоми, како што се кислород, азот, сулфур).
Карбоцикличните соединенија, пак, вклучуваат две серии на соединенија: алициклични и ароматични.
Ароматичните соединенија, врз основа на структурата на нивните молекули, имаат рамни прстени што содржат јаглерод со посебен затворен систем на p-електрони, формирајќи заеднички π-систем (единствен π-електронски облак). Ароматичноста е карактеристична и за многу хетероциклични соединенија.
Сите други карбоциклични соединенија припаѓаат на алицикличната серија.
И ацикличните (алифатични) и цикличните јаглеводороди можат да содржат повеќе (двојни или тројни) врски. Таквите јаглеводороди се нарекуваат незаситени (незаситени) за разлика од заситените (заситени), кои содржат само единечни врски.
Заситени алифатични јаглеводородиповикани алкани, тие ја имаат општата формула C n H 2 n +2, каде што n е бројот на јаглеродни атоми. Нивното старо име денес често се користи - парафини.
Содржи една двојна врска, го доби името алкени. Тие ја имаат општата формула C n H 2 n.
Незаситени алифатични јаглеводородисо две двојни врскиповикани алкадиени
Незаситени алифатични јаглеводородисо една тројна врскаповикани алкини. Нивната општа формула е C n H 2 n - 2.
Заситени алициклични јаглеводороди - циклоалкани, нивната општа формула е C n H 2 n.
Посебна група јаглеводороди, ароматични, или арени(со затворен заеднички π -електронски систем), познат од примерот на јаглеводороди со општа формула C n H 2 n -6.
Така, ако нивните молекули содржат еден или поголем бројатомите на водород се заменуваат со други атоми или се формираат групи атоми (халогени, хидроксилни групи, амино групи итн.). јаглеводородни деривати: халогени деривати, кои содржат кислород, азот и други органски соединенија.
Халогени дериватијаглеводородите може да се сметаат како производи на замена на еден или повеќе атоми на водород во јаглеводороди со атоми на халоген. Во согласност со ова, може да постојат заситени и незаситени моно-, ди-, три- (во општ случај поли-) халогени деривати.
Општа формула на монохалогени деривати на заситени јаглеводороди:
а составот се изразува со формулата
C n H 2 n +1 G,
каде што R е остаток од заситен јаглеводород (алкан), јаглеводороден радикал (оваа ознака се користи понатаму кога се разгледуваат други класи на органски материи), G е атом на халоген (F, Cl, Br, I).
Алкохоли- деривати на јаглеводороди во кои еден или повеќе атоми на водород се заменети со хидроксилни групи.
Алкохолите се нарекуваат монатомски, ако имаат една хидроксилна група и ограничувачки ако се деривати на алкани.
Општа формула на заситени монохидрични алкохоли:
а нивниот состав се изразува со општата формула:
C n H 2 n +1 OH или C n H 2 n +2 O
Познати се примери на полихидрични алкохоли, односно оние со неколку хидроксилни групи.
Феноли- деривати на ароматични јаглеводороди (бензен серија), во кои еден или повеќе атоми на водород во бензенскиот прстен се заменети со хидроксилни групи.
Наједноставниот претставник со формулата C 6 H 5 OH се нарекува фенол.
Алдехиди и кетони- деривати на јаглеводороди кои содржат карбонилна група на атоми (карбонил).
Во молекулите на алдехид, едната карбонилна врска се поврзува со водороден атом, а другата со јаглеводороден радикал.
Во случај на кетони, карбонилната група е поврзана со два (генерално различни) радикали.
Составот на заситените алдехиди и кетони се изразува со формулата C n H 2l O.
Карбоксилни киселини- јаглеводородни деривати кои содржат карбоксилни групи (-COOH).
Ако има една карбоксилна група во киселинската молекула, тогаш карбоксилната киселина е монобазна. Општа формула на заситени монобазни киселини (R-COOH). Нивниот состав се изразува со формулата C n H 2 n O 2.
Етерисе органски супстанции кои содржат два јаглеводородни радикали поврзани со атом на кислород: R-O-R или R1-O-R2.
Радикалите можат да бидат исти или различни. Составот на етерите се изразува со формулата C n H 2 n +2 O
Естери- соединенија формирани со замена на водородниот атом на карбоксилната група во карбоксилни киселинина јаглеводороден радикал.
Нитро соединенија- деривати на јаглеводороди во кои еден или повеќе атоми на водород се заменети со нитро група -NO 2.
Општа формула на заситени мононитро соединенија:
а составот се изразува со општата формула
C n H 2 n +1 NO 2.
Амини- соединенија кои се сметаат како деривати на амонијак (NH 3), во кои атомите на водород се заменуваат со јаглеводородни радикали.
Во зависност од природата на радикалот, амините можат да бидат алифатичени ароматични.
Во зависност од бројот на атоми на водород заменети со радикали, се разликуваат следниве:
Примарни амини со општа формула: R-NNH 2
Секундарно - со општата формула: R 1 -NН-R 2
Терциерно - со општата формула:
Во одреден случај, секундарните и терциерните амини може да ги имаат истите радикали.
Примарните амини може да се сметаат и како деривати на јаглеводороди (алкани), во кои еден водороден атом е заменет со амино група -NH2. Составот на заситените примарни амини се изразува со формулата C n H 2 n + 3 N.
Амино киселинисодржи две функционални групи поврзани со јаглеводороден радикал: амино група -NH 2 и карбоксил -COOH.
Составот на заситените амино киселини кои содржат една амино група и еден карбоксил се изразува со формулата C n H 2 n + 1 NO 2.
Познати се и други важни органски соединенија кои имаат неколку различни или идентични функционални групи, долги линеарни синџири поврзани со бензенски прстени. Во такви случаи, строго утврдување дали супстанцијата припаѓа на одредена класа е невозможно. Овие соединенија често се класифицираат во специфични групи на супстанции: јаглени хидрати, протеини, нуклеински киселини, антибиотици, алкалоиди итн.

За именување на органски соединенија, се користат две номенклатури: рационални и систематски (IUPAC) и тривијални имиња.
Составување на имиња според номенклатурата IUPAC
1) Основата на името на сложенката е коренот на зборот што означува заситен јаглеводородсо ист број на атоми како и главниот синџир.
2) Наставката се додава на коренот, што го карактеризира степенот на заситеност:
An (крајна, без повеќекратни врски);
-ен (во присуство на двојна врска);
-во (во присуство на тројна врска).
Ако има неколку повеќекратни врски, тогаш суфиксот го означува бројот на таквите врски (-диен, -триен, итн.), а по наставката позицијата на повеќекратната врска мора да биде означена со бројки, на пример:
CH 3 –CH 2 –CH=CH 2 CH 3 –CH=CH–CH 3
бутен-1 бутен-2
CH 2 =CH–CH=CH2
бутадиен-1,3
Во префиксот се ставаат групи како што се нитро-, халогени, јаглеводородни радикали кои не се вклучени во главниот синџир. Тие се наведени по азбучен ред. Позицијата на супституентот се означува со бројот пред префиксот.
Редоследот на именување е како што следува:
1. Најдете го најдолгиот синџир на атоми C.
2. Нумерирајте ги јаглеродните атоми на главниот синџир последователно, почнувајќи од крајот најблиску до гранката.
3. Името на алканот е составено од имињата на страничните радикали, наведени по азбучен ред, означувајќи ја позицијата во главниот синџир и името на главниот синџир.
Номенклатура на некои органски материи (тривијални и меѓународни)