4. Природа и видови на хемиски врски. Ковалентна врска
Апликација. Просторна структурамолекули
Секоја молекула (на пример, CO 2, H 2 O, NH 3) или молекуларен јон (на пример, CO 3 2 −, H 3 O +, NH 4 +) има одреден квалитативен и квантитативен состав, како и структура ( геометрија). Геометрија на молекулитесе формира поради фиксна релативна положбаатоми и вредности на аглите на врската.
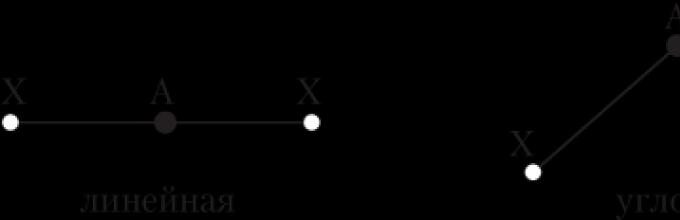
Аголот на врската е аголот помеѓу имагинарните прави линии што минуваат низ јадрата на хемиски сврзани атоми. Можеме да кажеме и дека тоа е аголот помеѓу две линии на врска кои имаат заеднички атом.
Линија за врска е линија што ги поврзува јадрата на два хемиски врзани атоми.
Само во случај на диатомски молекули (H 2, Cl 2 итн.) не се поставува прашањето за нивната геометрија - тие се секогаш линеарни, т.е. јадрата на атомите се наоѓаат на иста права линија. Структурата на посложените молекули може да личи на различна геометриски фигури, На пример:
- триатомски молекули и јони од типот AX 2 (H 2 O, CO 2, BeCl 2)

- тетраатомски молекули и јони од типот AX 3 (NH 3, BF 3, PCl 3, H 3 O +, SO 3) или A 4 (P 4, As 4)

- пентаатомски молекули и јони од типот AX 4 (CH 4, XeF 4, GeCl 4)

Има честички и многу повеќе комплексна структура(октаедар, тригонална бипирамида, рамен правилен шестоаголник). Покрај тоа, молекулите и јоните можат да имаат облик на искривен тетраедар, неправилен триаголник; во молекулите со аголна структура, вредностите на α можат да бидат различни (90°, 109°, 120°).
Структурата на молекулите е сигурно воспоставена експериментално со користење на различни физички методи. За да се објаснат причините за формирање на одредена структура и да се предвиди геометријата на молекулите, развиени се различни теоретски модели. Најлесно за разбирање се моделот на одбивање на валентни електронски парови (модел OVEP) и моделот на хибридизација на валентни атомски орбитали (модел GVAO).
Основата на сите (вклучувајќи ги и двата споменати) теоретски модели кои ја објаснуваат структурата на молекулите е следниов предлог: стабилната состојба на молекулата (јон) одговара на просторен распоред на атомски јадра во кој меѓусебното одбивање на електроните во валентноста слојот е минимален.
Ова го зема предвид одбивањето на електроните и кои учествуваат во формирањето на хемиска врска (електрони на врска) и оние кои не учествуваат (сами парови електрони). Се зема предвид дека орбиталата на сврзувачкиот електронски пар е компактно концентрирана помеѓу два атома и затоа зафаќа помалку простор од орбиталата на осамен пар електрони. Поради оваа причина, одбивниот ефект на неврзувачкиот (осамен) пар на електрони и неговиот ефект врз аглите на врската е поизразен од оној на сврзувачкиот.
OVEP модел. Оваа теорија се заснова на следните основни принципи (наведени на поедноставен начин):
- геометријата на молекулата се одредува само со σ-врски (но не и π-);
- Аглите помеѓу врските зависат од бројот на осамени парови електрони во централниот атом.
Овие одредби треба да се разгледаат заедно, бидејќи и електроните на хемиската врска и осамените парови електрони се одбиваат еден со друг, што на крајот доведува до формирање на молекуларна структура во која оваа одбивност е минимална.
Да ја разгледаме геометријата на некои молекули и јони од гледна точка на методот OVEP; електроните на σ врската ќе бидат означени со две точки (:), единствени парови електрони со конвенционален симбол (или ) или цртичка.
Да почнеме со петатомната молекула на метан CH 4. Во овој случај, централниот атом (овој јаглерод) целосно ги исцрпил своите валентни способности и не содржи осамени парови валентни електрони, т.е. сите четири валентни електрони формираат четири σ врски. Како треба да се позиционираат електроните на σ врската еден на друг така што одбивноста меѓу нив е минимална? Очигледно, под агол од 109°, т.е. по линиите насочени кон темињата на имагинарен тетраедар, во чиј центар е јаглероден атом. Во овој случај, електроните кои учествуваат во формирањето на врската се колку што е можно подалеку еден од друг (за квадратна конфигурација, растојанието помеѓу овие електрони на врската е поголемо, а меѓуелектронската одбивност е помала). Поради оваа причина, молекулата на метан, како и молекулите CCl 4, CBr 4, CF 4, имаат форма редовен тетраедар(се вели дека има тетраедрална структура):

Амониумскиот катјон NH + 4 и анјонот BF 4 − имаат иста структура, бидејќи атомите на азот и бор формираат по четири σ врски и немаат поединечни парови електрони.
Да ја разгледаме структурата на тетраатомската молекула на амонијак NH 3. Молекулата на амонијак има три пара сврзувачки електрони и еден единствен пар електрони на атомот на азот, т.е. исто така четири пара електрони. Меѓутоа, дали аголот на врската ќе остане на 109°? Не, бидејќи осамен пар електрони, кој зафаќа поголем волумен во просторот, има силен одбивен ефект врз електроните на σ врската, што доведува до мало намалување на аголот на врската, во овој случај овој агол е приближно 107°. Молекулата на амонијак има форма на тригонална пирамида (пирамидална структура):

Тетраатомскиот хидрониумски јон H 3 O + исто така има пирамидална структура: атомот на кислород формира три σ врски и содржи еден единствен пар електрони.
Во молекулата со четири атоми BF 3, бројот на σ врски е исто така три, но атомот на бор нема единствени парови електрони. Очигледно, одбивноста на меѓуелектронот ќе биде минимална ако молекулата BF 3 има форма на правилен рамен триаголник со агол на врска од 120 °:

Молекулите BCl 3, BH 3, AlH 3, AlF 3, AlCl 3, SO 3 имаат иста структура и од истите причини.
Каква структура ќе има молекулата на водата?
Триатомската молекула на вода има четири пара електрони, но само два од нив се електрони на σ-врска, а останатите два се осамени парови на електрони од атомот на кислород. Одбивниот ефект на два единствени пара електрони во молекулата H 2 O е посилен отколку во молекулата на амонијак со еден осамен пар, затоа аголот на врската H-O-H е помал од аголот H-N-H во молекулата на амонијак. : во молекула на вода аголот на врската е приближно 105°:

Молекулата на CO 2 (O=C=O) исто така има два пара на сврзувачки електрони (сметаме само σ врски), меѓутоа, за разлика од молекулата на водата, јаглеродниот атом нема осамени парови електрони. Очигледно, одбивноста помеѓу паровите електрони во овој случај ќе биде минимална доколку тие се наоѓаат под агол од 180°, т.е. на линеарна формаМолекули на CO 2:
Молекулите BeH 2, BeF 2, BeCl 2 имаат слична структура и од исти причини. Во триатомска молекула SO 2, централниот атом (атом на сулфур) исто така формира две σ врски, но има осамен пар електрони, затоа молекулата на сулфур(IV) оксид има аголна структура, но аголот на врската во него е поголем од во молекула на вода (атом на кислород два единствени пара електрони, а атомот на сулфур има само еден):

Некои триатомски молекули од составот ABC (на пример, H–C≡N, Br–C≡N, S=C=Te, S=C=O) исто така имаат линеарна структура, во која централниот атом нема осамен парови електрони. Но, молекулата на HClO има аголна структура (α ≈ 103°), бидејќи централниот атом, атомот на кислород, содржи два единствени пара електрони.
Користејќи го моделот OVEP, можете исто така да ја предвидите структурата на молекулите органска материја. На пример, во молекулата на ацетилен C 2 H 2, секој јаглероден атом формира две σ врски, а јаглеродните атоми немаат единствени парови електрони; затоа, молекулата има линеарна структура H–C≡C–H.
Во молекулата на етен C 2 H 4, секој јаглероден атом формира три σ врски, кои, во отсуство на единствени парови електрони на јаглеродните атоми, доведуваат до триаголен распоред на атоми околу секој јаглероден атом:
Во табелата 4.2 сумира некои податоци за структурата на молекулите и јоните.
Табела 4.2
Врска помеѓу структурата на молекулите (јоните) и бројот σ -врски и осамени парови електрони на централниот атом
| Тип на молекула (јон) | Број на σ врски формирани од централниот атом | Број на осамени парови електрони | Структура, агол на врска | Примери на честички (нагласен централен атом) |
|---|---|---|---|---|
| АБ 2 | 2 | 0 | Линеарна, α = 180° | CO 2 , Be H 2 , HC N , Be Cl 2 , C 2 H 2 , N 2 O , C S 2 |
| 1 | Аголна, 90°< α < 120° | Sn Cl 2, S O 2, N O 2 - | ||
| 2 | Аголна, α< 109° | H 2 O , O F 2 , H 2 S , H 2 Se , S F 2 , Xe O 2 , - | ||
| АБ 3 | 3 | 0 | Триаголен, α ≈ 120° | B F 3, B H 3, B Cl 3, Al F 3, S O 3, C O 3 2 -, N O 3 - |
| 1 | Тригонална пирамида, α< 109° | N H 3 , H 3 O + , N F 3 , S O 3 2 − , P F 3 , P Cl 3 , како H 3 | ||
| АБ 4 | 4 | 0 | Тетраедар, α = 109° | N H 4 + , CH 4 , Si H 4 , B F 4 , B H 4 − , S O 4 2 − , A l H 4 − |
GVAO модел. Главната позиција на овој модел е дека формирањето на ковалентни врски не вклучува „чисти“ валентни s -, p - и d - орбитали, туку т.н. хибридни орбитали. Следно, се разгледува хибридизација која вклучува само 2p- и 2s-AOs.
Хибридизацијата е феномен на мешање на валентни орбитали, како резултат на што тие се усогласуваат во форма и енергија.
Концептот на хибридизација секогаш се користи кога електроните од различни енергетски поднивоа кои не се разликуваат многу по енергија учествуваат во формирањето на хемиски врски: 2s и 2p, 4s, 4p и 3d итн.
Хибридната орбитала не е слична по форма на оригиналните 2p- и 2s-AO. Има форма на неправилна тридимензионална фигура осум:
Како што можеме да видиме, хибридните AOs се поиздолжени, така што тие можат подобро да се преклопуваат и да формираат посилни ковалентни врски. Кога хибридните орбитали се преклопуваат, се формираат само σ врски; Поради нивната специфична форма, хибридните АО не учествуваат во формирањето на π-врски (само нехибридните АО формираат π-врски). Бројот на хибридни орбитали е секогаш еднаков на бројот на почетните АО кои учествуваат во хибридизацијата. Хибридните орбитали мора да бидат ориентирани во вселената на таков начин што ќе го обезбедат нивното максимално растојание една од друга. Во овој случај, одбивањето на електроните лоцирани на нив (врзување и неврзување) ќе биде минимално; енергијата на целата молекула исто така ќе биде минимална.
Моделот GVAO претпоставува дека хибридизацијата вклучува орбитали со слични енергетски вредности (т.е. валентни орбитали) и доволно висока густина на електрони. Електронската густина на орбиталата се намалува како што се зголемува нејзината големина, така што улогата во хибридизацијата е особено значајна за молекулите на елементите со мали периоди.
Треба да се запомни дека GVAO не е реален физички феномен, но пригоден концепт (математички модел) кој ви овозможува да ја опишете структурата на некои молекули. Формирањето на хибридни AOs не се открива со никакви физички методи. Сепак, теоријата на хибридизација има одредена физичка оправданост.
Да ја разгледаме структурата на молекулата на метан. Познато е дека молекулата CH4 има форма на правилен тетраедар со јаглероден атом во центарот; сите четири врски C–H се формираат со механизам за размена и имаат иста енергија и должина, т.е. се еквивалентни. Сосема е едноставно да се објасни присуството на четири неспарени електрони во јаглеродниот атом, претпоставувајќи го неговиот премин во возбудена состојба:

Меѓутоа, овој процес на ниту еден начин не ја објаснува еквивалентноста на сите четири врски C-H, бидејќи според горната шема, три од нив се формираат со учество на 2p-AO на јаглеродниот атом, една со учество на 2s-AO, а обликот и енергијата на 2p и 2s-AO се различни.
За да го објасни овој и други слични факти, L. Pauling го разви концептот на GVAO. Се претпоставува дека мешањето на орбиталите се случува во моментот на формирање на хемиски врски. Овој процесбара енергетско трошење за спарување на електрони, кое, сепак, се компензира со ослободување на енергија кога хибридните AO формираат посилни (во споредба со нехибридните) врски.
Врз основа на природата и бројот на АО вклучени во хибридизацијата, се разликуваат неколку видови.
Во случај на хибридизација sp 3, се мешаат една s и три p орбитали (оттука и името на типот на хибридизација). За јаглероден атом, процесот може да се претстави на следниов начин:
1 s 2 2 s 2 2 p x 1 2 p y 1 → транзиција на електрони 1 s 2 2 s 1 2 p x 1 2 p y 1 2 p z 1 → хибридизација 1 s 2 2 (s p 3) 4
или користење електронски конфигурации:

Четири sp 3-хибридни AOs заземаат средна позиција во енергијата помеѓу 2p и 2s AOs.
Шемата за хибридизација sp 3 може да се претстави со помош на слики од обликот AO на јаглеродниот атом:

Така, како резултат на хибридизацијата sp 3, се формираат четири хибридни орбитали, од кои секоја содржи неспарен електрон. Овие орбитали се наоѓаат под агол од 109°28′ во вселената, што обезбедува минимално одбивање на електроните кои се наоѓаат на нив. Ако ги поврзете темињата на хибридните орбитали, ќе добиете тродимензионална фигура - тетраедар. Поради оваа причина, молекулите од составот AX 4 (CH 4, SiH 4, CCl 4 итн.), во кои се реализира овој тип на хибридизација, имаат облик на тетраедар.
Концептот на sp 3 хибридизација на AO исто така добро ја објаснува структурата на молекулите H 2 O и NH 3. Се претпоставува дека 2s - и 2p -AOs на атомите на азот и кислород учествуваат во хибридизацијата. Во овие атоми, бројот на валентни електрони (5 и 6, соодветно) го надминува бројот на sp 3 -хибридни AOs (4), затоа, некои хибридни AOs содржат неспарени електрони, а некои содржат осамени парови електрони:

Гледаме дека во атомот на азот единствениот пар на електрони се наоѓа на еден хибриден AO, а во атом на кислород - на два. Само АО со неспарени електрони учествуваат во формирањето на врски со атоми на водород, а единствените парови електрони ќе имаат одбивен ефект (сл. 4.5) еден врз друг (во случај на кислород) и врз електроните за поврзување (за кислород и азот ).

Ориз. 4.5. Шема на одбивното дејство на сврзувачките и неврзувачките орбитали во молекулата на амонијак (а) и вода (б)
Одбивноста е посилна во случајот на молекулата на водата. Бидејќи атомот на кислород има два единствени пара електрони, отстапувањето од идеалниот агол на врската за овој тип на хибридизација (109°28′) во молекулата на вода е поголемо отколку во молекулата на амонијак (во молекулите H2O и NH3 аголот на врската е 104, соодветно, 5° и 107°).
Моделот на хибридизација sp 3 се користи за објаснување на структурата на дијамант, силициум, јони NH 4 + и H 3 O +, алкани, циклоалкани итн. Во случај на јаглерод, овој тип на хибридизација секогаш се користи кога атом од оваа елемент формира само σ врски.
Во случај на хибридизација на sp 2, една s и две p орбитали се мешаат. Да го разгледаме овој тип на хибридизација користејќи го атомот на бор како пример. Процесот е претставен со користење на енергетски дијаграми


Така, како резултат на sp 2 хибридизација на валентните орбитали на атомот на бор, се формираат три хибридни AO, насочени под агол од 120 °, а една од орбиталите 2p не учествува во хибридизацијата. Хибридните орбитали содржат еден неспарен електрон, се наоѓаат во иста рамнина и ако ги поврзете нивните темиња, ќе добиете правилен триаголник. Поради оваа причина, молекулите од составот AX 3 со sp 2 хибридизација на орбиталите на атомот А имаат триаголна структура, како што е прикажано за молекулата BF 3:

Нехибридниот 2p-AO на атомот на борот е слободен (неокупиран) и ориентиран нормално на рамнината на врските B-F, затоа молекулата BF 3 е акцептор на електрони кога формира ковалентна врска според механизмот донор-акцептор кога во интеракција со молекула на амонијак.
Концептот на хибридизација на sp 2 се користи за да се објасни природата на двојната врска јаглерод-јаглерод кај алкените, структурата на бензенот и графитот, т.е. во случаи кога јаглеродниот атом формира три σ и една π врска.
Просторниот распоред на орбиталите на јаглеродниот атом за хибридизација sp 2 изгледа вака: нехибридниот 2p AO е ориентиран нормално на рамнината во која се наоѓаат хибридните орбитали (и хибридните и нехибридните AO содржат неспарен електрон) .

Да го разгледаме формирањето на хемиски врски во молекулата на етилен H 2 C=CH 2. Во него, хибридните AOs се преклопуваат едни со други и со 1s-AOs на атомот на водород, формирајќи пет σ врски: една C–C и четири C–H. Нехибридните 2p-AOs се преклопуваат странично и формираат π врска помеѓу јаглеродните атоми (сл. 4.6).

Ориз. 4.6. Шема на формирање на σ-врски (а) и π-врска (б) во молекула на етилен
Во случај на sp хибридизација, една s и една p орбитала се мешаат. Да го разгледаме овој тип на хибридизација користејќи го примерот на атомот на берилиум. Да го замислиме процесот на хибридизација користејќи енергетски дијаграм:

и со слика на обликот на орбиталите
Така, како резултат на sp-хибридизација, се формираат два хибридни AOs, од кои секој содржи по еден неспарен електрон. Два 2p-AO не учествуваат во хибридизацијата и, во случај на берилиум, остануваат празни. Хибридните орбитали се ориентирани под агол од 180°, затоа молекулите од типот AX 2 со sp-хибридизација на орбиталите на атомот А имаат линеарна структура (сл. 4.7).

Ориз. 4.7. Просторна структура на молекулата BeCl 2
Користејќи го моделот на sp-хибридизација на орбиталите на јаглеродниот атом, се објаснува природата на тројната врска во алкинските молекули. Во овој случај, два хибридни и два нехибридни 2p-AO (прикажани со хоризонтални стрелки →, ←) содржат неспарен електрон:

Во молекулата на ацетилен HC≡CH, поради хибридните AOs, се формираат σ-врски C–H и C–C:

Хибридните 2p-AOs се преклопуваат во две нормални рамнини и формираат две π врски помеѓу јаглеродните атоми (сл. 4.8).

Ориз. 4.8. Шематски приказ на π-врски (а) и рамнини на π-врски (б) во молекулата на ацетилен (брановитата линија го покажува страничното преклопување на 2p-AO на јаглеродниот атом)
Концептот на sp-хибридизација на орбиталите на јаглеродниот атом овозможува да се објасни формирањето на хемиски врски во молекулите на карбин, CO и CO 2, пропадиен (CH 2 =C=CH 2), т.е. во сите случаи кога јаглеродниот атом формира две σ и две π врски.
Главните карактеристики на разгледуваните типови на хибридизација и геометриските конфигурации на молекулите што одговараат на некои видови хибридизација на орбиталите на централниот атом А (земајќи го предвид влијанието на неврзувачките електронски парови) се претставени во Табела. 4.3 и 4.4.
Табела 4.3
Главни карактеристики различни типовихибридизација
Споредување на податоците во Табела. 4.2 и 4.4, можеме да заклучиме дека двата модели - OVEP и GVAO - водат до исти резултати во однос на структурата на молекулите.
Табела 4.4
Видови на просторна конфигурација на молекули што одговараат на одредени видови на хибридизација
Хемиска врска
Сите интеракции кои водат до комбинација на хемиски честички (атоми, молекули, јони итн.) во супстанции се поделени на хемиски врски и меѓумолекуларни врски (меѓумолекуларни интеракции).
Хемиски врски- се врзува директно меѓу атомите. Постојат јонски, ковалентни и метални врски.
Меѓумолекуларни врски- врски помеѓу молекулите. Ова се водородни врски, јонски-диполни врски (поради формирањето на оваа врска, на пример, се јавува формирање на хидратна обвивка од јони), дипол-дипол (поради формирањето на оваа врска, се комбинираат молекулите на поларните супстанции , на пример, во течен ацетон) итн.
Јонска врска- хемиска врска формирана поради електростатско привлекување на спротивно наелектризирани јони. Во бинарни соединенија (соединенија од два елементи), тој се формира кога големините на врзаните атоми се многу различни една од друга: некои атоми се големи, други се мали - односно некои атоми лесно се откажуваат од електрони, додека други имаат тенденција да прифатете ги (обично тоа се атоми на елементите што формираат типични метали и атоми на елементи што формираат типични неметали); електронегативноста на таквите атоми е исто така многу различна.
Јонското поврзување е ненасочно и незаситено.
Ковалентна врска- хемиска врска која настанува поради формирање на заеднички пар електрони. Ковалентна врска се формира помеѓу мали атоми со исти или слични радиуси. Неопходен услов е присуството на неспарени електрони во двата врзани атоми ( механизам за размена) или осамен пар на еден атом и слободна орбитала на другиот (механизам донатор-акцептор):
| А) | H· + ·H H:H | H-H | H 2 | (еден заеднички пар на електрони; H е едновалентен); |
| б) | НН | N 2 | (три заеднички пара електрони; N е тривалентен); | |
| V) | H-F | HF | (еден заеднички пар на електрони; H и F се едновалентни); | |
| G) | NH4+ | (четири заеднички пара електрони; N е четиривалентен) |
- Врз основа на бројот на споделени електронски парови, ковалентните врски се делат на
- едноставно (сингл)- еден пар електрони,
- двојно- два пара електрони,
- тројки- три пара електрони.
Двојните и тројните врски се нарекуваат повеќекратни врски.
Според распределбата на густината на електроните меѓу врзаните атоми ковалентна врскаподелено со неполарнаИ поларна. Неполарна врска се формира помеѓу идентични атоми, поларна - помеѓу различни.
Електронегативност- мерка за способноста на атомот во супстанција да привлекува заеднички електронски парови.
Електронските парови на поларните врски се поместени кон повеќе електронегативни елементи. Самото поместување на електронските парови се нарекува поларизација на врската. Делумните (вишок) полнежи формирани при поларизација се означени + и -, на пример: .
Врз основа на природата на преклопувањето на електронските облаци („орбитали“), ковалентна врска е поделена на -обврзница и -врзница.
-Поради директното преклопување на електронските облаци (по правата линија што ги поврзува атомските јадра) се формира врска, -поради странично преклопување (од двете страни на рамнината во која лежат атомските јадра).
Ковалентната врска е насочена и заситува, како и поларизира.
Моделот на хибридизација се користи за објаснување и предвидување на взаемната насока на ковалентните врски.
Хибридизација на атомски орбитали и електронски облаци- претпоставеното порамнување на атомските орбитали во енергијата и електронските облаци во форма кога атомот формира ковалентни врски.
Трите најчести типови на хибридизација се: сп-, сп 2 и сп 3 -хибридизација. На пример:
сп-хибридизација - во молекулите C 2 H 2, BeH 2, CO 2 (линеарна структура);
сп 2-хибридизација - во молекулите C 2 H 4, C 6 H 6, BF 3 (рамна триаголна форма);
сп 3-хибридизација - во молекулите CCl 4, SiH 4, CH 4 (тетраедрална форма); NH 3 (пирамидална форма); H 2 O (аголна форма).
Метална врска- хемиска врска формирана со споделување на валентни електрони на сите поврзани атоми на метален кристал. Како резултат на тоа, се формира единствен електронски облак на кристалот, кој лесно се движи под влијание на електричниот напон - оттука и високата електрична спроводливост на металите.
Метална врска се формира кога атомите што се поврзуваат се големи и затоа имаат тенденција да се откажат од електроните. Едноставни супстанции со метална врска се металите (Na, Ba, Al, Cu, Au итн.), сложените супстанции се меѓуметални соединенија (AlCr 2, Ca 2 Cu, Cu 5 Zn 8 итн.).
Металната врска нема насоченост или заситеност. Зачуван е и во метални топи.
Водородна врска- интермолекуларна врска формирана поради делумно прифаќање на пар електрони од високо електронегативен атом од атом на водород со големо позитивно парцијално полнење. Се формира во случаи кога едната молекула содржи атом со осамен пар електрони и висока електронегативност (F, O, N), а другата содржи водороден атом врзан со високополарна врска со еден од таквите атоми. Примери на меѓумолекуларни водородни врски:
H—O—H OH 2, H—O—H NH 3, H—O—H F—H, H—F H—F.
Интрамолекуларните водородни врски постојат во полипептидните молекули, нуклеински киселини, протеини, итн.
Мерка за јачината на која било врска е енергијата на врската.
Комуникациска енергија- енергијата потребна за раскинување на дадена хемиска врска во 1 мол од супстанцијата. Мерната единица е 1 kJ/mol.
Енергиите на јонските и ковалентните врски се од ист ред, енергијата на водородните врски е ред по големина помала.
Енергијата на ковалентна врска зависи од големината на врзаните атоми (должина на врската) и од мноштвото на врската. Колку се помали атомите и колку е поголема множеството на врската, толку е поголема нејзината енергија.
Енергијата на јонската врска зависи од големината на јоните и нивните полнежи. Колку се помали јоните и колку е поголем нивниот полнеж, толку е поголема енергијата на врзувањето.
Структура на материјата
Според видот на структурата, сите супстанции се поделени на молекуларнаИ немолекуларна. Кај органските материи преовладуваат молекуларните материи, кај неорганските супстанци преовладуваат немолекуларните материи.
Врз основа на видот на хемиската врска, супстанциите се делат на супстанции со ковалентни врски, супстанции со јонски врски (јонски супстанции) и супстанции со метални врски (метали).
Супстанциите со ковалентни врски можат да бидат молекуларни или немолекуларни. Ова значително влијае на нивните физички својства.
Молекуларните супстанции се состојат од молекули поврзани едни со други со слаби меѓумолекуларни врски, меѓу кои се: H 2, O 2, N 2, Cl 2, Br 2, S 8, P 4 и други едноставни материи; CO 2, SO 2, N 2 O 5, H 2 O, HCl, HF, NH 3, CH 4, C 2 H 5 OH, органски полимери и многу други супстанции. Овие супстанции немаат висока јачина, тие имаат ниски температуритопење и вриење, не врши електрична енергија, некои од нив се растворливи во вода или други растворувачи.
Немолекуларните супстанции со ковалентни врски или атомски супстанции (дијамант, графит, Si, SiO 2, SiC и други) формираат многу силни кристали (со исклучок на слоевит графит), тие се нерастворливи во вода и други растворувачи, имаат големо топење и Точките на вриење, повеќето од нив не спроведуваат електрична струја (освен графитот, кој е електрично спроводлив, и полупроводниците - силициум, германиум итн.)
Сите јонски супстанции се природно немолекуларни. Тоа се цврсти, огноотпорни материи, раствори и топи од кои спроведуваат електрична струја. Многу од нив се растворливи во вода. Треба да се напомене дека во јонски супстанцииах, чии кристали се состојат од сложени јони, има и ковалентни врски, на пример: (Na +) 2 (SO 4 2-), (K +) 3 (PO 4 3-), (NH 4 +)( NO 3-) итн. Атомите кои сочинуваат сложени јони се поврзани со ковалентни врски.
Метали (супстанции со метални врски)многу различни во нивните физички својства. Меѓу нив има течни (Hg), многу меки (Na, K) и многу тврди метали (W, Nb).
Карактеристично физички својстваметалите се нивната висока електрична спроводливост (за разлика од полупроводниците, таа се намалува со зголемување на температурата), високиот топлински капацитет и еластичноста (за чисти метали).
Во цврста состојба, речиси сите супстанции се составени од кристали. Врз основа на видот на структурата и видот на хемиската врска, кристалите („кристални решетки“) се делат на атомски(кристали на немолекуларни супстанции со ковалентни врски), јонски(кристали на јонски супстанции), молекуларна(кристали на молекуларни материи со ковалентни врски) и метал(кристали на супстанции со метална врска).
Задачи и тестови на тема „Тема 10. „Хемиско поврзување. Структура на материјата“.
- Видови хемиски врски - Структура на материјата одделение 8–9
Часови: 2 Задачи: 9 Тестови: 1
- Задачи: 9 Тестови: 1
Откако ќе работите на оваа тема, треба да ги разберете следните концепти: хемиско поврзување, меѓумолекуларно поврзување, јонска врска, ковалентна врска, метална врска, водородна врска, единечна врска, двојна врска, тројна врска, повеќе врски, неполарна врска, поларна врска, електронегативност, поларизација на врската, - и - врска, хибридизација на атомски орбитали, енергија на врската.
Мора да ја знаете класификацијата на супстанциите по тип на структура, по тип на хемиска врска, зависноста на својствата на едноставни и комплексни супстанцииза видот на хемиската врска и типот на „кристалната решетка“.
Мора да бидете способни: да го одредите типот на хемиската врска во супстанцијата, типот на хибридизација, да изготвувате дијаграми за формирање на врската, да го користите концептот на електронегативност, одреден број на електронегативност; знаат како се менува електронегативноста хемиски елементиеден период и една група за одредување на поларитетот на ковалентна врска.
Откако ќе се уверите дека се што ви треба е научено, продолжете со завршување на задачите. Ви посакуваме успех.
Препорачана литература:
- О. С. Габриелјан, Г. Г. Лисова. Хемија 11 одделение. М., Бустард, 2002 година.
- Г. Е. Руџитис, Ф. Г. Фелдман. Хемија 11 одделение. М., Образование, 2001 година.
Опција 2
Дел А:
А 1. Пар елементи меѓу кои се формира јонска хемиска врска:
а) јаглерод и сулфур, б) водород и азот, в) калиум и кислород, г) силициум и водород.
А 2.Формула на супстанција со ковалентна врска:
а) NaCl, б) HCl, в) BaO, г) Ca 3 N 2.
А 3.Најмалата поларна врска е:
а) C – H, б) C – Cl, в) C – F, г) C – Br.
А 4. Изјавата дека δ е врска, за разлика од π, е точно:
а) помалку силни, б) формирани кога атомските орбитали се преклопуваат странично,
в) не е ковалентен, г) се формира со аксијално преклопување на атомските орбитали.
А 5.Супстанција во молекулата на која нема π врска:
а) етилен, б) бензен, в) амонијак, г) азот.
А 6. Најсилната молекула е:
а) H 2, б) N 2, в) F 2, г) O 2.
А 7. Во јонот CO 3 2-, јаглеродниот атом е во sp 2 - хибридна состојба, така што јонот ја има формата:
а) линеарен, б) тетраедар, в) триаголник, г) октаедар.
А 8. Јаглеродниот атом има оксидационен број -3 и валентност 4 кога се комбинира со формулата:
а) CO 2, б) C 2 H 6, в) CH 3 Cl, г) CaC 2.
А 9. Атомската кристална решетка има:
а) сода, б) вода, в) дијамант, г) парафин.
А 10. Супстанција помеѓу молекулите од кои има водородна врска:
а) етан, б) натриум флуорид, в) јаглерод моноксид (4), г) етанол.
А 11. Изберете група елементи подредени по редослед на зголемување на електронегативноста:
а) Cl, Si, N, O, б) Si, P, N, F, в) F, Cl, O, Si, г) O, N, F, Cl.
А 12. Постои ковалентна врска помеѓу атомите, формирана од механизам донор-акцептор во супстанција, чија формула е:
13.
А 14.Формирањето на водородни врски може да се објасни со:
а) растворливост оцетна киселинаво вода, б) киселински својстваетанол,
в) висока точка на топење на многу метали, г) нерастворливост на метанот во вода.
А 15.Формула на супстанција со поларна ковалентна врска:
а) Cl 2, б) KCl, в) NH 3, г) O 2.
Дел Б:
Б 1. Од предложените, изберете супстанција чија молекула содржи π врски: H 2, CH 4, Br 2, N 2, H 2 S, CH 3 OH, NH 3. Напишете го името на оваа супстанца.
Б 2.Процесот на интеракција на електронските орбитали, што доведува до нивно усогласување по форма и енергија, се нарекува......
Б 3. Како се вика феноменот на зголемување на колоидните честички и нивното таложење од колоиден раствор?
Б 4.Наведете пример за супстанца чија молекула содржи три δ – и една π – врски. Наведете ја супстанцијата во номинативен случај.
Б 5.Во која од наведените супстанции врските се најполарни: водород хлорид, флуор, вода, амонијак, водород сулфид. Запишете ја избраната супстанција со формула.
Дел В:
Од 1.Напиши структурни формулисите изомерни супстанции од составот C 4 H 8. Именувајте ја секоја супстанција.
C 2.Составете ги структурните формули на супстанциите: CHF 3, C 2 H 2 Br 2, O 2.
Состави графички формули: Mg 3 N 2, Na 2 SO 4, KHCO 3.
C 3.
Mg 3 N 2, Cl 2, ZnSO 4, KHS, CH 3 Cl, FeOHCl 2, BrO 2, AsO 4 3-, NH 4 +
Тестбр. 2 „СТРУКТУРА НА МАТЕРИЈАТА“.
Опција 3
Дел А:
А 1. Хемиски врски во супстанции чии формули се CH 4 и CaCl 2, соодветно:
а) јонски и ковалентни поларни, б) ковалентни поларни и јонски,
в) ковалентни неполарни и јонски, г) ковалентни поларни и метални.
А 2.Поларитетот на врската е поголем во супстанцијата со формулата:
а) Br 2, б) LiBr, в) HBr, г) KBr
А 3.Јонската природа на врската во серијата соединенија Li 2 O - Na 2 O - K 2 O - Rb 2 O:
а) се зголемува, б) се намалува, в) не се менува, г) прво се намалува, а потоа се зголемува.
А 4. Постои ковалентна врска помеѓу атомите, формирана од механизам донор-акцептор во супстанција, чија формула е:
а) Al(OH) 3, б) [CH 3 NH 3 ]Cl, в) C 2 H 5 OH, г) C 6 H 12 O 6.
А 5.Неколку формули за супстанции чии молекули содржат само δ врски:
а) CH 4 и O 2, б) C 2 H 5 OH и H 2 O, в) N 2 и CO 2, г) HBr и C 2 H 4.
А 6. Најсилната врска од овие:
а) C - Cl, б) C - F, в) C - Br, г) C - I.
А 7. Група формули на соединенија во кои има слична насока на врски, поради sp 3 - хибридизација на електронски орбитали:
а) CH 4, C 2 H 4, C 2 H 2, б) NH 3, CH 4, H 2 O, в) H 2 O, C 2 H 6, C 6 H 6, г) C 3 H 8, BCl 3, BeCl 2.
А 8. Валентноста и оксидациската состојба на јаглеродниот атом во молекулата на метанол се соодветно еднакви на:
а) 4 и +4, б) 4 и -2, в) 3 и +2, г) 4 и -3.
А 9. Супстанциите со јонска кристална решетка се карактеризираат со:
а) слаба растворливост во вода, б) висока точка на вриење, в) фузибилност, г) испарливост.
А 10. Формирањето на водородна врска помеѓу молекулите доведува до:
а) да се намалат точките на вриење на супстанциите, б) да се намали растворливоста на супстанциите во вода,
в) до зголемување на точките на вриење на супстанциите, г) до зголемување на испарливоста на супстанциите.
А 11. Формула на супстанција со јонска врска:
а) NH 3, б) C 2 H 4, в) KH, г) CCl 4.
А 12. Само δ – врска е присутна во молекулата:
а) азот, б) етанол, в) етилен, г) јаглерод моноксид (4).
13. Молекуларната структура има супстанција со формулата:
а) CH4, б) NaOH, в) SiO 2, г) Al.
А 14.Водородна врска се формира помеѓу:
а) молекули на вода, б) молекули на водород,
в) молекули на јаглеводород, г) атоми на метал и атоми на водород.
А 15.Ако енергично ја протресете мешавината од растително масло и вода, добивате:
а) суспензија, б) емулзија, в) пена, г) аеросол.
Дел Б:
Б 1. Бројот на заеднички електронски парови помеѓу атомите на бром во молекулата Br 2 е……
Б 2.Кои врски ја формираат тројната врска во молекулата N 2 (претставете го вашиот одговор во номинативен случај).
Б 3. На јазлите на металната кристална решетка има…….. .
Б 4.Наведете пример за супстанца чија молекула содржи пет δ - и две π - врски. Наведете ја супстанцијата во номинативен случај.
Б 5.Кој е максималниот број на π врски што можат да се формираат помеѓу два атома во една молекула? (одговорот претставувај го како бројка)
Дел В:
Од 1.Напиши ги структурните формули на сите изомерни супстанции од составот C 5 H 10 O. Наведете ја секоја супстанција.
C 2.Составете ги структурните формули на супстанциите: CHCl 3, C 2 H 2 Cl 2, F 2.
Составете графички формули: AlN, CaSO 4, LiHCO 3.
C 3.Одредете ја состојбата на оксидација во хемиски соединенијаи јони:
HNO 3, HClO 4, K 2 SO 3, KMnO 4, CH 3 F, MgOHCl 2, ClO 3 -, CrO 4 2-, NH 4 +
Поврзани информации.
Тест бр. 2 DKR „СТРУКТУРА НА СУПСТАНЦИЈАТА“.
А 1. Хемиски врски во супстанции чии формули се CH 4 и CaCl 2, соодветно:
а) јонски и ковалентни поларни, б) ковалентни поларни и јонски,
в) ковалентни неполарни и јонски, г) ковалентни поларни и метални.
А 2.Поларитетот на врската е поголем во супстанцијата со формулата:
а) Br 2, б) LiBr, в) HBr, г) KBr
А 3.Јонската природа на врската во серијата соединенија Li 2 O - Na 2 O - K 2 O - Rb 2 O:
а) се зголемува, б) се намалува, в) не се менува, г) прво се намалува, а потоа се зголемува.
А 4. Постои ковалентна врска помеѓу атомите, формирана од механизам донор-акцептор во супстанција, чија формула е:
а) Al(OH) 3, б) [CH 3 NH 3 ]Cl, в) C 2 H 5 OH, г) C 6 H 12 O 6.
А 5.Неколку формули за супстанции чии молекули содржат само δ врски:
а) CH 4 и O 2, б) C 2 H 5 OH и H 2 O, в) N 2 и CO 2, г) HBr и C 2 H 4.
А 6. Најсилната врска од овие:
а) C - Cl, б) C - F, в) C - Br, г) C - I.
А 7. Група формули на соединенија во кои има слична насока на врски, поради sp 3 - хибридизација на електронски орбитали:
а) CH 4, C 2 H 4, C 2 H 2, б) NH 3, CH 4, H 2 O, в) H 2 O, C 2 H 6, C 6 H 6, г) C 3 H 8, BCl 3, BeCl 2.
А 8. Валентноста и оксидациската состојба на јаглеродниот атом во молекулата на метанол се соодветно еднакви на:
а) 4 и +4, б) 4 и -2, в) 3 и +2, г) 4 и -3.
А 9. Супстанциите со јонска кристална решетка се карактеризираат со:
а) слаба растворливост во вода, б) висока точка на вриење, в) фузибилност, г) испарливост.
А 10. Формирањето на водородна врска помеѓу молекулите доведува до:
а) да се намалат точките на вриење на супстанциите, б) да се намали растворливоста на супстанциите во вода,
в) до зголемување на точките на вриење на супстанциите, г) до зголемување на испарливоста на супстанциите.
А 11. Формула на супстанција со јонска врска:
а) NH 3, б) C 2 H 4, в) KH, г) CCl 4.
А 12
А13.Молекуларната структура има супстанција со формулата:
А 14.Водородна врска се формира помеѓу:
а) молекули на вода, б) молекули на водород,
в) молекули на јаглеводород, г) атоми на метал и атоми на водород.
А 15.Ако енергично ја протресете мешавината од растително масло и вода, добивате:
а) суспензија, б) емулзија, в) пена, г) аеросол.
А 16. Формула на супстанција со поларна ковалентна врска:
а) Cl 2, б) KCl, в) NH 3, г) O 2.
А 17.Супстанција помеѓу молекулите на кои има водородна врска:
а) етанол, б) метан, в) водород, г) бензен.
А 18.Број на споделени електронски парови во молекула на водород:
а) еден, б) два, в) три, г) четири.
А 19. Поларитетот на хемиската врска се зголемува кај голем број соединенија чии формули се:
а) NH 3, HI, O 2, б) CH 4, H 2 O, HF, в) PH 3, H 2 S, H 2, г) HCl, CH 4, CL 2.
А 20.Кристална решетка од натриум хлорид:
а) атомски, б) јонски, в) метални, г) молекуларни.
А 21. Број на δ и π врски во молекула на ацетилен:
а) 5 δ и π - не, б) 2 δ и 3 π, в) 3 δ и 2 π, г) 4 δ и 1 π.
А 22. Супстанциите чии формули се: CH 3 – CH 2 – OH и CH 3 – O – CH 3 се:
а) хомолози, б) изомери, в) иста супстанција, г) и хомолози и изомери.
А 23. Хомологот на супстанција чија формула е CH 2 = CH – CH 3 е:
а) бутан, б) бутен - 1, в) бутен - 2, г) бутен - 1.
А 24. Ковалентна неполарна врска се формира помеѓу атомите:
а) водород и кислород, б) јаглерод и водород, в) хлор, г) магнезиум.
А 25. Само δ – врска е присутна во молекулата:
а) азот, б) етанол, в) етилен, г) јаглерод моноксид (4).
А 26. Атомот на азот има валентност 3 и состојба на оксидација од 0 во молекула на супстанција чија формула е:
а) NH 3, б) N 2, в) CH 3 NO 2, г) N 2 O 3.
А 27. Молекуларната структура има супстанција со формулата:
а) CH4, б) NaOH, в) SiO 2, г) Al.
А28.Врската C-H е посилна од врската Si-H бидејќи:
а) должината на врската е пократка, б) должината на врската е подолга,
в) поларитетот на врската е помал, г) поларитетот на врската е поголем.
А 29.Постои ковалентна врска помеѓу атомите, формирана од механизам донор-акцептор во супстанција, чија формула е:
а) CH 3 NO 2, б) NH 4 NO 2, в) C 5 H 8, г) H 2 O.
А 30.Најмалата поларна врска е:
а) C – H, б) C – Cl, в) C – F, г) C – Br
Дел Б:
Б 1. Бројот на заеднички електронски парови помеѓу атомите на бром во молекулата Br 2 е……
Б 2.Кои врски ја формираат тројната врска во молекулата N 2 (претставете го вашиот одговор во номинативен случај).
Б 3. На јазлите на металната кристална решетка има…….. .
Б 4.Наведете пример за супстанца чија молекула содржи пет δ - и две π - врски. Наведете ја супстанцијата во номинативен случај.
Б 5.
Б 6. Бројот на заеднички електронски парови помеѓу атомите на бром во молекулата N 2 е……
Б 7.Кои врски ја формираат тројната врска во молекулата C 2 H 2 (претставете го вашиот одговор во номинативен случај).
Б 8. Кај јазлите на јонската кристална решетка има......... .
Б 9.Наведете пример за супстанца чија молекула содржи пет δ – и една π – врски. Наведете ја супстанцијата во номинативен случај.
Б 10.Кој е максималниот број на π врски што можат да се формираат помеѓу два атома во една молекула? (одговорот претставувај го како бројка)
Дел В:
Од 1.Напиши ги структурните формули на сите изомерни супстанции од составот C 5 H 10 O. Наведете ја секоја супстанција.
C 2 .
Составете ги структурните формули на супстанциите: CHCl 3, C 2 H 2 Cl 2, F 2.
Составете графички формули: AlN, CaSO 4, LiHCO 3.
C 3.
HNO 3, HClO 4, K 2 SO 3, KMnO 4, CH 3 F, MgOHCl 2, ClO 3 -, CrO 4 2-, NH 4 +
C 4.Напиши ги структурните формули на сите изомерни супстанции од составот C 4 H 8 O 2. Именувајте ја секоја супстанција.
C 5 .
Составете ги структурните формули на супстанциите: CHBr 3, C 2 H 2 Br 2, Br 2.
Составете графички формули: Al 2 S 3, MgSO 4, Li 2 CO 3.
Од 6.Определете го степенот на оксидација во хемиските соединенија и јони:
CCl 4, Ba(NO 3) 2, Al 2 S 3, HClO 3, Na 2 Cr 2 O 7, K 2 O 4, SrO 2-, Cr 2 O 3 2
Страница 1
Новикова Олесија Владимировна
Наставник по хемија и биологија
Општинска образовна установа - средно училиште со. Прокудино
Округот Аткарски
Саратовскиот регион.
Тест бр. 1 на тема: „Структура на супстанциите“.
Опција Јас .
а) водород хлорид
б) натриум хидроксид
в) јаглерод моноксид (II)
г) јаглерод моноксид (IV)
2. Во молекулата е присутна поларна ковалентна врска
а) кислород
б) ромбичен сулфур
г) водород
3. Хемиска врска во молекула на јаглерод диоксид
а) ковалентна неполарна
б) ковалентна поларна
в) метал
г) јонски
4. Најсилната молекула е:
А) Х 2 ;
б) Н 2 ;
V) Ф 2 ;
G) О 2 .
5. Супстанција меѓу молекулите на кои има водородна врска:
б) натриум флуорид;
в) јаглерод моноксид (II);
г) етанол.
6. Супстанциите со јонска кристална решетка се карактеризираат со:
а) слаба растворливост во вода; в) фузибилност;
б) висока точка на вриење; г) нестабилност.
7. Формирањето на водородна врска помеѓу молекулите доведува до:
а) до намалување на точките на вриење;
б) да се намали растворливоста на супстанциите во вода;
в) да се зголемат температурите на вриење;
г) да се зголеми испарливоста на супстанциите.
8. Која супстанца содржи повеќе кислород во Na 2 CO 3 или во Ca(HCO 3 ) 2?
9. :
А) SO 2 +H 2 O͢͢→
Б) Na+H 2 O→
Б) Na 2 O+H 2 O→
Г) S+H 2 O→
10. Реши го проблемот :
Колку вода и натриум хидроксид се потребни за да се подготват 180 g 15% раствор?
11 . Реши го проблемот :
Колкава е масата на кислородот што се добива со фракциона дестилација од 200 m 3 (н.с.) воздух, ако волуменската фракција на кислородот е 0,21?
Тест бр. 1 на тема „Структура на супстанции“.
Опција II .
Јонското хемиско поврзување се јавува во
а) кристален сулфур
б) цврст јод
в) калциум јодид
г) фосфор оксид (v)
2. Ковалентна поларна врска е присутна во молекулата
а) сулфурна киселина
б) пластичен сулфур
г) рубидиум сулфид
3. Хемиска врска во молекула на водород
а) ковалентна неполарна
б) ковалентна поларна
в) метал
г) јонски
4. Најсилните врски во молекула на супстанција чија формула е:
А) Х 2 С ;
б) Х 2 Се ;
V) Х 2 О ;
G) Х 2 Те .
5. Молекуларната структура има супстанции со формулата:
А) CH 4 ;
б) NaOH ;
V) SiO 2 ;
G) Ал .
6. Водородна врска се формира помеѓу:
а) молекули на вода; в) молекули на јаглеводород;
б) молекули на водород; г) атоми на метал и атоми на водород.
7. Создавањето на водородни врски може да се објасни со:
а) растворливост на оцетна киселина во вода;
б) кисели својства на етанолот;
в) висока точка на топење на многу метали;
г) нерастворливост на метанот во вода.
8. Споредете ја содржината на сулфур во Mg(HSO 4) 2 и CuSO 4?
9. Дополни ги равенките на можните реакции :
А) CO 2 +H 2 O͢͢→
Б) Al+H 2 O→
Б) Fe+H 2 O→
Г) C+H 2 O→
10. Реши го проблемот:
Неопходно е да се подготват 540 g 12% раствор азотна киселина. Пресметајте колку вода и киселина треба да се земе за да се подготви таков раствор.
11. Реши го проблемот:
Колкава е масата на азот добиен од 143,6 литри воздух кој содржи 78% волуменски азот?