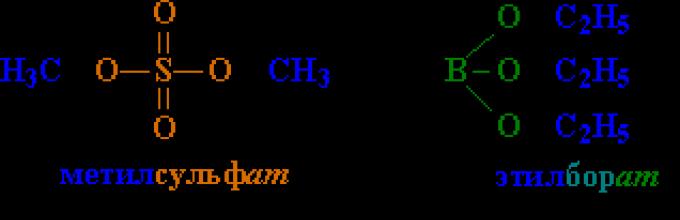Ако почетната киселина е полибазна, тогаш е можно формирање или на полни естери - сите HO групи се заменети или киселински естри - делумна замена. За монобазни киселини, можни се само полни естери (сл. 1).
Ориз. 1. ПРИМЕРИ НА ЕСТЕРИврз основа на неорганска и карбоксилна киселина
Номенклатура на естри.
Името е создадено на следниов начин: прво се означува групата R прикачена на киселината, потоа името на киселината со наставката „at“ (како во имињата на неорганските соли: јаглерод нанатриум, нитрат нахром). Примери на Сл. 2

Ориз. 2. ИМИЊА НА ЕСТЕРИТЕ. Фрагменти од молекули и соодветни фрагменти од имиња се означени во иста боја. Естерите обично се сметаат како производи на реакција помеѓу киселина и алкохол; на пример, бутил пропионат може да се смета како резултат на реакцијата помеѓу пропионската киселина и бутанолот.
Ако користите тривијални ( цм. ТРИВИАЛНИ ИМИЊА НА СУПСТАНЦИИ) името на почетната киселина, потоа името на соединението го вклучува зборот „естер“, на пример, C 3 H 7 COOC 5 H 11 - амил естер на маслен киселина.
Класификација и состав на естри.
Меѓу проучуваните и широко користените естри, мнозинството се соединенија добиени од карбоксилни киселини. Естерите базирани на минерални (неоргански) киселини не се толку разновидни, бидејќи класата на минерални киселини е помалку бројна од карбоксилните киселини (разновидноста на соединенијата е еден од белезите на органската хемија).
Кога бројот на атоми C во оригиналната карбоксилна киселина и алкохол не надминува 6-8, соодветните естри се безбојни мрсни течности, најчесто со овошен мирис. Тие формираат група на овошни естри. Ако ароматичен алкохол (содржи ароматично јадро) е вклучен во формирањето на естер, тогаш таквите соединенија, по правило, имаат цветен наместо овошен мирис. Сите соединенија од оваа група се практично нерастворливи во вода, но лесно растворливи во повеќето органски растворувачи. Овие соединенија се интересни поради нивната широка палета на пријатни ароми (Табела 1); некои од нив прво биле изолирани од растенија, а подоцна вештачки синтетизирани.
| Табела 1. НЕКОИ ЕСТЕРИ, со овошна или цветна арома (фрагменти од оригиналните алкохоли во формулата на соединението и во името се означени со задебелени букви) | ||
| Формула естер | Име | Арома |
| CH 3 КОО C 4 H 9 | Бутилацетат | круша |
| C 3 H 7 COO CH 3 | МетилЕстер на бутирна киселина | јаболко |
| C 3 H 7 COO C 2 H 5 | ЕтилЕстер на бутирна киселина | ананас |
| C 4 H 9 COO C 2 H 5 | Етил | темноцрвена |
| C 4 H 9 COO C 5 H 11 | изоамилестер на изовалерична киселина | банана |
| CH 3 КОО CH 2 C 6 H 5 | Бензилацетат | јасмин |
| C 6 H 5 COO CH 2 C 6 H 5 | Бензилбензоат | цветни |
Кога големината на органските групи вклучени во естерите се зголемува на C 15-30, соединенијата добиваат конзистентност на пластични, лесно омекнати супстанции. Оваа група се нарекува восоци; тие обично немаат мирис. Пчелин восок содржи мешавина од различни естери; една од компонентите на восокот, кој беше изолиран и утврден неговиот состав, е мирицил естерот на палмитинската киселина C 15 H 31 COOC 31 H 63. Кинескиот восок (производ на кохинеална екскреција - инсекти од Источна Азија) содржи церилен естер на церотинска киселина C 25 H 51 COOC 26 H 53. Покрај тоа, восоците содржат и слободни карбоксилни киселини и алкохоли, кои вклучуваат големи органски групи. Восоците не се навлажнуваат со вода и се растворливи во бензин, хлороформ и бензен.
Третата група се мастите. За разлика од претходните две групи врз основа на монохидрични алкохоли ROH, сите масти се естри формирани од трихидричниот алкохол глицерол HOCH 2 – CH (OH) – CH 2 OH. Карбоксилните киселини кои ги сочинуваат мастите обично имаат јаглеводороден синџир со 9-19 јаглеродни атоми. Животинските масти (кравјо путер, јагнешко, сало) се пластични, топливи материи. Растителни масти (маслиново, памучно семе, сончогледово масло) се вискозни течности. Животинските масти главно се состојат од мешавина на глицериди на стеаринска и палмитинска киселина (сл. 3А, Б). Растителните масла содржат глицериди на киселини со малку пократка должина на јаглеродниот синџир: лауринска C 11 H 23 COOH и миристичка C 13 H 27 COOH. (како стеаринската и палмитинската киселина, ова се заситени киселини). Таквите масла можат да се чуваат во воздух долго време без да се менува нивната конзистентност и затоа се нарекуваат несушени. Спротивно на тоа, маслото од ленено семе содржи незаситен глицерид на линолова киселина (Слика 3Б). Кога се нанесува во тенок слој на површината, таквото масло се суши под влијание на атмосферскиот кислород за време на полимеризацијата долж двојните врски и се формира еластична фолија која е нерастворлива во вода и органски растворувачи. Природното масло за сушење е направено од ленено масло.

Ориз. 3. ГЛИЦЕРИДИ НА СТЕАРИЧНА И ПАЛМИТИЧНА КИСЕЛИНА (А И Б)– компоненти на животинска маст. Глицеридот на линолеинската киселина (Б) е компонента на маслото од ленено семе.
Естерите на минералните киселини (алкил сулфати, алкилборати кои содржат фрагменти од пониски алкохоли C 1-8) се мрсни течности, естерите на повисоките алкохоли (почнувајќи од C 9) се цврсти соединенија.
Хемиски својства на естерите.
Најкарактеристично за естерите на карбоксилните киселини е хидролитичкото (под влијание на водата) расцепување на естерската врска; во неутрална средина се одвива бавно и значително се забрзува во присуство на киселини или бази, бидејќи H + и HO – јоните го катализираат овој процес (сл. 4А), при што хидроксилните јони дејствуваат поефикасно. Хидролизата во присуство на алкалии се нарекува сапонификација. Ако земете количина на алкали доволна за да ја неутрализирате целата формирана киселина, тогаш настанува целосна сапонификација на естерот. Овој процес се изведува на индустриско ниво, а глицеринот и повисоките карбоксилни киселини (C 15-19) се добиваат во форма на соли алкални метали, што претставува сапун (сл. 4Б). Фрагменти од незаситени киселини содржани во растителните масла, како и сите незаситени соединенија, може да се хидрогенизираат, водородот се врзува за двојни врски и се формираат соединенија слични на животинските масти (сл. 4Б). Со овој метод, цврстите масти се произведуваат индустриски врз основа на сончогледово, соја или пченкарно масло. Од хидрогенизација производи на растителни масла измешани со природни животински масти и разни адитиви за храна, направете маргарин.

Главниот метод на синтеза е интеракцијата на карбоксилна киселина и алкохол, катализирана од киселината и придружена со ослободување на вода. Оваа реакција е спротивна од онаа прикажана на сл. 3А. За да може процесот да продолжи во посакуваната насока (синтеза на естер), водата се дестилира (дестилира) од реакционата смеса. Преку посебни студии користејќи означени атоми, беше можно да се утврди дека за време на процесот на синтеза, атомот О, кој е дел од добиената вода, се одвојува од киселината (означена со рамка со црвена точки), а не од алкохолот ( нереализираната опција е означена со сина рамка со точки).
Естерите се подготвуваат со истата шема неоргански киселини, на пример, нитроглицерин (сл. 5Б). Наместо киселини, може да се користат киселински хлориди; методот е применлив и за карбоксилни (сл. 5C) и за неоргански киселини (сл. 5Д).
Интеракцијата на солите на карбоксилна киселина со RCl халиди, исто така, доведува до естри (слика 5D); реакцијата е погодна по тоа што е неповратна - ослободената неорганска сол веднаш се отстранува од органскиот медиум за реакција во форма на талог.
Употреба на естри.
Етил формат HCOOC 2 H 5 и етил ацетат H 3 COOC 2 H 5 се користат како растворувачи за целулозни лакови (врз основа на нитроцелулоза и целулоза ацетат).
Естерите базирани на пониски алкохоли и киселини (Табела 1) се користат во Прехранбена индустријакога се создаваат овошни есенции и естри базирани на ароматични алкохоли - во парфемската индустрија.
Полирање, лубриканти, композиции за импрегнирање за хартија (восочена хартија) и кожа се направени од восоци; тие исто така се вклучени во козметичките креми и медицинските масти.
Мастите, заедно со јаглехидратите и протеините, сочинуваат збир на храна неопходна за исхрана; тие се дел од сите растителни и животински клетки; покрај тоа, кога се акумулираат во телото, играат улога на енергетски резерват. Поради својата ниска топлинска спроводливост, масниот слој добро ги штити животните (особено морските животни - китови или моржови) од хипотермија.
Животинските и растителните масти се суровини за производство на повисоки карбоксилни киселини, детергентии глицерин (сл. 4), кој се користи во козметичката индустрија и како компонента на различни лубриканти.
Нитроглицеринот (сл. 4) е добро познат лек и експлозив, основата на динамитот.
Маслата за сушење се направени од растителни масла (слика 3), кои ја формираат основата на маслените бои.
Естерите на сулфурна киселина (сл. 2) се користат во органската синтеза како алкилирачки (воведување алкилна група во соединение) реагенси и естри фосфорна киселина(сл. 5) - како инсектициди, како и адитиви на масла за подмачкување.
Михаил Левицки
Кога карбоксилните киселини реагираат со алкохоли (реакција на естерификација), тие се формираат естри:
R 1 -COOH (киселина) + R 2 -OH (алкохол) ↔ R 1 -COOR 2 (естер) + H 2 O
Оваа реакција е реверзибилна. Производите на реакција можат да комуницираат едни со други за да формираат почетни материјали - алкохол и киселина. Така, реакцијата на естерите со вода - естерска хидролиза - е обратна од реакцијата на естерификација. Хемиска рамнотежа, кој се воспоставува кога брзините на директните (естерификација) и обратните (хидролиза) реакции се еднакви, може да се помести кон формирање на естер со присуство на супстанции што отстрануваат вода.
Естери во природата и технологијата
Естерите се широко распространети во природата и се користат во технологијата и различни индустрии. Тие се добри растворувачи органска материја, нивната густина е помала од густината на водата и практично не се раствораат во неа. Така, естерите со релативно мала молекуларна тежина се запаливи течности со ниски точки на вриење и имаат мирис на различни овошја. Тие се користат како растворувачи за лакови и бои и како ароматизирачки средства во прехранбената индустрија. На пример, метил естер на маслен киселина има мирис на јаболка, етаноловаа киселина - мирисот на ананас, изобутил етер оцетна киселина– мирисот на бананите:
C3H7-COO-CH3 (метил естер на бутерна киселина);
C3H7-COO-C2H5 (етил бутират);
CH3-COO-CH2-CH2 (изобутил ацетат)
Естерите на повисоките карбоксилни киселини и повисоките монобазни алкохоли се нарекуваат восоци. Така, пчелин восок главно се состои од естер на палмитинска киселина на мирицил алкохол C 15 H 31 COOC 31 H 63; сперма кит восок – спермацети – естер од истата палмитинска киселина и цетил алкохол C 15 H 31 COOC 16 H 33
Естери- функционални деривати на карбоксилни киселини,
во молекули во кои хидроксилната група (-OH) е заменета со алкохолен остаток (-OR)
Естери на карбоксилни киселини – соединенија со општа формула
R-COOR",каде што R и R“ се јаглеводородни радикали.
Естери на заситени монобазни карбоксилни киселини имаат општа формула:
Испарливи, безбојни течности
· Слабо растворлив во вода
· Најчесто со пријатен мирис
Полесни од водата
Естерите се наоѓаат во цвеќињата, овошјето и бобинките. Тие го одредуваат нивниот специфичен мирис.
Дали составен дел есенцијални масла(познати се околу 3000 м. - портокал, лаванда, роза итн.)
Естерите на пониски карбоксилни киселини и пониски монохидрични алкохоли имаат пријатен мирис на цвеќиња, бобинки и овошје. Естерите на повисоките монобазни киселини и повисоките монохидрични алкохоли се основата на природните восоци. На пример, пчелин восок содржи естер на палмитинска киселина и мирицил алкохол (мирицил палмитат):
CH 3 (CH 2) 14 –CO–O–(CH 2) 29 CH3
|
Арома. Структурна формула. |
Име естер |
|
јаболко
|
Етил етер 2-метилбутаноична киселина |
|
Цреша
|
Естер на амил мравја киселина |
|
Круша
|
Изоамил естер на оцетна киселина |
|
Ананас |
Етил естер на бутирна киселина (етил бутират) |
|
Банана
|
Изобутил естер на оцетна киселина (y изоамил ацетат исто така наликува на мирисот на банана) |
|
Јасмин
|
Бензил етер ацетат (бензил ацетат) |
Кратките имиња на естерите се засноваат на името на радикалот (R") во алкохолниот остаток и името на групата RCOO во киселинскиот остаток. На пример, етил оцетна киселина CH 3 COO C 2 H 5повикани етил ацетат.
Апликација
· Како мириси и засилувачи на мирис во прехранбената и парфимеријата (производство на сапун, парфеми, креми) индустрии;
· Во производството на пластика и гума како пластификатори.
Пластификатори - супстанции кои се внесуваат во составот на полимерните материјали за да се даде (или да се зголеми) еластичноста и (или) пластичноста за време на обработката и работењето.
Примена во медицината
ВО крајот на XIX- на почетокот на дваесеттиот век, кога органската синтеза ги направи првите чекори, многу естри беа синтетизирани и тестирани од фармаколозите. Тие станаа основа на такви лекови како што се салол, валидол итн. Метил салицилат беше широко користен како локален надразнувач и аналгетик, кој сега е практично заменет со поефикасни лекови.
Подготовка на естри
Естерите може да се добијат со реакција на карбоксилни киселини со алкохоли ( реакција на естерификација). Катализаторите се минерални киселини.
Видео „Подготовка на етил ацетил етер“
Видео „Подготовка на боронетил етер“
Реакцијата на естерификација при кисела катализа е реверзибилна. Обратен процес - расцепување на естер под дејство на вода за да се формира карбоксилна киселина и алкохол - се нарекува естерска хидролиза.
RCOOR" + H2O (H+)↔ RCOOH + R"OH
Хидролизата во присуство на алкали е неповратна (бидејќи добиениот негативно наелектризиран карбоксилат анјон RCOO не реагира со нуклеофилниот реагенс - алкохол).
Оваа реакција се нарекува сапонификација на естри(по аналогија со алкална хидролиза на естерските врски во мастите при производство на сапун).
5 март 2018 годинаЕстерите обично се нарекуваат соединенија добиени со реакција на естерификација од карбоксилни киселини. Во овој случај, OH- од карбоксилната група се заменува со алкокси радикал. Како резултат на тоа, се формираат естри, чија формула генерално е напишана како R-COO-R.
Структура на естерската група
Поларитет хемиски врскиво естерските молекули е сличен на поларитетот на врските во карбоксилните киселини. Главната разлика е отсуството на подвижен атом на водород, на местото на кое се наоѓа остаток на јаглеводород. Во исто време, електрофилниот центар се наоѓа на јаглеродниот атом од естерската група. Но, јаглеродниот атом на алкилната група поврзана со него е исто така позитивно поларизиран.
Електрофилноста, а со тоа и хемиските својства на естерите, се одредуваат со структурата на јаглеводородниот остаток кој го зазема местото на атомот H во карбоксилната група. Ако јаглеводородниот радикал формира конјугиран систем со атом на кислород, тогаш реактивностзначително се зголемува. Ова се случува, на пример, во акрилни и винилни естри.
Физички својства
Повеќето естри се течности или кристални материисо пријатен мирис. Нивната точка на вриење е обично пониска од онаа на карбоксилните киселини со слична молекуларна тежина. Ова го потврдува намалувањето на меѓумолекуларните интеракции, а тоа, пак, се објаснува со отсуството на водородни врски помеѓу соседните молекули.
Меѓутоа, исто како и хемиските својства на естерите, физичките својства зависат од структурните карактеристики на молекулата. Поточно, за видот на алкохол и карбоксилна киселина од која се формира. Врз основа на ова, естерите се поделени во три главни групи:
- Овошни естри. Тие се формираат од пониски карбоксилни киселини и истите монохидрични алкохоли. Течности со карактеристични пријатни цветни и овошни мириси.
- Восоци. Тие се деривати на повисоки (број на јаглеродни атоми од 15 до 30) киселини и алкохоли, кои имаат еден функционална група. Тоа се пластични материи кои лесно омекнуваат во вашите раце. Главната компонента на пчелин восок е мирицил палмитат C 15 H 31 COOC 31 H 63, а кинеската е естер на церотична киселина C 25 H 51 COOC 26 H 53. Тие се нерастворливи во вода, но растворливи во хлороформ и бензен.
- Масти. Формирана од глицерол и средни и повисоки карбоксилни киселини. Животинските масти обично се цврсти во нормални услови, но лесно се топат кога температурата се зголемува (путер, свинска маст и сл.). Растителните масти се карактеризираат со течна состојба (масло од ленено, маслиново, соја). Основната разлика во структурата на овие две групи, која влијае на разликите во физичките и хемиските својства на естерите, е присуството или отсуството на повеќе врски во киселинскиот остаток. Животинските масти се глицериди на незаситени карбоксилни киселини, а растителните масти се заситени киселини.
Хемиски својства
Естерите реагираат со нуклеофилите, што резултира со замена на алкокси групата и ацилација (или алкилација) на нуклеофилното средство. Доколку во структурна формулаестер има атом на α-водород, тогаш е можна естерска кондензација.
1. Хидролиза.Можна е киселинска и алкална хидролиза, што е обратна реакција на естерификацијата. Во првиот случај, хидролизата е реверзибилна, а киселината делува како катализатор:
R-COO-R" + H 2 O<―>R-COO-H + R"-OH
Основната хидролиза е неповратна и обично се нарекува сапунификација, а натриумовите и калиумовите соли на масни карбоксилни киселини се нарекуваат сапуни:
R-COO-R" + NaOH ―> R-COO-Na + R"-OΗ

2. Амонолиза.Амонијак може да дејствува како нуклеофилен агенс:
R-COO-R" + NH 3 ―> R-СО-NH 2 + R"-OH
3. Трансестерификација.Ова хемиско својство на естерите може да се припише и на методите на нивна подготовка. Под влијание на алкохоли во присуство на H + или OH -, можно е да се замени јаглеводородниот радикал поврзан со кислород:
R-COO-R" + R""-OH ―> R-COO-R"" + R"-OH
4. Редукцијата со водород доведува до формирање на молекули на два различни алкохоли:
R-СО-OR" + LiAlH 4 ―> R-СΗ 2 -ОХ + R"OH
5. Согорувањето е уште една типична реакција за естерите:
2CΗ 3 -COO-CΗ 3 + 7O 2 = 6CO 2 + 6H 2 O
6. Хидрогенизација. Ако има повеќе врски во јаглеводородниот синџир на молекулата на етер, тогаш е можно додавање на молекули на водород по нив, што се случува во присуство на платина или други катализатори. На пример, можно е да се добијат цврсти хидрогенизирани масти (маргарин) од масла.

Примена на естри
Естерите и нивните деривати се користат во различни индустрии. Многу од нив добро се раствораат различни органски соединенија, се користат во парфимеријата и прехранбената индустрија за производство на полимери и полиестерски влакна.
Етил ацетат. Се користи како растворувач за нитроцелулоза, целулоза ацетат и други полимери, за производство и растворање на лакови. Поради својата пријатна арома, се користи во прехранбената и парфемската индустрија.
Бутил ацетат. Се користи и како растворувач, но и полиестерски смоли.
Винил ацетат (CH 3 -COO-CH=CH 2). Се користи како полимерна основа неопходна за подготовка на лепак, лакови, синтетички влакна и филмови.
Малонски етер. Поради неговите посебни хемиски својства, овој естер е широко користен во хемиската синтеза за производство на карбоксилни киселини, хетероциклични соединенија и аминокарбоксилни киселини.

Фталати. Естерите на фтална киселина се користат како пластифицирачки адитиви за полимери и синтетички гуми, а диоктил фталат исто така се користи како репелент.
Метил акрилат и метил метакрилат. Тие лесно се полимеризираат за да формираат листови од органско стакло кои се отпорни на различни влијанија.