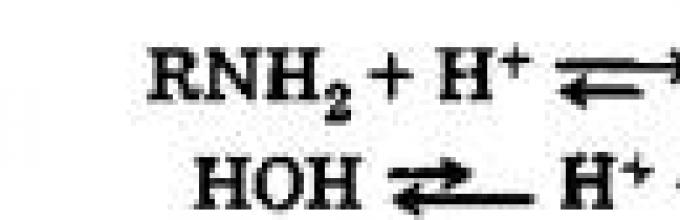ТЕМА НА ПРЕДАВАЊЕТО: АМИНИ И АМИНО АЛКОХОЛИ
Прашања:
општи карактеристики: структура, класификација, номенклатура.
Методи на прием
Физички својства
Хемиски својства
Поединечни претставници. Методи на идентификација.
Општи карактеристики: структура, класификација, номенклатура
Амините се деривати на амонијакот, чија молекула има атоми на водород заменети со јаглеводородни радикали.
Класификација
1– Амините се разликуваат во зависност од бројот на супституирани водородни атоми на амонијак:
– основносодржат амино група амино група (–NH 2), општа формула: R–NH 2,
– секундарносодржат имино група (-NH),
општа формула: R1-NH-R2
– терцијарносодржат атом на азот, општа формула: R 3 –N
Познати се и соединенијата со атом на кватернарен азот: кватернарен амониум хидроксид и неговите соли.
2– Во зависност од структурата на радикалот, се разликуваат амини:
- алифатичен (заситен и незаситен)
– алициклична
- ароматични (содржат амино група или страничен ланец во јадрото)
- хетероцикличен.
Номенклатура, изомеризам на амини
1. Имињата на амините според рационалната номенклатура обично се изведени од имињата на нивните составни јаглеводородни радикали со додавање на завршетокот -амин : метиламин CH 3 -NH 2, диметиламин CH 3 -NH-CH 3, триметиламин (CH 3) 3 N, пропиламин CH 3 CH 2 CH 2 -NH 2, фениламин C 6 H 5 - NH 2 итн.
2. Според номенклатурата IUPAC, амино групата се смета како функционална група и нејзиното име аминопоставен пред името на главниот синџир:
Изомеризмот на амините зависи од изомеризмот на радикалите.
Методи за производство на амини
Амините може да се подготват на различни начини.
А) Дејство на амонијак со халоалкили
2NH 3 + CH 3 I ––® CH 3 – NH 2 + NH 4 I
Б) Каталитичка хидрогенизација на нитробензен со молекуларен водород:
C 6 H 5 NO 2 ––® C 6 H 5 NH 2 + H 2 O
нитробензен мачка анилин
Б) Подготовка на пониски амини (C 1 – C 4) со алкилирање со алкохоли:
350 0 C, Al 2 O 3
R–OH + NH 3 –––––––––––® R–NH 2 +H 2 O
350 0 C, Al 2 O 3
2R–OH + NH 3 –––––––––––® R 2 –NH +2H 2 O
350 0 C, Al 2 O 3
3R–OH + NH 3 –––––––––––® R 3 –N + 3H 2 O
Физички својства на амините
Метиламин, диметиламин и триметиламин се гасови, средните членови на серијата амини се течности, повисоки - цврсти материи. Како што се зголемува молекуларната тежина на амините, се зголемува нивната густина, се зголемува нивната точка на вриење и се намалува нивната растворливост во вода. Високите амини се нерастворливи во вода. Долните амини имаат непријатен мирис, донекаде потсетува на мирисот на расипана риба. Високите амини се или без мирис или имаат многу благ мирис. Ароматичните амини се безбојни течности или цврсти материи, имаат непријатен мирис и се отровни.
Хемиски својства на амините
Хемиското однесување на амините се одредува со присуството на амино група во молекулата. Од надвор електронска обвивкаАтомот на азот има 5 електрони. Во молекулата на амин, како и во молекулата на амонијак, азотниот атом троши за формирање на три ковалентни врскитри електрони, а два остануваат слободни.
Присуството на слободен електронски пар на азотниот атом му дава можност да прикачи протон, затоа амините се слични на амонијакот, покажуваат основни својства, формираат хидроксиди и соли.
Формирање сол. Амините со киселини даваат соли, кои под влијание на силна база повторно даваат слободни амини:
Амините даваат соли дури и со слаби јаглеродна киселина:
Како и амонијакот, амините имаат основни својства поради врзувањето на протоните во слабо дисоцирачки супституиран амониум катјон:
| |
Кога аминот се раствора во вода, дел од протоните на водата се троши за да се формира катјон; Така, во растворот се појавува вишок на јони на хидроксид и има алкални својства доволни за да ги обои растворите на лакмус сина и фенолфталеин темноцрвена боја. Основност на амини гранични сериифлуктуира во многу мали граници и е блиску до базичноста на амонијакот.
Ефектот на метил групите малку ја зголемува базичноста на метил и диметиламин. Во случај на триметиламин, метил групите веќе ја попречуваат солвацијата на добиениот катјон и ја намалуваат неговата стабилизација, а со тоа и неговата базичност.
Аминските соли треба да се сметаат како сложени соединенија. Централниот атом во нив е атом на азот, чиј координативен број е четири. Атомите на водород или алкил се поврзани со атомот на азот и се наоѓаат во внатрешната сфера; киселинскиот остаток се наоѓа во надворешната сфера.
Ацилација на амини. Кога некои деривати на органски киселини (киселински халиди, анхидриди, итн.) дејствуваат на примарните и секундарните амини, се формираат амиди:
Секундарни амини со азотна киселинададе нитрозамини- жолтеникави течности, малку растворливи во вода:
Терциерните амини се отпорни на дејството на разредената азотна киселина на студ (тие формираат соли на азотна киселина); во потешки услови, еден од радикалите се разделува и се формира нитрозоамин.
Дијамини
Дијамините играат важна улога во биолошките процеси. Како по правило, тие се лесно растворливи во вода, имаат карактеристичен мирис, имаат високо алкална реакција и комуницираат со CO 2 во воздухот. Дијамините формираат стабилни соли со два еквиваленти на киселина.
Етилендиамин (1,2-етанедиамин) H 2 NCH 2 CH 2 NH 2 . Тоа е наједноставниот диамин; може да се добие со дејство на амонијак на етилен бромид:
Тетраметилендиамин (1,4-бутанедиамин), или путресцин, NH 2 CH 2 CH 2 CH 2 CH 2 NH 2 и пентаметилендиамин (1,5-пентанедиамин) NH 2 CH 2 CH 2 CH 2 CH 2 CH 2 NH 2, или кадаверин. Тие беа откриени во производите на распаѓање на протеинските супстанции; се формираат со декарбоксилација на диамино киселини и се нарекуваат птомаини(од грчки - труп), тие претходно се сметаа за „кадаверски отрови“. Сега е откриено дека токсичноста на гнили протеини не е предизвикана од птомаини, туку од присуството на други супстанции.
Путрешин и кадаверин се формираат како резултат на виталната активност на многу микроорганизми (на пример, предизвикувачките агенси на тетанус и колера) и габи; ги има во сирењето, ерготот, мушичкиот агарик и пивскиот квасец.
Некои дијамини се користат како суровини за производство на полиамидни влакна и пластика. Така, од хекса-метилендиамин NH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 NH 2 е добиено многу вредно синтетичко влакно - најлон(САД) или анид(Русија).
Амино алкохоли
Амино алкохоли- соединенија со мешани функции, чија молекула содржи амино и хидрокси групи.
Аминоетанол(етаноламин) HO-CH 2 CH 2 -NH 2, или коламин.
Етаноламинот е густа мрсна течност, која се меша со вода во сите погледи и има силни алкални својства. Заедно со моноетаноламин, се добиваат и диетаноламин и триетаноламин:
Холин е вклучен во лецитини- супстанци слични на маснотии, многу чести кај животинските и растителните организми и може да се изолираат од нив. Холинот е кристална, високо хигроскопна маса која лесно се раствора во воздухот. Има силни алкални својства и лесно формира соли со киселини.
Кога холинот се ацилира со оцетен анхидрид, тој се формира холин ацетат,исто така се нарекува ацетилхолин:
 |
Ацетилхолинот игра исклучително важна биохемиска улога, бидејќи е медијатор (медијатор) кој ја пренесува возбудата од нервните рецептори до мускулите.
Најчестото својство на сите органски соединенија е нивната способност да горат. Самиот амонијак гори и, воопшто, лесно, но запалувањето не е секогаш лесно. Спротивно на тоа, амините лесно се палат и најчесто горат со безбоен или малку обоен пламен. Во овој случај, азотот од амини традиционално се оксидира до молекуларен азот, бидејќи азотните оксиди се нестабилни.
Амините полесно се палат во воздухот отколку амонијакот.
4NH3 + 3O2 = 2N2 + 6H2O;
4C 2 H 5 NH 2 + 15O 2 = 8CO 2 + 14H 2 O + 2N 2.
Основни својства
Примарни, секундарни и терциерни амини нужно содржи осамен пар електрони, како што доликува на тривалентен азот. Односно, амините во растворот покажуваат основни својства, или нивните раствори се бази. Ова е причината зошто амините во воден раствор добиваат лакмусова сина боја, а фенолфталеинот во темноцрвена боја. Ориз. 12.
Ориз. 1 .
Ориз. 2 .

Благодарение на овој електронски пар, може да се формира врска донор-акцептор со водороден јон:
C 2 H 5 NH 2 + H + = C 2 H 5 NH 3 +.
Така, како и амонијакот, амините ги покажуваат својствата на базите:
NH 3 + H 2 O NH 4 OH;
C 2 H 5 NH 2 + H 2 O C 2 H 5 NH 3 OH.
Амонијакот формира соли со киселини амониум, а амините се алкиламониум :
NH 3 + HBr = NH 4 Br ( амониум бромид)
C 2 H 5 NH 2 + HBr = C 2 H 5 NH 3 Br ( етиламониум бромид)
Исто како што амонијакот формира соли на амониум со киселини, амините ги формираат соодветните соли. Овие соли може да се формираат, како во случајот со амонијакот, не само за време на реакцијата на водените раствори, туку и во гасната фаза ако амините се доволно испарливи.
Тоа е, ако поставите садови со концентрирани хлороводородна киселинаили дури и со органска испарлива супстанција, како што е оцетна киселина, и сад со испарлив амин, тогаш наскоро во просторот меѓу нив ќе се појави нешто што личи на чад без оган, т.е. ќе се формираат кристали што одговараат на алкиламинска сол. Ориз. 3.

Ориз. 3 .
Алкалите ги поместуваат амините , кој, како амонијак, слаббази, од соли на алкил амониум:
NH4Cl + KOH = NH3- + KCl + H2O;
CH 3 NH 3 Cl + KOH = CH 3 NH 2 - + KCl + H 2 O.
Основните својства на амините се повисоки од оние на амонијакот. Зошто? Формирањето на донорска-акцепторна врска со водороден јон се случува полесно, толку е поголема густината на електроните на азотниот атом. Јаглеводородните радикали содржат многу електрони и лесно ги „делат“ со атомот на азот (сл. 4).

Ориз. 4. Врска донатор-акцепторсо водороден јон
Меѓутоа, основните својства на терциерните амини се помали од оние на секундарните (споредете ги константите на базичност). Зошто? Во терциерниот амин, азотниот атом е опкружен од сите страни со јаглеводородни радикали, а неговата способност да реагира е попречена.
Амините, како амонијакот, се способни да реагираат со халоалканите, заменувајќи го атомот на халоген:
CH3Br + NH3 = CH3NH2 + HBr;
CH3NH2 + CH3Br = (CH3) 2NH + HBr;
(CH 3) 2 NH + CH 3 Br = (CH 3) 3 N + HBr.
Терциерните амини исто така можат да го заменат халогенот, па реакцијата може да оди понатаму. Се формира квартерна амониумова сол - тетраметиламониум бромид (CH 3) 4 NBr:
(CH 3) 3 N + CH 3 Br = (CH 3) 4 N+ + Br-.
Сумирајќи ја лекцијата
Овој час ја опфати темата „Амино соединенија. Класификација, изомеризам, имиња и физички својства" Ја повторивте генезата на органските соединенија што содржат кислород и потсетивте на некои општи својстваамонијак и вода. Потоа разгледавме како да добиеме амино соединенија. Ја проучувавме нивната класификација, изомеризам, имиња и нивните вродени физички својства. .
Библиографија
- Руџитис Г.Е., Фелдман Ф.Г. Хемија: Органска хемија. 10-то одделение: учебник за образовните институции: основно ниво/Г. Е. Руџитис, Ф.Г. Фелдман. - 14-то издание. - М.: Образование, 2012 година.
- Хемија. Одделение 10. Ниво на профил: тетратка за општо образование институции/В.В. Еремин, Н.Е. Кузменко, В.В. Лунин, А.А. Дроздов, В.И. Теренин. - М.: Бустард, 2008. - 463 стр.
- Хемија. 11 одделение. Ниво на профил: академски. за општо образование институции/ В.В. Еремин, Н.Е. Кузменко, В.В. Лунин, А.А. Дроздов, В.И. Теренин. - М.: Бустард, 2010. - 462 стр.
- Хомченко Г.П., Хомченко И.Г. Збирка проблеми по хемија за оние кои влегуваат на универзитетите. - 4-то издание. - М.: РИА „Нов бран“: Издавач Умеренков, 2012. - 278 стр.
- веб-страница ().
- Chemistry.ssu.samara.ru ().
- Khimik.ru ().
- Promobud.ua ().
- Бр. 3, 4 (стр. 14) Руџитис Г.Е., Фелдман Ф.Г. Хемија: Органска хемија. 10-то одделение: учебник за општообразовни установи: основно ниво/Г. Е. Руџитис, Ф.Г. Фелдман. - 14-то издание. - М.: Образование, 2012 година.
- Споредете ги својствата на ограничувачките амини и алкохоли.
- Напиши равенки за реакција кои ја потврдуваат базичноста на амините.
Врз основа на природата на јаглеводородните супституенти, амините се поделени на
Општи структурни карактеристики на амините
Исто како и во молекулата на амонијак, во молекулата на кој било амин, азотниот атом има осамен електронски пар насочен кон едно од темињата на искривениот тетраедар:
Поради оваа причина, амините, како и амонијакот, имаат значително изразени основни својства.
Така, амините, слични на амонијакот, реагираат реверзибилно со вода, формирајќи слаби бази:
Врската помеѓу водородниот катјон и азотниот атом во молекулата на аминот се реализира со помош на механизам донор-акцептор поради осамениот електронски пар на азотниот атом. Заситените амини се посилни бази во споредба со амонијакот, бидејќи во таквите амини, јаглеводородните супституенти имаат позитивен индуктивен (+I) ефект. Во овој поглед, густината на електроните на азотниот атом се зголемува, што ја олеснува неговата интеракција со катјонот H +.
Ароматичните амини, доколку амино групата е директно поврзана со ароматичниот прстен, покажуваат послаби основни својства во споредба со амонијакот. Ова се должи на фактот дека осамениот електронски пар на азотниот атом се поместува кон ароматичниот π-систем на бензенскиот прстен, како резултат на што се намалува густината на електроните на атомот на азот. За возврат, ова доведува до намалување на основните својства, особено на способноста за интеракција со вода. На пример, анилин реагира само со силни киселини, и практично не реагира со вода.
Хемиски својства на заситените амини
Како што веќе споменавме, амините реагираат реверзибилно со вода:
Водните раствори на амини имаат алкална реакција поради дисоцијација на добиените бази:
Заситените амини реагираат со вода подобро од амонијакот поради нивните посилни основни својства.
Основни својства заситени аминизголемување во серијата.
Секундарна ограничувачки аминисе посилни бази од примарните ограничувачки, кои пак се посилни бази од амонијакот. Што се однесува до основните својства на терциерните амини, тогаш ако зборуваме за реакции во водени раствори, тогаш основните својства на терциерните амини се изразени многу полошо од оние на секундарните амини, па дури и малку полоши од оние на примарните. Ова се должи на стеричните пречки, кои значително влијаат на стапката на амин протонација. Со други зборови, три супституенти го „блокираат“ азотниот атом и се мешаат во неговата интеракција со катјоните H +.
Интеракција со киселини
И слободните заситени амини и нивните водени раствори реагираат со киселини. Во овој случај, се формираат соли:
Бидејќи основните својства на заситените амини се поизразени од оние на амонијакот, таквите амини реагираат дури и со слаби киселини, како што е јаглеродната киселина:
Аминските соли се цврсти материи кои се многу растворливи во вода и слабо растворливи во неполарни органски растворувачи. Интеракцијата на аминските соли со алкалите доведува до ослободување на слободни амини, слично на поместувањето на амонијакот кога алкалите делуваат на солите на амониум:
2. Примарните заситени амини реагираат со азотна киселина за да ги формираат соодветните алкохоли, азот N2 и вода. На пример:
Карактеристична карактеристика на оваа реакција е формирањето на азотен гас, и затоа е квалитативен за примарните амини и се користи за да се разликуваат од секундарните и терциерните. Треба да се напомене дека најчесто оваа реакција се изведува со мешање на аминот не со раствор од самата азотна киселина, туку со раствор од сол на азотна киселина (нитрит) и потоа во оваа смеса се додава силна минерална киселина. Кога нитритите комуницираат со силни минерални киселини, се формира азотна киселина, која потоа реагира со аминот:
Секундарните амини даваат, под слични услови, масни течности, таканаречените N-нитрозамини, но оваа реакција во реална Задачи за унифициран државен испитне се наоѓа во хемијата. Терциерните амини не реагираат со азотна киселина.
Целосното согорување на сите амини доведува до формирање на јаглерод диоксид, вода и азот:
Интеракција со халоалкани
Вреди да се одбележи дека токму истата сол се добива со дејство на водород хлорид на повеќе супституиран амин. Во нашиот случај, кога водород хлоридот реагира со диметиламин:
Подготовка на амини:
1) Алкилација на амонијак со халоалкани:
Во случај на недостаток на амонијак, наместо амин се добива неговата сол:
2) Редукција со метали (до водород во серијата активности) во кисела средина:
проследено со третман на растворот со алкали за ослободување на слободниот амин:
3) Реакцијата на амонијакот со алкохоли при минување на нивната смеса низ загреан алуминиум оксид. Во зависност од пропорциите на алкохол/амин, се формираат примарни, секундарни или терциерни амини:
Хемиски својства на анилин
Анилин - тривијалното име за аминобензен, со формулата:
Како што може да се види од илустрацијата, во молекулата на анилин амино групата е директно поврзана со ароматичниот прстен. Таквите амини, како што веќе споменавме, имаат многу помалку изразени основни својства од амонијакот. Така, особено, анилин практично не реагира со вода и слаби киселини како што е јаглеродната киселина.
Реакција на анилин со киселини
Анилин реагира со силна и средна јачина неоргански киселини. Во овој случај, се формираат соли на фениламониум:
Реакција на анилин со халогени
Како што веќе беше кажано на самиот почеток на ова поглавје, амино групата во ароматичните амини е вовлечена во ароматичниот прстен, што пак ја намалува густината на електроните на азотниот атом и како резултат на тоа ја зголемува во ароматичниот прстен. Зголемувањето на густината на електроните во ароматичниот прстен води до фактот дека реакциите на електрофилна супституција, особено реакциите со халогени, се одвиваат многу полесно, особено во орто и пара позициите во однос на амино групата. Така, анилин лесно реагира со бромна вода, формирајќи бел талог од 2,4,6-трибромоанилин:
Оваа реакција е квалитативна за анилин и често овозможува да се идентификува меѓу другите органски соединенија.
Реакција на анилин со азотна киселина
Анилин реагира со азотна киселина, но поради специфичноста и сложеноста на оваа реакција во вистински обединет државен испитне се појавува во хемијата.
Реакции на анилин алкилација
Користејќи секвенцијална алкилација на анилин во азотниот атом со халогени јаглеводороди, може да се добијат секундарни и терциерни амини:
Хемиски својства на амино киселините
Амино киселини се соединенија чии молекули содржат два вида функционални групи - амино (-NH 2) и карбокси- (-COOH) групи.
Со други зборови, амино киселините може да се сметаат како деривати карбоксилни киселини, во молекулите од кои еден или повеќе водородни атоми се заменети со амино групи.
Така, општата формула на амино киселините може да се запише како (NH 2) x R(COOH) y, каде што x и y најчесто се еднакви на еден или два.
Бидејќи молекулите на амино киселините содржат и амино група и карбоксилна група, тие покажуваат Хемиски својстваслично и на амини и на карбоксилни киселини.
Кисели својства на амино киселини
Формирање на соли со алкали и карбонати на алкални метали
Естерификација на амино киселини
Амино киселините можат да реагираат со естерификација со алкохоли:
NH 2 CH 2 COOH + CH 3 OH → NH 2 CH 2 COOCH 3 + H 2 O
Основни својства на амино киселините
1. Формирање на соли при интеракција со киселини
NH 2 CH 2 COOH + HCl → + Cl —
2. Интеракција со азотна киселина
NH 2 -CH 2 -COOH + HNO 2 → HO-CH 2 -COOH + N 2 + H 2 O
Забелешка: интеракцијата со азотна киселина се одвива на ист начин како и со примарните амини
3. Алкилација
NH 2 CH 2 COOH + CH 3 I → + I —
4. Интеракција на амино киселините едни со други
Амино киселините можат да реагираат едни со други за да формираат пептиди - соединенија што ги содржат нивните молекули пептидна врска-C(O)-NH-
Во исто време, треба да се забележи дека во случај на реакција помеѓу две различни аминокиселини, без да се набљудуваат некои специфични услови за синтеза, формирањето на различни дипептиди се случува истовремено. Така, на пример, наместо реакцијата на глицин со аланин погоре, што доведува до глицилананин, може да се појави реакција што води до аланилглицин:
Покрај тоа, молекулата на глицин не мора да реагира со молекулата на аланин. Реакциите на пептизација се јавуваат и помеѓу молекулите на глицин:
И аланин:
Дополнително, бидејќи молекулите на добиените пептиди, како и оригиналните молекули на амино киселини, содржат амино групи и карбоксилни групи, самите пептиди можат да реагираат со амино киселини и други пептиди поради формирање на нови пептидни врски.
Одделни амино киселини се користат за производство на синтетички полипептиди или таканаречени полиамидни влакна. Така, особено, користејќи поликондензација на 6-аминохексан (ε-аминокапроична) киселина, најлон се синтетизира во индустријата:
Добиената најлонска смола се користи за производство на текстилни влакна и пластика.
Формирање на внатрешни соли на амино киселини во воден раствор
Во водените раствори, амино киселините постојат претежно во форма на внатрешни соли - биполарни јони (цвитерјони).
Амини- Ова органски соединенија, во кој атом на водород (можеби повеќе од еден) е заменет со јаглеводороден радикал. Сите амини се поделени на:
- примарни амини;
- секундарни амини;
- терциерни амини.
Исто така, постојат аналози на соли на амониум - кватернерни соли како [ Р 4 Н] + Cl - .
Во зависност од видот на радикалот аминиможе да биде:
- алифатични амини;
- ароматични (мешани) амини.
Алифатични заситени амини.
Општа формула CnH 2 n +3 Н.
Структура на амини.
Атомот на азот е во сп 3 хибридизација. Четвртата нехибридна орбитала содржи осамен пар електрони, што ги одредува основните својства на амините:

Супституентите од донатори на електрони ја зголемуваат густината на електроните на азотниот атом и ги подобруваат основните својства на амините, поради оваа причина секундарните амини се посилни бази од примарните, бидејќи 2 радикали на атом на азот создаваат поголема густина на електрони од 1.
Кај терциерните атоми просторниот фактор игра важна улога: бидејќи 3 радикали го прикриваат осамениот пар на азот, до кој е тешко да се „приближат“ другите реагенси; основната основа на таквите амини е помала од примарната или секундарната.
Изомеризам на амини.
Амините се карактеризираат со изомеризам на јаглеродниот скелет и изомеризам на положбата на амино групата:

Како се нарекуваат амини?
Името обично ги наведува јаглеводородните радикали (по азбучен ред) и го додава крајот -амин:

Физички својства на амините.
Првите 3 амини се гасови, средните членови на алифатичната серија се течности, а повисоките се цврсти материи. Точката на вриење на амините е повисока од онаа на соодветните јаглеводороди, бидејќи во течна фаза, во молекулата се формираат водородни врски.
Амините се многу растворливи во вода; како што расте јаглеводородниот радикал, растворливоста се намалува.
Подготовка на амини.
1. Алкилација на амонијак (главен метод), што настанува кога алкилхалид се загрева со амонијак:
Ако алкилхалидот е во вишок, примарниот амин може да претрпи реакција на алкилација, станувајќи секундарен или терцијарен амин:
2. Намалување на нитро соединенија:
Се користи амониум сулфид ( Реакцијата на Зинин), цинк или железо во кисела средина, алуминиум во алкална средина или водород во гасна фаза.
3. Намалување на нитрилите. Користете LiAlH4:
4. Ензимска декарбоксилација на амино киселините:

Хемиски својства на амините.
Сите амини- силните бази, а алифатичните се посилни од амонијакот.

Водните раствори се алкални по природа.
Амини
Класификација и номенклатура
Амините се органски деривати на амонијакот, во молекулата на која еден, два или три атоми на водород се заменуваат со радикали. Врз основа на тоа тие разликуваат основно (RNH 2), секундарно (R 2 NH) и терцијарно (R 3 N) амини
Во зависност од природата на радикалот, амините можат да бидат заситени или ароматични, како и заситени ароматични (метиламин, анилин и метиланилин, соодветно). Разгранет радикал, исто така, може да се поврзе со атом на азот (на пример, триебутиламин), и поликондензиран, како што е прикажано со примерот на адамантиламин (аминоадамантан), кој има биолошки ефект и се користи во медицината


Според принципите на рационалната номенклатура, името на оваа класа на супстанции се состои од името на радикалите во атомот на азот, т.н. амин.Во имињата на примарните амини меѓународна номенклатураатом на амин азот го добива името ами-Но,се користи со означување на неговата локација пред името на јаглеводородниот синџир. Сепак, многу амини ги задржале своите тривијални имиња, на пример, анилин“.
Покрај амино групата, молекулите на органските материи може да содржат и други супституенти, како што е, на пример, случајот со сулфанилна киселина. Атомот на амин азот може да биде вклучен и во заситениот прстен. Меѓу заситените хетероциклични амини е тричлена структура изградена со напнатост етиленимин,има силен мутаген ефект. Етилениминскиот прстен е дел од молекулите на некои лекови. Тетрахидропиролските и пиперидинските прстени присутни во молекулите на голем број алкалоиди (вклучувајќи никотин и анабазин, види Дел 20.4) се конструирани без напнатост. Со нивно учество, како и со помош на морфолинскиот прстен, се градат молекулите на многу лекови.




Хетероциклични ароматични амини се, на пример, пирол и пиридин. Конечно, амино групата може да се поврзе и со хетероцикл, како што е илустрирано со примерот на аденин (6-аминопурин), суштински фрагмент од нуклеинските киселини.


Дериватите на амонијак вклучуваат органска материја, кој може да се конструира од соли на амониум или негов хидроксид со замена на сите четири атоми на водород со различни јаглеводородни радикали, како што може да се види во примерот на тетраметиламониум хидроксид:

Друг пример на тетра-супституирани деривати на амониум - кватернерни амониумски бази или нивни соли - е неврин,токсична супстанција формирана за време на распаѓањето на животинското ткиво.
Кватернарниот атом на азот може да биде дел од хетероцикли, на пример, соодветната сол од пиридинската серија - сол на N-алкилпиридиниум. Таквите кватернарни соли вклучуваат некои алкалоиди. Покрај тоа, квартерниот атом на азот се наоѓа во многу лековити супстанции и некои биомолекули.
Горенаведените примери ја демонстрираат разновидноста на амино соединенијата и нивното големо медицинско и биолошко значење. Неопходно е да се додаде дека амино групата е дел од такви класи на биомолекули како амино киселини и протеини, нуклеински киселини и е присутна во голем број природни деривати на јаглени хидрати наречени амино шеќери. Амино групата е најважната функционална група на алкалоиди и бројни лекови за различни намени. Некои примери на такви супстанции ќе бидат дадени подолу.
24.3.2. Амините како органски бази

 Присуството на слободен електронски пар на азот им дава на амините својства на базите. Затоа карактеристична особинаамини е реакција со киселини за да се формираат соодветните соли на амониум, како што може да се види од реакцијата за примарниот заситен амин:
Присуството на слободен електронски пар на азот им дава на амините својства на базите. Затоа карактеристична особинаамини е реакција со киселини за да се формираат соодветните соли на амониум, како што може да се види од реакцијата за примарниот заситен амин:
Слично на тоа, анилин се формира од анилин, солта на пиридиниум се формира од пиридин, итн. Како и амонијакот, амините во водените раствори создаваат алкална средина, според равенката:
Квантитативно, основаноста на базите што содржат азот во водната средина се рефлектира со вредноста на константата на рамнотежа (ДО б ) (почесто ја користат вредноста rK б ) yl/С а (ВН +), што ја карактеризира киселоста на конјугирана киселина на дадена база.

Најсилните бази ќе бидат соединенијата кои содржат азотен атом во кој азотниот осамен пар се наоѓа во осамената 5p 3 хибридна орбитала (алифатични амини, амонијак, амино киселини), а најслаби ќе бидат оние во кои овој пар е вклучен во стр. ,n конјугација (амиди, пирол, пиридин).
Супституентите кои донираат електрони, кои вклучуваат алкилни групи, треба да ја зголемат базичноста на амините бидејќи тие ја зголемуваат густината на електроните во атомот на азот. Да, метиламин (pK б = 3.27) е посилна основа од амонијакот (pK б = 4,75), и диметиламин (pK б = 3.02) е посилна база од метиламинот. Меѓутоа, кога се префрла на триметиламин, спротивно на очекувањата, базичноста малку се намалува (pK б = 4,10). Причината за ова е што како што се зголемува бројот на супституенти на атомот на азот, приближувањето на протонот станува сè потешко. Така, овде не зборуваме за електронското, туку за просторното влијание на супституентите. Овој ефект на супституентите се нарекува стеричнифактор.
Ароматичните амини се послаби бази од заситените поради ефектот на повлекување електрони на ароматичниот прстен. Затоа, базичноста на пиридин е исто така ниска. Акумулацијата на фенилните супституенти значително ја потиснува активноста на електронскиот пар на азотниот атом. Значи, rK,дифениламин е 13,12, а трифениламинот воопшто не ги покажува својствата на базата.
Екстремно ниската базичност на пиролот е предизвикана од фактот што во неговата молекула електронскиот пар на азотниот атом е вклучен во формирањето на ароматична врска b-електрон. Неговото врзување со протон бара значителни дополнителни трошоци за енергија. Како резултат на формирањето на соли на пиролиум, исчезнува ароматичната врска и, следствено, стабилноста на молекулата. Ова го објаснува фактот дека пиролот брзо станува смолест во кисела средина.
Интересно е да се забележи дека силниот ефект на повлекување електрони што го врши пироловиот прстен врз атомот на азот доведува до слабеење N-H врски, поради што пиролот е во состојба да покажува својства на слаба киселина (pK А = 17,5).
![]()
Под влијание на таквите активен метал, како и калиумот, неговата калиумова сол, пирол-калиум, може да се подготви.
Киселините својства на N-H врската на пиролскиот прстен ја објаснуваат, особено, способноста на порфинот и неговите природни деривати да формираат соли со метални катјони. Два пиролски прстени од молекулата на порфирин се координирани со катјонот поради електронските парови на нивните азотни атоми, а другите два се координираат со замена на атоми на водород, како самата молекула на пирол за време на формирањето на пирол-калиум. Овие соли се хлорофил и хемоглобин.