Тест на тема „Алкани“ 2016 година
1. Која јаглеводородна молекула може да има разгранет јаглероден ланец?
1) метан CH 4 2) етан C 2 Н 6 3) пропан В 3 Н 8 4) бутан Ц 4 Н 10
2. Структурна формула на пропан В 3 Н 8
1) CH 2 - CH 3 - CH 3 2) CH 3 - CH 2 - CH 3 3) CH 3 -CH-CH 4 4) CH 2 - CH 4 - CH 2
3. Главен дел од природен гас
1) метан 2) етан 3) пропан 4) бутан
4. Молекулата на метанот има врска јаглерод-јаглерод
1) едноставно 2) двојно 3) тројно 4) нема таква врска
5. Формула на хомолог на метан 1) В 3 Н 6 2) В 4 Н 8 3) В 6 Н 12 4) В 5 Н 12
6. Наведете го правилниот суд
A. алканите се карактеризираат со реакции на додавање
B. алканите се карактеризираат со реакции на супституција
7.Изомерите се различни
1) квалитативен состав 2) квантитативен состав 3) структура 4) хомологна разлика
8. Изомер на хептан е
1) 2,3-диметилхептан 2) 2,3-диметилпентан 3) 2,3-диметилбутан 4) 2,3-диметилхексан
9.Нитроетанска формула
1) CH 3 - CH 2 - ОНО 2 2) CH 3 - CH 2 - БР 2
3) CH 3 - CH 2 - НН 2 4) CH 3 - CH 2 - CH 2 - CH 2 - БР 2
10. Која супстанца му недостига на природниот гас?
1) метан 2) етан 3) пентан 4) бутан
11. Определи кое од наведените соединенија има максимална оксидациска состојба на јаглеродниот атом?
1) CH 2 О 2) CH 3 OH 3) SSл 4 4) В 2 Н 4
12. Секој јаглероден атом во молекула на етан се формира
1) две σ-врски и две π-врски 2) три σ-врски и една π-врска
3) четири σ врски 4) една σ и три врски
13.метан е главната компонента
1) нафта 2) природен гас 3) синтезен гас 4) гас од печка за кокс
14. Наведете го правилното расудување
A. алканите се карактеризираат со реакции на супституција
B. етанот го обезбојува растворот на калиум перманганат
1) само А е точно 2) само Б е точно 3) двете пресуди се точни 4) двете пресуди се неточни
15. Какви производи може да се добијат со реакција на бромоетан и бром пропан со натриум метал?
1) бутан 2) хексан
3) мешавина од бутан и хексан 4) мешавина од хексан, бутан, пентан
16.Наведете го името на радикалот – CH 3
1) бутил 2) метан 3) етил 4) метил
17. Наведете ја формулата на етил радикалот
1) -C 2 H 6 2b) -C 3 H 7 3) -C 2 H 5 4d) -C 4 H 9
18. Должина S-S врскиво молекули на алкани
1) 0,109 nm 2) 0,154 nm 3) 0,120 nm 4) 0,134 nm
19. Како резултат на реакцијата на дехидрогенизација на алканите, следново се дели:
1) вода 2) водород 3) јаглерод 4) кислород
20. Кои услови се неопходни за да започне реакцијата помеѓу метанот и хлорот?
1) ладење 2) греење 3) зголемен притисок 4) осветлување
21.Од страна на состојба на агрегацијаалкани:
1) гасови, течности 3Б) течности, цврсти материи
2) гасови, течности, цврсти материи 4) гасови, цврсти материи
22. Молекулата на метан има форма:
1) четириаголна пирамида 2) тетраедар 3) октаедар 4) квадрат
23. Изомерот на 2,3-диметилбутан е:
1) хексан 2) 2,3 - диметилциклохексан 3) циклохексан 4) 2-метилбутан
24. НЕ се применува за реакција на супституција
1) дехидрогенизација 2) бромирање 3) нитрација 4) хлорирање
25. Во втората фаза на хлорирање на метанот,
1) јаглерод тетрахлорид 2) трихлорометан 3) дихлорометан 4) 1,2 - дихлороетан
26. Етанот влегува во интеракција со секој пар супстанци:
1) Јас 2 и Н 2 2 ) HBr и H 2 О 3)Cl 2 и О 2 4) Н 2 и NaOH
27. Како резултат на реакцијата може да се добие метан хлорид
А) метан со водород хлорид Б) метан со хлороводородна киселина
Б) метан со хлор под осветлување Г) метан со раствор од хлор во вода
28. Како резултат на термичко распаѓање на метанот на 1500 °C,
1) В 2 Н 2 и Н 2 2) CO и H 2 3) В и Н 2 4) CO 2 и Н 2 ЗА
29. Во реакцијата на бромирање на пропан неопходен услов е:
1) осветлување со сончева светлина 3) присуство на катализатор
2) реакцијата се случува во нормални услови 4) загревање
30.Како се оксидираат алканите при процесот на согорување?
1) водород во воздухот 2) кислород во воздухот 3) калиум перманганат 4) алканите не горат
31. Реакцијата на Вурц е реакцијата….
А) нитрација на алканите Б) интеракција на монохалоген дериват соNa
Б) бромирање Г) нема таква реакција
32. Реакцијата која води до издолжување на јаглеродниот синџир е
1) изомеризација на алканите 3) хидрогенизација на алкените
2) декарбоксилација натриумови соли карбоксилни киселини 4) Вурцова реакција
33.Што не се формира при дехидрогенизација на алканите? 1) арени 2) алкини 3) алкени 4) акадиени
34. Наведете ги „најблиските хомолози“ на пропанот.
1) В 4 Н 10 2) CH 4 3) В 6 Н 12 4) В 2 Н 6
35 Алканите во лабораторија се добиваат:
А) при пукање на нафтата Б) хидрогенизација на јагленот
Б) Вурцова реакција Г) Реакција Кучеров
36. Наведете ја формулата на алканот, кој е течност во нормални услови
1) В 4 Н 10 2) В 16 Н 34 3) В 7 Н 16 4) CH 4
37. Со зголемување на бројот на јаглеродни атоми во јаглеводородни молекули, точката на вриење на овие јаглеводороди
1) не се менува 2) се намалува
3) се зголемува 4) прво се зголемува, а потоа се намалува
38.При термичко разложување на метанот на температура од 1000 0 C се формираат
1) саѓи и водород 2) јаглерод моноксид и водород
3) јаглерод диоксид и водород 4) ацетилен и водород
39. Кога се спојуваат калиум ацетат и калиум хидроксид, се ослободува гасовит производ
1) водород 2) јаглерод диоксид 3) метан 4) етан
40. Хексанот не реагира со водород хлорид бидејќи
1) нема π врски во неговата молекула 2) хексан е јаглеводород
3) молекулата на хексан е неполарна 4) нема водородни врски помеѓу атомите
41. Производот на реакција (доминантен) на 2-бромопропан со натриум е
1) 2,3-диметилбутан 2) хексан 3) циклохексан 4) пропен
43. Колку различни супстанцииприкажано на сликата: 1) 7 2) 4 3) 3 4) 2
44. При реформирање на метилциклохексан, како резултат на реакции на изомеризација и дехидрогенизација, тој се претвора во
1) етилциклопентан 2) хексен 3) бензен 4) толуен
45. Алканите се подложени на следните реакции: а) супституција; б) пристапување; в) оксидација; г) полимеризација; д) изомеризација
1) а, б, в 2) а, в, д 3) а, б, в, г, д 4) б, г, е
46. Етанот е во интеракција со
1) халогени 2) водород3) карбоксилни киселини 4) водородни халиди
47. Конверзијата на бутан во бутен се однесува на реакцијата
1) полимеризација 2) дехидрогенизација 3) дехидрација 4) изомеризација
48. Структурниот изомер на нормалниот n-хексан е
1) 3-етилпентан 2) 2-метилпропан 3) 2,2-диметилпропан 4) 2,2-диметилбутан
49. Интеракцијата на метанот со хлорот е реакција
1) соединенија, егзотермни 2) супституција, ендотермични
3) соединенија, ендотермични 4) супституција, егзотермни
50. Дали се вистинити? следните пресудиза јаглеводородите?
A. Сите алкани се гасовити.
Б. Метанот обезбојува воден раствор на калиум перманганат.
1) само А е точно 2) само Б е точно 3) двете пресуди се точни 4) двете пресуди се неточни
51. Бутанот може да се добие со реакцијата на Вурц, чија шема е
1) C 4 H 8 т°"мачка → 2) C 4 H 9 C1 + KOH (алкохол) → 3) C 2 H 5 C1 + Na → 4) 2 C 2 H 4 т°" мачка →
Тест на тема „Алкани“ 2016 година
52. Изобутан реагира со
1) хлороводородна киселина 2) водород 3) водород бромид 4) азотна киселина
53. Интеракцијата на метанот со хлорот е реакција
1) замена, неповратна 3) размена, неповратна
2) замена, реверзибилна 4) размена, реверзибилна
54. При загревање на мешавина од 2-хлоропропан и хлороетан со натриум метал, се формира натриум хлорид и мешавина
1) 2,3-диметилбутан, бутан, 2-метилбутан 2) хексан, 2-метилбутан, 1,2-дихлороетан
3) 2,3-диметилбутан, бутан, 2-метилбутан 4) 2,3-диметилбутан, 2-метилбутан, бутен
55 Кои од следните тврдења се точни?
А. Дехидроциклизацијата на n-хептан произведува бензен.
B. Метанот не подлежи на реакции на додавање.
1) само А е точно 2) само Б е точно 3) двете тврдења се вистинити 4) двете изјави се неточни
56.Име на алканот CH 3 -CH (CH 3 ) -CH 2 -C (CH 3 ) 2 -CH 3
57. 2-хлоробутан главно се формира со реакцијата
1) бутен-1 и хлор 2) бутин-1 и водород хлорид
3) бутан и хлор 4) бутин-2 и водород хлорид
58. Метанот реагира
1) со водород хлорид 2) со водена пареа на катализатор
3) изомеризација 4) со бромна вода
59. Содржи шест јаглеродни атоми
1) 2-метилбутан2)2,2-
диметилбутан 3) 2-метилпропан 4) 3-метилхексан
60. 2-метилпентан и 2-метилхексан се релативно еден на друг
1) аналози 2) радикали 3) хомолози 4) изомери
61. Може да се произведува етан
1) дехидрација на етанол 2) електролиза на раствор на калиум ацетат
3) хидрогенизација на етанол 4) дехидрација на етаноична киселина
62. Изомери се
1)3-метилхексан и октан 2)3-етилпентан и 3-метилпентан
3)2,2-диметилпентан и 2,2-диметилхексан 4)2-метилпентан и хексан
64.Број органска материја, кои се формираат кога бромометанот и бромоетанот се загреваат со натриум метал, е еднаков на 1) 1 2)2 3)3 4)4
Задачи повисоко нивотешкотии
66. Сите алкани можат да реагираат со:
1) водород 2) кислород 3) вода
4) хлор 5) водород хлорид 6) азотна киселина Одговор____________
67 Метанот се карактеризира со:
1) реакција на хидрогенизација 2) тетраедрална форма на молекулата
3) достапност π -врски во молекулата 5) реакции со водородни халиди
4) сп 3 -хибридизација на орбиталите на јаглеродниот атом во молекулата
6) согорување во воздух Одговор: ________
68. Се јавува реакција на пропан со хлор
1) со верижен радикален механизам2) со средно формирање на честичка CH 3 - CH + - CH 3
3) без катализатор 4) во воден раствор
5) со формирање на пропен 6) со руптураσ -врски во молекулата на пропанОдговор____________
69 Реакција на пропан и бром
3) доведува до преференцијално формирање на 2-бромопропан
4) доведува до преференцијално формирање на 1-бромопропан
5) обично се јавува во темница
6) е каталитички процес Одговор: _______
69.Хлорирање на метанот
1) постојано доведува до формирање на различен метан супституиран со хлор
2) започнува со процесот на раскинување на врската во молекулата на метанот
3) се однесува на радикални реакции
4) изведено во темница
5) е типичен каталитички процес
6) се однесува на егзотермички процеси Одговор: _________
70.Хлорирање на метанот
1) тече низ јонски механизам 2) се однесува на радикални реакции
3) започнува со процесот на кршење на врската во молекулата на хлорот 5) се однесува на ендотермички процеси
4) продолжува низ средна реакција: CH 4 →C + 4H 6) доведува до формирање на хлорометан
Одговор: __________
71. Механизмот на реакцијата на хлорирање на метан ги вклучува следните фази:
1)CH 4 → CH 3 + H 2) C1 2 → 2C1
3) C1 + CH 4 → CH 3 C1 + H 4) CH 4 → C + 4H
5) C1 2 + CH 4 → CH 3 C1 + HC1 6) H + Cl → HC1
Одговор: __________
72. Реакција на 2-метилпропан и бром
1) се однесува на реакции на супституција
2) продолжува преку радикален механизам
3) доведува до преференцијално формирање на 1-бромо-2-метилпропан
4) доведува до преференцијално формирање на 2-бромо-2-метилпропан
5) обично се јавува во темница
6) е каталитички процес Одговор: __________
73. 2-Метилбутанот се карактеризира со тоа што тој
1) се користи за производство на изопрен
2) комуницира со хлор во присуство на A1C1 3
3) при хлорирање формира претежно 2-хлоро-2-метилбутан
4) е изомер на диметилпропан
5) при интеракција со бакар (II) хидроксид, формира 2-метилбутанал
6) не формира експлозивни смеси со воздухот
Одговор:__________
74.Итан се карактеризира со тоа што тој
1) може да се добие со електролиза на калиум пропионат 2) комуницира со бром на светлина
3) при дехидрогенизација сукцесивно се претвора во етилен и ацетилен
4) се подложува на Вурцова реакција 5) се оксидира со воздух при амбиентални услови.
6) е хомолог на октан Одговор: ______________
75. Продолжува реакцијата на бромирање на метан
1) со радикален механизам 2) во една фаза
3) со формирање на разни бромо деривати 4) во темница и без загревање
5) со ослободување на топлина
6) во согласност со правилото на В.В.Марковников Одговор: _____.
76. За производство на метан можете да ги користите следните реакции:
1) загревање на калиум ацетат со калиум хидроксид 2) распаѓање на етанот при загревање
3) хидролиза на алуминиум карбид 4) хлорометан со натриум
5) редукција на метанал 6) водород со јаглерод Одговор: _________
77. Интеракцијата се одвива според радикалниот механизам
1) пропен и бром вода 2) пропен и водород бромид
3) пропен и хлор (во воден раствор) 4) пропен и хлор (на 500°C)
5) етан и кислород 6) метан и хлор
Одговор: ________
78. Метанот се формира кога
1) хидролиза на калциум карбид CaC 2 2) хидролиза на алуминиум карбид А1 4 СО 3
3) хидрогенизација на етилен 4) калцинација на натриум ацетат со натриум хидроксид
5) разградување на бензенот 6) дехидрација етил алкохолОдговор: ____________ .
79. Бутанот се карактеризира со:
1) изомеризација 4) интеракција со натриум
2) хидратација 5) хидрогенизација
3) интеракција со халогени 6) каталитичка оксидација
Одговор: ____________
80. Изберете ги карактеристиките карактеристични за етанот:
А) гасовита супстанција Б) гори со бледо синкав пламен
В) има лут мирис Г) 1,5 пати потежок од водородот
Д) растворлив во вода Д) претрпува реакции на адиција
Одговор: _____________________
– ова се заситени (или заситени) нециклични јаглеводороди во кои сите врскисингл.
Општа формула:
C n H 2 n +2
Сите јаглеродни атоми во алканите имаат сп 3 - хибридизација.
Првите четири членови од хомологната серија на алкани се гасови, C5–C17 се течности, а почнувајќи од C18 се цврсти материи. Сите алкани се полесни од водата, нерастворливи во вода и не се мешаат со неа.
Хемиски својства.
1) Врската на јаглеродот со водородот во алканите е нискополарна.
2) Затоа, неговото раскинување во реакциите е можно само со хомолитичен механизам:
Ова е можно само во тешки услови.
3) Заситените (заситени) јаглеводороди немаат способност да влегуваат во адициони реакции. Тие се карактеризираат со реакции на замена атоми на водород и разделување. Овие реакции се случуваат или со топлина, или на светлина, или со употреба на катализатори.
Алканите не реагирајСо концентрирани киселини, алкалии, калиум перманганат, бром вода.
I. Реакции на замена.
1) Халогенација: радикална супституција.
Хлор и бром на светлина или топлина.
А) хлорирање: процесот е брз, затоа се одвива неселективно, се формира мешавина на заменски производи:
CH 3 - CH 2 - CH 3 + Cl 2 - (светло) CH3-CH2-CH2Cl + CH3-CHCl-CH3 + HCl
Б) бромирање:
CH 3 CH 3
CH 3 -CH 2 -CH -CH 3 +Br 2 - (светло) CH3-CH2-C-CH3 + HBr
Бромирањето е побавен и поселективен процес.
Селективност на бром:
терцијарен > секундарен > примарен јаглероден атом.
Механизам на радикална замена:Ланец на слободен радикал.
Слободен радикал Р ∙ е МНОГУ АКТИВНА честичка која носи еден неспарен електрон и има тенденција да формира врска со некој друг атом.
1) Иницирање на колото (почеток): Молекулата на хлор се распаѓа на два радикали со дејство на лесен квант. Cl · :
2) Развој на синџирот: Радикалот на хлор апстрахира атом на водород од алканот. Во овој случај, се формира средна честичка - алкилен радикал, кој пак апстрахира атом на хлор од молекулата Cl 2. Во овој случај, повторно се добива радикал на хлор и процесот се повторува - ланецот продолжува:
3) Отворено коло: комбинација на два радикали во молекула.
2) Нитрација
(реакција на М.И. Коновалов):
Механизмот на реакција е исто така радикален.
Греење на 140°C со разредена (10%) азотна киселина:
CH 3 CH 3
CH 3 -CH 2 -CH-CH 3 + HNO 3 CH3-CH2-C-CH3 + H2O
Селективност на нитрација: НЕ 2
терцијарен > секундарен > примарен јаглероден атом.
3) Пукнатина - трансформација на алкани под влијание на топлина.
а) За алканите со долг ланец, пукањето произведува алкан и алкен. Покрај тоа, со должина поголема од 5 атоми C, резултатот е мешавина од јаглеводороди со различни должини.
CH 3 –CH 2 –CH 2 –CH 3 - 400°C CH 3 -CH 3 + CH 2 = CH 2
б) Напукнување со метансе случува на два можни начини:
1. долгорочно загревање на метан: CH 4 - 1500°C C+2H2
2. моментално загревање до 1500 степени и моментално ладење:
2CH 4 - 1500°C H–C ≡ C –H + 3H 2
Ацетилен
4) Изомеризација - преуредување на јаглеродниот скелет со формирање на други изомери:кога се загрева со катализатор AlCl 3.
CH3-CH2-CH2-CH3-(100 o, AlCl3) CH 3 -CH -CH 3
5) Оксидација:
1) Согорување:
CH 4 + 2O 2 ⇆ CO 2 + 2H 2 O
C 5 H 12 + 8O 2 ⇆ 5CO 2 + 6H 2 O
2) Каталитичка оксидација:
Метан: CH 4 + O 2 - (катализатор) мешавина од CH 3 OH, HSON и HCOOH
Бутан: C 4 H 10 + O 2 - (катализатор) 2 CH 3 COOH ( оцетна киселина)
6) Дехидрогенизација и циклизација.
1) Кратките алкани се дехидрогенизираат во алкени или диени:
C 2 H 6 - (кат., т) C 2 H 4 + H 2
CH 3 -CH 2 -CH 2 -CH 3 - (кат. Cr 2 O 3, t) бутадиен + H2
2) Во присуство на катализатор, хексан и хептан се претвораат во бензен и толуен, соодветно.
CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3 - (кат.Pt, t) + 4 H 2
Потврда:
1) Реакција на Вурц:ефектот на металниот натриум врз монохалогените деривати на јаглеводородите:
2 CH 3 – CH 2 Br + 2Na CH 3 – CH 2 – CH 2 – CH 3 +2NaBr
Јаглеродниот скелет се удвојува. Реакцијата е погодна за подготовка на симетрични алкани.
2) Декарбоксилација на соли на карбоксилна киселина(Дума реакција): фузија на соли на карбоксилни киселини со алкалии.
Така се добива метанот со загревање на натриум ацетат со натриум хидроксид.
CH 3 COONa + NaOH ( фузија) CH 4 + На 2 CO 3
3) Електролиза на раствори на соли на карбоксилна киселина(Реакцијата на Колбе):
2CH 3 COONa + 2H 2 O – (електрична струја) 2CO 2 + H 2 + C 2 H 6 + 2NaOH
катода:
испушта вода: 2H 2 О + 2е Н 2 + 2OH -
анодна:
киселински анјонски исцедок: 2 CH 3 ТАКА - -2е 2 CO 2 + CH 3 - CH 3
4) Хидролиза на алуминиум карбид– производство на метан.
Ал 4 В 3 +12 ч 2 О 3 CH 4 + 4Al(OH) 3
5) Хидрогенизација на незаситени или циклични јаглеводородиво присуство на катализатори (платина, паладиум, никел).
R–CH=CH–R’ + H 2 – кат R–CH 2 – CH 2 -Р'
(циклопропан) + H 2 – Pd CH 3 – CH 2 – CH 3 (пропан)
6) Алканите може да се добијат од нафта со пукање или фракциона дестилација.
Се подготвуваме за обединет државен испит.Алкани.
АЛКАН (заситени јаглеводороди, парафини)
Алканите се алифатични (ациклични) заситени јаглеводороди во кои јаглеродните атоми се меѓусебно поврзани со едноставни (единечни) врски во прави или разгранети ланци, сосо општата формула C n H 2n+2, каде што n ≥1.
Алканите – име на заситени јаглеводороди од меѓународна номенклатура.
Парафини – историски утврдено име кое ги одразува својствата на овие соединенија (од лат. parrum афинис – има мал афинитет, слаба активност).
Екстремни или заситени , овие јаглеводороди се именувани поради целосната заситеност на јаглеродниот синџир со атоми на водород.
Хомологни серии на алкани
Алкани, кои имаат општа формула C n H 2n+2 , се серија поврзани соединенија со иста структура, во која секој следен член се разликува од претходниот со константна група атоми (-CH 2 -). Оваа низа на врски се нарекувахомологни серии(од грчки хомолог - слично), поединечни членови на оваа серија -хомолози , а групата атоми во кои се разликуваат соседните хомолози ехомолошка разлика.
- CH 4 – првиот член на хомологната серија –метанот (содржи 1 C атом);
- CH 3 -CH 3 или CH 3 -CH 3 - етан (2 C атоми);
- CH3-CH2-CH3 или CH3-CH2-CH3 – пропан (3 C атоми);
- CH 3 -CH 2 -CH 2 -CH 3 или CH 3 -CH 2 -CH 2 -CH 3 – бутан (4 C атоми).
Наставка -ан е карактеристично за имињата на сите алкани. Почнувајќи од петтиот хомолог, името на алканот е формирано од грчкиот број, што го означува бројот на јаглеродни атоми во молекулата и суфиксот-ан: пентан C5H12, хексан C6H14, хептан C7H16, октан C8H18, нонан C9H20, декан C10H22 итн.
Хомолозите се разликуваат по молекуларната тежина и, според тоа, по физичките својства. Со зголемување на бројот на јаглеродни атоми во молекула на алкан во хомологна серија, се забележува природна промена во физичките својства на хомолозите: температурите на вриење и топење се зголемуваат, а густината се зголемува. Сите алкани се полесни од водата и се нерастворливи во неа, но тие се растворливи во неполарни растворувачи (на пример, бензен) и самите се добри растворувачи. Алканите од CH 4 до C 4 H 10 - гасови, од C 5 H 12 до C 17 H 36 – течности, потоа – цврсти материи. Имајќи го истото висококвалитетен состави истиот тип на хемиски врски, хомолозите имаат слични хемиски својства. Затоа, знаејќи Хемиски својстваеден од членовите на хомологната серија, можно е да се предвиди хемиското однесување на другите членови од оваа серија.
Структура на алканите
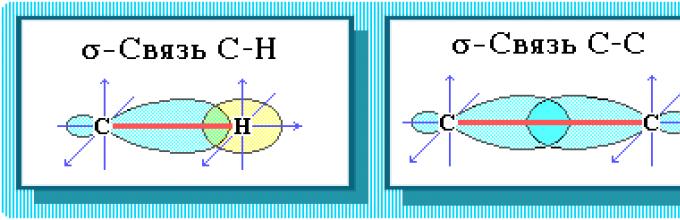
Алканите имаат два вида хемиски врски:
C–C и C–H.
Врската C-C е ковалентна неполарна. Врската C–H е ковалентна, слабо поларна, бидејќи јаглеродот и водородот се блиски по електронегативност).
Сите јаглеродни атоми во алканите се во состојба sp 3-хибридизација.
Четири јаглеродни σ врски се насочени во просторот под агол од 109О 28", што одговара на најмала електронска одбивност. Затоа, молекулата на наједноставниот претставник на алканите - метанот CH 4 – има форма на тетраедар, во чиј центар има атом на јаглерод, а на темињата има атоми на водород.
Изомеризам на алканите
Изомеризам е феномен на постоење на соединенија кои имаат ист состав (исти молекуларна формула), но различна структура. Таквите врски се нарекуваатизомери.
Разликите во редоследот по кој атомите се комбинираат во молекулите (т.е. хемиската структура) доведуваат доструктурен изомеризам (изомеризам на јаглероден скелет). Во серијата алкани, структурниот изомеризам се манифестира кога синџирот содржи 4 или повеќе јаглеродни атоми, т.е. почнувајќи со бутан C 4 N 10 . На пример, алкан со состав Ц 4 H 10 може да постои во формадва структурни изомери:
CH 3 –CH 2 –CH 2 –CH 3 (бутан) и CH 3 –CH(CH 3) –CH 3 (2-метилпропан).
Структурните изомери се разликуваат по физичките својства. Алканите со разгранета структура, поради помалку густо пакување на молекули и, соодветно, помалку меѓумолекуларни интеракции, врие на пониска температура од нивните неразгранети изомери.
Хемиски својства на алканите
Тривијалното (историско) име за алканите - „парафини“ - значи „нема афинитет“. Алканите кај нормални условихемиски неактивни. Ниско реактивносталканите се должи на многу нискиот поларитет на врските C-C и C-H во нивните молекули поради речиси идентичната електронегативност на атомите на јаглерод и водород. Заситените јаглеводороди во нормални услови не комуницираат со концентрирани киселини, алкалии, па дури и со таков активен реагенс како што е калиум перманганат. Алканите генерално не се способни за реакции на додавање поради екстремната заситеност на сите врски на јаглеродни атоми.
I. Реакции на замена
Под одредени услови (кога се загрева, или на светлина или со употреба на катализатори), врските C-H се прекинуваат и атомите на водород се заменуваат со други атоми или групи на атоми. Во овие реакции се случува хомолитичко расцепување на ковалентни врски, односно тие се изведуваат со механизам на слободни радикали (синџир).
1) Халогенација
Халогенизацијата на алканите е реакција на замена на еден или повеќе атоми на водород во молекула на алкан со халоген. Производите на реакција се нарекуваат халоалкани или халогени деривати на алканите R-Cl или C n H 2n+1 – Cl.
Реакцијата на алканите со хлор и бром се јавува на светлина или при загревање.
Метанско хлорирање:
CH 4 + Cl 2 hν → CH 3 Cl + HCl (прва фаза)
(hν - светлосен квант; CH 3 Cl - хлорометан)
Ако има доволно хлор, реакцијата продолжува понатаму:
CH 3 Cl + Cl 2 hν → CH 2 Cl 2 + HCl (фаза 2)
(CH 2 Cl 2 - дихлорометан)
СH 2 Cl 2 + Cl 2 hν → CHCl 3 + HCl (3-та фаза)
(CHCl 3 - трихлорометан или хлороформ)
CHCl 3 + Cl 2 hν → CCl 4 + HCl (четврта фаза)
(CCl 4 - јаглерод тетрахлорид)
Реакцијата на халогенација на алканите се јавува преку механизам на радикален синџир. Во развојот на теоријата на верижни реакции, делата на академик, лауреат Нобелова наградаН.Н.Семенова.
Брзината на реакцијата на замена на водородот со атом на халоген е поголема за халоалканите отколку за соодветните алкани, ова се должи на меѓусебно влијаниеатоми во молекула. Како што се зголемува јаглеводородниот радикал, најподвижните атоми на водород остануваат на јаглеродниот атом најблиску до супституентот:
CH 3 –CH 2 –Cl + Cl 2 hν → CH 3 – CHCl 2 + HCl
(CH 3 - CHCl 2 - 1,1-дихлороетан)
При хлорирање или бромирање на алкан со секундарни или терциерни јаглеродни атоми, најлесно е да се замени водородот кај терциерниот атом, потешко е секундарниот, а уште потешко е примарниот. Ова се објаснува со поголемата стабилност на терциерните и секундарните јаглеводородни радикали во споредба со примарните поради делокализацијата на неспарениот електрон. Затоа, на пример, при бромирање на пропан, главниот производ на реакција е 2-бромопропан:
Со флуор реакцијата се јавува експлозивно.
2) Нитрација (реакција на Коновалов)
И покрај фактот дека во нормални услови алканите не реагираат со концентрирана азотна киселина, кога се загреваат до 140 ° C со разредена (10%) азотна киселина под притисок, се јавува реакција на нитрација - замена на атом на водород со нитро група NO2. Производи за реакција - нитроалкани R-NO 2 или C n H 2n+1 – NO 2.
Шема на реакција:
CH 4 + HNO 3 t˚С,Р → CH 3 NO 2 + H 2 O (нитрација на метанот произведува нитрометан).
Во реакциите, атомите на водород најлесно се заменуваат кај терциерните јаглеродни атоми, потоа кај секундарните и, на крај, кај примарните.
3) Сулфонација
Сулфурната киселина на обични температури нема ефект врз алканите, но на ниски температури се концентрирасулфурна киселинаможе да дејствува до крајјаглеводородишто доведува до замена на атом на водород со сулфо група SO 3H
II. Реакции на оксидација на алкани
На обични температури, алканите не реагираат дури и со силни оксидирачки агенси (H 2 Cr 2 O 7, KMnO 4, итн.).
1) Кога се внесуваат во отворен пламен, алканите горат. Во овој случај, во вишок на кислород, тие целосно се оксидираат до CO 2 и вода. Согорувањето на јаглеводородите е придружено со ослободување на голема количина топлина (егзотермична реакција).
CH 4 + 2O 2 →CO 2 + 2H 2 O+ Q
C 5 H 12 + 8O 2 →5CO 2 + 6H 2 O + Q
Равенката за реакцијата на согорување на алканите во општа форма:
Од оваа равенка произлегува дека со зголемување на бројот на јаглеродни атоми ( n ) во алканот се зголемува количината на кислород потребна за негова целосна оксидација. При согорување на повисоки алкани ( n >>1) кислородот содржан во воздухот можеби не е доволен за нивна целосна оксидација до CO 2
. Потоа се формираат производи за делумна оксидација:јаглерод моноксид CO,
саѓи (фин јаглерод, нула степеноксидација). Затоа, повисоките алкани горат во воздухот со зачаден пламен, а отровниот јаглерод моноксид што се ослободува по пат (без мирис и безбоен) претставува опасност за луѓето.
Согорувањето на метан со недостаток на кислород се случува според равенките:
2CH 4 + 3O 2 → 2CO + 4H 2 O
CH 4 + O 2 → C + 2H 2 O
2) Каталитичка оксидација со атмосферски кислород.
Делумната оксидација на алканите на релативно ниска температура и со употреба на катализатори е придружена со кинење на само дел од врските C-C и C-H и се користи за добивање вредни производи: карбоксилни киселини, кетони, алдехиди и алкохоли.
2CH 4 + O 2 → 2CH 3 OH (CH 3 OH - метанол)
CH 4 + O 2 → HCOH + H 2 O (HCOH - метанал)
2CH 4 + 3O 2 → 2HCOOH + 2H 2 О (HCOOH - метаноична киселина)
Кога бутанот е нецелосно оксидиран, се добива оцетна киселина:
2C 4 H 10 + 5O 2 → 4СH 3 COOH + 2H 2 O
III.Термички трансформации на алканите
1) Пукнатина на алкани– процес на термичко разложување на јаглеводородите, кој се заснова на реакциите на разделување на јаглеродниот синџир на големи молекули со формирање на молекули на алкани и алкени со пократок синџир.
Напукнувањето на алканите е основа на рафинирањето на нафтата со цел да се добијат производи со помала молекуларна тежина, кои се користат како моторни горива, масла за подмачкување итн., како и суровини за хемиската и петрохемиската индустрија.
Постојат два начина да се спроведе овој процес:термичко пукање(кога се загрева без воздушен пристап) икаталитичко пукање(поумерено загревање во присуство на катализатор).
C 10 H 22 t ° С → C 5 H 12 + C 5 H 10
2) Дехидрогенизација на алканите
При загревање на алканите во присуство на катализатори (Pt, Pd, Ni, Cr 2 О 3, Ал 2 О 3 ) нивниот каталитичкидехидрогенизација – апстракција на атоми на водород поради кршење на врските C-H.
3) Изомеризација на алканите.
Алканите со нормална структура под влијание на катализаторите и при загревање се способни да се трансформираат во разгранети алкани без да го менуваат составот на молекулите, т.е. влегуваат во реакции на изомеризација. Овие реакции вклучуваат алкани чии молекули содржат најмалку 4 јаглеродни атоми.
На пример, изомеризацијата на n-пентан во изопентан (2-метилбутан) се случува на 100°C во присуство на катализатор на алуминиум хлорид:
4) Реакција на дехидроциклизација или ароматизација
Алканите со главен синџир од 6 или повеќе јаглеродни атоми влегуваат во реакција на дехидроциклизација, но секогаш формираат 6-член прстен (циклохексан и неговите деривати). Во услови на реакција, овој циклус е подложен на понатамошна дехидрогенизација и се претвора во енергетски постабилен бензен прстен на ароматичен јаглеводород (арен). На пример:
Овие реакции се во основата на процесот на реформирање - преработка на нафтени продукти за производство на арени (ароматизација на заситените јаглеводороди) и водород. Трансформацијата на n-алканите во арени доведува до подобрување на отпорноста на удар на бензинот.
5) Термичко распаѓање до едноставни материи
CH 4 t → C + 2H 2
6) Пиролиза на метан.
На 1500 °C се јавуваинтермолекуларна дехидрогенизацијаметанот
со формирање на ацетилен:
2CH 4 1500°С → C 2 H 2 + 3H 2
Оваа реакција се користи за индустриско производствоацетилен.
IV.Конверзија на метан
Важна е реакцијата на интеракцијата на метанот со водена пареа, како резултат на што се формира мешавина на јаглерод моноксид (II) со водород - „синтезен гас“:
Оваа реакција се користи за производство на водород. Синтезниот гас служи како суровина за производство на различни јаглеводороди.
Подготовка на алкани
Алканите се изолирани од природни извори (природни и придружни гасови, нафта). Природниот гас се состои од 95% метан. Мочуришниот гас, формиран како резултат на бактериска обработка (гниење) на јаглени хидрати, има ист состав. Придружните нафтени гасови се состојат главно од етан, пропан, бутан и делумно пентан. Тие се одвојуваат од маслото во специјални постројки за третман на масло. Во отсуство на гасни кондензатни станици, придружните нафтени гасови се согоруваат во ракети, што е крајно немудра и расипничка практика во производството на нафта. Истовремено со гасовите, маслото се прочистува од вода, нечистотија и песок, по што влегува во цевката за транспорт. Од маслото при неговата дестилација се добива
повеќе од 100 поединечни соединенија, прави и разгранети алкани, циклоалкани и ароматични јаглеводороди.
Се користат и синтетички методи.
- Пукнување на алкани (индустриски метод)
- Хидрогенизација на незаситени јаглеводороди:
C n H 2n + H 2 t˚С, Ni или Pd → C n H 2n+2
Синтеза на посложени алкани со дејство на метален натриум на монохалоалкани со помалку јаглеродни атоми:
2CH3–CH2Br+2Na→CH3–CH2–CH2–CH3+2NaBr
Вурцовата реакција има смисла само за подготовка од еден алкил халид, бидејќи инаку мешавината на алкани е тешко да се одвои во лабораториски услови.
На пример:
Покрај пропанот C 3 H 8 се формира бутан C 4 H 10 (од 2 молекули на C 2 H 5 Br ) и етан C 2 H 6 (од 2 молекули на CH 3 Br ).
- Термичка декарбоксилација. Спој на соли на карбоксилни киселини со алкали (реакција на Думас):
или воопшто
R-COONa + NaOH R-H + Na 2 CO 3
- Електролиза на соли на карбоксилни киселини (Колбе реакција):
- Изомеризација. Под влијание на катализаторите, кога се загреваат, алканите со нормална структура се подложени на изомеризација - преуредување на јаглеродниот скелет со формирање на алкани со разгранета структура
- Течните јаглеводороди сочинуваат значителен дел од моторните и ракетните горива и се користат како растворувачи.
- Маслото од вазелин (мешавина од течни јаглеводороди со до 15 јаглеродни атоми) е транспарентна течност без мирис и вкус, која се користи во медицината, парфимеријата и козметиката.
- Вазелин (мешавина од течни и цврсти заситени јаглеводороди со број на јаглеродни атоми до 25) се користи за подготовка на масти кои се користат во медицината.
- Парафин (мешавина од цврсти алкани В 19 -С 35 ) - бела цврста маса без мирис и вкус (mp 50-70 ° C) - се користи за правење свеќи, импрегнирање кибритчиња и хартија за завиткување, за термички процедури во медицината. Служи како суровина за производство на органски киселини и алкохоли, детергентии сурфактанти.
- Нормалните заситени јаглеводороди со просечна молекуларна тежина се користат како хранлив супстрат во микробиолошката синтеза на протеини од масло.
- Од големо значење се халогените деривати на алканите, кои се користат како растворувачи, течности за ладење и суровини за понатамошни синтези.
- Во современата петрохемиска индустрија, заситените јаглеводороди се основа за добивање на различни органски соединенија, важна суровина во процесите на добивање меѓупроизводи за производство на пластика, гуми, синтетички влакна, детергенти и многу други материи.
Извори
- Г.И. Дерјабина, Г.В. Кантарија. Органска хемија. Електронски ресурс.
- И.И.Новошински, Н.С.Новошинскаја. Органска хемија: прирачник за средношколци и апликанти. – М.: ООО „Издавачка куќа ОНИКС 21 век“, 2004 година
- Кузменко Н.Е., Еремин В.В., Попков В.А. Почеток на хемијата. Модерен курсза оние кои влегуваат на универзитети. М.: Испит, 2002 година.
Алкани.Структура на алканите
Алканите (парафини)– алифатични (нециклични) заситени јаглеводороди, во кои атомите на јаглеродот се поврзани едни со други со едноставни (единечни) врски во прави или разгранети синџири.
Алканите ја имаат општата формула В n Х 2 n +2 , Каде n– број на јаглеродни атоми.
Хемиска структура. Валканите имаат два вида хемиски врски:
С-СИ S–H.
Врската C-C е ковалентна неполарна. Врската C–H е ковалентна, слабо поларна, бидејќи јаглеродот и водородот се блиски по електронегативност (2,5 за јаглерод и 2,1 за водород). Образование ковалентни врскикај алканите поради заедничките електронски парови на атоми на јаглерод и водород може да се прикажат со помош на електронски формули:
Електронски и структурни формулиодразуваат хемиска структура, но не давајте идеја за просторна структура на молекулите, што значително влијае на својствата на супстанцијата.
Просторна структура , т.е. меѓусебно уредувањеатомите на молекулата во вселената зависи од ориентацијата на атомските орбитали (АО) на овие атоми. Во јаглеводородите главна улогаПросторната ориентација на јаглеродните атомски орбитали игра улога, бидејќи сферичниот 1s-AO на атомот на водород нема специфична ориентација.
Просторниот распоред на јаглеродот АО, пак, зависи од видот на неговата хибридизација. Заситениот јаглероден атом во алканите е поврзан со четири други атоми. Затоа, неговата состојба одговара на хибридизацијата sp 3. Во овој случај, секој од четирите sp 3 -хибридни јаглеродни AOs учествува во аксијално (-) преклопување со s-AO на водород или со sp 3 -AO на друг јаглероден атом, формирајќи -CH или C-C врски.

Четири -врски од јаглерод се насочени во вселената под тетраедрален агол од 109 o 28". Според тоа, молекулата на наједноставниот претставник на алканите - метанот CH 4 - има облик на тетраедар, во чиј центар има јаглероден атом, а на темињата има атоми на водород:

Агол на врска N-C-H е еднаков 109 или 28'. Просторната структура на метанот може да се прикаже со користење на волуметриски (скала) и модели со топка и стап.

За снимање, погодно е да се користи просторна (стереохемиска) формула.

Во молекулата на следниот хомолог - етан C 2 H 6 - два тетраедрални sp 3 - атоми на јаглерод формираат посложена просторна структура:

Молекулите на алканите кои содржат повеќе од 2 јаглеродни атоми се карактеризираат со заоблени форми.

Номенклатура
Според номенклатурата IUPAC, имињата на заситените јаглеводороди се карактеризираат со суфиксот -ан. Првите четири јаглеводороди имаат историски утврдени имиња, почнувајќи од петтото, името на јаглеводородот се заснова на грчкото име за соодветниот број на јаглеродни атоми.
Јаглеводородите со нормален синџир на јаглеродни атоми ги имаат следните имиња:
| CH 4 - метан | CH 3 - (CH 2) 5 - CH 3 - хептан |
Имињата на јаглеводородите со разгранет ланец се конструирани на следниов начин:
1. Основата на името на оваа врсказемете го името на јаглеводородот што одговара на бројот на јаглеродни атоми во главниот синџир.
Главниот синџир на јаглеродни атоми се смета за:
а) најдолго;
б) најкомплексен (со максимален број на гранки). Ако во јаглеводород може да се разликуваат два или повеќе еднакво долги синџири, тогаш за главен се избира оној со најдолг синџир. поголем бројгранки:

2. По воспоставувањето на главниот синџир, потребно е повторно да се нумерираат атомите на јаглеродот. Нумерирањето започнува од крајот на синџирот до кој е најблиску кој било од алкилите. Ако различни алкили се наоѓаат на еднакво растојание од двата краја на синџирот, тогаш нумерирањето започнува од крајот до кој е поблиску радикалот со помал број јаглеродни атоми (метил, етил, пропил итн.). На пример:


Ако идентичните радикали кои го одредуваат почетокот на нумерирањето се наоѓаат на еднакво растојание од двата краја на синџирот, но има повеќе од едната страна отколку од другата страна, тогаш нумерирањето започнува од крајот каде што бројот на гранки е поголем: 
2, 2, 4-триметилпентан

2, 3, 6-триметилхептан
При именување на соединение, прво наведете ги супституентите по азбучен ред (бројките не се земаат предвид), а пред името на радикалот ставаат број што одговара на бројот на јаглеродниот атом на главниот синџир на кој се наоѓа овој радикал. . По ова, јаглеводородот што одговара на главниот синџир на јаглеродни атоми е именуван, одвојувајќи го зборот од броевите со цртичка.
Ако јаглеводородот содржи неколку идентични радикали, тогаш нивниот број се означува со грчки број (ди, три, тетра, итн.) и се става пред името на овие радикали, а нивната позиција е означена, како и обично, со бројки, со броевите одделени со запирки, подредени по редослед на нивните зголемувања и се ставаат пред името на овие радикали, одвојувајќи ги од него со цртичка.
ЦИКЛОАЛКАНИ
Имињата на циклоалканите се формираат со додавање на префикс цикло-до името на соодветниот неразгранет заситен јаглеводород со ист број јаглеродни атоми:
Супституентите се нумерирани според нивната положба во циклусот на таков начин што збирот на броевите е минимален:
Изомеризам
Изомери- тоа се супстанции кои имаат ист состав и иста молекуларна формула и маса, но различна хемиска структура и затоа имаат различни физички и хемиски својства.
Структурна изомеризам
Причината за манифестацијата на структурниот изомеризам во низата алкани е способноста на јаглеродните атоми да формираат синџири од различни структури. Овој тип на структурна изомеризам се нарекува изомеризам на јаглероден скелет.
Структурните изомери имаат ист состав, но се разликуваат по хемиската структура, додека хемиските својства на изомерите се слични, но физичките својства се различни. Алканите со разгранета структура, поради помалку густо пакување на молекули и, соодветно, помалку меѓумолекуларни интеракции, врие на пониска температура од нивните неразгранети изомери.
Во молекулите на метан CH 4, етан C 2 H 6 и пропан C 3 H 8 може да има само еден ред на поврзување на атомите, односно првите три членови од хомологната серија на алкани немаат изомери. За бутан C4H10, можни се две структури:

Еден од овие изомери (n-бутан) содржи директен јаглероден ланец, а другиот, изобутан, содржи разгранет (изоструктура).
Со зголемување на бројот на јаглеродни атоми во молекулите се зголемуваат можностите за разгранување на синџирот, т.е. бројот на изомери се зголемува со бројот на јаглеродни атоми.

Во низата радикали се среќаваме и со феноменот на изомеризам. Покрај тоа, бројот на изомери во радикалите е значително поголем отколку во нивните соодветни алкани. На пример, пропанот, како што е познато, нема изомери, а пропил радикалот има два изомери: n-пропил и изо-пропил:
|
CH3-CH3-CH2- и H3C-CH-CH3
Ротациона изомеризам на алканите
Ротацијата на атомите околу s-врската нема да доведе до нејзино прекинување. Како резултат на интрамолекуларната ротација по C–C s-врските, молекулите на алканите, почнувајќи од етан C 2 H 6, можат да заземат различни геометриски форми.
Различни просторни форми на молекула кои се трансформираат една во друга со ротирање околу C-C s-врски се нарекуваат конформацииили ротациони изомери(конформатори).
Ротационите изомери на молекулата се нејзините енергетски нееднакви состојби. Нивната интерконверзија настанува брзо и постојано како резултат на термичко движење. Затоа, ротационите изомери не можат да се изолираат во индивидуална форма, но нивното постоење е докажано со физички методи. Некои конформации се постабилни (енергетски поволни) и молекулата останува во такви состојби подолго време.
Во нормални услови, првите четири членови од хомологната серија на алкани се гасови, C 5 -C 17 се течности, а почнувајќи од C 18 се цврсти материи. Точките на топење и вриење на алканите со нивната густина се зголемуваат со зголемување на молекуларната тежина. Сите алкани се полесни од водата и се нерастворливи во неа, но тие се растворливи во неполарни растворувачи (на пример, бензен) и самите се добри растворувачи.
Физичките својства на некои алкани се претставени во табелата.
| Име | Формула | тpl°C | тбала°C | г 20 4 |
| Метанот | CH 4 | (на -164 °C) |
||
| Етан | СО 2 Н 6 | (на -100 °C) |
||
| Пропан | СО 3 Н 8 | (на -44,5 °C) |
||
| Бутан | СО 4 Н 10 | (на 0°C) |
||
| Пентан | В 5 Х 12 | |||
| Хексан | СО 6 Н 14 | |||
| Хептан | СО 7 Х 16 | |||
| Октански | В 8 Х 18 | |||
| Нонан | СО 9 Н 20 | |||
| деканот | В 10 Х 22 | |||
| Пентадекан | В 15 Х 32 | |||
| Еикосан | СО 20 Н 42 | (на 37 °C) |
||
| Пентакозан | В 25 Х 52 | |||
| Триаконтан | СО 30 Н 62 | |||
| *
г 4
20
– релативна густина, т.е. |
||||
Хемиски својства
Тривијалното (историско) име за алканите - „парафини“ - значи „нема афинитет“. Алканите се хемиски неактивни. Ниската реактивност на алканите се должи на многу нискиот поларитет на врските C-C и C-H во нивните молекули поради речиси идентичната електронегативност на атомите на јаглерод и водород. Заситените јаглеводороди во нормални услови не комуницираат со концентрирани киселини, алкалии, па дури и со таков активен реагенс како што е калиум перманганат.
Тие се карактеризираат со реакции на супституција на атоми на водород и разделување.
Во овие реакции се случува хомолитичко расцепување на ковалентни врски, односно тие се изведуваат со механизам на слободни радикали (синџир).
Поради јачината на врските C-C и C-H, реакциите се случуваат или со загревање, или на светлина или со употреба на катализатори.
Ајде да погледнеме неколку примери на реакции од овој тип.
Халогенација.Ова е една од карактеристичните реакции на заситените јаглеводороди. Халогенирањето на алканите се случува во фази - не повеќе од еден водороден атом се заменува во една фаза:
CH 4 + Cl 2 → CH 3 Cl + HCl (хлорометан)
CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорометан)
CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорометан)
CHCl 3 + Cl 2 → CCl 4 + HCl (јаглерод тетрахлорид).
Нитрација.И покрај фактот дека во нормални услови алканите не комуницираат со концентрирана азотна киселина, кога се загреваат до 140 ° C со разредена (10%) азотна киселина под притисок, се јавува реакција на нитрација - замена на атом на водород со нитро група (Реакцијата на М.И. Коновалов ). Сите алкани влегуваат во слична реакција на нитрација во течна фаза, но брзината на реакцијата и приносите на нитро-соединенијата се ниски. Најдобри резултати се забележани кај алканите кои содржат терциерни јаглеродни атоми.
Напукнување.При високи температури во присуство на катализатори, заситените јаглеводороди претрпуваат разделување, што се нарекува пукање. За време на пукањето, врските јаглерод-јаглерод хомолитички се кршат за да формираат заситени и незаситени јаглеводороди со пократки синџири.
CH 3 –CH 2 –CH 2 –CH 3 (бутан) –– 400°C CH 3 –CH 3 (етан) + CH 2 = CH 2 (етилен)
Зголемувањето на температурата на процесот доведува до подлабоко распаѓање на јаглеводородите и, особено, до дехидрогенизација, т.е. до разделување
водород. Така, метанот на 1500ºС доведува до ацетилен.
2CH 4 –– 1500°C H–C =
C–H(ацетилен) + 3H 2
Изомеризација.Под влијание на катализаторите, кога се загреваат, јаглеводородите со нормална структура се подложени на изомеризација - преуредување на јаглеродниот скелет со формирање на разгранети алкани.
Оксидација. Во нормални услови, алканите се отпорни на кислород и оксидирачки агенси. Кога ќе се запалат во воздух, алканите согоруваат, се претвораат во јаглерод диоксид и вода и се ослободуваат голем број натоплина.
CH 4 + 2O 2 – пламен CO 2 + 2H 2 O
C 5 H 12 + 8O 2 –– пламен 5CO 2 + 6H 2 O
Да се биде во природа и да се прима
Главните извори на алкани се нафтата и природниот гас. 

Метанот го сочинува најголемиот дел од природниот гас; исто така содржи мали количини на етан, пропан и бутан. Метанот се наоѓа во емисиите од мочуриштата и јагленовите шевови. Заедно со лесните хомолози, метанот е присутен во придружните нафтени гасови. Овие гасови се раствораат во масло под притисок и исто така се наоѓаат над него. Алканите сочинуваат значителен дел од нафтените продукти. Маслото содржи и циклоалкани - тие се нарекуваат нафтани (од грчки. нафта- нафта). Гасните хидрати на алканите, главно метанот, се исто така широко распространети во природата; тие се појавуваат во седиментните карпи на континентите и на дното на океаните. Нивните резерви веројатно ги надминуваат познатите резерви на природен гас и во иднина може да станат извор на метан и неговите најблиски хомолози. Алканите се добиваат и со пиролиза (коксирање) јаглени негова хидрогенизација (производство на синтетичко течно гориво). Цврстите алкани се наоѓаат во природата во вид на наслаги од планински восок - озокерит, во восочните облоги на листовите, цветовите и растителните семиња, а се дел од пчелин восок. 
Во индустријата, алканите се добиваат со каталитичка хидрогенизација на јаглеродните оксиди CO
Планински восок
и CO 2 (Метод Фишер-Тропш). Во лабораторија, метан може да се добие со загревање на натриум ацетат со цврсти алкали: CH 3 COONa + NaOH → CH 4 + Na 2 CO 3, како и со хидролиза на некои карбиди: Al 4 C 3 + 12H 2 O → 3CH 4 + 4Al(OH) 3. Хомолози на метанот може да се добијат со реакцијата на Вурц, на пример: 2CH 3 Br + 2Na→CH 3 –CH 3 + 2NaBr. Кај дихалоалканите се добиваат циклоалкани, на пример: Br–CH 2 –(CH 2) 4 –CH 2 Br + 2Na→ цикло-C6H12 + 2NaBr. Алканите се формираат и при декарбоксилација на карбоксилните киселини и при нивната електролиза.
Примени на алкани
Заситените јаглеводороди се широко користени во широк спектар на области од човечкиот живот и активност.
Гасните алкани (мешавина од метан и пропан-бутан) се користат како вредно гориво. 
Течните јаглеводороди сочинуваат значителен дел од моторните и ракетните горива и се користат како растворувачи.
Маслото од вазелин (мешавина од течни јаглеводороди со до 15 јаглеродни атоми) е проѕирна течност без мирис и вкус, која се користи во медицината, парфимеријата и козметиката. 
Вазелин (мешавина од течни и цврсти заситени јаглеводороди со до 25 јаглеродни атоми) се користи за подготовка на масти кои се користат во медицината.
Парафин (мешавина од цврсти алкани C 19 -C 35) - бела цврста маса без мирис и вкус (mp 50-70 ° C) - се користи за правење свеќи, импрегнирање кибритчиња и хартија за завиткување, за термички процедури во медицината. Служи како суровина за производство на органски киселини и алкохоли, детергенти и сурфактанти. 
Нормалните заситени јаглеводороди со просечна молекуларна тежина се користат како хранлив супстрат во микробиолошката синтеза на протеините од маслото.
Од големо значење се халогените деривати на алканите, кои се користат како растворувачи, течности за ладење и суровини за понатамошни синтези. Во современата петрохемиска индустрија, заситените јаглеводороди се основа за производство на различни органски соединенија, важна суровина во процесите на добивање меѓупроизводи за производство на пластика, гума, синтетички влакна, детергенти и многу други материи.
Структура на алканите
Алканите се јаглеводороди во кои се поврзани атомите единечни обврзнициа кои одговараат на општата формула C n H 2n+2. Во молекулите на алканите, сите јаглеродни атоми се во состојба sp 3 -хибридизација.
Ова значи дека сите четири хибридни орбитали на јаглеродниот атом се идентични по форма, енергија и се насочени кон аглите на рамностран триаголна пирамида - тетраедар. Аглите помеѓу орбиталите се 109° 28′. Можна е речиси слободна ротација околу една јаглерод-јаглеродна врска, а молекулите на алканите можат да стекнат најмногу разни формисо агли на јаглеродни атоми блиску до тетраедар (109° 28'), на пример, во молекулата n-пентан.

Особено вреди да се потсетиме на врските во молекулите на алканите. Сите врски во молекулите на заситените јаглеводороди се единечни. Преклопувањето се јавува долж оската што ги поврзува јадрата на атомите, т.е σ обврзници. Јаглерод-јаглерод врски се неполарни и слабо поларизирани. Должината на врската C-C во алканите е 0,154 nm (1,54 10 10 m). Врските C-H се нешто пократки. Густината на електронот е малку поместена кон поелектронегативниот јаглероден атом, т.е. C-H врскае слабо поларна.
Хомологни серии на метан
Хомолози- супстанции кои се слични по структура и својства и се разликуваат по една или повеќе CH групи 2 .


Заситени јаглеводородија сочинуваат хомолошката серија на метан.
Изомеризам и номенклатура на алканите
Алканите се карактеризираат со т.н структурен изомеризам. Структурните изомери се разликуваат едни од други по структурата на јаглеродниот скелет. Наједноставниот алкан, кој се карактеризира со структурни изомери, е бутанот.

Да ја разгледаме подетално основната номенклатура за алканите IUPAC.
1. Избор на главно коло. Формирањето на името на јаглеводород започнува со дефиницијата на главниот синџир - најдолгиот синџир на јаглеродни атоми во молекулата, што е, како што беше, нејзината основа.
2. Нумерирање на атоми на главниот синџир. На атомите на главниот синџир им се доделуваат броеви. Нумерирањето на атомите на главниот синџир започнува од крајот до кој супституентот е најблиску (структури A, B). Ако супституентите се наоѓаат на еднакво растојание од крајот на синџирот, тогаш нумерирањето започнува од крајот на кој ги има повеќе (структура Б). Ако различни супституенти се наоѓаат на еднакви растојанија од краевите на ланецот, тогаш нумерирањето започнува од крајот до кој е најблиску постариот (структура D). Стажот на јаглеводородните супституенти се одредува според редоследот по кој буквата со која започнува нивното име се појавува во азбуката: метил (-CH 3), потоа пропил (-CH 2 -CH 2 -CH 3), етил (-CH 2 -CH 3 ) итн.
Имајте предвид дека името на супституентот се формира со замена на наставката -ane со наставката -yl во името на соодветниот алкан.
3. Формирање на името. На почетокот на името се означени броеви - броевите на јаглеродните атоми на кои се наоѓаат супституентите. Ако има неколку супституенти на даден атом, тогаш соодветниот број во името се повторува двапати одвоен со запирка (2,2-). По бројот, цртичка го означува бројот на супституенти (ди - два, три - три, тетра - четири, пента - пет) и името на супституентот (метил, етил, пропил). Потоа, без празни места или цртички, името на главниот синџир. Главниот синџир се нарекува јаглеводород - член на хомологната серија на метан (метан, етан, пропан, итн.).




Имињата на супстанциите чии структурни формули се дадени погоре се како што следува:
Структура А: 2-метилпропан;
Структура Б: 3-етилхексан;
Структура Б: 2,2,4-триметилпентан;
Структура D: 2-метил 4-етилхексан.
Отсуство на заситени јаглеводороди во молекулите поларни врски води до нив слабо растворлив во вода, не комуницирајте со наелектризирани честички (јони). Најкарактеристичните реакции за алканите се оние кои вклучуваат слободни радикали.
Физички својства на алканите
Првите четири претставници на хомологната серија на метан се гасови. Наједноставниот од нив е метанот - безбоен, без вкус и мирис (мирисот на „гас“, кога го мирисате, треба да повикате 04, се одредува според мирисот на меркаптаните - соединенија што содржат сулфур специјално додадени на користениот метан во апарати за домаќинство и индустриски гас, така што луѓето, лоцирани до нив, може да го откријат истекувањето со мирис).
Јаглеводороди со состав од СО 5 Н 12 пред СО 15 Н 32 - течности; потешките јаглеводороди се цврсти материи. Точките на вриење и топење на алканите постепено се зголемуваат со зголемување на должината на јаглеродниот синџир. Сите јаглеводороди се слабо растворливи во вода; течните јаглеводороди се вообичаени органски растворувачи.


Хемиски својства на алканите
Реакции на замена.
Најкарактеристични реакции за алканите се замена на слободните радикали, при што атом на водород се заменува со атом на халоген или некоја група.
Да ги претставиме карактеристичните равенки реакции на халогенација:
Во случај на вишок халоген, хлорирањето може да оди понатаму, до целосна замена на сите водородни атоми со хлор:

Добиените супстанции се широко користени како растворувачи и почетни материјали во органските синтези.
Реакција на дехидрогенизација(апстракција на водород).
Кога алканите се пренесуваат преку катализатор (Pt, Ni, Al 2 O 3, Cr 2 O 3) на високи температури (400-600 °C), молекулата на водород се елиминира и алкен:
Реакции придружени со уништување на јаглеродниот синџир. Сите заситени јаглеводороди горатсо формирање на јаглерод диоксид и вода. Гасовитите јаглеводороди измешани со воздух во одредени пропорции можат да експлодираат.
1. Согорување на заситени јаглеводородие слободен радикален егзотермна реакција која има многу големо значењекога се користат алкани како гориво:
Генерално, реакцијата на согорување на алканите може да се запише на следниов начин:
2. Термичко разделување на јаглеводороди.
Процесот се одвива според механизам за слободни радикали. Зголемувањето на температурата доведува до хомолитичко расцепување на врската јаглерод-јаглерод и формирање на слободни радикали.
Овие радикали комуницираат едни со други, разменувајќи атом на водород, за да формираат молекула алкан и алкен молекула:
Термичките реакции на распаѓање се во основата на индустрискиот процес - јаглеводород пукање. Овој процес е најважната фаза на рафинирање на нафта.
3. Пиролиза. Кога метанот се загрева на температура од 1000 °C, пиролиза на метан- распаѓање на едноставни материи:
Кога се загрева до температура од 1500 °C, се формира ацетилен:
4. Изомеризација. Кога линеарните јаглеводороди се загреваат со катализатор за изомеризација (алуминиум хлорид), супстанциите со разгранет јаглероден скелет:

5. Ароматизација. Алканите со шест или повеќе јаглеродни атоми во синџирот циклизираат во присуство на катализатор за да формираат бензен и неговите деривати:

Алканите влегуваат во реакции кои се одвиваат според механизмот на слободните радикали, бидејќи сите јаглеродни атоми во молекулите на алканите се во состојба на хибридизација sp 3. Молекулите на овие супстанции се изградени со употреба на ковалентни неполарен C-C(јаглерод - јаглерод) врски и слабо поларни врски C-H (јаглерод - водород). Тие не содржат области со зголемена или намалена густина на електрони, лесно поларизирани врски, т.е. такви врски во кои густината на електронот може да се помести под влијание на надворешни фактори(електростатски полиња на јони). Следствено, алканите нема да реагираат со наелектризираните честички, бидејќи врските во молекулите на алканите не се прекинуваат со хетеролитичкиот механизам.