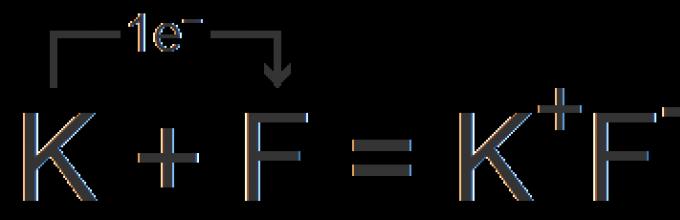Ретко хемиски супстанциисе состои од поединечни, неповрзани атоми хемиски елементи. Во нормални услови, само мал број на гасови наречени благородни гасови ја имаат оваа структура: хелиум, неон, аргон, криптон, ксенон и радон. Најчесто, хемиските супстанции не се состојат од изолирани атоми, туку од нивни комбинации во различни групи. Таквите асоцијации на атоми може да брои неколку, стотици, илјадници или дури и повеќе атоми. Силата што ги држи овие атоми во такви групи се нарекува хемиска врска.
Со други зборови, можеме да кажеме дека хемиската врска е интеракција која обезбедува поврзување на поединечни атоми во посложени структури (молекули, јони, радикали, кристали итн.).
Причина за формирање хемиска врскае дека енергијата на посложените структури е помала од вкупната енергија на поединечните атоми што ја формираат.
Значи, особено, ако интеракцијата на атомите X и Y произведува молекула XY, тоа значи дека внатрешната енергија на молекулите на оваа супстанција е помала од внатрешната енергија на поединечните атоми од кои е формирана:
E(XY)< E(X) + E(Y)
Поради оваа причина, кога се формираат хемиски врски помеѓу поединечни атоми, се ослободува енергија.
Електроните на надворешниот електронски слој со најмала енергија на врзување со јадрото, наречени валентност. На пример, во бор ова се електрони 2 ниво на енергија– 2 електрони за 2 s-орбитали и 1 на 2 стр-орбитали:
Кога се формира хемиска врска, секој атом има тенденција да ја добие електронската конфигурација на атоми на благороден гас, т.е. така што во неговиот надворешен електронски слој има 8 електрони (2 за елементи од првиот период). Овој феномен се нарекува октет правило.
Можно е атомите да постигнат електронска конфигурација на благороден гас ако првично единечни атоми делат дел од нивните валентни електрони со други атоми. Во овој случај, се формираат заеднички електронски парови.
Во зависност од степенот на споделување на електрони, може да се разликуваат ковалентни, јонски и метални врски.
Ковалентна врска
Ковалентните врски најчесто се јавуваат помеѓу атоми на неметални елементи. Ако неметалните атоми кои формираат ковалентна врска припаѓаат на различни хемиски елементи, таквата врска се нарекува поларна ковалентна врска. Причината за ова име лежи во фактот што атомите различни елементиТие исто така имаат различни способности да привлечат заеднички електронски пар. Очигледно, ова доведува до поместување на заедничкиот електронски пар кон еден од атомите, како резултат на што на него се формира делумно негативен полнеж. За возврат, на другиот атом се формира делумно позитивен полнеж. На пример, во молекула на водород хлорид, електронскиот пар се префрла од атомот на водород во атомот на хлор:
Примери на супстанции со поларни ковалентни врски:
CCl 4, H 2 S, CO 2, NH 3, SiO 2, итн.
Ковалентна неполарна врска се формира помеѓу атоми на неметал од истиот хемиски елемент. Бидејќи атомите се идентични, нивната способност да привлекуваат заеднички електрони е исто така иста. Во овој поглед, не се забележува поместување на електронскиот пар:
Погоре опишаниот механизам на формирање ковалентна врскаКога двата атома обезбедуваат електрони за да формираат заеднички електронски парови, тоа се нарекува разменето.
Постои и механизам за донатор-акцептор.
Кога ковалентна врска се формира од механизмот донор-акцептор, се формира заеднички електронски пар поради исполнетата орбитала на еден атом (со два електрони) и празната орбитала на друг атом. Атомот кој обезбедува осамен пар електрони се нарекува донатор, а атомот со празна орбитала се нарекува акцептор. Атомите кои имаат спарени електрони, на пример N, O, P, S, дејствуваат како донатори на електронски парови.
На пример, според механизмот на донор-акцептор, формирање на четвртиот ковалентен N-H врскиво амониумскиот катјон NH 4 +:
Покрај поларитетот, ковалентните врски се карактеризираат и со енергија. Енергијата на врската е минималната енергија потребна за прекинување на врската помеѓу атомите.
Енергијата на врзување се намалува со зголемување на радиусите на врзаните атоми. Бидејќи знаеме дека атомските радиуси се зголемуваат по подгрупите, можеме, на пример, да заклучиме дека јачината на халогено-водородната врска се зголемува во серијата:
Здраво< HBr < HCl < HF
Исто така, енергијата на врската зависи од нејзината мноштво - колку е поголема мноштвото на врската, толку е поголема нејзината енергија. Множеството на врската се однесува на бројот на споделени електронски парови помеѓу два атома.
Јонска врска
Јонската врска може да се смета како екстремен случај на поларна ковалентна врска. Ако во ковалентно-поларна врска заедничкиот електронски пар е делумно поместен на еден од парот атомите, тогаш во јонска врска тој е речиси целосно „даден“ на еден од атомите. Атомот што донира електрони (и) добива позитивен полнеж и станува катјон, а атомот што зел електрони од него добива негативен полнеж и станува анјон.
Така, јонска врскае врска формирана поради електростатско привлекување на катјоните кон анјоните.
Формирањето на овој тип на врска е типично при интеракција на атомите на типични метали и типични неметали.
На пример, калиум флуорид. Калиумскиот катјон се формира со отстранување на еден електрон од неутрален атом, а флуорниот јон се формира со додавање на еден електрон во атомот на флуор:

Помеѓу добиените јони се јавува електростатска привлечна сила, што резултира со формирање на јонско соединение.
Кога се формирала хемиска врска, електроните од атомот на натриум преминале во атомот на хлор и се формирале спротивно наелектризирани јони, кои имаат завршено надворешно енергетско ниво.
Утврдено е дека електроните од металниот атом не се целосно одвоени, туку само се поместуваат кон атомот на хлор, како во ковалентна врска.
Повеќето бинарни соединенија кои содржат метални атоми се јонски. На пример, оксиди, халиди, сулфиди, нитриди.
Јонското поврзување се јавува и помеѓу едноставни катјони и едноставни анјони (F −, Cl −, S 2-), како и помеѓу едноставни катјони и сложени анјони (NO 3 −, SO 4 2-, PO 4 3-, OH −). Затоа, јонските соединенија вклучуваат соли и бази (Na 2 SO 4, Cu(NO 3) 2, (NH 4) 2 SO 4), Ca(OH) 2, NaOH)
Метална врска
Овој тип на врска се формира кај металите.
Атомите на сите метали имаат електрони во нивниот надворешен електронски слој кои имаат мала енергија на врзување со јадрото на атомот. За повеќето метали, процесот на губење на надворешните електрони е енергетски поволен.
Поради таквата слаба интеракција со јадрото, овие електрони во металите се многу подвижни и следниот процес континуирано се случува во секој метален кристал:
М 0 — ne − = M n + ,
каде M 0 е неутрален метален атом, а M n + катјон од истиот метал. Сликата подолу дава илустрација за процесите што се случуваат.
Односно, електроните „брзаат“ низ метален кристал, се одвојуваат од еден метален атом, формирајќи катјон од него, спојувајќи се со друг катјон, формирајќи неутрален атом. Овој феномен беше наречен „електронски ветер“, а собирањето на слободни електрони во кристал на неметален атом беше наречено „електронски гас“. Овој тип на интеракција помеѓу металните атоми се нарекува метална врска.
Водородна врска
Ако водороден атом во супстанција е поврзан со елемент со висока електронегативност (азот, кислород или флуор), таа супстанција се карактеризира со феномен наречен водородно поврзување.
Бидејќи водородниот атом е поврзан со електронегативен атом, на атомот на водород се формира делумно позитивно полнење, а на атомот на електронегативниот елемент се формира делумно негативен полнеж. Во овој поглед, електростатското привлекување станува возможно помеѓу делумно позитивно наелектризираниот водороден атом на една молекула и електронегативен атом на друга. На пример, водородната врска е забележана за молекулите на водата:
Водородната врска е таа што ја објаснува ненормално високата точка на топење на водата. Покрај водата, силни водородни врски се формираат и во супстанции како што се водород флуорид, амонијак, оксигенирани киселини, феноли, алкохоли, амини.
1. Просторна ориентација. Ако електронските облаци се преклопуваат во насока на линијата што ги поврзува јадрата на атомите, таквата врска се нарекува s-обврзница(s–s се преклопуваат H2, р–рCl2, s–рHC1).
Кога p-орбиталите насочени нормално на оската на врската се преклопуваат, се формираат два преклопувачки региони на двете страни на оската на врската. Оваа ковалентна врска се нарекува р-врска. На пример, во молекула на азот, атомите се поврзани со една s-врска и две p-врски.
Насоката на комуникација одредува просторна структурамолекули, односно нивната форма и се карактеризира со присуство на строго дефиниран агол помеѓу врските. На пример, аголот помеѓу s-врските во молекулата на водата е 104,5°.

2. Поларитет на комуникацијасе одредува со асиметријата во распределбата на вкупниот електронски облак по оската на врската.
Ако заедничките електронски парови се наоѓаат симетрично во однос на двете јадра, тогаш таквата ковалентна врска се нарекува неполарна.
Ако заедничките електронски парови се префрлат на еден од атомите (поредени асиметрично во однос на јадрата различни атоми), тогаш таквата ковалентна врска се нарекува поларна.
Во случај кога електронски пар се поместува кон поелектронегативен атом, центрите на (+) и (–) полнежи не се совпаѓаат, а системот (електричен дипол) произлегува од два полнежи еднакви по големина, но спротивставени по знак, растојанието меѓу кои е ( л) се нарекува должина на дипол. Мерката на молекуларниот поларитет е електричен диполен момент m, еднаков на производот на апсолутната вредност на електронскиот полнеж
(q = 1,6 × 10 -19 C) по должина на дипол л:
m = q× л.
Единицата m е debye D, 1 D = 3,33×10 –30 C×m.
Вежбајте.Должината на диполот на молекулата на HCl е 2,2 × 10 –9 cm Пресметај го електричниот момент на диполот.
2,2×10 –9 cm = 2,2×10 –11 m
m = 1,6 × 10 –19 × 2,2 × 10 –11 = 3,52 × 10 –30 Kl×m = 3,52 × 10 –30 / 3,33 × 10 –30 = 1,06 Д.
3. МноштвоКовалентната врска се одредува според бројот на споделени електронски парови што ги поврзуваат атомите. Врската помеѓу два атома со помош на еден пар електрони се нарекува едноставно(врски H – C1, C – H, H – O итн.). Сврзувањето со помош на два електронски парови се нарекува двојно(етилен H 2 C = CH 2) , користејќи три електронски парови - тројно(азот N N, ацетилен N – C C – H).
4.Должина на врскатае рамнотежното растојание помеѓу атомските јадра. Должината на врската се изразува во нанометри (nm). 1 nm = 10 –9 m Колку е пократка должината на врската, толку е посилна хемиската врска.
5. Комуникациска енергијаеднаква на работата потребна за прекин на врската. Изразете ја енергијата на врзување во килоџули по мол (kJ/mol). Енергијата на врската се зголемува со намалување на должината на врската и со зголемување на мноштвото на врската. Процесот на формирање на врски се јавува со ослободување на енергија (егзотермичен процес),а процесот на раскинување на врската вклучува апсорпција на енергија (ендотермичен процес).
Хибридизација
Хибридизација– порамнување на орбиталите по форма и енергија.
Сп хибридизација
Да го разгледаме примерот на берилиум хидрид BeH 2. Електронската структура на атомот Be во нормална состојба е 1s 2 2s 2. Атомот на берилиум може да комуницира со атоми на водород само во возбудена состојба (s ® p-транзиција).
Be – 1s 2 2s 1 2p 1

Двете формирани врски мора да бидат различни по енергија, бидејќи формирањето на едната е поврзано со преклопување на две s-орбитали, втората
рој – s- и p-орбитали. Тогаш атомите на водород во молекулата мора да бидат хемиски нееднакви: едниот е помобилен и пореактивен од другиот. Експериментално, тоа не е случај - двата атоми на водород се енергетски еквивалентни. За да ја објасни оваа појава, Ј.К. Слејтер и Л. Полинг сугерираат дека „при интерпретација и пресметување на аглите и должината на врските, препорачливо е врските што се блиски по енергија да се заменат со еднаков број енергетски еквивалентни врски“. Врските што се појавуваат на овој начин се хибридни.
Така, една s- и една p-орбитала на атомот на берилиум се заменуваат со две енергетски еквивалентни sp-орбитали лоцирани под агол од 180 o една до друга, т.е. молекулата има линеарна структура.

sp 2 хибридизација
Да го разгледаме примерот на молекулата на бор хидрид BH 3. Електронската структура на атомот на бор во нормална состојба е B – 1s 2 2s 2 2p 1. Може да формира само една ковалентна врска. Три ковалентни врски за атомот на бор се карактеристични само во возбудена состојба B* – 1s 2 2s 1 2p 2

Една врска, формирана со преклопување на две s-орбитали на атомите B и H, енергетски не се разликува од другите две, формирани со преклопување на s- и p-орбитали. Три sp 2 -хибридни орбитали лоцирани под агол од 120 o една до друга, молекулата има рамна структура. Слична слика е типична за сите тетраатомски молекули формирани од три sp 2 хибридни врски, на пример, бор хлорид (BCl 3).

sp 3 хибридизација
Да го погледнеме примерот на метанот CH4. Во нормална состојба, јаглеродниот атом со електронска структура 1s 2 2s 2 2p 2 може да произведе само две ковалентни врски. Во возбудена состојба, може да биде четиривалентен со електронската структура 1s 2 2s 1 2p 3.

Една s- и три p-орбитали од јаглеродниот атом стануваат хибридни и се формираат четири sp 3-хибридни, енергетски еквивалентни орбитали. Молекулата на метанот добива тетраедрална структура. Во центарот на тетраедарот, чиишто темиња се геометриски еквивалентни, има јаглероден атом, а на неговите темиња има атоми на водород. Аголот помеѓу врските е 109°28¢.

Силите на интеракција помеѓу молекулите се нарекуваат ван дер Валс или интермолекуларни. Оваа интеракција е предизвикана од електростатско привлекување помеѓу поединечни молекули и се карактеризира со следниве карактеристики:
Дејствува на релативно долги растојанија, значително надминувајќи ја големината на самите молекули;
Се карактеризира со ниска енергија, затоа значително слабее со зголемување на температурата;
Тој е незаситен, односно интеракцијата на дадена молекула со втора не исклучува сличен ефект во однос на третата, четвртата итн.
Со зголемувањето на релативна моларни масисилите на интермолекуларната интеракција се зголемуваат и, како резултат на тоа, се зголемуваат точките на топење и вриење на супстанциите.
Вежбајте. Пресметајте ја разликата во електронегативноста на атомите ΔEO за врските O–H и O–Mg во соединението Mg(OH) 2 и определете која од овие врски е пополарна. EO(H) = 2,1 eV, EO(O) = 3,5 eV, EO(Mg) = 1,2 eV.
Решение:
ΔEO(O–H) = 3,5 – 2,1 = 1,4; ΔEO(O–Mg) = 3,5 – 1,2 = 2,3.
Така, врската Mg-O е пополарна.
Кога соединенијата се формираат од елементи кои се многу различни по електронегативност (типични метали и типични неметали), заедничките електронски парови целосно се префрлаат на поелектронегативниот атом. На пример, кога натриумот согорува во хлор, неспарениот 3s електрон на атомот на натриум е спарен со електронот 3p од атомот на хлор. Споделениот електронски пар е целосно префрлен во атомот на хлор (Δχ(Cl) = 2,83 eV, Δχ(Cl) = 0,93 eV). За да се појави јонска врска потребно е:
1. Присуство на атом со јасно изразена тенденција да се откаже од електрон за да се формира позитивно наелектризиран јон (катјон), т.е. со ниска EI. Потенцијалот за јонизација е енергијата што мора да се потроши за да се отстрани 1 електрон од надворешната орбитала. Колку е помал потенцијалот за јонизација, толку полесно атомот губи електрони, толку е поизразен елементот метални својства. Потенцијалот за јонизација се зголемува во период од лево кон десно и се намалува од врвот до дното.
Процесот на губење на електрони се нарекува оксидација.
2. Присуство на атом со јасно изразена тенденција за додавање на електрон за формирање негативно наелектризирани јони (анјони), т.е. со голема СЕ. Процесот на додавање електрони се нарекува редукција.
Cl + e ® Cl -
Типичните јонски соединенија се формираат со комбинирање на метални атоми од главните подгрупи на групите I и II со атоми на неметални од главната подгрупа од групата VII (NaCl, KF, CaCl 2).
Не постои остра граница помеѓу јонските и ковалентните врски. Во гасната фаза, супстанциите се карактеризираат со чисто ковалентни поларни врски, но истите супстанции во цврста состојба се карактеризираат со јонски врски.
Должина на ковалентна врскаго нарекуваат растојанието помеѓу јадрата на атомите кои формираат врска. Должината на врската е директно поврзана со радиусот на атомот - колку е поголема, толку е подолга врската.
Вредности на ковалентни радиуси на некои атоми (pm; 10 -12 m):
- H = 30 часот;
- F = 58;
- О=73;
- N = 75;
- C = 77;
- Cl = 99;
- S = 103;
- P = 110;
- Si = 118;
- Ал = 130.
Во симетрични молекули (H 2, F 2, Cl 2 ...) половина од должината на врската се нарекува ковалентен радиус. Знаејќи го ковалентниот радиус, многу е лесно да се пресмета должината на ковалентната врска во молекулата. На пример, должината на ковалентната врска на молекулата HF = 30 + 58 = 88 pm.
2. Енергија на ковалентна врска
Под енергија на ковалентна врска(изразено во kcal/mol или kJ/mol) обично се однесува на енергијата што е неопходна за раскинување на врската (кога се формира ковалентна врска, енергијата се ослободува, а кога се скрши, се апсорбира). Колку е поголема енергијата на врзувањето, толку е посилна врската.
Енергијата на врската зависи од нејзината должина - колку е подолга врската во молекулата, толку е полесно да се прекине (троши помалку енергија).
Енергии на врзување на некои молекули (kJ/mol):
- H2 = 453 (должина на обврзницата = 60 pm);
- Cl 2 = 242 (198 часот);
- HCl = 431 (129 часот).
3. Поларитет на ковалентна врска
Оваа карактеристика ја прикажува локацијата на електронскиот пар од два атома што формираат врска. Степенот на поларитет на врската зависи од електронегативноста на атомите што ја формираат врската (колку е поголема, толку е поголем поларитетот на врската). Пополарна ковалентна врска има заеднички пар на електрони поместени повеќе кон поелектронегативниот атом (види концепт на електронегативност).
Електронегативноста е табеларна вредност одредена со помош на Полинг скалата. Многу е поважно да не се знае електронегативноста на самиот атом, туку разликата помеѓу овие вредности во молекулата - кој од атомите е повеќе електронегативен, а кој е помал.
Поларитетот на ковалентна врска се квантифицира со користење диполен момент(µ), додека се нарекува систем од два еквивалентни, но спротивни по знак, полнежи дипол.
Многу е важно да се направи разлика помеѓу диполниот момент на ковалентна врска (нејзиниот поларитет) и диполниот момент на молекулата како целина. Кај едноставните диатомски молекули овие два параметри се еднакви. Сосема поинаква слика е забележана кај сложените молекули, во кои диполниот момент на молекулата е збир на вектори на диполни моменти на поединечни врски.
4. Поларизираност на ковалентни врски
Поларизираноста го одразува степенот до кој електроните се способни да се поместат под влијание на надворешни електрично полеформирана од јони или други поларни молекули.
Поларизираноста на ковалентна врска е директно пропорционална со нејзината должина, што, генерално, е логично - колку електронот е подалеку од јадрото на атомот, толку послаб е привлечен од него, и затоа е полесно да се помести кога изложени на надворешни влијанија. Така, како што се зголемува должината на врската, се зголемува нејзината поларизација, што, пак, доведува до зголемување на јачината на киселините (на пример, јодната киселина е посилна од флуороводородната киселина).
Поларизираноста и поларитетот на врската се инверзно зависни величини: помалку поларна врска е повеќе поларизирана, и обратно.
5. Заситеност на ковалентни врски
Заситеноста е способност на атомот да формира одреден број ковалентни врски - сите „неспарени“ електрони на атомот имаат тенденција да учествуваат во формирањето на врската. На пример, атом на водород има само еден неспарен електрон, додека атом на азот има три. Поради оваа причина, најодржлив хемиско соединениеќе биде NH 3, но не NH или NH 2.
6. Насока на ковалентна врска
Насоченоста ја карактеризира просторната ориентација на ковалентна врска во однос на другите врски на молекулата. Во молекулите, електроните на ковалентни врски и слободните парови електрони постојано доживуваат меѓусебна одбивност, како резултат на што ковалентните врски се наредени така што аголот на врската меѓу нив одговара на принципот на најмала одбивност помеѓу електроните (на пример, во молекулата на водата аголот на врската е 104,5°).
7. Мноштво на ковалентни врски
Во некои случаи, не еден, туку два (двојна врска) или три (тројна врска) споделени електронски парови (т.н. повеќекратни врски) може да се појават помеѓу атомите.
Двојна ковалентна врска е формирана од атоми кои имаат два неспарени електрони; тројно - за атоми со три неспарени електрони (види Повеќекратни врски).
Како што може да се види од табелата подолу, молекулата на азот е приближно 7 пати „посилна“ од молекулата на флуор.
Табела на зависноста на должината и јачината на ковалентна врска од нејзината мноштво.
Ковалентната врска се изведува со заеднички валентни електрони кои ги делат два соседни атоми сврзувачка орбитала(види дел 2.2.1). Покрај тоа, во случај на елементарни супстанции, секој од атомите „донира“ ист број на валентни електрони на врската и ја комплетира својата валентна обвивка додека не се пополни целосно поради сврзувачките електрони на најблиските соседни атоми во решетката. Со овој имот сатурацијаСе запознавме со ковалентни врски користејќи го примерот на молекулата на водород. Нејзината последица е правилото воспоставено од Хјум-Ротери. Според него, за кристали на елементарни супстанци во кои е реализирана претежно ковалентна врска, меѓу координативниот број важи следниот однос Здо и бројот на групата Н, каде што се наоѓа овој елемент:
З k = 8 − Н. Структурата на елементарните полупроводници (доминантната врска е ковалентна) се одредува со ова едноставно емпириско правило и насоката на ковалентната врска.
Насоката на ковалентната врска се определува со дистрибуцијата на густината на електроните во кристалот, која може да се одреди користејќи, на пример, податоци од Х-зраци. Тие укажуваат дека во кристалите со ковалентни врски густината на електроните на валентните електрони е значително нерамномерно распоредена во вселената. Во насоките кои се најкратки за два соседни атоми, густината на електроните е поголема отколку во другите насоки. Ова значи дека валентните електрони се, како да се, локализирани во просторот и формираат „електронски мостови“, односно ковалентната врска има изразена насочен карактер. Природата на дистрибуцијата на густината на електроните за време на формирањето на ковалентна врска зависи од специфичноста електронска структураатоми во интеракција.
Бидејќи ковалентна хемиска врска, за разлика од другите видови хемиски врски, има локализирана природа, таа се определува не само од енергијата на врската, туку има и геометриски карактеристики. Геометриските карактеристики на ковалентна врска се нејзината должина и аглите помеѓу врските во молекулата или кристалот. Ковалентна должина
хемиска врскае растојанието помеѓу јадрата на атомите обединети со ковалентна врска во кристал. Тоа зависи од големината на атомите во интеракција и степенот на преклопување на нивните електронски облаци. Должината на врската и аглите помеѓу врските се определуваат експериментално со помош на молекуларна спектроскопија, дифракција на Х-зраци и други методи.
Да го разгледаме насоченото својство на ковалентна врска користејќи го примерот за формирање на хемиска врска во дијамантот.9 Во овој случај, ќе се водиме од правилата што ја сочинуваат содржината на теоријата за насочени валентности.
1. Ковалентна единечна врска се формира со интеракција на два електрони со спротивни спинови кои припаѓаат на различни атоми.
2. Насоката на ковалентната врска мора да одговара на насоката во која орбиталите на даден валентен електрон максимално се преклопуваат со орбиталите на друг валентен електрон спарен со него, кој припаѓа на соседен атом.
Треба да се има на ум дека во некои случаи обликот на орбиталите на валентните електрони вклучени во формирањето на врската малку се менува, а во некои случаи нагло се менува. Во вториот случај, мешани, т.н хибридни орбитали.
Во дијамантот, кој се состои од јаглеродни атоми, како што е познато, се реализира ковалентна хемиска врска. Електронска конфигурација на валентната обвивка на јаглеродниот атом во невозбудена состојба - 2 с 22стр 2. На 1 с-орбитали и 2 с-орбиталите содржат два спарени електрони чии спинови се антипаралелни. Валентноста излегува дека е две 2 стр-орбитали во кои се наоѓа еден електрон кој може да учествува во формирањето на хемиска врска. Овие 2 стр-орбитали
формираат агол од 90◦ меѓу себе. Така, јаглеродот во неговите соединенија мора да биде двовалентен и да формира врски меѓу кои има прав агол.
Сепак, како што покажуваат експерименталните податоци, во повеќето негови соединенија јаглеродот е четиривалентен и сите четири јаглеродни врски се подеднакво силни и имаат иста ориентација меѓу себе.
пријател: аголот помеѓу врските е 109◦28∗. Оваа околност се објаснува со хибридизацијата на орбиталите, која се јавува во две фази. Прво, јаглеродниот атом преминува од основната состојба во возбудена, во која еден од електроните со пополнета 2 с 2-орбитали оди до
9 Ковалентната врска во молекулата на водород нема својство на насоченост поради сферично симетричната распределба на густината на електроните во с-се наведува.

Ориз. 2.10. Шема за хибридизација сИ стр-електронски облаци и просторна ориентација сп 3-хибриди.
празен 2 стр-орбитална. Следно, четирите бранови функции се „мешаат“ и се формираат четири нови идентични бранови функции, кои не се ниту една од друга. с-, ниту едно стр-функции. Овие се хибридни сп 3-функции. Тие се еквивалентни и имаат ориентација прикажана на сл. 2.10. Така, во добиената состојба, јаглеродниот атом во дијамантот има четири неспарени електрони. Насоките на максималната густина на облаците за размена, како што може да се види од сл. 2.12, концентрирана долж просторните дијагонали на коцката<111>. Се формира атом со четири соседи редовен тетраедар, а од збир на тетраедри се гради „бесконечна ковалентна молекула“.
Јачината на хемиската врска зависи од степенот на преклопување на орбиталите на валентните електрони: колку е поголемо преклопувањето, толку е посилна врската. Пресметките покажуваат дека преклопувањето на електронските обвивки на поврзувачките атоми во случај на хибрид спИма значително повеќе 3-орбитали отколку во случајот со нехибридните сИ стр-орбитали. Иако хибридизираните состојби одговараат на поголема енергија на електроните во атомот од нехибридизираните состојби, сепак, вкупната енергија на кристалот се покажува помала во случај на формирање на врска од сп 3-хибриди, поради што хибридизацијата се покажува како енергетски поволна.
Може да учествува во формирањето на ковалентни врски с-, стр-, гИ ѓ-орбитали. Ако хибридизацијата се случи за време на формирањето на врската, тогаш во зависност од тоа колку и кои орбити се хибридизирани, тие разликуваат сп-, сп 2-, dsp 2-, сп 3i г 2сп 3-хибридни орбитали (сл. 2.11).
Така, структурата на ковалентните кристали е одредена со правилото Хјум-Ротери, кое го дава бројот на најблиските соседи неопходни за целосна заситеност на хемиската врска и насоката на хемиската врска, која може да се утврди од анализата на бранот. функции

Ориз. 2.11. Просторна ориентација сп-, сп 2 -, dsp 2 -, сп 3 и г 2 сп 3-хибридни орбитали.
лента електрони или експериментално. Карактеристичната вредност на енергијата на ковалентна врска е од редот на 5-7 eV. Кај полупроводничките материјали, може да се забележат следните општи обрасци во промената на својствата со промените во енергијата на врзувањето. Како што се зголемува енергијата на врзувањето помеѓу атомите, периодот се намалува кристална решетка, температурата на топење и јазот на лентата се зголемуваат.
Најкарактеристичните својства на едноставните кристали, во кои доминантно е реализиран еден од четирите видови хемиски врски, се дадени во Табела. 2.2.
Табела 2.2. Својства на четирите групи цврсти материи, кои се разликуваат по видовите меѓуатомски врски.
Вид на меѓуатомска врска
Карактеристики и енергија на врзување
Ненасочена и незаситена, силна врска; 5-7 eV по јонски пар.
Режија
и богата, силна врска; 5-7 eV по атом.
Ненасочена и незаситена комуникација; во близина
3,5 eV по атом.
Ненасочено и незаситено, слабо, кратко дејство
поврзување; ≈0,1 eV на
Јонски ковалентен метал Ван дер Валс
Структурни својства
Големите анјони формираат густо набиени структури, во чии празнини се наоѓаат катјоните ( З k = 8, 6, 4 и 3).
Структури со лабава решетка за пакување (на пример, З k = 4) и мала густина.
З k = 12 и 8) и висока густина.
Компактен кристални структурисо најтесно пакување ( З k = 12) и висока густина.
Термички својства
Доста високи точки на топење. Низок коефициент на проширување.
Високи температури на топење. Низок коефициент на проширување.
Различни температури на топење.
Ниски точки на топење. Висок коефициент на експанзија.
Електрични својства
Изолатори. Спроводливоста е главно јонска по природа и се зголемува со зголемување на температурата.
Електронски тип на спроводливост (два типа носачи). Зависност од активирање на спроводливоста од температурата.
Диригенти. Главниот тип на спроводливост е електронски. Спроводливоста се намалува со зголемување на температурата.
Изолатори.
Оптички својства
Транспарентно на електромагнетно зрачењеод ниски фреквенции до работ на апсорпција. Обично транспарентен во видливиот регион на спектарот.
Транспарентен на електромагнетното зрачење од ниските фреквенции до работ на апсорпција.
Непроѕирни на електромагнетни бранови од најниските фреквенции до средно-ултравиолетовиот регион; добро ја рефлектираат светлината.
Транспарентен на електромагнетното зрачење од ниските фреквенции до далечниот ултравиолетовиот регион.
Јонски ковалентен метал Ван дер Валс
Структура на зоната
зоната е одвоена
од следниот празен проводен опсег до широк пропуст ( На пр> 2-3 eV).
Целосно исполнета горна валентност
зоната е одвоена
од следната празна проводна лента до јазот на лентата На пр< 2–3 эВ.
Проводниот појас е делумно исполнет.
Целосно исполнета горна валентност
зоната е одвоена
од следната празна проводна лента до многу широк јаз.
Важни квантитативни карактеристики на ковалентна врска се врзувачка енергија, неа должинаИ диполен момент.
Комуникациска енергија- енергијата ослободена за време на нејзиното формирање, или неопходна за одвојување на два сврзани атоми. Енергијата на врската ја карактеризира нејзината сила.
Должина на врската– растојанието помеѓу центрите на врзаните атоми. Колку е пократка должината, толку е посилна хемиската врска.
Диполен моментврска (μ) - векторска големина што го карактеризира поларитетот на врската (мерено во деби Дили кулон метри: 1 Д= 3,4·10 -30 C m).
Должината на векторот е еднаква на производот од должината на врската л
до ефективно полнење q
, кои атоми ги добиваат кога густината на електроните се поместува: | μ | = л · q
.Векторот на диполен момент е насочен од позитивниот полнеж кон негативниот. Со векторско собирање на диполните моменти на сите врски се добива диполен момент на молекулата.
Карактеристиките на обврзниците се под влијание на нивната мноштво:

Ковалентна врска(атомска врска, хомеополарна врска) - хемиска врска формирана со преклопување (споделување) на пар валентни електронски облаци. Електронските облаци (електрони) кои обезбедуваат комуникација се нарекуваат споделен електронски пар.
Терминот ковалентна врска првпат беше воведен од лауреатот Нобелова наградаод Ирвинг Лангмуир во 1919 година. Терминот се однесува на хемиска врска поради заедничкото поседување на електрони, наспроти метална врска, во која електроните биле слободни или од јонска врска, во која еден од атомите се откажал од електрон и станал катјон, а другиот атом прифатил електрон и станал анјон.
Подоцна (1927), Ф. Лондон и В. Хајтлер, користејќи го примерот на молекула на водород, го дадоа првиот опис на ковалентна врска од гледна точка на квантната механика.
Земајќи ја предвид статистичката интерпретација на функцијата на брановите M. Born, густината на веројатноста за пронаоѓање на сврзувачките електрони е концентрирана во просторот помеѓу јадрата на молекулата (сл. 1). Теоријата за одбивање на електронски пар ги разгледува геометриските димензии на овие парови. Така, за елементите од секој период постои одреден просечен радиус на електронски пар (Å):
0,6 за елементи до неонски; 0,75 за елементи до аргон; 0,75 за елементи до криптон и 0,8 за елементи до ксенон.
Карактеристични својстваковалентна врска - насоченост, заситеност, поларитет, поларизација - одредуваат хемиски и физички својстваврски.
Се одредува насоката на поврзувањето молекуларна структурасупстанции и геометриска форманивните молекули. Аглите помеѓу две врски се нарекуваат агли на врска.
Заситеноста е способност на атомите да формираат ограничен број на ковалентни врски. Бројот на врски формирани од атомот е ограничен со бројот на неговите надворешни атомски орбитали.
Поларитетот на врската се должи на нерамномерната распределба на густината на електроните поради разликите во електронегативноста на атомите. Врз основа на ова, ковалентните врски се поделени на неполарни и поларни (неполарна - диатомската молекула се состои од идентични атоми (H 2, Cl 2, N 2) и електронските облаци на секој атом се распоредени симетрично во однос на овие атоми Поларна - диатомската молекула се состои од атоми на различни хемиски елементи, а вкупниот електронски облак се поместува кон еден од атомите, со што се формира асиметрија на дистрибуцијата Електрично полнењево молекулата, генерирајќи диполен момент на молекулата).
Поларизираноста на врската се изразува во поместувањето на електроните на врската под влијание на надворешно електрично поле, вклучувајќи го и она на друга честичка што реагира. Поларизираноста се одредува со подвижноста на електроните. Поларитетот и поларизираноста на ковалентните врски одредува реактивностмолекули во однос на поларните реагенси.
Сепак, двапати добитник на Нобеловата награда Л. Полинг истакна дека „во некои молекули има ковалентни врски поради еден или три електрони наместо заеднички пар“. Едноелектронска хемиска врска се реализира во молекуларниот водороден јон H 2 +.
Молекуларниот водороден јон H2+ содржи два протони и еден електрон. Единечниот електрон на молекуларниот систем го компензира електростатското одбивање на двата протони и ги држи на растојание од 1,06 Å (должината на хемиската врска H 2+). Центарот на електронската густина на електронскиот облак на молекуларниот систем е подеднакво оддалечен од двата протони во Боровиот радиус α 0 =0,53 Å и е центар на симетрија на молекуларниот водороден јон H 2 +.
9-прашање) Методи за формирање на ковалентна врска. Наведи примери.
Методи за формирање на ковалентна врска
Постојат два главни начини да се формира ковалентна врска*.
1) Електронски пар што формира врска може да се формира поради неспарени електрони присутни во невозбудени атоми.
Сепак, бројот на ковалентни врски може да биде повеќе бројнеспарени електрони. На пример, во невозбудена состојба (наречена и основна состојба), јаглеродниот атом има два неспарени електрони, но тој е карактеристичен за соединенијата во кои формира четири ковалентни врски. Излегува дека ова е можно како резултат на возбудувањето на атомот. Во овој случај, еден од s-електроните се преместува во p-поднивото:
Зголемувањето на бројот на создадени ковалентни врски е придружено со ослободување на повеќе енергија отколку што се троши за возбудување на атомот. Бидејќи валентноста на атомот зависи од бројот на неспарени електрони, побудувањето доведува до зголемување на валентноста. За атомите на азот, кислород и флуор, бројот на неспарени електрони не се зголемува, бидејќи во рамките на второто ниво нема слободни орбитали *, а движењето на електроните до третото квантно ниво бара значително повеќе енергија од онаа што би се ослободила при формирањето на дополнителни врски. Така, Кога атомот е возбуден, транзициите на електроните кон слободните орбитали се можни само во рамките на едно енергетско ниво.
Елементите од третиот период - фосфор, сулфур, хлор - можат да покажат валентност еднаква на бројот на групата. Ова се постигнува со возбудување на атомите со транзиција на 3s и 3p електрони во празни орбитали на 3d подниво:
P* 1s 2 2s 2 2p 6 3s 1 3p 3 3d 1(валентност 5)
S* 1s 2 2s 2 2p 6 3s 1 3p 3 3d 2(валентност 6)
Cl* 1s 2 2s 2 2p 6 3s 1 3p 3 3d 3(валентност 7)
Во горенаведените електронски формули * на возбудени атоми, поднивоата * што содржат само неспарени електрони се подвлечени. Користејќи го примерот на атом на хлор, лесно е да се покаже дека валентноста може да биде променлива:

За разлика од хлорот, валентноста на атомот F е константна и еднаква на 1, бидејќи На валентното (второ) енергетско ниво нема орбитали од d-подниво и други празни орбитали.
2) Ковалентните врски може да се формираат поради спарените електрони присутни во надворешниот електронски слој на атомот. Во овој случај, вториот атом мора да има слободна орбитала на надворешниот слој. На пример, формирањето на јон на амониум од молекула на амонијак и водороден јон може да се претстави со дијаграмот:

Атомот што го обезбедува својот електронски пар за да формира ковалентна врска * се нарекува донатор, а атомот што обезбедува празна орбитала се нарекува акцептор. Ковалентната врска формирана на овој начин се нарекува врска донаторски-акцептор. Во амониумскиот катјон, оваа врска е апсолутно идентична по своите својства со другите три ковалентни врски формирани со првиот метод, затоа терминот „донатор-акцептор“ не значи некој посебен вид на врска, туку само методот на неговото формирање.
10-прашање) Киселинско-базна интеракција - реакции на неутрализација. Кисели и основни соли. Наведи примери.
NaOH + HCl = NaCl + H2O - реакција на неутрализација
NaOH + H2SO4 = NaHSO4 + H2O - формирање на киселинска сол на натриум хидроген сулфат, киселинските соли можат да формираат други базни киселини, на пример H3PO4 може да формира 2 киселински соли NaH2PO4. Na2HPO4. -киселински соли- производ на нецелосна замена на водородни катјони во киселина.
Al(OH)3 + 3HCl = AlCl3 + 3H2O - средна сол
Al(OH)3 + 2HCl = Cl2 + 2H2O - алуминиум хидроксихлорид - основна сол
Al(OH)3 + HCl = Cl + H2O - алуминиум дихидроксихлорид
Основната сол е производ на нецелосна замена на хидроксилните групи на базата со анјоните на киселинскиот остаток.
Теории на киселини и бази- збир на основни физички и хемиски концепти кои ја опишуваат природата и својствата на киселините и базите. Сите тие воведуваат дефиниции за киселини и бази - две класи на супстанции кои реагираат една со друга. Задачата на теоријата е да ги предвиди производите од реакцијата помеѓу киселина и база и можноста за нејзино појавување, за што се користат квантитативни карактеристики на јачината на киселината и базата. Разликите меѓу теориите лежат во дефинициите на киселините и базите, карактеристиките на нивната сила и, како последица на тоа, во правилата за предвидување на производите на реакцијата меѓу нив. Сите тие имаат своја област на применливост, кои области делумно се преклопуваат.
Киселинско-базните интеракции се исклучително чести по природа и се широко користени во научните и производствена практика. Теоретските идеи за киселините и базите се важни во формирањето на сите концептуални системи на хемијата и имаат различно влијание врз развојот на многу теоретски концепти во сите главни хемиски дисциплини.
Врз основа модерна теоријакиселини и бази се развиени такви делови хемиски науки, како што се хемијата на водени и неводени раствори на електролити, pH-метрија во неводени медиуми, хомо- и хетерогена киселинско-базна катализа, теорија на функции на киселост и многу други.
11-прашање) Јонска врска, нејзините својства, наведи примери.
За разлика од ковалентна врска, јонската врска не е заситена.
Јачина на јонските врски.
Супстанциите со јонски врски во нивните молекули имаат тенденција да имаат повисоки точки на вриење и топење.
Јонска врска- многу силна хемиска врска формирана помеѓу атоми со голема разлика (> 1,5 на скалата на Полин) на електронегативност, во која заедничкиот електронски пар е целосно префрлен во атом со поголема електронегативност.Тоа е привлекување на јони како тела спротивно наелектризирани . Пример е соединението CsF, во кое „степенот на јоност“ е 97%. Ајде да го разгледаме методот на формирање користејќи натриум хлорид NaCl како пример. Електронска конфигурацијаАтомите на натриум и хлор може да се претстават како: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 3s2 3р5. Тоа се атоми со нецелосни нивоа на енергија. Очигледно, за да се комплетираат, полесно е атом на натриум да се откаже од еден електрон отколку да добие седум, а за атом на хлор е полесно да добие еден електрон отколку да се откаже од седум. На хемиска интеракцијаАтомот на натриум целосно се откажува од еден електрон, а атомот на хлор го прифаќа. Шематски, ова може да се запише на следниов начин: Na. - l e -> Na+ натриум јон, стабилна обвивка од осум електрони 1s2 2s2 2p6 поради второто енергетско ниво. :Cl + 1е --> .Cl - јон на хлор, стабилен осум електронска обвивка. Електростатските привлечни сили се јавуваат помеѓу јоните Na+ и Cl-, што резултира со формирање на соединение. Јонското поврзување е екстремен случај на поларизација на поларна ковалентна врска. Формирана помеѓу типичен метал и неметал. Во овој случај, електроните од металот целосно се пренесуваат на неметалот. Се формираат јони.
Ако се формира хемиска врска помеѓу атомите кои имаат многу голема разлика во електронегативноста (EO > 1,7 според Полинг), тогаш вкупниот електронски параполитет оди на атомот со поголем ЕО. Резултатот од ова е формирање на соединение од спротивно наелектризирани јони:
Помеѓу добиените јони се јавува електростатско привлекување, што се нарекува јонско поврзување. Или подобро кажано, овој изглед е удобен. Всушност, јонската врска помеѓу атомите во својата чиста форма не се реализира никаде или речиси никаде; обично, всушност, врската е делумно јонска и делумно ковалентна по природа. Во исто време, врската на сложени молекуларни јони често може да се смета за чисто јонска. Најважните разлики помеѓу јонските врски и другите видови хемиски врски се ненасочноста и незаситеноста. Затоа кристалите формирани поради јонските врски гравитираат кон различни густи пакувања на соодветните јони.
КарактеристикиТаквите соединенија имаат добра растворливост во поларни растворувачи (вода, киселини, итн.). Ова се случува поради наелектризираните делови на молекулата. Во овој случај, диполите на растворувачот се привлекуваат кон наелектризираните краеви на молекулата и, како резултат на тоа, Брауново движење, ја „раскине“ молекулата на супстанцијата на парчиња и ги опкружува, спречувајќи ги повторно да се поврзат. Резултатот е јони опкружени со диполи на растворувачи.
Кога таквите соединенија се раствораат, обично се ослободува енергија, бидејќи вкупната енергија формирани врскијонот на растворувачот е поголем од енергијата на врската анјон-катјон. Исклучоците вклучуваат многу соли азотна киселина(нитрати), кои апсорбираат топлина кога се раствораат (растворите се ладат). Последниот факт е објаснет врз основа на законите што се разгледуваат во физичката хемија.
примери: (MgS, K2CO3), бази (LiOH, Ca(OH)2), базни оксиди (BaO, Na2O)
тип на решетка - метал
12) Размена на реакции во раствори. Наведи примери.
Во пракса неповратни реакциирамнотежата е силно поместена кон формирање на реакциони продукти.
Често има процеси во кои слабите електролити или слабо растворливи соединенија се вклучени во почетните и финалните производи на реакцијата. На пример,
HCN(p) + CH 3 COO - (p)↔ CH 3 COOH (p) + CN - (p) (1), ΔG˚=43kJ
NH 4 OH (p) + H + (p) ↔ H 2 O (l) + NH 4 + (p) (2) ΔG˚= -84 kJ
Има слаби електролити и на левата и на десната страна на равенките.
Во овие случаи, рамнотежата на реверзибилниот процес се поместува кон формирање на супстанција со понизок Kdissoc.
Во реакцијата (1) рамнотежата е поместена налево K HCN = 4,9 10 -10< K CH 3 COOH = 1,8 · 10 -5 , в реакции (2) – сильно сдвинуто вправо (K H 2 O =1,8 · 10 -16 < K NH 4 OH = 1,8 · 10 -5).
Примери на процеси во равенката за реакција на која лево и десно влегуваат слабо растворливи материи, може да послужи:
AgCl(k)↓ + NaI(p) ↔ AgI↓(k) + NaCl(p) (1) ΔG˚= - 54 kJ
BaCO 3 ↓(k) + Na 2 SO 4 (p) ↔ BaSO 4 ↓ (k) + Na 2 CO 3 (p) (2) ΔG˚≈ 0
Рамнотежата се поместува кон формирање на помалку растворливо соединение. Во реакцијата (1) рамнотежата е поместена надесно, бидејќи PRAgI=1,1·10 -16< ПРAgCl =1,8·
10-10. Во реакцијата (2) рамнотежата е само малку поместена кон BaSO 4
(PR BaCO 3 = 4,9·10 -9 > PR BaSO 4 =1,08·10 -10).
Има процеси во чии равенки од едната страна од равенката има слабо растворливо соединение, а од другата страна слаб електролит. Така, рамнотежата во системот
AgCN(k)↓ + H + (p) ↔ HCN(p) + Ag + (p) ΔG˚= - 46 kJ
значително поместен надесно, бидејќи CN - јонот поцврсто се врзува во молекулата на многу слабиот електролит HCN отколку во молекулата на слабо растворливата супстанција AgCN. Затоа, талогот AgCN се раствора кога се додава азотна киселина.