Kwasy karboksylowe są kwasami organicznymi. Są częścią organizmów żywych i uczestniczą w metabolizmie. Właściwości chemiczne kwasy karboksylowe są spowodowane obecnością grupy karboksylowej -COOH. Należą do nich kwas octowy, mrówkowy, szczawiowy, masłowy i wiele innych kwasów.
ogólny opis
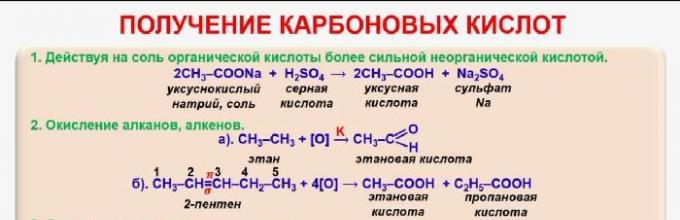
Istnieje kilka sposobów otrzymywania kwasów karboksylowych:
- utlenianie alkoholi - C 2 H 5 OH + O2 → CH 3 COOH + H 2 O (kwas octowy powstaje z etanolu);
- utlenianie aldehydów - CH 3 COH + [O] → CH 3 COOH;
- utlenianie butanu - 2C 4 H 10 + 5O 2 → 4CH 3 COOH + 2H 2 O;
- karbonylowanie alkoholu - CH 3 + CO → CH 3 COOH;
- rozkład kwasu szczawiowego w celu wytworzenia kwasu mrówkowego - C 2 H 2 O 4 → HCOOH + CO 2;
- oddziaływanie soli ze stężonym kwasem siarkowym - CH 3 COONa + H 2 SO 4 → CH 3 COOH + NaHSO 4.

Ryż. 1. Metody wytwarzania kwasów karboksylowych.
Właściwości fizyczne kwasów karboksylowych:
- temperatura wrzenia wyższa niż temperatura wrzenia odpowiednich węglowodorów i alkoholi;
- dobra rozpuszczalność w wodzie - rozpuszczają się w kationach wodoru i aniony reszty kwasowej (są słabymi elektrolitami);
- zwiększenie liczby atomów węgla zmniejsza siłę kwasów.
Kwasy karboksylowe mają silne wiązania wodorowe (silniejsze niż alkohole), co spowodowane jest dużym ładunkiem dodatnim na atomie wodoru w grupie karboksylowej.
Interakcja
Kwasy karboksylowe zmieniają kolor wskaźników. Lakmus i oranż metylowy zmieniają kolor na czerwony.

Ryż. 2. Interakcja ze wskaźnikami.
Na stole właściwości chemiczne kwasy karboksylowe opisuje oddziaływanie kwasów z innymi substancjami.
|
Reakcje |
Wynik |
Przykład |
|
Z metalami |
Uwalnia się wodór i tworzą się sole |
2CH 3 COOH + Mg → (CH 3 COO) 2 Mg + H 2 |
|
Z tlenkami |
Powstaje sól i woda |
2CH 3 COOH + ZnO → (CH 3 COO) 2 Zn + H 2 O |
|
Z uziemieniem (neutralizacja) |
Powstaje sól i woda |
CH 3 COOH + NaOH → CH 3 COONa + H 2 O |
|
Z węglanami |
Wydziela się dwutlenek węgla i woda |
2CH 3 COOH + CaCO 3 → (CH 3 COO) 2 Ca + H 2 O + CO 2 |
|
Z solami słabych kwasów |
Tworzy się kwas nieorganiczny |
2CH 3 COOH + Na 2 SiO 3 → 2CH 3 COONa + H 2 SiO 3 |
|
Z amoniakiem lub wodorotlenkiem amonu |
Tworzy się octan amonu. Podczas interakcji z wodorotlenkiem uwalniana jest woda |
CH 3 COOH + NH 3 → CH 3 COONH 4 CH 3 COOH + NH 4 OH → CH 3 COONH 4 + H 2 O |
|
Z alkoholami (estryfikacja) |
Tworzą się estry |
CH 3 COOH + C 2 H 5 OH → CH 3 COOC 2 H 5 + H 2 O |
|
Halogenowanie |
Tworzy się sól |
CH3COOH + Br2 → CH2BrCOOH |
Sole powstałe w wyniku oddziaływania substancji z kwasem mrówkowym nazywane są mrówczanami, a z kwasem octowym - octanami.
Dekarboksylacja
Usunięcie grupy karboksylowej nazywa się dekarboksylacją i zachodzi w następujących przypadkach:
- podczas ogrzewania soli w obecności stałych zasad z utworzeniem alkanów - RCONa ciało stałe + NaOH ciało stałe → RH + Na 2 CO 3;
- po podgrzaniu sole stałe- (CH 3 COO) 2 Ca → CH 3 -CO-CH 3 + CaCO 3;
- podczas kalcynacji kwasu benzoesowego - Ph-COOH → PhH + CO 2;
- podczas elektrolizy roztworów soli - 2RCOONa + H 2 O → R-R + 2CO 2 + 2NaOH.
Kwasy karboksylowe to związki zawierające grupę karboksylową:
Wyróżnia się kwasy karboksylowe:
- jednozasadowe kwasy karboksylowe;
- kwasy dwuzasadowe (dikarboksylowe) (2 grupy UNS).
W zależności od budowy wyróżnia się kwasy karboksylowe:
- alifatyczny;
- alicykliczny;
- aromatyczny.
Przykłady kwasów karboksylowych.


Wytwarzanie kwasów karboksylowych.
1. Utlenianie alkoholi pierwszorzędowych nadmanganianem potasu i dwuchromianem potasu:

2. Hydroliza węglowodorów podstawionych halogenem zawierających 3 atomy halogenu na atom węgla:
3. Wytwarzanie kwasów karboksylowych z cyjanków:
Po podgrzaniu nitryl hydrolizuje, tworząc octan amonu:
Po zakwaszeniu wytrąca się kwas:
4. Zastosowanie odczynników Grignarda:
5. Hydroliza estry:
6. Hydroliza bezwodników kwasowych:
7. Specyficzne metody otrzymywania kwasów karboksylowych:
Kwas mrówkowy wytwarza się przez ogrzewanie tlenku węgla (II) ze sproszkowanym wodorotlenkiem sodu pod ciśnieniem:
Kwas octowy wytwarza się w wyniku katalitycznego utleniania butanu tlenem atmosferycznym:
Kwas benzoesowy otrzymuje się przez utlenianie monopodstawionych homologów roztworem nadmanganianu potasu:
Reakcja Canniciaro. Benzaldehyd traktuje się 40-60% roztworem wodorotlenku sodu w temperaturze pokojowej.

Właściwości chemiczne kwasów karboksylowych.
W roztwór wodny kwasy karboksylowe dysocjują:

Równowaga jest mocno przesunięta w lewo, ponieważ kwasy karboksylowe są słabe.
Podstawniki wpływają na kwasowość poprzez efekt indukcyjny. Takie podstawniki przyciągają do siebie gęstość elektronów i następuje na nich ujemny efekt indukcyjny (-I). Wycofanie się gęstości elektronowej prowadzi do wzrostu kwasowości kwasu. Podstawniki będące donorami elektronów wytwarzają dodatni ładunek indukcyjny.

1. Tworzenie soli. Reakcja z tlenkami zasadowymi, solami słabych kwasów i metali aktywnych:

Kwasy karboksylowe są słabe, ponieważ kwasy mineralne wypierają je z odpowiednich soli:
2. Tworzenie funkcjonalnych pochodnych kwasów karboksylowych:
3. Estry podczas ogrzewania kwasu z alkoholem w obecności kwasu siarkowego - reakcja estryfikacji:
4. Tworzenie amidów, nitryli:
3. O właściwościach kwasów decyduje obecność rodnika węglowodorowego. Jeśli reakcja zachodzi w obecności czerwonego fosforu, powstaje następujący produkt:
4. Reakcja addycji.

8. Dekarboksylacja. Reakcję prowadzi się przez stopienie zasady z solą metal alkaliczny kwas karboksylowy:
9. Kwas dwuzasadowy można łatwo wyeliminować CO2 po podgrzaniu:
Dodatkowe materiały na ten temat: Kwasy karboksylowe.
Kalkulatory chemiczne |
|
| Chemia online na naszej stronie internetowej do rozwiązywania problemów i równań. | |
Utlenianie węglowodorów nasyconych tlenem na specjalnych katalizatorach do kwasów karboksylowych przeprowadza się przemysłowo, ale metoda ta nie różni się selektywnością. Zazwyczaj mieszaniny kwasów karboksylowych otrzymuje się, ponieważ utlenianie rozrywa różne wiązania węgiel-węgiel.
Utlenianie alkenów silnymi utleniaczami jest znacznie bardziej selektywne. Gdy alkeny, które mają jeden atom wodoru przy każdym atomie węgla wiązania podwójnego, ogrzewa się z alkalicznym roztworem nadmanganianu potasu, powstaje mieszanina dwóch kwasów karboksylowych. Jeśli alken jest symetryczny, powstają dwie cząsteczki jednego kwasu karboksylowego. To samo utlenianie można przeprowadzić przez ogrzewanie alkenów stężonym kwasem azotowym.
![]()
Podobnie, gdy alkiny utlenia się alkalicznym roztworem nadmanganianu potasu, otrzymuje się kwasy karboksylowe. Na przykład kwas octowy można otrzymać przez utlenienie 2-butenu lub 2-butyny.

Alkilobenzeny utlenia się do kwasu benzoesowego za pomocą tlenu na katalizatorach (w przemyśle) lub przez ogrzewanie nadmanganianem potasu. Na przykład gotowanie toluenu z wodnym roztworem nadmanganianu potasu, a następnie zakwaszanie roztworu prowadzi do kwasu benzoesowego.

Kwasy karboksylowe można również otrzymać przez utlenianie pierwszorzędowych alkoholi lub aldehydów. Jako utleniacze stosuje się zwykle związki chromu na najwyższym stopniu utlenienia, na przykład bezwodnik chromowy, nadmanganian potasu w środowisku zasadowym, stężony kwas azotowy. Aldehydy łatwo utleniają się za pomocą innych środków utleniających, na przykład amoniakalnego roztworu tlenku srebra (reakcja „srebrnego lustra”).

1.2. Synteza kwasów karboksylowych z pochodnych halogenowych
1.2.1.Synteza kwasów karboksylowych poprzez nitryle
Halogenki alkilowe reagują z cyjankiem sodu, tworząc cyjanki alkilowe, które są nitrylami kwasów karboksylowych. Te ostatnie ulegają hydrolizie w środowisku kwaśnym do kwasów karboksylowych.

W ten sposób następuje dwuetapowe zastąpienie atomu halogenu w cząsteczce pochodnej halogenu grupą karboksylową. Zatem, aby otrzymać kwas walerianowy (5 atomów węgla), należy zacząć od halogenku butylu.
Kwas 1-bromobutanonitrylowo-walerianowy
kwas walerianowy
1.2.2. Synteza kwasów karboksylowych w reakcji Grignarda
Odczynniki Grignarda, które wytwarza się z pochodnych halogenowych w reakcji z metalicznym magnezem, są odczynnikami nukleofilowymi. Dlatego do syntezy z nich kwasów karboksylowych wykorzystuje się reakcję karboksylacji za pomocą elektrofilowego dwutlenku węgla.
Aby otrzymać kwas benzoesowy tą metodą, jako wyjściową pochodną halogenową należy przyjąć np. bromobenzen, który w wyniku reakcji z magnezem, późniejszej reakcji bromku fenylomagnezu z dwutlenkiem węgla i końcowej hydrolizy soli magnezu przekształca się w kwas benzoesowy .
1.3. Hydroliza pochodnych kwasów karboksylowych
Podobnie jak nitryle i sole, których hydroliza została już omówiona, inne pochodne kwasów karboksylowych ulegają hydrolizie do kwasów karboksylowych. Reakcje mogą być katalizowane zarówno przez kwasy, jak i zasady. Na przykład hydroliza estru metylowego kwasu propionowego, katalizowana przez mocny kwas mineralny, daje kwas propanowy i metanol.
Po ogrzaniu acetanilidu (fenyloamidu kwasu octowego) z wodnym roztworem wodorotlenku sodu otrzymuje się octan sodu i anilinę.
Hydroliza cząsteczki bezwodnika benzoesowego powoduje utworzenie dwóch cząsteczek kwasu benzoesowego.

Kataliza i mechanizm hydrolizy zostaną omówione bardziej szczegółowo w rozdziałach poświęconych pochodnym kwasów karboksylowych
Wytwarzanie kwasów karboksylowych
I. W przemyśle
1. Wyizolowany z produktów naturalnych
(tłuszcze, woski, olejki eteryczne i roślinne)
2. Utlenianie alkanów:
2CH4 + + 3O2 t, kat→ 2HCOOH + 2H 2O
metan kwas mrówkowy
2CH 3 -CH 2 -CH 2 -CH 3 + 5O 2 t, kat, str→4CH3COOH + 2H2O
kwas n-butanooctowy
3. Utlenianie alkenów:
CH 2 = CH 2 + O 2 t, kat→CH3COOH
etylen
Z H3-CH=CH2 + 4[O] t, kat→ CH3COOH + HCOOH (kwas octowy + kwas mrówkowy )
4. Utlenianie homologów benzenu (produkcja kwasu benzoesowego):
C 6 H 5 -C n H 2n+1 + 3n[O] KMnO4,H+→ C 6H 5 -COOH + (n-1)CO 2 + nH 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 -COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
kwas toluenobenzoesowy
5.Otrzymywanie kwasu mrówkowego:
Scena 1: CO+NaOH T , P→HCOONa (mrówczan sodu – sól )
2 scena: HCOONa + H 2 SO 4 → HCOOH + NaHSO 4
6. Przygotowanie kwasu octowego:
CH3OH+CO t, s→CH3COOH
Metanol
II. W laboratorium
1. Hydroliza estrów:
2. Z soli kwasów karboksylowych :
R-COONa + HCl → R-COOH + NaCl
3. Rozpuszczanie bezwodników kwasów karboksylowych w wodzie:
(R-CO) 2O + H 2 O → 2 R-COOH
4. Hydroliza zasadowa halogenowych pochodnych kwasów karboksylowych:

III. Ogólne metody otrzymywania kwasów karboksylowych
1. Utlenianie aldehydów:
R-COOH + [O] → R-COOH
Na przykład reakcja „Silver Mirror” lub utlenianie wodorotlenkiem miedzi (II) - reakcje jakościowe aldehydy
2. Utlenianie alkoholi:
R-CH2-OH + 2[O] t, kat→ R-COOH + H 2 O
3. Hydroliza węglowodorów halogenowanych zawierających trzy atomy halogenu na atom węgla.

4. Z cyjanków (nitryli) - metoda pozwala zwiększyć łańcuch węglowy:
Z H3-Br + Na-C≡N → CH3-CN + NaBr
CH3-CN - cyjanek metylu (nitryl kwasu octowego)
Z H3-CN + 2H2O T→ CH 3 COONH 4
octan amon
CH 3 COONH 4 + HCl → CH 3 COOH + NH 4 Cl
5. Stosowanie odczynnik Grignarda
R-MgBr + CO 2 →R-COO-MgBr H2O→ R-COOH + Mg(OH)Br
ZASTOSOWANIE KWASÓW KARBOKSYLOWYCH
Kwas mrówkowy– w medycynie – alkohol mrówkowy (1,25% alkoholowy roztwór kwasu mrówkowego), w pszczelarstwie, w syntezie organicznej, przy produkcji rozpuszczalników i konserwantów; jako silny środek redukujący.
Kwas octowy– w przemyśle spożywczym i chemicznym (produkcja octanu celulozy, z którego uzyskuje się włókno octanowe, szkło organiczne, folię; do syntezy barwników, leków i estrów). W gospodarstwie domowym jako substancja aromatyzująca i konserwująca.
Kwas masłowy– do produkcji dodatków smakowych, plastyfikatorów i odczynników flotacyjnych.
Kwas szczawiowy– w przemyśle metalurgicznym (odkamienianie).
Stearynowy C17H35COOH i palmitynowy kwas C 15 H 31 COOH – jako środki powierzchniowo czynne, smary w obróbce metali.
Kwas oleinowy C 17 H 33 COOH to odczynnik flotacyjny i kolektor do wzbogacania rud metali nieżelaznych.
Indywidualni przedstawiciele
jednozasadowe nasycone kwasy karboksylowe
Kwas mrówkowy
został po raz pierwszy wyizolowany w XVII wieku z czerwonych mrówek leśnych. Występuje także w soku z pokrzywy. Bezwodny kwas mrówkowy to bezbarwna ciecz o ostrym zapachu i ostrym smaku, która powoduje oparzenia skóry. Stosowany jest w przemyśle tekstylnym jako zaprawa do barwienia tkanin, garbowania skór, a także do różnych syntez.
Kwas octowy
szeroko rozpowszechniony w przyrodzie - występuje w wydalinach zwierząt (mocz, żółć, kał), w roślinach (w zielonych liściach). Powstaje podczas fermentacji, gnicia, kwaśnienia wina, piwa, występuje w kwaśnym mleku i serze. Temperatura topnienia bezwodnego kwasu octowego wynosi +16,5°C, jego kryształy są przezroczyste jak lód, dlatego nazywany jest lodowatym kwasem octowym. Po raz pierwszy uzyskał go pod koniec XVIII wieku rosyjski naukowiec T. E. Lovitz. Naturalny ocet zawiera około 5% kwasu octowego. Przygotowuje się z niego esencję octową, używaną w Przemysł spożywczy do konserw warzywnych, grzybów, ryb. Kwas octowy jest szeroko stosowany w przemyśle chemicznym do różnych syntez.
Przedstawiciele aromatycznych i nienasyconych kwasów karboksylowych
Kwas benzoesowy
C 6 H 5 COOH jest najważniejszym przedstawicielem kwasów aromatycznych. Ukazuje się w przyrodzie w flora: w balsamach, kadzidłach, olejki eteryczne. W organizmach zwierzęcych występuje w produktach rozkładu substancji białkowych. Ten substancja krystaliczna, temperatura topnienia 122°C, łatwo sublimuje. Słabo rozpuszcza się w zimnej wodzie. Dobrze rozpuszcza się w alkoholu i eterze.
Nienasycone kwasy nienasycone z jednym podwójnym wiązaniem w cząsteczce mają ogólny wzór C n H 2 n -1 COOH.
Kwasy nienasycone o dużej masie cząsteczkowej
często wymieniane przez dietetyków (nazywają je nienasyconymi). Najczęstszym z nich jest oleinowy
CH 3 –(CH 2) 7 –CH=CH–(CH 2) 7 –COOH lub C 17H 33 COOH. Jest to bezbarwna ciecz, która twardnieje pod wpływem zimna.
Szczególnie ważne są kwasy wielonienasycone, posiadające kilka wiązań podwójnych: linolowy
CH 3 –(CH 2) 4 –(CH=CH–CH 2) 2 –(CH 2) 6 –COOH lub C 17 H 31 COOH z dwoma podwójnymi wiązaniami, linolenowy
CH 3 –CH 2 –(CH=CH–CH 2) 3 –(CH 2) 6 –COOH lub C 17 H 29 COOH z trzema podwójnymi wiązaniami i arachidonowy
CH 3 –(CH 2) 4 –(CH=CH–CH 2) 4 –(CH 2) 2 –COOH z czterema podwójnymi wiązaniami; często nazywane są niezbędnymi kwasami tłuszczowymi. To właśnie te kwasy mają największą aktywność biologiczną: biorą udział w przenoszeniu i metabolizmie cholesterolu, syntezie prostaglandyn i innych niezbędnych substancji oraz utrzymują strukturę błony komórkowe, są niezbędne do funkcjonowania aparatu wzrokowego i system nerwowy, wpływają na układ odpornościowy. Brak tych kwasów w żywności hamuje wzrost zwierząt, hamuje ich funkcje rozrodcze i powoduje różne choroby. Organizm ludzki nie jest w stanie sam syntetyzować kwasów linolowego i linolenowego i musi je otrzymywać w postaci gotowej z pożywieniem (np. witamin). Do syntezy kwasu arachidonowego w organizmie niezbędny jest kwas linolowy. Wielonienasycone kwasy tłuszczowe o 18 atomach węgla w postaci estrów glicerolu występują w tzw. olejach schnących – lnianym, konopnym, makowym itp. Kwas linolowy C17H31COOH i kwas linolenowy C 17 H 29 COOH wchodzą w skład olejów roślinnych. Na przykład olej lniany zawiera około 25% kwasu linolowego i do 58% kwasu linolenowego.
Kwas sorbinowy Kwas (2,4-heksadienowy) CH 3 –CH=CH–CH=CHCOOH otrzymano z jagód jarzębiny (łac. sorbus). Kwas ten jest doskonałym środkiem konserwującym, dzięki czemu jagody jarzębiny nie pleśnieją.
Najprostszy kwas nienasycony, akryl CH 2 = CHCOOH, ma ostry zapach (po łacinie acris - ostry, ostry). Do produkcji szkła organicznego wykorzystuje się akrylany (estry kwasu akrylowego), a nitryl (akrylonitryl) do produkcji włókien syntetycznych.
Nazywając nowo wyizolowane kwasy, chemicy często puszczają wodze wyobraźni. Zatem nazwa najbliższego homologu kwasu akrylowego, kroton
CH 3 – CH = CH – COOH, wcale nie pochodzi od kreta, ale od rośliny Kroton tiglium, z którego oleju został wyizolowany. Syntetyczny izomer kwasu krotonowego jest bardzo ważny - kwas metakrylowy CH 2 = C (CH 3) – COOH, z którego estru (metakrylanu metylu), a także z akrylanu metylu powstaje przezroczyste tworzywo sztuczne – plexi.
Węgiel nienasycony kwasy mają zdolność do reakcji addycji:
CH 2 = CH-COOH + H 2 → CH 3 -CH 2 -COOH
CH 2 = CH-COOH + Cl 2 → CH 2Cl -CHCl -COOH
WIDEO:
CH 2 = CH-COOH + HCl → CH 2Cl -CH 2 -COOH
CH 2 = CH-COOH + H 2 O → HO-CH 2 -CH 2 -COOH
Dwie ostatnie reakcje są sprzeczne z regułą Markownikowa.
Nienasycone kwasy karboksylowe i ich pochodne są zdolne do reakcji polimeryzacji.