Proteazy: elastazy, kolagenazy, katepsyny B, D, G, F;
Hydrolazy glikozydowe: β-glukuronidaza, lizozym, neuraminidaza;
Hydrolazy estrowe: DNaza;
Hydrolazy lipidowe: fosfolipaza A 1 i A 2 , esteraza cholesterolowa;
Inne enzymy: kwaśna fosfataza.
Enzymy siateczki śródplazmatycznej
Tabela 4.1.2
Enzymy siateczki śródplazmatycznej i ich lokalizacja
Enzymy zlokalizowane w cytozolu
Metabolizm węglowodanów: enzymy glikolizy, w tym fosforylaza, kinaza fosforylazy, kinaza białkowa, syntaza glikogenu, karboksykinaza fosfoenolopirogronianowa, enzymy szlaku pentozofosforanowego, dehydrogenaza jabłczanowa, dehydrogenaza izocytrynianowa;
Metabolizm lipidów: karboksylaza acetylo-CoA, kompleks syntazy kwasów tłuszczowych;
Metabolizm aminokwasów i białek: aminotransferaza asparaginianowa, aminotransferaza alaninowa, arginaza, syntetazy aminoacylo-t-RNA;
Synteza nukleotydów: kinaza nukleozydowa, kinaza nukleotydowa.
Enzymy błonowe
Białka obwodowe (łatwo ekstrahowane z błony solą fizjologiczną).
Białka integralne z niewielką częścią łańcucha polipeptydowego zakotwiczoną w błonie.
Integralne białko z małą częścią łańcucha polipeptydowego osadzoną w dwuwarstwie.
Białko integralne obejmujące dwuwarstwę lipidową (transferazy jonowe, takie jak Na, K-ATPaza, Ca 2+ -ATPaza).
Białko przyłączone do błony dzięki drugiemu białku znajdującemu się w dwuwarstwie (ryc. 4.3.2).
Ryż. 4.1.2. Enzymy błonowe
Poziomy organizacji strukturalnej enzymów w komórce
Komórka zawiera enzymy o różnych organizacjach strukturalnych - od prostych monomerów po enzymy połączone w zespoły enzymatyczne. Enzymy ze względu na organizację strukturalną można podzielić na:
1. Enzymy monomeryczne;
2. Enzymy oligomeryczne (proste, zbudowane z podjednostek tego samego typu);
3. Enzymy oligomeryczne (złożone, zbudowane z różnych podjednostek);
4. Kompleksy enzymatyczne: a) kompleksy wieloenzymowe,
b) koniugaty wieloenzymowe;
5. Zespoły enzymatyczne: a) adsorpcja,
b) całka.
Masy cząsteczkowe enzymów są bardzo zróżnicowane: od kilku tysięcy do kilku milionów. W przyrodzie występuje kilkadziesiąt enzymów o stosunkowo małych cząsteczkach (do 50 kDa). Większość enzymów reprezentowana jest przez białka o większej masie cząsteczkowej, zbudowane z podjednostek (ryc. 4.1.3).

Ryż. 4.1.3. Modele budowy niektórych enzymów oligomerycznych: a - cząsteczka dehydrogenazy glutaminianowej, złożona z 6 protomerów; b - cząsteczka polimerazy RNA; c - połowa cząsteczki katalazy; d – kompleks molekularny dehydrogenazy pirogronianowej.
Zatem katalaza (252 kDa) zawiera w cząsteczce sześć protomerów o masie cząsteczkowej 42 kDa każdy. Cząsteczka enzymu przyspieszająca reakcję syntezy kwasu rybonukleinowego (polimeraza RNA, 400 kDa) składa się z 6 nierównych podjednostek. Kompletna cząsteczka dehydrogenazy glutaminianowej, która przyspiesza utlenianie kwasu glutaminowego (336 kDa), zbudowana jest z 6 podjednostek o masie cząsteczkowej 56 kDa.
Proces oligomeryzacji nadaje podjednostkom białek zwiększoną stabilność. Wiązania w kompleksie są głównie niekowalencyjne, dlatego takie enzymy łatwo dysocjują na protomery.
Metody łączenia protomerów w multimery są zróżnicowane. Niezwykle ważne jest, aby enzym złożony z podjednostek wykazywał maksymalną aktywność katalityczną w postaci multimeru: dysocjacja na protomery gwałtownie zmniejsza aktywność enzymu. Nie wszystkie enzymy multimeryczne są zbudowane wyłącznie z katalitycznie aktywnych protomerów. Oprócz katalitycznych zawierają podjednostki regulatorowe, takie jak np. karbamoilotransferaza asparaginianowa.
Wśród enzymów multimerowych niewątpliwie dominują dimery i tetramery (kilkaset z nich), rzadziej spotykane są heksamery i oktamery (kilkadziesiąt), a niezwykle rzadkie są trimery i pentamery.
W niektórych przypadkach cząsteczki enzymów multimerowych składają się z podjednostek dwóch typów, umownie określanych jako podjednostki typu A I W. Są do siebie podobne, ale różnią się pewnymi szczegółami struktur pierwotnych i trzeciorzędowych. W zależności od stosunku protomerów typu A I W w multimerze ten ostatni może występować w postaci kilku izomerów, które nazywane są izozymami. Zatem przy czterech podjednostkach możliwych jest 5 izozymów:
I II III IV V
AAAA AAAAB AABB ABBB BBBB
Obecnie zainteresowanie izozymami gwałtownie wzrosło. Okazało się, że oprócz genetycznie zdeterminowanych izozymów istnieje duża grupa enzymów, które przybierają różnorodne formy powstałe w wyniku ich modyfikacji potranslacyjnych. W szczególności różnorodne formy enzymów i izozymów znajdują obecnie zastosowanie w diagnostyce chorób w medycynie, przewidywaniu produkcyjności zwierząt, doborze par rodzicielskich podczas krzyżowania w celu zapewnienia maksymalnej heterozji u potomstwa itp. (szerzej o tych zagadnieniach można przeczytać w wykładzie 5.2).
W jaki sposób komórka jest w stanie „trawić” substancje dostające się do cytoplazmy? Odpowiedź można uzyskać, zastanawiając się, czym są lizosomy. Jaka jest ich struktura? Dzięki jakim właściwościom te organelle mogą pełnić swoją funkcję?
Lizosomy. Cechy konstrukcyjne i funkcje
Lizosom ma wielkość około 0,2 mikrona, jest otoczony pojedynczą błoną i zawiera enzymy hydrolityczne. Główną funkcją takich pęcherzyków jest rozkład substancji, które dostały się do komórki w wyniku endocytozy lub ich własnych cząsteczek, które nie są już potrzebne.
Czym są lizosomy pod względem budowy?
Rozkład lub degradacja substancji odbywa się za pomocą hydrolaz - enzymów, które mogą pracować w środowisku kwaśnym. Aby utrzymać niskie pH, w błonę lizosomu wbudowują się wakuolowe ATPazy, których specyficzna budowa pozwala na pompowanie w ich stronę protonów wodoru, zwiększając w ten sposób ich liczbę w środowisku wewnętrznym organelli.
Hydrolazy mogą działać tylko w środowisku kwaśnym. Odgrywa to ważną rolę ochronną, ponieważ środowisko jest prawie neutralne. Jeśli błona lizosomu zostanie w jakiś sposób uszkodzona, a enzymy dostaną się do cytozolu, utracą zdolność rozkładania substancji i organelli.
Błona lizosomowa składa się z obszarów blaszkowatych i micelarnych. Przestrzenie pomiędzy warstwami fosfolipidów wypełnione są wodą. Na obszarze membrany rozproszone są liczne pory, które również są wypełnione wodą i mogą być zamykane przez cząsteczki polarne. Ten kompleks odcinków membrany i układu porów umożliwia penetrację organelli zarówno cząsteczkom hydrofobowym, jak i hydrofilowym.
Jak powstają lizosomy?
Białka potrzebne do budowy lizosomu są początkowo syntetyzowane w ER. Następnie należy je „oznakować” poprzez dołączenie reszty mannozy. Ta reszta mannozowa jest specyficznym sygnałem dla aparatu Golgiego: białka skupiają się w jednym miejscu, po czym syntetyzuje się z nich pęcherzyk z enzymami litycznymi. Tym właśnie są lizosomy w biologii.
Zawartość wewnętrzna lizosomów
Co to są lizosomy i jaki jest skład środowiska wewnętrznego tych organelli?
Wewnątrz lizosomu utrzymuje się kwaśne środowisko, którego pH osiąga 4,5-5. W takich warunkach enzymy mogą spełniać swoją funkcję trawienną. Hydrolazy to ogólna nazwa całej klasy enzymów. W sumie lizosom zawiera około 40 różnych biologicznie aktywnych cząsteczek, które katalizują własną, absolutnie specyficzną reakcję.
W wewnętrznej zawartości lizosomu można znaleźć następujące enzymy:
- fosfataza kwaśna – rozkłada substancje zawierające grupy fosforanowe;
- nukleaza - niszczy kwasy nukleinowe;
- proteaza - rozkłada białka;
- kolagenaza – niszczy cząsteczki kolagenu;
- lipaza - rozkłada się;
- glikozydazy - przyspieszają rozkład węglowodanów;
- asparaginaza - rozkłada kwas asparaginowy;
- glutaminaza - niszczy kwas glutaminowy.
W sumie lizosomy zawierają około 40 różnych typów hydrolaz. Można zatem odpowiedzieć na pytanie, czym są lizosomy w biologii: magazynem enzymów.

Rodzaje lizosomów
Istnieją 4 rodzaje lizosomów: lizosomy pierwotne i wtórne, autofagosomy i ciała resztkowe.
Tworzenie lizosomów jest złożonym procesem, któremu towarzyszy praca różnych cząsteczek sygnalizacyjnych na powierzchni ER i AG. Pierwotny lizosom to mały pęcherzyk odcinany od błony za pomocą aparatu Golgiego.
Pierwotny lizosom początkowo zawiera cały kompleks enzymów niezbędnych do rozkładu makrocząsteczek.
Lizosom wtórny jest strukturą o dużej objętości. Powstaje w wyniku fuzji pęcherzyka pierwotnego z substancjami, które przedostały się przez endocytozę lub z produktami metabolizmu komórkowego, które należy wykorzystać.
Tworzenie autofagosomów wiąże się z procesem takim jak autofagia - wchłanianiem i „trawieniem” zużytych organelli komórkowych.
Średni czas trwania mitochondriów wynosi 10 dni. Gdy organella nie jest już w stanie pełnić swoich funkcji, należy ją usunąć. Aby to zrobić, wiele pierwotnych lizosomów otacza mitochondrium i łączy się ze sobą. W rezultacie powstaje duży autofagosom, w obrębie którego rozpoczyna się rozszczepienie mitochondriów na monomery.
Czym są lizosomy w postaci ciał resztkowych? Jest to końcowy moment funkcjonowania każdego lizosomu, kiedy enzymy zakończyły swoją pracę, a w organelli pozostają substancje, które nie mogą ulec dalszemu rozkładowi. Niestrawione pozostałości są po prostu wyrzucane z komórki.

Choroby związane z dysfunkcją lizosomów
Enzymy nie zawsze działają prawidłowo. Lizosomy pełnią funkcję rozszczepiania tylko wtedy, gdy hydrolazy nie mają zaburzeń strukturalnych. Dlatego wiele chorób związanych z lizosomami ma podłoże w nieprawidłowym funkcjonowaniu enzymów.

Takie odchylenia nazywane są. Oznacza to, że gdy brakuje jakiegoś enzymu, jego główny substrat po prostu nie jest trawiony w lizosomie, dlatego gromadzi się i powoduje niekorzystne konsekwencje.
Sfingolipidoza, zespół Taya-Sachsa, choroba Sendhoffa, choroba Niemanna-Picka, leukodystrofia – wszystkie te choroby związane są z nieprawidłowym funkcjonowaniem enzymów lizosomalnych lub ich całkowitym brakiem. Większość chorób ma charakter recesywny.
Rola jądra
Rdzeń implementuje dwie grupy funkcje ogólne: związany z samym przechowywaniem Informacja genetyczna, drugi - z jego realizacją, z zapewnieniem syntezy białek.
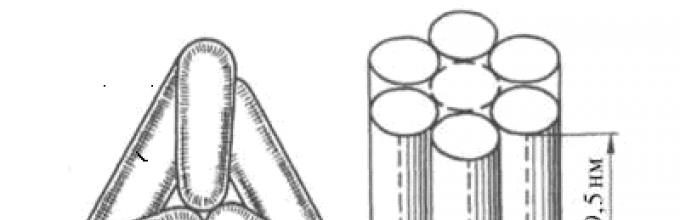
Mitochondria- organella ziarnista lub nitkowata z podwójną błoną o grubości około 0,5 mikrona.
Główna funkcja- utlenianie związki organiczne oraz wykorzystanie energii uwolnionej podczas ich rozpadu w syntezie Cząsteczki ATP, który zachodzi w wyniku ruchu elektronu wzdłuż łańcucha transportu elektronów białek w błonie wewnętrznej.
Struktura mitochondriów
Zewnętrzna błona mitochondriów ma grubość około 7 nm, nie tworzy wgłębień ani fałd i jest zamknięta. Błona zewnętrzna stanowi około 7% powierzchni wszystkich błon organelli komórkowych. Główną funkcją jest oddzielenie mitochondriów od cytoplazmy. Zewnętrzna błona mitochondrium składa się z warstwy bilipidowej i przenikających przez nią białek; stosunek wagowy lipidów i białek wynosi w przybliżeniu 1:1.
Przestrzeń międzybłonowa to przestrzeń pomiędzy zewnętrzną i wewnętrzną błoną mitochondrium. Jego grubość wynosi 10-20 nm. Ponieważ zewnętrzna błona mitochondrium jest przepuszczalna dla małych cząsteczek i jonów, ich stężenie w przestrzeni peryplazmatycznej niewiele różni się od tego w cytoplazmie. Wręcz przeciwnie, duże białka wymagają specyficznych peptydów sygnałowych do transportu z cytoplazmy do przestrzeni peryplazmatycznej; dlatego składniki białkowe przestrzeni peryplazmatycznej i cytoplazmy są różne. Jednym z białek znajdujących się w przestrzeni peryplazmatycznej jest cytochrom c, będący jednym ze składników mitochondrialnego łańcucha oddechowego.
Wewnętrzna membrana tworzy liczne fałdy grzebieniowe – cristae, które znacznie zwiększają jego powierzchnię i np. w komórkach wątroby stanowią około jednej trzeciej wszystkich błony komórkowe. Cecha charakterystyczna Skład wewnętrznej błony mitochondriów polega na obecności w niej kardiolopiny – specjalnego fosfolipidu, który zawiera cztery kwasy tłuszczowe i sprawia, że błona jest całkowicie nieprzepuszczalna dla protonów.
Lizosom- organelle komórkowe o wielkości 0,2 - 0,4 mikrona, jeden z rodzajów pęcherzyków. Te organelle jednobłonowe są częścią próżni (układu endobłonowego komórki).
Jeden z oznaki lizosomów- obecność w nich szeregu enzymów (hydrolaz kwasowych) zdolnych do rozkładania białek, węglowodanów, lipidów i kwasów nukleinowych. Do enzymów lizosomalnych zaliczają się katepsyny (proteazy tkankowe), rybonukleaza kwaśna, fosfolipaza itp. Ponadto lizosomy zawierają enzymy zdolne do rozszczepiania organiczne molekuły grupy siarczanowe (sulfatazy) lub fosforanowe (fosfataza kwaśna). Lizosomy charakteryzują się kwaśnym środowiskiem wewnętrznym.
Tworzenie lizosomów i ich rodzaje
Lizosomy powstają z pęcherzyków (pęcherzyków), które oddzielają się od aparatu Golgiego i pęcherzyków (endosomów), do których przedostają się substancje podczas endocytozy. Błony retikulum endoplazmatycznego biorą udział w tworzeniu autolizosomów (autofagosomów). Wszystkie białka lizosomalne są syntetyzowane na osadzonych rybosomach po zewnętrznej stronie błon siateczki śródplazmatycznej, a następnie przechodzą przez jej jamę i aparat Golgiego.
Wyróżnić lizosomy pierwotne i wtórne . Te pierwsze powstają w rejonie aparatu Golgiego i zawierają enzymy w stanie nieaktywnym, drugie natomiast zawierają enzymy aktywne.
Wśród lizosomów można również wyróżnić heterolizosomy ( trawiący materiał wchodzący do komórki z zewnątrz - przez fago- lub pinocytozę) i autolizosomy (niszczenie własnych białek lub organelli komórki).
Funkcje lizosomów
Trawienie substancji lub cząstek wychwyconych przez komórkę podczas endocytozy (bakterie, inne komórki)
Autofagia to niszczenie struktur zbędnych dla komórki np. podczas zastępowania starych organelli nowymi, czy też trawienia białek i innych substancji wytwarzanych wewnątrz samej komórki
Autoliza to samostrawienie komórki, prowadzące do jej śmierci (czasami proces ten nie jest patologiczny, ale towarzyszy rozwojowi organizmu lub różnicowaniu niektórych wyspecjalizowanych komórek).
Cytoszkielet jest szkieletem komórkowym lub szkieletem zlokalizowanym w cytoplazmie żywej komórki. Jest obecny we wszystkich komórkach zarówno eukariontów, jak i prokariotów. To dynamiczna, zmieniająca się struktura, w których funkcje obejmują utrzymanie i adaptacja kształtu komórki do wpływów zewnętrznych, egzo- i endocytozy, zapewnienie ruchu komórki jako całości, aktywny transport wewnątrzkomórkowy i podział komórek.
Cytoszkielet zbudowany jest z białek. W cytoszkielecie wyróżnia się kilka głównych układów, nazwanych albo na podstawie głównych elementów strukturalnych widocznych w badaniach mikroskopu elektronowego (mikrofilamenty, włókna pośrednie, mikrotubule), albo na podstawie głównych białek wchodzących w ich skład (układ aktyna-miozyna, keratyny, tubulina- układ dyneinowy).
Pytanie 2. Budowa molekularna i funkcje głównych składników komórki: kompleks Golgiego, siateczka śródplazmatyczna, centrum komórkowe, rybosomy.
Aparat Golgiego (kompleks Golgiego) - struktura błonowa komórki eukariotycznej, organellum przeznaczone głównie do wydalania substancji syntetyzowanych w retikulum endoplazmatycznym
Struktura
Kompleks Golgiego to stos worków błonowych w kształcie dysku (cisternae), nieco rozszerzonych bliżej krawędzi, i powiązany układ pęcherzyków Golgiego. Komórki roślinne zawierają pewną liczbę pojedynczych stosów (dyktosomów); komórki zwierzęce często zawierają jeden duży lub kilka stosów połączonych rurkami.
Główna funkcja aparatu Golgiego- sortowanie przechodzących przez nią białek
Za pomocą transportu pęcherzykowego białka przechodzące przez aparat Golgiego dostarczane są „pod adres” w zależności od „znaczników”, które otrzymały w aparacie Golgiego. Mechanizmy tego procesu również nie są w pełni poznane.
Siateczka śródplazmatyczna (ER) Lub retikulum endoplazmatyczne (ER)- wewnątrzkomórkowa organella komórki eukariotycznej, która jest rozgałęzionym systemem spłaszczonych wnęk, pęcherzyków i kanalików otoczonych błoną.
Struktura
Siateczka śródplazmatyczna składa się z rozgałęzionej sieci kanalików i kieszeni otoczonych błoną. Powierzchnia błon retikulum endoplazmatycznego jest większa niż połowa Całkowita powierzchnia wszystkie błony komórkowe.
Błona ER jest morfologicznie identyczna z błoną jądra komórkowego i jest z nią integralna. W ten sposób wnęki siateczki śródplazmatycznej otwierają się do wnęki międzybłonowej otoczki jądrowej. Zapewniają membrany EPS transport aktywny szeregu pierwiastków wbrew gradientowi stężeń. Włókna tworzące retikulum endoplazmatyczne mają średnicę 0,05-0,1 µm (czasami do 0,3 µm), grubość dwuwarstwowych membran tworzących ścianę kanalików wynosi około 50 angstremów (5 nm, 0,005 µm). Struktury te zawierają nienasycone fosfolipidy, a także trochę cholesterolu i sfingolipidów. Zawierają także białka.
Centrum komórek, stała struktura prawie wszystkich zwierząt i niektórych komórki roślinne, wyznacza bieguny dzielącej się komórki.
K.c. zwykle składa się z dwóch centrioli - gęstych granulek o wielkości 0,2-0,8 μm, umieszczonych względem siebie pod kątem prostym.
Podczas tworzenia aparatu mitotycznego centriole rozchodzą się w stronę biegunów komórkowych, określając orientację wrzeciona podziału komórkowego. Dlatego bardziej poprawne jest K. c. zwane centrum mitotycznym, co odzwierciedla jego znaczenie funkcjonalne, zwłaszcza że tylko w niektórych komórkach K. c. znajdujący się w jego centrum.
W trakcie rozwoju organizmu zmienia się położenie krwinek. w komórkach i jego postać. Kiedy komórka się dzieli, każda komórka potomna otrzymuje parę centrioli. Proces ich podwajania następuje częściej pod koniec poprzedniego podziału komórek. Występowanie szeregu patologicznych form podziału komórek wiąże się z nieprawidłowym podziałem K. c.
Rybosom- najważniejsza niebłonowa organella żywej komórki, o kształcie kulistym lub lekko elipsoidalnym, o średnicy 100-200 angstremów, składająca się z dużych i małych podjednostek.
Rybosomy służą do biosyntezy białek z aminokwasów dana macierz w oparciu o informację genetyczną dostarczoną przez informacyjny RNA, czyli mRNA. Proces ten nazywa się audycja.
Rybosomy są nukleoproteinami, w którym stosunek RNA/białko wynosi 1:1 u zwierząt wyższych i 60-65:35-40 u bakterii. Rybosomalny RNA stanowi około 70% całkowitego RNA w komórce.
Rybosomy eukariotyczne zawierają cztery cząsteczki rRNA, z których 18S, 5,8S i 28S rRNA są syntetyzowane w jąderku przez polimerazę RNA I jako pojedynczy prekursor (45S), który jest następnie modyfikowany i cięty. 5S rRNA jest syntetyzowany przez polimerazę RNA III w innej części genomu i nie wymaga dodatkowych modyfikacji. Prawie cały rRNA ma postać soli magnezu, która jest niezbędna do utrzymania struktury; Po usunięciu jonów magnezu rybosom ulega dysocjacji na podjednostki.
6. Klasyfikacja enzymów zawartych w lizosomach
1. Esterazy przyspieszające reakcje hydrolizy estrów alkoholowych z kwasami organicznymi i nieorganicznymi. Najważniejszymi podklasami esteraz są hydrolazy estrowe kwasy karboksylowe i fosfatazy. Jako przedstawiciel pierwszej podklasy rozważ lipazę. Lipaza przyspiesza hydrolizę czynników zewnętrznych, tj. wiązania a-estrowe w cząsteczkach triacyloglicerolu (tłuszczu). Fosfatazy katalizują hydrolizę estrów fosforu. Szczególnie rozpowszechnione są fosfatazy, które działają na estry Kwas fosforowy węglowodany, takie jak glukozo-1-fosfataza. Działanie fosfataz objawia się w szerokim zakresie pH od 3 do 9, dlatego wyróżnia się fosfatazy zasadowe i kwaśne. W tym przypadku interesuje nas kwaśna fosfataza, która jest enzymem markerowym dla lizosomów. Większość z nich ma szeroką specyficzność substratową.
2. Peptyd - hydrolazy przyspieszające reakcje hydrolizy białek, peptydów i innych związków zawierających Wiązania peptydowe. Specyficzność enzymów proteolitycznych zależy od charakteru bocznych grup aminokwasów znajdujących się w pobliżu zhydrolizowanego wiązania. Inną ważną cechą specyficzności peptydaz jest położenie zhydrolizowanego wiązania; Na podstawie tej cechy wyróżnia się dwie główne grupy peptydaz. Egzopeptydazy to enzymy podgrupy 3.4.11 – 15, które do swojego działania wymagają albo wolnej końcowej grupy aminowej (aminopeptydazy), albo wolnej końcowej grupy karboksylowej (karboksypeptydazy). Pozostałe peptydazy lub endopeptydazy hydrolizują pewne wiązania w łańcuchu; działanie niektórych z nich jest hamowane, jeśli w pobliżu zhydrolizowanego wiązania znajduje się wolna grupa końcowa. Katepsyny (z gr. kathepso – trawię), enzymy proteolityczne z grupy endopeptydaz. Zlokalizowane w lizosomach komórek zwierzęcych. Przeprowadzić wewnątrzkomórkowe trawienie białek. Mają szeroką specyficzność, optymalną aktywność przy lekko kwaśnym pH.
3. Nukleazy przyspieszające reakcje rozszczepienia wiązań fosfodiestrowych w łańcuchu polinukleotydowym kwasy nukleinowe z tworzeniem mono- i oligonukleotydów. Końcowe mononukleotydy są odcinane przez egzonukleazy, a cięcie w obrębie łańcucha polinukleotydowego przeprowadzane jest przez endonukleazy. Nukleazy mogą rozszczepiać RNA (rybonukleazy) i DNA (deoksyrybonukleazy) lub oba (tj. niespecyficzne nukleazy). Nukleazy są szeroko rozpowszechnione w przyrodzie i odgrywają ważną rolę w rozkładzie i syntezie kwasów nukleinowych. Nukleazy mają szeroką i nakładającą się specyficzność; Klasyfikacja tych enzymów jest bardzo trudna i kontrowersyjna.
4. Glikozydazy przyspieszające reakcje hydrolizy glikozydów, w tym węglowodanów. W zależności od tego, na który izomer przestrzenny (a lub b) działa enzym, dzieli się go na a- lub b-glikozydazy. Zatem glikozydazy mają wyraźną specyficzność przestrzenną, która jest określona przez konfigurację każdej grupy CHOH. Oprócz glikozydów substratami podlegającymi działaniu niektórych glikozydaz są oligo- i polisacharydy. Enzymy tej dużej i ważnej grupy rozkładają głównie substraty, których cząsteczki nie zawierają grup naładowanych. W podłożach tych dominującą rolę odgrywa układ grup hydroksylowych i atomów wodoru. Z reguły wykazują glikozydazy wysoki stopień specyficzność dla konkretnego pierścienia monosacharydowego; jednakże przyłączona grupa aglikonowa może również mieć mniej lub bardziej zauważalny efekt. W niektórych przypadkach (na przykład w przypadku nukleozydaz) to działanie aglikonu jest bardziej wyraźne niż działanie składnika monosacharydowego. Na przykład inozynaza hydrolizuje rybozyd hipoksantyny, ale nie ma wpływu na rybozyd ksantyny.
5. Hydrolazy działające na wiązania C–N, inne niż peptydowe, tj. przyspieszają hydrolizę amidów kwasowych. Spośród nich ważną rolę w organizmie odgrywają ureaza, asparaginaza i glutaminaza. Ureaza przyspiesza hydrolizę mocznika do NH3 i CO2. Asparaginaza i glutaminaza przyspieszają hydrolizę amidów aminokwasów dikarboksylowych – asparaginowego i glutaminianowego. Do hydrolaz działających na wiązania C–N, które różnią się od hydrolaz peptydowych, oprócz amidaz, należą enzymy katalizujące hydrolizę wiązań C–N w liniowych amidynach. Arginaza jest jednym z nich.
7. Lizosomalne choroby spichrzeniowe
Koncepcja lizosomalnych chorób spichrzeniowych wyłoniła się z badań nad glikogenozą typu II (Pompe). Fakt gromadzenia się glikogenu w lizosomach na skutek niedoboru a-glukozydazy, a także dane uzyskane z badań innych anomalii, pozwoliły Erowi zdefiniować wrodzoną chorobę lizosomalną jako stan, w którym: 1) stwierdza się niedobór któregokolwiek enzymu lizosomalnego oraz 2) w związanych z nimi nietypowych osadach (substracie) pojawiają się lizosomy wakuoli. Definicję tę można zmodyfikować tak, aby obejmowała defekty pojedynczego genu wpływające na jeden lub więcej enzymów lizosomalnych, a tym samym rozciągała się na choroby takie jak mukolipidozy i niedobór wielu sulfataz. Definicję można dodatkowo rozszerzyć o niedobór innych białek niezbędnych do funkcjonowania lizosomów (enzymy aktywujące niszczenie sfingolipidów). Biochemiczne i badania genetyczne wskazują, że te białka aktywujące biorą udział w hydrolizie niektórych substratów.
Lizosomalne choroby spichrzeniowe obejmują większość chorób spichrzeniowych lipidów, mukopolisacharydozy, mukolipidozy, choroby spichrzeniowe glikoprotein i inne. Niedobory enzymów mają podłoże autosomalne recesywne, z wyjątkiem mukopolisacharydozy Huntera II (MPS II), która jest dziedziczona jako cecha recesywna sprzężona z chromosomem X, oraz choroby Fabry'ego, która jest sprzężona z chromosomem X i często występuje u kobiet. Narządy docelowe są zwykłymi miejscami zniszczenia tej lub innej makrocząsteczki. Na przykład u osób z zaburzeniem procesu niszczenia mieliny, w proces ten zaangażowana jest istota biała mózgu, jeśli proces niszczenia glikolipidów w zrębie erytrocytów zostanie zakłócony, rozwija się hepatosplenomegalia, a jeśli proces zniszczenie wszechobecnych mukopolisacharydów zostaje zakłócone, następuje uogólnione uszkodzenie tkanki. Nagromadzony materiał często powoduje wisceromegalię lub makrocefalię, ale może wystąpić wtórny zanik, zwłaszcza mózgu i mięśni. Ogólnie rzecz biorąc, objawy odpowiednich chorób zależą od szkodliwego działania nagromadzonych substancji, ale często nie jest jasne, w jaki sposób powodują one śmierć lub dysfunkcję komórek. Wszystkie te choroby mają charakter postępujący i wiele z nich kończy się śmiercią w dzieciństwie lub okresie dojrzewania. Dla ostatecznej diagnozy najważniejsze wyniki to oznaczenie specyficznych enzymów w surowicy, leukocytach lub hodowanych fibroblastach skóry; odpowiednie badania dobierane są na podstawie obrazu klinicznego choroby. Choroby te charakteryzują się dużymi wahaniami fenotypowymi, a wiele z nich jest związanych z wiekiem, tj. rozróżniają postacie niemowlęce, młodzieńcze i dorosłe. Ponadto w chorobach spowodowanych pojedynczym defektem genu możliwe są różne kombinacje zaburzeń trzewnych, kostnych i neurologicznych.
Wybrane choroby
Sfingoliposy.
g mi - gangliozydoza. Smggangliozydoza jest spowodowana niedoborem β-galaktozydazy. Dziecięca postać choroby objawia się zaraz po urodzeniu lub wkrótce potem (opóźnienie rozwoju, drgawki, szorstkie rysy twarzy, obrzęk, powiększenie wątroby i śledziony, makroglozja, wiśniowo-czerwone plamy na siatkówce i wyraźna dysostoza przypominająca mukopolisacharydozę). Śmierć następuje zwykle w wieku 1-2 lat. Postać młodzieńcza charakteryzuje się późniejszym początkiem, dłuższą oczekiwaną długością życia (ponad 5 lat), zaburzeniami neurologicznymi i drgawkami oraz mniej poważnymi uszkodzeniami szkieletu i oczu. W postaci dorosłej często stwierdza się dysplazję kręgowo-nasadową, podobną do MPS IV, zmętnienie rogówki i normalną inteligencję. Może być widoczna spastyczność mięśni i ataksja z niewielkimi nieprawidłowościami w zakresie kości. Istnieją izoenzymy β-galaktozydazy, a różne fenotypy są powiązane z różnymi mutacjami tego samego genu strukturalnego. Wszystkie formy SMGangliozydozy są dziedziczone jako cecha autosomalna recesywna.
G M2 - gangliozydoza. Choroba (lub zespół) Taya-Sachsa jest stosunkowo częstą wrodzoną nieprawidłowością metabolizmu: udowodniono już kilka tysięcy przypadków tej choroby. Pomimo tego, że klinicznie zespół ten przypomina chorobę Sendhoffa, różnią się one genetycznie: w pierwszym przypadku występuje niedobór heksozominidazy A, a w drugim – heksozominidazy A i B. Innym typem patologii (wariant AB gangliozydozy G M2) jest charakteryzuje się prawidłową aktywnością heksozominidazy A i B. Jest ona spowodowana niedoborem czynnik białkowy(aktywator) niezbędny do realizacji działania enzymu w stosunku do naturalnego substratu. Objawy kliniczne wszystkich wariantów choroby, które ujawniają się w okresie niemowlęcym (postacie dziecięce), są podobne i obejmują opóźnienie rozwoju, które ujawnia się w wieku 3-6 miesięcy, a następnie szybko postępujące objawy neurologiczne. Podejrzenia choroby są spowodowane makrocefalią, drgawkami, wiśniowymi plamami na siatkówce i wyraźną reakcją (nadmiernym strachem) na dźwięk. Rozpoznanie potwierdzają wyniki oznaczania enzymów. W większości przypadków niedobór heksaminidazy o późnym początku (postać młodzieńcza) charakteryzuje się demencją, drgawkami i objawami ocznymi, a u niektórych pacjentów rozwijają się nietypowe zmiany zwyrodnieniowe w rdzeniu kręgowym i móżdżku. Niektórzy pacjenci z postaciami młodzieńczymi i dorosłymi wykazują oznaki zaniku mięśni pochodzenia rdzeniowego.
Choroba Sendhoffa nie jest alleliczna z chorobą Tay-Sachsa, podczas gdy młodzieńcze postacie niedoboru heksozominidazy są zwykle alleliczne z tą ostatnią. Choroba Tay-Sachsa jest najczęstszą postacią niedoboru heksaminidazy. Wszystkie formy gangliozydozy G M2 są dziedziczone jako cecha autosomalna recesywna. Heksozominidaza B składa się z podjednostek b, których gen strukturalny jest zlokalizowany na chromosomie 5, podczas gdy heksozominidaza A obejmuje zarówno podjednostki a, jak i p, a gen strukturalny podjednostki a jest zlokalizowany na chromosomie 15. Zatem defekt podjednostki α jest typowy dla zespołu Tay-Sachsa, a defekt podjednostki β dla zespołu Sandhoffa.
Leukodystrofie. Lipidoza galaktozyloceramidu Krabbe, czyli leukodystrofia komórek kulistych, objawia się w dzieciństwie z powodu niedoboru galaktozyloceramidu-b-galaktozydazy. Jej typowy początek przypada na wiek 2-6 miesięcy, łagodna pobudliwość, przeczulica, zwiększona wrażliwość na wpływy zewnętrzne, gorączkę niewiadomego pochodzenia, zanik nerwu wzrokowego, a czasami drgawki. Ilość białka w płynie mózgowo-rdzeniowym jest zwykle zwiększona. Napięcie mięśniowe i odruchy z głębokich ścięgien są początkowo zwiększone, ale później napięcie mięśniowe maleje. Po 1-2 latach objawy neurologiczne gwałtownie się pogarszają i następuje śmierć. Diagnoza na całe życie opiera się na wynikach oznaczania enzymów. Cechą charakterystyczną i być może specyficzną są komórki kuliste w tkankach system nerwowy. Funkcja galaktozyloceramido-b-galaktozydazy polega na niszczeniu sulfatydów powstałych z mieliny. Uszkodzenie tkanek tak zakłóca syntezę mieliny, że sekcja zwłok zwykle nie ujawnia wzrostu bezwzględnej ilości substratu galaktocerebrozydowego w tkankach. Galaktozyloceramido-β-galaktozydaza różni się genetycznie od β-galaktozydazy, której niedobór jest typowy dla gangliozydozy G M1.
Przyczyną leukodystrofii metachromicznej (choroby spichrzania lipidów), występującej z częstością 1:40 000, jest niedobór arylosulfatazy A (sulfatazy cerebrozydowej). Przejawia się w późniejszym wieku niż zespół Tay-Sachsa czy Krabbe. Chore dzieci zaczynają chodzić, ale w wieku 2-5 lat ich chód jest często zaburzony. Początkowo napięcie mięśniowe i odruchy ze ścięgien głębokich ulegają osłabieniu, co wiąże się z uszkodzeniem nerwów obwodowych. W ciągu pierwszych 10 lat życia choroba postępuje i objawia się ataksją, wzmożonym napięciem mięśniowym, stanem dekortycznym lub mózgowym, a ostatecznie utratą wszelkich kontaktów ze światem zewnętrznym. Oczekiwana długość życia zależy od starannej pielęgnacji i karmienia przez rurkę nosową lub rurkę gastrostomijną.
Choroba Niemanna-Picka. Choroba Niemanna-Picka to lipidoza sfingomieliny. W chorobach typu A i B występuje wyraźny niedobór sfingomielinazy, enzymu hydrolizującego sfingomielinę z wytworzeniem ceramidu i fosforylocholiny. Najczęstsza postać A objawia się wkrótce po urodzeniu powiększeniem wątroby i śledziony, złym samopoczuciem i objawami neurologicznymi. Na siatkówce mogą pojawić się wiśniowo-czerwone plamy, ale drgawki i hipersplenizm są rzadkie. Zespół postaci B jest stosunkowo łagodnym procesem objawiającym się powiększeniem wątroby i śledziony, niedoborem sfingomielinazy i czasami naciekami płucnymi; jednakże w tej postaci zespołu nie występują objawy neurologiczne. Postać C charakteryzuje się lipidozą sfingomieliny, postępującymi zaburzeniami neurologicznymi w dzieciństwie i zachowaniem (do normy) aktywności sfingomielinazy. W zespole Niemanna-Picka typu E lipidozę sfingomieliny trzewnej stwierdza się bez zaburzeń neurologicznych i niedoboru sfingomielinazy. Podstawa biochemiczna zespołu typu C, D i E nie jest jasna. Wielu pacjentów z zespołem wodnistych histiocytów ma niedobór sfingomielinazy; u pozostałych pacjentów z tym zespołem defekty metaboliczne pozostają niejasne.
choroba Gauchera. Choroba Gauchera to lipidoza glukozyloceramidowa spowodowana niedoborem glukozyloceramidazy. Postać dziecięca charakteryzuje się wczesnym początkiem, ciężką hepatosplenomegalią i ciężkim postępującym upośledzeniem neurologicznym prowadzącym do przedwczesnej śmierci. Postać dorosła jest prawdopodobnie najczęstszym typem lizosomalnej choroby spichrzeniowej. Pacjenci z postaciami młodzieńczymi i dorosłymi znajdowali się w tych samych rodzinach, ale mieli różnych rodziców, co wskazuje na alleliczność tych postaci.
Wszystkie postacie zespołu Gauchera są dziedziczone w sposób autosomalny recesywny. Pomimo tego, że ten wariant choroby nazywany jest zwykle dorosłą postacią zespołu Gauchera, często objawia się on w dzieciństwie. Kryterium postaci dorosłej jest brak zaburzeń neurologicznych. Klinicznie postać ta objawia się przypadkowo wykrytym powiększeniem śledziony lub małopłytkowością spowodowaną hipersplenią. Ponadto u pacjenta mogą wystąpić bóle kości lub złamania patologiczne, w tym jałowa martwica głowy kości udowej i ucisk kręgów. Ból kości, któremu towarzyszy gorączka, jest czasami nazywany zapaleniem rzekomym i szpiku. Można wykryć nacieki w płucach, nadciśnienie płucne i umiarkowane zaburzenia czynności wątroby. Typowy jest wzrost poziomu kwaśnej fosfatazy w surowicy. We wszystkich postaciach zespołu Gauchera w szpiku kostnym stwierdza się specyficzne „obciążone” komórki, jednak oznaczenie enzymu jest w dalszym ciągu konieczne, ponieważ komórki Gauchera można wykryć także u pacjentów z białaczką granulocytową i szpiczakiem.
Choroba Fabry’ego. W chorobie Fabry’ego, z powodu niedoboru α-galaktozydazy A, gromadzi się triheksozyd,eramid. Zespół ten jest dziedziczony jako cecha powiązana z chromosomem X i jest szczególnie wyraźny u mężczyzn. Zwykle rozwija się w wieku dorosłym. Jeśli objawy pojawią się w dzieciństwie, najprawdopodobniej przybierają postać bolesnej neuropatii. Zespół często rozpoznawany jest dopiero po rozwinięciu się postępującego uszkodzenia nerek, tj. po 20-40 roku życia. Zakrzepica naczyń może wystąpić w dzieciństwie. Śmierć następuje najczęściej z powodu niewydolności nerek, zwykle po 30-40 roku życia. U kobiet heterozygotycznych choroba ma łagodniejszy przebieg. Najczęściej diagnozuje się u nich dystrofię rogówki, chociaż mogą również wystąpić wszystkie inne objawy.
Niedobór lipazy kwaśnej. Anomalia ta leży u podstaw dwóch patologii o różnych fenotypach. Choroba Wolmana jest poważną anomalią rozpoczynającą się w młodym wieku, ciężka hepatosplenomegalia, niedokrwistość, wymioty, zaburzenia rozwojowe i charakterystyczne zwapnienie nadnerczy. Objawy neurologiczne są minimalne w porównaniu z wyraźnymi somatycznymi. Choroba spichrzeniowa estrów cholesterolu jest rzadką chorobą o stosunkowo łagodniejszych objawach. DO znaki stałe obejmują hepatosplenomegalię i podwyższony poziom cholesterolu w osoczu. Może występować zwłóknienie wątroby, żylaki przełyku i opóźnienie wzrostu. W tkankach pacjentów z niedoborem lipazy kwaśnej nie ulegają hydrolizie trójglicerydy ani estry cholesterolu. Możliwe jest, że pojedynczy enzym hydrolizuje wiele substratów, jednak struktura podjednostek i właściwości hydrolityczne różnych lipaz lizosomalnych nie zostały dostatecznie zbadane. Niedobór lipazy kwaśnej powoduje zaburzenie niszczenia lipoprotein o małej gęstości i może mu towarzyszyć przedwczesny rozwój miażdżycy. Zarówno choroba Wolmana, jak i choroba spichrzania estrów cholesterolu są dziedziczone w sposób autosomalny recesywny.
Choroby spichrzeniowe glikoprotein. Fukozydoza, mannozydoza i aspartyloglukozaminuria to rzadkie anomalie dziedziczone w sposób autosomalny recesywny i związane z niedoborem hydrolaz rozkładających wiązania polisacharydowe. W fukozydozie gromadzą się zarówno glikolipidy, jak i glikoproteiny. Wszystkie te anomalie charakteryzują się zaburzeniami neurologicznymi i różnymi objawami somatycznymi. Fukozydoza i mannozydoza najczęściej prowadzą do śmierci w dzieciństwie, natomiast aspartyloglukozaminuria objawia się lizosomalną chorobą spichrzeniową o późnym początku, znacznym upośledzeniu umysłowym i dłuższym przebiegu. Fukozydozę charakteryzują zaburzenia składu elektrolitowego potu i skórne angiokeratomy, natomiast mannozydoza charakteryzuje się niezwykłą zaćmą okrężną. W przypadku aspartyloglukozaminurii wartość diagnostyczną mają wyniki badania moczu, w którym stwierdza się zwiększenie ilości aspartyloglukozaminy. Mieszkańcy Finlandii chorują częściej. Sialidoza to grupa fenotypów związanych z niedoborem neuraminidazy glikoproteinowej (sialidazy). Należą do nich postać dorosła, charakteryzująca się wiśniowo-czerwonymi plamami siatkówki i miokloniami, postać dziecięca i młodzieńcza o fenotypie przypominającym mukopolisacharydozę oraz postać wrodzona z obrzękiem płodu. W wielu przypadkach, wcześniej sklasyfikowanych jako mukolipidoza I, stwierdzano mannozydozę lub sialidozę. U niektórych pacjentów z sialidozą występuje niedobór zarówno b-galaktozydazy, jak i neuraminidazy. Podstawa molekularnaŁączny niedobór b-galaktozydazy i neuraminidazy pozostaje niejasny, ale sugeruje się defekt w „białku ochronnym”. Każdą z chorób spichrzania glikoproteiny można zdiagnozować poprzez oznaczenie odpowiednich enzymów.
Mukopolisacharydozy. Jest to ogólna nazwa różnych zaburzeń spowodowanych niedoborem jednej z grupy enzymów niszczących mukopolisacharydy trzech klas: siarczanu heparanu, dermatyny i keratanu. Uogólniony fenotyp obejmuje grube rysy twarzy, zmętnienie rogówki, hepatosplenomegalię, sztywność stawów, przepukliny, dysostozę mnogą, wydalanie mukopolisacharydów z moczem i metachromiczne barwienie leukocytów obwodowych i szpiku kostnego. Pewne cechy fenotypu mukopolisacharydozy są również nieodłącznie związane z mukolipidozami, glikogenozą i innymi lizosomalnymi chorobami spichrzeniowymi.
Prototypem mukopolisacharydozy jest zespół Hurlera, czyli mukopolisacharydoza IX. W tym przypadku obecne są prawie wszystkie składniki wspomnianego fenotypu i są one ostro wyrażone. Wczesne objawy obejmują przekrwienie naczyń nosowych i makroskopowo widoczne zmętnienie rogówki. Szybki wzrost w pierwszych latach życia ulega spowolnieniu w miarę postępu choroby. W badaniu RTG stwierdza się powiększenie siodła tureckiego z charakterystyczną podkową dnem, poszerzenie i skrócenie kości długich, a także hipoplazję i zaostrzenie kręgów w odcinku lędźwiowym. Ten ostatni powoduje zwiększoną kifozę lub garbus. Śmierć następuje w ciągu pierwszych 10 lat; skrawki ujawniają wodogłowie i uszkodzenie układu sercowo-naczyniowego z zablokowaniem tętnic wieńcowych. Wada biochemiczna polega na niedoborze a-iduronidazy z nagromadzeniem heparanu i siarczanu dermatanu.
Mukopolisacharydoza IS, czyli zespół Scheiego, ma objawy kliniczne. Rozpoczyna się w dzieciństwie, ale pacjent dożywa dorosłości. Charakteryzuje się sztywnością stawów, zmętnieniem rogówki, niedomykalnością zastawki aortalnej i zwykle nienaruszoną inteligencją. Co zaskakujące, ta znacznie łagodniejsza choroba jest również spowodowana niedoborem a-iduronidazy; jak wykazał brak krzyżowej korekcji aktywności enzymatycznej podczas wspólnej hodowli fibroblastów skóry, jest to alleliczny zespół Hurlera. Istnieją wyraźnie pośrednie fenotypy pomiędzy zespołami Hurlera i Scheie. Uważa się, że pacjenci o fenotypie pośrednim to chimery genetyczne z jednym allelem zespołu Hurlera, a drugim zespołem Scheiego. W każdym razie trudno jest odróżnić od innych mutacji, które determinują pośrednie nasilenie choroby.
Zespół Gunthera, czyli mukopolisacharydoza I, różni się od fenotypu zespołu Hurlera brakiem makroskopowo widocznego zmętnienia rogówki i dziedziczenia recesywnego sprzężonego z chromosomem X. Postać dziecięca przypomina fenotyp zespołu Hurlera, a postać łagodniejsza pozwala pacjentowi dożyć wieku dorosłego. Ciężkie i łagodne formy mogą być alleliczne, ponieważ obie są powiązane z chromosomem X i są spowodowane niedoborem tego samego enzymu (sulfatazy siarczanu iduronu).
Mukopolisacharydozy Sanfilippo (IIIA, IIIB, IIIC i IIID) charakteryzują się nagromadzeniem siarczanu heparanu bez siarczanu dermatanu lub keratanu, a także wyraźnymi zmianami w ośrodkowym układzie nerwowym z łagodniejszymi objawami somatycznymi. Mukopolisacharydozę Sanfilippo diagnozuje się zwykle na podstawie upośledzenia umysłowego w dzieciństwie. Ponieważ objawy somatyczne są łagodne, mogą nie zostać zauważone, jeśli zaburzenia ośrodkowego układu nerwowego będą rozpatrywane oddzielnie. Śmierć następuje zwykle po 10-20 latach. Schorzenia zgrupowane w mukopolisacharydozy grupy III są bliskimi kopiami genów. Innymi słowy, w przybliżeniu te same fenotypy kliniczne, w których odkłada się ten sam produkt, są spowodowane niedoborem czterech różnych enzymów. Za pomocą testów enzymatycznych można rozpoznać i różnicować cztery typy mukopolisacharydozy III.
Zespół Morquio, czyli mukopolisacharydoza IV, charakteryzuje się prawidłowym rozwojem umysłowym i charakterystyczną dystrofią kości, którą można sklasyfikować jako dysplazję kręgowo-nasadową. Ciężka hipoplazja wyrostka zębodołowego może powodować kręcz szyi i zwykle prowadzi do ucisku rdzeń kręgowy w takim czy innym stopniu. Często wykrywa się niedomykalność zastawek aortalnych. Zespół ten wynika z niedoboru sulfatazy 6-siarczanowej N-acetylogalaktozaminy. Zmiany kostne przypominające nieco te występujące w zespole Morquio mogą również wystąpić w przypadku niedoboru β-galaktozydazy i innych postaci dysplazji kręgowo-nasadowej. Zespół Maroteaux-Lamiego, czyli mukopolisacharydoza VI, charakteryzuje się ciężką patologią kości, zmętnieniem rogówki i zachowaną inteligencją. Znane są formy alleliczne o różnym nasileniu, ale z niedoborem tej samej arylosulfatazy B (sulfatazy N-acetyloheksozamino-4-siarczanowej). Mukopolisacharydozę VII, czyli niedobór β-glukuronidazy, stwierdza się tylko u kilku osób z prawie całkowitym fenotypem mukopolisacharydozy. Zespół ten ma niezwykle różnorodne formy: od śmiertelnego niemowlęcia do łagodnego dorosłego.
Wielokrotny niedobór sulfatazy. Ten niezwykły stan, choć dziedziczony jako cecha autosomalna recesywna, charakteryzuje się niedoborem pięciu lub więcej komórkowych sulfataz (arylosulfatazy A i B, innych sulfataz mukopolisacharydowych i nielizosomalnej sulfatazy steroidowej). Obraz kliniczny łączy w sobie cechy leukodystrofii metachromicznej, fenotypu mukopolisacharydozy i rybiej łuski. To ostatnie jest prawdopodobnie związane z niedoborem sulfatazy steroidowej, który może być izolowany i dziedziczony jako cecha sprzężona z chromosomem X. W tym drugim przypadku niedobór ten objawia się zaburzeniami pracy i rybią łuską. Badania biochemiczne w tym stanie powinno rzucić dodatkowe światło na biochemiczne i kliniczne aspekty problemu heterogeniczności genetycznej.
Mukolipidozy. Jest to ogólna nazwa lizosomalnych chorób spichrzeniowych, w których mukopolisacharydy, glikoproteiny, oligosacharydy i glikolipidy gromadzą się w określonej kombinacji. Mukolipidoza I prawdopodobnie może zostać pominięta, ponieważ większość lub wszystkie osoby faktycznie cierpią na jakiś rodzaj choroby spichrzania glikoprotein.
Mukolipidoza II, czyli choroba 1-komórkowa, zaczyna się we wczesnym wieku i objawia się upośledzeniem umysłowym i fenotypem mukopolisacharydozy. DO cechy charakterystyczne obejmują wyraźne wtrącenia w hodowanych fibroblastach skóry i znacznie podwyższony poziom enzymów lizosomalnych w surowicy. Zespół ten jest dziedziczony jako cecha autosomalna recesywna i, jak obecnie ustalono, odzwierciedla defekt w potranslacyjnym przetwarzaniu enzymów lizosomalnych. Mukolipidoza III, czyli pseudopolidystrofia Hurlera, jest łagodniejszą chorobą z fenotypowymi cechami mukopolisacharydozy, w szczególności dysostozą mnogą. Objawia się w pierwszych 10 latach życia sztywnością stawów, która często kojarzy się z reumatoidalnym zapaleniem stawów. Głównymi objawami są postępująca niepełnosprawność ruchowa, zwłaszcza pojawienie się pazurowatych deformacji rąk oraz dysplazja stawów biodrowych. Rozwój umysłowy jest często opóźniony. Typowe objawy obejmują nieprawidłowości zastawek aortalnych lub mitralnych serca, chociaż często nie ma to konsekwencji funkcjonalnych. Pacjenci zwykle dożywają wieku dorosłego, ich stan udaje się ustabilizować, a u mężczyzn deformacje powodujące niepełnosprawność są bardziej wyraźne niż u kobiet. W hodowanych fibroblastach skóry wykrywa się te same wtręty, a poziom enzymów lizosomalnych w surowicy również wzrasta, jak w mukolipidozie II. Wskazuje to na alleliczną naturę anomalii. Podstawową wadą mukolipidoz II i III jest niedobór UDP-K-acetyloglukozaminy (GLcNAc)-glikoproteiny (GLcNAc)-1-fosfotransferazy, która bierze udział w potranslacyjnej syntezie oligosacharydowej części enzymów lizosomalnych.
Mukolipidoza IV charakteryzuje się upośledzeniem umysłowym, zmętnieniem rogówki i zwyrodnieniem siatkówki bez innych objawów somatycznych.
Inne lizosomalne choroby spichrzeniowe. Prototypem lizosomalnej choroby spichrzeniowej jest glikogenoza typu II (choroba Pompego). Główne cechy kliniczne związane z uszkodzeniem mięśni szkieletowych i mięśnia sercowego. Laktozyloceramidoza jest najwyraźniej odmianą zespołu Niemanna-Picka: hydroliza laktozyloceramidu in vitro, w zależności od warunków, jest prowadzona przez enzymy, których niedobór określa się w gangliozydozie g mi lub zespole Krabbe. Doniesienia o niedoborze β-siarczanu N-acetyloglukozaminy w przebiegu mukopolisacharydozy typu VIII mogą być błędne. Adrenoleukodystrofia jest charakterystyczną chorobą sprzężoną z chromosomem X, charakteryzującą się gromadzeniem się w tkankach estrów cholesterolu i długołańcuchowych kwasów tłuszczowych, ale może nie być chorobą spichrzeniową lizosomalną. Identyfikacja kobiet z fenotypem zespołu Gunthera (mukopolisacharydoza II) i tym samym niedoborem enzymu sugeruje istnienie autosomalnej recesywnej postaci zespołu Gunthera. Miałoby to miejsce, gdyby nieprawidłowy enzym składał się z nieidentycznych podjednostek kodowanych przez jeden gen autosomalny i jeden gen połączony z chromosomem X, lub gdyby w grę wchodziły regulacyjne elementy genetyczne. Z drugiej strony objawy fenotypowe u kobiet mogą być spowodowane różnymi aberracjami chromosomu X. Znana jest rodzina, której członkowie cierpią na gangliozydozę C m3. Zespół ten nie jest lizosomalną chorobą spichrzeniową, ale prawdopodobnie odzwierciedla defekt w syntezie gangliozydów. Jej objawy kliniczne są podobne do lizosomalnych chorób spichrzeniowych, lecz rozbieżności między rodzeństwem pozostawiają otwartą kwestię jej genetycznej natury. Być może pewnego dnia do lizosomalnych chorób spichrzeniowych zaliczone zostaną także inne zespoły neurodegeneracyjne, a mianowicie młodzieńcza lipidoza dystoniczna, dystrofia neuroaksonalna, zespoły Hallervordena-Spatza, Peliceusa-Merzbachera itp. Ponadto często występują pacjenci z wyraźnymi objawami klinicznymi lipidozy, mukolipidozy lub mukopolisacharydozę, w której nie można zidentyfikować żadnego z obecnie znanych zaburzeń biochemicznych. W rezultacie prawdopodobnie wzrośnie częstość występowania lizosomalnych chorób spichrzeniowych.
Wniosek
Zatem z powyższego wynika, że lizosomy, pełniąc funkcje trawienne, ochronne i wydalnicze, odgrywają bardzo ważną rolę w komórkach naszego organizmu. Na przykładzie takich lizosomalnych chorób spichrzeniowych jak choroba Gauchera, sfingolipoza, choroba Fabry’ego, choroba Niemanna-Picka możemy zobaczyć, jakie zaburzenia występują w organizmie przy braku niektórych enzymów hydrolitycznych i jak poważne są te zaburzenia. W wielu przypadkach to znaczne zmniejszenie aktywności enzymatycznej jest wynikiem mutacji genu strukturalnego, która znacząco upośledza syntezę lub funkcję enzymu. Istnieje również naturalny polimorfizm, z niewielkimi zmianami w aktywności enzymatycznej wynikającymi z mutacji w sekwencjach regulatorowych. Tym różnicom w aktywności enzymów nie towarzyszy żadna znacząca patologia, ale leżą one u podstaw naszej indywidualności biochemicznej. Każdy z nas różni się liczbą enzymów i ich rozmieszczeniem w tkankach. Różnice te niewątpliwie odgrywają rolę w naszej względnej podatności na różne czynniki środowiskowe i patogeny. Zatem możemy się spodziewać, że wraz ze wzrostem naszej wiedzy na temat regulacji genów wzrośnie także nasza zdolność do oceny udziału różnic w składzie enzymów w określaniu zdrowia i choroby. Dlatego badanie lizosomów i zawartych w nich enzymów jest bardzo ważną sekcją biochemii i Biologia molekularna. Należy to potraktować bardzo poważnie.
Ogólna charakterystyka hydrolaz peptydowych w tkance nerwowej o lokalizacji nielizosomalnej i cechy ich funkcji. EndopeptydazyPrzegląd prac nad tymi enzymami, który zostanie zaprezentowany poniżej, świadczy o dużym zainteresowaniu hydrolazami peptydowymi Tkanka nerwowa lokalizacja nielizosomalna, a jednocześnie są to dopiero pierwsze kroki w wyjaśnieniu funkcjonalnej roli tej grupy hydrolaz peptydowych. Charakterystyka enzymów proteolitycznych tkanki nerwowej o lokalizacji nielizosomalnej i ich rola biologiczna Hydrolazy peptydowe...
Spowodowane poważnym niedożywieniem spowodowanym zanieczyszczeniem. Szybkość wydalania azotu może dostarczyć więcej informacji na temat stanu zwierzęcia, jeśli zostanie uwzględniona wraz z innymi wskaźnikami fizjologicznymi. Stosunek zużytego tlenu do uwolnionego azotu (stosunek O/N) jest wskaźnikiem równowagi katabolicznej białek, węglowodanów i lipidów, stanowiących atomowe odpowiedniki spożytych...
Skurcz podczas intensywnego chłodzenia (w % masy schładzanego mięsa). Tryb chłodniczy Indyk Przy schładzaniu schłodzonego mięsa drobiowego do +4 C 0,5 Chłodzenie można przeprowadzić za pomocą par ciekłego azotu lub w zimnej solance z dodatkiem ciekłego azotu. Technologia dwustopniowego chłodzenia drobiu, najpierw metodą nawadniania, a następnie zanurzenia, obejmuje: -wstępne...
Lizosomy
- organelle komórkowe utworzone przez pojedynczą dwuwarstwę błony. Kompleksy ligand-receptor ulegają zniszczeniu w lizosomach
metabolizm cholesterolu
hydrolazy niszczą białka, lipidy, węglowodany, kwasy nukleinowe
Wewnątrz lizosomów utrzymuje się stałe pH = 5, zapewniane przez pompę zależną od ATP, która poprzez antyport Na
+
i H
+
pompy H
+
wewnątrz lizosomu. pH jest również utrzymywane przez kanały jonowe Cl
Enzymy lizosomalne: rybonukleaza, deoksyrybonukleaza, fosfataza, glikozydazy, arylosulfatazy (organiczne estry kwasu siarkowego), kolagenaza, katepsyny
Struktura enzymu lizosomalnego katepsyny D z przyłączonym cukrem, w tym mannozą: PDB = 1LYA.
lgpA Grupa lgpB białek integralnych o masie 100-120 kDa, silnie glikozylowanych. Glikozylacja białek błony własnej zapobiega samostrawieniu.
Białka lizosomalne są syntetyzowane w ER, przechodząc przez sieć trans-AG, tworząc endosomy, które łączą się
d=0,2-2µm. degradacja składników komórkowych, ~40 hydrolaz (nukleazy, proteinazy, glikozydazy, lipazy, fosfatazy, sulfatazy, fosfolipazy) o optymalnym pH ~4,5-5 (w cytoplazmie ~7-7,3) - pompy protonowe - ochrona przed degradacją komórek
białka utworzone w SER są glikozylowane do AG, końcowe reszty mannozy (Man) są fosforylowane na C-6, tworząc końcową resztę -
mannozo-6-fosforan
(Człowiek-6-P). Receptory AG rozpoznają Man-6-P, następuje lokalna akumulacja białek w AG -
klatryna
– wycina i transportuje odpowiednie fragmenty błony w ramach pęcherzyków transportowych do endolizosomów. W endolizosomach pH obniża się za pomocą pomp protonowych (H
+
-ATP-aza). Białka oddzielają się od receptorów, a grupa fosforanowa jest usuwana z Man-6-P. Receptory Man-6-P po recyklingu wykorzystywane są po raz drugi – trafiają do AG.
trans-Golgi zawiera
receptor mannozo-6-fosforanu wiązanie fosforylowanej mannozy enzymów lizosomalnych,
kierując enzymy do pęcherzyka transportowego.
Pierwotne lizosomy.
Autofagia
– wychwytywanie organelli =
lizosomy wtórne
– proces rozszczepiania hydrolitycznego |
pozostałości ciał.
Heterocytoza
– fuzja lizosomu z endosomami endo- i fagocytozy.
Elementy błonowe lizosomów są chronione przed działaniem hydrolaz kwaśnych przez regiony oligosacharydowe, które nie są rozpoznawane przez enzymy lub uniemożliwiają interakcję z nimi hydrolaz.
Oksydaza D-aminokwasów
– utlenia D-aminokwasy do ketokwasów.
Zniszczenie białek w lizosomach.
Białka cytoplazmatyczne mogą ulegać degradacji w proteasomach (patrz przegląd
Proteasomy
) lub w lizosomach. Zdegradowane białka mają specyficzne miejsce rozpoznawane przez chaperony, które wiążą się z białkiem i transportują je do receptorów na błonie lizosomu. Białko jest rozplatane przez chaperony i wchodzi do kanału prowadzącego do lizosomu, na którego drugim końcu proteaza tnie białko na małe fragmenty. Aktywność tego szlaku jest znacznie zmniejszona w fibroblastach i komórkach wątroby starych szczurów. Redukcja ta sprzyja gromadzeniu się niepotrzebnych białek, zakłócając różne procesy komórkowe.
Autofagia
Podczas długotrwałego głodu komórka pobiera energię i składniki niezbędne do jej przetrwania, niszcząc niektóre organelle. Lizosomy biorą udział w niszczeniu organelli.
Organelle powstają z lizosomów
W niektórych zróżnicowanych komórkach lizosomy mogą pełnić określone funkcje, tworząc dodatkowe organelle. Wszystko
dodatkowe funkcje są związane z wydzielaniem substancji.
| organelle | komórki | Funkcje |
| melanosomy | melanocyty, siatkówka nabłonek barwnikowy |
tworzenie, magazynowanie i transport melaniny |
| granulki płytek krwi | płytki krwi, megakariocyty | niezbędne uwolnienie ATP, ADP, serotoniny i wapnia na krzepnięcie krwi |
| ciałka blaszkowate | nabłonek płuc typu II | magazynowanie i wydzielanie środka powierzchniowo czynnego niezbędnego do pracy płuca |
| granulki lizujące | cytotoksyczny T limfocyty, komórki NK |
zniszczenie komórek zakażonych wirusem lub nowotworem |
| MCG klasa II | Komórki prezentujące antygen (dendrytyczne komórki, limfocyty B, makrofagi itp.) |
Zmiana i prezentacja antygenów limfocytów T CD4+ za regulację odporności |
| granulki bazofili | bazofile, komórki tuczne | wywołać uwalnianie histaminy i innych stanów zapalnych zachęty |
| granulki azurofilowe | neutrofile, eozynofile | uwalniają środki bakteriobójcze i przeciwzapalne |
| ziarnistości osteoklastów | osteoklasty | zniszczenie kości |
| Ciała Weibela-Pallade’a | komórki śródbłonka | dojrzewanie i regulowane uwalnianie czynnika von Willebranda do krwi |
| granulki a płytek krwi | Płytki krwi, megakariocyty | uwalnianie fibrynogenu i czynnika von Willebranda odpowiedzialnego za adhezję płytek krwi i krzepnięcia krwi |
Choroby związane z lizosomami
Choroba Taya-Sachsa
zespół Chediaka-Higashiego
Zespół Hermańskiego-Pudlaka
Zespół Griscellego
Skróty.
ER - siateczka śródplazmatyczna
AG – aparat Golgiego